acidi e basi
acidi e basi
Sostanze inseparabili che si neutralizzano reciprocamente
Gli acidi e le basi sono classi di composti chimici con un comportamento caratteristico: le basi neutralizzano l'acidità degli acidi, gli acidi neutralizzano la basicità delle basi. La reazione tra acidi e basi produce sali. La loro presenza e quantità in un ambiente chimico può essere misurata con la scala di acidità, detta pH. Molti processi chimici e biochimici possono realizzarsi solo a un determinato pH. Così alcune sostanze vitali del nostro organismo, come il plasma del sangue, devono mantenere un determinato grado di pH
Che cosa sono gli acidi
Acido è una parola che deriva dal latino e significa "acuto, che punge". Come noi, i Romani consideravano acide le sostanze che avevano un sapore agro, aspro, come il limone, che infatti contiene l'acido citrico. Molti acidi sono utilizzati nei processi industriali, per esempio l'acido cloridrico, che è materia prima di moltissimi composti contenenti cloro, come gli insetticidi. Una sua soluzione, che ha il nome di acido muriatico, si usa in casa per disincrostare le tubature. L'acido solforico, anticamente denominato vetriolo, è una sostanza molto importante per l'industria chimica nella sintesi di fertilizzanti, petrolchimici, coloranti, detergenti. L'acido nitrico reagisce con tutti i metalli a eccezione dell'oro e del platino, e per questo può essere usato per riconoscere se un oggetto è d'oro o per saggiarne la purezza. È un'importante sostanza nella fabbricazione dei concimi e degli esplosivi.
Che cosa sono le basi
Le basi analogamente agli acidi si riconoscono da come si comportano in soluzione o con altre sostanze. Le basi, come già anticipato, reagiscono con gli acidi e formano sostanze che si chiamano sali. Una base è l'idrossido di sodio, un composto corrosivo, bianco e ceroso, che è impiegato sia nell'industria dei saponi e della carta sia nell'uso domestico ma in forma di soluzione, ed è chiamato soda caustica. Un'altra base è l'ammoniaca, sostanza fondamentale nell'industria dei concimi, dei coloranti, degli esplosivi e delle fibre. In soluzione diluita, toglie dalle stoffe le macchie d'unto e attenua il dolore delle punture di insetti.
Indicatori di acidità e basicità
Gli acidi in soluzione possono essere presenti in piccole o grandi quantità e inoltre non tutti gli acidi possiedono lo stesso grado di acidità. Per misurare il grado di acidità di una soluzione si possono utilizzare alcune sostanze, chiamate indicatori, che hanno la proprietà di cambiare colore secondo il grado di acidità di una soluzione. Un indicatore molto usato è il tornasole, un colorante vegetale estratto da alcuni licheni colorati. Il tornasole in soluzione acida dà un colore rosso alla soluzione, in soluzione basica un colore blu. Un altro indicatore naturale è il succo della rapa rossa: rosso porpora in presenza di acido, blu-viola in ambiente basico. Nel 1909 il biochimico danese S.P.L. Sørensen, partendo dal fatto che la caratteristica comune degli acidi è la loro capacità di liberare ioni idrogeno in soluzione, ha proposto una scala di grandezza, la scala del pH (letteralmente vuol dire "potenza d'idrogeno") per misurare il grado di acidità e di basicità di una soluzione acquosa. Questa scala è in funzione della concentrazione di ioni idrogeno in soluzione: tanto più questa è elevata tanto più basso è il pH e tanto più acida sarà la soluzione. Una soluzione acida ha un pH minore di sette, una soluzione basica un pH maggiore di sette. Un pH pari a sette indica una soluzione neutra. Il valore 7 corrisponde all'acqua pura, che è neutra, cioè non è acida né basica.
L'acidità e l'ambiente
Alcune proprietà di un ambiente dipendono dal suo pH. Molti processi chimici e biochimici avvengono solo a un determinato pH. Per esempio, tra i parametri usati per misurare in Italia la qualità dell'aria, dell'acqua e del suolo c'è il pH. Infatti modificazioni nella composizione chimica, e soprattutto nell'acidità, dell'acqua piovana possono determinare significativi cambiamenti dell'ambiente. Normalmente l'acqua piovana ha un pH tra 5 e 5,6. La leggera acidità della pioggia è dovuta all'anidride carbonica presente nell'atmosfera. Le piogge acide hanno invece un pH inferiore a 5 e rendono acido il terreno su cui cadono, ostacolando la normale crescita di molte piante. È stato riconosciuto che la causa principale dell'acidità dell'acqua piovana è lo zolfo, naturalmente presente in piccole quantità nel petrolio e nel carbone. Lo zolfo viene emesso sotto forma di anidride solforosa dai gas di scarico e dai processi di combustione industriale: dopo una serie di trasformazioni si scioglie nell'acqua piovana, formando acido solforico e rendendo acide le gocce di pioggia. Le piogge acide possono far diminuire notevolmente la concentrazione di sostanze, come il calcio, necessarie per la crescita della flora e della fauna di un territorio. Si deve tener conto che la maggior parte delle piante cresce bene con un terreno a pH neutro. Alcune piante, però, quali ortensie, azalee, rododendri e camelie richiedono un terreno acido, mentre altre, come rose e garofani, vogliono un terreno basico. L'ortensia può essere un ottimo indicatore del pH di un terreno attraverso il colore dei suoi fiori: per avere ortensie rosa il terreno deve avere un pH basico, per avere ortensie blu il terreno deve essere decisamente acido.
Acidità e organismi viventi
Piante e animali forniscono, con il loro stato di salute, informazioni sulla qualità di un ambiente.
La chiocciola ci può segnalare la presenza di un ambiente acido. In zone di piogge acide le chiocciole tendono a sparire: in questa situazione non hanno, infatti, abbastanza calcio per costruire il loro guscio.
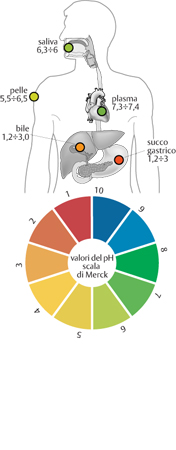
Gli organismi viventi si reggono su un complesso equilibrio tra le variabili biologiche e fisico-chimiche: ogni variabile deve rimanere in un intervallo al di fuori del quale la salute dell'organismo è in pericolo. Questo vale anche per la variabile acidità. Il nostro organismo è in grado di mantenere il pH del plasma nel sangue tra i valori di 7,3 e 7,4, ma se il pH del plasma scende sotto 7,0 o sale sopra 7,8 si può addirittura morire. Alcune malattie o un forte spavento possono far scendere il pH sotto il valore di 7,4. Una grave ustione lo può far salire sopra 7,4. La saliva nella bocca ha un pH che può variare tra 6,0 e 6,3, mentre i succhi gastrici dello stomaco sono molto acidi: il pH deve essere compreso tra 1,2 e 3,0 per permettere la digestione del cibo. Malgrado questo lo stomaco non viene corroso dai propri succhi perché possiede un efficace sistema di protezione della mucosa gastrica.
Sigla Nome sostanza Proprietà come conservante Prodotti commerciali
E 260
Acido acetico È il componente principale dell’aceto. È usato per evitare la crescita di batteri nocivi per l’uomo nei cibi. È anche un agente antifunghi: evita, per esempio, il formarsi di muffe nel pane Mostarda, sottaceti, salse, condimenti per insalate, pane a fette preconfezionato
E 270 Acido lattico È prodotto normalmente nella fermentazione di cibi, per esempio nel latte che si trasforma in yogurt. Per la sua moderata acidità è usato come antibatterico: infatti la maggior parte delle specie batteriche non può crescere a pH inferiore a 4,5 Formaggi, marmellate, birra, yogurt E 330 Acido citrico Si trova in natura in arance, limoni, pompelmi, ribes, fragole. È un inibitore di batteri, lieviti e muffe e anche un antiossidante Carni fresche, crostacei e molluschi, bevande analcoliche, marmellate, gelatine, gelati
Gli acidi organici come conservanti
Numerosi acidi organici che cioè contengono carbonio, sono normalmente presenti nei cibi. Alcuni acidi sono usati nell'industria alimentare come conservanti (in tabella sono citati i più noti) e possiamo trovarli segnalati nelle etichette dei cibi.
L'acquaforte
Così si denominava anticamente l'acido nitrico, mentre poi ha preso questo nome una tecnica di incisione per la stampa, di cui descriviamo qui di seguito le modalità di esecuzione. Si copre una lastra di rame o di zinco con cera o con una vernice antiacido. Con una punta di acciaio si incide la superficie ottenuta fino a comporre a rovescio il disegno voluto. Si sparge poi sulla superficie una soluzione di acido nitrico che reagisce con la lastra di rame nei punti incisi riproducendo così il disegno sulla lastra. Questa viene pulita, cosparsa di un apposito inchiostro e passata al torchio insieme a un foglio di carta. Il disegno si stampa sul foglio e può essere riprodotto in più copie.