AIDS: NOVITÀ E SPERANZE
AIDS: novità e speranze
Nel giugno del 1981, il bollettino «Morbidity and mortality weekly report» dei Centers for disease control and prevention (CDC) di Atlanta, riportò la notizia che negli Stati Uniti era stato riscontrato un improvviso aumento dei casi di polmonite da Pneumocystis carinii in giovani omosessuali maschi. Subito dopo fu segnalato un numero alto di casi di pazienti omosessuali che soffrivano di un raro tumore dei vasi sanguigni noto come sarcoma di Kaposi. I pazienti presentavano tutti un quantitativo molto basso di linfociti T e tendevano a peggiorare rapidamente fino alla morte. Le successive osservazioni dimostrarono che tutti questi casi erano associati alla presenza di un’immunodeficienza non ereditaria (quindi acquisita), con linfoadenopatia generalizzata. In seguito alla descrizione di casi simili anche in emofilici, emotrasfusi e tossicodipendenti che facevano uso di droghe per via endovenosa, si iniziò a ipotizzare che la sindrome potesse avere un’eziologia infettiva e, in particolare, che la malattia potesse essere trasmessa tramite contatto con sangue o prodotti da esso derivati infetti. Nel luglio del 1982, in un congresso promosso dalla Food and drug administration (FDA) si propose di coniare l’espressione Acquired immunodeficiency syndrome (AIDS) per definire un insieme di sintomatologie, malattie e neoplasie, caratterizzate dalla presenza di una grave immunodeficienza acquisita.
Nel frattempo, accurate indagini epidemiologiche avevano portato alla conclusione che un rapido decremento del numero delle cellule ematiche T, che possedevano sulla loro superficie il recettore CD4 (un’importante molecola coinvolta nella risposta immunitaria verso gli agenti infettivi e i tumori), era responsabile dell’insorgere della sintomatologia. Quando i livelli delle cellule T CD4+ scendevano sotto il limite di 200/mm3 i pazienti divenivano vulnerabili a una miriade di infezioni e ad alcuni tumori.
Nel maggio del 1983 Luc Montagnier, dell’Institut Pasteur di Parigi, riuscì a isolare, dalla coltura di cellu;le di un linfonodo proveniente da un paziente affetto da linfoadenopatia generalizzata, un virus a RNA (RiboNucleic Acid) al quale diede il nome di Lymphoadenopathy-associated virus (LAV) e formulò l’ipotesi che esso potesse essere correlato all’AIDS. Nel 1984 Robert Gallo, del National cancer institute di Bethesda (Stati Uniti), descrisse l’isolamento, da un paziente con AIDS conclamato, di un nuovo retrovirus umano, che chiamò Human T-lymphotropic virus type III (HTLV-III). Entrambi i virus avevano un caratteristico tropismo per le cellule T del sangue che presentavano sulla loro superficie il recettore CD4. In seguito venne dimostrata l’identità tra i due virus LAV e HTLV-III, che furono così unificati sotto il nuovo termine di Human immunodeficiency virus (HIV).
Negli anni successivi, con le segnalazioni di casi da ogni parte del mondo, divenne sempre più evidente che l’AIDS non colpiva solamente alcune categorie di individui, come gli omosessuali e i tossicodipendenti, ma anche persone eterosessuali e, in particolare, quelle residenti nei Paesi in via di sviluppo. Era chiaro, quindi, che l’epidemia si stava diffondendo rapidamente e che altri fluidi del corpo, oltre al sangue, erano in grado di trasmettere il virus. Nel giro di pochi anni l’AIDS sarebbe divenuto una vera e propria emergenza sanitaria globale, soprattutto per i Paesi più poveri (ANSA 2005; Kallings 2008).
Cenni di patogenesi e di storia naturale dell’infezione da HIV
L’HIV infetta e uccide le cellule che presentano il recettore CD4 sulla loro superficie. La maggior parte di queste cellule è costituita da linfociti T, che hanno un ruolo chiave nella risposta immunitaria ai patogeni e ai tumori. Subito dopo l’infezione, un’iniziale moltiplicazione del virus avviene nel sito di entrata, mentre un’estesa replicazione si ha a livello dei tessuti linfoidi, ossia i linfonodi, la milza, il fegato, il midollo osseo e l’intestino. Macrofagi e cellule di Langerhans sono infettati, ma non vengono uccisi; queste cellu;le costituiscono, pertanto, una riserva fondamentale del virus e forniscono ai virioni la possibilità di spostarsi attraverso l’organismo. All’interno dei linfonodi, i virioni che si generano rimangono intrappolati e infettano nuovi linfociti T CD4+. Poiché il principale bersaglio dell’HIV sono cellule T CD4+, che hanno un ruolo chiave nella risposta immunitaria, il risultato dell’estesa replicazione del virus ai danni di queste cellule porta a un progressivo indebolimento della risposta immunitaria verso molti patogeni e verso alcuni tipi di tumori. Pertanto, finché il numero delle cellule T CD4+ è sufficientemente alto da assicurare un’immunosorveglianza, molte delle infezioni da differenti agenti patogeni sono controllate efficacemente. Quando un numero significativo di queste cellule è distrutto e non più rimpiazzato, insorgono molteplici infezioni e alcuni tipi di tumore, portando, infine, all’AIDS conclamato.
L’evoluzione della malattia può essere divisa in tre fasi. Una prima fase inizia al momento dell’infezione. Dopo 3-6 settimane può presentarsi una sintomatologia acuta, febbrile, di diverso grado, con manifestazioni che simulano i sintomi dell’influenza o della mononucleosi infettiva. In molti casi, questa prima fase può essere del tutto asintomatica. In un periodo che va da venti giorni a qualche mese dall’infezione compaiono gli anticorpi specifici per l’HIV e una risposta cellulare contro il virus.
La seconda fase inizia quando i livelli di viremia plasmatica si abbassano e si stabilizzano, come conseguenza dell’azione della risposta immunitaria contro l’HIV, ma anche del fatto che la maggior parte del virus risulta intrappolata nei linfonodi. In questa fase, la replicazione del virus nei linfonodi può generare da 1 a 10 miliardi di particelle virali ogni 1,5-2 giorni. La risposta immunitaria è in grado di eliminare molte delle particelle virali che si generano; tuttavia, contemporaneamente, molte cellule T CD4+ sono uccise e vengono continuamente rimpiazzate con nuove cellule. Il continuo turnover delle T CD4+ determina un lento e graduale calo del numero di tali cellule negli anni. Questo periodo, che può durare diversi anni (in media otto), è caratterizzato dall’assenza di una specifica sintomatologia (latenza clinica).
Verso la fine della seconda fase compare una sintomatologia che prelude alla comparsa delle infezioni opportunistiche e all’AIDS, caratterizzanti la terza fase. In questo stadio si manifesta una linfoadenopatia persistente generalizzata tipica di uno stadio denominato Lymphoadenopathic syndrome (LAS), con una sintomatologia aspecifica che include malessere generale, febbre, sudorazione notturna con ingrossamento di molti linfonodi. È questo un segno che si sta entrando nella terza fase della malattia, caratterizzata dalla comparsa delle prime infezioni opportunistiche che porteranno all’AIDS conclamato. In questo periodo sono frequenti le infezioni micotiche superficiali, le infezioni ginecologiche, quali, per es., la candidosi e le infezioni pelviche. Il numero delle cellule T CD4+ è drammaticamente basso. Al di sotto delle 200 cellule/mm3, in presenza della sintomatologia sopra descritta, si definisce lo stadio di AIDS conclamato con complicazioni dovute alle sempre più frequenti e meno controllabili infezioni opportunistiche, alla comparsa di malattie neurodegenerative e di alcune neoplasie, tra cui il sarcoma di Kaposi. In breve sopravviene la morte, dovuta alle complicazioni delle malattie e dei tumori sopra citati (Levy 20073).
Dati epidemiologici sulla diffusione di HIV a livello mondiale
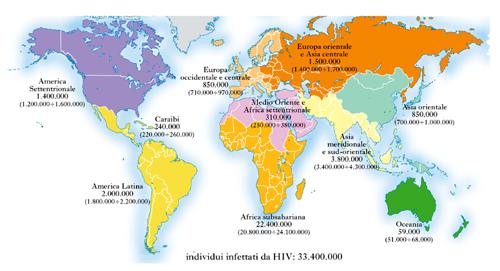
Secondo l’Organizzazione mondiale della sanità (OMS) e il Joint United Nations programme on HIV/AIDS (UNAIDS), alla fine del 2008, erano globalmente circa 33.400.000 gli individui che vivevano con l’infezione da HIV, la maggior parte dei quali residente nei Paesi in via di sviluppo (fig. 1). Rispetto agli anni precedenti, la prevalenza (numero totale di malati in un dato momento) stimata inizia a stabilizzarsi. Ogni giorno più di 6800 persone si infettano con HIV e oltre 5700 muoiono di AIDS, quasi tutte nei Paesi in via di sviluppo. La regione geografica più colpita è l’Africa subsahariana con 22.400.000 di HIV-positivi (il 67% delle infezioni totali) e con quasi il 90% del totale dei bambini infettati. Il numero delle morti per AIDS alla fine del 2008 è stato stimato intorno ai 2.000.000. Circa il 71% di queste morti per AIDS è avvenuto nell’Africa subsahariana. La tendenza è al ribasso, poiché il trattamento con farmaci antiretrovirali ha raggiunto, nel 2008, un maggior numero di persone, tuttavia in Africa subsahariana l’AIDS rimane ancora la prima causa di morte.
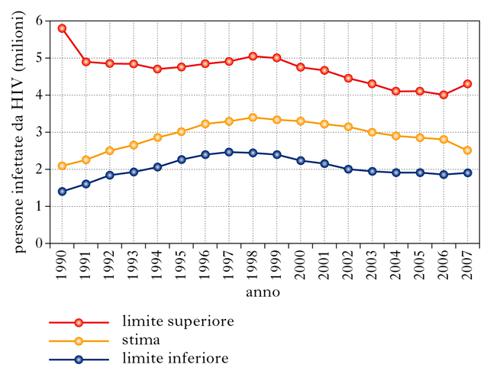
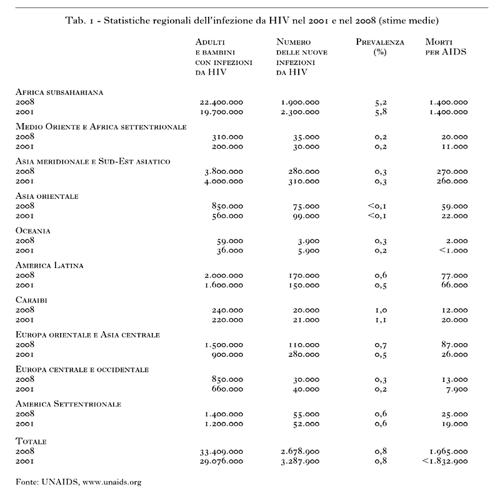
L’incidenza dell’infezione da HIV (il numero di nuovi individui infettati con il virus nella popolazione, per anno) è un parametro fondamentale da controllare, poiché le persone con una nuova infezione contribuiscono ad accrescere il numero totale di quelle che vivono con HIV e sono una potenziale fonte di ulteriore trasmissione del virus. L’incidenza globale ha avuto un picco verso la fine degli anni Novanta del 20° sec. (fig. 2, dati aggiornati al 2007), con una media di oltre 3.000.000 di nuove infezioni per anno. Il numero stimato di persone che hanno contratto l’infezione da HIV nel 2008 è di circa 2.700.000, con oltre i 2/3 delle nuove infezioni avvenute in Africa subsahariana. La tendenza alla stabilizzazione della prevalenza e a una leggera riduzione dell’incidenza è probabilmente il risultato di programmi di prevenzione che hanno influito sul controllo dei comportamenti a rischio. La tabella 1 riporta i dati di prevalenza e incidenza della pandemia da HIV nel 2001 e nel 2008 ripartiti per regione geografica.
L’Africa subsahariana è la regione più colpita dalla pandemia di AIDS, tuttavia la diffusione dell’infezione varia da Paese a Paese. Per es., alcune regioni del Sahel registrano una prevalenza di infezione da HIV relativamente bassa (intorno al 2%), mentre la maggior parte dei Paesi dell’Africa australe mostra dati di prevalenza estremamente elevati, intorno al 32%. In generale, in Africa subsahariana nel periodo 2001-2008 si è registrato un declino della prevalenza globale media di infezione da HIV dal 5,8% al 5,2% e il numero di nuove infezioni è sceso, nel periodo 2001-2008, da 2.300.000 a 1.900.000. Simili tendenze nell’incidenza, ma caratterizzate da numeri più bassi, si registrano nell’Asia meridionale e nel Sud-Est asiatico, in Europa orientale e in Asia centrale. Nelle altre regioni, i dati di incidenza di infezione da HIV sono rimasti sostanzialmente stabili.
Fino a questo momento è stato esaminato il numero totale degli adulti e dei bambini infettati da HIV. Ma se i dati vengono analizzati per sesso si nota che il numero delle donne infettate è andato aumentando dal 2001 al 2008. In particolare, in Africa subsahariana il 60% delle persone infettate da HIV nel 2008 era rappresentato da donne. L’alta prevalenza d’infezione da HIV in queste ultime è una conseguenza della trasmissione del virus tramite il rapporto eterosessuale non protetto, in cui la donna è maggiormente esposta al virus rispetto all’uomo. Il quadro che emerge da questi dati riflette, inoltre, la condizione di subordinazione che la donna vive ancora nella maggior parte dei Paesi e, in particolare, in quelli in via di sviluppo.
Anche il numero totale dei bambini infettati dal virus è gradualmente aumentato nello stesso periodo passando da 1.600.000 (2001) a 2.100.000 (2008), mentre si registrano dati di incidenza in calo nel 2008 rispetto al 2001. Circa il 91% dei bambini colpiti dal virus vive nell’Africa subsahariana, dove l’infezione avviene in utero, o al momento del parto, tramite il contatto con il sangue infetto della madre, o nei mesi successivi al parto tramite l’allattamento. Nei Paesi sviluppati, dove le condizioni economiche e sanitarie permettono il trattamento con farmaci antiretrovirali di tutte le donne infette che ne hanno bisogno, la trasmissione materno-fetale dell’infezione da HIV è, di fatto, assente.
Dati epidemiologici sulla diffusione di HIV in Italia
Dal 1982, anno della prima diagnosi in Italia, al 31 dicembre 2008, sono stati notificati al Centro operativo AIDS, attivo presso l’Istituto superiore di sanità a Roma, 60.346 casi cumulativi di AIDS. Di questi, oltre il 7% è rappresentato da stranieri. L’età mediana alla quale è diagnosticata la sindrome è andata gradualmente aumentando, dai 26 anni delle donne e i 29 degli uomini nel 1987 ai 40 per le donne e i 43 per gli uomini nel 2008. Nel corso degli ultimi anni, in Italia, si è assistito al costante incremento dei casi attribuibili ai contatti sessuali (omosessuali ed eterosessuali) e dal 2001 in poi i contatti eterosessuali rappresentano la modalità di trasmissione più frequente.
Per quanto riguarda i casi di AIDS pediatrico (pazienti con età inferiore a 13 anni) si è registrata una cospicua diminuzione a partire dal 1997, dovuta all’applicazione delle linee guida relative al trattamento antiretrovirale delle donne in gravidanza per ridurre la trasmissione verticale.
L’incidenza dei casi di AIDS notificati in Italia fino al 1995 è andata costantemente aumentando, ma dal 1996 in poi si è registrato un graduale calo. Nel 2008 i casi sono stati 1330, mentre nel 1996 erano oltre 5500. Tale diminuzione, iniziata dalla metà del 1996, sembra ormai tendere alla stabilizzazione. Come suggerito da simulazioni con modelli matematici sull’andamento dei casi di AIDS, la loro repentina diminuzione negli ultimi anni non è attribuibile a una riduzione delle nuove infezioni da HIV, ma è una conseguenza dell’effetto delle terapie antiretrovirali combinate.
In Italia un sistema nazionale di notifica delle nuove diagnosi di infezione da HIV è stato istituito solo con il d.m. 31 marzo 2008 (G.U. n. 175, 28 luglio 2008). Negli anni precedenti, tuttavia, alcune regioni e province si sono organizzate autonomamente e raccolgono informazioni sulla diffusione dei nuovi casi di infezione. Tra queste compaiono le regioni Lazio, Veneto, Piemonte, Liguria e Friuli-Venezia Giulia e le province di Modena, Rimini, Sassari, Trento e Bolzano. A queste si sono aggiunte, dal 2008, per adempiere alle nuove direttive, le regioni Emilia-Romagna e Puglia. I dati ottenuti rendono possibile stimare i sieropositivi in Italia, per l’anno 2008, tra i 140.000 e i 150.000.
L’incidenza di nuove infezioni da HIV è stata stimata intorno a 3500÷4000 casi verificatisi nel 2008, mentre nel 1987 erano state registrate stime intorno ai 14.000÷18.000 casi. Dopo un picco di infezioni verificatosi alla fine degli anni Ottanta del 20° sec., vi è stata una progressiva diminuzione dei nuovi casi di infezione fino alla fine degli anni Novanta. Successivamente, il numero di nuove infezioni si è stabilizzato e risulta addirittura in aumento in alcune zone; questo andamento potrebbe costituire il preludio a una possibile riattivazione dell’epidemia in numerose aree del nostro Paese.
Anche le caratteristiche di coloro che oggi si infettano con l’HIV sono cambiate nel tempo e sono completamente diverse da quelle di coloro che si infettavano dieci o venti anni fa. In generale, non si tratta più di persone giovani e prevalentemente tossicodipendenti, ma piuttosto di adulti maturi che si infettano attraverso i rapporti sessuali.
Trasmissione e caratteristiche dell’epidemia
L’HIV è presente nei liquidi biologici dell’organismo, quali il sangue, il liquido spermatico, le secrezioni vaginali, il latte materno e, in misura molto limitata, la saliva e il sudore. Pertanto, il contatto con un fluido biologico infetto può potenzialmente essere causa d’infezione. La probabilità d’infezione, tuttavia, varia secondo la concentrazione di virus presente nel fluido biologico; infatti, è evidente che il rischio d’infezione è tanto più elevato quanto maggiore è la carica virale. Sulla base di questa conclusione, si può affermare che il virus viene principalmente trasmesso mediante le seguenti modalità: contatto sessuale (eterosessuale o omosessuale) non protetto; contatto con sangue infetto o con derivati del sangue infetti; dalla madre malata al neonato.
Numerosi studi hanno cercato di stabilire la probabilità di trasmissione dell’HIV per singolo atto sessuale. Da questi studi, essa sembra essere compresa tra lo 0,03 e lo 0,15% da maschio a femmina e tra lo 0,02 e lo 0,09% da femmina a maschio. Tuttavia, la circoncisione riduce ulteriormente la probabilità di infezione dalla donna all’uomo. Il rischio d’infezione in seguito a rapporto anale recettivo è del 2%. Oltre alla carica virale, esistono comunque fattori associati a un maggiore rischio d’infezione, quali, per es., la presenza concomitante di altre infezioni, ulcere genitali, sanguinamento e mestruazioni.
La stima dell’efficacia di trasmissione attraverso lo scambio di siringhe tra tossicodipendenti è resa difficile dalla contemporanea presenza di altri fattori di rischio difficilmente scindibili e quantificabili, quali lo scambio di altri oggetti legati all’assunzione di droghe e la frequenza dei rapporti sessuali a rischio. Un modello che valuta tale probabilità, prendendo in considerazione tutti questi fattori e la prevalenza dell’infezione tra i tossicodipendenti, produce una stima dello 0,67% in caso di uso per iniezione endovenosa di ago e siringa utilizzati da una persona infetta.
Il rischio medio d’infezione da HIV occupazionale negli operatori sanitari si aggira intorno allo 0,3% in seguito a esposizione a sangue infetto per via percutanea e allo 0,09% per esposizione mucocutanea, ma è chiaro che la probabilità di trasmissione dipende dal tipo di lesione prodotta (superficiale o profonda), dalla presenza di sangue visibile sullo strumento che ha causato la lesione e dallo stadio della malattia del paziente fonte dell’infezione.
Non è mai stato documentato alcun caso di infezione da HIV che possa ritenersi conseguente a esposizione con aghi abbandonati nell’ambiente.
La trasmissione avviene anche dalla madre HIV-positiva al feto o al neonato. Essa dipende dallo stadio della malattia e dalla possibilità di accesso alle terapie antiretrovirali da parte della madre. In assenza di terapia il rischio medio di trasmettere l’infezione al neonato è del 20% circa.
Il contesto nel quale la pandemia da HIV si sviluppa è estremamente eterogeneo e la diffusione del virus è influenzata da differenti fattori economici, politici e sociali dei diversi Paesi. Per es., un basso livello socioeconomico si associa a insufficienti condizioni igienico-sanitarie e a scarsi standard d’educazione sessuale. La disuguaglianza economica spesso contribuisce all’emarginazione di alcuni gruppi sociali, che si manifesta in ridotto accesso all’educazione, scarse pratiche igienico-sanitarie e bassa, o assente, percezione dei comportamenti a rischio d’infezione. Inoltre, le condizioni di subalternità in cui vivono alcuni gruppi sociali portano a comportamenti a rischio d’infezione, anche se questo pericolo viene percepito. Si pensi, per es., agli abusi sessuali sui soggetti più deboli e sulle donne, anche all’interno del nucleo familiare; o al rifiuto, da parte dell’uomo, o del marito, di utilizzare il profilattico durante il rapporto sessuale. L’assunzione di droghe o di alcol in questi contesti non può non favorire ancora di più pratiche a rischio d’infezione.
Se si prendono in considerazione le principali vie di trasmissione del virus all’interno delle popolazioni si può affermare che la terza decade della pandemia di AIDS è caratterizzata da una marcata eterogeneità che va progressivamente aumentando. Alla fine del 2007 si possono distinguere almeno quattro definite epidemie: quella riguardante i tossicodipendenti che fanno uso di droghe per via iniettiva, in Europa orientale, Asia centrale e nei territori dell’ex Unione Sovietica; l’epidemia emergente favorita dai comportamenti a rischio degli omosessuali maschi nei Paesi in via di sviluppo e negli Stati Uniti; l’epidemia dovuta alla trasmissione del virus per via eterosessuale nei Paesi in via di sviluppo, in particolare in Africa subsahariana; l’epidemia dovuta alla trasmissione dell’infezione dalla madre infetta al feto o al neonato, in particolare nei Paesi in via di sviluppo.
In Eurasia l’infezione si sta diffondendo rapidamente tra coloro che dipendono da droghe assunte per via iniettiva, o da alcol, in particolare in Russia, Ucraina, repubbliche dell’Asia centrale, Cina, Iran, Indonesia, Nepal e Vietnam. Questo quadro è non solo la conseguenza della condivisione di aghi e siringhe infette tra più persone, ma anche della diminuita percezione dei comportamenti a rischio d’infezione sotto l’influenza delle droghe o dell’alcol.
In molti dei Paesi in via di sviluppo l’omosessualità è fuorilegge o fortemente stigmatizzata. È stato dimostrato che la vulnerabilità all’infezione da HIV aumenta drammaticamente laddove l’omosessualità, in particolare quella tra i maschi, è criminalizzata. L’omofobia e i pregiudizi sono, inoltre, responsabili del mancato o minore accesso degli omosessuali ai servizi di prevenzione.
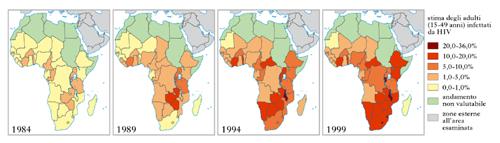
L’epidemia sostenuta dai rapporti eterosessuali non protetti è, in ogni caso, quella più estesa, in particolare in molte aree dell’Africa subsahariana, dove circa un terzo della popolazione risulta infettato dal virus HIV. Le precarie condizioni economiche nelle quali vive la maggior parte delle persone in quest’area geografica, le scarse condizioni igieniche, la disuguaglianza sociale, soprattutto la condizione di subalternità della donna rispetto all’uomo, la promiscuità, alcune pratiche e credenze tribali, la crescente e incontrollata urbanizzazione, le numerose guerre locali con le loro ondate di profughi e, infine, la mobilità d’intere comunità nel tentativo di trovare lavoro, sono tra le maggiori ragioni dell’estesa diffusione dell’infezione tramite questa via. La figura 3 mette in evidenza la rapidità con la quale l’infezione si è diffusa in Africa australe. In soli 15 anni, infatti, la prevalenza d’infezione da HIV è passata da meno dell’1% a oltre il 30%. Le persone infettate sono soprattutto donne, specialmente giovani, nella fascia d’età tra i 15 e i 29 anni. Questo quadro può essere spiegato con la coercizione sessuale e la violenza nei confronti delle donne, anche nell’ambiente familiare. La mobilità di comunità per motivi di lavoro è un’altra importante causa d’infezione da HIV. Le povere condizioni di vita delle comunità d’immigrati e la lontananza dalle famiglie in genere favoriscono l’acquisizione dell’infezione tramite rapporti eterosessuali non protetti (Beyrer 2007).
Stime dell’OMS e dell’UNAIDS indicano che nel 2007 si sono infettati più di 400.000 bambini, oltre il 90% dei quali vive nell’area subsahariana. La trasmissione da madre a figlio può avvenire nel corso della gravidanza, ma nella maggior parte dei casi avviene durante il parto per il verificarsi di contatti diretti fra sangue materno e bambino. In una ridotta percentuale di casi, l’infezione può avvenire tramite allattamento al seno. La trasmissione dell’infezione dalla madre al feto o al neonato può essere bloccata se la madre effettua un’adeguata terapia antiretrovirale.
Epidemiologia molecolare
La variabilità è la migliore arma che l’HIV possiede, poiché è in grado di difendere efficacemente il virus dalle strategie terapeutiche (farmaci) e preventive (vaccini) che l’uomo può mettere in atto nel tentativo di contenere la diffusione dell’infezione. La variabilità dell’HIV nasce dal non fedele meccanismo di trascrizione dell’RNA virale in DNA (DeoxyriboNucleic Acid) da parte della trascrittasi inversa, un enzima fondamentale per la replicazione del virus, e dall’elevato numero di particelle virali generate ogni giorno, da 1 a 10 miliardi (Menéndez-Arias 2002).
La costruzione di alberi filogenetici è basata sulle omologie di sequenza dei genomi delle varianti di HIV circolanti in una determinata area geografica. Basandosi sul grado di similarità tra le diverse sequenze di virus della famiglia Retroviridae, alla quale l’HIV appartiene, si può classificarlo nel genere dei Lentivirus. Si possono distinguere due tipi di HIV: HIV-1 e HIV-2. L’HIV-1 è distribuito in tutto il mondo ed è responsabile della maggior parte delle in;fezioni dovute al virus. Invece l’HIV-2 è confinato, principalmen;te, in Africa occidentale e in India sud-occidentale; casi più sporadici sono segnalati in Spagna, Portogallo e Francia, in America Settentrionale e Meridionale e in Corea. Entrambi i tipi sono trasmessi tramite contatto sessuale, scambio di sangue infetto e dalla madre infettata al feto o al neonato, e sono agenti causali di una sindrome da immunodeficienza acquisita clinicamente identica. Tuttavia, la trasmissione di HIV-2 sembra essere meno efficiente rispetto a quella di HIV-1 e, probabilmente, questo è il motivo della limitata diffusione geografica dell’HIV-2.
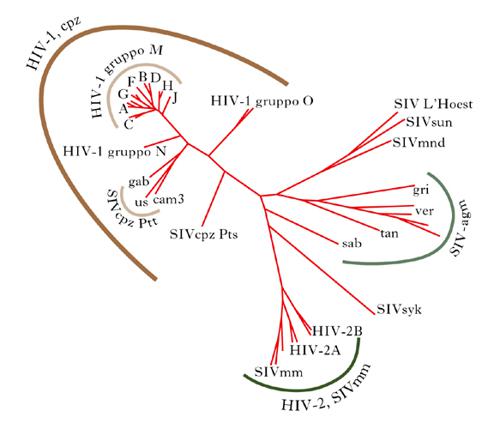
In base alle omologie nelle sequenze dei loro genomi, le varianti di HIV-1 e di HIV-2 possono essere organizzate in gruppi e sottotipi (fig. 4). In alcuni sottotipi si possono anche distinguere due o più sotto-sottotipi. Sono inoltre presenti forme ricombinanti tra due o più sottotipi o all’interno dello stesso sottotipo. Attualmente, le varianti di HIV-1 sono classificate in tre maggiori gruppi filogenetici, molto divergenti ma geneticamente correlati: M (Major o Main), O (Outlier) e N (Non-M/Non-O). Il gruppo M, a sua volta responsabile della maggioranza delle infezioni da HIV-1, può essere suddiviso in 9 sottotipi filogenetici, da A a K (dati aggiornati al 2007), approssimativamente distanti equamente l’uno dall’altro. Sulla base delle omologie di sequenza del genoma, i sottotipi A e F possono essere suddivisi in due sotto-sottotipi, A1 e A2 e F1 e F2. All’interno di ogni sottotipo, le infinite varianti sono molto divergenti, pur tuttavia non arrivando mai a un livello tale che le vedrebbe classificate in un altro sottotipo. I sottotipi, sia del gruppo N sia del gruppo O, non sono chiaramente definiti al momento, poiché sono stati caratterizzati pochi isolati virus.
Prima del 2001 per il tipo 2 erano stati identificati i sottotipi A, B, C, D, E, F. Dal 2001, l’HIV nomenclature committee (un comitato di studiosi costituitosi per proporre un sistema tassonomico volto a dare un nome alle numerose varianti di HIV continuamente identificate) ha deciso che i sottotipi di HIV-2 siano considerati gruppi, perché ognuno di essi è distante dagli altri allo stesso modo in cui lo sono i gruppi M, N e O di HIV-1.
Alcuni ceppi di HIV-1 vengono classificati in più sottotipi, a seconda delle regioni del genoma utilizzate nell’analisi filogenetica. I genomi di questi ceppi sono considerati mosaici ed è chiaro che derivano dalla ricombinazione di due o più ceppi di differenti sottotipi. Questi ceppi vengono chiamati forme ricombinanti circolanti (dall’ingl. circulating recombinant forms, CRFs), oppure forme uniche ricombinanti (dall’ingl. unique circulating forms, URFs), quando non si sono diffusi lontano dalle loro zone di origine. Attualmente, sono note 43 CRFs (dati aggiornati all’aprile 2008). Se il genoma di questi ceppi contiene più di due sottotipi, i ricombinanti vengono chiamati cpx, da complex (Taylor, Sobieszczyk, McCutchan, Hammer 2008). Su scala globale, alla fine del 2007, i genotipi prevalenti risultano: C (56%), A (23%), B (8%), D e CRF01-AE (5% ognuno). Nell’Africa subsahariana si ritrova la più estesa diversità genetica, con i sottotipi C e A più diffusi rispetto agli altri, ma con la presenza di ceppi rappresentanti tutti gli altri sottotipi del gruppo M e dei gruppi O e N. Inoltre in Africa occidentale, a sud del Sahara, sono presenti anche ceppi del tipo HIV-2. Tra i Paesi dell’Africa subsahariana, la Repubblica Democratica del Congo è quello dove si registra la più alta diversificazione, con numerosi sottotipi del gruppo M. Viste l’estesa variabilità e, anche, le evidenze epidemiologiche che indicano come i primi casi di infezione si siano verificati in Africa centrale subsahariana, si può affermare che questa regione è stata probabilmente la culla della presente pandemia da AIDS. In Africa australe e orientale è presente quasi esclusivamente il sottotipo C.
Anche in Asia e, in particolar modo, in India, predomina il sottotipo C, con una stima di quasi 6.000.000 di persone infettate da ceppi di questo sottotipo. Nel Sud-Est asiatico è tuttora prevalente la forma ricombinante CRF01-AE, introdotta dalla Thailandia e trasmessa attraverso contatti eterosessuali promiscui. Dalla Thailandia, questa forma si è diffusa in Cambogia, Vietnam, Malaysia, Cina, Taiwan, Corea e Giappone.
I virus del sottotipo B prevalgono in America Settentrionale e Meridionale, in Europa centrale e occidentale e in Australia. Varianti del sottotipo B sono anche comuni in alcuni Paesi asiatici, in Africa settentrionale e nel Medio Oriente. In Thailandia è anche presente una forma del sottotipo B (la variante thailandese del sottotipo B, o virus Thai-B), che si diffonde in tutto il Sud-Est asiatico, principalmente tra coloro che fanno uso di droghe per via iniettiva.
Altri sottotipi sono distribuiti in diverse regioni geografiche con minor prevalenza. Nell’Africa orientale subsahariana (Uganda, Tanzania e Kenya) circolano i sottotipi A e D; il sottotipo A è presente in Europa orientale; il sottotipo F è comune in Romania, soprattutto tra i bambini (infettati a causa di derivati del sangue o aghi e siringhe contaminati), e, in minor misura, in Brasile; il sottotipo G circola nell’Africa centro-occidentale ed è presente in Nigeria. Varianti del sottotipo G sono state segnalate anche in Portogallo e in Spagna.
Alcune forme ricombinanti sono state segnalate in Argentina (CRF12-BF e CRF17-BF) e in Brasile (CRF29-BF e CRF31-BF). Tali forme ricombinanti sono responsabili del 12% del totale delle infezioni in questi Paesi. Infine, in Europa orientale, i tossicodipendenti che utilizzano droghe iniettabili hanno favorito la diffusione di una nuova epidemia di HIV-1 sostenuta dalla forma ricombinante CFR03-AB. Questa forma è partita da Kaliningrad (in Russia) e in breve tempo si è diffusa in Ucraina e Bielorussia. Sebbene la prevalenza dei ceppi ricombinanti non sia nota con precisione, i dati ci indicano che le forme ricombinanti stanno notevolmente aumentando in prevalenza. Probabilmente questo processo di incremento continuerà nel futuro, aumentando, in questo modo, la variabilità di HIV-1 e portando alla generazione di nuove forme ricombinanti.
Origine dell’HIV
I dati più recenti sembrano indicare che l’HIV si sia originato dalle scimmie, attraverso molteplici infezioni dalla scimmia all’uomo (zoonosi). Infatti, l’HIV-2 e il SIVsm (Simian Immunodeficiency Virus sooty mangabey), ossia il virus dell’immunodeficienza della scimmia cercocebo agile (Cercocebus atys), mostrano un alto grado di omologia genetica e fenotipica; pertanto, si pensa che il virus SIVsm sia stato trasmesso all’uomo da queste scimmie, dando origine al virus umano HIV-2 (fig. 4). L’ipotesi è rafforzata dal fatto che l’habitat del cercocebo agile coincide perfettamente con la diffusione dell’HIV-2 in Africa occidentale. Analisi filogenetiche hanno portato a ipotizzare che la trasmissione del SIVsm all’uomo, che ha dato origine all’HIV-2, sia avvenuta intorno al 1940 (con un margine di errore di 16 anni, in più o in meno).
L’HIV-1, invece, è più strettamente correlato al SIVcpz (chimpazee), che infetta principalmente gli scimpanzé (Pan troglodytes troglodytes). Le sequenze dei genomi dei differenti SIVcpz sono, infatti, ampiamente diffuse nell’albero filogenetico dell’HIV-1. Inoltre, la maggiore varietà di sottotipi di HIV-1 e di ricombinanti si trova nell’Africa equatoriale occidentale, ossia la zona geografica corrispondente all’habitat di questi scimpanzé, evidenza che rafforza l’ipotesi di una derivazione dell’HIV-1 dal SIVcpz. L’antenato comune più recente dei virus del gruppo M di HIV-1 dovrebbe avere avuto origine intorno al 1931. Recentemente, è stato isolato un nuovo SIV (SIVgor, gorilla) in gorilla selvatici (Gorilla gorilla gorilla), il cui genoma è molto simile a quelli del gruppo O di HIV-1.
Prevenzione
Informazione e riduzione del rischio d’infezione
Quando è in corso un’epidemia generalizzata, quale è quella da HIV, non vi sono settori della società che risultino immuni dal rischio di contagio, perciò la necessità di un’adeguata prevenzione interessa tutti. In questa direzione si muovono le campagne informative nei Paesi sviluppati, effettuate periodicamente attraverso i mass media, con lo scopo non solo di raggiungere la popolazione generale, ma anche di ridurre lo stigma nei confronti delle persone con infezione da HIV o a rischio di contrarla. Per molti di questi Paesi, il controllo dell’infezione prevede incontri formativi con gli studenti nelle scuole e la creazione di una rete territoriale di servizi di prevenzione, quali quelli attivi presso i consultori familiari e i centri per le infezioni sessualmente trasmesse. Esistono anche forme di prevenzione rivolte a specifici gruppi vulnerabili, ossia i tossico;dipendenti, gli omosessuali, i detenuti, le prostitute. Inoltre, a tutte le donne gravide si propone il test per l’HIV accompagnato da un accurato counseling e, in caso di riscontro di sieropositività della madre, si consiglia di iniziare il trattamento antiretrovirale secondo le correnti linee guida. Infine, l’aggiornamento legislativo è una strategia chiave per rimuovere le barriere di accesso ai servizi di prevenzione ed eliminare la discriminazione nei confronti delle persone con infezione da HIV o con comportamenti a rischio d’infezione.
Nei Paesi in via di sviluppo, invece, l’informazione sulle modalità di trasmissione del virus è scarsa. In alcuni Paesi sono state attivate campagne per il trattamento delle infezioni sessualmente trasmesse, con l’intento di diminuire il rischio di trasmissione dell’HIV, ma il loro impatto è generalmente basso. Inoltre, difficilmente le donne sieropositive in gravidanza hanno accesso ai farmaci, con la conseguenza che molti bambini nascono infettati dal virus.
Vaccino
Per oltre vent’anni si è tentato di creare un vaccino che impedisse all’HIV di infettare le cellule. Tuttavia, l’enorme diversità genetica del virus e la difficoltà nell’indurre la formazione di anticorpi neutralizzanti hanno finora impedito tale realizzazione. Le strategie vaccinali più recenti prevedono, quindi, l’induzione di un’immunità in grado di controllare la progressione della malattia, allungando di conseguenza i tempi di sopravvivenza e allontanando l’insorgenza dell’AIDS. Queste strategie hanno come obiettivo l’induzione di un’ampia risposta immunitaria contro proteine di HIV che hanno funzione di regolazione della replicazione del virus (Tat, Rev e Nef). Tra tali strategie s’inserisce il vaccino sviluppato recentemente in Italia dal Centro nazionale AIDS dell’Istituto superiore di sanità, basato sulla proteina Tat (www.hiv1tat-vaccines.info), un prodotto fondamentale per l’espressione dei geni di HIV, che attualmente è in via di sperimentazione nell’uomo, sia in Italia sia in Africa. Per la sua natura, il vaccino potrebbe essere efficace su soggetti sia sieronegativi, per prevenire la progressione dell’infezione in caso di contagio con HIV (vaccino preventivo), sia sieropositivi, per limitare la replicazione del virus e bloccare l’insorgenza della malattia (immunizzazione terapeutica).
Terapia
Per chi, attraverso il test per l’infezione da HIV, scopre di avere acquisito il virus, le prospettive sono oggi molto diverse rispetto a dieci anni fa, grazie alla presenza di terapie specifiche potenti ed efficaci che riducono la replicazione del virus e, quindi, prevengono il declino immunologico.
Un’efficace terapia antiretrovirale, che riduca drasticamente la carica virale, dovrebbe, in teoria, uccidere tutti i virioni nel tempo (clearance del virus), tuttavia l’eliminazione del virus è, allo stato attuale delle nostre conoscenze, improbabile, perché esso persiste in forma latente in alcune cellule CD4+ che si trovano in uno stato di disattivazione e sulle quali i farmaci non hanno effetto.
Gli antiretrovirali (ARV)
La terapia antiretrovirale ha alterato, nel corso degli anni, la natura della malattia da HIV, trasformandola da malattia mortale con un decorso di circa dieci anni, in malattia cronica, con una durata più lunga, prima della comparsa dei sintomi che portano all’AIDS conclamato e alla morte.
Gli antiretrovirali funzionano con diversi meccanismi d’azione, ma il fine ultimo è quello di impedire al virus di replicarsi. Il primo ARV usato è stato l’AZT (azitotimidina), introdotto negli Stati Uniti nel 1987. L’utilizzo di questo farmaco ha migliorato molto la qualità della vita delle persone infettate e ha ritardato la comparsa dei primi sintomi della malattia. Tuttavia, subito dopo i primi successi, è risultato evidente che l’HIV era in grado di generare dei mutanti resistenti al trattamento. Pertanto, era necessaria una combinazione di farmaci per rendere meno probabile la comparsa delle varianti di HIV resistenti. Nel 1995 ha fatto quindi la sua comparsa l’HAART (Highly Active Anti-Retroviral Therapy). Essa consiste, tuttora, in una combinazione di almeno tre farmaci di classi diverse, in grado di ritardare considerevolmente la comparsa di varianti di resistenza, anche se il trattamento risulta così più complicato, con l’assunzione di vari farmaci in tempi diversi durante la giornata.
L’HAART ha avuto un grande successo nel mondo occidentale, poiché le economie dei relativi Paesi sono in grado di sostenerne le spese. Grazie all’HAART, infatti, nei Paesi sviluppati è stato possibile ridurre consistentemente la morbilità e la mortalità dell’infezione da HIV. Diversa, invece, è la situazione nei Paesi in via di sviluppo, dove l’epidemia è estremamente più diffusa e le economie non sono in grado di assicurare nemmeno condizioni igieniche dignitose per i residenti. A causa della diffusione dell’AIDS, a una preesistente situazione di scarsa organizzazione e cattivo funzionamento del settore sanitario, si aggiunge, ora, una ridotta forza lavoro, dovuta all’incremento del tasso di mortalità nella popolazione adulta, con conseguente riduzione delle attività specializzate. Inoltre, gli effetti sanitari ed economici dell’AIDS si ripercuotono maggiormente sulle comunità più povere, incrementando l’instabilità sociale. In questo quadro, l’OMS ha lanciato, nel 2004, l’iniziativa 3 by 5 (www.who.int/3by5/en), con l’obiettivo ambizioso di trattare con l’HAART 3.000.000 di persone del Terzo mondo alla fine del 2005. Il progetto presupponeva un ribasso sostanziale del prezzo dei farmaci e il coinvolgimento dei Paesi più ricchi per il suo finanziamento. L’iniziativa è però in parte fallita poiché, alla fine del 2006, i pazienti trattati con HAART erano circa 2.000.000, solo il 28% degli aventi bisogno stimati.
Il trattamento con HAART presuppone, oltre alla disponibilità dei farmaci, la presenza di strutture adeguate e di personale specializzato per monitorare gli effetti della terapia. Sono, infatti, necessari periodici controlli del numero delle cellule T CD4+ e della carica virale nel plasma per verificare se e quando iniziare la terapia, per valutarne l’efficacia e identificare eventuali varianti di HIV resistenti a uno o più farmaci. Nei Paesi in via di sviluppo le strutture e le specializzazioni sono carenti e, pertanto, accade spesso che, se disponibile, la terapia venga iniziata troppo tardi e incontri problemi legati alla scarsa efficacia o alla rapida comparsa di varianti resistenti ai farmaci.
Le classi dei farmaci antiretrovirali
Attualmente sono oltre 20 gli ARV approvati e quasi tutti risultano efficaci contro sottotipi conosciuti di HIV-1 (HIV medicine 2007, 2007). Gli ARV sono classificati in categorie basate sul loro meccanismo d’azione, che riflette i differenti stadi del ciclo replicativo del virus. Considerando in ordine temporale gli stadi replicativi dell’HIV, possono essere individuate, allo stato attuale, quattro categorie di farmaci: inibitori della fusione, inibitori nucleosidici della trascrittasi inversa, inibitori non nucleosidici della trascritta;si inversa, inibitori della proteasi.
Per quanto riguarda gli inibitori della fusione, nella membrana di HIV, un complesso formato da più molecole delle proteine gp120 e gp41 è responsabile dell’attacco del virus alla cellula e della fusione della membrana cellulare con quella virale, che porterà alla liberazione dell’RNA virale all’interno del citoplasma della cellula. Due differenti regioni della gp41, HR1 e HR2, sono responsabili del processo di fusione. Un farmaco di recente scoperta, il T-20, l’unico di questa categoria a essere stato approvato per l’uso nell’uomo, è in grado di legare l’HR1 e di bloccare il processo di fusione, impedendo, di fatto, l’infezione della cellula da parte del virus.
Gli inibitori della trascrittasi inversa, analoghi dei nucleosidi (NRTI, Nucleoside Reverse Transcriptase Inhibitors), sono stati i primi farmaci a essere approvati per l’uso nell’uomo. Il prototipo di questa classe di farmaci, l’AZT, è stato approvato nel 1987. Tali farmaci presentano similarità strutturale con i nucleosidi, i mattoni costituenti il DNA e l’RNA, dai quali differiscono in composizione chimica. Nel meccanismo di replicazione del virus, l’RNA virale è trascritto in un DNA virale a doppia elica dalla trascrittasi inversa, l’enzima che caratterizza la famiglia dei Retroviridae. Il meccanismo d’azione degli NRTI è quindi quello di interferire con l’attività della trascrittasi inversa, competendo con il substrato naturale, l’RNA. L’incorporazione di questi nucleosidi alterati determina la sintesi abortiva del corrispondente DNA a doppia elica. Questa classe comprende, attualmente, otto singoli farmaci.
Gli inibitori non nucleosidici della trascrittasi inversa (NNRTI, Non-Nucleoside Reverse Transcriptase Inhibitors) sono molecole che si legano direttamente alla trascrittasi inversa, impedendone il funzionamento grazie alla distruzione del suo sito catalitico. Allo stato attuale, sono tre i farmaci approvati per l’uso nell’uomo: nevirapina, delaverdina ed efavirenz. I maggiori problemi con gli NNRTI riguardano l’interazione con il citocromo P450 e, quindi, l’effetto (incrementati o diminuiti livelli plasmatici) di farmaci eventualmente somministrati insieme, che vengono metabolizzati dal sistema del citocromo P450. Inoltre, gli NNRTI non sono efficaci contro il sottotipo O di HIV-1.
Infine, per quanto riguarda gli inibitori della proteasi, va ricordato che, durante le fasi finali del processo di replicazione, lunghi polipeptidi, precursori delle proteine virali, sono tagliati dalla proteasi di HIV in proteine funzionali. In assenza di questo taglio si formano particelle virali non organizzate e non infettive. Gli inibitori della proteasi (PI, Protease Inhibitors) bloccano l’attività della proteasi virale legandosi al suo sito catalitico. Attualmente sono stati approvati dieci PI per l’uso nell’uomo. Le interazioni con altri farmaci sono importanti e da tenere sotto controllo. I PI sono, infatti, substrati per il sistema del citocromo P450, in grado quindi di inibirlo o di attivarlo. Questo effetto, inibente o adiuvante, può essere sfruttato per associare due PI e ridurne il dosaggio e la tossicità.
Sono ancora in fase di sperimentazione altre classi di farmaci che agiscono a livelli del ciclo replicativo diversi da quelli descritti precedentemente. Tra questi farmaci, il maraviroc impedisce il legame del virus a un recettore cellulare delle chemochine, il CCR-5. Il virus, infatti, per entrare nella cellula, ha bisogno di legarsi al recettore CD4 e a uno dei recettori delle chemochine presenti sulla cellula, quale, appunto, il CCR-5. Molti virus HIV, ma non tutti, sono in grado di legare il CCR-5 e, pertanto, il maraviroc è attivo contro di essi, ma non contro i virus HIV che non utilizzano il CCR5 come corecettore. Il maraviroc è già stato approvato negli Stati Uniti e ha ricevuto un parere favorevole per l’uso in Europa da parte della European medicines agency (EMEA), ossia l’Agenzia europea del farmaco.
Un altro farmaco, che agisce a un differente livello, è il raltegravir della classe degli inibitori dell’integrasi, già approvato negli Stati Uniti e in attesa di approvazione in Europa. Durante il suo ciclo replicativo, il DNA di HIV, ottenuto per l’azione della trascrittasi inversa, si integra nel genoma della cellula a opera di un enzima virale: l’integrasi. Il farmaco agisce bloccando l’integrasi del virus e quindi impedendo l’integrazione del DNA del virus nel genoma della cellula, con il conseguente blocco della replicazione del virus.
Gli studi sulle nuove classi di farmaci permetteranno, in un futuro molto prossimo, di trattare persone per le quali tutte le terapie attualmente esistenti sono fallite. I successi della ricerca nel campo della terapia dell’infezione da HIV potrebbero rendere, quindi, meno lontano l’obiettivo, fino a poco tempo fa considerato troppo ambizioso, di eliminare il virus (Adamson, Freed 2008).
Il trattamento con HAART
Le differenti scelte terapeutiche devono tenere conto dei numerosi problemi correlati all’HAART, che vanno dalla tossicità al costo. Sono state, pertanto, stilate linee guida per il trattamento delle persone infettate. Le linee guida riguardanti i Paesi sviluppati prevedono che la terapia con HAART abbia inizio quando il numero delle cellule T CD4+ scende al di sotto di 350/μl. Questo numero indirizza la scelta del medico riguardo al trattamento, anche se il paziente è asintomatico. Il momento in cui iniziare la terapia antiretrovirale deve essere, invece, esaminato con molta attenzione nei pazienti con un’infezione opportunistica di particolare gravità, oppure una neoplasia HIV-correlata. In questo caso, infatti, nonostante la presenza di una patologia rilevante, l’inizio potrebbe essere ritardato di un tempo limitato per evitare il rischio di tossicità di sommazione, dovuto alla contemporanea assunzione di farmaci per la patologia in atto e di farmaci antiretrovirali, e il rischio di comparsa dell’immune reconstitution inflammatory syndrome (IRIS), una grave risposta infiammatoria (per una trattazione estesa su modalità, tempi di somministrazione e dosaggi dei farmaci, si consultino le linee guida italiane per la terapia antiretrovirale negli adulti del Ministero della Salute, aggiornate alla fine del 2007, al sito http://www.ministerosalute.it/imgs/C_17_pubblicazioni_718_allegato.pdf, 22 marzo 2010).
Per quanto riguarda la terapia antiretrovirale nei Paesi in via di sviluppo, in particolare in Africa subsahariana, essa è influenzata dall’alto costo dei farmaci, dalla complessità della loro somministrazione e dall’assenza di adeguate infrastrutture per il suo monitoraggio. Infatti, le sofferenti economie di questi Paesi non possono sostenere i costi della terapia antiretrovirale, considerato il numero elevato di persone che ne avrebbero bisogno. Oltre alla necessità di ridurre il prezzo dei farmaci antiretrovirali, si devono anche ottimizzare i regimi terapeutici e le strategie per il monitoraggio della terapia. Pertanto, sono state sviluppate da organismi internazionali, come l’OMS, linee guida che indicano differenti scelte terapeutiche che tengano conto di costi, gestione del paziente e cronica carenza di infrastrutture sanitarie (http://www.who.int/hiv/pub/prev_care/en/ScalingUp_E.pdf, 22 marzo 2010). Sono state suggerite strategie di ‘prima linea’ e, se queste non si rivelano efficaci, strategie di ‘seconda linea’. L’utilizzo di due farmaci della classe degli NRTI e di uno della classe degli NNRTI costituisce l’approccio di prima linea. La scarsa efficacia di questo approccio, o la comparsa di resistenze, giustifica il ricorso alla strategia di seconda linea, con l’introduzione di un PI. La gestione del paziente viene così notevolmente semplificata e il monitoraggio di laboratorio risulta basato solo sulla conta del numero delle cellule T CD4+ e non anche sulla determinazione della carica virale. Il numero soglia di cellule T CD4+, sotto il quale è necessario iniziare a considerare la terapia, è fissato a 200/mm3. Laddove il monitoraggio di laboratorio sia ancor più difficoltoso, la scelta se iniziare il trattamento si basa sull’evidenza clinica.
La terapia HAART in gravidanza e nei bambini
Dalla metà degli anni Novanta del 20° sec. a oggi i casi di AIDS pediatrico (ossia di pazienti che al momento della diagnosi hanno un’età inferiore ai 13 anni) sono diminuiti in modo notevole nei Paesi sviluppati. La causa principale è stata l’applicazione delle linee guida sul trattamento antiretrovirale in gravidanza. Infatti, secondo le recenti linee guida la terapia antiretrovirale in gravidanza si basa sul principio che non è giustificabile sospendere o rimandare una terapia efficace, a meno che non esistano fondati effetti negativi sulla madre, sul feto o sul neonato.
Linee guida dettagliate, che tengano conto dei diversi stadi di progressione della malattia nella madre, si possono consultare nel sito degli statunitensi NIH, National Institutes of health (http://aidsinfo.nih.gov/ (iqc35b45aiwkdknxzkheer2b)/ContentFiles/PerinatalGL_PDA.pdf, 22 marzo 2010).
Anche nei Paesi in via di sviluppo per le donne in gravidanza sono state create specifiche linee guida, che includono tra l’altro scenari riguardanti il trattamento della donna sieropositiva solamente durante il parto o nel periodo perinatale e la difficoltà di somministrazione di latte artificiale in alcuni contesti. Informazioni dettagliate sono visibili sul sito dell’OMS (http://www.who.int/hiv/pub/guidelines/en).
Resistenza al trattamento con ARV
L’emergenza di varianti virali di resistenza ai farmaci durante la terapia con ARV è il motivo più comune per l’interruzione del trattamento. La scarsa aderenza del paziente al regime terapeutico, gli effetti collaterali dei farmaci o le interazioni tra essi possono portare a concentrazioni subottimali del farmaco nell’organismo. Questa situazione favorisce l’emergenza di varianti di HIV che iniziano a replicarsi. Si osserva, pertanto, un aumento del virus nel sangue (rebound). Per ogni farmaco antiretrovirale sono state identificate specifiche mutazioni di resistenza per tutti i sottotipi di HIV. Queste varianti sono trasmissibili entrando nella popolazione e possono diffondersi nella comunità dal momento che sono in grado di infettare altre persone. Nei Paesi sviluppati, dove si registra un elevato accesso ai farmaci antiretrovirali, le varianti di resistenza circolanti nella popolazione possono raggiungere il 20%.
Nei Paesi in via di sviluppo si ricorre spesso al trattamento perinatale della donna sieropositiva in gravidanza per prevenire la trasmissione dell’HIV al neonato. Questi interventi sono, tuttavia, potenzialmente in grado di generare resistenze al farmaco utilizzato, sia nella madre sia nel bambino.
Conclusioni
La pandemia di AIDS rappresenta ancora oggi una priorità di sanità pubblica. L’impatto maggiore si ha nei Paesi in via di sviluppo, tuttavia i dati epidemiologici indicano che ci troviamo di fronte a un nuovo aumento della diffusione dell’infezione in molte aree sviluppate del mondo. La complessità genetica delle varianti circolanti di HIV è in aumento e, in particolare, si registra un forte incremento delle varianti di HIV-1 ricombinanti. Il sottotipo B è ancora prevalente nei Paesi sviluppati, mentre il sottotipo C rappresenta la forma prevalente a livello globale.
La prevenzione è l’unica arma di cui al momento si dispone. Un’adeguata e corretta informazione sui meccanismi di trasmissione dell’infezione, in grado di generare una drastica riduzione dei comportamenti a rischio, è un’azione efficace per limitare la diffusione dell’infezione nella popolazione, soprattutto nei Paesi in via di sviluppo. L’estrema variabilità del virus rende il vaccino ancora non semplice da sviluppare, anche se più recenti approcci mirati a un vaccino in grado di contenere la progressione della malattia sembrano generare nuove speranze.
I farmaci antiretrovirali hanno contribuito a migliorare la qualità della vita, oltre che a ritardare la comparsa della malattia; tuttavia essi restano difficilmente accessibili alle popolazioni che vivono nei Paesi in via di sviluppo a causa degli alti costi e delle carenti infrastrutture sanitarie, necessarie per il monitoraggio del trattamento. L’emergenza di varianti di resistenza è un problema in aumento e le speranze per un controllo della diffusione di queste varianti sono riposte nello sviluppo di farmaci di nuova generazione.
Bibliografia
L. Menéndez-Arias, Targeting HIV: antiretroviral therapy and development of drug resistance, «Trends in pharmacological sciences», 2002, 23, 8, pp. 381-88.
ANSA, 1981-2005: 25 anni di AIDS, a cura di F. Marabotto, M. Boldrini, S. Smerrieri, G. Tommasini, Milano 2005.
Ch. Beyrer, HIV epidemiology update and transmission factors: risks and risk contexts – 16th International AIDS Conference epidemiology plenary, «Clinical infectious diseases», 2007, 44, 7, pp. 981-87.
J.A. Levy, HIV and the pathogenesis of AIDS, Herndon (Va.), 20073.
HIV medicine 2007, ed. C. Hoffmann, J.K. Rockstroh, B.S. Kamps, Paris-Cagliari-Wuppertal, 2007.
C.S. Adamson, E.O. Freed, Recent progress in antiretrovirals. Lessons from resistance, «Drug discovery today», 2008, 13, 9-10, pp. 424-32.
L.O. Kallings, The first postmodern pandemic: 25 years of HIV/AIDS, «Journal of internal medicine», 2008, 263, 3, pp. 218-43.
B.S. Taylor, M.E. Sobieszczyk, F.E. McCutchan, S.M. Hammer, The challenge of HIV-1 subtype diversity, «New England journal of medicine», 2008, 358, 15, pp. 1590-1602.