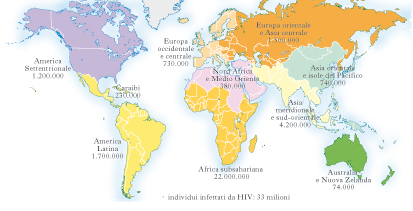
AIDS (sigla dell'ingl. Acquired Immune Deficiency Syndrome)
AIDS (sigla dell’ingl. Acquired Immune Deficiency Syndrome)
Sindrome da immunodeficienza acquisita, stadio clinico terminale dell’infezione da parte del virus dell’immunodeficienza umana (HIV, Human Immunodeficiency Virus) (➔). È stata descritta per la prima volta nel 1981.
L’infezione
Le cellule bersaglio dell’infezione da HIV sono cellule del sistema immunitario, i linfociti T-CD4+, fondamentali per la risposta immunitaria adattativa contro vari tipi di agenti patogeni. L’infezione da HIV provoca una distruzione progressiva di queste cellule con conseguente alterazione del sistema immunitario (immunodepressione) e aumento del rischio di contrarre (da parte di virus, batteri, protozoi e funghi) infezioni e malattie – più o meno gravi – che in condizioni normali potrebbero essere curate o controllate dal sistema immunitario.
Il test sugli anticorpi anti-HIV
Dopo essere entrato in contatto con l’HIV, il soggetto inizia a produrre anticorpi diretti specificamente contro il virus, riscontrabili nel sangue, diventando così sieropositivo. La sieropositività implica che l’infezione è in atto e che è dunque possibile trasmettere il virus ad altri soggetti. La comparsa degli anticorpi, però, non è immediata. Il tempo che intercorre tra il momento del contagio e la comparsa nel sangue degli anticorpi contro l’HIV è detto periodo finestra e dura mediamente 4÷6 settimane, ma può estendersi, in rari casi, fino a 6 mesi. Durante questo periodo, anche se i test sono negativi, il soggetto è comunque in grado di trasmettere l’infezione. È possibile rimanere sieropositivi per anni senza alcun sintomo e accorgersi del contagio solo al manifestarsi di una malattia. Sottoporsi al test della ricerca degli anticorpi anti-HIV è, quindi, l’unico modo di scoprire l’infezione.
Le infezioni opportunistiche
La fase asintomatica può durare anche diversi anni, fino a quando la malattia non diventa clinicamente conclamata a causa dell’insorgenza di una o più infezioni cosiddette opportunistiche. A provocarle sono agenti patogeni che, normalmente, non riescono a infettare soggetti sani, ma soltanto quelli con un sistema immunitario fortemente compromesso. Gli agenti principali sono: protozoi, tra cui Pneumocistis Jeroveci, responsabile di una polmonite interstiziale detta pneumocistosi (➔) e Toxoplasma gondii, che provoca la neuro-toxoplasmosi, malattia che colpisce il cervello, e la criptosporidiosi (➔); batteri, soprattutto Mycobacterium tuberculosis, responsabile della tubercolosi; virus, tra cui il citomegalovirus (CMV) e il John Cunningham virus (JCV); funghi, quali la Candida albicans, il criptococco. Nell’AIDS si possono sviluppare anche diverse forme di tumore, soprattutto linfomi e sarcoma di Kaposi.
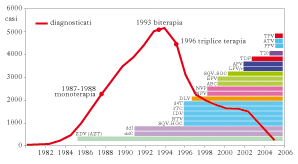
Multiterapia e resistenza nella terapia dell’infezione da HIV
Multiterapia e resistenza nella terapia dell’infezione da HIV. L’obiettivo fondamentale della terapia antiretrovirale consiste nel mantenere bassi i livelli di replicazione virale il più a lungo possibile. Ciò deriva dall’acquisizione che l’aumento dei livelli di HIV-RNA plasmatico coincide con la perdita di immunocompetenza e con un rapido, irreversibile declino delle condizioni cliniche. La terapia ideale dovrebbe avere i seguenti requisiti: abbattere precocemente la replicazione virale; essere efficace per il più lungo periodo possibile; essere priva di effetti collaterali.
Strategie multiterapeutiche
La Terapia Antiretrovirale Altamente Attiva (HAART, Highly Active Antiretroviral Therapy), consiste in una combinazione di tre o più farmaci, appartenenti ad almeno due diverse classi. La scelta della politerapia si basa su due punti fondamentali: è una terapia che abbatte in modo efficace la replicazione virale, se confrontata con monoterapie o bioterapie; permette associazioni sinergiche dal punto di vista farmacodinamico e farmacocinetico e anche favorevoli sotto il profilo delle resistenze agli antiretrovirali, in quanto queste associazioni, per vari motivi, ritardano l‘insorgenza di mutazioni conferenti resistenza. Sono sei le classi attive di farmaci contro l’HIV. Ciascuna classe ha un nome che deriva dal meccanismo di azione:
• NRTI (Nucleoside Reverse Transcriptase Inhibitor, inibitori nucleosidici della trascrittasi inversa). Sono la classe più vecchia di farmaci antiretrovirali: bloccano la capacità dell’HIV di copiare il DNA di una cellula, di cui necessita il virus per replicarsi.
• NNRTI (Non Nucleoside Reverse Transcriptase Inhibitor, inibitori non-nucleosidici della trascrittasi inversa). Bloccano la stessa proteina degli NRTI, ma sono chimicamente differenti.
• IP (Inibitori della Proteasi). Bloccano la proteasi, un enzima necessario al virus dell’HIV per replicarsi.
• IF (Inibitori della Fusione). Bloccano l’ingresso dell’HIV nelle cellule.
• II (Inibitori dell’Integrasi). Agiscono inibendo l’inserzione del DNA dell’HIV nel DNA umano, per mezzo dell’enzima dell’integrasi.
• Gli inibitori del corecettore CCR5. Agiscono bloccando l’attacco del virus a questo recettore e ne impediscono l’ingresso nella cellula.
L’unico effettivo svantaggio della multiterapia consiste nel fatto che l’associazione di farmaci con un basso indice terapeutico e un’elevata incidenza di effetti collaterali, rendono frequenti le sospensioni autonome della terapia o la sua discontinua assunzione.
Resistenza ai farmaci e mutazioni virali
Il fenomeno della diminuzione di sensibilità a farmaci antiretrovirali, correlata alla presenza di mutazioni accumulatesi sul genoma di HIV, è un fenomeno descritto alla fine del 20° secolo, in seguito a lunghe terapie con uno o due NRTI. Questo fenomeno sta nell’enorme potenzialità di varianti che HIV è in grado di esprimere, a causa dell’ elevata capacità replicativa e della bassa accuratezza del processo di trascrizione del suo genoma. È inoltre ormai chiaro che il fenomeno della resistenza è correlato con terapie non pienamente soppressive.
Dal punto di vista molecolare, la resistenza è determinata, nella maggior parte dei casi, da un cambiamento della struttura dell’enzima virale che è il bersaglio del farmaco in questione. La resistenza viene espressa come una determinata diminuzione della suscettibilità a un determinato farmaco. La suscettibilità a un farmaco viene misurata in vitro ed espressa come concentrazione di farmaco che inibisca la replicazione virale del 50% e del 90% (IC50 ed IC90), in modo simile a quanto avviene per gli antibiotici. La constatazione che, una volta interrotta la terapia in atto in un soggetto ormai resistente, il sottotipo virale dominante torni a essere quello più simile a quello selvaggio, ossia quello iniziale prima della terapia, nel giro di alcune settimane, porta alla conclusione che, al di fuori della somministrazione dei farmaci, la maggioranza delle mutazioni di resistenza siano sfavorevoli per la replicazione virale.
Effettivamente, alterando fortemente la struttura degli enzimi virali che sono bersaglio dei farmaci, molte di queste mutazioni rallentano la replicazione di HIV, ossia ne riducono la vitalità (fitness). Tuttavia, un virus, resistente a un farmaco che continui a essere somministrato, tende ad accumulare altre mutazioni secondarie che ripristinano una buona fitness virale pur mantenendo la resistenza.
Probabilmente un meccanismo simile è anche alla base del fatto che per alcuni farmaci una significativa resistenza si sviluppa più difficilmente che per altre, sia perché necessita della presenza di più mutazioni, sia perché queste tendono a verificarsi con una frequenza minore. La facilità o meno con cui un farmaco o una classe di farmaci sviluppa una resistenza rilevante viene espressa con il concetto di ‘barriera genetica’. Farmaci a bassa barriera genetica, come gli NNRTI, determinano gradi elevati di resistenza in presenza di una singola mutazione, mentre farmaci ad alta barriera genetica come gli IP tipicamente necessitano di un accumulo di diverse mutazioni.