Alla ricerca dei morfogeni
Alla ricerca dei morfogeni
Lo sviluppo embrionale e postembrionale del cervello è regolato, come quello di ogni altro organo, da una serie di circuiti genici. Questi constano di vari tipi di geni tra i quali spiccano i cosiddetti geni regolatori, il cui ruolo è di modulare l'attività di gruppi di altri geni. In questo saggio viene tracciata lo storia dell'identificazione di alcune famiglie di geni regolatori operanti nel sistema nervoso centrale. Alcuni controllano lo sviluppo del midollo spinale e del bulbo mentre altri, tra cui quelli delle famiglie EMX e OTX, controllano lo strutturazione del cervello e della corteccia cerebrale, lo sua parte più nobile. II gene Emx2, in particolare, sembra controllare lo proliferazione dei neuroni della corteccia cerebrale. Un discorso a parte merita lo regione dalla quale prende origine il cervelletto, che sembra svilupparsi secondo un proprio schema.
Ontogenesi e filogenesi
Il cervello di ogni organismo si trova, istante per istante, al crocevia di due processi biologici fondamentali. Da una parte, il cervello degli individui di una determinata specie è soggetto a un processo evolutivo di lungo termine, al passo con tutti gli altri organi. Dall'altra, il cervello di ogni singolo individuo è in continua, quotidiana trasformazione al seguito delle vicende della sua vita: o si sta sviluppando, oppure sta invecchiando, o ancora sta semplicemente elaborando i dati forniti dalla vita di tutti i giorni e, quindi, sta imparando.
Questa osservazione è valida sostanzialmente per tutte le strutture biologiche, ma per il cervello si impongono delle condizioni particolari su entrambi i fronti. Su quello evolutivo o filo genetico, è stato più volte osservato che la velocità con cui si è evoluto il cervello, nei mammiferi prima e nei primati poi, è prodigiosa. Non vi è nessun motivo per ritenere che questo processo evolutivo abbia seguito vie diverse o abbia obbedito a principi diversi da quelli validi per tutte le altre strutture biologiche, ma certo la rapidità con cui tutto è avvenuto è veramente impressionante. Nella linea evolutiva che porta dai primati superiori all'uomo, per esempio, la massa del cervello è raddoppiata in un periodo di tempo inferiore ai due milioni di anni e triplicata negli ultimi tre o quattro milioni di anni.
Anche sul piano dello sviluppo ontogenetico, embrionale e postembrionale di un particolare individuo, il cervello occupa una posizione tutta particolare. Per questo organo, come per tutti gli altri organi del nostro corpo, il biologo si può porre due ordini di interrogativi: uno riferito al suo funzionamento, l'altro alla sua formazione. In una certa misura questi due interrogativi possono essere affrontati separatamente. È infatti molto interessante studiare come si formano un rene o il cristallino dell'occhio, ma si può studiare il funzionamento di questi organi indipendentemente dalla comprensione dei meccanismi biologici che hanno portato alla loro formazione. Nel caso del cervello la situazione è un po' più complicata.
La struttura del cervello e, in particolare, della corteccia cerebrale è tutt'uno con la sua formazione e il suo funzionamento è, da un lato, dettato dalle istruzioni biologiche contenute nel genoma, dall'altro, è anche il risultato degli eventi biologici che hanno avuto luogo durante lo sviluppo embrionale nonché delle esperienze fatte nei primi giorni e poi nei primi mesi di vita. A rigore il nostro cervello si sviluppa per tutta la vita, perché per tutta la vita noi siamo capaci di apprendere e memorizzare qualcosa di nuovo, ma questo è particolarmente vero per i primissimi tempi della nostra vita che sono in grado di plasmare il cervello in maniera determinante. Per il cervello quindi lo sviluppo embrionale e postembrionale è parte del suo funzionamento.
Va notato d'altra parte che sviluppo ontogenetico ed evoluzione non sono due processi indipendenti, malgrado l'enorme differenza nella scala dei tempi implicati. Qualcuno ha detto che, almeno per gli organismi pluricellulari, l'intero processo evolutivo non sarebbe altro che l'evoluzione dei processi di sviluppo. Protagonista, nell'uno e nell'altro caso, è il genoma, cioè l'insieme dei geni di un organismo. Per quanto riguarda l'evoluzione del cervello, la nostra attenzione si deve concentrare in particolare su quell'insieme di geni che controllano la formazione e il funzionamento del cervello stesso. Comprendere il controllo genetico dello sviluppo di questa struttura vuoI dire anche comprendere il materiale sul quale opera l'evoluzione della struttura stessa. l geni, infatti, non sono i protagonisti diretti dei processi che assicurano lo sviluppo e il funzionamento degli organismi viventi: il loro ruolo è quello di custodire l'informazione biologica per sintetizzare le varie famiglie di proteine che rappresentano gli esecutori materiali di tutte le funzioni vitali dei viventi. Ma l'oggetto primario dell'evoluzione non sono le proteine; a evolvere sono i geni che le codificano, sia individualmente sia nell'insieme dei loro processi regolativi.
Categorie di geni e proteine
Che cosa codificano i geni e in particolare quei geni che regolano lo sviluppo e il funzionamento del cervello? Nel loro complesso codificano ovviamente un numero enorme di proteine diverse, ma concettualmente è possibile suddividere in categorie questa enorme congerie. La prima categoria è quella delle proteine dette housekeeping (letteralmente, che gestiscono la casa), ovvero le proteine coinvolte nella gran parte dei cicli cellulari metabolici; esse assicurano la sopravvivenza e la proliferazione di tutte le cellule dell'organismo. Nonostante l'indiscutibile importanza del loro ruolo, si ritiene che esse siano più o meno le stesse per tutte le cellule e che quindi, almeno in linea di principio, non rivestano un ruolo primario nell'evoluzione e nella formazione di strutture biologiche specifiche.
Oltre questo primo gruppo, dobbiamo considerare almeno altre quattro grandi categorie di proteine e quindi di geni. In primo luogo vi sono le proteine nucleari, tra cui spiccano quelle che, interagendo più o meno direttamente con sequenze specifiche di DNA, regolano l'espressione dei geni. Queste proteine sono spesso defrnite fattori di trascrizione o fattori trascrizionali, mentre i geni che le codificano prendono il nome di geni regolatori. Comunque, non tutte le proteine nucleari sono fattori trascrizionali, anche se questi ne rappresentano la parte più cospicua e rilevante.
Una seconda categoria, molto vasta ed eterogenea, comprende tutte quelle proteine citoplasmatiche che fanno da tramite fra ciò che succede sulla membrana cellulare e il nucleo della cellula. Può trattarsi di proteine che si muovono esse stesse verso il nucleo o, più comunemente, di proteine che mettono in atto una serie di processi biochimici a catena, indicati nel loro complesso come trasduzione di segnale. Il ruolo di queste proteine è fondamentale se si vuole che la cellula risponda alle sollecitazioni e ai messaggi provenienti dalle altre cellule costituenti l'organismo. La cellula comunica con le altre cellule essenzialmente tramite la sua membrana plasmatica nella quale si trovano le proteine della terza categoria, le proteine di membrana, appunto, di varia natura e con varie funzioni fondamentali per la vita cellulare. Per esempio, le proteine di adesione assicurano il contatto più o meno stabile fra una cellula e l'altra o tra una cellula e la cosiddetta matrice extracellulare. Un altro tipo di proteine di membrana, i recettori, hanno invece la funzione di riconoscere fattori extracellulari specifici e segnalarne la presenza all'interno della cellula stessa. La quarta categoria di proteine comprende, infine, proprio i fattori extracellulari, il cui ruolo è quello di assicurare la sintonia tra le vicende interne delle varie cellule che compongono il corpo, durante la fase di sviluppo e per tutta la vita adulta. Appartengono a questa categoria gli ormoni e i cosiddetti fattori di crescita, che spesso sono molecole diffusibili in grado di agire a distanza, o molecole a diffusione controllata in grado di trasmettere un segnale biologico solo a corto raggio, nell'ambito di qualche diametro cellulare. l fattori di crescita traggono il loro nome dalle circostanze storiche che hanno portato alla loro identificazione; infatti, i primi di questi sono stati individuati in base alla loro proprietà di sostenere la sopravvivenza e la crescita di specifiche popolazioni cellulari coltivate in vitro. Questo non significa che queste proteine svolgano anche in vivo un'analoga funzione di fattori trofici. È opportuno, invece, considerare i vari fattori di crescita come regolatori dello stato proliferativo o differenziativo di specifiche popolazioni cellulari. Questa regolazione avviene istante per istante in maniera quasi continua e contribuisce tra l'altro alla creazione e al mantenimento della forma biologica. Si tratta quindi allo stesso tempo di fattori trofici di mantenimento e di fattori morfogenetici.
Possiamo considerare la vita di una cellula come divisa fra due esigenze: da una parte, il suo funzionamento di base e la sua sopravvivenza, magari in adesione a processi e programmi preordinati che si dipanano sul filo di un orologio interno; dall'altra, la sua pronta risposta alle sollecitazioni di tutte le altre cellule e, in ultima analisi, del mondo esterno. La cellula deve ottemperare contemporaneamente a queste due esigenze per tutta la vita, ma in maniera preponderante nella fase di crescita e di sviluppo, quando le varie strutture vanno formate, organizzate e consolidate. Dato che durante questa fase la concertazione dei vari processi e la loro orchestrazione complessiva sono essenziali, perché certi nessi e certi contatti non esistono ancora, è particolarmente istruttivo considerare che cosa succede in questi periodi.
Alle origini della forma
Lo sviluppo di un organismo pluricellulare si articola essenzialmente su due direttrici: l'aumento della sua massa, raggiunto per lo più attraverso la moltiplicazione cellulare, e l'organizzazione di questa nuova massa in tessuti, organi e apparati in grado di sussistere e funzionare per il vantaggio proprio e di tutto l'organismo. Questo secondo processo racchiude gli aspetti più propri dello sviluppo embrionale all'origine della struttura e della forma. Le molecole regolatrici di questa serie di eventi possono essere chiamate fattori determinanti morfogenetici, o morfògeni in senso lato.
Intuitivamente, un agente morfogeno è una sostanza che si sposta fra le cellule di una certa regione dell'embrione e fornisce le istruzioni necessarie per la genesi delle forme. Questo è però solo un aspetto del processo di generazione della forma biologica, perché tali istruzioni devono essere ricevute, applicate e talvolta anticipate, se non sollecitate. Lo sviluppo richiede quindi l'azione concertata di un gran numero di molecole, e quindi di geni, appartenenti a tutte le categorie sopra menzionate, senza che si possa assolutamente assegnare un primato a qualcuna di esse. In futuro, quando saranno state accumulate molte più conoscenze sulle basi biochimiche e molecolari degli eventi ontogenetici, si potrà probabilmente descrivere l'intero processo procedendo di pari passo su tutti i fronti di questa gigantesca concertazione. La storia della scienza in generale, e della biologia in particolare, dimostra invece che spesso si procede con passo molto diverso sui vari fronti, soprattutto in una fase iniziale. Ciò è dovuto in larga parte a circostanze accidentali che consentono una velocità di avanzamento più sostenuta su un fronte piuttosto che su un altro, così che in certi periodi sembra che si dia importanza a una certa classe di molecole e al loro ruolo, mentre in un altro periodo si privilegia il ruolo di un'altra classe. Le conoscenze attualmente disponibili sullo sviluppo e, in particolare, su quello del sistema nervoso sono decisamente preliminari e tipiche di una fase iniziale; esse riguardano i fattori di crescita e soprattutto i fattori trascrizionali. Tratterremo qui prevalentemente questi ultimi.
La seconda metà del secolo 20° ha visto accumularsi un'incredibile quantità di conoscenze per quanto riguarda i geni regolatori attivi nel controllo dello sviluppo, quasi una vera e propria esplosione. Nonostante si sia ancora molto lontani dal comprendere in dettaglio i meccanismi che regolano lo sviluppo embrionale di un organismo superiore, le nozioni acquisite su tale argomento in questo secolo, e più in particolare dalla fine degli anni Settanta, superano di gran lunga tutto ciò che si era imparato in tutta la storia precedente della biologia. In questo periodo sono stati introdotti molti nuovi concetti e molti altri, già espressi precedentemente, sono stati rivisitati in chiave molecolare.
Tra le varie storie che punteggiano questa fase esplosiva di ricerca ed esplorazione, ve n'è una che merita particolare menzione perché costituisce una delle storie più appassionanti di questo secolo e una delle più esaltanti in assoluto dell' epopea della biologia. Si tratta della scoperta dei geni omeotici della drosofila, una categoria di geni che controllano l'impianto generale e l'organizzazione del corpo di questo insetto, e della conseguente identificazione dei geni regolatori appartenenti alla famiglia degli omeogeni, o geni contenenti un omeobox, operanti in tutti gli organismi pluricellulari. Sulla base di queste scoperte oggi si crede di cominciare a capire come è regolata l'intera strutturazione del nostro corpo.
Dalla drosofila all'uomo
La storia della scoperta dei geni omeotici è cominciata vari anni fa con lo studio sistematico di alcune bizzarre mutazioni, condotto dal ricercatore americano E.B. Lewis (Lewis, 1964; 1978). La drosofila ha normalmente due ali, come tutti i ditteri, ma in seguito a una mutazione possono nascere moscerini con quattro ali, o del tutto privi di queste, oppure possono nascere moscerini che hanno un paio di zampe sulla testa al posto delle antenne o anche al posto del naso. Lewis ragionò che alla base di mutazioni come queste dovevano esservi geni importanti, il cui compito fosse quello di garantire che queste cose non accadano e di controllare che le zampe, le ali e le antenne si formino tutte regolarmente alloro posto.
Tutte queste alterazioni rivelano una logica comune (Lawrence, 1992): ciò che si trasforma in questi mutanti non è la singola struttura anatomica, ma l'intero segmento corporeo a cui quella struttura appartiene. Il moscerino che nasce con quattro ali nasce in realtà con due toraci, all'interno dei quali l'ala è soltanto la struttura più evidente. Quello che nasce con le zampe al posto delle antenne mostra una trasformazione globale della regione a cui normalmente appartengono le antenne in quella a cui normalmente appartengono le zampe.
I geni in questione sono stati chiamati omeotici perché le mutazioni a loro carico comportano la trasformazione di una struttura biologica in un'altra consimile. Mutazioni del genere, in cui strutture ripetute come zampe e ali negli insetti o foglioline nelle piante si trasformavano in altre strutture ripetute simili, erano già state osservate verso la fine del secolo 19° e al fenomeno era stato dato il nome di omeosi, dal greco ὁμοίωσις, letteralmente assimilazione, somiglianza (Bateson, 1894).
I geni omeotici della drosofila sono quindi quei geni che controllano l'identità dei singoli segmenti corporei di questo insetto. L'analisi genetica rivela inoltre che otto di questi geni si trovano l'uno vicino all'altro in una ristretta regione genomica di uno dei cromosomi della drosofila, in un ordine fisico che non è casuale ma riproduce l'ordine dei segmenti corporei che ciascuno di essi controlla: il gene omeotico che si trova più a destra sul cromosoma controlla il segmento corporeo posto all'estremità anteriore, mentre quello che si trova più a sinistra controlla il segmento posto all'estremità posteriore. A questo fenomeno affascinante e misterioso è stato dato il nome di colinearità (Lewis, 1978).
I geni omeotici della drosofila furono poi tra i primi a essere isolati e caratterizzati non appena venne messa a punto la tecnica del clonaggio molecolare, che portò un certo numero di conferme e un certo numero di novità. Le conferme riguardarono in primo luogo la corrispondenza fra le regioni del corpo controllate da un determinato gene omeotico e il dominio di espressione dei suoi prodotti genici. Il prodotto genico di un gene che controlla il primo segmento toracico è effettivamente presente nei primordi del primo segmento toracico e solo lì, mentre il prodotto genico di un gene che controlla il primo segmento addominale è effettivamente presente nei primordi del primo segmento addominale. Un'altra conferma riguardò il fenomeno della colinearità. Gli otto geni omeotici principali della drosofila sono localizzati effettivamente l'uno accanto all'altro in una regione fisica abbastanza ristretta del genoma del moscerino e l'ordine secondo il quale si succedono è lo stesso con il quale si succedono i segmenti corporei che ciascuno di loro controlla e nei quali sono individuabili i loro prodotti genici.
Nei primi mesi del 1984 si scoprì che questi geni hanno una struttura molto simile tra loro e, in particolare, contengono una regione di circa 180 nucleotidi praticamente identica in tutti e otto. Questa regione venne chiamata omeobox e il dominio proteico di circa 60 amminoacidi che essa codifica venne chiamato omeodominio. In seguito, si scoprì che questi otto geni regolatori codificano altrettante proteine appartenenti a una stessa famiglia di fattori trascrizionali e che geni simili ai geni omeotici della drosofila esistono in tutti gli organismi superiori, compreso l'uomo. Si è visto successivamente che l'omeodominio è presente nei prodotti genici di molti geni regolatori, sia nella drosofila sia in tutti gli organismi superiori, dagli invertebrati ai vertebrati e quindi all'uomo. Oggi è noto che l'omeodominio è una regione proteica e che la proteina che lo contiene, detta omeoproteina, è una proteina nucleare con proprietà di fattore trascrizionale, in grado di riconoscere e legarsi a sequenze nucleotidiche specifiche di DNA regolando l'espressione di un certo numero di geni. Ogni gene che contiene un omeobox ha molte probabilità di essere un gene regolatore che codifica un fattore trascrizionale e la presenza di un omeobox ha costituito il filo conduttore per la scoperta di sempre nuovi geni regolatori negli organismi più diversi. Con questo criterio sono state individuate nel corso degli anni Novanta intere famiglie di geni regolatori contenenti un omeobox, cioè di omeogeni.
Gli omeogeni HOX del tronco e del rombencefalo
Sulla base della loro sequenza amminoacidica, gli omeodomini possono essere suddivisi in varie classi e i geni corrispondenti possono essere suddivisi in famiglie. In moltissimi casi questi geni sono omologhi ad altrettanti geni di drosofila di cui è stato possibile studiare la genetica, se non direttamente la funzione. Esiste per esempio la famiglia dei geni EN omologhi al gene engrailed, la famiglia dei geni P AX omologhi al gene paired, la famiglia dei geni NKX omologhi ai geni NK e la famiglia dei geni DLX omologhi al gene Distal-less, sempre di drosofila; ma non v'è dubbio che la famiglia meglio studiata sia quella che riunisce i geni che codificano proteine contenenti gli omeodomini più simili alla sequenza prototipo presente nei geni omeotici della drosofila. Gli omeogeni contenenti un omeodominio di questa classe costituiscono una famiglia genica, la famiglia dei geni HOX, in tutte le specie di vertebrati in cui sono stati studiati, in particolare nel topo e nell'uomo (McGinnis e Krumlauf, 1992). Questi omeogeni costituiscono una famiglia genica sulla base di almeno due criteri: si trovano localizzati l'uno accanto all'altro in regioni genomiche relativamente compatte e provvedono collettivamente a specificare l'identità delle varie regioni del corpo lungo l'asse antero-posteriore.
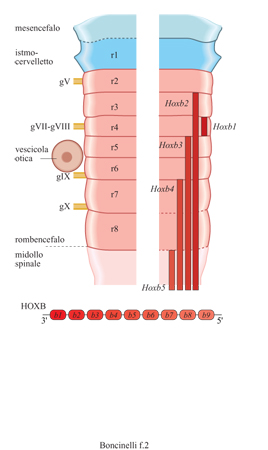
Gli omeogeni HOX di mammifero sono una quarantina e sono disposti in quattro regioni cromosomiche compatte diverse, chiamate complessi genici o loci HOX (HOXA, HOXB, HOXC e HOXD) e contenenti ciascuna circa dieci geni (fig. 1). Tutti questi geni sono trascritti nella stessa direzione, dall'estremità 5' verso quella 3' del proprio locus. l quattro loci possono essere facilmente allineati in maniera tale che i geni corrispondenti si trovino disposti sulla stessa verticale. Si usa dire che i geni HOX allineati sulla stessa verticale appartengono allo stesso gruppo di omologia, o sotto famiglia. In termini evolutivi questo significa che i quattro loci si sono originati per duplicazioni successive da uno stesso locus primitivo e si sono successivamente distribuiti su cromosomi diversi. Durante questo processo alcuni dei geni originariamente presenti si sono persi, mentre non ne è stato acquistato nessuno nuovo.
I quattro loci HOX dei vertebrati possono essere facilmente allineati anche al complesso degli otto geni omeotici della drosofila e ciascuno dei quattro loci si può considerare omologo a esso. Se ne può concludere che un complesso genico ancestrale, contenente almeno quattro o cinque di questi geni, doveva esistere già in un antenato comune degli insetti e dei vertebrati, le cui linee evolutive si sono separate più di mezzo miliardo di anni fa. Dato che è quasi incredibile che questi geni siano rimasti tutti insieme per tante decine e centinaia di milioni di anni, e che si siano mantenuti allineati sempre nello stesso ordine, è probabile che si tratti di un fenomeno di grande significato biologico o di un cosiddetto 'incidente congelato' nel tempo.
I prodotti dei geni HOX sono presenti nelle cellule del sistema nervoso centrale durante lo sviluppo embrionale dei vertebrati. Il dominio di espressione di ogni singolo gene HOX si estende per un certo tratto lungo l'asse antero-posteriore dell'embrione, ma mostra un bordo anteriore molto netto. Le regioni dell'embrione controllate dai vari geni HOX presentano anch'esse il fenomeno della colinearità già osservato per i geni omeotici di drosofila; in questo caso, anzi, le regole della colinearità sono ancora più facili da enunciare che nella drosofila, perché i geni HOX dei vari loci sono trascritti tutti nella stessa direzione: geni che si trovano verso l'estremità 3' dei rispettivi loci sono espressi anteriormente rispetto a geni che si trovano via via spostati verso l'estremità 5' dello stesso locus (McGinnis e Krumlauf, 1992).
La scansione del tubo neurale da parte dei geni HOX non è uniforme, in quanto esistono evidentemente regioni che richiedono una minore rifinitura e regioni che richiedono una ripartizione e una specificazione molto più accurate. Questo è il caso del rombencefalo, quella parte del cervello embrionale al confine fra il cervello vero e proprio e il midollo spinale, che darà successivamente luogo al bulbo e al midollo allungato e dal quale partiranno quasi tutti i nervi cranici. In una fase ben precisa dello sviluppo del topo e del pollo, per esempio, si può osservare che il romboencefalo è suddiviso in otto regioni morfologiche, dette rombomeri, consistenti in altrettanti rigonfiamenti separati da solchi. Il bordo anteriore del dominio di espressione di alcuni geni HOX coincide con il confine fra alcuni di questi rombomeri in formazione. Gli omeogeni localizzati al 3' del locus HOXB, per esempio, scandiscono il rombencefalo (fig. 2) in maniera regolare e colineare. Quello che vale per i geni al 3' del locus HOXB vale anche per i geni al 3' degli altri tre loci: i primi quattro geni al 3' di ognuno dei quattro loci HOX suddividono in quattro sottoregioni il rombencefalo e tutta la circostante regione branchiale. In corrispondenza di alcuni rombomeri si ha, nelle fasi successive dello sviluppo, il posizionamento delle radici dei nervi cranici e dei gangli spinali dorsali. Il rombencefalo rappresenta l'unica regione primariamente segmentata del sistema nervoso embrionale dei mammiferi e l'espressione dei geni HOX è rilevabile ben prima che compaiano segni morfologici di confini fra rombomero e rombomero. I geni HOX, quindi, suddividono palesemente la regione del corpo corrispondente al rombencefalo in territori distinti, o sottoregioni.
Allo scopo di comprendere più a fondo il ruolo dei geni HOX nello sviluppo dell'embrione, è stato prodotto un certo numero di topi transgenici che portano mutazioni artificiali, per eccesso o per difetto di funzione, in alcuni di questi geni (Krumlauf, 1994). Mutanti artificiali per eccesso di funzione di un gene HOX hanno mostrato dei difetti a carico dello scheletro assiale, malformazioni cranio- facciali e alterazioni nella disposizione dei nervi cranici. Alcuni difetti osservati in strutture ripetute di questi mutanti sembrano poter suggerire trasformazioni in direzione posteriore: la prima vertebra cervicale si presenta, per esempio, come una copia imperfetta della seconda. Al contrario, topi transgenici mutanti per difetto di funzione mostrano una trasformazione d'identità in direzione anteriore: per esempio, alcune vertebre toraciche possono acquisire caratteristiche proprie di quelle anteriori.
L'assenza del prodotto di un dato gene HOX produce difetti generalizzati in tessuti e organi diversi all'interno di una regione corporea relativamente ristretta, ben definita e delimitata lungo l'asse antero-posteriore, regione localizzata all'estremità anteriore del dominio di espressione che contiene i trascritti di quel gene. Da notare che i mutanti per due o più geni HOX che appartengono allo stesso gruppo di omologia mostrano un fenotipo molto più severo di quello dei singoli mutanti; quindi, i geni HOX che appartengono allo stesso gruppo cooperano, almeno in parte, alla regolazione della stessa regione corporea e al compimento di funzioni concorrenti.
È corretto domandarsi se possono essere definite omeotiche le trasformazioni osservate nei topi transgenici mutanti per questi geni. Non v'è dubbio che l'identità di certe strutture è parzialmente modificata a imitazione di una struttura simile, ma anteriore nel caso dei mutanti per difetto di funzione, posteriore nel caso dei mutanti per eccesso di funzione; questo è particolarmente evidente nel caso dei doppi mutanti per due geni appartenenti allo stesso gruppo di omologia. In altri casi, però, la trasformazione non è così chiaramente di tipo omeotico o, al contrario, si osserva la soppressione di una determinata struttura corporea ripetuta. Esistono perciò alcune differenze fra il meccanismo d'azione dei geni HOX e quello dei geni omeotici della drosofila. D'altra parte, occorre tener presente che i mammiferi non sono organismi nettamente segmentati al pari di questi insetti. Possiamo anche pensare che l'esistenza di quattro loci HOX invece di uno serva anche a mitigare l'effetto strettamente segmentale dei geni appartenenti ai vari gruppi e che la relativa continuità delle nostre regioni corporee derivi da una sovrapposizione di diverse logiche segmentali, leggermente sfalsate fra loro.
Recentemente è stato messo in luce un altro tipo di colinearità esibita dai geni appartenenti ai vari complessi genici HOX, la cosiddetta eolinearità temporale. l geni HOX non entrano in azione tutti contemporaneamente durante lo sviluppo embrionale; infatti, prima si attivano quelli localizzati al 3' dei vari loci, poi quelli che si trovano in posizione centrale e infine quelli localizzati al 5' dei loro rispettivi loci. Nell'embrione di topo, la cui gestazione dura una ventina di giorni, i geni localizzati al 3' sono attivati per la prima volta intorno al 7° giorno dalla concezione, mentre quelli localizzati al 5' compaiono almeno due giorni dopo. Nell'embrione di rospo, che impiega 24 ore a svilupparsi, trascorrono 5 o 6 ore tra la comparsa dei prodotti dei primi geni HOX e quella dei prodotti dei geni più tardivi. Non è chiaro quale sia la relazione fra il fenomeno della colinearità topo grafica o strutturale e quello della colinearità temporale dei geni HOX. Secondo alcuni è proprio la colinearità temporale l'evento primario e la colinearità strutturale non è che una sua conseguenza. Dopo tutto, lo sviluppo non è altro che uno svolgimento ordinato di eventi che si succedono nel tempo e che, in seguito alla loro successione temporale, danno luogo a strutture specifiche organizzate nello spazio.
L'azione dei geni appartenenti ai complessi HOX può essere spiegata considerando il fatto che in una regione specifica del nucleo delle nostre cellule è localizzato un gruppo di geni che contiene nel suo complesso tutte le informazioni necessarie per determinare il succedersi delle parti principali del nostro corpo. Al momento opportuno tutti questi geni entrano in azione uno dopo l'altro, con un ritmo cadenzato, in modo che il loro succedersi lineare sul cromosoma si risolva dapprima in una progressione temporale del momento di inizio della loro azione e in seguito in una successione spaziale e posizionale delle varie parti del corpo.
Gli omeogeni del cervello
Molto meno si conosce, invece, a proposito del controllo genetico dello sviluppo della testa e del cervello, sia negli insetti che nei mammiferi (Finkelstein e Boncinelli, 1994), ma recentemente si è registrato qualche progresso anche in questo campo. Infatti, sono stati identificati alcuni geni che sembrano giocare un ruolo essenziale nella specificazione delle regioni anteriori della testa e del cervello, sia nella drosofila sia nei vertebrati. Nella drosofila sono stati identificati due omeogeni, a cui è stato dato il nome di empty spiracles (ems) e orthodenticle (otd), che sembrano necessari per la regionalizzazione della regione cefalica dell'embrione di questo insetto. Utilizzando questi due geni è stato possibile isolare e caratterizzare quattro loro omologhi nei vertebrati: Emxl ed Emx2 (Simeone et al., 1992a; l 992b), omologhi a ems, e Otxl e Otx2 (Simeone et al., l 992a; 1993), omologhi a otd.
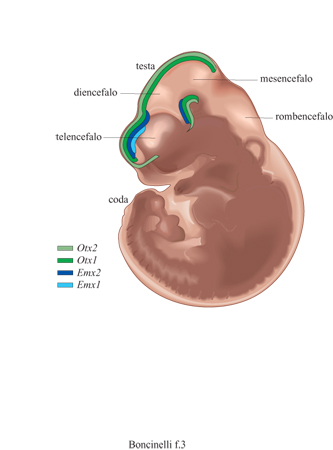
In tutte le specie studiate, i quattro geni citati sono espressi in estese regioni del cervello rostrale in via di sviluppo, regioni che comprendono tra l'altro la futura corteccia cerebrale. In particolare, Emxl ed Emx2 sono specifici del prosencefalo, mentre gli altri due, Otxl e Otx2, riguardano l'intero cervello rostrale che comprende il prosencefalo e il mesencefalo.
Espressione dei geni EMX e OTX in embrioni di topo
A 10 giorni di gestazione (periodo indicato come E10), il tubo neurale dell'embrione di topo comincia a mostrare le regioni presuntive corrispondenti alle future suddivisioni anatomiche fondamentali. L'intero tubo neurale è costituito da cellule neuroepiteliali in attiva proliferazione e la maggior parte degli eventi differenziativi specifici deve ancora avere luogo. Tutti e quattro i geni sono espressi a questo stadio; i loro domini di espressione (Simeone et al., 1992a) appaiono come ampie regioni del cervello embrionale, che sono comprese l'una nell' altra nella sequenza Emxl<Emx2<Otxl<Otx2 (fig. 3). Il dominio d'espressione di Emxl comprende il telencefalo dorsale, con un bordo posteriore leggermente anteriore a quello che si trova fra il diencefalo e il telencefalo presuntivi, mentre Emx2 è espresso nel neuroectoderma prosencefalico dorsale e ventrale, con un bordo anteriore leggermente più avanzato rispetto a quello di Emxl e un bordo posteriore situato all'interno del tetto del diencefalo presuntivo. Questo bordo molto probabilmente coincide con il confine fra il primo e il secondo segmento talamico, che daranno luogo rispettivamente al tal amo ventrale e al talamo dorsale. Il dominio d'espressione di Otxl contiene quello di Emx2 e copre una regione continua che racchiude parte del telencefalo, il diencefalo e il mesencefalo, con un bordo anteriore non molto dissimile da quello di Emx2. Il bordo posteriore del dominio d'espressione di Otxl coincide con quello del futuro mesencefalo. Il dominio d'espressione di Otx2, infine, contiene quello di Otxl, sia dorsalmente sia ventralmente, e interessa praticamente l'intero cervello rostrale, con la sola eccezione dell'area ottica primordiale.
Lo studio dell' espressione di questi geni nel cervello di embrioni ElO mostra, quindi, uno schema di domini d'espressione concentrici relativi ai quattro geni in questione. Questi domini definiscono collettivamente un cervello embrionale rostrale, o preistmico, contrapposto al rombencefalo e ancor più al midollo spinale. Inoltre, anche la prima comparsa dei trascritti dei quattro geni è sequenziale (Simeone et al., 1992a): Otx2 è già espresso a E5,5 (cioè a 5 giorni e mezzo di gestazione), seguito da Otxl ed Emx2 a E8÷E8,5 (tra gli otto e gli otto giorni e mezzo) e infine da Emxl a E9,5 (nove giorni e mezzo). Sembra a questo punto ragionevole postulare un ruolo di questi quattro geni nella definizione o nel mantenimento, o in entrambi, dell'identità delle varie regioni del cervello embrionale. Secondo questa ipotesi la specificazione delle varie sottoregioni del cervello rostrale implicherebbe il succedersi di varie tappe, con centro nel telencefalo dorsale.
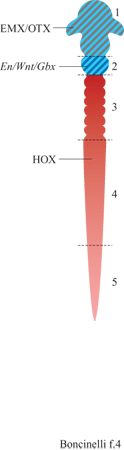
Con l'individuazione dei geni delle famiglie EMX e OTX, si completa un primo quadro delle sfere d'influenza dei vari geni regolatori nel sistema nervoso centrale. Sulla base dell' espressione di questi geni possiamo ipotizzare il sistema nervoso centrale di un vertebrato, e per estensione tutto il suo corpo, come suddiviso in almeno cinque vaste regioni (fig. 4). La regione l corrisponde al cervello rostrale, che comprende il prosencefalo e il mesencefalo e che rappresenta il dominio dei geni EMX e OTX, mentre le regioni 3, 4 e 5 rappresentano il campo d'azione dei geni HOX. All'interno di questa famiglia genica si possono facilmente distinguere tre sotto famiglie che corrispondono ad altrettante regioni del sistema nervoso centrale. Per esempio, i geni HOX dei gruppi 1÷4 localizzati al 3' dei vari IDei controllano il rombencefalo, o per essere più precisi i rombomeri dal 2° all'8°. Vi sono buone ragioni per ritenere che questa suddivisione del sistema nervoso centrale in vaste regioni non sia soltanto una semplice registrazione dei domini d'espressione dei vari geni. Si ritiene, infatti, che sia proprio la meccanica della regolazione genica dello sviluppo a essere diversa fra la regione l e le regioni 3÷5, in analogia con quanto avviene per le corrispondenti regioni dell' embrione di drosofila. Resta fuori da questo schema la regione 2, corrispondente al l° rombomero e alla cosiddetta regione mes-metencefalica, ma ciò non significa che si abbiano poche informazioni al riguardo. Al contrario, molti geni attivi in questa regione sono già stati identificati (v. figura 4). Appare chiaro comunque che la regione 2 non appartiene né al campo d'azione dei geni EMX e OTX né a quello dei geni HOX e che la sua regolazione obbedisce a regole del tutto particolari (v. oltre).
Espressione precoce di Otx2
Tra questi omeogeni, Otx2 sembra svolgere un ruolo fondamentale in una fase molto precoce dello sviluppo del sistema nervoso dei vertebrati, cioè nella prima specificazione della testa e del cervello rostrale frn dai primi stadi della gastrulazione (Bally-Cuif e Boncinelli, 1997). La sua espressione nel topo è già rilevabile nelle strutture embrionali della blastocisti appena impiantata a partire da embrioni di cinque giorni e mezzo, uno stadio ancora precedente alla formazione della stria primitiva (Simeone et al., 1993; Mallamaci et al., 1996). A questo stadio, i prodotti genici di Otx2 sono presenti nelle cellule del foglietto embrionale da cui deriverà l'intero embrione, il cosiddetto ectoderma embrionale o epiblasto, ma non nell'ectoderma extraembrionale. Lo stesso profilo d'espressione si osserva in embrioni in fasi di gestazione leggermente più avanzate (E6,5÷E7). Tra E7 ed E7,5 il confine posteriore del dominio di espressione di Otx2 ripiega progressivamente su posizioni anteriori, dove rimarrà per il resto dello sviluppo. Queste regioni corrispondono al neuroectoderma del prosencefalo e del mesencefalo presuntivi.
Un identico profilo d'espressione si osserva in embrioni di rospo, pollo (Bally-Cuif et al., 1995) e pesce zebra. Un'analisi dettagliata di questi sistemi mostra che Otx2 è espresso all'inizio nelle cellule del mesendoderma assiale che si invagina e, più precisamente, nella sua parte anteriore, detta placca precordale, che soggiace al cervello rostrale presuntivo. Più o meno nel periodo nel quale la piastra neurale viene indotta e si compiono i primi passi della sua regionalizzazione, i prodotti genici di Otx2 si estendono alle cellule del neuroectoderma sovrastante e partecipano presumibilmente alla specificazione del cervello rostrale. Questa ipotesi ha trovato recentemente supporto nell'analisi delle manipolazioni genetiche nel topo, nel rospo e nel pollo (Bally-Cuif et al., 1995).
Topi transgenici portanti mutazioni nulle di Otx2 cessano di svilupparsi a metà gestazione perché non riescono a portare a termine la gastrulazione in maniera appropriata. In questi embrioni, inoltre, mancano completamente le regioni del cervello rostrale anteriori al 3° rombomero. È molto probabile che la delezione delle strutture cerebrali anteriori sia da imputare a una formazione difettosa del mesoendoderma assiale anteriore o a una difettosa migrazione delle cellule corrispondenti.
Ancora più interessante è ciò che si osserva negli embrioni precoci di rospo, facilmente manipolabili e nei quali è relativamente semplice modulare l'espressione di un dato gene, regolandola sia verso l'alto sia verso il basso. Riducendo il livello d'espressione di Otx2 negli embrioni precoci, si ottengono embrioni privi di cervello rostrale, mentre tutte le altre strutture del sistema nervoso centrale restano intatte, come anche la notocorda e i somiti. Una sovraespressione di Otx2 comporta, invece, un'espansione della regione del cervello e della testa a danno delle strutture del tronco e della coda. In conclusione, si può ipotizzare un ruolo primario del gene Otx2 nella determinazione precoce del cervello rostrale. Recentemente è stato dimostrato un ruolo simile per il gene Lim-l, un omeogene appartenente a un'altra famiglia genica, quella degli omeogeni LIM. Anche i topi transgenici mancanti di una copia funzionale di questo gene non arrivano a compiere la gastrulazione e mancano completamente di strutture cerebrali anteriori al 3° rombomero.
Espressione dei geni OTX in territori e confini del cervello embrionale
In embrioni di topo a metà gestazione i geni Otxl e Otx2 sono espressi in specifiche regioni del cervello in via di sviluppo (Simeone et al., 1993). Entrambi sono espressi nel telencefalo basale, nel diencefalo e nel mesencefalo ma non nel midollo spinale. Il loro dominio d'espressione nel mesencefalo mostra un netto bordo posteriore a livello dell'istmo rombico e, a partire dal periodo E9,25, l'espressione di questi due geni demarca il bordo posteriore del mesencefalo.
A questo stadio, Otxl e Otx2 sono espressi anche in certe regioni del diencefalo e del mesencefalo ed è interessante notare come questa espressione coincida con regioni di confine fra aree anatomo- funzionali e con tratti assonici presuntivi, comprese la commissura anteriore e quella posteriore. Questa espressione è ristretta a cellule che circondano transitoriamente tali strutture, come se queste cellule potessero essere utilizzate quale guida per il cammino degli assoni cosiddetti 'pionieri'. Ciò è particolarmente evidente nella commissura posteriore e lungo la zona limitans intrathalamica, il precursore della lamina medullaris externa e del tratto mammillo-talamico che si trova al confine fra il talamo dorsale e il talamo ventrale. L'espressione dei geni OTX nella commissura posteriore è limitata alle cellule del neuroepitelio ventricolare, mentre le fibre primarie che corrono sulla sua superficie non sono marcate. L'espressione dei geni OTX lungo la zona limitans intrathalamica, che consiste in una striscia d'ibridazione che consta di due segnali paralleli separati da una linea di cellule negative, potrebbe costituire una base di riferimento per la localizzazione degli assoni della lamina medullaris e delle altre strutture che separano fisicamente il talamo dorsale dal talamo ventrale. Entrambi i geni OTX sono anche espressi tutt'intorno al nervo ottico in via di sviluppo. Questa localizzazione è simile a quella lungo la zona limitans intrathalamica. Entrambe le localizzazioni suggeriscono che l'espressione di questo gene potrebbe fornire indicazioni per il posizionamento e la strutturazione dei fasci assonali. In questa ottica, l'espressione dei geni OTX potrebbe fornire una struttura di sostegno alla rete delle vie assonali primarie nel primo epitelio del prosencefalo. Con lo studio di questi geni e di altri che vengono identificati in continuazione sia nei vertebrati sia negli invertebrati, si può cominciare ad affrontare un altro dei problemi fondamentali della neurobiologia dello sviluppo, quello dei meccanismi cellulari e molecolari che guidano e assistono gli assoni in via di sviluppo nella ricerca della via più appropriata verso il loro bersaglio. È istruttivo considerare la possibilità che i geni OTX giochino ruoli diversi in due stadi diversi dello sviluppo del cervello. In un primo momento questi geni sembrano specificare aree e territori all'interno del cervello rostrale dell' embrione precoce, mentre più tardi sembrano fornire una serie di coordinate affrnché la crescita assonale segua cammini specifici e preordinati nel cervello embrionale. Non è chiaro se le due funzioni siano indipendenti o siano invece l'una la conseguenza dell'altra. È anche interessante considerare che, nelle drosofile mutanti per il gene orthodenticle, gli assoni pionieri della cosiddetta commissura posteriore di ognuno dei segmenti che costituiscono la loro corda nervosa non sono in grado di estendersi normalmente, come se fossero venute a mancare specifiche informazioni posizionali.
Espressione dei geni EMX e OTX nella corteccia cerebrale in via di sviluppo
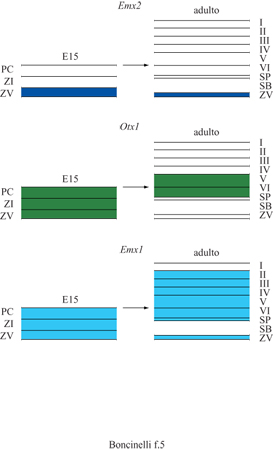
Tutti e quattro i geni EMX e OTX sono espressi nella corteccia cerebrale del topo in via di sviluppo nel periodo di gestazione compreso fra E9,5 e E10,5 (Simeone et al., 1992a). A partire da E10,75 l'espressione di Otx2 scompare progressivamente da questa regione, con un processo abbastanza veloce che inizia nelle regioni centrali dei due emisferi cerebrali per poi irradiarsi verso la periferia degli stessi. L'espressione di Otx2 persiste nei plessi corioidei, nel setto e in alcune regioni dell'eminenza ganglionare, che darà luogo ai futuri gangli della base. Il ritrarsi dei prodotti genici di questo gene dalla regione della corteccia cerebrale sembra suggerire che questa può svilupparsi e acquisire la sua identità solo in loro assenza. l geni Emxl, Emx2 e Otxl sono invece espressi nella regione della corteccia embrionale presuntiva per un periodo di tempo abbastanza esteso, durante il quale hanno luogo eventi fondamentali della neurogenesi corticale. Nella sua estensione massima, raggiunta nel periodo fra E12,5 ed E13,5, il dominio d'espressione di Emxl comprende le regioni corticali corrispondenti al neopallio e a una parte dell' archipallio ippocampale e paraippocampale. L' espressione di Emxl sembra quindi caratterizzare regioni corticali prevalentemente, ma non esclusivamente, esalaminari. Durante lo stesso periodo il dominio d'espressione di Emx2 comprende regioni corticali presuntive che includono il neopallio, l'archipallio ippocampale e paraippocampale, nonché alcune localizzazioni nel paleopallio, ma non i gangli della base. A partire da El4,5 l'espressione corticale di Emx2 declina progressivamente nelle regioni anteriori e ventrolaterali e a E l 7 appare esclusivamente confinata a regioni specifiche dell'ippocampo. Otxl dal canto suo è espresso nell'intero prosencefalo e il suo dominio d'espressione contiene il telencefalo dorsale ma si estende anche ai gangli della base (Simeone et al., 1993; Gulisano et al., 1996). È interessante considerare il profilo temporale dell' espressione dei geni EMX e Otxl nelle diverse zone della corteccia cerebrale in via di sviluppo (Gulisano et al., 1996). Nella corteccia si possono distinguere almeno tre zone, dalla più interna alla più esterna: il neuroepitelio germinativo o zona ventricolare (ZV), dove i neuroblasti corticali proliferano, un cosiddetto campo transizionale e, infine, la placca corticale (PC) dalla quale prenderà origine la materia grigia vera e propria, con i suoi caratteristici sei strati. Nelle fasi iniziali, e fino a 12,5 giorni di età embrionale, il neuroepitelio germinativo costituisce l'unico componente della parete telencefalica. Dopo questo stadio compare un campo transizionale che comprende una zona subventricolare, la cui natura è ancora poco conosciuta, e una zona intermedia (Zl) dove traslocano i neuroni corticali che hanno smesso di proliferare e cominciano a differenziarsi prima di migrare verso le regioni più esterne. Con il procedere dello sviluppo aumenta progressivamente lo spessore della placca corticale e sia quest'ultima sia il campo transizionale si espandono a spese del neuroepitelio, che si riduce secondo una specifica sequenza spaziale e temporale. Questa sequenza si conforma a due gradienti principali, che procedono uno dal davanti all'indietro e uno dalle regioni ventrolaterali a quelle dorsomediali degli emisferi. Alla fine di tutti questi processi la zona intermedia darà luogo alla cosiddetta sostanza bianca, mentre la placca corticale darà luogo alla materia grigia, cioè alla corteccia vera e propria. Qui si vengono poi a formare i vari strati con una precisa sequenza spazio-temporale detta talvolta insideout: i neuroni destinati a occupare gli strati più profondi della corteccia, cioè il quinto e il sesto, nascono per primi, mentre i neuroni usciti dal ciclo replicativo in ondate successive vanno a occupare gli strati via via più esterni, scavalcando i primi arrivati. Negli embrioni di topo di tutti gli stadi, l'espressione di Emx2 (fig. 5) coincide con i neuroblasti proliferanti del neuroepitelio germinativo (Gulisano et al., 1996). In embrioni nella fase gestazionale El2,5 i trascritti di Emx2 sono distribuiti uniformemente su tutta la corteccia in via di sviluppo ma, a partire da El3,5, appaiono confinati nel neuroepitelio germinativo della zona ventricolare, mentre sono chiaramente assenti nel campo transizionaIe e nella placca corticale. A partire dal quattordicesimo giorno e mezzo di gestazione, l'espressione corticale di Emx2 declina progressivamente nelle regioni anteriori e ventrolaterali per relegarsi a specifici strati cellulari dell'ippocampo e ridursi infine a uno strato sottilissimo nella regione ependimale della corteccia alla fine della gestazione. Si deve notare, però, che la sua espressione non scompare mai del tutto, nemmeno durante la vita adulta. Questi dati, insieme con altri risultati sperimentali, hanno condotto recentemente alla convinzione che anche nella corteccia adulta esista una piccola popolazione di cellule staminali capaci di rinnovarsi e di differenziarsi. Questa popolazione cellulare si trova nello strato ependimale, a stretto contatto con i ventri coli cerebrali, ed è probabilmente destinata a fornire sempre nuove cellule per lo strato granulare dei bulbi olfattivi. Qualunque sia la destinazione naturale di queste cellule, è abbastanza ovvia la loro potenziale utilità per eventuali operazioni di ricolonizzazione di distretti del cervello adulto danneggiati a seguito di insulti di varia natura.
In conclusione, si può immaginare che Emx2 giochi un ruolo specifico nel controllo di alcuni parametri inerenti alla proliferazione dei neuroblasti corticali o nella regolazione della loro successiva migrazione, oppure in entrambi. Abbiamo visto, infatti, che i neuroni della corteccia raggiungono la loro destinazione fmale nei vari strati della corteccia cerebrale matura a seconda dei loro tempi di nascita.
Otxl, invece, è espresso nella zona ventricolare e più marcatamente nei precursori di quei neuroni che andranno successivamente a costituire gli strati più profondi della corteccia (v. figura 5). Nella corteccia cerebrale adulta Otxl è infine espresso in una sottopopolazione di neuroni dello strato 5 e in quasi tutti i neuroni dello strato 6 (Gulisano et al., 1996). Al contrario, Emxl è espresso in tutti i neuroni corticali (v. figura 5), siano essi proliferanti, migranti, in via di differenziarsi o differenziati e funzionanti nel contesto di una corteccia cerebrale matura (Gulisano et al., 1996). D'altra parte, nessuna espressione di Emxl è rintracciabile nelle regioni ventrali del prosencefalo o nei gangli della base in vari stadi del loro sviluppo; tutto ciò porta a credere che Emxl possa essere coinvolto esclusivamente nella definizione dell'identità delle cellule proprie della corteccia cerebrale.
L'espressione dei geni EMX nella corteccia in via di sviluppo è stata oggetto di numerosi studi (Gulisano et al., 1996). La corteccia cerebrale adulta è suddivisa in un certo numero di aree funzionali che raggiungono la loro massima significatività nell'uomo, ma sulla cui determinazione si sa molto poco. A questo proposito sono state avanzate due teorie principali. Secondo la prima, questa suddivisione è specificata in gran parte su base genetica. Una 'protomappa' delle future aree funzionali esisterebbe già in epoche di sviluppo molto precoci, forse custodita nelle cellule della cosiddetta subplate (SP). Questa suddivisione potenziale si trasferirebbe poi punto per punto alle cellule della corteccia attraverso la migrazione dei neuroni corti cali verso gli strati esterni, lungo la cosiddetta glia radiale. Secondo l'altra teoria, le aree funzionali della corteccia non sono determinate, almeno nel dettaglio, prima dell'arrivo delle proiezioni neurali dalle aree subcorticali, primo fra tutti il talamo. Sarebbero quindi queste proiezioni e le corrispondenti connessioni neuronali a determinare la natura e i confini delle varie aree corticali definitive.
È interessante notare a questo proposito che l'espressione di Emx2 nella zona ventri colare di un embrione di topo a metà gestazione segue un gradiente d'intensità antero-posteriore, con valori più alti nella regione occipitale e valori più bassi verso la regione frontale. Questo gradiente d'espressione di Emx2 potrebbe implicare un contributo dei prodotti di Emx2 alla determinazione di una polarizzazione della corteccia, nel quadro di una specificazione precoce della suddivisione in aree della corteccia stessa. In quanto gene regolatore che codifica un fattore trascrizionale, Emx2 si presenta come un candidato ideale per svolgere il ruolo di generare, come anche di mantenere, segnali posizionali all'interno della corteccia. Emxl, a sua volta, è espresso anche nella subplate, che rappresenta uno strato di neuroni generati abbastanza precocemente e che si trova proprio sotto la placca corticale. I neuroni di questa struttura ricevono segnali sinaptici dagli assoni talamici afferenti e li proiettano a loro volta verso la placca corticale. Alcuni esperimenti sembrano suggerire che la subplate mostri alcune caratteristiche fondamentali dell'organizzazione in aree corticali che poi proietta sui vari strati della corteccia cerebrale adulta. È possibile pensare che i prodotti genici di Emxl giochino un ruolo chiave in alcuni di questi processi.
Risultati dell'analisi funzionale
Attualmente, sono disponibili solo dati preliminari riguardo i fenotipi dei topi portanti mutazioni nulle dei quattro geni. Abbiamo visto che la mancanza di Otx2 in topi transgenici determina mortalità embrionale precoce e che tali topi non hanno fornito informazioni utili per comprendere il ruolo di questo gene nello sviluppo definitivo del cervello. Al contrario, topi transgenici privi dei prodotti dei geni Otxl, Emxl ed Emx2 arrivano a nascere e il loro cervello può essere analizzato. Tutti mostrano disturbi abbastanza rilevanti nell'architettura di varie regioni cerebrali, inclusa la corteccia. Particolarmente notevole è la completa assenza del giro dentato in mutanti nulli di Emx2 (Pellegrini et al., 1996). L'analisi dei topi mancanti del gene Emx2 sta inoltre fornendo preziose indicazioni su come i neuroni della corteccia si organizzino nei sei strati specifici di questa struttura. Si può quindi senz'altro anticipare che uno studio dettagliato di tutti questi mutanti porterà un certo numero di informazioni utili sul ruolo di questi geni, anche se richiederà sicuramente non poco tempo a causa della complessità della struttura e del funzionamento della corteccia cerebrale stessa.
Nel frattempo è stata riportata l'individuazione di mutazioni nel gene umano Emx2 in casi sporadici di schizoencefalia, un disturbo congenito della corteccia cerebrale (Brunelli et al., 1996). Questo raro disordine ereditario umano è caratterizzato da una fissurazione degli emisferi cerebrali, che presentano larghe porzioni mancanti riempite da fluido cerebro-spinale (fig. 6). Le fissurazioni presenti in questa malformazione sono caratterizzate da un rivestimento di corteccia con deficiente sviluppo delle circonvoluzioni cerebrali (polimicrogiria) che si estende fino al ventricolo; infatti, la pia corticale e l' ependima ventri colare sono fusi all'interno della fissurazione. I segni clinici associati a questa malformazione possono variare considerevolmente a seconda delle dimensioni e della localizzazione delle regioni mancanti e dell' entità della separazione dei lembi della fissurazione. Nei casi più lievi i lembi sono fusi e i pazienti si presentano quasi normali, anche se possono andare soggetti a episodi epilettici e a spasticità. In casi più severi ci si trova in presenza di ampie lacune nella materia grigia emisferica, lacune riempite di fluido e con evidente polimicrogiria. Pazienti di questo tipo possono mostrare ritardo mentale anche grave, epilessia, ipotonia, spasticità, incapacità di camminare o parlare e cecità. La presenza di mutazioni a carico di Emx2 in casi di schizoencefalia offre un valido sostegno all'ipotesi di un coinvolgimento dei prodotti di questo gene nella formazione della corteccia cerebrale umana. Non è chiaro se il difetto corticale presente nella schizoencefalia sia da attribuire a problemi di proliferazione o di migrazione dei neuroni corticali. In entrambi i casi però è molto ragionevole pensare che il gene implicato sia Emx2, in quanto essendo espresso nei neuroblasti corticali proliferanti potrebbe controllame sia l'entità della proliferazione sia la successiva migrazione.
I geni EMX e OTX rappresentano, per questo motivo, dei preziosi strumenti per lo studio dello sviluppo del cervello, in particolare della corteccia cerebrale. I loro profili d'espressione ci permettono di seguire da vicino gli eventi fondamentali della neurogenesi della corteccia e della sua susseguente maturazione. È anche concepibile che mutazioni a carico di questi geni, o di alcuni dei loro geni bersaglio, possano essere alla base di un certo numero di disordini cerebrali umani e in particolare di displasie corticali derivanti da alterazioni nello sviluppo corticale. Sembra perciò utile studiare la possibile implicazione di mutazioni in uno di questi geni in entità patologiche specifiche, quali le varie forme di eterotopia della materia grigia. Ne sono esempio la lissencefalia (presenza di emisferi cerebrali con superficie liscia o con solchi appena accennati), l'agiria (corteccia cerebrale priva di alcune circonvoluzioni), la pachigiria o macrogiria (esagerata ampiezza e spessore delle circonvoluzioni) e la stessa polimicrogiria. Tutti questi disordini congeniti sono caratterizzati da difetti nell'architettura della corteccia con presenza di neuroni normali o displastici in posizioni aberranti che instaurano, perciò, anche connessioni abnormi, ma della maggior parte di essi non è nota l' eziopato genesi. Episodi epilettici sono presenti nella schizoencefalia e nella maggior parte delle displasie corticali. È molto probabile, anzi, che ogni difetto di una certa consistenza nello sviluppo della corteccia cerebrale possa risultare in una qualche forma di epilessia. L'identificazione di geni responsabili dell'epilessia, che avrebbe ovviamente profonde implicazioni sia per la terapia che per la comprensione della fisiologia cerebrale, non si è dimostrata un compito facile. Nonostante esistano forti indizi dell'esistenza di fattori ereditari coinvolti nell' epilessia, questo disturbo sembra intrinsecamente molto eterogeneo sia dal punto di vista fenotipico sia da quello genetico. Sarà quindi molto interessante investigare la struttura e l'espressione di geni di questo tipo in pazienti affetti da patologie del genere. I risultati di questa analisi saranno probabilmente interessanti sia in sé che per la comprensione degli elementi che costituiscono la componente genetica dei difetti multifattoriali dell'encefalo.
Implicazioni filogenetiche
È interessante considerare un possibile aspetto evolutivo dell'azione di Emx2 o di geni di questo tipo. Si ritiene oggi che molti processi evolutivi siano spiegabili in termini di un'alterata regolazione dell'espressione di alcuni geni, piuttosto che con la comparsa sulla scena biologica di geni completamente nuovi. Questa convinzione nasce da diverse motivazioni. In primo luogo, i geni sono più o meno gli stessi in tutte le specie. In secondo luogo, non vi è stato tempo sufficiente alla creazione di geni completamente nuovi: il cervello si è formato e si è perfezionato in così poco tempo che i geni implicati sono rimasti quasi certamente gli stessi. Quello che può essere avvenuto è da una parte il reimpiego dello stesso gene per generare nuovi prodotti in grado di compiere nuove funzioni e dall' altra un cambiamento nella regolazione, temporale o spaziale, dell' espressione di geni già esistenti.
Un caso particolare da considerare è la possibilità che un gene che controlla la proliferazione dei neuroblasti corticali si inattivi in una nuova specie con un certo ritardo rispetto a una specie già esistente. Si può allora ipotizzare che questa nuova specie avrebbe più neuroni corticali della precedente e conseguentemente una corteccia più ricca di cellule. Questo fatto di per sé non vorrebbe dire che l'animale avrebbe una capacità mentale superiore, ma certamente potrebbe costituire un primo passo in questa direzione. Se nello stesso tempo un certo numero di geni, ed è difficile dire quanti, cambiassero alcune loro caratteristiche, si potrebbe cominciare a pensare a un vero cambiamento evolutivo. Per ora questa non è niente più che un'ipotesi, ma si comincia a pensare di poter arrivare per questa via a comprendere qualcosa di questi fondamentali processi.
Emx2 è un gene molto antico, presente in tutti i vertebrati che sono stati analizzati, a partire dalla lampreda. È concepibile che una piccola alterazione nella sua regolazione abbia conseguenze rilevanti sulla formazione o sulla struttura della corteccia. Ed Emxl? Tutto lascia pensare che Emxl si sia originato da Emx2 con il consueto meccanismo di duplicazione e successiva differenziazione. Si può immaginare, cioè, che Emx2 si sia duplicato e che una delle due copie del gene abbia continuato a svolgere la sua funzione mentre l'altra, per così dire libera da impegni, abbia cominciato ad accumulare mutazioni e si sia progressivamente differenziata fino ad assumere i caratteri che oggi sono appannaggio di Emxl.
Si sa ancora molto poco della funzione di Emxl, ma si intuisce che il suo ruolo possa essere ancora più specifico di quello di Emx2. Emxl infatti è attivo nei neuroni della corteccia cerebrale in ogni momento della loro vita, prima in quelli che si stanno replicando, poi in quelli che stanno migrando e differenziandosi e infine in quelli che sono già differenziati e funzionanti. A tutti gli effetti Emxl è il gene della corteccia. Riesce veramente difficile immaginare quale ruolo possa esercitare lo stesso gene in cellule che si trovano in fasi così diverse della loro vita. È interessante notare a questo proposito che Emxl è stato identificato nelle cellule di tutti i vertebrati terrestri e in quelle specie di pesci con i quali si presume che condividiamo un antenato, cioè nei pesci polmonati e nel famoso celacanto, ma non nei pesci di tutte le altre specie. Viene la tentazione di speculare che tali pesci non si siano sviluppati intellettualmente come gli altri vertebrati perché non hanno avuto questo gene, il cui possesso potrebbe aver fornito, invece, a quei pochi pesci che lo avevano la duttilità e l'intraprendenza necessarie per lasciare il mare e invadere le terre emerse, così da dare poi luogo alle innumerevoli schiere di vertebrati terrestri da cui si sono originati i mammiferi e gli stessi esseri umani.
Altri geni
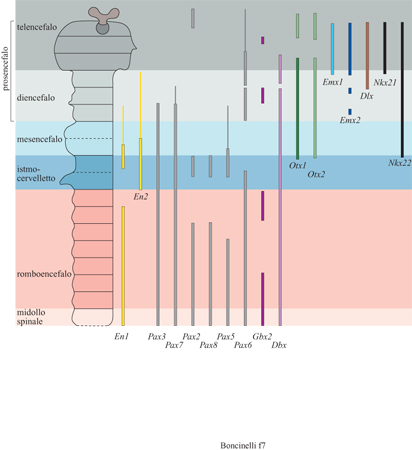
Abbiamo parlato in maniera approfondita degli omeogeni EMX e OTX perché essi ci permettevano di seguire un filo conduttore e di raccontare una storia di senso quasi compiuto. Questi non sono però ovviamente gli unici geni regolatori espressi nel cervello in via di sviluppo, anche se per ora sono gli unici che sono espressi esclusivamente in questa struttura. Se ne conoscono in realtà molti altri (fig. 7) appartenenti a varie famiglie geni che e identificati in questi ultimi anni utilizzando le strategie più diverse (Rubenstein et al., 1994; Shimamura et al., 1995). Si tratta di omeogeni appartenenti alle famiglie P AX, DLX, POU, EN, NKX, MSX, DBX, GBX, GTX e LIM; di altri geni regolatori quali BF e HNF; di geni codificanti fattori di crescita come FGF, WNT o HH o infine di geni di attribuzione ancora incerta. Di alcuni di questi si comincia a capire qualcosa. Abbiamo già visto, per esempio, che l'azione di Lim-l è richiesta per il completamento della gastrulazione e per l'induzione del cervello. L'azione di un altro gene regolatore, BF-l, è richiesta per la crescita della regione ventrale del telencefalo corrispondente ai gangli della base. I prodotti di questo gene sono presenti nei neuroblasti proliferanti della corteccia cerebrale, esattamente come Emx2, ma anche nei neuroblasti proliferanti del telencefalo ventrale. La loro assenza influenza però soltanto la crescita cellulare nel telencefalo ventrale e non nella corteccia. Di molti altri geni non si conosce per il momento il ruolo specifico, ma è chiaro che presto il quadro si comporrà e avremo a disposizione un certo numero di strumenti fondamentali per capire la genesi e la regionalizzazione del sistema nervoso centrale in generale e del cervello in particolare.
Un discorso a parte merita la genesi della regione mesmetencefalica, dalla quale derivano strutture adulte quali i collicoli del tetto mesencefalico, il cosiddetto tegmento, l'istmo e il cervelletto. Abbiamo già visto che si tratta di una regione particolare che si sviluppa come un'unità relativamente autonoma con un certo ritardo rispetto ad altre regioni del cervello e che probabilmente si è evoluta un po' più recentemente di queste. Il cervelletto, che rappresenta la struttura più cospicua che si forma da questa regione, è composto da cellule che derivano dal 1° rombomero e da cellule che derivano dalla parte posteriore del mesencefalo. Questa sua caratteristica pone il problema dei geni che ne regolano lo sviluppo e dei principi morfogenetici che operano in questa regione. Nel corso degli anni Novanta si è appreso abbastanza su entrambi i fronti (Bally-Cuif e Wassef, 1995; Joyner, 1996). Per il corretto sviluppo della regione mes-metencefalica è richiesta l'azione di un certo numero di geni. Oltre a Otx2 hanno in questa regione un ruolo specifico almeno altri sei geni: Enl, En2, Wntl, Pax2, Pax5 e Pax8 (Joyner, 1996).
Durante lo sviluppo embrionale i prodotti di questi geni sono presenti in domini parzialmente sovrapposti che interessano questa regione e la loro assenza comporta una delezione totale della intera regione. Tra questi geni si è stabilita anche una gerarchia, con i geni della famiglia PAX a preparare la strada per la successiva espressione dei geni EN e WNT. Il primo gene a essere attivo in questa regione è Pax2, cui fanno seguito Enl e Wntl, un po' più tardi Pax5 ed En2 e infine Pax8.
Esperimenti di trapianto di frammenti di questa regione fra embrioni precoci di pollo suggeriscono un suo ruolo come regione organizzatrice, capace non solo di autoorganizzarsi ma anche di reclutare cellule dai tessuti circostanti, cambiame la destinazione biologica e indurle a partecipare alla formazione di strutture adulte tipiche di questa regione (Bally-Cuif e Wassef, 1995). Tra le molecole che agiscono come induttori in questo processo di organizzazione o di riorganizzazione figurano certamente i fattori di crescita Wntl e Fgf8.
La formazione e la regionalizzazione del cervelletto si risolvono quindi in una continua e ordinata interazione tra fattori di crescita e fattori di trascrizione. È immediato osservare che in questa dialettica tra fattori di crescita e fattori trascrizionali risiede tutto il segreto della morfogenesi in generale e della formazione del cervello in particolare.
Bibliografia citata
BALLY-CUlF, L., BONCINELLI, E. (1997) Transcription factors and head formation in vertebrates. Bioessays, 19, 127-135.
BALLY-CUlF, L., GULISANO, M., BROCCOLI, V., BONCINELLI, E. (1995) c-otx2 is expressed in two different phases of gastrulation and is sensitive to retinoic acid treatment in chick embryo. Mech. Dev., 49, 49-63.
BALLY -CUlF, L., W ASSEF, M. (1995) Determination events in the nervous system of the vertebrate embryo. Curr. Opin. Genet. Dev., 5, 450-458.
BATESON, W. (1894) Materials for the study of variation. Londra, Macmillan.
BRUNELLI, S., FAIELLA, A., CAPRA, V., NIGRO, V., SIMEONE, A., CAMA, A., BONCINELLI, E. (1996) Germline mutations in the homeobox gene EMX2 in patients with severe schizencephaly. Nat. Genet., 12, 94-96.
FINKELSTEIN, R., BONCINELLI, E. (1994) From fly head to mammalian forebrain: the story of otd and Otx. Trends Genet., 10, 310-315.
GULISANO, M., BROCCOLI, V., PARDINI, C., BONCINELLI, E. (1996) Emxl and Emx2 show different pattems of expression during proliferation and differentiation of the developing cerebral cortex in the mouse. Eur. J. Neurosci., 8, 1037-1050.
JOYNER, A.L. (1996) Engrailed, Wnt and Pax genes regulate midbrain-hindbrain development. Trends Genet., 12, 15-20.
KRUMLAUF, R. (1994) Hox genes in vertebrate development. CelI, 78, 191-201.
LAWRENCE, P.A. (1992) The making of a fly: the genetics of animaI design. Cambridge, Mass., Blackwell Science.
LEWIS, E.B. (1964) In The chromosomes in development, a c. di Locke M., New York, Academic Press.
LEWIS, E.B. (1978) A gene complex controlling segmentation in Drosophila. Nature, 276, 565-570.
MCGINNIS, W., KRUMLAUF, R. (1992) Homeobox genes and axial patteming. CelI, 68, 283-302.
MALLAMACI, A., DI BLAS, E., BRIATA, P., BONCINELLI, E., CORTE, G. (1996) OTX2 homeoprotein in the developing centraI nervous system and migratory cells of the olfactory area. Mech. Dev., 58,165-178.
PELLEGRINI, M., MANSOURI, A., SIMEONE, A., BONCINELLI, E., GRUSS, P. (1996) Dentate gyrus formation requires Emx2. Development, 122, 3893-3898.
RUBENSTEIN, J.L., MARTINEZ, S., SHIMAMURA, K., PUELLES, L. (1994) The embryonic vertebrate forebrain: the prosomeric model. Science, 266, 578-580.
SHIMAMURA, K., HARTIGAN, D.J., MARTINEZ, S., PUELLES, L., RUBENSTEIN, J.L. (1995) Longitudinal organization of the anterior neural plate and neural tube. Development, 121, 3923-3933.
SIMEONE, A., ACAMPORA, D., GULISANO, M., STORNAIUOLO, A., BONCINELLI, E. (1992a) Nested expression domains of four homeobox genes in developing rostral brain. Nature, 358, 687-690.
SIMEONE, A., ACAMPORA, D., MALLAMACI, A., STORNAIUOLO, A., D'APICE, M. R., NIGRO, V., BONCINELLI, E. (1993) A vertebrate gene related to orthodenticle contains a homeodomain of the bicoid class and demarcates anterior neuroectoderm in the gastrulating mouse embryo. EMBO J., 12, 2735-2747.
SIMEONE, A., GULISANO, M., ACAMPORA, D., STORNAIUOLO, A., RAMBALDI, M., BONCINELLI, E. (1992b) Two vertebrate homeobox genes related to the Drosophila empty spiracles gene are expressed in the embryonic cerebral cortex. EMBO J., Il, 2541-2550.
Bibliografia generale
BAYER, S.A., ALTMAN, J. Neocortical development. New York, Raven Press, 1991.
BONCINELLI, E. Biologia dello sviluppo: dalla cellula all'organismo. Roma, La Nuova Italia Scientifica, 1994.
BONCINELLI, E. I nostri geni. Torino, Einaudi, 1998.
CHANGEUX, J.-P. L'uomo neuronale. Milano, Feltrinelli, 1993.
KANDEL, E.R., SCHWARTZ, J.H., JESSEL, T.M. Principles of neural science, 3a ed., New York, Elsevier, 1991