allodinia
allodinia
Dolore suscitato da uno stimolo che normalmente non è in grado di provocare una sensazione dolorosa (definizione dell’Associazione internazionale per lo studio del dolore, International Association for the Study of Pain, IASP 1994). L’a. consiste, quindi, in una falsa identificazione dello stimolo, nel senso che lo stimolo (non algogeno) e la risposta (dolore) hanno qualità differente: è importante in questo contesto sottolineare la distinzione tra a. e iperalgesia (➔). L’a. può essere riscontrata sia nel dolore tessutale che in quello neuropatico. Topograficamente, si può avere: a. superficiale, evocata e avvertita sulla cute e le mucose (per es., il semplice sfioramento della cute danneggiata può provocare dolore); a. profonda, evocata e avvertita nei tessuti profondi somatici e viscerali (per es., il dolore causato dalla palpazione di un viscere). L’a. superficiale può essere a sua volta classificata in a. meccanica, prodotta da stimoli meccanici non nocicettivi, e in a. termica, provocata da stimoli termici normalmente non nocicettivi.
Basi neurofisiologiche
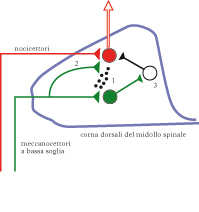
Le cause neurologiche dell’a. sono tuttora oggetto di dibattito e ricerca. Per quanto riguarda l’a. meccanica, per es., il problema è come l’attività dei meccanocettori possa influenzare la via dolorifica. Le vie attivate da meccanorecettori e nocicettori (➔) appaiono largamente distinte a livello anatomico: infatti i segnali meccanocettivi vengono trasportati principalmente da fibre afferenti mielinizzate e di grosso diametro (dette fibre Aβ), mentre le fibre nocicettive sono tipicamente mielinizzate e di basso diametro (fibre Aδ) o non mielinizzate (fibre C). Queste due popolazioni di fibre effettuano contatti sinaptici su cellule in lamine distinte delle corna dorsali nel midollo spinale; collaterali delle fibre Aβ ascendono nel midollo spinale ipsilaterale fino al tronco encefalico. Inoltre, la sensazione del tatto è trasferita all’encefalo mediante il sistema delle colonne dorsali e del lemnisco mediale, una via che si incrocia a livello del tronco encefalico; gli stimoli dolorosi sono invece trasferiti centralmente per mezzo del sistema anterolaterale, che si incrocia all’interno del midollo spinale. Esistono dati sperimentali su modelli animali di dolore neuropatico o di dolore infiammatorio, che suggeriscono come l’interazione tra stimoli meccanici e dolorifici, responsabile dell’a. meccanica, possa aver luogo a livello di corna dorsali del midollo spinale; in partic., è stato osservato che, a seguito di un fenomeno infiammatorio, le fibre Aβ possono attivare la sintesi di un neuropeptide denominato sostanza P, normalmente espresso nelle sole fibre C. La sostanza P sarebbe rilasciata dalle fibre Aβ a livello delle corna dorsali del midollo spinale, dove potrebbe diffondere e attivare la via dolorifica. In questo caso il fenomeno infiammatorio indurrebbe un cambiamento fenotipico delle fibre Aβ, capace di stimolare la sensibilità dolorifica. Un secondo possibile meccanismo per l’a. meccanica è la modificazione del territorio di innervazione (sprouting) delle fibre mieliniche nelle corna dorsali. In alcuni modelli di dolore neuropatico è stato osservato per es. che le fibre Aβ sono in grado di colonizzare la lamina II delle corna dorsali, la quale è normalmente innervata dalle sole fibre C. Questa modificazione plastica potrebbe quindi indurre una attivazione diretta di vie dolorifiche da parte dei meccanorecettori. Un altro possibile meccanismo per giustificare un accesso dei meccanorecettori alla via del dolore, e la conseguente comparsa di a. meccanica, è l’attivazione di una via polisinaptica (normalmente silente o sotto soglia) tra le cellule delle lamine profonde delle corna dorsali (normalmente innervate dalle fibre Aβ) e le cellule delle lamine superficiali (su cui convergono i nocicettori). Infatti, mentre in animali normali la stimolazione delle fibre Aβ induce l’attivazione di un numero ridotto di cellule nelle lamine superficiali del midollo spinale, in modelli animali di dolore neuropatico si ha una cospicua attivazione neuronale nelle lamine I-II. Quindi, lo ‘smascheramento’ funzionale di connessioni tra neuroni all’interno delle corna dorsali potrebbe consentire a segnali portati dalle fibre Aβ di attivare la via dolorifica. In questi processi di smascheramento, un ruolo importante potrebbe essere giocato dalla riduzione dell’attività inibitoria di interneuroni GABAergici o glicinergici.