ambiente e cervello
ambiente e cervello
In parallelo all’azione dei geni, l’ambiente in cui l’individuo si sviluppa e dal quale riceve gli stimoli sensoriali nel corso della vita ha un’influenza notevole sul cervello e, di conseguenza, sul comportamento. Nelle fasi precoci di sviluppo l’esperienza ambientale guida la maturazione delle connessioni tra i neuroni, regolando i processi che portano al cablaggio fine dei circuiti nervosi, con effetti marcati sull’anatomia e la fisiologia del cervello. Un’alterata o ridotta esperienza sensoriale può causare deficit funzionali, come nell’esempio paradigmatico del mancato sviluppo di una visione normale in soggetti con strabismo o cataratta congenita. Viceversa, un’aumentata stimolazione sensoriale e motoria (arricchimento ambientale) promuove la maturazione dei circuiti nervosi, che completano i programmi di sviluppo in tempi più brevi. Nell’adulto, una vita ricca di stimoli ha un ruolo essenziale per la corretta funzionalità cerebrale, guidando il rimodellamento dei circuiti neuronali in risposta ai cambiamenti ambientali (plasticità cerebrale) e contribuendo a conservare l’integrità anatomofunzionale del cervello durante gli anni del decadimento fisiologico che si verifica con l’invecchiamento. [➔ apprendimento; cervello, sviluppo del; evoluzione culturale; invecchiamento cerebrale; plasticità neurale; visione]. Geni e ambiente agiscono di concerto nella costruzione dell’architettura del sistema nervoso centrale. Nell’uomo, lo studio dei tratti comportamentali dei gemelli è uno strumento molto potente per indagare le basi biologiche dell’individualità. Studi di questo tipo mostrano un contributo sia genetico sia ambientale nella formazione della personalità. Da una parte, i geni si rivelano responsabili delle differenze tra gemelli non identici (dizigoti) che hanno condiviso lo stesso ambiente durante lo sviluppo. Dall’altra, differenze di personalità presenti in coppie di gemelli monozigoti (geneticamente identici) separati in tenera età e cresciuti in ambienti differenti mostrano come l’esperienza possa incidere sui tratti comportamentali di individui che condividono lo stesso repertorio genetico. L’influenza combinata di geni e ambiente risulta evidente altresì nella regolazione della patogenesi di malattie psichiatriche, quali la schizofrenia. Mentre i gemelli monozigoti hanno una percentuale di concordanza per la schizofrenia molto maggiore rispetto ai gemelli dizigoti, anche in essi il contributo genetico non supera il 50%, dimostrando il ruolo importante dell’influenza ambientale. Anche nelle condizioni controllate di laboratorio, ceppi di topi altamente inincrociati − così da renderne il genotipo omogeneo − mostrano differenze marcate nei tratti comportamentali se allevati in ambienti diversi.
Natura e cultura nello sviluppo del sistema nervoso centrale e del comportamento
Anche se le evidenze oggi disponibili sottolineano l’importanza di entrambe le componenti, l’azione dei geni e quella dell’ambiente sono state considerate mutualmente esclusive per lungo tempo nella storia del pensiero biologico, dando vita alla cosiddetta diatriba ‘Natura-Cultura’. Un esempio esplicativo delle forme in cui la diatriba si è sviluppata è dato dal dibattito tra comportamentisti ed etologi nella seconda metà del Novecento. Il comportamentismo (➔ behaviorismo) era incentrato sull’assunto secondo cui il concetto di ‘innato’ (natura) è totalmente privo di scientificità e sul ruolo essenziale dell’apprendimento (cultura). La centralità dell’apprendimento come base del comportamento venne invece osteggiata dalle teorie della scuola etologica classica, sorta in Europa. Studi etologici comparativi effettuati su numerose specie misero in luce l’esistenza di comportamenti altamente stereotipati, perfettamente eseguiti fin dalla prima volta in cui sono messi in campo dall’individuo, in assenza di apprendimento pregresso. Tali evidenze portarono allo sviluppo del concetto di comportamento istintivo e con esso all’idea, oggi ampiamente dimostrata, secondo cui i tratti comportamentali possono essere ereditati. La soluzione della diatriba tra comportamentisti ed etologi si deve a Konrad Lorenz, premio Nobel per la fisiologia o la medicina nel 1973. Lorenz introdusse per la prima volta l’idea di una predisposizione innata ad apprendere (L’etologia, 1978), basata sull’assunto che ogni processo di apprendimento deve necessariamente estrinsecarsi all’interno dei limiti fisiologici di ciascuna specie. Così come le specie differiscono tra loro nei tratti morfologici e sono soggette alle leggi della selezione e della ereditarietà, allo stesso modo anche la potenzialità di acquisire nuova informazione tramite l’apprendimento è regolata e programmata in modo specie-specifico. Una chiara predisposizione a imparare determinate cose meglio di altre è presente anche nei bambini (per es. nel caso del riconoscimento dei volti) e spiega perché ogni processo di apprendimento è adattato alle necessità naturali di ogni singola specie. ‘Innato’ e ‘appreso’ non sono costrutti antitetici, ma costituiscono due vie tramite le quali l’informazione relativa all’ambiente si rende disponibile all’organismo. Anche in neurobiologia, i due poli della diatriba Natura-Cultura hanno visto alterne fortune, legate alle scoperte e al pensiero degli studiosi più influenti. La teoria dei riflessi, proposta da Charles Sherrington, era basata sull’assunto secondo cui ogni comportamento può essere spiegato come la somma di una sequenza di movimenti prodotti dalla combinazione di riflessi semplici, le unità di base dell’attività motoria.
Ogni singolo comportamento era descritto come il risultato dell’attivazione evocata da uno stimolo sensoriale appropriato, il quale innesca una catena di archi riflessi che veicola l’informazione al sistema nervoso centrale e, mediante l’attivazione di gruppi selezionati di motoneuroni, elabora la risposta comportamentale. Lo studio dell’attività spontanea del sistema nervoso centrale condusse Erich von Holst alla scoperta dei generatori centrali di pattern, centri cerebrali capaci invece di organizzare il comportamento dall’interno, generando sequenze ritmiche di attività motoria in assenza di input sensoriali provenienti dai recettori periferici. Con la scoperta dei generatori centrali di pattern, il comportamento cessò di essere visto come mera risposta agli stimoli, presentandosi invece come un processo dotato di autorganizzazione. Una sintesi tra Natura e Cultura nell’analisi del funzionamento del cervello può essere rintracciata nella scoperta di processi biologici caratterizzati da riarrangiamenti plastici delle connessioni sinaptiche regolati dall’ambiente, ma possibili solo, o in modo preferenziale, durante fasi di maturazione rigidamente controllate su base genetica. Un esempio paradigmatico è dato dai cosiddetti periodi critici (➔), finestre temporali precoci in cui i programmi genetici di maturazione si aprono, per intervalli temporalmente limitati, all’influenza dell’esperienza, che può modularne e dirigerne l’attuazione.
Esperienza sensoriale e periodi critici: il caso paradigmatico dello sviluppo del sistema visivo
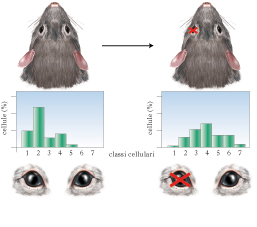
Dal punto di vista metodologico, il modo più diretto per analizzare l’influenza dell’ambiente sul cervello è manipolare il pattern di esperienza sensoriale al quale l’individuo viene esposto. Benché tale procedura possa sembrare ovvia, la possibilità di misurare in modo preciso i cambiamenti indotti nel cervello dagli stimoli ambientali è relativamente recente e si può far risalire all’inizio degli anni Sessanta del 20° secolo, quando furono introdotti nuovi approcci sperimentali volti a investigare gli effetti dell’esperienza ambientale sul sistema nervoso centrale. Risultati decisivi si devono al lavoro pionieristico di David H. Hubel e Torsten N. Wiesel che, per primi, mostrarono l’influenza drammatica di un’alterata esperienza sensoriale sull’anatomia e la fisiologia della corteccia visiva, oggi considerata il paradigma di elezione per lo studio della plasticità cerebrale. Tramite registrazioni elettrofisiologiche dalla corteccia visiva primaria (V1), questi autori notarono che i due occhi attivano i neuroni corticali visivi in maniera differenziale e che le cellule che mostrano la stessa preferenza per uno dei due occhi sono raggruppate insieme all’interno di colonne, chiamate, per l’appunto, colonne di dominanza oculare. In seguito, Hubel e Wiesel fecero la rimarchevole scoperta che la riduzione degli input provenienti da un occhio − effettuata, nell’animale da esperimento, mediante sutura delle palpebre (deprivazione monoculare) − determina, se eseguita precocemente nel corso dello sviluppo, una marcata alterazione delle proprietà di binocularità dei neuroni corticali della V1. Mentre normalmente la maggior parte dei neuroni corticali visivi e binoculare e la percentuale dei neuroni dominati dall’uno o dall’altro occhio e approssimativamente la stessa, nei soggetti deprivati monocularmente la grande maggioranza dei neuroni corticali diviene monoculare e risponde solo alla stimolazione dell’occhio non deprivato. Lo spostamento di binocularità in risposta alla deprivazione monoculare e stato riportato in tutte le specie di mammiferi con visione binoculare fino a oggi studiate e si accompagna ad altri effetti, come il mancato sviluppo dell’acuita visiva (➔) e della sensibilità al contrasto nell’occhio deprivato, una condizione nota come ambliopia (➔). La stessa manipolazione risulta invece totalmente inefficace nell’individuo adulto, delineando quindi l’esistenza di un periodo critico in V1 per gli effetti della deprivazione monoculare la cui durata, di circa 35 giorni nel topo, 4 mesi nel gatto e 25 mesi nella scimmia, e correlata alla durata di vita media della specie. Nell’uomo, gli effetti della deprivazione monoculare sono visibili negli individui con cataratta congenita unilaterale, un’opacizzazione del cristallino presente già alla nascita. La maturazione dell’acuita visiva nell’occhio con cataratta e fortemente rallentata e i valori si mantengono indefinitamente bassi e prossimi a quelli tipici del neonato fino all’avvenuta rimozione della cataratta stessa. Se l’opacità viene rimossa quando il periodo critico e ormai terminato, l’ambliopia diviene permanente. Effetti simili si riscontrano anche in bambini caratterizzati da altre disfunzioni che comportano uno sbilanciamento funzionale tra i due occhi, come difetti di rifrazione unilaterali (miopia, ipermetropia), nei quali l’occhio deficitario diventa ambliope, o nello strabismo, che comporta la deviazione degli assi ottici. Anche l’assenza di una normale esperienza visiva in entrambi gli occhi dovuta, nell’uomo, a cataratta bilaterale o, nell’animale da esperimento, a deprivazione binoculare o allevamento al buio, causa l’arresto della maturazione dei circuiti nervosi, con ridotto sviluppo dell’acuita visiva. Negli ultimi decenni sono stati compiuti sforzi notevoli dalla comunità scientifica volti a delucidare meccanismi cellulari e molecolari alla base della risposta plastica della corteccia visiva ai cambiamenti dell’input sensoriale durante il periodo critico e alla base della perdita di plasticità del cervello adulto. Benché la caratterizzazione di questi processi sia ancora (2010) incompleta, molte informazioni sono oggi disponibili, anche grazie ai risultati di studi effettuati su roditori di laboratorio che, inizialmente non considerati idonei per l’analisi delle proprietà del sistema visivo (si tratta, infatti, di animali notturni che si servono del tatto come senso principale), sono poi divenuti un modello molto usato, grazie alle conoscenze dettagliate acquisite sul loro sistema nervoso e alle potenzialità di indagine molecolare offerte dalle tecniche di ingegneria genetica.
Arricchimento ambientale e cervello
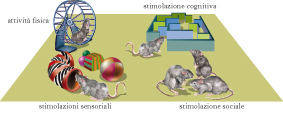
In parallelo agli studi di Hubel e Wiesel sugli effetti indotti in V1 dalla deprivazione monoculare, un contributo fondamentale allo sviluppo del dibattito Natura-Cultura venne dagli esperimenti di Mark R. Rosenzweig e collaboratori, che introdussero il paradigma dell’arricchimento ambientale quale protocollo sperimentale specificamente dedicato allo studio dell’influenza dell’ambiente sul cervello. Questi autori mostrarono che la morfologia, la chimica e la fisiologia del cervello possono essere alterate in modo marcato incrementando la qualità e la quantità degli stimoli ambientali. L’arricchimento ambientale può essere definito come la combinazione di una complessa stimolazione inanimata e sociale. Gli animali arricchiti sono allevati in gruppi sociali numerosi all’interno di ambienti di grandi dimensioni dove sono presenti oggetti di varia natura (giochi, tunnel, scale, tane), cambiati di frequente per posizione e tipologia. Una componente essenziale dell’ambiente arricchito e data dall’opportunità per gli animali di svolgere un’intensa attività fisica volontaria mediante le ruote di movimento. Se confrontato con la condizione ambientale definita standard (una gabbia di piccole dimensioni in cui sono presenti solo cibo, acqua e lettiera), l’arricchimento ambientale fornisce condizioni ottimali per l’esplorazione, l’attività cognitiva, l’interazione sociale, l’esercizio fisico, il gioco. Rispetto alla deprivazione monoculare, l’arricchimento ambientale si presenta quindi come un trattamento fisiologico basato sulla ottimizzazione degli stimoli ambientali piuttosto che sulla riduzione o l’alterazione dell’esperienza sensoriale.
Arricchire l’ambiente per potenziare la plasticità cerebrale
Storicamente, gli effetti dell’arricchimento ambientale furono descritti dapprima a livello anatomico: ratti arricchiti presentano marcati incrementi nello spessore e nel peso della corteccia, nelle dimensioni dei corpi cellulari e del nucleo, nella lunghezza delle spine dendritiche e nella densità sinaptica. Più di recente, gli studi hanno messo in luce che la vita in un ambiente arricchito stimola la neurogenesi ippocampale e riduce l’apoptosi (➔), anche in modelli animali di epilessia indotta da iniezioni di acido kainico (un acido bicarbossilico derivato dalla pirrolidina). Benché gli effetti si osservino primariamente nella corteccia e nell’ippocampo, un’aumentata sinaptogenesi e stata riportata anche nello striato, nel talamo e nel cervelletto di topi arricchiti. La stimolazione offerta dalla vita in un ambiente arricchito comporta anche incrementi dell’angiogenesi cerebrale, tramite i quali la disponibilità di glucosio aumenta in diversi distretti neuronali. A livello comportamentale, l’arricchimento ambientale potenzia le prestazioni in compiti che coinvolgono le funzioni cognitive superiori, come l’apprendimento e la memoria: gli animali arricchiti presentano un rilevante miglioramento della memoria spaziale, della memoria di riconoscimento di oggetti e nei test di condizionamento classico alla paura (➔ emozioni). Questi effetti correlano con un incremento dell’ampiezza del potenziamento a lungo termine (➔) dei potenziali di campo eccitatori ippocampali. Maggiore incertezza esiste sugli effetti indotti dalla vita in un ambiente arricchito sui circuiti responsabili della regolazione allo stress (gli studi nei roditori hanno alternativamente riportato maggiori o minori livelli di stress). La visione prevalente e quella dell’azione ansiolitica dell’arricchimento ambientale, come evidenziato nei topi balb/c, un ceppo patologicamente ansioso. Lo studio dei meccanismi molecolari alla base degli effetti dell’arricchimento ambientale sul cervello e mosso dall’ambizioso obiettivo di scoprire molecole (chiamate enviromimetics) che possano poi essere manipolate per riprodurre gli effetti benefici dell’esperienza arricchita. L’esposizione a un ambiente arricchito stimola l’attività dei sistemi a proiezione diffusa (colinergico, serotoninergico e noradrenergico) e aumenta i livelli di espressione di geni coinvolti nella trasmissione sinaptica, nella plasticità ed eccitabilità neuronale (come c-fos e creb) e nella neuroprotezione. L’azione sull’espressione genica può imputarsi, almeno in parte, alla capacita dell’arricchimento ambientale di aumentare l’acetilazione istonica, che facilita il legame dei fattori di trascrizione alla cromatina (➔ epigenetica). Una classe di molecole molto sensibili all’arricchimento ambientale e costituita dalle neurotrofine, fattori secreti che giocano un ruolo essenziale nei fenomeni di plasticità strutturale e funzionale sia durante lo sviluppo sia nel cervello adulto. La capacita dell’arricchimento ambientale di agire in modo totalmente non invasivo e su più livelli (comportamentale, anatomico, molecolare) lo rende un metodo molto promettente anche per il trattamento di condizioni patologiche. L’esposizione a un ambiente arricchito ha effetti benefici marcati in modelli animali di malattie neurodegenerative come la malattia di Alzheimer, il morbo di Parkinson e la corea di Huntington, o in modelli di disturbi di sviluppo del sistema nervoso centrale quali la sindrome dell’X fragile, la sindrome di Rett e la schizofrenia. Inoltre, ratti arricchiti presentano un generale miglioramento dei deficit cognitivi e motori causati da infarto cerebrale o lesione del midollo spinale. Alessandro Sale
Effetti dell’arricchimento ambientale su sviluppo e plasticità del sistema visivo
L’influenza dell’arricchimento ambientale sulla fisiologia dei sistemi sensoriali è stata per lungo tempo scarsamente investigata. In tempi recenti, una serie di studi effettuati presso l’Istituto di Neuroscienze del CNR e la Scuola Normale Superiore di Pisa ha dimostrato che l’arricchimento ambientale ha un effetto notevole sullo sviluppo e la plasticità del sistema visivo.
L’arricchimento ambientale accelera lo sviluppo del sistema visivo
Uno degli effetti più marcati indotti da un protocollo di arricchimento ambientale applicato dalla nascita nel roditore consiste nell’accelerazione della maturazione dell’acuità visiva (➔), un indice molto sensibile di sviluppo, documentata sia con metodi elettrofisiologici (registrazioni di potenziali visivi evocati) sia con metodi comportamentali. Rapportando il fenomeno ai tempi di sviluppo dell’uomo, si può dire che è come se un bambino dell’età di tre anni raggiungesse i valori di acuità visiva tipici dell’adulto (cioè con circa due anni di anticipo). La precoce maturazione dell’acuità visiva si accompagna a un’accelerazione nella durata del periodo critico per la plasticità sinaptica in corteccia visiva. Un ruolo cruciale è svolto dal fattore neurotrofico derivato dal cervello (BDNF): i livelli di BDNF aumentano a sette giorni di vita nella corteccia visiva di topi nati in un ambiente arricchito. Il BDNF promuove la maturazione del circuito inibitorio GABAergico, che è a sua volta responsabile del restringimento delle dimensioni dei campi recettivi visivi, correlate in modo inverso all’acuità. Un altro fattore molecolare alla base dell’azione dell’arricchimento ambientale sullo sviluppo del sistema visivo è il fattore di crescita insulino-simile di tipo 1 (IGF-1). Poiché gli effetti dell’arricchimento ambientale sono già presenti prima dell’apertura degli occhi, l’influenza precoce dell’ambiente non dipende dalla visione. A conferma di ciò, nel ratto l’arricchimento ambientale al buio previene il ritardo di sviluppo indotto dalla totale assenza di stimoli visivi.
Arricchimento materno e sviluppo del sistema visivo
La precocità degli effetti indotti dall’arricchimento ambientale dimostra che l’ambiente non agisce sul sistema nervoso in sviluppo mediante un’azione diretta degli stimoli presenti nella gabbia di arricchimento. Le prime settimane di vita nei roditori, infatti, sono caratterizzate dall’assenza di interazione tra i nuovi nati e l’ambiente circostante. Piuttosto, i piccoli spendono la maggior parte del tempo nel nido, dove la madre rappresenta la più importante sorgente di stimoli. È stato di recente dimostrato che gli effetti più precoci di accelerazione dello sviluppo del sistema visivo indotti dall’arricchimento ambientale sono mediati dalle cure materne (➔). I piccoli arricchiti ricevono livelli di cure maggiori rispetto ai piccoli allevati in gabbie standard ed è noto che variazioni nell’intensità delle cure agiscono da regolatori dei livelli intracerebrali di BDNF. Inoltre, la stimolazione tattile artificiale di piccoli di ratto allevati in gabbie non arricchite (effettuata mediante un protocollo di massaggi che mimano le cure materne) accelera la maturazione dell’acuità visiva, e ciò rappresenta un esempio notevole di plasticità cross-modale nel quale l’aumento degli input sensoriali in una modalità mette in moto meccanismi che guidano lo sviluppo di altri sistemi. Sorprendentemente, la terapia del massaggio (➔) ha effetti simili anche nei bambini.
Arricchimento ambientale e sviluppo della retina
La visione classica secondo cui lo sviluppo della retina è indipendente dall’esperienza sensoriale è stata smentita da una serie di studi, che hanno usato il paradigma dell’arricchimento ambientale come strategia per aumentare i livelli di stimolazione ambientale. Mediante registrazioni di elettroretinogramma da pattern (una tecnica che studia la risposta delle cellule gangliari retiniche alla visione di reticoli con bande alternate chiare e scure), è stato dimostrato che l’acuità retinica matura precocemente in piccoli di ratto arricchiti dalla nascita, secondo una scala temporale sovrapponibile a quella della corteccia. A livello anatomico, l’accelerazione è evidente nel pattern di segregazione dei dendriti delle cellule gangliari all’interno delle sublamine on e off della retina. L’influenza dell’arricchimento ambientale sulla maturazione retinica è evidente perfino durante lo sviluppo fetale. I feti di madri allevate in ambiente arricchito durante la gravidanza presentano una marcata accelerazione dei processi di migrazione dei progenitori neuronali retinici e di morte naturale programmata, un effetto mediato dall’IGF-1.
Ringiovanire il cervello
La capacità dell’arricchimento ambientale di agire sui processi che regolano la plasticità del sistema visivo è marcatamente presente anche nel cervello adulto. Usando un modello di ambliopia nel roditore (ratti sottoposti a deprivazione monoculare a lungo termine) è stato dimostrato che l’arricchimento ambientale aumenta la plasticità della corteccia visiva adulta, promuovendo un completo recupero dell’acuità visiva e della binocularità in animali fuori dal periodo critico e quindi incapaci, in condizioni standard, di riacquistare una visione normale. I meccanismi molecolari alla base del recupero della visione sono la diminuzione dei livelli di inibizione intracorticale GABAergica e l’aumento dell’espressione di BDNF. Questi risultati aprono prospettive incoraggianti nel campo del trattamento delle malattie neurologiche. Di particolare interesse, infatti, è la possibilità di favorire il recupero delle funzioni visive usando un paradigma sperimentale fisiologico, assolutamente non invasivo, come l’arricchimento ambientale.
Esercizio fisico e cervello
L’importanza dell’esercizio fisico per il mantenimento delle funzioni cerebrali era già nota nell’antichità e riecheggia nel celebre detto latino mens sana in corpore sano. A dispetto della lontana origine del concetto, fino a oggi pochi studi hanno caratterizzato gli effetti dell’attività fisica sul cervello usando un approccio sperimentale diretto. Piuttosto, esiste una vasta letteratura aneddotica che correla, nell’uomo, lo stile di vita individuale con le prestazioni cognitive dei soggetti. Uno studio di metanalisi, condotto nel 2003, ha individuato, in bambini in età scolare (4÷18 anni), una relazione positiva tra attività fisica e performance cognitive, misurate in svariati domini quali abilita percettive, quoziente intellettivo, abilita nei test verbali, risoluzione di compiti matematici, capacità mnemoniche. Inoltre, in studenti di college è stato documentato un aumento della velocita di reazione e di memorizzazione di nuovi vocaboli nel periodo seguente a un intenso allenamento aerobio. Il dato importante, con implicazioni pedagogiche rilevanti, è rappresentato dal fatto che la partecipazione ad attività motorie non solo non riduce la performance accademica dei soggetti, ma contribuisce ad aumentarne il benessere psicofisico e le prestazioni scolastiche. Effetti simili sono stati riportati anche in analisi non focalizzate su una ristretta fascia di età, ma estese all’intera durata della vita (dai 6 ai 90 anni). L’esercizio fisico, inoltre, aumenta la riserva cognitiva, cioè la capacità di mantenere funzioni mentali intatte negli anni dell’invecchiamento cerebrale. Infatti, esiste una correlazione positiva tra i livelli di attività fisica nella fascia di età 15÷25 anni e la velocita di processamento delle informazioni misurata a 62÷85 anni.
Studi di neuroimaging
Studi neurofisiologici rivelano che i cambiamenti nelle prestazioni cognitive indotti dall’esercizio fisico sono correlati a modifiche funzionali nel cervello. L’analisi elettroencefalografica mostra un’aumentata attivazione delle bande spettrali theta, alfa e beta in individui con alti livelli di allenamento aerobico, unitamente a un incremento dell’ampiezza e una riduzione della latenza dell’onda p3 nei potenziali evocati evento-correlati. L’onda p3, generata da una complessa rete di connessioni che collega i lobi frontali con la corteccia cingolata anteriore, il lobo inferotemporale e la corteccia parietale, è correlata ai livelli di attenzione verso lo stimolo e alla velocita di elaborazione dello stesso. Studi di risonanza magnetica per immagini evidenziano, in individui con alti livelli di allenamento aerobico, un incremento del volume della sostanza grigia prefrontale e temporale. L’esercizio fisico, inoltre, causa incrementi anche nell’attivazione del giro frontale mediano e della corteccia parietale superiore, evidenziati mediante risonanza magnetica funzionale per immagini. Più di recente (2007), sono stati documentati aumenti nel volume di sangue cerebrale a livello del giro dentato dell’ippocampo in individui di mezza età coinvolti in un programma di allenamento motorio della durata di tre mesi.
Ricerca sui modelli animali
Gli studi sui modelli animali hanno il vantaggio di consentire un’indagine dei meccanismi cellulari e molecolari alla base degli effetti dell’esercizio fisico sul cervello e di ridurre il contributo di variabili confondenti legate, per es., alle differenze individuali nella partecipazione ai programmi di allenamento o alla covarianza con altri fattori legati allo stile di vita, quali la dieta o le relazioni sociali. Uno degli effetti più marcati e riproducibili dell’esercizio fisico è l’aumento dei livelli di proliferazione e sopravvivenza cellulare nel giro dentato dell’ippocampo, evidenziato sia durante lo sviluppo, sia nell’età adulta e nell’anziano, ma documentabile, sorprendentemente, anche nella prole di topi che effettuano intensa attività motoria durante la gravidanza. Questi cambiamenti si accompagnano a un incremento della densità sinaptica nella corteccia entorinale e nell’ippocampo e alla stimolazione della crescita di nuovi vasi nel cervelletto, nello striato e nell’ippocampo, dipendente dall’aumentata espressione del fattore di crescita dell’endotelio vascolare (VEGF, Vascular Endothelial Growth Factor) e del fattore di crescita insulino-simile di tipo 1 (IGF-1). Una molecola essenziale nel mediare gli effetti dell’esercizio fisico è il fattore neurotrofico derivato dal cervello (BDNF, Brain-Derived Neurotrophic Factor), che stimola la plasticità sinaptica ippocampale, la crescita e la sopravvivenza dei neuroni e, a livello cognitivo, l’apprendimento e la memoria. L’esercizio fisico agisce sul BDNF mediante l’innalzamento dei livelli circolanti di IGF-1 che, attraversando la barriera ematoencefalica, stimola in modo diretto l’espressione del fattore neurotrofico. Il blocco sperimentale di IGF-1, ottenuto mediante iniezione sottocutanea di un anticorpo diretto contro tale fattore di crescita, previene, nel ratto, sia l’aumento di BDNF sia il potenziamento delle performance di apprendimento e memoria indotte dall’esercizio fisico. Anche nell’uomo il BDNF sembra avere un ruolo importante come mediatore degli effetti benefici dell’esercizio fisico. Aumentate concentrazioni di BDNF sono state riportate nel siero di giovani adulti in salute e in pazienti con sclerosi multipla a seguito di episodi acuti di allenamento motorio. Poiché è noto che i livelli di BDNF sono ridotti in numerose patologie quali la malattia di Alzheimer, il morbo di Parkinson, la depressione e l’anoressia, l’attività aerobica può rivelarsi utile come terapia comportamentale, svolgendo una spiccata azione neuroprotettiva mediata dalla regolazione della secrezione di BDNF.