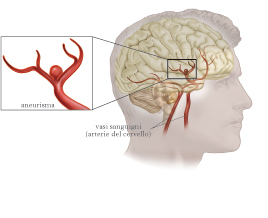
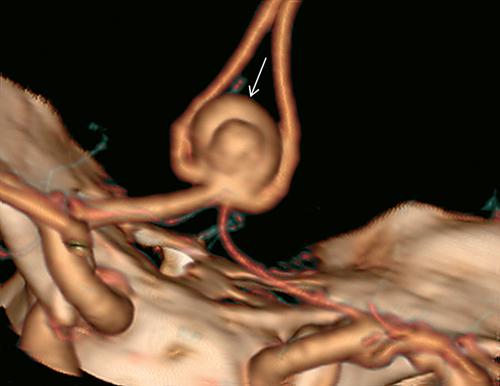
aneurisma
aneurisma
Dilatazione patologica di strutture vascolari quali arterie, vene, pareti cardiache. Classici studi autoptici o angiografici su larga scala hanno dimostrato la presenza di a. a livello delle arterie cerebrali in circa il 5% degli individui. La morfologia è generalmente sacculare, più raramente fusiforme. A. di dimensioni superiori ai 2,5 cm sono definiti giganti. Gli a. intracranici sono stati considerati per lungo tempo di natura congenita. In realtà, per gran parte di essi è ormai assodato che lo sfiancamento della parete arteriosa è un fatto acquisito, condizionato dall’impatto emodinamico su punti di minore resistenza della parete stessa. Il fatto che gli a. prediligano le biforcazioni arteriose − tipicamente quelle della porzione anteriore del circolo di Willis – conferma il ruolo causale rivestito dallo stress emodinamico. I noti fattori di rischio vascolare (principalmente fumo e ipertensione) agevolano la progressione della patologia di parete. Più raramente, la formazione di a. cerebrali può associarsi all’uso di sostanze stupefacenti, a concomitanti patologie del tessuto connettivo, a traumi o infezioni della parete arteriosa, come può accadere in corso di endocarditi batteriche. Esiste quasi certamente una predisposizione a sviluppare a., fondata su fattori congeniti e risultante in una difettosa costituzione della parete arteriosa. Il substrato genetico di tale predisposizione pare essere di natura multifattoriale, non essendo emerse associazioni univoche con singoli loci genici. La manifestazione clinica più temibile di un a. cerebrale è l’emorragia subaracnoidea.
Diagnosi
La rottura di un a. cerebrale costituisce il primo sospetto clinico in presenza di un’emorragia subaracnoidea spontanea. La conferma diagnostica è stata affidata per decenni all’arteriografia cerebrale tramite cateterismo. La RMN e la TC hanno generato metodiche di visualizzazione non invasiva dei vasi intracranici che hanno progressivamente ridimensionato il ruolo dell’angiografia per catetere. Le stesse metodiche rendono conto del crescente riscontro occasionale di a. cerebrali non rotti.
Manifestazioni cliniche
Molti a. intracranici rimangono silenti nel corso della vita. Occasionalmente, un a. integro può dare segno di sé per la compressione esercitata sulle strutture adiacenti: tipica la ptosi palpebrale per compressione del nervo oculomotore da parte di a. dell’arteria carotide interna. In rari casi, a. di grandi dimensioni possono esercitare irritazione sulla corteccia cerebrale limitrofa, determinando l’insorgenza di crisi epilettiche. Con le eccezioni di cui sopra, la presentazione clinica di un a. coincide quasi sempre con la sua rottura. La propensione di un a. alla rottura è condizionata da alcuni fattori, tra i quali le dimensioni della sacca. La rottura dell’a. comporta l’immissione di sangue a pressione arteriosa all’interno dello spazio subaracnoideo. Oltre ai possibili danni derivanti dall’azione diretta dello stravaso sulle strutture limitrofe, l’emorragia comporta un innalzamento della pressione intracranica a livelli spesso incompatibili con la vita. Più di un terzo dei pazienti non sopravvive all’evento iniziale. Nei rimanenti casi, l’emorragia si arresta spontaneamente lasciando il paziente indenne o con sequele di gravità variabile. La prognosi dei pazienti colpiti da emorragia subaracnoidea è condizionata da tre possibili complicanze: ripresa del sanguinamento, sviluppo di idrocefalo, sviluppo di vasospasmo arterioso. La prima complicanza incide con maggiore frequenza nelle prime ore dall’emorragia ma rimane significativa anche a diverse settimane dall’evento iniziale. All’incirca il 50% degli a. rotti è destinato a risanguinare entro i sei mesi successivi. La prevenzione del risanguinamento determina la necessità di obliterare sollecitamente gli a. cerebrali rotti. Essa, salvo casi selezionati, costituisce una priorità. L’idrocefalo (➔) può insorgere immediatamente o anche a distanza di tempo dall’emorragia, per l’azione di disturbo esercitata dai coaguli ematici sul normale flusso liquorale. Il vasospasmo arterioso è un fenomeno dalla genesi parzialmente oscura, sebbene evidentemente correlata alla quantità di sangue riversatosi nelle cisterne subaracnoidee. Consiste nella costrizione focale o diffusa delle arterie cerebrali, con possibili ricadute ischemiche sulle corrispondenti aree cerebrali, a distanza di alcuni giorni dall’evento emorragico.
Criteri di trattamento
Per lungo tempo il trattamento di prima scelta per la chiusura degli a. intracranici è stato chirurgico. L’operazione comporta l’esposizione dell’a. attraverso una craniotomia e, sotto guida microscopica, il collasso della sacca mediante una o più clip metalliche. A partire dai primi anni Novanta del 20° secolo, la chirurgia è stata affiancata − e per molti versi sostituita − da metodiche di obliterazione endovascolare, ottenuta mediante cateterismo arterioso e introduzione, sotto guida radiologica, di specifici dispositivi (coil, stent) in grado di promuovere la trombosi del lume aneurismatico. Il riscontro occasionale di a. integri ha sollevato un dibattito non completamente risolto circa l’opportunità di procedere al loro trattamento in via preventiva. La determinazione del rischio emorragico degli a. integri è la pietra angolare su cui poggia tale scelta e pertanto costituisce l’oggetto di studi osservazionali su larga scala, alcuni dei quali non ancora conclusi. Le evidenze sinora raccolte suggeriscono che gli a. di dimensioni inferiori ai 7 mm comportino un rischio di sanguinamento spontaneo molto basso.