Biologia dello sviluppo
Biologia dello sviluppo
Biologia dello sviluppo animale
di Giovanni Giudice
Le ricerche di quest'ultimo ventennio del sec. 20° hanno consentito di trovare risposte sempre più puntuali, in termini molecolari, a numerosi problemi posti dall'embriologia fin dagli inizi del secolo. Sempre meglio si è precisata la corrispondenza tra azione dei geni e differenziamento dei vari territori embrionali. Pionieri sono stati gli studi sul moscerino Drosophila: alle conoscenze già acquisite sulla genetica di questo animale se ne sono aggiunte di nuove sulla biologia del suo sviluppo grazie a indagini sempre più approfondite, condotte mediante tecniche di biologia molecolare.
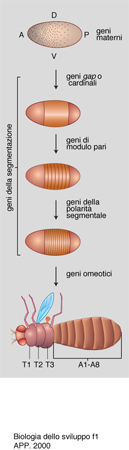
Si è trovato che in Drosophila agiscono dapprima dei geni battezzati gap, cioè intervallo, perché la loro mutazione provoca la mancanza di un'intera parte del corpo (per es., la testa o l'addome); si conclude che essi siano i responsabili della formazione di queste grandi parti del corpo (come dimostrato anche da altri esperimenti, quali, per es., la microiniezione dei loro prodotti nell'uovo).
All'azione dei geni gap segue quella dei cosiddetti pair rule (geni di modulo pari), perché la loro mutazione causa difetti in segmenti alterni della larva. Segue ancora l'azione dei geni detti segment polarity, che specificano qual è la parte anteriore e quale la posteriore di ciascun segmento. Infine entrano in azione i geni omeotici, così chiamati perché la loro mutazione causa la trasformazione di una parte del corpo in un'altra che era in origine omologa, ma che è diventata diversa nell'evoluzione: per es., l'animale forma zampe al posto di antenne sulla testa (fig. 1).
Le informazioni ottenute da questi studi hanno dato un valido contributo all'indagine relativa allo stabilirsi degli assi embrionali, che in Drosophila ha raggiunto traguardi tali da divenire oggi punto di riferimento per analoghi studi su altri sistemi biologici: questi studi molto spesso prendono le mosse da quanto noto in Drosophila per vedere se gli stessi o simili meccanismi molecolari siano al lavoro per stabilire gli assi embrionali nell'organismo considerato.
Si è visto che in Drosophila una serie di geni, tra quelli appena descritti, che agiscono durante l'ovogenesi, depositano nel citoplasma dell'ovocita degli RNA in maniera spazialmente ordinata: il che determina le coordinate spaziali del futuro embrione. In particolare si è chiarito come nell'ovocita di Drosophila si determina il lato nel quale si formerà la testa, quello nel quale si formerà l'addome, il lato dorsale e il lato ventrale, e che cosa determina la formazione delle strutture dell'estremità rostrale (acron) e dell'estremità caudale (telson).
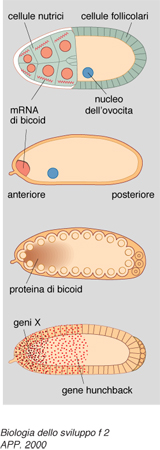
Per la formazione della testa alcuni geni (tra i quali quelli detti exuperantia, swallow e staufen) producono degli RNA che vengono tradotti in proteine del citoscheletro (cioè dello scheletro dell'ovocita), le quali ancorano un mRNA prodotto anche nell'ovogenesi, detto bicoid, a un estremo dell'ovocita stesso, quello che sarà appunto il polo anteriore, tramite l'estremità 3′ non tradotta (cioè non destinata alla produzione di proteina) del RNA stesso (fig. 2).
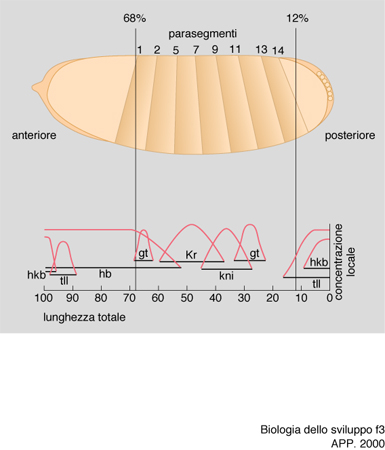
Di conseguenza, la proteina prodotta sullo stampo del RNA bicoid sarà disposta in un gradiente di concentrazione antero-posteriore. Questa proteina è un fattore di trascrizione, dunque è capace di attivare la sintesi di RNA da parte di geni specifici ai quali si va a legare. Essa si lega allora al DNA dei nuclei che si trovano nella parte anteriore dell'embrione (che in questo stadio è costituito da molti nuclei immersi in un unico citoplasma) e vi attiva la 'trascrizione' (cioè la sintesi del RNA) da parte di un gene detto hunchback. Solo nella zona anteriore, dunque, si produrrà la proteina di hunchback, che a sua volta andrà solo in questa parte a stimolare la trascrizione di altri geni, ancora in via di individuazione, che consentiranno la formazione della testa. D'altro canto si è trovato che il RNA prodotto da un altro gene, detto caudal, importante per la formazione di strutture posteriori, è distribuito uniformemente in tutto l'ovocita, ma la sua proteina forma pure un gradiente con massimo posteriore e minimo anteriore, perché la proteina bicoid si lega all'estremità 3′ non tradotta del RNA di caudal e ne inibisce la 'traduzione' in proteina nella zona anteriore.
È questo un meccanismo che ritroveremo altre volte nello sviluppo e che sottolinea ancora l'importanza di questa estremità del RNA per regolare sia il suo ancoraggio in territori particolari delle cellule, sia la sua traducibilità in proteina. La formazione dell'addome si basa ancora infatti su questo meccanismo: l'RNA di hunchback che stimola la formazione della testa, anche se prodotto solo anteriormente nell'embrione, come visto, è presente anche nella sua parte posteriore, perché vi era già nell'ovocita prima della fecondazione; esso però non viene tradotto in proteina in quanto nella zona posteriore si è ancorato, per mezzo del proprio estremo 3′ non tradotto, al RNA prodotto dal gene nanos. Pertanto, si è formato un gradiente di concentrazione con massimo posteriore e minimo anteriore della proteina di nanos: questa si lega all'estremità 3′ non tradotta del RNA di hunchback e ne inibisce la traduzione in proteina; nella zona posteriore, dunque, sarà presente la proteina di caudal ma non quella di hunchback; ciò porta all'attivazione solo nei nuclei della zona posteriore dell'embrione dei geni detti knirp e giant che, attraverso meccanismi ancora allo studio, stimolano la formazione dell'addome (fig. 3).
Per quanto riguarda la formazione dell'asse dorso-ventrale dell'embrione, vi è ancora un meccanismo diverso, che nuovamente trova la sua origine nell'ovogenesi. La proteina toll, un recettore di membrana, è distribuita uniformemente su tutta la membrana esterna dell'embrione; essa però viene attivata soltanto nella zona ventrale dell'embrione, perché esclusivamente da questo lato si trova nello spazio tra le membrane dell'uovo un ligando, prodotto probabilmente dal gene spätzle, che attiva il recettore toll. L'attivazione di toll solo dal lato ventrale provoca, unicamente da questo lato, una degradazione della proteina prodotta da un altro gene, detto cactus, che tiene ancorata al citoplasma la proteina dorsal, uniformemente distribuita nell'embrione. Sia per l'inattivazione ventrale della proteina cactus, sia per l'intervento dei geni tube e pelle, la proteina dorsal viene trasferita ai nuclei solo dal lato ventrale; poiché essa è un fattore di trascrizione, attiva nei nuclei del lato ventrale dell'embrione i geni twist e snail, mentre vi reprime i geni zerknult e decapentaplegico. Questo fatto, con meccanismi a valle ancora oggetto di studio, determina l'asse dorso-ventrale.
Un meccanismo che richiede l'attivazione localizzata di un recettore è anche all'opera per determinare la formazione degli estremi acron e telson. Un altro recettore di membrana prodotto dal gene torso è pure distribuito uniformemente su tutta la superficie dell'embrione, però il ligando che lo attiva, probabilmente la proteina del gene torso-like, è prodotto in piccola quantità solo dalle cellule follicolari localizzate ai due estremi dell'embrione. Ciò significa che solo a queste estremità il recettore torso sarà attivato; il che, attraverso una catena di eventi implicanti i meccanismi di trasduzione del segnale, attiva solo alle estremità la trascrizione dei geni tailless e huckebein, responsabili, attraverso meccanismi ancora oggetto di studio, della formazione dei due estremi dell'embrione. Informazioni sono anche disponibili sui meccanismi che inducono le cellule dell'ovaio a creare le asimmetrie molecolari nell'ovocita, le quali portano alla formazione degli assi ora descritta. Si sa, per es., che il nucleo dell'ovocita, localizzato vicino al suo polo posteriore, stimola attraverso il prodotto del gene gurken un recettore delle cellule follicolari più vicine, prodotto dal gene torpedo, che fa adottare a queste cellule un destino posteriore; da queste cellule partirebbe un altro segnale di natura ancora non nota, che fa riorganizzare i microtubuli dell'ovocita; questi trasportano così il nucleo vicino alla zona dorsale e anteriore dell'ovocita stesso. A questo punto dal nucleo partirebbe di nuovo il segnale di gurken, che farebbe adottare alle cellule follicolari un destino dorsale e anteriore.
Un altro meccanismo del quale si hanno spiegazioni molecolari è quello della formazione delle cellule polari di Drosophila, le quali, come si sapeva, sono destinate a formare le cellule germinali dell'adulto. Si è infatti visto che nella zona dell'ovocita da cui esse si genereranno, il cosiddetto plasma polare, vi è un accumulo del RNA ribosomale mitocondriale, che, probabilmente attraverso l'intervento dei geni oskar, tudor e vasa, provoca la formazione in quella zona delle cellule polari: queste però saranno funzionali solo se interviene anche il gene nanos.
Tra i sistemi biologici nei quali il meccanismo per la determinazione degli assi è stato studiato in termini molecolari, va ricordato il nematode (verme a sezione tonda) Caenorhabditis elegans. In esso una serie di geni detti Par (Partition defective) agisce sulla miosina, provocando dei movimenti citoplasmatici che portano verso il lato posteriore dell'uovo quelle granulazioni poi responsabili della formazione, appunto da quella parte dell'uovo, delle cellule della linea chiamata P, dalla quale si origineranno le cellule germinali.
In stadi successivi di sviluppo una differenza molecolare tra le cellule della linea P e quelle anteriori (cellula AB e suoi discendenti) si realizza attraverso uno dei meccanismi già descritti in Drosophila.
Il prodotto del gene skn1 è presente sia nella cellula P sia nella AB. Esso però viene trasferito al nucleo nella cellula P e discendenti, e non nella cellula AB e discendenti. Solo nella linea P, dunque, il prodotto di skn1 può esercitare la sua azione di attivazione di geni. Ancora un meccanismo già descritto in Drosophila differenzia la cellula AB posteriore da quella AB anteriore e da P. Il RNA del gene glp1, che contiene l'informazione per un recettore di membrana, è tradotto in proteina solo nella cellula AB posteriore, perché nella cellula P, dove pure esso esiste, qualcosa si lega a una sequenza specifica della sua estremità 3′ non tradotta, impedendo la traduzione di tutto il messaggero. La cellula P, invece, produce una proteina codificata dal gene APX, che va a legare il recettore glp1 sulla superficie della cellula AB posteriore, inducendola a essere diversa dalla AB anteriore.
Un altro sistema nel quale il meccanismo molecolare della determinazione degli assi è stato molto studiato è quello dell'anfibio Xenopus laevis. In esso era noto che l'asse dorso-ventrale è determinato dal punto di entrata dello spermio, che segna la zona ventrale attraverso una rotazione del citoplasma sottostante la zona corticale dell'uovo.
Negli ultimi anni numerosi studi si sono concentrati dapprima sui segnali che inducono la formazione del mesoderma da parte delle cellule ectodermiche sotto lo stimolo di quelle endodermiche, e poi sull'identificazione delle molecole che provocano il differenziamento del mesoderma ventrale rispetto a quello dorsale. Ricorderemo che il primo darà origine alla notocorda e ai somiti, mentre il secondo a muscoli mesenchima e, più ventralmente ancora, a sangue e rene. Sono stati isolati i prodotti di una serie di geni con effetto ventralizzante o dorsalizzante sul mesoderma, costituenti un complesso sistema di equilibrio che viene ogni giorno di più chiarito.
Tra quelli a effetto ventralizzante annoveriamo Xwnt-8 (dove X sta per Xenopus e wnt per sequenze geniche simili a quelle di wingless di Drosophila e a quelle dell'oncogene int di topo), BMP4 (Bone morphogenetic protein), Xvent-1 (vent=ventralizzante), Xom (om=omeotico), Vox (ox=omeobox), XMAD (MAD=Mother against decapentaplegic). Tra i prodotti a effetto dorsalizzante si annoverano quelli dei geni goosecoid (da gosberry e bicoid di Drosophila), Xnr₃, cordina, noggina, Vg1, attivina, beta catenina, follistatina, siamois. È recente la scoperta che la noggina e la cordina legano e inattivano la proteina di BMP4. A valle di BMP4 agisce la catena di trasduzione del segnale rappresentata, nell'ordine, da Ras (una proteina della superficie cellulare attiva quando legata al nucleotide guanosina trifosfato, e inattiva quando questo diviene difosfato), da Raf (un enzima che fosforila, cioè aggiunge un fosfato agli amminoacidi serina e treonina delle proteine) e da 4AP-1 (un dimero degli oncogeni jun e fos).
Wnt-8 a sua volta attiva una cascata di eventi: Wnt lega un recettore di membrana detto frizzled, questo, attraverso il prodotto del gene dishevelled, inattiva una serina treonina chinasi, la GSK₃ (da glicogeno sintasi chinasi, un enzima cioè che aggiunge fosfato alla proteina che sintetizza glicogeno); questa proteina, se non fosse inibita, aggiungerebbe fosfato a un'altra proteina, la beta catenina, che verrebbe allora degradata. Dal momento che non è fosforilata, per effetto della catena di eventi messa in moto da Wnt, la beta catenina lega un fattore di trascrizione detto XTcf3, che insieme a essa si trasferisce allora al nucleo producendo il suo effetto sul DNA. È interessante notare come ancora una volta molti, se non tutti, gli elementi di questa catena di eventi trovano il loro omologo in Drosophila, dove sono stati identificati per primi, anche se con funzioni non identiche. Il concetto generale che emerge è che nell'evoluzione le stesse pietre sono utilizzate per costruire edifici diversi: per es., Wnt è omologo di wingless, GSK₃ di zw3, la beta catenina di armadillo.
È interessante l'osservazione di E. De Robertis (1996), il quale, rilevato che il prodotto del gene sog (short gastrulation) di Drosophila è come sequenza simile alla cordina di Xenopus, trova che tutti e due questi prodotti, se sperimentalmente iniettati, provocano ventralizzazione in Drosophila e dorsalizzazione in Xenopus. Ciò ha fatto ridiscutere e dato forza alla vecchia teoria di J. Saint-Hilaire, secondo la quale il lato dorsale degli Artropodi corrisponde al lato ventrale dei Vertebrati e viceversa, per un'inversione avvenuta nell'evoluzione. De Robertis teorizza anche l'esistenza di animali antenati comuni dei due, detti Urbilateralia.
Per quanto riguarda l'asse animale vegetativo negli Anfibi, destò notevole interesse, alla fine degli anni Ottanta, la scoperta di D.A. Melton che un RNA battezzato Vg1, localizzato in modo piuttosto diffuso nell'ovocita, si muove durante la maturazione di questo per localizzarsi al polo vegetativo. È stato molto studiato in questi anni, proprio nell'ovocita di Xenopus, il meccanismo di trasporto degli RNA messaggeri lungo l'asse animale vegetativo dell'ovocita.
La proteina di Vg1 è un fattore di crescita, che ha un ruolo nell'induzione mesodermica, come già detto e come vedremo più avanti. Non è stato però ancora definitivamente chiarito se abbia un ruolo nello stabilirsi dell'asse animale vegetativo. È stato però in questi anni abbondantemente studiato il sistema di trasporto e ancoraggio di messaggeri nell'ovocita di Xenopus. Si è descritto in proposito un sistema di trasporto, che con un certo umorismo è stato chiamato METRO (Messenger transport organizer); questo è attivo ai primi stadi dell'ovogenesi, dall'1 al 3, e trasporta a una zona discoidale della corteccia alcuni RNA. Un altro sistema di trasporto entra in funzione più tardivamente nell'ovogenesi e attraverso il citoscheletro localizza in tutta la corteccia vegetativa altri RNA, come il già citato Vg1. Altri RNA e proteine sono localizzati nella metà animale dell'uovo. È da sottolineare, però, che a differenza di quanto abbiamo visto in Drosophila, non è ancora stato descritto per nessuno di questi RNA localizzati nelle due metà di Xenopus un chiaro ruolo nella determinazione dell'asse animale vegetativo.
Un caso particolare è quello dell'embrione di riccio di mare; in esso fu per primo descritto agli inizi del Novecento, a seguito di esperimenti di microchirurgia tra i quali primeggiano quelli dello svedese S. Hörstadius, il fatto che l'asse animale vegetativo è già fissato nell'uovo vergine. Un altro svedese, J. Runnström, elaborò, per spiegare questa circostanza, la teoria dei gradienti: secondo questa teoria una o più sostanze animalizzanti hanno un massimo di concentrazione al polo animale e divengono sempre meno concentrate via via che ci si sposta verso il polo vegetativo; viceversa, una o più sostanze vegetativizzanti hanno il massimo di concentrazione al polo vegetativo e divengono sempre meno concentrate verso il polo animale. Nel passato, una grande quantità di esperimenti ha cercato invano di identificare quali molecole costituiscano questo gradiente, fino a che, nel 1994, fu trovato che tre RNA messaggeri e le rispettive proteine facenti parte della superficie, ma anche del citoplasma dell'uovo vergine, dette BEP (Butanol extracted proteins), sono localizzati nella parte animale dell'uovo, mentre mancano nella parte vicina al polo vegetativo. Vi è anche indicazione che queste proteine possano avere un ruolo nella determinazione dell'asse animale-vegetativo, perché anticorpi contro di esse provocano ipersviluppo delle parti vegetative.
Lo stabilirsi degli assi embrionali è stato anche molto studiato rispetto ad alcuni segmenti del corpo; due tra questi hanno ricevuto particolare attenzione: l'arto e il sistema nervoso centrale. Per quanto riguarda l'arto, vediamo che ancora una volta si sono prese le mosse da quanto noto in Drosophila, per vedere quali eventi molecolari siano stati evolutivamente conservati per specificare lo stabilirsi degli assi. Molto interesse ha destato di recente la scoperta di un nuovo gene, detto fringe, che in Drosophila localizza il suo prodotto nella faccia dorsale dell'ala fino al suo confine con la faccia ventrale. Esso trova un omologo (detto radical fringe) anche nell'abbozzo dell'arto dei Vertebrati, dove è espresso pure nella faccia dorsale dell'abbozzo fino al margine tra la faccia ventrale e quella dorsale. Anche altri geni che sono attivi per specificare gli assi dell'ala di Drosophila trovano omologhi (cioè geni con sequenze simili) attivi nella specificazione degli assi dell'arto dei Vertebrati, ma per questi l'omologia di posizione non è conservata, perché, per es., il prodotto del gene en si trova dorsalmente in Drosophila e ventralmente nel pollo; wg specifica l'asse prossimo-distale in Drosophila e il suo omologo wnt l'asse dorso-ventrale nel pollo, tuttavia con una cascata di eventi che è analoga a quella di Drosophila.
Un altro esempio di conservazione parziale di geni e segnali nello stabilirsi degli assi dell'arto è dato dal ligando prodotto dal gene hedgehog, che passa il segnale al recettore prodotto dal gene patched nello stabilirsi dell'asse antero-posteriore dell'ala di Drosophila e dell'arto dei Vertebrati; in questi ultimi, però, a tali segnali segue l'attivazione dei geni Hox, cosa che non accade in Drosophila. Per quanto concerne i Vertebrati, inoltre, ha avuto molto seguito l'idea che l'acido retinoico giochi un ruolo centrale nello stabilirsi dell'asse antero-posteriore dell'arto. Tuttavia, mentre rimangono valide le osservazioni sulla sua efficacia sperimentale, meno certo è il suo ruolo in natura, anche se questo è oggi sostenuto, tra l'altro, dall'esito di esperimenti di inibizione della sintesi di acido retinoico endogeno mediante citrale.
La funzione dei geni Hox, insieme a quella dell'acido retinoico, è stata particolarmente studiata e accertata nello stabilirsi dell'asse antero-posteriore del tubo neurale dei Vertebrati.
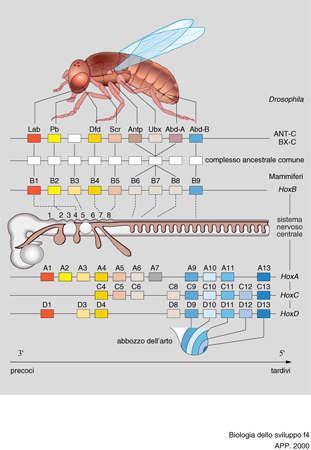
I geni Hox sono così chiamati perché contengono un 'omeobox', simile a quello dei geni omeotici di Drosophila; in particolare essi contengono l'informazione per un tipo di fattori di trascrizione la cui conformazione è detta elica-giro-elica. Geni Hox, regolati nella loro trascrizione dall'acido retinoico, sono situati sul cromosoma in una sequenza che indica anche l'ordine della loro funzione nell'organismo, per cui si parla di colinearità; infatti quelli situati più vicino all'estremo 3′ del cromosoma agiscono sulle parti più vicine all'estremo anteriore del corpo, e viceversa quelli situati più vicino all'estremo 5′. Oltre a questa colinearità spaziale esiste nei Vertebrati anche una colinearità temporale, in quanto si esprimono prima nello sviluppo i geni Hox più vicini all'estremo 3′ e poi quelli più vicini all'estremo 5′ (fig. 4).
I geni Hox sono stati studiati nel topo e nell'uomo (dopo che in Drosophila), e si è visto che in questi organismi sono situati su quattro cromosomi diversi, in raggruppamenti chiamati da 1 a 4 (o da A a D), formati ciascuno da 9 a 13 geni. Questi geni sono allineati su ogni cromosoma in modo che quelli a sequenza simile cadano sulla stessa verticale, se i cromosomi vengono disegnati l'uno sull'altro. I geni sulla stessa verticale vengono detti paraloghi. Le mutazioni dei geni Hox causano nei Vertebrati, oltre ai già accennati difetti degli arti, difetti della formazione ordinata delle strutture nervose. Molti studi in proposito sono stati centrati sul romboencefalo, che è diviso in segmenti successivi chiamati rombomeri; in questi è stato riscontrato che i prodotti dei geni Hox si trovano allineati su gruppi formati ciascuno da due rombomeri, nello stesso ordine nel quale i geni si trovano allineati sul cromosoma. La mancata localizzazione di tali prodotti per mutazione provoca difetti della struttura corrispondente; mentre la loro localizzazione in rombomeri diversi fa sì che questi ultimi acquistino la struttura dei rombomeri cui apparteneva il prodotto genico. Ciò fa pensare che essi agiscano similmente ai geni omeotici in Drosophila, cioè specificando l'identità dei singoli segmenti metamerici. Poiché la localizzazione dei prodotti dei geni Hox mostra un ordine anche nelle creste neurali, nel mesoderma parassiale e negli archi branchiali, difetti di questi geni causano anche difetti delle strutture craniofacciali.
Molta parte di questi lavori, che consentono di riferire l'effetto di un gene sullo sviluppo di una parte di un organismo, si è resa possibile nel topo, grazie all'evoluzione della tecnica della distruzione genica mirata. Con tale tecnica si introduce per trasfezione in colture di cellule di topo ancora totipotenti un frammento di DNA che, per l'affinità delle sue estremità, si inserisce per ricombinazione omologa in un gene prescelto, interrompendone così la sequenza e pertanto rendendolo non funzionale. A questo punto le cellule così trasformate vengono microiniettate in una blastocisti di topo; qui esse si mescoleranno alle altre e andranno a far parte di vari organi. In qualche caso esse faranno parte delle gonadi: nasceranno animali transgenici le cui uova o spermi avranno una mutazione ereditabile del gene scelto. Operando gli opportuni incroci, si selezioneranno linee omozigote, nelle quali la mutazione sia presente in tutti e due i cromosomi, e si osserverà quale organo si sviluppa con difetti a causa della mutazione di quel gene.
Gli studi sul meccanismo dell'induzione negli Anfibi sono stati ripresi con molto vigore nell'ultimo decennio, ma l'attenzione si è spostata soprattutto dall'induzione neurale al meccanismo di induzione del mesoderma da parte delle cellule dell'emisfero vegetativo della blastula dell'anfibio Xenopus laevis. Inizialmente, sembrò che questo problema fosse risolto con l'isolamento di sostanze induttrici, come il cosiddetto MIF (Mesoderm inducing factor), e in un secondo momento con l'identificazione di questo con il citato Vg1 e poi con l'attivina. Il prosieguo delle ricerche ha messo però in evidenza che anche altre sostanze possono operare questa induzione, e che la situazione è più complessa di quanto si fosse inizialmente pensato. Questa linea di ricerca, comunque, suggerisce che l'induttore naturale più probabile del mesoderma in generale sia da considerarsi il Vg1.
Molta attenzione ha ricevuto, sempre in questo ultimo decennio, lo studio dei meccanismi molecolari per il differenziamento di alcune strutture embrionali. Lo studio di due di esse, in particolare, ha fornito informazioni che riguardano anche settori di grande attualità, come quello delle interazioni cellulari e della trasduzione del segnale.
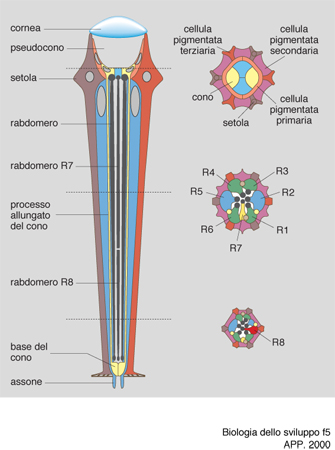
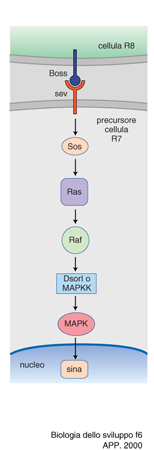
Il primo di questi studi riguarda il differenziamento della cellula R7 della retina di Drosophila. Ogni ommatidio della retina di Drosophila è composto da 20 cellule, 8 delle quali sono fotorecettori disposti a forma di rosetta e numerati da 1 a 8 (fig. 5). Per il differenziamento del fotorecettore detto R7, la cellula R8 esprime sulla sua superficie la proteina Boss (Bride of sevenless). Questa proteina stimola il recettore a tirosina chinasi situato sulla superficie di R7, detto appunto sevenless, perché se esso è mutato la cellula R7 non si differenzia. Il recettore così stimolato si autofosforila nell'amminoacido tirosina e manda un segnale a un'altra proteina, la Sos (Son of sevenless); il segnale viene mediato dalla proteina Drk, capace di riconoscere, da un lato, le tirosine fosforilate di sevenless e, dall'altro, le zone ricche in prolina di Sos. Quest'ultimo viene così attivato e attiva a sua volta la già citata proteina Ras, dando inizio alla nota cascata di eventi che caratterizza la trasduzione del segnale. Questo, infatti, viene passato alla proteina Raf, la quale a sua volta attiva Dsori, una chinasi di chinasi (MAPKK), cioè una proteina che ne fosforila un'altra che è anch'essa una chinasi, prodotta dal gene detto rolled. Quest'ultima infine fosforila un fattore di trascrizione, il sina (seven in absentia), che attiva un segmento specifico del DNA, probabilmente con il concorso dei geni fos e jun e con una modulazione negativa da parte dei geni detti pokkury e tramtrack. Di recente è stata descritta la proteina Dos, (Daugther of sevenless, con l'evidente intento umoristico di arricchire la famiglia), che si collocherebbe prima di Ras e sarebbe capace di sostituire Drk. La catena di chinasi descritta viene detta delle MAP chinasi (MAP=Mitosis activating proteins), perché queste proteine con le loro fosforilazioni a catena possono attivare la mitosi, ovvero portare all'attivazione di un gene specifico. (fig. 6).
Grande interesse ha suscitato qualche anno fa (1995) la pubblicazione di un lavoro, nel quale W. Gehring e collaboratori riuscivano a fare produrre degli occhi ectopici in Drosophila, facendo esprimere ectopicamente il gene eyeless. È questo un gene altamente conservato in Vertebrati e Invertebrati, equivalente al gene Pax, detto anche small eye nel topo, e aniridia nell'uomo. Se si fa esprimere ectopicamente il gene small eye di topo in Drosophila, si hanno occhi ectopici di Drosophila. La teoria che ne è seguita è che questi geni siano dei master control, cioè degli interruttori generali da cui dipende lo sviluppo di un determinato organo, e la cui funzione è di dare il via a tutta una serie di eventi specifici, che portano alla formazione di quell'organo.
Il secondo sistema che ha ricevuto grande attenzione, e al quale accenneremo qui, è quello del differenziamento della vulva nel verme a sezione tonda Caenorhabditis elegans. In questo una serie di sei cellule forma un cosiddetto gruppo di equivalenza, nel quale cioè ciascuna cellula può rimpiazzare le altre se queste vengono distrutte, ma che normalmente, per l'effetto di vari stimoli provenienti da altre cellule, hanno ciascuna un destino diverso nella formazione della vulva. I segnali meglio conosciuti sono quelli provenienti da una cellula, detta ancora, situata al di sopra di queste sei; questa secerne la proteina lin3, simile a un fattore di crescita, che viene ricevuta da un recettore a tirosina chinasi, il let23, situato sulla cellula più vicina (chiamata P6); da qui il segnale passa a un adattatore tipo Drk, il sem5, che lega a valle una proteina probabilmente tipo Sos di Drosophila; questa attiva una proteina tipo Ras, la let60, che a sua volta attiva una proteina tipo Raf, la lin45. Segue a questo punto il rimanente della cascata delle MAP chinasi, che culmina con la modulazione dell'attività di due 'fattori di trascrizione', lin31 e lin1.
Ogni giorno vengono scoperti nuovi geni i cui prodotti influenzano, positivamente o negativamente, i destini della cellula P6 e di quelle vicine ai fini della formazione della vulva.
Un altro sistema biologico, molto usato in quest'ultimo decennio per lo studio della b. dello s., è quello dell'ameba acrasiale Dictyostelium discodeum, che, pur non presentando una vera e propria organogenesi, va incontro a un vero sviluppo di parti complesse a partire da semplici amebe. Essa infatti vive in forma di singole amebe che stanno libere sul terreno finché c'è nutrimento, cioè batteri, in abbondanza. Se questo scarseggia, però, esse si aggregano e si differenziano. Formano dapprima ammassi a forma di sezione di sfera (stadio di collinetta); ciascuna collinetta forma poi una punta rivolta verso l'alto (stadio di punta); quindi si piega da un lato e comincia a migrare sul terreno come una specie di lumacone; questo a un certo momento si ferma e si appiattisce sul terreno, prendendo la forma di una specie di cappello messicano, la cui punta si dirige di nuovo verso l'alto (stadio di culminazione), spingendosi poi a formare una specie di stelo, in cima al quale si forma una sferetta. All'interno di questa sfera, denominata corpo fruttificante, si differenziano delle spore. Queste cadono sul terreno e lì rimangono dormienti; se però nel terreno ricompare il nutrimento, le spore si schiudono e ne fuoriescono le amebe che riprendono a nutrirsi, e il ciclo può ricominciare.
L'interesse degli studiosi per questo sistema si è appuntato fondamentalmente su tre fenomeni: il meccanismo di aggregazione; il meccanismo della sintesi di proteine differenti in momenti diversi dello sviluppo; i geni che regolano le singole fasi di questo. Per la riaggregazione è stato dimostrato il ruolo fondamentale della sintesi e rilascio dell'AMP ciclico, nonché della sua distruzione periodica e dei recettori per esso, situati sulla membrana cellulare. Per quanto riguarda il meccanismo che regola la sintesi proteica, numerosi studi hanno portato all'identificazione di un gran numero di proteine specifiche dei vari stadi di sviluppo o delle varie parti dell'aggregato, come, per es., stelo o spore, che sono riconoscibili anche in stadi precedenti. Questo riconoscimento si è potuto realizzare grazie alla possibilità di introdurre nelle amebe costruzioni artificiali di DNA contenenti il promotore del gene per la proteina da studiare (cioè il frammento di DNA necessario per attivare la trascrizione del gene), seguito da un cosiddetto gene rivelatore (cioè da un gene il cui prodotto proteico sia facilmente riconoscibile, per es. attraverso una reazione colorata). Si guarda poi in quali cellule compare il prodotto del gene rivelatore.
Interesse suscitò la scoperta, nel 1983, di un morfogeno, il cosiddetto DIF (Differentiation inducing factor), che è un cloro-alchilfenone, disposto in gradiente all'interno del lumacone, e che induce il differenziamento dello stelo.
Tra i sistemi più usati negli ultimi venti anni per chiarire il meccanismo di regolazione della sintesi proteica nelle varie fasi dello sviluppo, spicca l'embrione del riccio di mare. Della miriade di esperimenti condotti in proposito paiono particolarmente importanti quelli rivolti a caratterizzare i fattori di trascrizione (cioè proteine che legano il promotore e attivano la trascrizione del DNA) dei geni per le varie proteine stadio-specifiche, per misurarne la quantità in vivo. La tecnica consiste nell'iniettare nell'uovo quantità crescenti di frammenti di promotore di DNA e misurare a quale quantità iniettata la sintesi della proteina corrispondente si ferma, perché il fattore di trascrizione è stato tutto sequestrato dai frammenti iniettati.
Un concetto che è stato di recente ribadito, attraverso gli esperimenti di clonazione (v. App. V e in questa Appendice) di ovini mediante il trapianto di un nucleo di una cellula da animale adulto in ovocita privato del suo nucleo, è quello che lo sviluppo non si attua tramite modifiche del DNA, il quale, salvo alcuni casi, mantiene tutte le sue potenzialità. Bisogna precisare che la cosa non è così schematica, perché, come era da tempo noto, la capacità di un nucleo di sostenere lo sviluppo di un animale fino all'età adulta, quando esso viene trapiantato in un ovocita enucleato, declina con l'età dell'embrione donatore del nucleo. Inoltre, è stato da tempo discusso il possibile ruolo che la metilazione del DNA può avere nel regolare l'espressione dei geni che vengono trascritti solo in determinati tessuti.
A proposito di metilazione del DNA, ha ricevuto molta attenzione in questi ultimi anni il cosiddetto fenomeno dell'imprinting genomico. Esso deriva dall'osservazione che, se si inietta un secondo pronucleo femminile in un ovocita di topo, ottenendo così uno zigote ginogenone, o se si iniettano due pronuclei maschili in un ovocita di topo enucleato, ottenendo così uno zigote androgenone, si hanno anormalità dello sviluppo. Questa osservazione ha portato a concludere che i cromosomi di origine paterna e di origine materna portano informazioni che differiscono tra loro in qualche modo. Molti lavori si sono accumulati per spiegare in che cosa consistano queste differenze. La conclusione principale è che esse siano probabilmente dovute a una metilazione di siti particolari dei cromosomi paterni o materni nel momento della meiosi.
Lo sviluppo inizia con la fecondazione in gran parte dei casi, e ai meccanismi che a essa presiedono in termini molecolari è stata dedicata molta attenzione in quest'ultimo decennio. Alcuni modelli teorici, come quello del riccio di mare, di roditori o di suidi, hanno contribuito a chiarire alcuni meccanismi base. Una delle scoperte di maggior rilievo è stata quella del sistema di ancoraggio tra spermio e uovo nel riccio di mare: è stata identificata la proteina binding dello spermio e, inoltre, è stata isolata e determinata la sequenza del recettore per lo spermio sulla superficie dell'uovo.
Uno dei fenomeni generali che si osservano alla fecondazione è l'aumento del calcio libero, seguito da una serie di oscillazioni di quest'ultimo nei momenti immediatamente successivi. Due teorie si sono fronteggiate sui meccanismi che avviano tale aumento: la prima sostiene che è sufficiente che lo spermio tocchi la superficie dell'uovo per scatenare una serie di reazioni dipendenti o da proteine G (cioè che legano nuleotidi guaninici) di membrana o da un recettore a tirosina chinasi, culminanti con la formazione di inositolo trifosfato e diacilglicerolo, responsabili della liberazione di calcio dalle riserve. Questa teoria si basa, tra l'altro, sull'osservazione che nel riccio di mare la microiniezione dello spermio, senza che questo interagisca pertanto con la membrana dell'uovo, non provoca fecondazione. Va però osservato che così non è per l'uovo di alcuni Mammiferi. La seconda teoria obietta che vi è un intervallo troppo lungo tra il contatto con lo spermio e la liberazione di calcio perché la prima sia vera. Propone, dunque, che ciò sia dovuto al fatto che lo spermio deve fondere la sua membrana con quella dell'uovo e versarvi dentro una sostanza che provocherà la liberazione di calcio. Alcuni autori sostengono che, nel caso di molti Invertebrati marini, questa sostanza sia proprio il calcio. La teoria della sostanza versata dallo spermio ha ricevuto di recente notevole sostegno dall'isolamento dagli spermi di criceto di una sostanza, battezzata oscillina, che, se iniettata negli ovociti di topo, vi provoca le stesse oscillazioni del calcio libero causate dalla fecondazione.
Le principali conclusioni dei molti esperimenti condotti sulla fecondazione in sistemi modello di mammifero possono essere così schematizzate: una proteina della supeficie dello spermio, probabilmente la galattosiltrasferasi (candidati minori essendo la p56, una proteina di membrana, e la p95, una proteina fosforilata in tirosina), liberatasi dagli zuccheri suoi substrati durante il cosiddetto processo di capacitazione, lega gli zuccheri tipo galattosio o glucosamine legati alla glicoproteina ZP3, che fa parte dell'involucro dell'uovo ('zona pellucida'). A questo punto, probabilmente attraverso un legame tra le varie molecole di galattosiltrasferasi della superficie dello spermio, si ha un'attivazione dei recettori per l'inositolo trifosfato, con conseguente aumento del calcio intracellulare dello spermio e rottura della membrana acrosomale di questo. Dopo tale reazione acrosomale, un complesso proteico della superficie dello spermio, battezzato fertilina, lega una proteina della superficie dell'uovo, probabilmente un'integrina.
Mentre la fecondazione rappresenta l'evento iniziale dello sviluppo, il differenziamento dei gameti rappresenta un evento di grande specializzazione, del quale a lungo si sono occupate anche discipline come la biologia cellulare e la genetica. In questi ultimi anni la b. dello s. ha appuntato la propria attenzione sul meccanismo di maturazione degli ovociti. Tra quelli che hanno permesso di raggiungere le conclusioni più complete, anche se non ancora definitive, si annoverano gli ovociti nell'anfibio Xenopus e nella stella di mare Asterias. Il primo è fermo nella diplotene della prima profase meiotica, perché il fattore che promuove la maturazione, detto MPF (Mitosis promoting factor), è inattivo perché fosforilato in una particolare tirosina. A un certo momento l'ormone progesterone stimola la traduzione del messaggero dell'oncogene mos, attraverso il legarsi di una proteina detta CPEB (Cytoplasmic polyadenilation element binding) a una sequenza del messaggero detta CPE (Cytoplasmic polyadenilation element); il che stimola l'aggiunta di una sequenza di acido poliadenilico alla estremità 3′ del messaggero, consentendone così la 'traduzione'. Su questo messaggero viene prodotta allora la proteina pp39mos. A valle di pp39mos agiscono Raf e le altre MAP chinasi descritte, che, con modalità ancora oggetto di studio, consentono l'attivazione del MPF, la rottura della vescicola germinale e il raggiungimento della seconda metafase meiotica, dove la maturazione dell'ovocita si ferma per l'azione di un cosiddetto fattore citostatico (CSF). Alla fecondazione, il descritto aumento del calcio libero inattiva il CSF: ciò consente il prosieguo della divisione cellulare con l'emissione dei globuli polari e la prima divisione dello zigote.
Anche l'ovocita di Asterias è fermo nella prima profase meiotica. Durante la stagione riproduttiva le cellule follicolari, che circondano l'ovocita, producono un recettore per le gonadostimoline; queste allora stimolano le cellule follicolari a produrre un particolare ormone, la 1metil-adenina. A questo punto un ormone di natura peptidica, prodotto dal nervo radiale, stimola le cellule follicolari a rilasciare la 1metil-adenina. Questa si porta sulla superficie dell'ovocita, dove stimola l'attivazione di una proteina G, la quale provoca una cascata di eventi che culminano con l'attivazione del MPF e la rottura della vescicola germinale.
Un argomento che ha destato molto interesse in passato è quello della rigenerazione. Negli ultimi anni si sono accumulati lavori principalmente sui meccanismi di rigenerazione nello cnidario Hydra e, di recente, sono stati prodotti dati di estremo interesse sui meccanismi di rigenerazione del sistema nervoso centrale dei Mammiferi. La teoria corrente è che in Hydra vi sia un gradiente di sostanze che stimolano o inibiscono la rigenerazione della testa da una parte e quella del piede dall'altra. Si è purificato, per es., un undecapeptide che stimola la formazione della testa, nonché un peptide di 13 amminoacidi, il pedina, che sembra stimolare la rigenerazione del piede. Una teoria corrente sul meccanismo di azione dell'attivatore della rigenerazione della testa sostiene che questo leghi un recettore che attiva l'adenilato ciclasi; l'AMP ciclico così prodotto stimola la PKA (proteina chinasi dipendente da cAMP), questa fosforila allora la proteina CREB (cAMP responding element binding), che lega ora la sequenza CRE (cAMP responding element) del promotore di alcuni geni, che vengono così attivati. Lungo l'asse del corpo di Hydra esisterebbe un gradiente testa-piede di recettori per l'attivatore della testa.
Anche in Hydra si è indagato se geni che regolano la crescita in Drosophila siano pure attivi nella rigenerazione. In quest'ottica si sono purificati da Hydra alcuni geni provvisti di omeobox; tra questi, quello detto Cnox2 (omologo del gene deformed di Drosophila) appare implicato nella rigenerazione del piede, come il prodotto del gene CnNK-2, mentre i prodotti di alcuni geni della famiglia detta fork head si accumulano nelle zone di rigenerazione della testa.
Riguardo alla rigenerazione di nervi nel sistema nervoso centrale (SNC) di mammifero, si è ipotizzato che essa sia inibita dalla mielina. Si sa infatti che la mielina è prodotta dalle cellule di Schwann per quanto riguarda il sistema nervoso periferico, nel quale i nervi rigenerano, e invece dagli oligodendrociti nel SNC. Ha destato interesse un recente esperimento, nel quale anticorpi contro la mielina del SNC hanno consentito una qualche rigenerazione dei nervi in quest'ultimo. Una qualche rigenerazione di nervi nel SNC si ha anche in topi transgenici che sintetizzano un eccesso della proteina detta GAP-43 (Growth associated protein). Interesse ha destato anche la recente osservazione che, in espianti di retina nei quali i nervi derivanti dalle cellule gangliari vanno a innervare in vitro le cellule del tubercolo quadrigemino superiore, l'innervazione si ferma a seguito del taglio del neurite delle cellule gangliari, ma, al contrario, procede, se le cellule provengono da topi mutanti che producono un eccesso della proteina bcl-2 (B cell leukemia-2). Ciò è interessante anche perché questa proteina ha sequenza simile alla proteina ced-9, una delle proteine implicate nell'inibizione della morte cellulare programmata in Caenorhabditis.
In questi ultimi anni un nuovo materiale è emerso come sistema modello per gli studi di biologia dello sviluppo. Si tratta del pesce teleosteo Danio rerio. Le caratteristiche che lo rendono particolarmente interessante per questi studi sono: la possibilità di fecondare una grande quantità di uova e ottenerne altrettanti embrioni trasparenti, il cui sviluppo è facile da osservare; di produrre sperimentalmente con facilità una grande quantità di mutanti e riferire a particolari geni particolari alterazioni dello sviluppo; di trapiantare cellule singole o a gruppetti, per es. da mutanti, e seguirne il destino; l'estesa mappatura del genoma che è stata realizzata in questi anni. Tutto ciò ha fatto sì che il numero dei lavori su questo materiale sia oggi in vertiginosa crescita.
bibliografia
E. Boncinelli, Biologia dello sviluppo, Roma 1994.
S.F. Gilbert, Developmental biology, Sunderland (Mass.) 1997.
W.E. Muller, Developmental biology, New York-Berlin-Heidelberg 1997.
L. Raunich, G. Giudice, H. Manelli, Biologia dello sviluppo. Embriologia generale molecolare e comparata, Padova 1998.
Biologia dello sviluppo vegetale
di Ida Albanese
Gli studi della b. dello s. vegetale, stimolati negli anni Ottanta e Novanta dai successi conseguiti nell'analisi dei meccanismi di sviluppo negli animali, si sono prevalentemente concentrati sulle piante evolute, le Angiosperme o piante a fiore. Poiché queste, malgrado la diversità delle loro forme, costituiscono un gruppo di organismi abbastanza omogeneo dal punto di vista biologico, dallo studio di un piccolo numero di specie scelte come sistema modello è possibile ottenere informazioni valide per tutte le Angiosperme.
Nell'analizzare i processi che regolano il loro sviluppo, conviene ricordare che nelle piante la crescita, determinata dall'aumento sia nel numero che nelle dimensioni delle cellule, e l'organogenesi continuano per tutta la vita. Inoltre, dato che le loro cellule, avvolte da una parete rigida, sono incapaci di movimento, nelle piante non si verificano quei processi di migrazione di singole cellule o di interi foglietti cellulari tanto importanti per la morfogenesi negli animali. L'acquisizione di una specifica dimensione e forma da parte dei vari organi di una pianta, così come la posizione in cui questi ultimi si formano, sono pertanto il risultato di sofisticati controlli sull'attività proliferativa di singole cellule o gruppi di esse, sull'orientamento del loro piano di divisione, sul grado e sulla direzionalità del loro accrescimento. La regolazione di tali processi dipende in modo fondamentale dalla comunicazione fra le cellule, che si scambiano segnali sia per interazione fra molecole di membrana con funzione recettoriale e molecole, secrete o di membrana, con funzione di ligando, sia attraverso ponti citoplasmatici (plasmodesmi) fra cellule adiacenti, il cui diametro e la cui stessa formazione o eliminazione possono essere opportunamente regolati; attraverso di essi possono selettivamente essere trasportate da una cellula all'altra anche intere proteine e/o i loro mRNA. Metabolismo, proliferazione, accrescimento, differenziamento e senescenza cellulare sono poi regolati anche da altri fattori, fra cui i fitormoni (auxine, gibberelline, acido abscissico, citochinine, etilene) e i brassinosteroidi.
L'importanza della comunicazione fra le cellule è dimostrata dal fatto che il loro differenziamento è determinato, nella maggior parte dei casi, dalla posizione delle cellule stesse nell'organismo, e non dall'identità delle loro progenitrici. A differenza che negli animali, lo stato differenziato delle cellule vegetali, inoltre, è in molti casi reversibile; in opportune condizioni esse sono infatti in grado di convertirsi in un tipo cellulare diverso da quello originario, o addirittura di rigenerare un intero nuovo organismo. Talvolta ciò avviene ripercorrendo le stesse tappe di sviluppo che si osservano nell'embriogenesi conseguente a fecondazione, per cui nelle piante si può parlare di un'embriogenesi 'somatica' oltre che di un'embriogenesi 'zigotica'. Anche in quest'ultimo caso, del resto, e al contrario di quanto avviene negli animali, i gameti derivano da cellule somatiche inizialmente non diverse dalle altre. Infatti, raggiunta la fase riproduttiva, nella pianta si formano, ripetutamente e in varie posizioni lungo il suo corpo, i fiori; nelle antere dei loro stami e nell'ovario dei loro carpelli alcune cellule vanno incontro a meiosi formando spore aploidi che, attraverso poche divisioni mitotiche, formano i gametofiti, femminile (sacco embrionale) o maschile (granulo pollinico); una delle loro cellule diventerà il gamete.
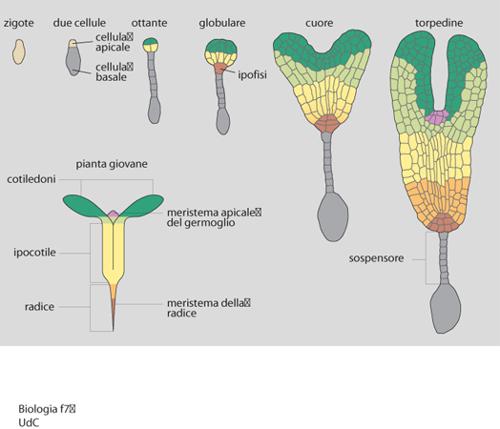
L'embriogenesi zigotica inizia con la fecondazione dell'oosfera, una delle otto cellule aploidi del sacco embrionale, da parte di uno dei due nuclei germinativi del granulo pollinico, veicolati dal tubulo pollinico all'interno del sacco embrionale stesso (l'altro nucleo feconderà la cellula centrale, binucleata, del sacco embrionale per dare l'endosperma, triploide). Essa termina con la formazione del seme, quiescente fino al momento in cui particolari condizioni ambientali ne determineranno la germinazione. L'embrione maturo è un organismo molto semplice, costituito da meristema apicale del germoglio (SAM, Shoot apical meristem), cotiledoni, ipocotile, radichetta embrionale e meristema della radice. La crescita e l'organogenesi, cioè la formazione di fusto, foglie, radici, fiori, si realizzano dopo la germinazione, per proliferazione, espansione e differenziamento di cellule derivate dai meristemi embrionali, a cui si aggiungono anche meristemi secondari. Tuttavia, l'organizzazione fondamentale del corpo della pianta (asse apicale/basale e pattern radiale) si determina già fin dalle prime fasi dello sviluppo. Ciò è rivelato da recenti studi condotti prevalentemente sulla dicotiledone Arabidopsis thaliana (una crucifera), nel corso dei quali sono state generate decine di mutanti con alterazioni in specifiche tappe dell'embriogenesi. I risultati di tali studi, in parte riportati in seguito, dimostrano anche quanto la corretta esecuzione delle divisioni cellulari sia importante perché si realizzino i giusti rapporti spaziali fra le cellule, e di conseguenza le appropriate interazioni cellulari e la normale morfogenesi dell'embrione, oltre che per la segregazione di specifici destini e, quindi, per il differenziamento di particolari tipi cellulari.
Lo zigote, dividendosi asimmetricamente, genera due cellule diverse per dimensioni e per destino (fig. 7). Quella apicale, più piccola, darà luogo a quasi tutto l'embrione; da quella basale si formerà una colonna di cellule (il sospensore), struttura extraembrionale con funzione di sostegno e che, in Arabidopsis thaliana, collegando l'embrione all'endosperma, lo rifornisce di sostanze nutritive. Fra tutte le cellule derivate dalla cellula basale, solo quella superiore, denominata ipofisi, genererà strutture embrionali (una parte della radice), dopo essere andata incontro a una divisione asimmetrica. Dalla cellula apicale, attraverso due divisioni verticali seguite da una orizzontale, si forma un proembrione con otto cellule disposte in due anelli sovrapposti. A questo stadio (denominato ottante) è già definito il futuro asse apicale/basale della pianta: dall'anello superiore, o regione apicale, deriveranno il SAM e, in parte, i cotiledoni, mentre quello inferiore, o regione centrale, genererà parte dei cotiledoni, l'ipocotile e la radice embrionale con le cellule iniziali (cellule staminali) della radice; la regione basale dell'embrione, da cui si forma il resto del meristema radicale, deriva dall'ipofisi, che a questo stadio si divide in una cellula superiore, più piccola, progenitrice delle quattro cellule del centro quiescente della radice, e una cellula più grande, inferiore, che originerà le cellule centrali della cuffia radicale (columella).
Le divisioni asimmetriche dello zigote e dell'ipofisi sono fra i pochi esempi di determinazione del destino di una cellula vegetale, in base alla sua origine e non alla sua posizione. In Arabidopsis thaliana, mutazioni nel gene gnom, il cui prodotto potrebbe essere implicato in processi secretori, provocano una divisione quasi simmetrica dello zigote, oltre che anomalie nei successivi piani di divisione, e causano profonde alterazioni dello sviluppo embrionale lungo l'intero asse apicale/basale. Mutazioni del gene hobbit (hbt), che rendono simmetrica la divisione dell'ipofisi, causano la completa assenza del meristema della radice e della radice stessa. Il fatto che non si formi neppure quella parte di radice normalmente derivata dalla regione centrale rivela, poi, l'importanza di interazioni fra la regione basale e quella centrale. Ciò è confermato dall'effetto di mutazioni in un altro gene, monopteros (mp), che alterano l'orientamento delle divisioni nella regione centrale dell'embrione. In conseguenza di ciò, la cellula all'estremità superiore del sospensore non si differenzia più in ipofisi ma, dividendosi simmetricamente, si comporta come le altre cellule del sospensore; mp è dunque necessario per lo sviluppo sia dell'ipocotile che della radice. Un altro gene che controlla lo sviluppo di una specifica regione dell'embrione, quella apicale, è gurke, le cui mutazioni provocano assenza del SAM e dei cotiledoni. Poiché non si forma neppure quella parte di cotiledoni normalmente generata dalla regione centrale, questo processo dipende da interazioni fra cellule delle due regioni. A differenza di altri geni (per es., fass, fackel), le cui mutazioni, pur provocando una disorganizzazione delle strutture embrionali e alterazioni morfologiche, non pregiudicano il corretto differenziamento dei vari tipi cellulari, gnom, hbt, mp e gurke hanno dunque un ruolo fondamentale in fasi cruciali dello sviluppo.
La quarta divisione delle cellule embrionali, di tipo periclinale, genera uno strato di cellule interno e uno esterno, con destini diversi; in quello esterno (protoderma) le cellule cominciano subito a esprimere alcuni geni epidermide-specifici. Nei mutanti nel gene knolle, il cui prodotto è coinvolto nella formazione delle pareti cellulari, questi geni sono espressi anche dalle cellule interne; l'incompleta chiusura delle pareti cellulari impedirebbe la separazione funzionale dei due strati.
Le successive divisioni embrionali sono per la maggior parte dette 'morfogenetiche', perché il loro corretto orientamento determina la forma dell'embrione, ma non la segregazione di specifici destini cellulari. Tuttavia, man mano che l'embrione passa dallo stadio di ottante a quelli detti 'globulare', 'a cuore' e 'a torpedine', specifiche divisioni, periclinali, delle cellule interne della regione centrale (che forma l'asse ipocotile/radice) generano progressivamente, e presumibilmente sotto il controllo di geni specifici, il pattern radiale, cioè una serie di anelli concentrici con caratteristiche differenti: cortex, endoderma, periciclo, tessuto vascolare, in aggiunta al protoderma (epidermide). Le dimensioni radiali di ciascun anello aumentano poi per divisioni anticlinali delle cellule, mentre loro ulteriori divisioni, trasversali, e successiva espansione causano l'allungamento complessivo dell'asse. Meccanismi molecolari ancora non identificati devono garantire un accrescimento coordinato di tutti gli strati cellulari.
Due geni necessari perché da un singolo anello di cellule iniziali si generino due anelli di cellule, progenitrici rispettivamente del cortex e dell'endoderma, sono scarecrow (scr) e shortroot (shr). Nei mutanti in scr, il cui prodotto potrebbe essere un fattore trascrizionale, è presente un singolo strato, con caratteristiche miste di cortex ed endoderma; scr sembra quindi necessario per la formazione di due distinti tipi cellulari, ciascuno dei quali esprime un solo destino tra i due possibili. Invece shr, le cui mutazioni causano assenza di endoderma e formazione del solo cortex, appare essenziale per determinare il destino 'endoderma'. Altri studi sulla radice rivelano che il tipo di differenziamento a cui va incontro ogni cellula, inizialmente specificato nella sede in cui essa si origina, viene determinato definitivamente, o modificato, da segnali trasmessi dalle cellule adiacenti, e può essere alterato con opportune micromanipolazioni sperimentali.
Nella regione apicale si distinguono due popolazioni di cellule. La prima, localizzata nelle aree laterali, costituisce i primordi dei cotiledoni, e il suo rapido accrescimento conferisce una simmetria bilaterale all'embrione, che a questo stadio è detto a cuore. La seconda, che si evidenzia un po' più tardi in un'area centrale, è il SAM, da cui deriverà tutta la porzione aerea della pianta; consiste di un gruppetto di cellule indifferenziate, disposte in tre strati sovrapposti a formare una cupoletta fra i due cotiledoni.
Le cellule subepidermiche del SAM esprimono il gene shoot meristemless (stm), le cui mutazioni provocano assenza completa di SAM. Il suo prodotto, essenziale perché cellule embrionali in questa posizione proliferino e/o acquisiscano (e mantengano nel tempo) l'identità di 'meristema apicale', è un fattore di trascrizione con dominio omeobox di legame al DNA, omologo a knotted 1 di mais. Knotted 1, il primo gene con dominio omeobox identificato in una pianta e capostipite di una famiglia di geni, molti dei quali in mais risultano importanti per lo sviluppo dei primordi delle foglie, controllando in essi la proliferazione di specifici gruppi di cellule. Ancora, in Arabidopsis thaliana, il gene wuschel sembra necessario per diversificare la regione centrale del SAM, dove le cellule devono restare indifferenziate e con proprietà staminali, da quelle periferiche - con più intensa attività proliferativa e da cui si formano i primordi dei vari organi della pianta adulta -, mentre clavata 1, che sembra codifichi una proteina-chinasi di membrana, regola negativamente la proliferazione delle cellule del SAM; le sue mutazioni, all'opposto di quelle in stm, causano una iperproliferazione delle cellule meristematiche.
Nelle piante adulte, lo studio del processo di fioritura, che segna il passaggio dalla fase di crescita vegetativa a quella riproduttiva, ha consentito di identificare geni essenziali per il controllo temporale della fioritura (geni FT=Flowering time) in risposta a segnali ambientali (fotoperiodo, intensità e qualità dell'illuminazione, temperatura) o a fattori endogeni (età della pianta, distanza fra apice e radice); per l'acquisizione dell'identità 'fiorale' nel meristema (geni FMI = Flower meristem identity); per l'acquisizione della specifica identità dei singoli organi fiorali (sepali, petali, stami, carpelli); per la delimitazione dei territori entro cui devono essere espressi e operare questi geni; per il controllo del numero di organi fiorali in ogni verticillo e della loro spaziatura. In Anthirrinium majus, i cui fiori hanno una spiccata simmetria bilaterale, sono anche stati identificati geni che ne determinano l'asse dorso/ventrale.
Molti di questi geni codificano per fattori trascrizionali. Per es., in Arabidopsis thaliana il prodotto di un gene del gruppo FT, costans (co), promuove l'espressione di leafy (lfy), il principale rappresentante della classe FMI, che avvia il processo di fioritura attivando i geni dell'identità degli organi fiorali. Nel meristema centrale, co attiva anche terminal flower 1, che reprime lfy; quest'ultimo verrà quindi espresso solo alla periferia del meristema e ciò consente l'allungamento dello stelo, mentre i fiori verranno prodotti lateralmente.
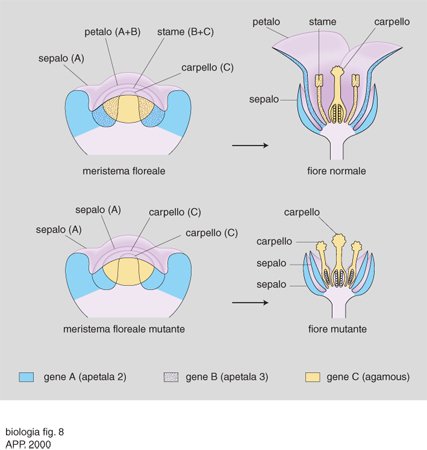
Tutti i geni dell'identità degli organi fiorali (tranne uno) sono caratterizzati dal dominio MADS (mcm 1, gene di lievito che codifica un fattore di trascrizione; agamous [ag], gene di Arabidopsis thaliana; deficens, gene di Arabidopsis majus; serum response factor [srs], gene dei Mammiferi che codifica un fattore di trascrizione) di legame al DNA e possono essere definiti omeotici, in quanto loro mutazioni provocano la formazione di organi strutturalmente più o meno normali in posizioni sbagliate (per es., carpelli al posto di sepali). Prima ancora che i singoli geni coinvolti fossero identificati, l'esame del tipo di mutazioni omeotiche che si potevano riscontrare in un fiore fece proporre il modello ABC, poi confermato da studi successivi. In sintesi, la definizione dei quattro tipi di organi fiorali dipende da tre classi (A, B e C) di geni. La determinazione delle quattro regioni concentriche (verticilli) di un primordio fiorale a dare, dall'esterno verso l'interno, sepali, petali, stami e carpelli dipende dall'espressione nelle corrispondenti regioni delle classi di geni A, A+B, B+C, C. Si è osservata anche una mutua repressione fra un gene di classe A e il solo gene di classe C, ag, mentre i due geni della classe B si regolano reciprocamente, ma non sono influenzati né da A né da C. In conseguenza di ciò, mutazioni di A causano la formazione di fiori costituiti da carpelli, stami, stami, carpelli (C, C+B, B+C, C); mutazioni di B danno fiori con sepali, sepali, carpelli, carpelli (A, A, C, C) ecc. (fig. 8). In base al modello ABC, si possono anche predire i risultati di mutazioni simultanee in due diverse classi di geni e ottenere sperimentalmente i fiori corrispondenti (per es., mutazioni in A e B=solo carpelli; in B e C=solo sepali ecc.). È interessante notare che mutazioni simultanee in tutte e tre le classi di geni provocano la formazione di foglie al posto di fiori, a conferma dell'ipotesi già formulata da Goethe, nel 1790, che i vari organi fiorali non fossero altro che foglie modificate.
Il meccanismo molecolare di determinazione dell'identità degli organi fiorali presenta molte omologie con quello che determina l'identità dei segmenti durante lo sviluppo di Drosophila, anche se nel primo caso i geni coinvolti hanno un dominio MADS e nel secondo un dominio omeobox. Recentemente è stato scoperto che un gene, curly leaf, responsabile della repressione di ag, al di fuori del suo normale dominio di espressione, per es. nelle foglie, è strutturalmente simile a uno dei geni polycomb di Drosophila, responsabili della repressione permanente dei geni omeotici nelle regioni in cui non devono essere espressi.
bibliografia
B. Sheres, Embryo patterning genes and reinforcement cues determine cell fate in the Arabidopsis thaliana root, in Seminars in cell and developmental biology, 1996, pp. 857-65.
E.M. Meyerowitz, Genetic control of cell division patterns in developing plants, in Cell, 1997, 88, pp. 299-308.
U. Mayer, G. Jurgens, Pattern formation in plant embryogenesis. A reassessment, in Seminars in cell and developmental biology, 1998, pp. 187-93.
P. Westhoff, G. Jurgens, K. Kloppsteeh, G. Link, Molecular plant development. From gene to plant, Oxford-New York 1998.