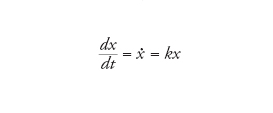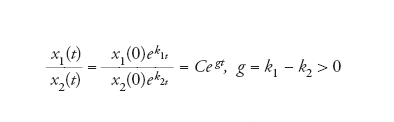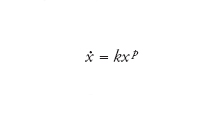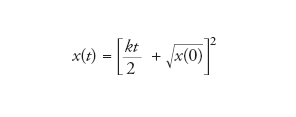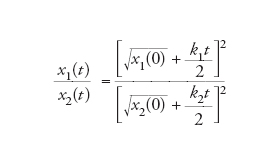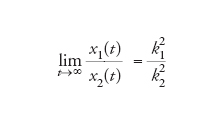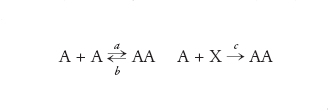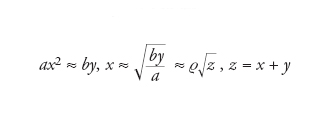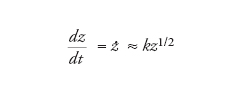Biosfera. Origine ed evoluzione
Biosfera. Origine ed evoluzione
Per approfondire la conoscenza dell'origine della nostra biosfera, è opportuno fare riferimento a un utile e chiaro modello di vita minima. Esso può essere considerato come un sistema costituito da tre sottosistemi autocatalitici: uno metabolico, uno genetico e uno che funge da confine. Il sistema, nel suo insieme, deve essere in grado di riprodursi nello spazio e, inoltre, può risultare utile poiché è in grado di conciliare le due teorie tradizionali rispetto al problema della vita: l'approccio genetico e quello sistemico. Per di più consente di esaminare ulteriori ipotesi sulle origini della vita. Varie teorie spiegano le origini di questi sottosistemi e le loro diverse associazioni. Nonostante siano stati effettuati con successo numerosi esperimenti nel campo dell'evoluzione chimica, ancora non sappiamo da dove potrebbero essere derivati gli acidi nucleici (DNA, RNA) e i lipidi, ossia i composti chimici considerati determinanti rispettivamente per i processi ereditari e per la costituzione dei confini cellulari. Pur in presenza di questo limite, molti ricercatori credono che ci sia stato uno stadio transitorio dell'evoluzione, il cosiddetto mondo a RNA, in cui si ritiene che quest'acido svolgesse sia il ruolo genetico, sia quello enzimatico. Ciò nonostante, non è ancora disponibile una qualche ipotesi attendibile in grado di delineare un meccanismo plausibile per l'autoreplicazione dell'RNA, senza l'ausilio di enzimi in un ambiente prebiotico. Al di là delle considerazioni strutturali, anche la dinamica di questi sistemi è d'importanza fondamentale. Sembra che per la formazione del genoma primordiale sia stata essenziale la compartimentazione, prima in forma passiva (tramite adsorbimento su superfici minerali), poi in una forma attiva (mediante le membrane). È probabile che il codice genetico si sia originato in sistemi già viventi e che gli amminoacidi possano essere stati introdotti in un mondo a RNA come coenzimi dei ribozimi.
Per poter affrontare il problema dell'origine dei sistemi biotici, quindi, si deve innanzi tutto concordare su una definizione operativa del concetto di vita. Purtroppo, a questo proposito, non esiste finora un accordo generale, poiché alcuni studiosi ritengono che per caratterizzare la vita siano necessari o sufficienti, da soli o in associazione, la capacità di autoreplicazione, l'utilizzazione di enzimi nei processi chimici o addirittura la presenza di vere e proprie cellule.
Di certo è importante il criterio di discriminazione, che se applicabile su vasta scala, dovrebbe essere in grado di: (a) differenziare tra vivente e non vivente in modo operativamente semplice e in modo non troppo restrittivo; (b) includere la vita in tutte le sue forme note, sia quelle attuali sia, ipoteticamente, in tutte quelle passate; (c) agevolare la progettazione in laboratorio di esperimenti su forme di vita minima coerenti con essa; (d) aiutare chi esplora lo spazio ad attribuire il termine vita a nuove forme biologiche scoperte; (e) essere coerente dal punto di vista logico.
Definizione dei sistemi viventi
Le unità di evoluzione
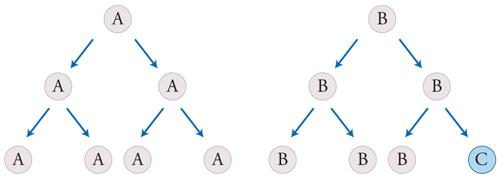
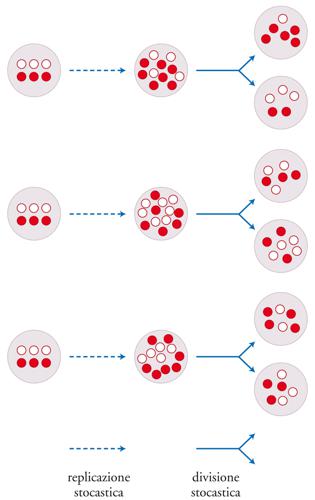
I virus evolvono, anche se di per sé non sono altro che cristalli inerti. Di fatto essi sono diventati uno dei sistemi più utilizzati per la valutazione delle ipotesi evolutive. Anche alcuni programmi di computer possono evolvere rispetto ad altri. È sempre più di moda parlare di unità di evoluzione culturale o memi. Qual è, allora, la relazione esistente tra unità di evoluzione e unità di vita? Per poter rispondere, si devono prima definire entrambi i concetti con sufficiente chiarezza. Le unità di evoluzione devono: (a) riprodursi; (b) possedere un'ereditarietà e (c) questa ereditarietà non deve essere troppo precisa, nel senso che deve poter consentire una certa variabilità (fig. 2). Inoltre, alcuni dei caratteri ereditati devono influire sulle possibilità di riproduzione e/o di sopravvivenza delle unità che li possiedono. Se tutti questi criteri vengono soddisfatti, in una popolazione di entità così organizzate può compiersi la selezione naturale. Si noti che questa definizione non si riferisce necessariamente a sistemi viventi; infatti, qualsiasi sistema che soddisfi questi criteri può evolvere secondo modalità darwiniane.
Le unità di vita
Nel 1961 Alexander Oparin ha definito vivente qualsiasi sistema in grado di replicarsi e di mutare. La maggior parte dei biologi evoluzionisti concorderebbe con questa opinione e in parte a ragione: sono proprio sistemi con queste proprietà che in natura riescono a evolvere producendo adattamenti complessi (cioè funzioni finalizzate) caratteristici degli esseri viventi. Tuttavia, alcuni autori hanno sollevato dubbi in proposito. Il punto fondamentale è capire se i virus siano sistemi viventi o no. Tibor Gánti ha sostenuto che considerare i virus entità viventi equivale all'errore concettuale di equiparare programmi e computer. In quest'analogia il virus corrisponderebbe a un programma, scritto in un linguaggio da decifrare, che dicesse al computer: "Stampami tante e tante volte, anche se per farlo dovessi arrivare a disintegrarti!". La parte attiva è ovviamente il computer e non il programma. Il computer può fare tante cose senza questo malefico programma; al contrario, il programma da solo non può fare niente. In questo caso la cellula vivente è quindi analoga al computer. Dato che si considera la cellula nel suo stato attivo come vitale, in questo esempio la vita in quanto tale va attribuita alla cellula e non al virus.
Il concetto di unità di vita di per sé è poco studiato, nonostante cellule e organismi siano ben noti e ampiamente analizzati. Nel corso degli anni, Gánti ha ridefinito i criteri di vitalità che a suo avviso i sistemi viventi devono soddisfare. Egli ha osservato, correttamente, che, per definire vivente un singolo individuo, la capacità riproduttiva non è né necessaria, né sufficiente. Molte cellule e molti organismi vengono considerati viventi anche se non si riproducono (o non lo fanno più). I cosiddetti 'criteri di vitalità potenziale' devono essere soddisfatti solo se la popolazione di unità deve mantenersi o evolvere. Perciò, la corretta relazione tra unità di evoluzione e unità di vita è quella di due gruppi parzialmente sovrapponibili. Penso che questa semplice schematizzazione risolva molte apparenti contraddizioni in questo campo. John Barrow e David Tipler hanno avuto ragione quando, nel 1988, hanno fatto notare che i criteri di vitalità potenziale (questa è la terminologia usata da Gánti) devono essere soddisfatti dai sistemi viventi se quel che si sta cercando è l'evoluzione autonoma dell'intera biosfera (quel che fa, per es., un esobiologo).
Si può immaginare un sistema vivente costruito artificialmente e non ottenuto mediante i convenzionali sistemi evolutivi. Si supponga che esso non sia in grado di riprodursi. Un sistema siffatto sarebbe comunque vivo, anche se dal punto di vista evolutivo è completamente separato dal resto del mondo vivente. Sarebbe paragonabile alla configurazione del Giardino dell'Eden degli automi cellulari, strutture dinamiche che si automantengono e che non si sono sviluppate da precursori più semplici. Se si dovesse trovare un tale essere vivente, si potrebbe essere certi della sua origine artificiale.
Esiste un'interessante gerarchia tra le unità di evoluzione e tra le unità di vita: in parecchi casi alcuni livelli coincidono. Un organismo e le sue cellule sono sia unità di vita, sia unità di evoluzione. Quest'ultima caratteristica può sorprendere, ma va ricordato che i tumori insorgono proprio da una selezione interna all'organismo di cellule moderatamente instabili dal punto di vista genetico. Ovviamente, tali fenomeni a livello cellulare per la maggior parte vanno soppressi per salvaguardare l'integrità dell'organismo, che altrimenti si estinguerebbe o non si sarebbe mai sviluppato.
Un modello di vita minima
Viene qui presentato un modello (una descrizione precisa) di sistema vivente minimo, che soddisfa anche i criteri potenziali proposti da Gánti. Il chemoton è un supersistema chimico, composto da tre sottosistemi autocatalitici: una rete metabolica, uno stampo per la replicazione e una membrana che lo delimita (fig. 3). L'associazione stechiometrica tra questi sottosistemi assicura una riproduzione regolata del sistema nel suo complesso. La riproduzione spaziale avviene essenzialmente per il fatto che la superficie della membrana cresce più rapidamente della massa di materiale interno; questo perché se l'area di superficie di una sfera raddoppia, il suo volume verrà più che raddoppiato. È importante sottolineare il fatto che la membrana è anche autocatalitica: il costituente T, prodotto dalla rete metabolica, viene integrato spontaneamente grazie all'esistenza di una superficie di membrana preesistente. Tuttavia, è la presenza della molecola stampo pVn che qualifica questo sistema come un'unità di evoluzione (con un illimitato potenziale ereditario). Se si suppone che questi stampi siano la versione astratta dei ribozimi (molecole di RNA che agiscono come enzimi), allora essi possono anche catalizzare passaggi del ciclo metabolico e della crescita di membrana, utilizzando l'informazione ereditata.
Il modello del chemoton è utile perché concilia le due teorie tradizionali rispetto al problema della vita: l'approccio genetico e quello sistemico. Inoltre, esso è utile per esaminare ulteriori teorie sull'origine della vita: in realtà, tutti e tre i sottosistemi del chemoton, o alcune loro combinazioni, sono stati indicati come i punti cruciali su cui focalizzare l'attenzione quando si affronti il problema. Prenderemo in considerazione, quindi, varie teorie sull'origine della vita e precisamente: (a) quella metabolica; (b) quella delle membrane; (c) quella dello stampo. Ma prima è doveroso chiedersi da dove siano derivati i composti organici fondamentali.
L'evoluzione chimica
I composti chimici fondamentali, necessari per la costruzione di un primitivo sistema vivente, potrebbero essere arrivati dallo spazio oppure essere stati prodotti sulla Terra stessa. La panspermia (secondo la quale la vita si sarebbe originata da qualche altra parte e poi avrebbe fecondato la Terra con modalità naturali o artificiali) non viene esclusa a priori, ma non risolve il problema di come la vita sia sorta inizialmente. L'ipotesi delle argille avanzata nel 1982 da A. Graham Cairns-Smith si basa sull'assunto che i minerali d'argilla possano essere unità di evoluzione, ma finora non esistono prove sperimentali a supporto di questa tesi.
L'idea che le cellule viventi primordiali fossero eterotrofe (cioè usassero le sostanze organiche presenti nell'ambiente per metabolizzare materia ed energia) è strettamente associata all'ipotesi del brodo primordiale, a cui hanno aperto la strada i famosi esperimenti effettuati da Stanley L. Miller e Harold C. Urey nel 1953. Tale apparecchiatura intendeva simulare la circolazione dell'acqua sulla Terra primordiale, assumendo che, durante i temporali primitivi, i lampi e la pioggia fossero stati presenti in concomitanza di un'atmosfera fortemente riducente. L'individuazione nel pallone da esperimento di amminoacidi prodottisi spontaneamente in sospensione è diventato un risultato celeberrimo. L'ipotesi che gli oceani primordiali si fossero trasformati in una soluzione complessa di materiali biologicamente importanti presenta tuttavia un problema: non esistono prove a favore di un'atmosfera primordiale fortemente riducente. Per questo motivo gli stessi esperimenti sono stati ripetuti in condizioni moderatamente riducenti o non riducenti. Il deludente risultato è stato che la produzione di amminoacidi cala drasticamente se il metano (CH4) viene sostituito da monossido di carbonio (CO) o diossido di carbonio (anidride carbonica, CO2) e l'idrogeno libero (H2) viene eliminato. Per questo approccio sono fondamentali un'atmosfera riducente primordiale e un brodo di sostanze organiche (simile al "piccolo stagno tiepido" ipotizzato da Charles Darwin). Inoltre, in molti casi, le reazioni che producono questo o quel composto biochimico si sono rivelate chimicamente incompatibili tra loro. Sta aumentando, perciò, il dubbio che l'ipotesi del brodo primordiale possa essere attendibile. Per di più, in realtà, essa non è una teoria sull'origine della vita, ma solo una teoria sull'origine di alcune sostanze chimiche che ne fanno parte. Vedremo, nel prosieguo, che sono state suggerite alcune alternative promettenti, per quanto non vada escluso che anche il brodo primordiale possa aver contribuito all'accumularsi di materiale organico.
L'evoluzione chimica è il processo che si presume abbia condotto alla produzione del materiale organico di importanza biologica. Come vedremo, nelle sue fasi più recenti potrebbero aver svolto un ruolo rilevante fenomeni che conosciamo dalla biologia attuale, come la selezione a favore della replicazione più veloce.
L'atmosfera primordiale
La maggior parte dei ricercatori cerca una spiegazione su come si sia originata la vita sulla scena terrestre, più di 3,8 miliardi di anni fa, anche se pare ormai certo che sulla Terra primordiale sia stato considerevole il trasporto di sostanze organiche di provenienza extraterrestre. Secondo le attuali conoscenze astronomiche, i pianeti interni del Sistema solare si sono formati per accrezione dai cosiddetti planetesimi, cioè da corpi formanti pianeti. L'analisi degli atomi radioattivi suggerisce per la Terra un'età di 4,5 miliardi di anni. Le più antiche rocce sedimentarie rinvenute a Isua (Groenlandia) risalgono a 3,8 miliardi di anni fa. È interessante il fatto che anche la più antica dimostrazione isotopica di presenza di vita risalga a quel periodo: l'analisi degli isotopi del carbonio su questi sedimenti indica già una qualche forma di fissazione enzimatica della CO2. Ciò può essere affermato perché nella fissazione autotrofa della CO2 viene preferito l'isotopo leggero (12C) rispetto a quello pesante (13C). I crateri da impatto su vari corpi del Sistema solare testimoniano che c'è stato un pesante bombardamento della Terra primitiva, continuato fino a 4,2 miliardi di anni fa, fin quando non diminuì al punto tale da consentire l'origine della vita.
L'idea prevalente sull'atmosfera primordiale era che fosse molto riducente e costituita da CH4, NH3 e H2. Secondo Miller e Urey, le scariche dei fulmini in questo tipo di atmosfera, combinate alla circolazione dell'acqua, avrebbero portato facilmente alla produzione di sostanze organiche, compresi gli amminoacidi. La natura estremamente riducente dei pianeti gassosi esterni è in accordo con questo punto di vista. Tuttavia, indagini recenti indicano che è improbabile che l'atmosfera primordiale fosse fortemente riducente, perché la formazione del nucleo ferroso avvenne durante il processo stesso di accrezione, che non consentiva molti contatti tra elementi volatili e ferro metallico. Neanche l'analisi dei gas vulcanici attuali conferma l'idea di un'atmosfera primordiale fortemente riducente. Tuttavia, l'atmosfera potrebbe non essere stata neppure ossidante: la prima prova chiara di una consistente quantità di O2 risale a 2,2 miliardi di anni fa. Attualmente la maggior parte dei ricercatori concorda su un'atmosfera moderatamente riducente, costituita soprattutto da CO2, N2 e H2O, in associazione a un po' di CO e di H2. Può un'atmosfera di questo tipo aver portato alla formazione di sostanze organiche di rilevanza biologica?
È stato dimostrato che in un tale tipo di atmosfera si origina formaldeide (H2CO), che potrebbe essere stata un buon punto di partenza per la produzione di zuccheri (il ribosio C5H10O5, ha una formula pari a cinque volte la formaldeide). Il fosfato potrebbe essere stato prodotto dall'alterazione meteorica delle rocce. Come è ben noto da tempo, l'adenina (C5N5H5), una base azotata costituente degli acidi nucleici, ha formula pari a cinque volte l'acido cianidrico (HCN). è risultato che l'HCN può essere formato in un'atmosfera debolmente riducente solo se è presente anche una sufficiente quantità di metano (CH4). Ma questa necessità non è in contraddizione con l'idea stessa di atmosfera debolmente, invece che fortemente, riducente? Non esattamente, in realtà. Mentre la pressione stazionaria di CH4 era probabilmente molto bassa, il suo flusso può essere stato notevole, visto che si sprigionava gas vulcanico dalle dorsali medio-oceaniche. Anche oggi il rapporto CH4/CO2 nei fluidi delle bocche idrotermali di profondità è dell'1÷2% circa. Considerando il fatto che probabilmente il mantello primitivo della Terra era più riducente, si può concludere che esiste la possibilità che venissero prodotti l'HCN e quindi anche le basi degli acidi nucleici.
È probabile che l'atmosfera primordiale fosse rifornita da una sorgente interna e da una esterna: meteoriti secondo la teoria di alcuni ricercatori, comete ghiacciate secondo quella di altri.
Il contributo extraterrestre di sostanze organiche
Nel 1961 Juan Oró fu il primo a suggerire che le comete potrebbero aver portato una notevole quantità di materiale organico sulla Terra. Questo suggerimento sta acquistando plausibilità man mano che aumentano le conoscenze sullo spazio extraterrestre e sulla sua storia. Le sostanze organiche non sono per nulla limitate alla Terra: le si può trovare nelle nubi di molecole interstellari, nelle meteoriti (come le condriti carboniose) e nelle comete. Finora, con i metodi radioastronomici, si è riusciti a identificare quasi un centinaio di tipi di molecole interstellari. È interessante notare che la molecola con 3 atomi più abbondante nell'Universo è l'acqua, mentre le molecole organiche maggiormente presenti sono la formaldeide e l'acido cianidrico. La più grande molecola finora identificata è costituita da 13 atomi (HC11N) ed è stata inoltre individuata anche la glicina (H2N−CH2− COOH), che è il più semplice degli amminoacidi.
Ormai si è compreso che talvolta, nel corso della loro storia, queste nubi molecolari si trasformano in nebulose protostellari. È quindi importante chiedersi quanta parte delle sostanze organiche interstellari si sarebbe potuta preservare durante l'accrezione dei planetesimi, mantenendo sostanze volatili adsorbite sulla loro superficie. I calcoli suggeriscono che, molto probabilmente, gran parte del materiale organico è derivato dalle comete e dalle cosiddette micrometeoriti. È probabile che le comete abbiano fornito 10 volte la quantità d'acqua necessaria per colmare gli oceani e 1000 volte più gas di quello richiesto per l'atmosfera.
Per accrezione si sono formati anche i pianeti interni; ma la loro composizione così diversa da quella dei pianeti esterni (come Giove e Saturno) richiede una spiegazione. Mercurio è troppo piccolo per mantenere un'atmosfera. Venere è troppo vicino al Sole, perciò la CO2 non poteva essere catturata attraverso l'alterazione meteorica e la formazione dei carbonati: esso possiede ancora un'atmosfera densa e calda, apparentemente a causa di un forte effetto serra. Sulla Terra la temperatura era inferiore e divenne quindi possibile intrappolare l'anidride carbonica. Inoltre, la collisione con un planetesimo di dimensioni simili a quelle di Marte pare aver portato alla formazione della Luna e, cosa importante, alla dispersione di una gran parte dell'originaria atmosfera densa.
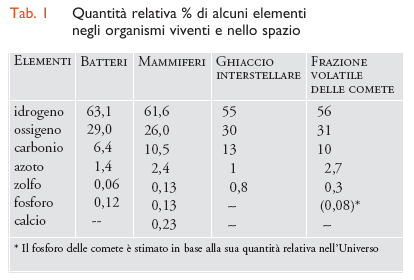
La distribuzione dei vari elementi nella frazione volatile delle comete (tab. 1) è notevolmente simile a quella negli organismi biologici, mentre la composizione media della Terra è diversa, soprattutto per la presenza di silicati nelle rocce. Nella cometa di Halley sono state identificate numerose molecole organiche, tra cui pirimidine e purine (molecole costituenti le basi azotate degli acidi nucleici), ma non si è ancora trovata traccia di amminoacidi. Si potrebbe pensare che le sostanze organiche presenti nelle comete vengano distrutte nelle collisioni o a causa dell'attrito dovuto all'ingresso nell'atmosfera. Le cose, però, non stanno così. Il pulviscolo proveniente dalle code delle comete può entrare agevolmente nell'atmosfera, portandosi dietro, senza rischi, le sostanze volatili adsorbite su di esso.
Benché alcune meteoriti ospitino molte sostanze organiche ‒ tra cui purine, pirimidine e molti amminoacidi ‒, la possibilità che le abbiano recapitate sulla Terra primordiale è fonte di discussione. L'attenzione è puntata sulle micrometeoriti (più piccole di 5×10−4 m). La quantità di carbonio attualmente portata sulla Terra da questi corpuscoli è di circa 500 t all'anno. Si può supporre che una quantità simile si sia accumulata per i 300 milioni di anni trascorsi tra 4,2 e 3,9 miliardi di anni fa, recapitando sulla Terra un'immensa quantità di carbonio, 150 volte maggiore di quella presente nella biosfera attuale. Poiché nelle micrometeoriti sono state individuate sostanze organiche complesse, non si può escludere un loro significativo contributo all'evoluzione chimica sulla Terra primordiale.
Nel 2002 Guillermo M. Muñoz Caro e collaboratori hanno dimostrato che l'irraggiamento di un analogo del ghiaccio interstellare mediante radiazione UV a temperature molto basse determina la sintesi di 16 amminoacidi ben identificati, alcuni dei quali riscontrati anche nelle meteoriti. Benché dal punto di vista chimico ciò non sia in realtà sorprendente (la produzione e la ricombinazione di radicali liberi è paragonabile a quelle verificatesi negli esperimenti di Miller), questa scoperta dà ulteriore credito all'idea dell'apporto esogeno di sostanze organiche sulla Terra.
L'evoluzione chimica nel brodo prebiotico
Nelle idee di Oparin, condivise da John Haldane, Urey e John D. Bernal, vi si trova l'ipotesi che nelle condizioni presenti sulla Terra primordiale si sarebbe facilmente ottenuta la sintesi di sostanze organiche. È curioso che un chimico tedesco, Walther Löb, già nel 1906 e poi nel 1914, avesse effettuato alcuni esperimenti che retrospettivamente possono essere considerati importanti a questo proposito. Egli aveva utilizzato un sistema con tecnologia a plasma freddo, con CO2, CO e NH3 come reagenti e aveva ottenuto aldeidi e amminoacidi. Löb pensava che i suoi esperimenti presentassero analogie chimiche con il metabolismo autotrofo e, cosa ancora più rilevante, non parlò mai di origine della vita. Come si è già detto sopra, il primo tentativo mirato a vagliare l'ipotesi di Oparin-Haldane fu effettuato da Miller e Urey (incidentalmente, nello stesso 1953 in cui James D. Watson e Francis H.C. Crick proposero il modello della struttura a doppia elica del DNA).
Una linea forse più promettente per la sintesi degli amminoacidi è quella che parte dall'HCN. Lo stesso composto potrebbe essere stato importante nella sintesi delle basi puriniche come l'adenina. La formaldeide catalizza il processo di formazione dell'adenina. Sono state sintetizzate anche le basi pirimidiniche, seppure con risultati inferiori. La formazione degli zuccheri può essere avvenuta attraverso la 'reazione del formosio', scoperta da Aleksandr M. Butlerov nel 1861. Di fatto si tratta di un complesso sistema di zuccheri di varie dimensioni che trasforma la formaldeide in ulteriore zucchero. Nella stessa miscela di reazione si possono produrre più di 40 tipi di zuccheri diversi, ma il ribosio, il costituente dell'RNA (l'acido ribonucleico), è presente solo in piccola quantità. La reazione richiede una concentrazione piuttosto elevata e condizioni alcaline. Inoltre, il ribosio è instabile in acqua, benché si possa immaginare che esista uno stato stazionario di formazione e utilizzazione da parte del metabolismo. Ciò richiede, ovviamente, che la reazione del formosio sia inserita in una rete anche più complessa. La produzione di ribosio è notevolmente più favorita quando gli zuccheri sono sostituiti da zuccheri fosfato. Una variante più promettente di questo sistema verrà presa in considerazione più avanti.
Alcuni composti biologici per i quali non si conosce un plausibile processo di sintesi prebiotica sono i seguenti: arginina, lisina, istidina, acidi grassi a catena non ramificata, porfirine, piridossale, tiamina, riboflavina, acido folico, acido lipoico e biotina. Comunque, gli esperimenti che si ispirano all'ipotesi del brodo primordiale talvolta hanno avuto come risultato molecole biologiche incredibilmente complesse, quali la panteteina, che è un precursore del coenzima A, attualmente un trasportatore di molecole organiche attivate, come l'acido acetico, nel metabolismo intermedio. Tre molecole ‒ la cisteamina, la β-alanina e l'acido pantoico ‒ si formano facilmente nelle condizioni del brodo primordiale e si convertono in panteteina.
Il valore principale dell'ipotesi del brodo primordiale è dato dalla chiara dimostrazione che sostanze organiche d'importanza biologica si formano agevolmente in appropriate condizioni, senza la necessità di sistemi viventi, di enzimi o delle tecniche elaborate utilizzate nella chimica organica. Esistono, però, anche alcuni elementi che indeboliscono l'ipotesi. Il primo è che il brodo primordiale non presenta caratteristiche tali da consentire sintesi prebiotiche in quantità sufficienti. In secondo luogo, esiste l'incompatibilità chimica. Anche se l'elenco delle sostanze organiche sintetizzate negli esperimenti del tipo di quello di Miller è cospicuo, tali risultati spesso derivano da condizioni di partenza differenti. Se la sintesi della sostanza A richiede l'ambiente X, e quella di B richiede l'ambiente Y, è difficile che un ambiente (X+Y) possa realizzarsi; e se ciò dovesse succedere, potrebbe portare alla sintesi del prodotto C, invece che di A e B. Finora non è stata suggerita alcuna via d'uscita convincente da questo vicolo cieco. Come ha osservato correttamente Günter Wächtershäuser nel 2000, ci si trova a che fare con un'enorme varietà di composti sintetizzati in vari esperimenti che mimano il brodo primordiale, per cui, secondo quest'assunto, lo scenario dell'origine della vita implica la necessità che si sia creato un ordine dal caos.
L'ipotesi delle superfici minerali
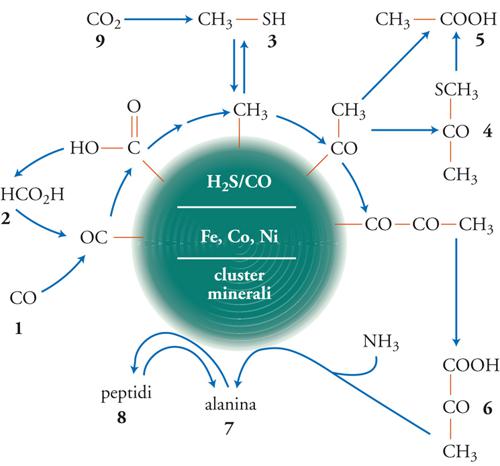
Diversi ricercatori, tra cui il cristallografo Bernal, hanno ripetutamente suggerito che le superfici dei minerali, come l'argilla, potrebbero aver avuto un ruolo decisivo nella formazione delle molecole biologiche. Wächtershäuser ha suggerito una versione più rigorosa di questa teoria, quella del cosiddetto mondo a ferro e zolfo. È probabile che superfici minerali cariche positivamente (quali la pirite o le argille ricoperte di ioni positivi) abbiano avuto un ruolo cruciale nell'origine delle reazioni biochimiche, e questo per diverse ragioni: (a) le superfici adsorbenti agiscono come catalizzatori, perché aumentano la concentrazione locale di reagenti; (b) la polimerizzazione può essere termodinamicamente favorita, perché l'acqua può lasciare la superficie e quindi aumentare l'entropia dell'ambiente, compensando la diminuzione di entropia sulla superficie; (c) la dinamica della selezione naturale sulla superficie porta più rapidamente a una maggiore complessità.
Nel mondo a ferro e zolfo, le reazioni avvengono tra molecole legate alla superficie minerale in virtù delle loro cariche ioniche negative, dovute a gruppi come COO−, PO43−, ecc., che si trovano in molti composti del metabolismo intermedio. Dal momento che si suppone che tutte le molecole importanti vengano sintetizzate all'interno del sistema del metabolita di superficie, la rete di reazioni che ne emerge è il nucleo di un presunto metabolismo autocatalitico, che effettua la fissazione dell'anidride carbonica utilizzando energia chimica. La reazione centrale di questa teoria chemioautotrofa è la fissazione dell'anidride carbonica associata alla formazione della pirite:
[1] 4 CO2 + 7 FeS + 7 H2S → (CH2COOH)2 +
+ 7FeS2 + 4 H2O
che è energeticamente favorita.
Questo suggerimento è aperto alla valutazione sperimentale. È incoraggiante la dimostrazione che, nelle condizioni sperimentali richieste di elevata temperatura, si è riusciti a verificare molteplici reazioni che sostengono ampiamente lo scenario del supporto di pirite. Per esempio, le reazioni:
[2] CO2 (o CO) + FeS/H2S → CH3SH + FeS2
[3] CH3SH + CO → CH3COSH → CH3COOH
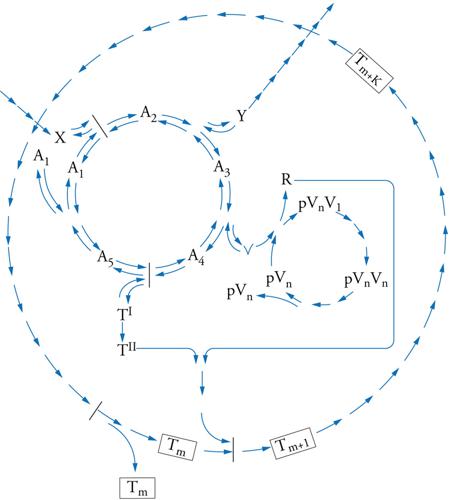
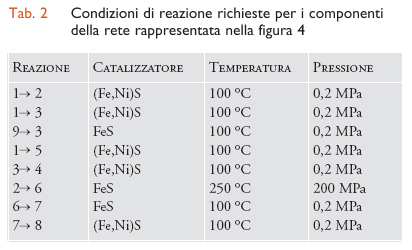
sono state confermate sperimentalmente, utilizzando una superficie (Fe,Ni)S. Una lista crescente di reazioni sintetizzate utilizzando lo scenario del supporto è elencata nella tab. 2 (la fig. 4 presenta invece la rete di molecole coinvolte). Va notato che si può andare dal monossido di carbonio fino ai peptidi (amminoacidi legati mediante l'eliminazione di una molecola d'acqua): per esempio, l'amminoacido alanina si forma dall'amminazione riduttiva del piruvato.
La sintesi dell'acido piruvico (CH3−CO−COOH) alla temperatura di 250 °C è molto sorprendente, dato che si tratta di un composto estremamente sensibile al calore, che si decompone intorno al suo punto di ebollizione di 165 °C. Probabilmente è l'elevata pressione che modifica così drasticamente il risultato.
Quale potrebbe essere stata, nella Terra primordiale, l'ambientazione naturale di una sintesi a valori così elevati di pressione e temperatura? Probabilmente la risposta sta nelle indagini sulle bocche idrotermali sottomarine, che hanno rivelato un ambiente che di fatto è un reattore chimico continuo, dove sono contemporaneamente presenti un'elevata pressione, un'elevata temperatura, una fonte di carbonio (CO2/CO) e un potere riducente (come quello dell'H2S) e dove inoltre si ha la formazione in situ di pirite.
Un'obiezione ricorrente contro questo scenario primordiale è che in tali condizioni le molecole biologiche dovrebbero decomporsi piuttosto che formarsi, ma i dati contenuti nella tab. 2 confutano quest'affermazione. Ulteriori esperimenti sembrano rafforzare l'ipotesi dell'alta pressione/alta temperatura: infatti in un reattore continuo che simuli le bocche idrotermali sottomarine si riesce a far formare peptidi, e il processo, inoltre, è facilitato dagli ioni di metalli bivalenti.
Un'ipotesi coerente con il mondo a ferro e zolfo, è quella del mondo a tioesteri. Questi ultimi sono molecole che si formano quando il tiolo (R−SH, in cui R è un gruppo organico) reagisce con un acido carbossilico (R′−COOH): viene eliminata una molecola d'acqua e si forma così un tioestere (R−S−CO−R′). L'importanza di questo legame sta nel fatto che esso possiede un'alta energia utilizzabile in altre reazioni sintetiche che necessitino di un apporto energetico. Attualmente un nucleoside trifosfato, l'ATP (adenosintrifosfato), serve come fonte d'energia nella maggior parte delle reazioni metaboliche di questo tipo. Va notato che attualmente le reazioni biochimiche più antiche che portano alla formazione di ATP indicano che i tioesteri possono essere stati associati a reazioni di questo tipo sin quasi dall'inizio, e che l'ATP stesso possa essere arrivato come secondo.
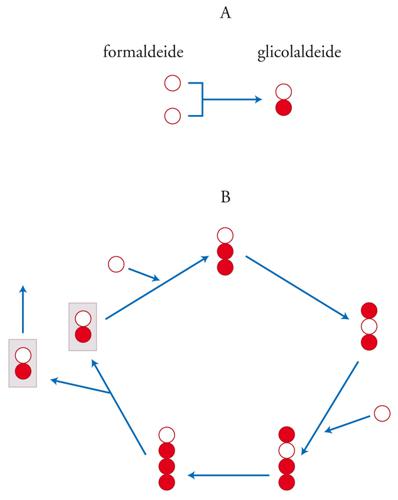
Oramai esistono pochi dubbi sul fatto che superfici minerali abbiano svolto un ruolo cruciale e probabilmente indispensabile nell'evoluzione chimica. Per esempio, è stato dimostrato che una versione catalizzata da minerali della reazione del formosio modificata utilizzando gli zuccheri fosfato si può verificare a basse concentrazioni di reagenti e in condizioni neutre (cioè né acide, né basiche). In particolare, si è osservato che la fosfogliceraldeide e la fosfoglicolaldeide sulle superfici minerali possono formare il pentoso fosfato (fig. 5). I catalizzatori utilizzati sono minerali di idrossido metallico in doppio strato a valenza mista. Il Fe2+, o anche qualsiasi catione metallico bivalente, può sostituire il metallo nelle principali lamine di idrossidi. Va notato che gli zuccheri fosfato così prodotti, al contrario degli zuccheri nella reazione del formosio, sono stabili all'idrolisi (5% in 10 mesi), grazie all'ambiente protettivo che si crea tra gli strati minerali.
Forse il significato degli scenari che prevedono alta pressione, elevata temperatura e presenza di zolfo e ferro è che probabilmente le interconversioni chimiche sono state fortemente indirizzate dalle superfici minerali che hanno così condotto alla produzione solo di certe sostanze. Secondo questa prospettiva, dall'ordine si sarebbe prodotto un ordine ancora maggiore.
La lunga strada verso gli oligonucleotidi
Günter von Kiedrowski ha suggerito nel 1996 un meccanismo secondo il quale i monomeri si sarebbero formati nel brodo primordiale, ma avrebbero intrapreso la polimerizzazione sostanzialmente solo su superfici. Inoltre, più lunghi fossero stati gli oligomeri, maggiore sarebbe stata la forza con cui si sarebbero legati alle superfici stesse.
Il minerale d'argilla montmorillonite è un efficiente catalizzatore per diverse reazioni in soluzione acquosa. Catalizza, per esempio, la condensazione di fosforimidazolidi dei nucleotidi e, per quanto riguarda l'adenosina, sulla sua superficie fa prevalere il corretto legame 3'5'-fosfodiesterico (cosa che non succede in soluzione). Nel 1996 Grant Ferris e collaboratori sono riusciti a estendere un decamero su una superficie mediante l'aggiunta quotidiana di nucleotidi attivati, ottenendo una miscela di polimeri costituiti da 30 fino a 50 monomeri, vale a dire la lunghezza dei più piccoli ribozimi conosciuti.
La replicazione non enzimatica, diretta da uno stampo, è un problema molto complesso. Stampi con una maggioranza di residui di citosina possono essere copiati per dare oligonucleotidi complementari, ma la copia in sé non può essere ulteriormente copiata. Per questo è stata ipotizzata l'esistenza, nel mondo (pre-)RNA, di un catalizzatore sofisticato che potesse svolgere tale ruolo, in pratica una sorta di enzima.
3. Interfaccia tra evoluzione chimica ed evoluzione biologica
L'autocatalisi
Il sottosistema metabolico delle cellule viventi garantisce che la replicazione del materiale genetico possa avvenire pure in condizioni complesse: essa, infatti, può procedere anche se i monomeri attivati (i nucleotidi) non sono presenti nell'ambiente esterno. Il metabolismo ha una vita autonoma soprattutto perché si tratta di un sistema autocatalitico. La base chimica della replicazione è l'autocatalisi (il composto A catalizza la formazione di ulteriore composto A a partire dalla materia prima) un processo che spesso ha come risultato una replicazione. L'eredità si basa sulla replicazione dell'informazione e pertanto possono esistere tipi diversi di autocatalizzatori. Sono possibili replicatori metabolici di informazione? Il più semplice autoreplicatore noto è la glicolaldeide, il germe autocatalitico della reazione del formosio (fig. 5). Questo sistema sembra sia importante per capire l'origine della vita, anche se permangono dei dubbi. In ogni caso, non è chiaro se tali sistemi esistano come tali o debbano sottostare a un certo tipo di evoluzione mediante selezione naturale, per la quale la variabilità ereditaria sarebbe vincolante.
Se in questo tipo di sistemi si possa avere o meno eredità è un problema aperto. Esistono comunque altri cicli autocatalitici di piccole molecole organiche che potrebbero aver svolto precocemente un ruolo anche nell'evoluzione chimica, tra cui il ciclo di Calvin e il ciclo riducente dell'acido citrico, che fissano il biossido di carbonio, rispettivamente, nelle piante e in alcuni batteri. Nel 1992 Wächtershäuser ha suggerito che versioni arcaiche del ciclo riducente dell'acido citrico sarebbero potute esistere e si sarebbero potute espandere sulle superfici di pirite.
Eredità ed evoluzione nei sistemi metabolici
Attualmente non sono note alternative alla glicolaldeide nella reazione del formosio. La maggior parte dei cambiamenti nell'identità chimica degli intermedi del ciclo sono solo fluttuazioni transitorie o conducono alla distruzione del sistema. Qualora fosse possibile un qualche tipo di eredità in questi cicli, ci si aspetterebbe che la variazione dell'eredità fosse molto rara, più vicina a quelle che i biologi chiamano macromutazioni. L'eredità, quand'anche possibile, sarebbe limitata. Questo significa che in un dato sistema il numero di tipi possibili sarebbe minore del numero di individui e in queste circostanze l'evoluzione per selezione naturale si ferma subito.
Un altro aspetto importante è la mancanza di modularità in questi replicatori. Il DNA viene copiato mediante l'addizione sequenziale di moduli, complementari ad altri moduli alloggiati nel filamento parentale, mentre ciò non avviene nei cicli metabolici olistici qui considerati: c'è bisogno dell'intera serie di trasformazioni chimiche finché, quasi per miracolo, appaiono due individui del tipo iniziale (fig. 5).
L'ultimo aspetto importante è che, in questo caso, l'eredità è basata sulla natura dinamica di tutte le reazioni chimiche importanti della rete, perciò gli stati ereditari devono essere stati dinamici stabili. Tali sistemi di eredità sono stati chiamati sistemi a stati stazionari o sistemi basati su un attrattore. Il problema è comprendere come l'evoluzione possa aver proceduto da replicatori così semplici fino a qualcosa come l'RNA.
Le reti di peptidi autocatalitici
Un altro tipo di approccio metabolico è quello basato su reti di proteine mutuamente autocatalitiche, prese in considerazione da Manfred Eigen, Freeman G. Dyson e Stuart A. Kauffman tra gli anni Settanta e Ottanta del XX secolo. Esse si basano sull'interconversione di oligo- e polipeptidi, catalizzata dai peptidi stessi. Data un'adeguata fonte di amminoacidi come cibo, un sistema siffatto dovrebbe crescere autocataliticamente. Si noti che questo sistema è modulare, ma ancora basato su un attrattore: in generale, i peptidi non sottostanno a una replicazione mediata da uno stampo come avviene per gli acidi nucleici. Tuttavia, sorgono almeno due problemi: il numero irrealisticamente alto di reazioni differenti che ogni peptide della rete dovrebbe catalizzare, e l'ipotesi che le reazioni catalizzate siano tutte potenzialmente vantaggiose. Invece, la maggioranza delle possibili reazioni porterà fuori dal sistema. Per avere una chiusura catalitica, si deve avere una rete relativamente grande. Più grande è la rete, maggiore è il numero di reazioni secondarie che possono verificarsi, per cui sarebbe preferibile un sistema di piccole dimensioni. Chiaramente, non si possono avere entrambe le cose. Finora non è stata trovata una soluzione soddisfacente a questo problema e va notato che ciò è applicabile a tutte le teorie metaboliche.
Reti di oligonucleotidi autocatalitici?
Un altro esempio di replicatore basato su un attrattore, ma modulare, sarebbe una popolazione di molecole di RNA che potessero replicarsi solo attraverso il mutuo aiuto eterocatalitico fornito per la saldatura dei monomeri. Queste reti possono aver costituito uno stadio intermedio tra i replicatori olistici e i sistemi basati sull'immagazzinamento dell'informazione di un mondo a RNA. Se siano veramente esistite resta una questione aperta.
L'eredità di membrana e il mondo a lipidi
Harold J. Morowitz ha ipotizzato nel 1992 la possibilità che una replicazione ereditaria delle membrane abbia svolto un ruolo importante agli albori dell'evoluzione. Anche la membrana del chemoton è un sistema a crescita autocatalitica. Nel 2001, inoltre, Daniel Segré e collaboratori hanno presentato una versione molto più sofisticata di quest'idea proponendo lo scenario del mondo a lipidi. In prima approssimazione il loro sistema è una versione a lipidi delle reti di proteine mutuamente autocatalitiche. Esistono, tuttavia, due differenze importanti: il sistema di Segré è olistico ed è spazialmente confinato grazie al fatto che i costituenti lipidici formano una vescicola. Questo confinamento ha una conseguenza dinamica molto importante: i lipidi che formano una vescicola possono appartenere solo a un piccolo gruppo tra tutti quelli possibili, a causa dei limiti fisici imposti dalle dimensioni della vescicola. Le simulazioni mostrano che questa selezione limitata promuove un comportamento di tipo ereditario. Anche qui, non si può dire se replicatori lipidici complessi siano possibili o no. In ogni caso, il problema delle reazioni secondarie non è stato risolto neanche per questo tipo di sistemi.
Una buona domanda da porsi è la seguente: da dove potrebbero essere arrivati i costituenti di questo mondo a lipidi? Una volta arrivati, essi si sarebbero autoassemblati, producendo (assieme ad altri) strutture di membrana, ma ciò richiede la disponibilità di molecole adatte alla costruzione di membrane. Le meteoriti potrebbero essere state una fonte esogena di appropriate molecole anfifiliche, e David W. Deamer ha dimostrato che in condizioni opportune sostanze estratte dalle condriti carboniose possono portare alla formazione di vescicole. Tuttavia, i dati a supporto di questa ipotesi sono piuttosto controversi, e non è stato suggerito un meccanismo convincente per la produzione endogena di queste molecole sulla Terra.
L'immagazzinamento digitale dell'informazione e il mondo a RNA
Potenziale ereditario illimitato
Sicuramente, replicatori corti di tipo modulare devono aver preceduto quelli più lunghi. In uno studio pionieristico del 1986 von Kiedrowski riuscì a sintetizzare l'analogo di un esadeossinucleoside in grado di replicarsi senza ausilio enzimatico. Finora sono stati progettati e messi alla prova con successo molti replicatori simili. Questi risultati sono importanti perché dimostrano l'attuabilità di una vera autoreplicazione molecolare. Essi non sono direttamente importanti per la comprensione dell'origine della vita, perché non si è certi che le molecole coinvolte siano effettivamente state dei composti prebiotici. Inoltre, nonostante la replicazione di queste molecole sia modulare, esse consentono un'ereditarietà ancora di tipo limitato, perché le loro piccole dimensioni riducono il numero di sequenze ottenibili. Si conquista la possibilità di un'ereditarietà illimitata quando si raggiungono le dimensioni dei virus.
La natura digitale dell'immagazzinamento dell'informazione negli acidi nucleici consente la microevoluzione e, se la lunghezza dei replicatori è sufficiente, l'ereditarietà illimitata permette all'evoluzione di andare avanti indefinitamente. Ereditarietà illimitata significa che, in un dato sistema, il numero di tipi possibili (in concreto, le sequenze) è molto più grande del numero di individui. Sequenze di RNA di 200 nucleotidi (ca. 3 volte le dimensioni dell'RNA di trasporto) consentono 4200≈10120 possibili sequenze. Con tutta la materia osservabile dell'universo, non si potrebbe costruire un museo che esponga una copia di ciascuna di queste sequenze.
I ribozimi e il mondo a RNA
Il mondo a RNA, termine coniato da Walter Gilbert nel 1986, si rifà ai suggerimenti della fine degli anni Sessanta di Carl R. Woese (1967), Leslie E. Orgel (1968) e Crick (1968). Essi avevano compreso che, poiché l'RNA è una macromolecola costituita da componenti con gruppi funzionali chimicamente differenti e ha una struttura tridimensionale codificata dalla sua stessa sequenza, esso stesso poteva essere servito da catalizzatore primordiale, oltre che da materiale genetico. Questo suggerimento ha ricevuto scarsa attenzione fino alla scoperta degli RNA catalitici (i ribozimi) nei primi anni Ottanta del Novecento. Quasi tutti i ribozimi naturali attualmente esistenti catalizzano reazioni di altri pezzi di RNA, ma esperimenti di genetica in vitro, mediante la selezione artificiale di ribozimi con funzioni predeterminate, hanno dato un forte appoggio all'idea che i ribozimi potrebbero aver avuto funzioni catalitiche generiche e aver diretto il metabolismo primordiale.
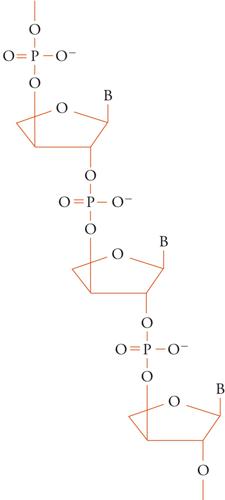
Rimangono da risolvere, comunque, tre problemi importanti. Il primo, è che nessuno sa da dove provenga l'RNA. Si tratta di una molecola troppo complessa per la chimica primordiale. Non si sa per certo quanto ordine ci fosse nel repertorio chimico prima del mondo a RNA. Essenzialmente, ogni costituente dei nucleotidi potrebbero essere stati presenti in tutti i tipi di varianti, e una piccola frazione di essi sarebbe stata in grado di assemblarsi in nucleotidi adatti a costituire un replicatore funzionale. Come abbiamo visto, il metabolismo sopra superfici di supporto potrebbe aver limitato la varietà degli zuccheri, per esempio prediligendo il ribosio nella forma di ribosio-2-4-difosfato. La preferenza per i corretti residui nucleotidici con legame 3',5' potrebbe essere stata catalizzata dall'argilla. Altri pensano che nel replicatore primitivo dovesse essere presente uno zucchero più semplice, come il treoso (TNA) (fig. 6) che è semplice, non ha molte varianti, può formare legami solo in posizioni definite e si forma facilmente nella reazione del formosio. Inoltre, la successiva sostituzione dell'acido nucleico contenente treoso è verosimile in quanto quest'ultimo può appaiare le sue basi non solo con se stesso, ma anche con l'RNA.
Un altro problema è l'inibizione enantiomerica crociata. Questa si riferisce alla più ampia questione dell'omochiralità biomolecolare. Molte molecole organiche possono esistere in due forme, che sono immagini speculari una dell'altra. Tipicamente, i sistemi viventi utilizzano solo una di esse e questo è ciò che si intende per omochiralità. Anche l'RNA è una molecola chirale: le sue unità costituenti sono destrorse. Una miscela di entrambi i costituenti destrorsi e sinistrorsi inibirebbe la replicazione di uno stampo omochirale. Perciò è stato suggerito che sia esistito un precursore non chirale dell'RNA, ma manca tuttora un candidato prebiotico plausibile per questo ruolo.
Il terzo problema con l'RNA è che non è una molecola in grado di autoreplicarsi. Attualmente per replicare gli RNA è necessaria una replicasi proteica di dimensioni notevoli. Un ribozima con funzione di replicasi risolverebbe il problema, ma finora nessuno è riuscito a individuarne uno. Il miglior ribozima con attività RNA-polimerasica attualmente disponibile contiene circa 200 nucleotidi e in 24 ore e mediante l'utilizzazione di uno stampo può aggiungere 14 nucleotidi a un innesco, con una fedeltà media di circa il 97% per nucleotide. Ovviamente, un tale ribozima non può catalizzare la propria replicazione. C'è bisogno di una molecola che sia in grado di estendere l'innesco consentendo di ottenere copie molto più lunghe. Inoltre, come si vedrà, questa fedeltà è sufficiente a mantenere una popolazione di individui costituiti da soli 40 monomeri, ma resta molto incerto se un RNA così piccolo possa fungere da polimerasi attiva. Quand'anche si fosse in grado di individuare una polimerasi così piccola ma efficiente, c'è da tener presente la complicazione aggiuntiva della separazione del filamento stampo da quello copia. La fabbricazione di un RNA veramente in grado di autoreplicarsi sembra che sia un problema davvero arduo.
Come si è visto, a causa delle innumerevoli difficoltà, alcuni immaginano che sia esistito un mondo pre-RNA in cui fosse presente qualcosa di simile all'RNA, ma dotato anche di un potenziale catalitico, in modo che ad esso sia potuto facilmente succedere il mondo a RNA. Purtroppo, la nostra capacità di comprendere un tale tipo di mondo è molto limitata.
Quali potrebbero essere state le potenzialità metaboliche dell'RNA? Un'ovvia condizione è che l'RNA dovrebbe essere stato in grado di catalizzare la propria formazione a partire da componenti più semplici. Al momento non conosciamo ribozimi che possano catalizzare la formazione di ribosio, purine e pirimidine partendo da molecole più semplici, ma è noto un ribozima che può catalizzare l'assemblaggio dei nucleotidi a partire da questi tre componenti. Ciò è importante dal momento che questa reazione è risultata essere notevolmente difficile per la chimica prebiotica. Per le reazioni delle restanti componenti della sintesi dell'RNA si conoscono già i ribozimi adatti, a eccezione che per la replicazione dell'RNA.
L'ambiente chimico necessario
È curioso il fatto che le discussioni sui replicatori solitamente trascurino l'ambiente in cui avviene la replicazione. Ciò è dovuto alla classica tradizione anatomo-fisiologica, che prende poco in considerazione gli aspetti ecologici. Tuttavia, se nell'ambiente ci sono troppe sostanze chimiche, la replicazione verrà ostacolata. D'altro canto se non sono presenti i costituenti elementari dei replicatori molecolari, la replicazione sarà impossibile e si verificherà un deterioramento spontaneo. Ma l'ambiente chimico deve essere ancora più controllato: se gli elementi costituenti sono immersi in un mare di veleni, le reazioni secondarie graveranno il sistema a tal punto che il risultato finale sarà comunque l'estinzione del replicatore.
Uno dei principali problemi relativi all'evoluzione dei primi replicatori è che non si conosce con esattezza quale sia stato l'effettivo ambiente chimico disponibile. Attualmente la replicazione degli acidi nucleici avviene nel complesso ambiente metabolico all'interno delle cellule. Quand'anche il brodo primordiale sia veramente esistito, sarebbe subito servito da nutrimento ai primi sistemi viventi. Per questo motivo, l'ipotesi di un ordine chimico in espansione organizzato su superfici di supporto appare accattivante, perché quell'ordine può aver fornito l'ambiente necessario.
Questioni dinamiche sull'origine della vita
La crescita e la coesistenza dei replicatori non enzimatici
Come si è già detto, i primi eventi replicativi devono essersi verificati senza ausilio enzimatico, il che fa sorgere il problema della selettività e quello della separazione dei filamenti. L'elegante (ma parziale) soluzione di von Kiedrowski è di ricorrere a molecole corte. In questo caso lo stampo e la copia si dissociano spontaneamente uno dall'altra per poi riprendere un nuovo ciclo di replicazione. Sorprendentemente, è stato scoperto che la cinetica (la velocità) della replicazione di simili replicatori artificiali è subesponenziale o parabolica. Ciò ha importanti conseguenze per la dinamica della selezione naturale tra queste entità. Per comprendere questo aspetto è stato presentato un piccolo modello. Il sistema di riproduzione più semplice è la fissione binaria dell'oggetto parentale, di cui la stechiometria formale è
[4] A + S → 2A + W
dove A è un replicatore, e S e W sono rispettivamente le materie prime e il materiale di scarto. L'equazione cinetica associata descrive un processo di crescita maltusiano:
[5] formula
che significa che la crescita di x (la concentrazione di A) è esponenziale con una costante di velocità per capita k, posto che la concentrazione di S rimanga stazionaria. Quando due replicatori con differenti costanti di velocità crescono assieme, quello con k maggiore sopravanzerà l'altro. Ciò, ovviamente, è elementare, ma a fini didattici è meglio esprimerlo tramite i rapporti delle concentrazioni crescenti:
[6] formula
che dimostra che, anche in un sistema a crescita libera, la popolazione che cresce nel modo peggiore al limite tende a sparire. Si tratta di una dimostrazione molto semplificata di sopravvivenza del più adatto.
La crescita parabolica si ha quando nell'equazione
[7] formula
p è compreso tra 0 e 1. Se p=1/2, la soluzione si riduce a
[8] formula
Questo è il motivo per cui questo tipo di crescita è chiamato parabolico.
La crescita parabolica comporta la sopravvivenza di tutti in una situazione competitiva. Per constatarlo si consideri la concentrazione relativa di due replicatori che crescano in modo parabolico nello stesso ambiente:
[9] formula
e al limite:
[10] formula.
In questo modo, la sopravvivenza di tutti è garantita.
Il motivo per cui i replicatori del tipo di quelli di von Kiedrowski mostrano una crescita di tipo parabolico è il seguente: si assuma che una molecola stampo A reagisca con una fonte di materie prime formando una nuova copia di A, che rimane associata allo stampo:
[11] formula
È cruciale la relazione tra le costanti di velocità a≫b>c, cioè l'associazione di due molecole stampo è più rapida della loro dissociazione e la replicazione per sé fa da limite alla velocità. Va notato che il prodotto immediato di copiatura è il complesso AA inerte dal punto di vista replicativo. Perciò, la replicazione in questo senso è autolimitante. Maggiore è la concentrazione di A, più forte sarà questa autolimitazione. Si noti, inoltre, che questo tipo di replicazione è conservativa: non c'è sovrapposizione materiale tra la copia e lo stampo e per di più lo stampo e la copia sono esattamente identici e anche complementari.
Come appare chiaro dalle reazioni precedenti, la velocità di replicazione è determinata dalla concentrazione di A libero, e a concentrazioni totali sufficientemente elevate di A (indicate da x) e di AA (indicate da y), la prima è irrilevante in quanto l'associazione è maggiore della dissociazione. La formazione e la dissociazione di AA sono in stato di quasi-equilibrio, per cui
[12] formula
e quindi
[13] formula
che è formalmente identica alla [7], p=1/2.
Una dettagliata teoria cinetica per la crescita parabolica di replicatori minimi è stata elaborata nel 1993 da von Kiedrowski, dalla quale emerge che tra questi replicatori la sopravvivenza di tutti è un fenomeno piuttosto diffuso.
Uno dei passaggi importanti dell'evoluzione prebiotica deve quindi essere stata la comparsa di replicatori con crescita esponenziale. Esistono modelli teorici che prevedono un replicatore basato su peptidi con una costante di velocità p=0,9, in conseguenza dei limiti sterici dei replicatori, per cui stampo e copia si respingono a vicenda quando la sintesi del nuovo filamento è completa.
Ma questo particolare replicatore mostra ancora una crescita subesponenziale, che implica una coesistenza all'equilibrio di selezione. C'è una via d'uscita? È ipotizzabile che una selezione cromatografica possa identificare il replicatore più adatto (cioè quello con k più elevata). Si immagini che i doppi filamenti (AA) si leghino a una superficie cromatografica con maggior forza rispetto ai filamenti singoli (A). Si determina così una maggiore velocità di rilascio dei filamenti singoli rispetto ai filamenti doppi. I calcoli dimostrano che in queste condizioni c'è un ampio margine per la sopravvivenza del migliore.
Il processo SPREAD (Surface-promoted replication and exponential amplification of DNA analogues) di von Kiedrowski presenta un meccanismo non autonomo, ma anche non enzimatico e mediato da una superficie, di replicazione esponenziale tramite stampo. Se ciascuno stampo è legato a una superficie tramite un'estremità e anche le copie hanno la possibilità di essere legate fino al completamento della replicazione, ciò porta necessariamente al raddoppiamento del numero dei replicatori in ciascuna generazione. Comunque, una plausibile alternativa prebiotica non è disponibile.
La soglia d'errore della replicazione e il paradosso di Eigen
La maggior parte della ricerca in questo campo si concentra sulle indagini strutturali. Si sa, tuttavia, dagli studi pionieristici di Eigen (1971) che la dinamica temporale non può essere ignorata. Egli ha espresso chiaramente quel che attualmente viene indicato come 'il paradosso di Eigen' sull'origine della vita. La replicazione procede sempre con una precisione non assoluta: gli inserimenti di nucleotidi inesatti negli acidi nucleici sono detti mutazioni. L'attuale tasso d'errore nella replicazione degli acidi nucleici è nell'ordine di 10−4÷10−8/nucleotide/replicazione. In epoca primordiale, la precisione nella replicazione deve essere stata molto inferiore e i tassi di errore probabilmente dovevano essere superiori a 10−2/ nucleotide/replicazione. Il problema è che il carico mutazionale limita le dimensioni del genoma mantenibili mediante selezione. Perciò, le molecole primordiali del tipo degli acidi nucleici probabilmente non possono essere state più lunghe di circa 100 nucleotidi, cioè le dimensioni degli attuali tRNA. Queste dimensioni sono appena sufficienti per un piccolo gene, il che implica che i geni di un genoma primordiale devono essere stati non concatenati tra loro. Ma se non erano concatenati, erano pronti a competere tra loro (differenze nella sequenza e nella struttura tridimensionale si traducono in diverse velocità di replicazione), il che significa la fine del genoma segmentato.
Selezione naturale e struttura delle popolazioni
Per risolvere il paradosso di Eigen sono state suggerite numerose soluzioni e sostanzialmente tutte si basavano su un qualche tipo di popolazione strutturata. La più semplice, e probabilmente la più antica, è la selezione naturale su una superficie. Grazie al fatto che su una superficie i geni adsorbiti interagiscono solo con i loro vicini, diventa possibile la coesistenza di più geni diversi. Ciò può essere spiegato con il fatto che un gene a basso tasso di replicazione potrebbe associarsi funzionalmente con altri geni nelle immediate vicinanze, mentre è più probabile che un gene che si replica più in fretta venga circondato da copie di se stesso, rendendo impossibile la complementazione metabolica fornita da altri geni.
Una recente applicazione di questo effetto è correlata con il problema della soglia d'errore e con la possibilità di selezione a favore di replicasi sempre migliori su una superficie minerale. È stato recentemente proposto un modello basato su questo processo selettivo, con molecole sempre più lunghe che diventano replicasi sempre più efficienti, risolvendo così potenzialmente il problema di Eigen mediante l'innalzamento quasi continuo della soglia d'errore, con la guida della selezione naturale a favore della maggiore efficienza. Rimane, tuttavia, un problema essenziale: piccole molecole, con il solo aiuto per la replicazione fornito loro da replicasi più efficienti, sono di fatto in grado di distruggere il sistema in un reattore continuo opportunamente rimescolato (cioè omogeneo in ogni sua parte). Ciò, però, non è vero su una superficie, perché è stato dimostrato che gli stampi adsorbiti su una superficie evolvono in una popolazione bimodale: replicasi lunghe, efficienti e accurate coesistono con forme parassitarie più corte. Si noti che anche lo SPREAD si basava su una superficie che consentiva di amplificare esponenzialmente gli stampi. In futuro nuovi esperimenti potrebbero trovare ulteriori punti di contatto tra questi due aspetti.
Un'altra possibile soluzione è stata data dal modello del correttore stocastico. Volendo semplificare, si tratta di un'implementazione di genetica di popolazioni del chemoton che prevede l'uso di RNA catalitici (fig. 7). Benché ci sia competizione tra geni diversi nello stesso chemoton, esiste una selezione anche tra chemoton diversi. Gli stampi sono allocati casualmente nella progenie di vescicole. Ciò (e alcune altre sorgenti di stocasticità) genera variazioni tra i chemoton, sulle quali può agire la selezione naturale. La selezione a livello più alto contrasta con successo quella a livello più basso: un tema ricorrente nelle transizioni evolutive.
L'origine del codice genetico e della traduzione
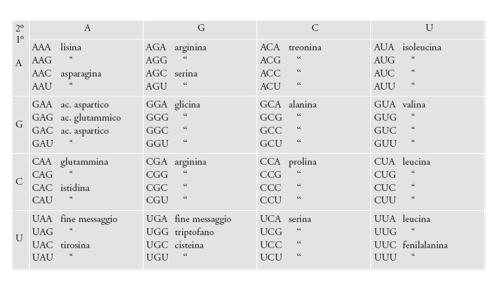
Si pensava che il codice genetico fosse universale, ora invece sappiamo che in alcuni organismi ne esistono dei dialetti. La versione mostrata nella fig. 8 è quella più comune, il codice canonico: si tratta sostanzialmente di una tabella che mostra come le triplette che costituiscono gli acidi nucleici specifichino gli amminoacidi durante la biosintesi delle proteine man mano che il ribosoma legge il messaggio contenuto nell'acido nucleico. La conoscenza del codice genetico è geneticamente specificata ed è evidente nell'attività delle amminoacil-tRNA sintetasi che legano i vari amminoacidi con gli appropriati tRNA, i quali recapitano poi ciascun amminoacido al ribosoma. Il ribosoma è una fabbrica sopramolecolare, costituita da più di 50 molecole, di cui tre sono RNA. Il messaggio genetico immagazzinato nel DNA viene recapitato al ribosoma dall'RNA messaggero (mRNA). Le triplette consecutive sono chiamate codoni. I tRNA si legano ai codoni con cui riescono ad appaiarsi tramite anticodoni complementari.
Un problema notoriamente complesso è sempre stato quello di capire come un meccanismo così complicato si sia potuto realizzare, ammesso che sia sempre stata necessaria una stretta collaborazione tra proteine e acidi nucleici. L'idea del mondo a RNA eliminerebbe questo problema. A parte il processo di sintesi dei peptidi in sé, tutti i processi per la formazione dei vari componenti possono essere stati catalizzati da ribozimi attualmente noti. Va notato che tuttora è l'RNA, e non le proteine, a catalizzare il passaggio cruciale del legame dell'amminoacido in ingresso nella catena peptidica in crescita sul ribosoma.
Non si sa come e quando il codice genetico sia entrato in gioco. È piuttosto probabile che sia giunto tardi, in sistemi (probabilmente viventi) già evoluti. Ma ciò implica che l'origine del codice genetico non debba più essere considerata un problema riguardante l'origine della vita, dal momento che quest'ultima lo ha preceduto. Ciò nonostante, considerando che tutte le forme di vita tuttora esistenti si basano su questo codice, bisogna accennare a questo problema.
Scenari di preadattamento per l'origine del codice vengono proposti sempre più spesso. Un preadattamento è un carattere di un'unità in evoluzione sviluppatosi per servire alla funzione a, che risulta essere utile ‒ a livello rudimentale ‒ anche per la funzione b. Un esempio è quello delle penne. Inizialmente esse non erano usate per volare, ma per mantenere caldo l'animale. Grazie alla loro struttura esse furono d'aiuto anche per forme rudimentali di volo e alla fine vennero selezionate penne utili per il volo di per sé.
È importante notare che il problema dell'origine del codice genetico dovrebbe essere considerato da due punti di vista: a partire dalle conoscenze chimiche e analizzando gli schemi percepibili nella struttura del codice genetico attuale. Prima prenderemo in considerazione questi schemi, poi si darà un rapido cenno a un possibile scenario sull'origine del codice.
Schemi nel codice genetico
L'assegnazione degli amminoacidi alle triplette non sembra un evento casuale (fig. 8). È noto da molto tempo che la base azotata che si trova nel mezzo della tripletta determina indiscutibilmente la natura chimica dell'amminoacido che viene codificato. Indipendentemente dal meccanismo d'origine, un tale schema è tuttora adattativo. Se codoni vicini specificano amminoacidi chimicamente correlati, ciò rende le conseguenze di alcune mutazioni negli acidi nucleici meno deleterie per l'organismo quando vengano espresse nelle proteine. Analisi statistiche confermano che questo schema è importante: in mezzo a un numero iperastronomico di possibili alternative (ottenibili mediante le permutazioni delle assegnazioni degli amminoacidi nella fig. 8), il codice canonico eccelle nel ridurre il carico mutazionale e anche le conseguenze degli errori di traduzione.
Un altro schema noto da tempo è la relazione tra i percorsi biosintetici degli amminoacidi e l'assegnazione degli amminoacidi a determinati codoni nel codice genetico. Per meglio dire, sembra che la prima base del codone sia associata alla famiglia biosintetica dell'amminoacido correlato. Dal momento che le due caratteristiche degli amminoacidi, natura chimica e appartenenza a una famiglia biosintetica, sembrano essere associate a differenti posizioni nel codone (rispettivamente la base nel mezzo e la prima) non sorprende che si sia detto che esse abbiano effetti statistici indipendenti sull'organizzazione del codice genetico.
Recentemente, la validità dello schema basato sulla biosintesi è stata messa in dubbio e nella sua formulazione completa può non essere sostenibile. Per formulazione completa s'intende l'affermazione che gli amminoacidi siano stati assegnati a codoni vicini sulla base delle relazioni tra precursore e prodotto. Storicamente, ciò implicherebbe la coevoluzione tra codoni e amminoacidi: il posto e l'ordine di assegnazione rifletterebbero quindi la comparsa degli amminoacidi nella biosintesi.
Dal mondo a RNA al mondo a RNA e proteine
Ci limiteremo alla discussione sull'origine del codice genetico supponendolo inserito nel mondo a RNA e questo per le seguenti ragioni: (a) si hanno ormai forti indicazioni che il mondo a RNA possa essere stato metabolicamente complesso; (b) un percorso evolutivo che abbia condotto fuori dal mondo a RNA sembra attuabile; (c) il problema da risolvere viene semplificato; (d) la mancanza di spazio non ci consente di prendere in esame altri scenari.
È praticamente ovvio che se il codice genetico ha avuto origine nel mondo a RNA, tutti i componenti dell'iniziale sistema codificato dovevano avere l'RNA come costituente critico. Quindi, è presumibile che gli amminoacidi venissero riconosciuti e manipolati dai ribozimi. Ciò getta, inoltre, nuova luce sulla cosiddetta ipotesi stereochimica del codice genetico, che sostiene che la codificazione fosse specificata mediante un'interazione diretta (tipo chiave-serratura) tra gli amminoacidi e i codoni/anticodoni. L'ipotesi del mondo a RNA suggerisce che questo tipo di interazione avrebbe potuto essere inserita nel contesto dei ribozimi più grandi. Questa sarebbe una prima forma della visione stereochimica, correlata al mondo a RNA. Una seconda versione direbbe che i ribozimi con funzione di sintetasi avrebbero catalizzato l'assegnazione di codoni e anticodoni agli amminoacidi nello stesso modo con cui lo fanno ora le sintetasi proteiche, cioè riconoscendo l'amminoacido e il tRNA appropriato mediante due differenti siti di legame. Perciò nella seconda forma ci sarebbe una combinazione stereochimica tra un motivo a RNA del ribozima con attività sintetasica e l'amminoacido, ma il primo può non essere simile al codone o all'anticodone.
Alcuni esperimenti di fatto suggeriscono che l'evoluzione nel mondo a RNA possa essere passata attraverso entrambe le ipotesi. Si è scoperto che molecole di RNA selezionate artificialmente a favore del legame con gli amminoacidi hanno una sovrarappresentazione statisticamente significativa delle sequenze codoniche (talvolta anticodoniche) nel sito di legame. Ciò si verifica per l'arginina, la tiroxina e l'isoleucina, ma non per la fenilalanina, benché l'RNA possa riconoscere anche quest'ultima. Quindi, durante l'assegnazione della fenilalanina può essersi verificata la seconda ipotesi.
Tutto ciò lascia aperta la questione del vantaggio selettivo del legame e dell'utilizzo degli amminoacidi in un mondo a RNA. Un possibile suggerimento è che gli amminoacidi o i peptidi (costituiti da pochi amminoacidi) possano essersi associati vantaggiosamente all'RNA per aumentare le potenzialità catalitiche dei ribozimi. In quest'ipotesi gli amminoacidi sarebbero stati attaccati a piccole molecole di RNA da ribozimi di caricamento, che rappresentano la forma più antica di tRNA e di sintetasi. Le corte forcine di RNA sarebbero state legate solo agli amminoacidi appropriati e i ribozimi nella cellula avrebbero utilizzato queste molecole come coenzimi, riconoscendole mediante l'anticodone nel manico dell'RNA (da cui il termine ipotesi del manico del coenzima codificante). La codificazione sarebbe quindi stata vantaggiosa senza e prima della traduzione, il che renderebbe questa difficile transizione evolutiva un processo sviluppatosi per gradi.
Col tempo un numero sempre maggiore di questi coenzimi sarebbe stato usato dai ribozimi attaccati a posizioni (triplette) adiacenti/contigue. Così gli amminoacidi adiacenti, ancora legati al loro manico, sarebbero stati in grado di agire in modo sinergico. Alcuni di loro, poi, potrebbero essere stati legati assieme da un antico ribozima con funzione peptidil-transferasica, l'antenato di uno degli odierni RNA ribosomali. In questo modo i polipeptidi avrebbero aumentato le proprie dimensioni, mentre la maggior parte dei ribozimi sarebbero stati trasformati in RNA messaggeri.
Chiaramente, questo scenario è ipotetico, ma verificabile. Un importante risultato è stata la dimostrazione che l'efficienza di un enzima costituito da un acido nucleico può essere aumentata di diversi ordini di grandezza utilizzando l'amminoacido istidina come cofattore. Saranno comunque necessari molti altri esperimenti prima di poter risolvere almeno approssimativamente il difficile problema dell'origine della traduzione.
7. Approcci combinati: verso una protocellula sperimentale
Quando sono entrate in scena le protocellule?
Sarebbe utile chiedersi fino a che punto la costruzione logica del chemoton possa aiutare a comprendere il processo storico dell'origine della vita. Gánti ha considerato un punto di vista essenzialmente empedocleo: egli ha immaginato che potenziali sottosistemi del chemoton fossero sorti indipendentemente, seguiti dalla selezione di varie combinazioni. Questo punto di vista può essere sbagliato. Benché siano stati fatti tentativi promettenti verso la sintesi di sistemi simili al chemoton, l'incorporazione di un metabolismo non enzimatico può essere impossibile all'infinito. Al contrario, diversi studiosi sostengono che l'evoluzione precellulare potrebbe essere progredita fino alla comparsa dei ribozimi, prima della generazione spontanea di sistemi simili al chemoton. Se questa visione risulterà corretta i chemoton più primitivi utilizzavano ribozimi già dal loro esordio.
Un'ipotesi è che la polimerizzazione mediata da uno stampo si sia verificata all'interno di vescicole lipidiche in grado di riprodursi. Esistono però due inconvenienti. Il primo è che lo stampo è polimerizzato da un enzima proteico fornito dall'esterno. Il secondo è che la polimerizzazione dello stampo non è sincronizzata con la crescita e la scissione della vescicola. L'incorporazione di un ciclo metabolico è un problema enorme, dal momento che per la polimerizzazione dello stampo non è garantita la fornitura di unità costituenti sufficientemente pure.
Protocellule senza un sottosistema metabolico: i veri eterotrofi?
Nel 2001 Jack W. Szostak e collaboratori hanno delineato un programma di ricerca che ha come scopo la sintesi della vita, sotto forma di una cellula semplice. Il sistema immaginato è costituito da una membrana, in grado di crescere e dividersi con modalità autocatalitiche, e da due ribozimi specifici. Il primo ribozima è una replicasi generica, in grado di replicare altre copie di se stessa o di altri tipi di molecole. L'altro ribozima ha parte attiva nella sintesi dei lipidi. In questo modo l'associazione tra stampi e membrana è di tipo catalitico. Materie prime complesse, come i monomeri per la replicazione dell'RNA o i precursori dei lipidi, vengono prese dal mezzo esterno.
Può essere possibile costruire un sistema di questo tipo, sebbene il trasporto attraverso la membrana e la sincronia tra replicazione dello stampo e accrescimento della membrana pongano particolari problemi. (Si ricordi che nel chemoton l'accoppiamento fondamentale tra questi due sistemi è su base stechiometrica.)
Bibliografia
Bartel, Unrau 1999: Bartel, David P. - Unrau, Peter J., Constructing an RNA world, "Trends in cell biology", 9, 1999, pp. M9-M13.
Cairns-Smith 1982: Cairns-Smith, A. Graham, Genetic takeover and the mineral origins of life, Cambridge, Cambridge University Press, 1982.
Crick 1968: Crick, Francis H.C., The origin of the genetic code, "Journal of molecular biology", 38, 1968, pp. 367-379.
Cronin 1998: Cronin, John R., Clues from the origin of theSolar System: meteorites, in: The molecular origins of life. Assembling pieces of the puzzle, edited by André Brack, Cambridge, Cambridge University Press, 1998, pp. 119-146.
Deamer 1985: Deamer, David W., Boundary structures are formed by organic components of the Murchison carbonaceous chondrite, "Nature", 317, 1985, pp. 792-794.
Dyson 1985: Dyson, Freeman G., Origins of life, Cambridge, Cambridge University Press, 1985.
Eigen 1971: Eigen, Manfred, Self-organization of matter and the evolution of biological macromolecules, "Naturwissen-schaften", 58, 1971, pp. 465-523.
Ferris 1996: Ferris, James P. e altri, Synthesis of long prebiotic oligomers on mineral surfaces, "Nature", 381, 1996, pp. 59-61.
Gánti 2003: Gánti, Tibor, The principles of life, Oxford, Oxford University Press, 2003.
Huber, Wächtershäuser 1997: Huber, Claudia - Wächters-häuser, Günter, Activated acetic acid by carbon fixation on (Fe,Ni)S under primordial conditions, "Science", 276, 1997, pp. 245-247.
Illangasekare, Yarus 2002: Illangasekare, Mali - Yarus, Michael, Phenylalanine-binding RNAs and genetic codeevolution, "Journal of molecular evolution", 54, 2002, pp. 298-311.
Johnston 2001: Johnston, Wendy K. e altri, RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension, "Science", 292, 2001, pp. 1319-1325.
Joyce 2002: Joyce, Gerald F., The antiquity of RNA-basedevolution, "Nature", 418, 2002, pp. 214-221.
Kauffman 1993: Kauffman, Stuart A., The origins of order, New York, Oxford University Press, 1993.
Knight 1999: Knight, Robin D. - Freeland, Stephen J. - Landweber, Laura E., Selection, history and chemistry: three faces of the genetic code, "Trends in biochemical sciences", 24, 1999, pp. 241-247.
Lee 1996: Lee, David H. e altri, A self-replicating peptide, "Nature", 382, 1996, pp. 525-528.
Luther 1998: Luther, Anatol - Brandsch, Romana - von Kiedrowski, Günter, Surface-promoted replication and exponential amplification of DNA analogues, "Nature", 396, 1998, pp. 245-248.
Maynard Smith 1970: Maynard Smith, John, Natural selection and the concept of a protein space, "Nature", 225, 1970, pp. 563-564.
Maynard Smith 1986: Maynard Smith, John, The problems of biology, Oxford, Oxford University Press, 1986.
Maynard Smith, Szathmáry 1999: Maynard Smith, John - Szathmáry, Eörs, The origins of life, Oxford, Oxford University Press, 1999.
Miller 1953: Miller, Stanley L., Production of amino acids under possible primitive Earth conditions, "Science", 117, 1953, pp. 528-529.
Mojzsis 1996: Mojzsis, Steve J. e altri, Evidence for life on Earth before 3,800 million years ago, "Nature", 384, 1996, 55-59.
Morowitz 1992: Morowitz, Harold J., Beginnings of cellular life, New Haven, Yale University Press, 1992.
Muñoz Caro 2002: Muñoz Caro, Guillermo M. e altri, Amino acids from ultraviolet irradiation of interstellar ice ana-logues, "Nature", 416, 2002, pp. 403-406.
Orgel 2000: Orgel, Leslie E., Self-organizing biochemicalcycles, "Proceedings of the National Academy of Sciences USA", 97, 2000, pp. 12503-12507.
Oró 1961: Oró, Juan, Comets and the formation of biochem-ical compounds on the primitive Earth, "Nature", 190, 1961, pp. 389-390.
Paul, Joyce 2002: Paul, Natasha - Joyce, Gerald F., A self-replicating ligase ribozyme, "Proceedings of the National Academy of Sciences USA", 99, 2002, pp. 12733-12740.
Poole 1999: Poole, Anthony - Jeffares, David - Penny, Daniel, Early evolution: prokaryotes, the new kids on the block, "Bioessays", 21, 1999, pp. 880-889.
Schidlowski 2002: Schidlowski, Manfred, Sedimentary carbon isotope archives as recorders of early life: implications for extraterrestrial scenarios, in: Fundamentals of life, edited by Gyula Pályi, Claudia Zucchi, Luciano Caglioti, Paris, Elsevier, 2002.
Segré 2001: Segré, Daniel e altri, The lipid world, "Origins of life and evolution of the biosphere", 31, 2001, pp. 119-145.
Sievers, von Kiedrowski 1994: Sievers, D. - von Kiedrow-ski, Günter, Self-replication of complementary nucleotide-based oligomers, "Nature", 369, 1994, pp. 1-224.
Szathmáry 1990: Szathmáry, Eörs, Towards the evolution of ribozymes, "Nature", 1990, 344, p. 115.
Szathmáry 1999: Szathmáry, Eörs, The origin of the genetic code. Amino acids as cofactors in an RNA world, "Trends in genetics", 15, 1999, pp. 223-229.
Szathmáry 2000: Szathmáry, Eörs, The evolution of replicators, "Philosophical transactions of the Royal Society of London B", 355, 2000, pp. 1669-1676.
Szathmáry 2002: Szathmáry, Eörs, Units of evolution and units of life, in: Fundamentals of life, edited by Gyula Pályi, Claudia Zucchi, Luciano Caglioti, Paris, Elsevier, 2002, pp. 181-195.
Szostak 2001: Szostak, Jack W. - Bartel, David P. - Luisi, P. Luigi, Synthesizing life, "Nature", 409, 2001, pp. 387-390.
Von Kiedrowski 1986: von Kiedrowski, Günter, A self-replicating hexadeoxy nucleotide, "Angewandte Chemie. International edition", 25, 1986, pp. 932-935.
Von Kiedrowski 1993: von Kiedrowski, Günter, Minimal replicator theory I: parabolic versus exponential growth, "Bioorganic chemistry frontiers", 3, 1993, pp. 113-146.
Von Kiedrowski 1996: von Kiedrowski, Günter, Primordial soupe or crêpes?, "Nature", 381, 1996, pp. 20-21.
Von Kiedrowski, Szathmáry 2000: von Kiedrowski, Günter - Szathmáry, Eörs, Selection versus coexistence of parabolic replicators spreading on surfaces, "Selection", 1, 2000, pp. 173-179.
Wächtershäuser 2000: Wächtershäuser, Günter, Origin of life. Life as we don't know it, "Science", 289, 2000, pp. 1307-1308.
Woese 1967: Woese, Carl R., The genetic code, New York, Harper & Row, 1967.
Wong 1991: Wong, J. Tze-Fei, Origin of genetically encoded protein synthesis: A model based on selection for RNA peptidation, "Origins of life and evolution of the biosphere", 21, 1991, pp. 165-176.
Yarus 2000: Yarus, Michael, RNA-ligand chemistry: a testable source for the genetic code, "RNA", 6, 2000, pp. 475-484.
Zintzaras 2002: Zintzaras, Elias - Mauro, Santos - Szathmáry, Eörs, "Living" under the challenge of information decay: the stochastic corrector model versus hypercycles, "Journal of theoretical biology", 217, 2002, pp. 167-181.