Catalisi ambientale
Catalisi ambientale
Con l’espressione catalisi ambientale si indica l’insieme dei processi e delle tecnologie che adoperano catalizzatori in grado di ridurre l’impatto sull’ambiente dei processi produttivi e delle tecnologie inquinanti.
Nel XX sec. la catalisi ha rappresentato il fulcro dello sviluppo dell’industria chimica e della raffinazione del petrolio, ma solo a partire dagli anni Novanta la sua applicazione alle problematiche ambientali si è affermata come un campo specifico di indagine e di impiego. In senso stretto, la catalisi ambientale include solo le applicazioni che riducono le emissioni di composti inquinanti o eliminano inquinanti presenti nell’ambiente. In una definizione più estesa, essa comprende anche tutti gli usi della catalisi (principalmente di quella eterogenea) che consentono l’eliminazione dello zolfo dalle frazioni petrolifere durante la loro combustione, con conseguente riduzione delle emissioni di ossidi di zolfo (SOx), nonché i processi catalitici di miglioramento della qualità delle benzine o del diesel, che permettono la riduzione delle emissioni del particolato (PM), degli idrocarburi aromatici e del monossido di carbonio (CO) dagli autoveicoli. Inoltre, essa comprende i processi catalitici di sintesi di prodotti alternativi ai clorofluorocarburi (CFC) e quelli per la riduzione delle emissioni di gas a effetto serra (come la riutilizzazione dell’anidride carbonica, CO2).
In una definizione ancora più estesa, la catalisi ambientale include anche i processi catalitici in grado di ridurre l’uso di materie prime e di fonti energetiche; di prodotti chimici pericolosi (per es., la sostituzione del fosgene con il dimetilcarbonato); degli stadi di sintesi e di alcuni solventi (con introduzione di nuovi processi catalitici multistadio). Essa, infine, comprende anche i processi in grado di convertire i rifiuti in prodotti utili (per es., il riuso di sottoprodotti ramificati nella produzione dell’adiponitrile, precursore del nylon 6,6) o quelli capaci di diminuire alcune emissioni (per es., l’uso delle celle a combustibile invece dei motori a combustione). Nel contesto appena delineato, con il termine catalizzatore si indica l’effettivo elemento catalitico (generalmente ossidi misti, materiali di tipo zeolitico o metalli supportati nel caso di applicazione di catalisi per ildisinquinamento), mentre con l’espressione tecnologia ca-talitica si intende l’insieme costituito dal catalizzatore, dalsuo supporto strutturale e dal reattore. Questi ultimi sono tanto importanti quanto il catalizzatore nel determinare il comportamento catalitico della tecnologia e rivestono un ruolo fondamentale, in particolare nel caso del disinquinamento.
L’utilizzazione di catalizzatori per la depurazione delle emissioni da autoveicoli, ossia l’introduzione delle marmitte catalitiche, è stato il primo esempio commerciale, su larga scala, d’impiego di tecnologie catalitiche per il trattamento di emissioni inquinanti al di fuori del settore chimico o energetico. Tuttavia esistono numerosi altri esempi rilevanti di depurazione, come l’eliminazione degli ossidi d’azoto (NOx) da sorgenti fisse; l’eliminazione di composti a base di zolfo da emissioni gassose; la conversione dei gas a effetto serra; l’ossidazione totale di composti organici volatili. Settori più recenti della catalisi ambientale sono inoltre i processi catalitici per il trattamento di emissioni liquide; per la conversione di rifiuti solidi (polimeri e altri); per il miglioramento della qualità dell’aria in ambienti chiusi; per la riduzione dell’ozono.
Depurazione delle emissioni da sorgenti mobili
I principali tipi di motori a combustione interna utilizzati negli autoveicoli sono quelli a benzina (ciclo Otto) e quelli diesel (ciclo Diesel), questi ultimi utilizzati in Europa in oltre il 55% dei nuovi veicoli leggeri e nella quasi totalità dei motori per i veicoli pesanti (autocarri, autobus, trattori, motori marini). Una differenza fondamentale tra i due motori è il metodo d’introduzione dell’aria e del combustibile nei loro cilindri, che comporta notevoli differenze nella composizione delle loro emissioni: per esempio, nei motori diesel – diversamente da quelli a benzina – è necessario operare sempre in eccesso di aria per evitare la formazione eccessiva di particolato. In entrambi i casi, le emissioni sono caratterizzate dalla presenza di composti tossici (quali monossido di carbonio e alcuni prodotti dell’ossidazione incompleta degli idrocarburi presenti nel combustibile), negativi per la salute (NOx) o con effetto carcinogenico (composti aromatici policiclici), che possono anche dare luogo a inquinamento secondario: gli NOx e gli idrocarburi (HC), infatti, generano ozono e smog in seguito a reazioni fotochimiche nell’atmosfera; gli NOx, inoltre, sono ossidati ad acido nitrico (HNO3) che contribuisce all’acidificazione della pioggia (piogge acide). Anche la formazione di particolato (specialmente nel caso dei motori diesel) ha effetti negativi sulla salute; esso può, infatti, adsorbire sostanze cancerogene, metalli pesanti, solfati e nitrati che possono avere un’azione irritante. Il carattere altamente nocivo dipende anche dalle dimensioni delle particelle, poiché solo le frazioni più fini possono arrivare sino alle parti profonde dell’apparato respiratorio. Per questa ragione, si prende in considerazione soprattutto la misura della componente di diametro inferiore a 10 μm (in seguito, però, è stata introdotta anche la quantificazione delle particelle di diametro inferiore a 2,5 μm).
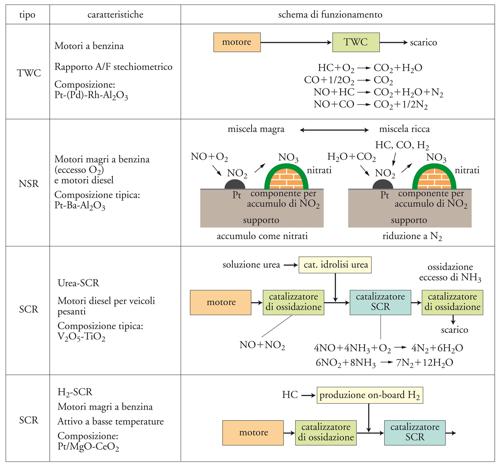
Attualmente i catalizzatori utilizzati sui motori a benzina permettono una conversione simultanea di oltre il 90% e per oltre 100.000 km di percorrenza del monossido di carbonio, degli ossidi di azoto e degli idrocarburi: per questa ragione essi sono chiamati catalizzatori a tre vie o TWC (Three way catalysts). Nel caso dei motori diesel, sono utilizzati catalizzatori in grado di agire per il particolato e per i componenti ossidabili (CO, idrocarburi), ma i dispositivi per l’eliminazione degli NOx sono ancora in fase di sviluppo, sebbene avanzato.
Catalizzatori per le emissioni dai motori a benzina
La progressiva variazione della normativa sulle emissioni da autoveicoli ha portato a una corrispondente evoluzione delle caratteristiche dei catalizzatori utilizzati nel controllo delle emissioni da motori a benzina: (a) introduzione del rodio (Rh) assieme al platino (Pt) come elemento attivo al fine di migliorare l’efficienza nella conversione degli NOx (il rapporto tipico Pt/Rh nei catalizzatori attuali è nel campo 5÷20, e la quantità totale di metallo nobile per marmitta catalitica è di ca. 2÷3 g); (b) utilizzazione di supporti strutturati tipo monoliti (fig. 2) per ridurre le perdite di carico e la disattivazione, e per migliorare l’efficienza; sul supporto monolitico è depositato un ulteriore supporto, generalmente a base di allumina (washcoat) per consentire un’elevata dispersione della fase attiva (a base di metalli nobili) e stabilizzare quest’ultima nelle condizioni di reazione (i monoliti – ceramici o metallici – sono costituiti da una serie di canali quadrati o a nido d’ape disposti orizzontalmente al flusso di gas esausti); (c) introduzione dell’ossido di cerio (CeO2) per migliorare l’efficienza nella rimozione combinata di NOx, CO e idrocarburi in presenza di oscillazioni nel rapporto aria/combustibile (A/F); (d) miglioramento della resistenza alla sinterizzazione (accrescimento delle dimensioni dei cristalliti, generalmente in seguito a effetti termici) dell’ossido di cerio e del metallo nobile, e in generale della stabilità idrotermale del catalizzatore tramite drogaggio dell’allumina (tipicamente con lantanio o bario), nonché formazione di una soluzione solida tra il CeO2 e l’ossido di zirconio (ZrO2) (fig. 2). La stabilità in condizioni idrotermali è molto importante in quanto la temperatura del catalizzatore può raggiungere valori superiori a 750 °C e in queste condizioni il catalizzatore deve rimanere stabile in presenza di tenori d’acqua nelle emissioni attorno al 10%; la presenza d’acqua, infatti, accelera in maniera significativa la velocità di sinterizzazione.
Gli sviluppi più recenti in questo settore sono basati sia sull’impiego di sistemi multistrato porosi, nei quali il Pt e il Rh sono disposti in strati differenti per ottimizzare il comportamento catalitico, sia sull’introduzione di una marmitta catalitica addizionale in prossimità del motore, per migliorare l’efficienza di rimozione a bassi regimi. In generale, è sufficiente abbassare ulteriormente la temperatura alla quale il catalizzatore inizia a essere attivo (light-off temperature) per ridurre le emissioni durante la fase di avviamento o nei percorsi caratterizzati da soste frequenti (traffico cittadino). Gli sviluppi attuali delle ricerche riguardano anche l’adeguamento del comportamento catalitico all’introduzione progressiva di biocombustibili.
Un parametro fondamentale che determina il comportamento dei catalizzatori a tre vie è la concentrazione di ossigeno nelle emissioni, collegata al rapporto A/F. In presenza di eccesso d’aria rispetto al valore stechiometrico (A/F=14,7) sono favorite le reazioni di ossidazione e quindi la conversione degli idrocarburi e del CO, ma sono sfavorite le reazioni di riduzione degli NOx e quindi la conversione di questi ultimi. L’opposto avviene utilizzando miscele ricche, ovvero con difetto d’ossigeno rispetto al valore stechiometrico. In condizioni magre di miscela d’alimentazione (A/F nel campo 18÷22), si ha la massima efficienza nel consumo di combustibile (minori emissioni di CO2 per km), mentre per valori stechiometrici del rapporto A/F i consumi di combustibile sono mediamente superiori del 10%. Tuttavia, valori stechiometrici del rapporto A/F sono necessari per mantenere l’efficienza di conversione degli NOx, del CO e degli idrocarburi superiore al 90%.
Negli attuali autoveicoli, il rapporto A/F è mantenuto attorno al valore stechiometrico da un sensore d’ossigeno (definito sonda lambda) che, attraverso una centralina elettronica, controlla il sistema d’iniezione del carburante e dell’aria nei cilindri del motore. A causa del tempo di risposta del sensore e del retrocontrollo del sistema d’alimentazione del motore, si hanno fluttuazioni nel rapporto A/F che influenzano negativamente l’efficienza di conversione combinata degli NOx, degli idrocarburi e del CO. L’introduzione di CeO2 nel supporto permette di minimizzare queste fluttuazioni. In difetto d’ossigeno il CeO2 si riduce cedendo ossigeno, il quale viene utilizzato per l’ossidazione del CO e degli idrocarburi, mentre si riossida quando l’alimentazione passa a condizioni magre. Il CeO2, quindi, agisce da elemento d’accumulo d’ossigeno, detto anche OSC (Oxygen storage component), consentendo di compensare, in regime transiente, le variazioni nel rapporto A/F. Ciò ha permesso un miglioramento rilevante della conversione combinata degli NOx, degli idrocarburi e del CO. Il CeO2 ha anche altri effetti catalitici positivi, quali la promozione della reazione tra CO e H2O per dare H2 e CO2 e il miglioramento della resistenza alla sinterizzazione del metallo nobile. Un ulteriore miglioramento in termini sia di effettivo controllo delle fluttuazioni nella composizione alla superficie del catalizzatore, sia del tempo di vita di questo si è avuto con l’utilizzazione di soluzioni solide di CeO2 e di ZrO2 (una composizione tipica è Ce0,4Zr0,6O2). La formazione di questa soluzione solida porta a un aumento dell’effetto OSC e a un miglioramento della resistenza alla sinterizzazione del CeO2, con incremento del tempo di vita del catalizzatore, specialmente in presenza di elevate temperature di reazione.
Catalizzatori per le emissioni dai motori diesel
Sebbene i motori diesel consentano emissioni di CO2 significativamente inferiori a quelle dei motori a benzina, essi, tuttavia, presentano maggiori emissioni di particolato e non possono utilizzare i TWC a causa della presenza di ossigeno che rende non efficiente la riduzione degli NOx in questi catalizzatori. Sono in fase di studio quattro differenti approcci per ridurre gli NOx in presenza di O2.
Riduzione degli NOx utilizzando idrocarburi come agenti riducenti. - Gli idrocarburi presenti nei vapori del serbatoio sono addizionati ai gas esausti provenienti dal motore e adoperati per la riduzione selettiva degli NOx in presenza di ossigeno. Sebbene questa soluzione sia stata ampiamente studiata, non sono ancora stati individuati catalizzatori (o loro combinazioni) dotati di caratteristiche che consentano di prevederne l’applicazione commerciale: attività a basse temperature, ampio campo d’attività (150 °C÷650 °C), ridotta formazione di protossido d’azoto (N2O), resistenza alla disattivazione e stabilità nel tempo. I principali catalizzatori studiati sono stati quelli a base di zeoliti contenenti metalli di transizione (rame, cobalto, ecc.) e metalli nobili supportati.
Riduzione selettiva degli NOx addizionando ammoniaca come agente riducente (SCR). - Questa soluzione parte dall’esperienza sviluppata nella riduzione selettiva degli NOx con ammoniaca da sorgenti fisse ed è basata su catalizzatori analoghi a base di ossidi di vanadio e tungsteno supportati sull’ossido di titanio (TiO2). Tale processo presenta le caratteristiche di attività e di stabilitànecessarie per lo sviluppo commerciale, ma richiede la presenza di un serbatoio addizionale per il riducente e un adeguamento della rete distributiva. Sebbene questa soluzione si trovi a uno stadio ormai quasi commerciale, devono essere ancora definiti più in dettaglio i rischi derivanti dalla possibile formazione di prodotti tossici, tra i quali acido cianidrico (HCN), cianuri e ammine organiche, in condizioni di malfunzionamento. Inoltre il sistema è particolarmente complesso (fig. 3). Per evitare lo stoccaggio e la distribuzione diretta d’ammoniaca, si utilizzano composti alternativi come l’urea, che per idrolisi catalitica genera l’ammoniaca necessaria per la riduzione degli NOx. Si prevede, infine, che la soluzione possa essere adottata per autoveicoli diesel pesanti (autobus, autotreni, ecc.), mentre è ancora in fase di valutazione l’applicabilità per le autovetture diesel leggere.
Conversione di NOx con sistemi accumulo-riduzione (NSR). - Questa soluzione, sviluppata recentemente da ricercatori della Toyota, si basa su un diverso principio di funzionamento. Il catalizzatore non opera in regime stazionario, ma sono imposte variazioni cicliche nell’A/F (fig. 3). Durante la fase con composizione magra dell’alimentazione, ovvero in presenza di O2, l’NO è ossidato dal metallo nobile a NO2 e viene accumulato sulla superficie del catalizzatore prevalentemente in forma di nitrati superficiali per reazione con un secondo componente del catalizzatore avente la funzione di accumulo degli NOx, tipicamente ossido di bario (BaO) o di altri metalli alcalini. La durata di questa fase è attorno a 1÷2 minuti. In questo periodo, la conversione degli NOx è inizialmente completa, e diminuisce progressivamente con il saturarsi della capacità adsorbente del catalizzatore. Durante la fase con composizione ricca della miscela di reazione, gli NOx accumulati sul catalizzatore vengono ridotti a N2 per reazione con il CO, con l’H2 e con gli idrocarburi presenti nella miscela di reazione. La velocità di questo processo è di due ordini di grandezza superiore alla velocità d’accumulo e quindi la durata di questa fase è tipicamente di 1 s o inferiore. Questa tecnologia può essere applicata a motori a combustione magra o diesel e permette di ottenere elevate conversioni di NOx (superiori all’80÷90%), anche dopo lunghi tempi di vita. Il sistema richiede un controllo sofisticato dell’alimentazione, ma compatibile con gli attuali motori (per es., i diesel common rail). La variazione continua nell’A/F in alimentazione non porta a effetti marcati rilevabili nella guida dell’autoveicolo. L’inconveniente principale è la sensibilità alla disattivazione da zolfo. Sono in fase avanzata di studio varie soluzioni per ovviare a questo problema, quali lo sviluppo di catalizzatori basati su questo principio ma più resistenti alla disattivazione da zolfo o rigenerabili più facilmente, e la rigenerazione periodica in situ del catalizzatore (tipicamente a 600÷650 °C per periodi di 30÷60 s). Inoltre, la tendenza attuale a diminuire il contenuto di zolfo nella benzina e nel diesel (si prevede che nel 2010 si arrivi a tenori di zolfo attorno a 10 ppm) indica anche la possibilità di sviluppare dispositivi di protezione di questo catalizzatore basati su adsorbenti rigenerabili degli SOx.
Riduzione degli NOx in presenza di H2. - Catalizzatori quale Pt supportato su TiO2-ZrO2 o CeO2-MgO o Ag/Al2O3 permettono di convertire gli NOx a basse temperature, ma il campo di temperatura in cui si ha il massimo di attività è molto ristretto (100÷200 °C). Ciò limita fortemente l’applicabilità di tale metodologia. L’H2 può essere generato sugli autoveicoli tramite dispositivi di reforming di parte del combustibile. Infatti, mediante la generazione di un plasma non termico è possibile produrre dagli idrocarburi un combustibile ricco in idrogeno. Questi dispositivi sono compatti e utilizzabili sugli autoveicoli, ma richiedono un consumo energetico significativo.
Controllo del particolato carbonioso
Nei motori diesel esiste una relazione inversa tra la formazione degli NOx e quella del particolato carbonioso. Quindi, un dispositivo molto efficiente per l’eliminazione del particolato permetterebbe di operare in condizioni in cui il motore genera quantità elevate di particolato, ma basse concentrazioni di NOx. Tuttavia, i limiti previsti per il 2008 (Euro 5) per gli NOx e per il particolato richiedono l’uso combinato di un catalizzatore per la riduzione degli NOx e di un dispositivo per la riduzione del particolato. Ci sono tre soluzioni per l’eliminazione del particolato, in quanto l’eliminazione per semplice filtraggio porterebbe a un rapido innalzamento delle perdite di carico a causa dell’occlusione del filtro.
Aggiunta di additivi al gasolio. - Gli additivi (composti organici di cerio o di ferro) portano alla formazione di nanoparticelle di ossido di cerio o di ferro durante il processo di combustione. Tali particelle agiscono da catalizzatori per la combustione del particolato, che è separato dai gas esausti per passaggio attraverso un filtro. Questo può essere di tipo ceramico monolitico analogo a quello dei catalizzatori a tre vie, ma in cui in modo alternato, ogni canale parallelo è chiuso a una delle due estremità. Il flusso di gas, quindi, deve passare attraverso la parete (porosa) che separa un canale dall’altro determinando il trattenimento del particolato e delle particelle d’ossido di cerio o di ferro. La presenza di queste ultime determina la combustione del particolato carbonioso quando la temperatura del filtro è superiore a circa 350 °C. In questo modo si ha quindi una rigenerazione continua del filtro. Problemi ancora aperti sono sia gli effetti sull’ambiente di nanoparticelle di ossidi di metalli di transizione (una parte di questi, infatti, non viene trattenuta dal filtro e viene immessa nell’ambiente), sia quelli sul motore della generazione di particelle solide con possibili azioni abrasive.
Rigenerazione continua del particolato carbonioso con NO2. - Il particolato carbonioso è trattenuto da un filtro con flusso a parete, analogo a quello descritto sopra, che viene ossidato con continuità a temperature superiori a circa 250÷300 °C (in modo da evitare un aumento eccessivo della perdita di carico del filtro) da NO2 generato per ossidazione dell’NO presente nei gas esausti su uno strato di catalizzatore posto prima del filtro. L’NO2 ha un potere ossidante superiore all’O2. Il limite di questa soluzione è la sensibilità alla disattivazione da parte dello zolfo del primo strato di catalizzatore (quello per ossidare l’NO a NO2). Questa tecnica è applicata a veicoli pesanti, specialmente in Germania e in Svezia.
Rigenerazione continua catalitica. - Il particolato carbonioso è trattenuto da un filtro analogo a quelli descritti in precedenza o con struttura simile a una spugna. Il catalizzatore (a base di sali di V, Fe, Cu e K) è depositato sulle pareti del filtro. A temperature attorno a 300÷350°C diventa pseudo-liquido e questo permette un miglior contatto tra le particelle carboniose e il catalizzatore con aumento dell’efficienza di rigenerazione continua. Tuttavia, è necessario un ulteriore abbassamento della temperatura d’operazione di questi catalizzatori.
Occorre rilevare, infine, che il particolato carbonioso è costituito da un nucleo carbonioso che può contenere anche composti inorganici e uno strato esterno costituito da vari composti organici pesanti adsorbiti sul nucleo. Quest’ultima frazione, detta frazione organica solubile, è la più dannosa di tutti i composti presenti ed è più facilmente ossidabile da parte di catalizzatori a base di metalli nobili supportati su monoliti. Tuttavia, le particelle residue che passano attraverso questo dispositivo catalitico hanno spesso dimensioni inferiori a 10μm (sono indicate con il termine PM10) e quindi non sono trattenute dall’apparato respiratorio umano, causando notevoli danni.
Eliminazione degli NOx da sorgenti fisse
Una delle principali sorgenti degli NOx deriva dalla produzione di energia nelle centrali a combustibili, in quanto l’utilizzazione dell’aria come comburente e le alte temperature di fiamma portano all’ossidazione dell’azoto attraverso un meccanismo radicalico proposto originariamente da Yaakov Borisovič Zel’dovič. Gli ossidi d’azoto, come si è visto, sono indicati generalmente con il simbolo NOx, ma il prodotto principale è l’NO, in quanto gli ossidi superiori (NO2, in particolare) non sono stabili ad alta temperatura. A basse temperature, tuttavia, è favorito lo spostamento dell’equilibrio verso la formazione di NO2 e quest’ultimo è quello normalmente monitorato, per esempio in ambito urbano. Le emissioni degli NOx (assieme a quelle degli SOx) sono tra le principali cause della formazione delle cosiddette piogge acide, che provocano notevoli danni all’ecosistema. Inoltre, gli NOx partecipano ai cicli fotochimici responsabili della formazione dello smog. Ne consegue che, a partire dagli anni Settanta, sono state sviluppate – inizialmente in Giappone e poi in Germania – tecnologie catalitiche che consentissero l’abbattimento degli NOx a livelli più compatibili con l’ambiente. Attualmente queste tecnologie (fig. 4) sono diffuse anche in Italia, in quanto i limiti imposti dalla legge (attorno a 500 ppm, in funzione tuttavia della potenza della centrale) ne richiedono spesso l’adozione. Tali tecnologie, inoltre, sono utilizzate nel trattamento di emissioni dai forni industriali, dagli inceneritori per biomasse e per rifiuti e dalle turbine a gas.
Riduzione catalitica selettiva
Il principio di funzionamento di queste tecnologie si basa sulla riduzione selettiva degli NOx tramite addizione di ammoniaca (NH3) in presenza di ossigeno e di un catalizzatore basato su ossidi di vanadio e tungsteno supportati su ossido di titanio (TiO2, nella forma cristallina anatasio) a bassa area superficiale. La fase attiva è presente in forma di monostrato di ossido di vanadio o tungsteno depositato su TiO2. Tipicamente la quantità della fase attiva è qualche % in peso rispetto all’intero catalizzatore. Il rapporto vanadio/tungsteno varia in funzione delle caratteristiche dell’alimentazione, in quanto un aspetto critico è rappresentato dal controllo della velocità della reazione parallela di ossidazione dell’anidride solforosa (SO2) presente normalmente nelle emissioni. L’ossidazione dell’SO2 a SO3 (anidride solforica) porta alla formazione di solfato d’ammonio, (NH4)2SO4, che tende a depositarsi a valle dell’impianto di abbattimento degli NOx (in particolare, sugli scambiatori di calore) provocando malfunzionamenti. Per migliorare la resistenza alla disattivazione, in alcuni casi si utilizzano ossidi di molibdeno invece che di tungsteno, un ossido misto di titanio e silicio (TiO2-SiO2) invece del solo TiO2 (l’ossido di silicio agisce da promotore strutturale per migliorare la resistenza alla sinterizzazione e ottimizzare la porosità) o il drogaggio dell’ossido di titanio con acido fosforico (H3PO4) o solforico (H2SO4), che ritardano la trasformazione del TiO2 dalla forma cristallina anatasio a quella rutilo (questa trasformazione è una delle cause della disattivazione). Tuttavia, occorre notare che tipicamente il tempo di vita di questi catalizzatori è superiore a 10 anni, ovvero molto più lungo del tempo di vita medio di molti catalizzatori industriali. La tecnologia è spesso indicata con l’acronimo SCR (Selective catalytic reduction).
La temperatura d’operazione tipica dei catalizzatori sopra indicati è attorno a 300÷350 °C, ovvero in corrispondenza del massimo di conversione di NOx. A temperature inferiori, l’attività del catalizzatore non è sufficiente, mentre a temperature superiori diventa significativa la reazione parallela di ossidazione dell’ammoniaca che diminuisce la disponibilità di questo reagente. Per applicazioni particolari, per esempio per piccole turbine a gas che utilizzano gas naturale, è necessario operare a temperature inferiori. In questo caso, sono adoperati catalizzatori con un massimo d’attività attorno a 200÷250 °C e contenenti quantità di vanadio più elevate oppure basati su metalli nobili supportati. Nel caso, invece, di applicazioni che richiedono temperature di operazione più elevate (alcune applicazioni per combustione di rifiuti) sono utilizzate zeoliti contenenti metalli di transizione.
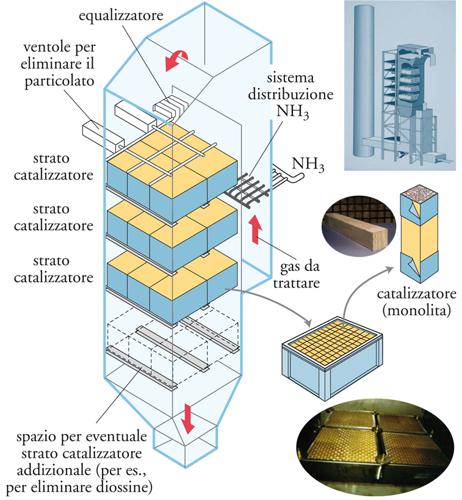
In generale, il catalizzatore è depositato su supporti monolitici analoghi a quelli già descritti, sebbene con dimensioni maggiori i moduli tipici hanno dimensioni 150×150×(300÷1000) mm, assemblati a formare tre strati successivi (fig. 5). Un quarto strato è previsto nel caso, per esempio, di trattamento delle emissioni provenienti da impianti d’incenerimento di rifiuti, per eliminare diossine e altri composti tossici tramite ossidazione. La composizione del catalizzatore in questo strato è analoga, ma il contenuto di vanadio è maggiore per aumentare il potere ossidante. L’uso di catalizzatori in forma monolitica è necessario per limitare sia le perdite di carico sia la disattivazione per deposito di veleni e/o particolato e per attrito meccanico, date le alte velocità lineari del gas. In generale, i monoliti sono di tipo ceramico (mullite o cordierite) con struttura a canali paralleli. La dimensione delle celle può variare da 50×50 mm a 20×20 mm (per dimensioni totali 150×150 mm) in funzione del contenuto di polveri nel gas da trattare e della posizione dell’impianto. Monoliti con densità maggiore di celle permettono efficienze più elevate, ma possono essere utilizzati solo quando il contenuto di polveri del gas è molto basso, in quanto tendono a occludersi molto facilmente.
Generalmente l’impianto di abbattimento catalitico degli NOx può essere posto in tre posizioni differenti nell’impianto generale di trattamento delle emissioni provenienti da impianti di produzione di energia elettrica. Nel caso di polveri elevate, l’impianto SCR viene posto a valle della caldaia e prima del precipitatore elettrostatico. Questa configurazione ha il vantaggio della temperatura ottimale dei gas, ovvero di una più elevata attività catalitica; tuttavia il catalizzatore, operando in presenza di un contenuto elevato di polveri, deve avere una bassa attività nella reazione parallela di ossidazione di SO2. Inoltre, sono richieste ventole per eliminare l’accumulo di polveri nel primo strato catalitico.
Nella situazione in cui è presente una bassa quantità di polveri, l’impianto SCR viene posto a valle del precipitatore elettrostatico. Le condizioni di operazione non sono ottimali, ma il contenuto di polveri nei gas da trattare è minore e quindi il tempo di vita del catalizzatore è maggiore. Inoltre, possono essere utilizzate densità di celle maggiori nel monolite. Nel caso che si abbia anche un impianto di desolforazione, ovvero nel caso di elevati contenuti di SO2 nei fumi di combustione (per es., in impianti che utilizzano carbone), l’impianto SCR viene posto a valle di quello, per ridurre la disattivazione del catalizzatore da parte dell’SO2. In tal caso, occorre riscaldare i fumi in uscita dall’impianto di desolforazione fino alle temperature di esercizio dell’SCR.
Le conversioni degli NOx ottenibili con l’impianto SCR sono superiori all’80%. Conversioni maggiori sono possibili, ma causano un aumento della quantità d’ammoniaca che passa inalterata attraverso lo strato di catalizzatore (ammonia slip). Questa deve essere mantenuta a valori molto bassi (inferiori a 5÷10 ppm). Quindi, nel caso siano necessari valori di conversione degli NOx superiori al 90÷95%, risulta necessario installare uno strato addizionale di catalizzatore (generalmente a base di metalli di transizione come il rame, supportati su ossidi o su zeoliti) con la funzione di ossidazione selettiva a N2 dell’ammoniaca che non ha reagito.
L’impianto SCR d’abbattimento degli NOx è anche adoperato per la conversione degli ossidi d’azoto residui negli impianti di sintesi dell’acido nitrico. A differenza delle emissioni da impianti di combustione, in questo caso le emissioni contengono NO e NO2, oltre a quantità significative di N2O, ed è preferibile usare catalizzatori differenti da quelli a base d’ossido di vanadio supportato su titania, quali ossidi di rame e di nichel supportati su allumina o su zeoliti scambiate con rame e con lantanio. Queste ultime permettono anche la parziale decomposizione dell’N2O a N2 e O2. Sebbene in Europa le emissioni di N2O non siano ancora regolate, si prevede che lo saranno nel prossimo futuro, essendo l’N2O un gas con un notevole effetto serra (ca. 300 volte maggiore della CO2).
Combustione catalitica dei composti organici volatili
I composti organici volatili o VOC (Volatile organic compounds) sono un’importante classe di inquinanti dell’aria. Essi sono emessi in numerose attività umane (trasporto, processi industriali, uso di prodotti contenenti solventi, evaporazione di combustibili, smaltimento di rifiuti, agricoltura, ecc.). Occorre distinguere tra la contaminazione localizzata e quella diffusa, ovvero rispettivamente quella per cui è possibile o meno individuare una sorgente specifica delle emissioni a cui applicare una tecnologia di trattamento.
La combustione catalitica – ovvero il processo d’ossidazione completa dei composti organici inquinanti con formazione di CO2 e di H2O tramite catalizzatori solidi (generalmente metalli di transizione o metalli nobili supportati su ossidi, come la silice e l’allumina) – è utilizzata spesso nel trattamento di emissioni contenenti VOC. Inoltre, il suo uso è in forte espansione anche per il controllo della contaminazione diffusa, come nel miglioramento della qualità dell’aria in ambienti chiusi, attraverso la combustione di sostanze quali formaldeide e composti aromatici, oppure per migliorare la qualità dell’aria in gallerie stradali attraverso l’ossidazione completa degli idrocarburi e del monossido di carbonio.
Alcuni esempi d’applicazione sono riassunti qui di seguito, dove per la specifica attività produttiva vengono indicati i principali composti organici volatili che devono essere eliminati: (a) verniciatura: toluene, xilene, alcol isopropilico, metanolo, metiletilchetone, esteri acetici, esano; (b) chimica: aldeidi, chetoni, etilene, monossido di carbonio, acido acrilico, acrilonitrile, cumene, caprolattame, anidride maleica e ftalica, vinilcloruro; (c) impianti elettrici: benzene, toluene, esteri acetici; (d) fonderia: fenolo, formaldeide; (e) lavorazione metalli: metiletilchetone, toluene e xilene, metil isobutil-chetone, isobutanolo; (f) stampa: toluene, esano, acetato d’etile, propanolo; (g) impianti tessili: alcoli, fenolo, toluene; (h) produzione componenti elettronici: acetato di cellulosa, alcani, chetoni, composti clorurati; (i) lavaggio a secco: tricloroetilene; (l) prodotti alimentari e lavorazione del pesce: acidi grassi, alcoli, mercaptani; (m) gomme: toluene, isocianati, aldeidi.
La lista è più estesa, ma si può osservare che, in realtà, l’applicazione dei processi di combustione catalitica copre l’intero campo delle attività produttive per il controllo delle emissioni nocive e degli odori. Le applicazioni variano secondo le dimensioni della tecnologia: dai sistemi miniaturizzati portatili per la combustione di sostanze nocive in ambienti chiusi – che operano spesso in maniera discontinua e si basano sull’uso di adsorbenti periodicamente rigenerati – a tecnologie capaci di trattare migliaia di m3/ora (nel caso di processi industriali). Occorre ricordare, inoltre, che la combustione catalitica è utilizzata anche nella distruzione delle sostanze organiche volatili presenti come contaminanti in acque superficiali, previo desorbimento delle stesse tramite un flusso d’aria.
Alternative di processo
In genere, gli impianti di combustione catalitica consistono: (a) di un filtro per rimuovere l’eventuale par-ticolato; (b) di un catalizzatore, spesso in forma mo-nolitica per ridurre le perdite di carico; (c) di uno o più scambiatori di calore per il recupero termico; (d) di apparecchiature ausiliarie e di controllo; (e) di un bruciatore per portare la temperatura dei gas ai valori necessari per ottenere la combustione catalitica completa. Quest’ultima dipende dalla composizione della miscela; le temperature tipiche sono superiori a 250÷350 °C. È molto importante che la temperatura sia sufficientemente alta da consentire l’eliminazione completa di tutti i sottoprodotti anche in tracce, poiché spesso questi possono essere più tossici dei prodotti di partenza. Sono possibili variazioni di questo schema per migliorare l’efficienza di recupero energetico e ridurre i costi. Processi in cui si recupera il calore dai fumi in uscita dal combustore catalitico per preriscaldare quelli in entrata (condizioni d’operazione autotermiche), ovvero senza necessità d’addizione esterna d’energia (con riduzione quindi dei costi energetici), sono possibili quando la concentrazione minima di sostanze combustibili nell’alimentazione è superiore, in termini energetici, a 35÷50 kcal/Nm3 (corrispondenti a 3,5÷5 g/Nm3 toluene). Utilizzando uno schema di processo di combustione catalitica rigenerativo si possono avere operazioni autotermiche già per concentrazioni di sostanze combustibili attorno a 8÷12 kcal/Nm3 (corrispondenti a 0,8÷1,2 g/Nm3 toluene). Tuttavia, occorre procedere in maniera ciclica (si opera con tre reattori in sequenza e i gas in uscita dal primo reattore sono utilizzati per il preriscaldamento dello strato inerte degli altri reattori) con aumento dei costi e della complessità di gestione dell’impianto. Nel caso di basse concentrazioni di composti organici volatili, sono utilizzate anche tecnologie nelle quali il catalizzatore (in forma di monolita cilindrico ruotante) è alternativamente esposto al flusso di gas a temperatura ambiente (in questa fase il catalizzatore rimuove per adsorbimento i composti organici volatili) e a un flusso d’aria preriscaldata (in questa fase avviene il desorbimento e la combustione delle sostanze adsorbite). Questa soluzione consente alcuni vantaggi economici nel caso di piccole applicazioni, in quanto evita il riscaldamento di elevati volumi d’effluenti. Il costo energetico è uno dei principali elementi del costo complessivo della tecnologia di combustione catalitica.
Caratteristiche dei catalizzatori
Nella combustione catalitica sono utilizzate due principali classi di catalizzatori: (a) quelli a base di metalli nobili supportati (Pt e/o Pd – tipicamente 0,3÷1,0% in peso – supportati su Al2O3, eventualmente stabilizzato con La o Ba, ZrO2 o zeoliti quali Beta e ZSM-5) che sono attivi a basse temperature di reazione, sono resistenti alla disattivazione (con l’esclusione di alcune sostanze chimiche) e facilmente rigenerabili; (b) quelli a base di metalli di transizione (ossidi di Cr, Cu, Mn, Co, Ce e loro combinazioni, supportati sull’allumina, sulla silice o sulle zeoliti, oppure composti quali le perovskiti). Eccetto per alcuni specifici composti chimici (per es., l’acetato d’etile) dove il forte chemisorbimento porta a inibizione dell’attività, i metalli nobili supportati hanno attività migliore della seconda classe di catalizzatori. Sebbene il costo di questi ultimi sia inferiore, la ridotta attività porta a costi d’impianto e di esercizio superiori.
Un caso particolare è dato dalla combustione degli idrocarburi clorurati quali il tricloroetilene (C2HCl3), il tetracloroetano (C2H2Cl4) e il cloruro di metile (CH3Cl), ampiamente utilizzati nei processi di pulizia chimica e di degrassaggio di superfici. In questo caso si ha la formazione di acido cloridrico (HCl) come prodotto di ossidazione e quindi è necessario usare materiali speciali per il reattore ed eliminare per assorbimento in acqua l’HCl formatosi. Inoltre è necessario addizionare vapor d’acqua all’alimentazione per evitare l’ossidazione dell’HCl a Cl2. I catalizzatori a base di metalli nobili si disattivano rapidamente e sono quindi utilizzati catalizzatori a base di ossidi di Cr, Cu e Mn supportati, oppure a base di metalli nobili su supporti alternativi (per es., Pt/V2O5/TiO2).
Altre applicazioni
Una recente estensione dell’applicazione di tecnologie catalitiche per l’abbattimento di composti organici volatili si è avuta in alcune applicazioni domestiche. Per esempio, sono stati sviluppati catalizzatori per la combustione di CO e di idrocarburi parzialmente ossidati nelle emissioni da stufe a legna e per abbattere i composti organici volatili e le particelle di grasso nelle emissioni da ristoranti fast-food (i catalizzatori sono a base di Pt e Pd supportati su allumina e depositati su monoliti metallici a bassa densità di celle), oppure per eliminare i cattivi odori nel bagno (causati da metilammine che, a temperatura prossima a quella ambiente, sono ossidate con catalizzatori a base di nanoparticelle di oro supportate su titania) o nei frigoriferi. In quest’ultima classe di applicazioni rientrano anche i catalizzatori di fotoossidazione a base di titania utilizzati in forma di mattonelle per l’eliminazione di odori e di batteri negli ospedali e nei luoghi pubblici.
Bibliografia
Armor 1994: Environmental catalysis, edited by John N. Armor, Washington D.C., American Chemical Society, 1994.
Centi 1995: Environmental catalysis, a cura di Gabriele Centi e altri, Roma, Società Chimica Italiana, 1995.
Centi 2002: Centi, Gabriele e altri, Environmental catalysis: trends and outlook, “Catalysis today”, 75, 2002, pp. 3-15.
Centi, Perathoner 2006: Centi, Gabriele - Perathoner, Siglinda, Selective catalytic reduction (SCR) processes on metaloxides, in: Metal oxides: chemistry and applications, edited by José Luis García Fierro, Boca Raton (Fla.), Taylor & Francis, 2006, pp. 661-682.
Dolidovich 1999: Dolidovich, Alexandre F. - Akhremkova, Galina S. - Efremtsev, Vyacheslav S., Novel technologiesof VOC decontamination in fixed, moving and fluidizedcatalyst-adsorbent beds, “Canadian journal of chemicalengineering”, 77, 1999, pp. 342-355.
Ertl 1997-: Handbook of heterogeneous catalysis, 2. ed., edited by Gerhard Ertl, Helmut Knözinger, Jens Weitkamp, Weinheim, Wiley-VCH, 1997-.
Ertl 1999: Environmental catalysis, edited by Gerhard Ertl, Helmut Knözinger, Jens Weitkamp, Weinheim, Wiley-VCH, 1999.
Grassian 2005: Environmental catalysis, edited by Vicki H. Grassian, Boca Raton (Fla.), Taylor & Francis, 2005.
Forzatti 2001: Forzatti, Pio, Present status and perspectives in de-NOx SCR catalysis, “Applied catalysis, A: general”, 222, 2001, pp. 221-236.
Janssen, van Santen 1999: Environmental catalysis, Frans J.J. G. Janssen, Rutger A. van Santen, London, Imperial College Press, 1999.
Menon 1998: Menon, Govind P. - Zwinkels, Marcus F.M. - Järås, Sven, Catalytic combustion for pollution abatement and cleaner thermal power generation, “Studies in surface science and catalysis”, 113, 1998, pp. 97-109.
Suzuki, Matsumoto 2004: Suzuki, Juji - Matsumoto, Shin’hichi, Development of catalysts for diesel particulate NOx reduction, “Topics in catalysis”, 28, 2004, pp. 171-176.
Topsoe 1997: Topsoe, Nan-Yu, Catalysis for NOx abatement, “Proceedings of CATTECH - Catalyst technology”, 1, 1997, pp. 125-134.
Twigg 2006: Twigg, Martyn V., Roles of catalytic oxidation in control of vehicle exhaust emissions, “Catalysis today”, 117, 2006, pp. 407-418.