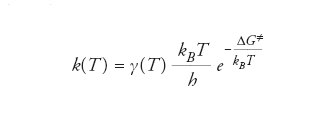Catalisi
Catalisi
I sumeri producevano una ventina di tipi di birra dimostrando di saper gestire, in modo pratico ed efficace, alcuni processi catalitici enzimatici la cui natura sarebbe stata compresa solo nel XIX secolo. Non a caso Jöns Jacob Berzelius, nel battezzare nel 1836 con la parola catalisi la capacità di alcune sostanze di aumentare la velocità di determinate reazioni chimiche senza subire alterazioni, ha messo anche in evidenza che essa giocava un ruolo centrale nei processi vitali. Questi fatti rivelano che lo studio dei processi catalitici offre l'opportunità di affrontare tutta la chimica nei suoi diversi aspetti, inorganici, organici e biologici. In realtà, l'ampio sviluppo applicativo che ha ricevuto la catalisi risale agli esordi della chimica industriale, ovvero all'inizio dell'Ottocento, con un'affermazione così estesa che la colloca nel cuore delle attività umane. La sua elevata potenzialità consiste nella possibilità di influenzare in modo radicale la natura dei prodotti che si ottengono in una reazione chimica a partire dagli stessi reagenti, attraverso opportune modifiche delle caratteristiche dei catalizzatori. Per esempio, se una miscela di idrogeno e ossido di carbonio, chiamata gas di sintesi, viene portata a contatto con diversi catalizzatori solidi si possono ottenere rispettivamente idrocarburi saturi, alcoli, glicoli e altri composti organici di varia natura. Attualmente, la maggior parte dei prodotti di largo consumo, dei materiali e dei composti della chimica farmaceutica, vengono ottenuti attraverso reazioni catalitiche. Nell'industria petrolifera la catalisi occupa una posizione di primo piano, poiché permette di preparare carburanti sempre più efficienti e meno inquinanti.
Le frontiere attuali riguardano il futuro energetico e ambientale del pianeta, per esempio attraverso lo sviluppo di processi fotocatalitici in grado di scindere l'acqua in idrogeno e ossigeno, grazie all'impiego di nuovi catalizzatori. La tutela dell'ambiente atmosferico richiede inoltre l'individuazione di efficienti catalizzatori in grado di eliminare gli inquinanti, che vengono prodotti nei processi di combustione e nelle attività industriali con l'ambizione di realizzare processi ove la produzione di inquinanti sia trascurabile. In microbiologia si sono sempre intraviste grandi prospettive nell'impiego degli enzimi per effettuare sintesi chimiche e, più recentemente, per l'attuazione di processi di interesse ambientale. Essi vengono impiegati per realizzare diverse reazioni, ottenendo elevata selettività anche nella preparazione di composti chirali, nei quali cioè è presente un atomo di carbonio tetraedrico asimmetrico. Inoltre, la conoscenza dei meccanismi sottostanti la loro azione può costituire un'ispirazione e una guida per la preparazione di nuovi sistemi catalitici in grado di estendere il repertorio delle sintesi chimiche che vengono attualmente praticate. In sostanza, lo studio della catalisi ha un elevato contenuto interdisciplinare, poiché in esso convergono oltre alla chimica, la fisica dello stato solido, la chimica fisica molecolare e la biologia molecolare. Esempi di tale versatilità vengono riportati nel numero di marzo 2003 della rivista "Science", sulla cui copertina viene illustrata la simulazione, mediante la meccanica quantistica, dello stato di transizione della reazione catalitica di ossidazione dell'ossido di carbonio su una lega di metalli nobili, supportata sulla membrana di una cella a combustibile.
Meccanismo delle reazioni catalitiche
Una reazione catalitica si svolge attraverso una successione di stadi, che danno origine a sequenze cicliche in cui sono coinvolte delle specie instabili molto reattive, chiamate centri attivi. Per esempio, la reazione:
[1] A + B ⇄ M + N
se si indica con σ il centro attivo, può essere spezzata nelle due reazioni :
[2] A + σ → A − σ
[3] A − σ + B ⇄ M + N + σ .
L'aggiunta del catalizzatore modifica la superficie di energia potenziale, che descrive l'evoluzione molecolare del sistema reagente nel passaggio dai reagenti ai prodotti, facendo intervenire un cammino alternativo compatibile con la presenza di un minimo corrispondente alla formazione di un composto intermedio fra reagente e catalizzatore. Nei processi omogenei il catalizzatore è presente nella stessa fase della miscela reagente. Un esempio ci viene offerto dall'azione esercitata sull'ozono atmosferico da parte dei clorofluorocarburi, che salendo nell'atmosfera vengono decomposti dalle radiazioni solari, generando atomi di cloro. Inoltre, poiché a 30 chilometri dal livello del mare è presente nell'atmosfera ossigeno atomico, si innesca un ciclo di reazioni che procede come segue:
[4] Cl + O3 ⇄ OCl + O2
OCl + O ⇄ O2 + Cl .
In questo caso il prodotto intermedio OCl agisce da catalizzatore. Ulteriori e importanti esempi di catalisi omogenea si riscontrano nell'azione degli acidi in soluzione. Questo tipo di catalisi acido-base è presente anche nei processi biologici per l'azione degli enzimi e interviene nella sintesi e nel metabolismo delle proteine. In soluzione acquosa un acido AH si dissocia secondo l'equilibrio:
[5] AH + H2O ⇄ A− + H3O+
per cui la sua azione nella catalisi si manifesta attraverso l'interazione dello ione H3O+ con il reagente, o substrato, S, che successivamente si trasforma per dare i prodotti:
[6] S + H3O+ ⇄ SH+ → prodotti.
Tipiche in questo contesto sono le reazioni di idrolisi, attraverso le quali si scinde il legame covalente di un composto organico, come si verifica nel caso di un estere che dà un alcol e un acido:
[7] R‒CO‒O‒R′ + H2O → R‒COOH + R′‒OH.
Risultati significativi nel campo della catalisi omogenea sono stati raggiunti attraverso la scoperta di una varietà di nuove e talora non comuni reazioni, catalizzate dagli ioni dei metalli di transizione e da alcuni composti di coordinazione. Fra questi ricordiamo l'idrogenazione delle olefine, catalizzata dai complessi dei metalli di transizione ‒ in particolare il rutenio ‒ la formazione di aldeidi e alcoli da olefine, ossido di carbonio e idrogeno (idroformilazione), catalizzatata dai complessi carbonilici di cobalto e nichel, e, infine, l'ossidazione delle olefine ad aldeidi catalizzata dal cloruro di palladio (processo Wacker).
Chimica bidimensionale
Le ricerche fondamentali che vengono condotte nel campo della catalisi eterogenea sono volte all'identificazione della natura dei gruppi chimici funzionali esistenti sulla superficie di un solido e delle loro interazioni con i reagenti. Particolare importanza riveste allora l'individuazione dei centri attivi superficiali, costituiti da gruppi di atomi che si trovano in particolari condizioni geometriche e fisiche. L'interazione di una molecola proveniente da una fase fluida con una superficie è dovuta alle forze di non legame, o di van der Waals, e può essere assimilata a una condensazione superficiale. Questo processo, chiamato adsorbimento fisico, gioca però un ruolo secondario nella catalisi eterogenea. Viceversa, è di grande importanza l'adsorbimento chimico in virtù del quale la molecola, interagendo specificamente con gli atomi del centro attivo, forma veri e propri legami chimici, talora accompagnati da una sua dissociazione, che precedono la successiva evoluzione verso i prodotti di reazione.
Le caratteristiche di un catalizzatore vengono solitamente individuate attraverso la velocità della reazione catalizzata, espressa dal numero di moli del reagente trasformato per unità di tempo e unità di superficie. Un altro importante parametro è la selettività, la quale, in un sistema in cui hanno luogo contemporaneamente più reazioni, esprime la tendenza a favorirne una particolare. Per lungo tempo gli studi sulla catalisi sono stati condotti con un approccio essenzialmente empirico, ma da qualche decennio, grazie all'acquisizione di metodologie sperimentali sempre più sofisticate e di metodi di calcolo avanzati, si stanno acquisendo approfondite conoscenze sui dettagli degli eventi molecolari coinvolti nei processi catalitici. Questo approccio, che sta letteralmente rinnovando l'intero settore, fa uso di metodologie che forniscono informazioni sulla struttura delle superfici, sui valori dell'energia e sulle caratteristiche delle vibrazioni cui sono soggette le molecole adsorbite. Di rilevanza è la spettroscopia in situ, che pone l'attenzione sia sul catalizzatore ‒ cercando di catturare il suo stato di ossidazione e la struttura geometrica dei centri attivi, utilizzando la spettroscopia di assorbimento e la risonanza paramagnetica ‒ sia sul meccanismo delle reazioni catalitiche e la natura degli intermedi coinvolti, mediante NMR (Nuclear magnetic resonance) e le spettroscopie infrarosse e Raman.
Particolare importanza va anche attribuita alla STM (Scanning tunnelling microscopy), che permette di individuare la posizione degli atomi presenti sulla superficie. Si tratta di una tecnica molto efficace che sta fornendo interessanti risultati. Per ottenere informazioni qualitative e quantitative sugli atti elementari dei processi superficiali, che non risultino mascherate dalla eterogeneità delle interfacce, si tende a impiegare superfici ben definite, per esempio quelle monocristalline ottenute fruendo delle tecniche di deposizione epitassiale da fase gassosa. I risultati così ottenuti vengono integrati con calcoli perseguiti mediante i metodi della meccanica quantistica, che permettono di approfondire le caratteristiche degli eventi che avvengono su scala molecolare. La maggioranza dei catalizzatori industriali è costituita da solidi di elevata area superficiale, sulla quale il componente attivo è disperso sotto forma di particelle aventi dimensioni comprese fra 1 e 20 nm. Alcuni di tali supporti si possono considerare inerti, ma talora esercitano un'azione catalitica che risulta complementare a quella della componente attiva. Un esempio è dato dall'allumina che, impiegata per supportare particelle di platino che catalizzano la reazione di deidrogenazione degli idrocarburi, si comporta a sua volta come catalizzatore per i processi di isomerizzazione che ristrutturano lo scheletro degli idrocarburi. L'impiego dei menzionati metodi di caratterizzazione permette di approfondire a livello molecolare il rapporto esistente fra le proprietà delle nanoparticelle e le loro caratteristiche catalitiche. Combinando questi risultati con le conoscenze sui metodi di sintesi di tali particelle, si aprono nuove e stimolanti prospettive sulla progettazione e lo sviluppo di nuovi catalizzatori
Lo studio dei processi chimici bidimensionali che avvengono su una superficie solida può essere perseguito assimilando le specie adsorbite ai corrispondenti composti organometallici ‒ che si preparano per sintesi in soluzioni omogenee ‒ la cui struttura può costituire il modello per la specie adsorbita. Questo approccio permette anche di fruire delle informazioni sui meccanismi delle reazioni catalitiche omogenee per la formulazione dei modelli delle corrispondenti reazioni eterogenee. Si possono identificare alcune tipologie di configurazioni superficiali che, a partire da un singolo atomo, divengono sempre più complesse e nelle quali gli atomi con un differente grado di saturazione rispetto a quelli circostanti possono presentare una diversa reattività. In un'impostazione geometrica si ipotizza che tali configurazioni esercitino un'azione preferenziale nei riguardi delle reazioni che coinvolgono dei reagenti, che presentano una compatibilità morfologica con i centri attivi stessi. Per verificare questa ipotesi si è studiato il modo in cui l'attività di un catalizzatore dipende dalla struttura della sua superficie. Per esempio, nella reazione di riduzione dell'ossido di carbonio con formazione di metano, condotta su un catalizzatore costituito da nichel metallico, la velocità della reazione riferita all'unità della superficie del metallo è la stessa sia su superfici di nichel monocristallino, aventi rispettivamente le due strutture (100) e (111), sia su particelle di nichel metallico supportate sull'allumina. In sostanza, la velocità della reazione ‒ riferita all'unità di superficie ‒ condotta su materiali catalitici aventi le stesse caratteristiche chimiche ma diversa struttura, non cambia. Questo risultato mette in evidenza che la struttura della superficie non influisce sulla velocità della reazione. Si tratta di un comportamento che viene definito insensibile alla struttura (structure insensitive). Molte reazioni catalitiche eterogenee si comportano però in modo diverso dal precedente, e un esempio ci viene offerto dalla reazione di sintesi dell'ammoniaca a partire da azoto e idrogeno. Essa è stata condotta impiegando come catalizzatori diverse superfici monocristalline di ferro, aventi quindi gli atomi superficiali con un differente grado di coordinazione. I valori sperimentali della velocità di reazione sono significativamente diversi. Reazioni di questo tipo vengono chiamate sensibili alla struttura (structure sensitive).
Talora si riscontrano risultati apparentemente curiosi, come si verifica con l'oro ‒ sempre ritenuto inerte dal punto di vista catalitico ‒ che, depositato a elevata dispersione su un supporto di ossido di titanio, presenta una spiccata attività nell'ossidazione dell'ossido di carbonio ad anidride carbonica. L'analisi con la tecnica STM accoppiata con lo studio dell'attività catalitica ha evidenziato che solo le particelle con dimensioni comprese fra 2 e 3 nm risultano attive, confermando una spiccata sensitività alla struttura del processo catalitico stesso. Per interpretare i comportamenti precedenti si può attribuire alle particelle la configurazione geometrica regolare di un cubo ottaedro avente dimensione dp e calcolare come variano in funzione di essa i numeri degli atomi che si trovano sugli angoli, di quelli che sono sugli spigoli e, infine, di quelli che si trovano sulla superficie. Ovviamente tali atomi hanno un diverso grado di coordinazione con quelli a essi adiacenti. Assumendo che a ciascuno di questi vada attribuita una differente attività catalitica, si dimostra che la velocità di reazione è proporzionale a dpδ−3. Il parametro δ viene chiamato dimensione della reazione e, in base al precedente modello geometrico, assume il valore 0 se la reazione avviene sugli angoli, 1 se la reazione avviene sugli spigoli e 2 se la reazione avviene sulle superfici ed è pertanto structure insensitive. Il valore di δ è stato valutato sperimentalmente per diverse reazioni, determinando come cambia la loro velocità al variare del diametro delle particelle del catalizzatore. I risultati ottenuti, per diversi significativi esempi di processi catalitici, rivelano che in alcuni casi tale valore risulta superiore a 2, indicando che la popolazione dei centri attivi cresce più rapidamente di quanto previsto dall'aumento dell'area della superficie. Questo risultato è compatibile con l'ipotesi che il numero di oggetti di estensione L richiesti per ricoprire la superficie risulti espresso da L−Df, dove Df è una dimensione frattale, che assume valori non interi compresi fra 3 e 0, e comunque inferiori alle dimensioni euclidiane che nel caso di una superficie sono ovviamente 2. In particolare, risulta che la reazione di sintesi dell'ammoniaca, che è molto sensibile alla struttura della superficie, presenta un valore di δ particolarmente elevato, mettendo in evidenza come il carattere frattale della superficie sia intimamente connesso con la menzionata sensitività.
Catalisi eterogenea acido-base
Le superfici di alcuni solidi, in particolare l'allumina, la silice e la silice allumina, sono sede di centri acidi o basici. Nel caso di ossidi ionici, i cationi esposti alla superficie si comportano come centri di Lewis in grado di accettare una coppia di elettroni presenti nella molecola che viene adsorbita. Viceversa, i gruppi ossidrilici superficiali possono cedere un protone comportandosi come acidi di Brönsted. Inoltre, la coordinazione dell'acqua con un centro acido di Lewis può dare origine per dissociazione a un centro di Brönsted. Entrambi i centri intervengono in importanti reazioni catalitiche, che riguardano in particolare la disidratazione degli alcoli e le trasformazioni degli idrocarburi, quali le isomerizzazioni per migrazione dei doppi legami o di gruppi alchilici. L'intervento dei centri acidi di Brönsted è associato alla formazione di ioni carbonio per addizione di un protone a un doppio legame olefinico:
[8] H2C=CHR + H+ → CH3C+HR.
La carica presente su uno ione carbonio può migrare sulla stessa molecola o essere trasferita a una molecola diversa, dando così luogo a reazioni a catena, quali la polimerizzazione per addizione ad altre olefine, le isomerizzazioni scheletrali per migrazione di gruppi alchilici, i processi di cracking con rottura della molecola nella posizione adiacente a quella della carica.
Fra i catalizzatori acidi rientra l'ampia classe dei silico-alluminati, aventi una struttura microporosa caratterizzata da una configurazione geometrica ben definita, cui appartengono le zeoliti, che sono presenti in natura in un'ampia varietà. Quelle di interesse nella catalisi sono prodotti sintetici, quale la zeolite ZSM-5. Le zeoliti hanno un'elevata area specifica, in gran parte presente nella struttura cristallina interna con un'architettura definita da un reticolo di micropori di dimensioni molecolari, con forma e misure variabili ma comunque ben definite. La loro attività catalitica è dovuta soprattutto alla presenza di centri acidi di Brönsted, molto attivi in reazioni che riguardano, per esempio, la trasformazione di idrocarburi saturi e insaturi. Per questa ragione, a partire dagli anni Cinquanta del secolo scorso, l'impiego delle zeoliti ha costituito un'autentica rivoluzione nella catalisi industriale, con particolare riferimento all'industria petrolifera, poiché esse vengono impiegate nei processi di cracking. Un ulteriore aspetto riguardante l'impiego delle zeoliti è la cosiddetta shape selective catalysis, associata al fatto che l'accessibilità della struttura interna delle zeoliti è strettamente condizionata dalle dimensioni delle molecole dei reagenti e dei prodotti di reazione, che devono risultare compatibili con quelle dei micropori delle zeoliti stesse. In virtù di questo fatto, le zeoliti agiscono come setacci nei confrontidi particolari trasformazioni, orientando così la selettività in direzioni particolari. Per esempio, nelle zeoliti ZSM-5 non si possono formare idrocarburi poliaromatici, poiché le dimensioni dei pori (ca. 0,55 nm) non lo permettono. Viceversa, se si impiegano materiali con diametro dei pori superiore, si forma anche la naftalina e altri idrocarburi poliarenici.
Ingegneria della catalisi
Il vertiginoso sviluppo raggiunto dall'industria chimica nel secolo scorso è dovuto in grande misura all'individuazione di nuovi processi catalitici, che hanno permesso di realizzare ampie e variegate trasformazioni delle materie prime esistenti in natura. Un esempio storicamente importante è la reazione di sintesi dell'ammoniaca a partire da idrogeno azoto, condotta industrialmente a pressione e temperature relativamente elevate (ca. 300 bar e 350 °C) in competizione con quanto avviene nelle piante leguminose per azione dell'enzima nitrogenasi, che opera a temperatura e pressione ordinarie. Tale processo, oltre ad avere contribuito a mitigare la fame nel mondo, attraverso la fabbricazione dei fertilizzanti sintetici utilizzando l'azoto atmosferico, ha anche costituito un'autentica svolta nello sviluppo delle moderne tecnologie chimiche.
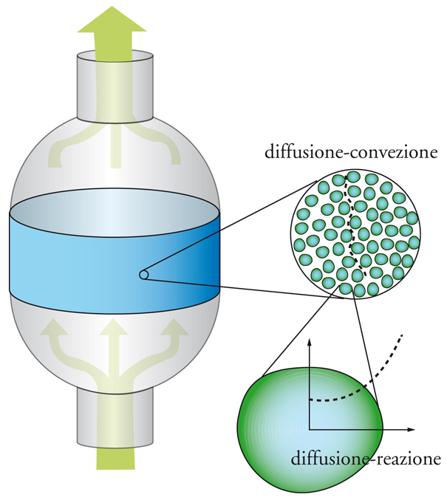
Lo sfruttamento del petrolio, attraverso processi catalitici, ha favorito il gigantismo degli impianti, che hanno acquistato dimensioni e complessità tali da richiedere, per la loro progettazione e gestione, l'impiego di sofisticate metodologie. Esse coinvolgono molti aspetti avanzati della fisica, della chimica-fisica e dell'ingegneria, che comprendono la termodinamica, la cinetica chimica, la fluidodinamica e i processi di trasporto su scala molecolare e turbolenta. Il cuore di tali impianti complessi è il reattore catalitico, che per lo più è costituito da un'unità, solitamente cilindrica (fig. 1), nella quale vengono ammassate le particelle di catalizzatore con forma sferica o cilindrica. Ciascuna di esse è lambita dalla corrente fluida, gassosa o liquida, che fluisce negli interstizi, mentre le molecole dei reagenti diffondono verso la superficie esterna del catalizzatore e successivamente all'interno dei pori stessi per raggiungere i centri attivi. La velocità della reazione può essere limitata da entrambi i processi diffusivi, quello esterno, che ha luogo nello strato di fluido a contatto con la particella stessa, e quello interno, che avviene attraverso i pori delle particelle catalitiche, che agiscono come due resistenze in serie.
Sui centri attivi si producono le reazioni catalitiche il cui svolgimento segue una logica che procede attraverso le seguenti scale:
(a) microscopica o atomica (nm), nella quale i processi vengono esplorati sulla base dei modelli molecolari superficiali;
(b) mesoscopica (decine di nm), nella quale si studiano sia le caratteristiche dei centri attivi superficiali attraverso l'impiego di tecniche in situ, sia l'influenza della rugosità della superficie sull'interazione fra fenomeni diffusivi e chimici;
(c) macroscopica (decine di cm), dove, tenendo conto delle caratteristiche geometriche, meccaniche e termiche delle particelle catalitiche, si simula, mediante le equazioni di conservazione della massa, quantità di moto ed energia, il comportamento dei reattori industriali
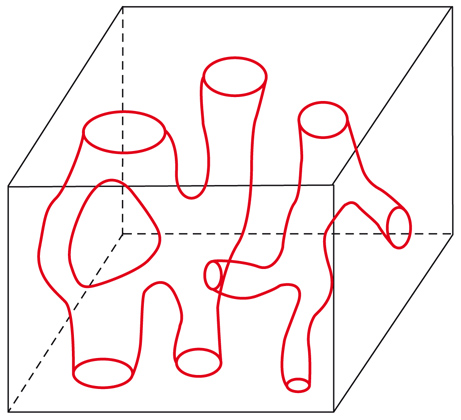
La superficie delle particelle solide porose di un catalizzatore si sviluppa nel loro interno attraverso un complesso reticolo di canalicoli, come viene illustrato nella fig. 2. Pertanto, affinché le molecole dei reagenti vengano catturate, ovvero adsorbite, dalla superficie per dare luogo alle trasformazioni chimiche, devono prima diffondere attraverso i pori stessi. Il processo coinvolge quindi sia la diffusione all'interno dei pori del catalizzatore, sia la reazione catalitica vera e propria. Entrambi intervengono nella progettazione di un buon catalizzatore, che risponda nel modo più adeguato alle aspettative. Per approfondire l'analisi del modo in cui i fattori precedenti condizionano la velocità di un processo catalitico, è opportuno riferirci alla situazione semplificata di un poro cilindrico di diametro d e lunghezza Lp, nel quale entra il reagente che diffonde e viene quindi adsorbito su un punto della superficie dove subisce la trasformazione chimica. In prima approssimazione, la velocità della reazione r, espressa come moli del reagente trasformato per unità di tempo e unità di superficie del catalizzatore, si può scrivere come segue:
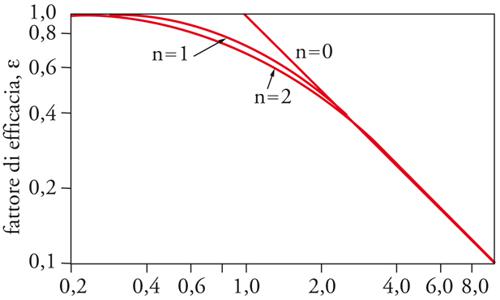
[9] r = rid η = k(T)Csη .
In essa compare un termine, che definiremo ideale, proporzionale alla concentrazione Cs del reagente in corrispondenza della superficie, moltiplicato per la costante di velocità di reazione k(T), che dipende dalla temperatura. Il parametro adimensionato η, chiamato efficienza del catalizzatore, riflette l'influenza dei processi diffusivi sulla velocità globale, poiché esprime il rapporto fra il flusso reale del reagente verso la superficie e quello ipotetico che si avrebbe in assenza di impedimenti diffusivi. Esso dipende dal parametro adimensionato ϕ=dτ√(ζ/Λ), secondo l'andamento illustrato nella fig. 3. ζ è il rapporto fra superficie e volume del poro, uguale a 4/d se è cilindrico, mentre Λ=D/k esprime il rapporto fra il coefficiente di diffusione del reagente e la costante di velocità. Ha le dimensioni di una lunghezza ed esprime la scala su cui si svolgono le reazioni chimiche τ è un parametro chiamato tortuosità, uguale a 1 per pori regolarmente cilindrici, e minore di 1 per i pori la cui irregolarità penalizza la diffusione. Per valori piccoli di ϕ l'efficienza è prossima all'unità, mentre al suo aumentare essa diminuisce, poiché ci si muove verso le condizioni nelle quali la diffusione rallenta la velocità del processo globale.
La catalisi della vita
La concezione che i processi vitali si svolgano attraverso reti di reazioni catalitiche sta esercitando un ruolo molto importante nelle scienze biologiche. Questa consapevolezza alimenta la prospettiva di poter cogliere le analogie fra processi catalitici che avvengono rispettivamente in soluzione e sui centri attivi delle superfici solide e degli enzimi, in una visione unificata nel cui ambito le conoscenze acquisite in ciascuno dei tre aspetti menzionati possano fertilizzarsi a vicenda. Tipiche, a questo proposito, sono le reazioni di idrolisi che possono essere condotte sia in soluzione sia per via enzimatica, come nel caso delle lipasi che idrolizzano gli esteri degli acidi grassi. Per lungo tempo si è però ritenuto che la possibilità di interpretare il meccanismo delle reazioni enzimatiche, sfruttando le conoscenze acquisite negli altri settori della catalisi, fosse un obbiettivo remoto, soprattutto per le elevate reattività e selettività che caratterizzano le reazioni enzimatiche stesse.
Questa situazione si è ribaltata a partire dalla seconda metà del secolo scorso, poiché lo sviluppo dei metodi di indagine delle strutture molecolari mediante i raggi X, che sono diventati sempre più accurati grazie anche all'impiego della radiazione prodotta dai sincrotroni, fornisce informazioni sulla struttura di alcuni centri catalitici enzimatici più dettagliate di quelle dei centri attivi presenti su molte delle superfici inorganiche. L'applicazione della spettroscopia NMR permette di conoscere non solo la struttura ma anche la flessibilità delle molecole enzimatiche. Queste acquisizioni, unitamente agli sviluppi della cinetica e della dinamica delle reazioni veloci e delle indagini sui sistemi di reazione complessi, permettono di analizzare il meccanismo delle reazioni enzimatiche. La gamma delle reazioni catalizzate dagli enzimi, la cui accelerazione può raggiungere valori dell'ordine di 1019, è molto ampia e variegata, poiché include le idrolisi, le addizioni e i trasferimenti inter- e intramolecolari di gruppi, le isomerizzazioni, le ossidazioni e il trasferimento di elettroni.
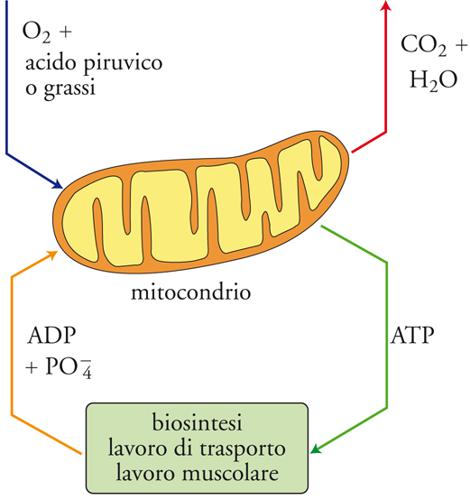
Negli organismi viventi gli enzimi sono organizzati in sistemi multifunzionali, che catalizzano catene di reazioni interconnesse, nelle quali la presenza di inibizioni dovute a retroazioni possono dare origine a oscillazioni delle concentrazioni dei reagenti. Per esempio, i mitocondri, che sono dei piccoli organi che svolgono nelle cellule la funzione di sorgenti di energia, costituiscono dei veri e propri microreattori chimici. In essi ha luogo l'ossidazione dell'acido piruvico e degli acidi grassi ad anidride carbonica e acqua, trasformando nel contempo l'ADP (Adenosin difosfato) in ATP (Adenosin trifosfato), che come è noto costituisce il vettore energetico dei processi biologici (fig. 4). I centri attivi enzimatici si trovano sulla superficie di una membrana avvolta su se stessa, e quindi possono essere raggiunti solo mediante la diffusione dei reagenti attraverso le zone comprese fra le pieghe della membrana stessa. La velocità di diffusione è in competizione con quella della reazione chimica, come si verifica in un catalizzatore poroso.
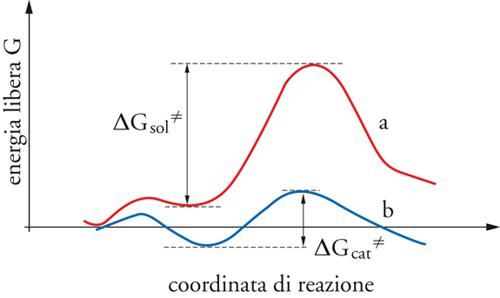
Gli enzimi sono costituiti da macromolecole proteiche, comprendenti qualche centinaio di residui di amminoacidi, ripiegate in strutture tridimensionali (folding), sulla cui superficie sono presenti configurazioni locali in grado di riconoscere determinate molecole, poiché il legame che si forma fra la molecola e il centro attivo è facilitato dalla loro complementarità morfologica, in accordo con un modello chiamato chiave-serratura (lock and key). Spesso la flessibilità dell'enzima permette cambiamenti della sua struttura, che possono agevolare l'avvicinamento del reagente verso il centro attivo e la rimozione del prodotto di reazione, secondo un più recente modello chiamato accesso-indotto (induced fit). Un approccio all'interpretazione di una reazione enzimatica è basato sulla simulazione degli eventi molecolari che intervengono in essa, mediante la chimica computazionale. In tale impostazione è interessante esaminare la variazione della funzione energia libera lungo il cammino di reazione, per una reazione che venga condotta rispettivamente in soluzione e su un centro attivo enzimatico. Da tali andamenti, riportati nella fig. 5, si può osservare che entrambe le curve partono da un punto comune e passano per un massimo non molto pronunciato, per scendere quindi verso un minimo corrispondente alla stabilizzazione dovuta rispettivamente alla formazione di una gabbia di solvente attorno al reagente, per la reazione in soluzione, e al suo adsorbimento sul centro attivo, per la catalisi enzimatica. Successivamente, le curve passano per un altro massimo che identifica lo stato di transizione della reazione. ΔGsol≠ e ΔGcat≠ sono i valori delle barriere di energia libera che devono essere superati perché abbia luogo la reazione. In base alla teoria dello stato di transizione (TST), la costante di velocità di reazione si esprime come segue:
[10 + formula
essendo kBla costante di Boltzmann e h quella di Planck. γ(T) è un coefficiente di trasmissione che tiene conto degli effetti dovuti al riattraversamento della barriera dell'energia potenziale in senso inverso a quello della reazione, alle deviazioni dalle condizioni di equilibrio e infine all'incidenza dell'effetto tunnel in virtù del quale, in base alla meccanica quantistica, può avere luogo una penetrazione della barriera.
Anzitutto si può osservare che in base agli andamenti della fig. 5, ΔGcat≠−ΔGsol≠〈0 e quindi kcat>ksol, per cui il catalizzatore agisce abbassando la barriera dell'energia di attivazione. Questa interpretazione è stata avanzata per la prima volta, nel 1946, da Linus Pauling, che aveva attribuito l'azione degli enzimi alla stabilizzazione del complesso attivato. Le ricerche successive, condotte su diversi casi specifici, hanno indicato che tale diminuzione di energia è essenzialmente riconducibile a una riduzione degli effetti elettrostatici, dovuti al fatto che l'enzima ripiegato favorisce un'opportuna organizzazione delle molecole polari, prima fra tutte l'acqua, che circondano il suo centro attivo. Inoltre, nel passaggio dal reagente allo stato di transizione ha luogo un sostanziale trasferimento di carica, sulla cui entità gioca un ruolo importante la posizione dei gruppi polari o elettrostaticamente carichi. La formazione di legami a idrogeno, che è tipicamente dominata da fattori elettrostatici, contribuisce a stabilizzare lo stato di transizione.
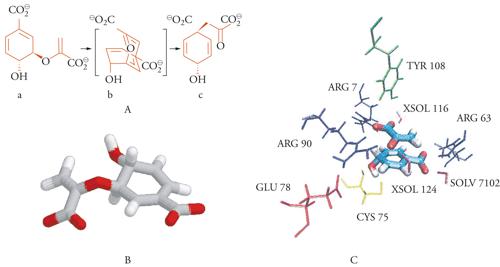
Un esempio interessante che legittima questa ipotesi è stato ottenuto dallo studio mediante la chimica computazionale della reazione, riportata nella fig. 6, di trasposizione intramolecolare di Claisen dell'acido corismico, il quale è presente nelle piante e costituisce il precursore di diversi composti organici, quali gli amminoacidi aromatici. Prescindendo dal suo interesse applicativo, tale reazione si presta in modo particolare per gli studi teorici sulla catalisi enzimatica, poiché coinvolge una sola molecola che si trasforma dal reagente A al prodotto C passando attraverso lo stato di transizione B, la cui struttura è illustrata nella fig. 6C. Lo stato di transizione, essendo più polare del reagente, viene stabilizzato dall'energia elettrostatica, che si manifesta attraverso il rafforzamento dei legami a idrogeno con la carica presente nel centro reattivo. In base ai calcoli, la variazione dell'energia elettrostatica risulta dell'ordine di 20 kcal/mole con un corrispondente aumento della costante di velocità di reazione dell'ordine di 1015.
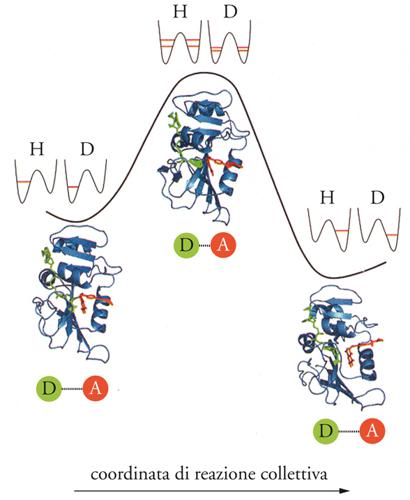
Una notevole attenzione è stata dedicata anche all'analisi dell'influenza dell'effetto tunnel, in particolare per reazioni che coinvolgono il trasferimento di protoni. I calcoli hanno indicato che esso contribuisce ad aumentare la velocità di reazione di un fattore che può essere superiore a due ordini di grandezza. Un'esemplificazione è riportata nella fig. 7, nella quale vengono illustrate le curve di energia potenziale relative sia all'evoluzione dell'intero enzima sia al moto del singolo protone, rispettivamente nello stato iniziale, di transizione e finale. Mediante la simulazione è stato approfondito anche il ruolo delle rapide fluttuazioni termiche, che tendono alla stocasticità browniana, sull'aumento della velocità di reazione, attraverso l'esaltazione dell'influenza di particolari moti di vibrazione degli atomi presenti nel centro attivo. I risultati dei calcoli hanno però dimostrato che questi effetti giocano un ruolo secondario.
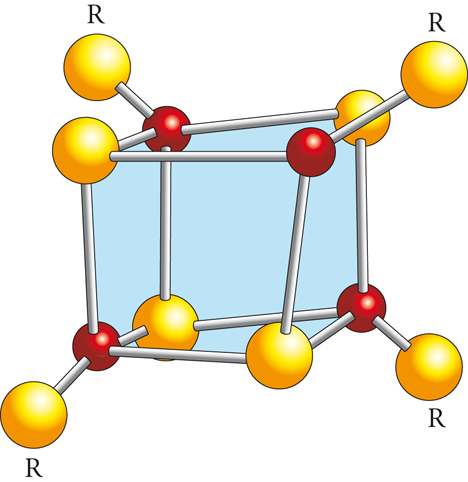
In molti enzimi, alla catena proteica è associato un cofattore costituito da atomi o ioni metallici organizzati in particolari strutture, quale, per esempio, il cluster Fe4S4, avente la struttura cubica illustrata nella fig. 8. Essi si trovano incorporati in alcune proteine, quali la ferredoxina, che interviene nel trasferimento di elettroni attraverso le membrane o verso un centro biosintetico.
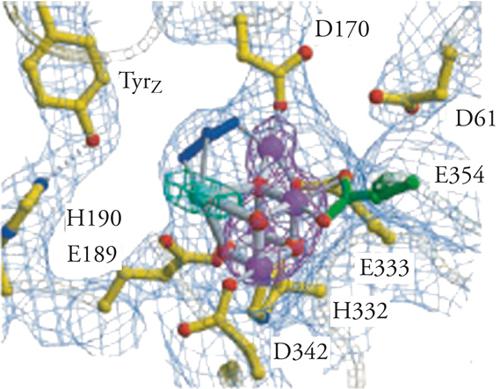
Un altro esempio è il centro catalitico del fotosistema II che, agendo sulla scissione dell'acqua, costituisce uno stadio del processo fotochimico globale:
[11] 2H2O + 4hν → O2 + 4H+ + 4e− .
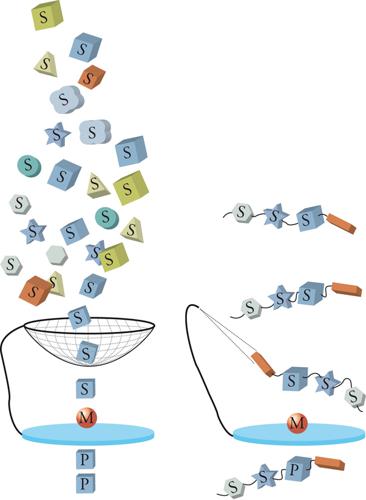
Il centro attivo in cui ha luogo la liberazione dell'ossigeno ha formula O4Mn3Ca, con gli atomi organizzati in una struttura cubica, come viene illustrato nella fig. 9. L'approfondimento del meccanismo del processo, oltre ad avere un notevole interesse conoscitivo, può contribuire alla progettazione di opportuni catalizzatori per la scissione fotochimica dell'acqua. In conclusione, si può affermare che gli enzimi, essendo i prodotti della selezione evolutiva, fruiscono nella loro azione di diversi meccanismi molecolari, i più importanti dei quali sono l'effetto chiave e serratura, che favorisce la selettività e la diminuzione dell'energia libera di attivazione che aumenta la reattività. Una delle principali sfide che la chimica sintetica deve affrontare è la progettazione di catalizzatori che permettano di realizzare reazioni con elevata selettività nei riguardi di particolari residui molecolari. Un approccio che viene seguito è quello di impiegare opportune strategie che imitano l'azione degli enzimi. In questa impostazione biomimetica sono state individuate le due strade illustrate nelle figg. 10 A e 10B. Nella prima mediante un'azione di setaccio, simile a quella esercitata dalla zeolite, si limita l'accesso al centro attivo M al solo reagente S che si trasforma in P; nella seconda, fruendo delle interazioni di non legame, si facilita un particolare orientamento del substrato che favorisce il contatto del residuo S con il centro attivo. Risultati interessanti basati su quest'ultimo approccio sono stati conseguiti per l'ossidazione selettiva dei legami C-H, usando per esempio complessi binucleari del manganese.
Le conoscenze che si stanno accumulando sul meccanismo dei processi catalitici biologici offrono interessanti prospettive anche per la soluzione del dibattuto problema sull'origine della vita sulla Terra. Ricordiamo, a tale proposito, che attualmente il mantenimento della vita è dovuto al processo fotosintetico grazie al quale l'acqua e l'anidride carbonica vengono impiegate per sintetizzare composti organici relativamente complessi, quali i carboidrati. Sulla Terra primordiale erano presenti idrogeno e anidride carbonica, che costituiscono le materie prime potenziali per far emergere la vita stessa. Anche se dal punto di vista termodinamico tali reagenti tenderebbero a combinarsi fra loro per formare acqua e metano, la reazione non avviene spontaneamente ma solo grazie all'intervento di opportune sostanze inorganiche naturali, che, agendo quali catalizzatori, la orientano verso la formazione di composti che portano all'emergenza dei processi vitali. Un candidato che è stato proposto, sia pure speculativamente, è il minerale greigite [Fe5NiS8], che è un solfuro di nichel e ferro la cui struttura molecolare è simile a quella del tiocubano. In realtà, le reazioni coinvolte sono molto complesse poiché intervengono altri elementi quali il fosforo, l'azoto, il ferro, il nichel, il cobalto e lo zinco. Le trasformazioni procedono probabilmente attraverso schemi di reazioni a catena, i cui dettagli sono oggetto di ampie e approfondite indagini che fanno intervenire meccanismi autocatalitici, il cui comportamento cinetico non lineare ha probabilmente costituito il fattore che ha innescato i processi di autoorganizzazione verso strutture ordinate e organizzate.
Bibliografia
Benkovic, Stephen J. - Hammes-Schiffer, Sharon, Enzyme motions inside and out, "Science", 312, 2006, pp. 208-209.
Carrà, Sergio - Morbidelli, Massimo, Chimica fisica applicata, Milano, Hoepli, 1983.
Carrà, Sergio, Catalisi, in: Enciclopedia degli Idrocarburi, Roma, Istituto della Enciclopedia Italiana, V, 2008.
Ferreira, Kristina N. e altri, Architecture of the photosynthetic oxygen-evolving center, "Science", 303, 2004, pp. 1831-1838.
García Viloca, Mireia e altri, How enzymes work: analysis by modern rate theory and computer simulations, "Science", 303, 2004, pp. 186-195.
Logadottir, Ashildur - Nørskov, Jens K., Ammonia synthesis over Ru(0001) surface, "Journal of catalysis", 220, 2003, pp. 273-231.
Mas-Ballesté, Rubén - Que, Lawrence, Targeting specific C-H bonds for oxidation, "Science", 312, 2006, pp. 1885-1886.
Ranaghan, Kara E. e altri, Transition state stabilization and substrate strain in enzyme catalysis: ab initio QM/MM modelling of the chorismate mutase reaction, "Organic and biomolecular chemistry", 2, 2004, pp. 968-980.
Reuter, Karsten - Scheffler, Matthias, First-principles atomistic thermodynamics for oxidation cata-lysis: surface phase diagrams and catalytically interesting regions, "Physical review letters", 90, 2003, pp. 046103-1-046103-4.
Russell, Michael, First life, "American scientist", 94, 2006, pp. 32-39.
Schlögl, Robert, Combinatorial chemistry in heterogeneous catalysis, "Angewandte Chemie. Internatio-nal edition", 37, 1998 , pp. 2333-2336.
Thomas, John M., Advanced catalysts: interfaces in the physical and biological sciences, "Angewandte Chemie. International edition", 28, 1989, pp. 1079-1088.
Villá, Jordi - Warshel, Arieh, Energetic and dynamics of enzymatic reactions, "Journal of physical chemistry B", 105, 2001, pp. 7887-7907.
Wise, Henry - Oudar, Jacques, Material concepts in surface reactivity and catalysis, New York, Dover, 1999.