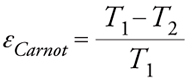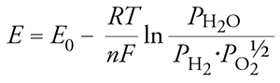Celle a combustibile
Celle a combustibile
Una cella a combustibile è un dispositivo elettrochimico in grado di convertire direttamente l’energia chimica in energia elettrica tramite un processo a temperatura costante in cui l’idrogeno viene combinato con l’ossigeno per formare acqua. Il principio di funzionamento della cella a combustibile fu scoperto nel 1839 dal fisico inglese William Grove. Quasi cento anni dopo, sempre in Gran Bretagna, l’ingegnere Francis Th. Bacon sviluppò ulteriormente l’invenzione di Grove, dedicando particolare attenzione alla morfologia degli elettrodi e al ruolo del catalizzatore nel promuovere i processi di cella. In tempi più recenti si sono avuti ulteriori sviluppi tecnologici, prima negli anni Settanta, a seguito dei programmi spaziali che hanno selezionato le celle a combustibile quali sistemi preferenziali per l’alimentazione elettrica a bordo di importanti missioni, come i programmi Gemini e Apollo e, più recentemente, in relazione alle loro potenzialità nel rinnovamento energetico (ciclo di idrogeno) e nel trasporto ecosostenibile (veicoli elettrici).
Il funzionamento di una cella a combustibile è basato sulla seguente reazione elettrochimica:
H2 (g) + ½ O2 (g) → H2O (l)
che comporta la combustione dell’idrogeno gassoso con l’ossigeno gassoso con formazione di acqua. L’idrogeno è il combustibile più utilizzato, ma possono essere adoperati anche alcoli o benzine. Poiché l’idrogeno non è una risorsa naturale è necessario che venga prodotto sfruttando dei processi che includono l’elettrolisi dell’acqua, il cracking o il reforming in corrente di vapore di combustibili organici quali il gas naturale, il metanolo o gli idrocarburi. Tra tutti questi processi di sintesi, solamente l’elettrolisi dell’acqua dà luogo a idrogeno puro, mentre dagli altri si ottengono miscele in cui l’idrogeno è presente con altri componenti gassosi, in genere indesiderati in quanto possono influire sul corretto funzionamento della cella a combustibile.
In linea di principio, una cella a combustibile è simile a una batteria elettrochimica, come per esempio il noto accumulatore piombo-acido. Infatti, entrambi i dispositivi sono in grado di convertire direttamente l’energia chimica in energia elettrica, combinando un elettrodo negativo, o anodo (idrogeno nella cella a combustibile e piombo nell’accumulatore), con uno positivo o catodo (ossigeno nella cella a combustile e biossido di piombo nell’accumulatore) posti a contatto con un opportuno mezzo a conduzione di ioni o elettrolita (una serie di sistemi protonici o alcalini nella cella a combustibile, soluzione di acido solforico nell’accumulatore). Vi è, tuttavia, una differenza tra i due dispositivi in quanto, mentre una batteria è un sistema chiuso che funziona consumando i componenti attivi agli elettrodi, la cella a combustibile lavora grazie a un flusso di reagenti gassosi riforniti dall’esterno. Ne segue che la batteria è limitata nella sua durata dalla quantità di reagenti che ha nel suo interno e necessita di un processo di carica per ripristinare le sue condizioni iniziali, mentre una cella a combustibile garantisce una vita di esercizio continua fino a quando essa viene rifornita con i reagenti gassosi.
Principio di funzionamento
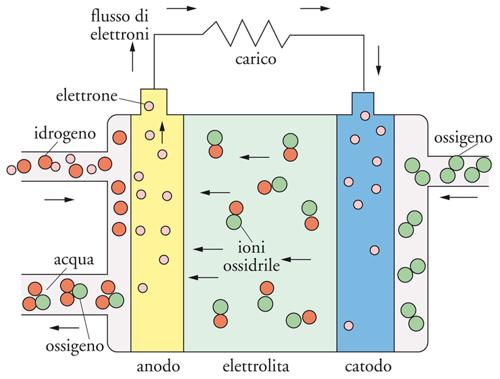
Il principio di funzionamento di una cella a combustibile è così descrivibile: il combustibile, idrogeno, viene fornito all’elettrodo negativo dove si ossida a ione H+ (protone) con cessione di elettroni. Gli elettroni fluiscono nel circuito esterno e producono lavoro elettrico, per poi giungere al catodo dove riducono l’ossigeno a ione OH− (ossidrile). Il circuito è chiuso dal trasporto di ioni da un elettrodo all’altro attraverso l’elettrolita. A seconda della natura dell’elettrolita usato (acido o basico), le reazioni dei singoli elettrodi possono essere scritte come indicato di seguito.
Nell’elettrolita acido:
anodo: H2 → 2H+ + 2 e−
[2] catodo: ½O2+2H++2 e− → H2O
totale: H2 + ½O2 → H2O
e il circuito elettrico viene chiuso dal trasporto di protoni che attraversano la cella dall’anodo fino a raggiungere il catodo per completare la reazione elettrochimica.
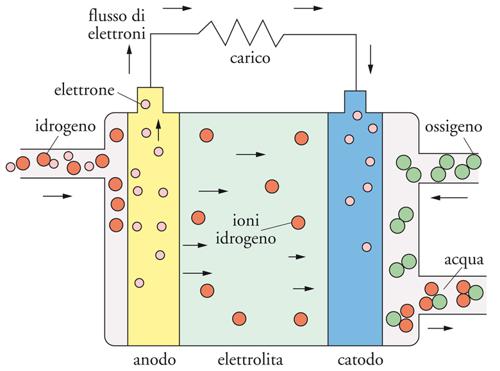
Nell’elettrolita basico:
anodo: H2+ 2OH− → 2H2O + 2 e−
[3] catodo: ½O2 + H2O + 2e− → 2OH−
totale: H2 + ½O2 → H2O
e il circuito elettrico viene chiuso dal trasporto degli ioni ossidrile che migrano dal catodo all’anodo per completare la reazione elettrochimica. In entrambi i casi il processo elettrochimico globale porta alla formazione di acqua.
In sintesi, una cella a combustibile sfrutta il processo di combustione dell’idrogeno al fine di produrre lavoro elettrico; pertanto questa cella può essere considerata come un motore elettrico capace di convertire l’energia libera della reazione elettrochimica in energia elettrica, con un processo analogo a quello che può aver luogo in un motore termico. Tuttavia, il grande merito di una cella a combustibile risiede nel fatto che essa, a differenza di quanto avviene in un motore termico, può convertire l’energia chimica in energia elettrica senza incorrere nelle limitazioni imposte dal ciclo di Carnot. Come è noto, l’efficienza massima di un motore termico (efficienza di Carnot, εCarnot) dipende dai valori estremi di temperatura, secondo la relazione:
[4] formula
dove T1 è il valore massimo della temperatura assoluta di operazione e T2 quello minimo. Questa equazione implica che l’efficienza può raggiungere un valore pari a 1 (100%) solamente se T2 è uguale allo zero assoluto, oppure se T1 approssima un valore infinito. In condizioni normali, l’efficienza massima non eccede il 40%.
L’efficienza di una cella a combustibile, εtherm, invece, è correlata al rapporto di due grandezze termodinamiche, la variazione di energia libera di Gibbs, ΔG, e la variazione di entalpia, ΔH, nella reazione di ossidazione del combustibile, secondo la relazione:
[5] εtherm = ΔG/ΔH.
Il rapporto tra le due grandezze termodinamiche, entrambe negative nella reazione di formazione dell’acqua, permette di raggiungere valori doppi di efficienza rispetto a quelli ottenibili dal motore termico.
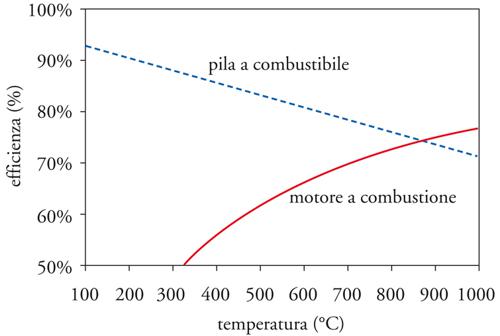
La fig. 2 mostra, in confronto, l’andamento al variare della temperatura dell’efficienza di una pila a combustibile, a idrogeno e ad aria, e di un motore termico, assumendo un valore di T2 pari a 25° C. Poiché ΔG diminuisce in valore assoluto al crescere della temperatura e ΔH rimane essenzialmente invariata, l’efficienza della cella a combustibile decresce al crescere della temperatura mentre l’opposto si verifica per il motore termico, fino a pervenire ad alti valori di temperatura in cui l’efficienza del motore a combustione supera quella della cella a combustibile.
La forza elettromotrice, f.e.m., o potenziale E di una cella a combustibile è espressa dall’equazione di Nernst:
[6] formula
dove E0 è definito come il potenziale standard di cella, cioè il valore che si otterrebbe se reagenti e prodotti si trovassero nel loro stato standard.
L’equazione [6] mostra come il valore di E cresca al crescere della pressione parziale del combustibile (per es., idrogeno, PH2) e dell’aria (PO2) e decresca al crescere della temperatura. Il potenziale E è correlato all’energia libera di Gibbs dalla relazione:
[7] ΔG = −nEF
dove n è il numero di elettroni coinvolti (2 nella reazione di interesse) e F è la costante di Faraday (96.495 C mol−1). La variazione di energia libera di Gibbs a 298 K, nel caso in cui prodotti e reagenti si trovino nel loro stato standard (H2O liquida, H2 e O2 puri sotto pressioni unitarie), coincide con la variazione di energia libera standard, ΔG0, ed è uguale a − 237 kJmol−1. Quindi, il potenziale di cella, coincidente con il potenziale standard, E0, è uguale, nelle suddette condizioni di reazione, a 1,23 V.
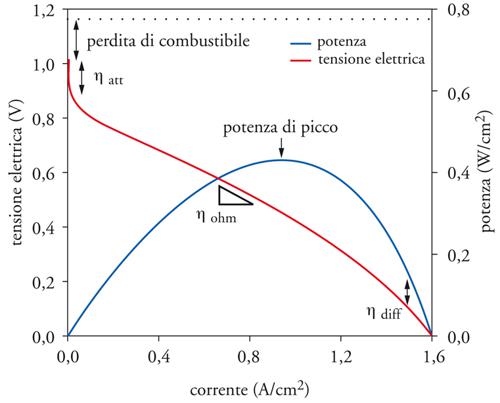
La fig. 3 illustra un andamento tipico della curva corrente-tensione di una cella a combustibile. In condizioni di circuito aperto la corrente è nulla e la tensione di cella è al suo valore massimo, corrispondente alla forza elettromotrice nelle particolari condizioni di reazione. Alla chiusura del circuito e al conseguente passaggio di corrente nella cella si verificano cadute irreversibili di potenziale che comportano una progressiva diminuzione della tensione di cella V secondo la relazione:
[8] V = E − ηatt − ηohm − ηdiff
da cui si rileva come V differisca da E per una serie di cadute di tensione indicate rispettivamente con: (a) ηatt − che identifica la sovratensione di attivazione legata ai processi anodici e catodici; (b) ηohm − che identifica la sovratensione ohmica dovuta alla caduta di tensione iR a seguito del passaggio di elettroni e ioni attraverso i materiali, rispettivamente, elettrodici ed elettrolitici che hanno resistenza finita; (c) ηdiff − che identifica la sovratensione di diffusione dovuta a limitazioni di trasporto di massa. Queste cadute di tensione si riflettono in regioni diverse nella curva corrente-tensione della fig. 3: (a) la sovratensione di attivazione, ηatt, appare nella parte iniziale a bassa corrente; (b) le cadute ohmiche, ηohm, nella parte centrale a media corrente; (c) le limitazioni di trasporto di massa, ηdiff , nella parte finale ad alta corrente. Un’ulteriore caduta di tensione può aver luogo a seguito del passaggio dei reagenti attraverso l’elettrolita e, in misura minore, di un’eventuale indesiderata conduzione elettronica attraverso lo stesso. Tali perdite, in genere trascurabili, diventano importanti nel caso di un combustibile liquido (metanolo) e, in generale, nel caso di celle a combustibile a bassa temperatura, provocando un marcato effetto di riduzione del valore di forza elettromotrice.
Ne segue che l’efficienza della cella diminuisce passando dalle condizioni ideali, vale a dire a circuito aperto, a quelle reali sotto carico dove parte dell’energia libera viene dissipata sotto forma di calore a causa delle resistenze della cella. Sebbene il valore finale del rendimento di cella dipenda anche da fattori legati a processi collaterali dei componenti ausiliari di cella – come quelli relativi al pompaggio, al riscaldamento, al raffreddamento e alla compressione dei reagenti gassosi – l’efficienza di conversione diretta rimane elevata così da rappresentare uno dei vantaggi distintivi della tecnologia delle celle a combustibile.
Tuttavia, è sempre opportuno minimizzare le sovratensioni mediante la scelta appropriata dei materiali impiegati e della geometria di cella. Per favorire le reazioni elettrodiche, per esempio, e accelerarne le cinetiche, è necessario ricorrere all’uso di un catalizzatore poiché i processi elettrodici, come l’ossidazione dell’idrogeno e la riduzione dell’ossigeno, procedono attraverso fenomeni di adsorbimento-desorbimento su un substrato solido, su cui l’idrogeno o l’ossigeno rilasciano o ricevono elettroni. Nel caso dell’ossidazione dell’idrogeno, per esempio, si può assumere che il processo si svolga attraverso una sequenza di passaggi, che inizialmente comporta il trasporto di una molecola d’idrogeno dalla fase gassosa al substrato solido e il suo adsorbimento sulla superficie; questo stadio è seguito dall’ossidazione elettrochimica dell’idrogeno adsorbito e, infine, dal rilascio nella fase elettrolitica delle specie che si sono formate. Il processo di riduzione dell’ossigeno è ancora più complesso, poiché implica un numero di passaggi paralleli e consecutivi, tra i quali la formazione di perossido di idrogeno come prodotto intermedio.
Si può quindi comprendere come la velocità dei processi agli elettrodi sia influenzata dalla natura del substrato e, in particolare, dal valore di entalpia di adsorbimento dell’idrogeno o dell’ossigeno. Ne segue che le cinetiche dei processi elettrodici possono essere accelerate, e quindi le sovratensioni ridotte, scegliendo il substrato più opportuno. In altre parole, il substrato agisce come un catalizzatore per le reazioni elettrodiche.
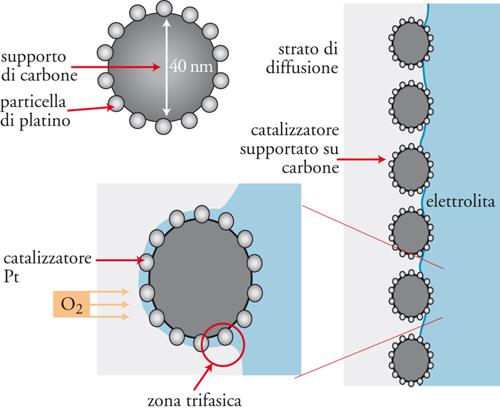
I catalizzatori più efficaci per il processo di ossidazione dell’idrogeno sono i metalli nobili − quali il platino, il palladio o il rutenio − mentre per la riduzione dell’ossigeno, oltre al platino e al palladio, possono essere usati, sotto regimi di alta temperatura, il nickel e i suoi ossidi. L’elevato costo di questi catalizzatori contribuisce a condizionare il costo globale di una cella a combustibile. Tuttavia, un efficace compromesso tra il costo e l’efficienza si ottiene progettando la struttura degli elettrodi in modo tale che il catalizzatore − per esempio, il platino − risulti in forma finemente dispersa su un opportuno supporto, come, per esempio, carbone a elevato sviluppo superficiale.
La fig. 4 riporta schematicamente una configurazione elettrodica di una cella a combustibile, evidenziando l’interfase che si realizza tra la componente elettrolitica e quelle elettrodiche (strato di diffusione dei gas reagenti e materiale elettrocatalizzatore). Si può notare come il catalizzatore (per es., Pt), ridotto a dimensioni nanometriche, possa essere efficacemente disperso sul substrato di carbone. Con questo artificio morfologico, il carico del metallo prezioso può essere ridotto a livelli molto bassi, vale a dire pochi milligrammi per unità di superficie, tipicamente dell’ordine di 0,5 mg/cm2, con notevoli risparmi di costo dell’intera struttura elettrodica.
Inoltre, poiché i diversi tipi di celle a combustibile operano in un ampio intervallo di temperatura, che va da 100 °C fino a 1000 °C , la scelta del catalizzatore può diversificarsi, passando dal platino per i regimi a bassa temperatura ai meno costosi composti di nickel per le celle ad alta temperatura.
Estremamente importante, per il buon funzionamento di una cella a combustibile, è la prevenzione dalla contaminazione dell’elettrodo con impurezze che potrebbero avvelenare il catalizzatore. Questo aspetto è particolarmente sentito nelle celle alimentate da flussi gassosi ottenuti da processi di cracking o di reforming di composti chimici, come l’alcool o il metano, che forniscono miscele contenenti, oltre all’idrogeno, anche altri componenti gassosi. Tra le sostanze dannose vanno citati i composti solforati e, soprattutto, il monossido di carbonio che, se presente anche solo in tracce, può avvelenare il catalizzatore, rendendone inattivi i siti superficiali. Dato che la forza del legame Pt-CO è maggiore di quella del legame Pt-H, il monossido di carbonio è in grado di legarsi tenacemente al platino, impedendo l’adsorbimento di idrogeno e portando così alla rapida degradazione delle prestazioni della cella.
L’effettivo funzionamento di una cella a combustibile richiede la realizzazione di un insieme elettrodico in grado di catalizzare il processo di ossidazione e/o di riduzione dei reagenti gassosi, assicurando allo stesso tempo il trasporto di elettroni nel circuito esterno e di ioni attraverso l’elettrolita. Per tener conto di questo requisito è necessario progettare opportunamente l’elettrodo, così da assicurare il trasporto dei reagenti gassosi nella zona dove avvengono i processi elettrodici, favorendo contemporaneamente la fuoriuscita dei prodotti. La progettazione di questa zona ‘a tre fasi’ è uno degli aspetti critici nel funzionamento di una cella a combustibile, poiché il gas deve venire in contatto (a) con il substrato solido, per garantire il contatto con il catalizzatore disperso sulla sua superficie in modo da favorire lo svolgersi della reazioni elettrodiche e il contemporaneo trasporto di elettroni nel circuito esterno; (b) con l’elettrolita, per garantire il trasporto di ioni attraverso la cella. A tale proposito, è stata di fondamentale importanza la messa a punto di strutture porose, di carbone o di metallo (comunemente chiamate gas diffusion layers), modellate con una rete di canali tale da assicurare l’efficiente distribuzione del gas entro tutto l’elettrodo e favorire al tempo stesso il contatto tra i componenti delle tre fasi. I substrati di carbone poroso sono realizzati usando quali agenti leganti alcuni additivi plastici come il politetrafluoroetilene, PTFE. Il contatto esterno è assicurato da collettori di corrente costituiti da sottili fili metallici inglobati nella massa elettrodica. Gli elettrodi metallici a struttura porosa sono preparati per sinterizzazione delle relative polveri.
Esistono due configurazioni di cella: monopolare e bipolare. La monopolare viene scelta per la fabbricazione di moduli (stack) disegnati per garantire elevate correnti. In questo caso, i singoli elettrodi sono connessi l’uno all’altro, lungo i propri lati, attraverso dei puntali (tab) che assicurano i contatti esterni. Poiché una raccolta efficiente di corrente richiede un’elevata conducibilità elettronica lungo tutto l’elettrodo, per questa configurazione vengono usati di preferenza elettrodi metallici porosi. La configurazione bipolare viene scelta per lo sviluppo di moduli a elevato potenziale. Gli elettrodi delle singole celle sono connessi in serie; la connessione riguarda, infatti, l’intera superficie di un catodo e quella dell’anodo della cella successiva. In questo caso i materiali più adatti sono quelli a base di carbone poroso i quali, sebbene meno conduttori, assicurano che la corrente che passa attraverso gli elettrodi possa venir raccolta lungo tutta la loro superficie.
Vi sono varie tipologie di celle a combustibile, che differiscono per la temperatura d’esercizio e per il tipo di elettrolita usato. Una classificazione conveniente e comunemente accettata si basa sulla natura dell’elettrolita prescelto. Si possono distinguere, quindi, sei tipi di celle a combustibile: (a) le celle a combustibile alcaline o AFC (Alkaline fuel cell); (b) le celle a combustibile ad acido fosforico o PAFC (Phosphoric acid fuel cell); (c) le celle a combustibile a membrana elettrolitica polimerica o PEMFC (Polymer electrolyte membrane fuel cell); (d) le celle a conversione diretta di metanolo o DMFC (Direct methanol fuel cell); (e) le celle a carbonati fusi o MCFC (Molten carbonate fuel cell); (f ) le celle a ossidi solidi o SOFC (Solid oxide fuel cell) (tab. 1).
Celle a combustibile alcaline (AFC)
Come schematizzato nella fig. 5, una AFC usa un elettrolita costituito da una soluzione concentrata di idrossido di potassio (KOH). Uno dei problemi di questo tipo di cella è legato all’intolleranza dell’elettrolita alcalino verso le impurezze acide, come il biossido di carbonio (CO2), che in un sistema alcalino può formare carbonati che precipitano sui pori degli elettrodi bloccandone così l’attività. Per questo motivo il corretto funzionamento di una cella alcalina richiede l’uso di gas di alimentazione (idrogeno e ossigeno) a elevata purezza. I meriti di un’AFC si ritrovano nel funzionamento a basse temperature, nel potenziale elevato e nella lunga vita operativa. Grazie a queste proprietà, le celle alcaline sono state scelte dalla NASA per applicazioni nelle missioni spaziali, come inizialmente negli anni Sessanta avvenne per il programma Apollo e in seguito per le missioni Shuttle.
Le celle alcaline hanno avuto pieno successo nei programmi spaziali, dove costo e ingombro non rappresentano fattori critici, ma trovano limitate applicazioni in sistemi a terra, a causa di svantaggi intrinseci, come la già citata intolleranza all’aria.
Celle a combustibile ad acido fosforico (PAFC)
La fig. 6 mostra la struttura di una PAFC. Essa si basa su elettrodi di carbone a elevato sviluppo superficiale, con particelle disperse di Pt come catalizzatore, le quali sono tenute insieme da un legante a base di PTFE a contatto con una soluzione elettrolitica di acido fosforico fortemente concentrata e immobilizzata in uno strato poroso di carburo di silicio posto tra gli elettrodi. Il processo elettrochimico globale implica la riduzione dell’ossigeno al catodo, l’ossidazione dell’idrogeno all’anodo e il trasporto di ioni H+ attraverso l’elettrolita (tab. 1). La temperatura d’esercizio è intorno ai 200°C e quindi l’acqua viene prodotta come vapore. Ciò assicura alcuni vantaggi, come il funzionamento con aria a pressione atmosferica e una buona tolleranza alle impurezze, permettendo così l’impiego come combustibile di miscele di gas naturali ottenute da processi di reforming del metano in corrente di vapore:
[9] CH4 + 2H2O → 4H2 + CO2.
Nei sistemi PAFC, come in tutti quelli che utilizzano combustibili da reforming, l’unità di lavoro è costituita, oltre che dalla cella a combustibile, da varie unità in serie tra le quali un processore per il combustibile (per rimuovere le specie contaminanti che avvelenano il catalizzatore, come i composti solforati), un’unità di reforming (dove il combustibile è mescolato al vapore e passando su catalizzatore è scisso in idrogeno e diossido di carbonio, vedi la [9]), scambiatori di calore (per disperdere l’elevato calore prodotto) e, in caso di unità per la produzione stazionaria di energia, anche convertitori di tensione DC-AC
Nonostante questa configurazione a multi unità, le celle ad acido fosforico garantiscono un’elevata efficienza di energia e per questo sono state scelte per lo sviluppo di impianti a elevata potenza per applicazioni stazionarie, come gli impianti di produzione di energia elettrica in case private o in edifici pubblici. Le PAFC sono state anche montate in via dimostrativa su grandi veicoli quali autobus e camion.
Celle a combustibile a membrana elettrolitica polimerica (PEMFC)
È un tipo di cella che riveste un’attenzione particolare per una serie di specifici vantaggi operativi. L’elemento distintivo di una PEMFC è l’elettrolita, costituito da una membrana polimerica a conduzione protonica. La membrana più usata è costituita da Nafion®, polimero dell’acido perfluorosolfonico, che può essere descritto da un’ossatura di Teflon con catene laterali fluorocarboniche, a legame etereo, terminanti nel gruppo solfonico acido, secondo la seguente struttura:
−[(CF2−CF2)x−(CF2−CF)]y−
|
(O−CF2−CF)m−O−(CF2)n−SO−3H+
|
CF3
dove m = 1-3, n = 2, x = 5-13, y = 1000-1200.
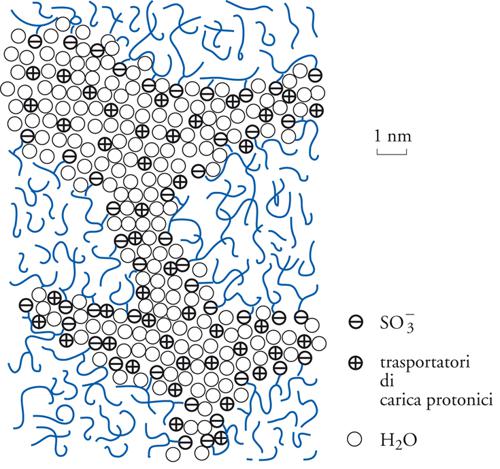
La fig. 7 illustra la microstruttura delle membrane perfluorosolfoniche tipo Nafion® in cui si ha la separazione su scala nanometrica di regioni idrofobiche e idrofiliche. In generale, la conducibilità protonica cresce con il livello d’idratazione del polimero secondo un meccanismo proposto di tipo Grotthus in cui il protone migra attraverso formazioni successive di legami a idrogeno con le molecole d’acqua. Al massimo grado d’idratazione la conducibilità raggiunge 0,1 Scm−1, cioè un valore sufficientemente elevato da permetterne l’uso come separatore in una pila a combustibile senza dare luogo a eccessive cadute di tensione.
Gli aspetti di pregio delle membrane perfluorosolfoniche acide risiedono, da un lato, nell’elevata affinità elettronica dell’atomo di fluoro che, essendo legato allo stesso tempo a un atomo di carbonio e al gruppo SO3−, conferisce elevata acidità e quindi elevata conducibilità al sistema, e, dall’altro, nella grande stabilità dei gruppi CF2 che garantisce la durata operativa. Questi aspetti sono contrastati dal costo elevato e ciò ha portato a un’intensa attività di ricerca e sviluppo mirata alla realizzazione di membrane protoniche alternative, ottenute con differenti processi di sintesi oppure basate su diverse strutture chimiche. Finora, comunque, le membrane tipo Nafion® rappresentano i sistemi elettrolitici preferenziali per le PEMFC.
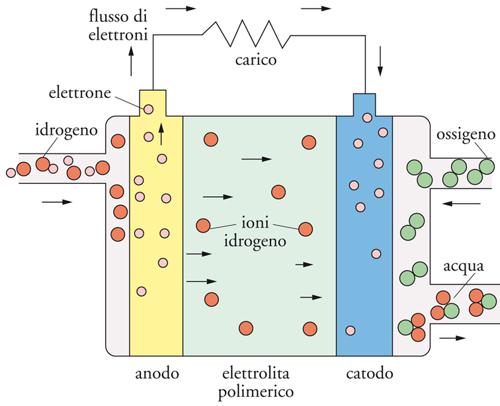
Lo schema di una PEMFC è mostrato nella fig. 8. L’idrogeno è ossidato all’anodo con formazione di protoni, che vengono trasportati attraverso la membrana fino a raggiungere il catodo, dove si combinano con l’ossigeno per formare acqua (tab. 1).
Uno dei fattori chiave nel funzionamento di una PEMFC risiede nell’interfase tra la componente elettrolitica e quella elettrodica, la cosiddetta MEA (Membrane electrode assembly), che deve garantire l’effettivo contatto del catalizzatore con il conduttore elettronico (carbone) e, contemporaneamente, con la membrana a conduzione ionica. Ciò viene ottenuto impregnando prima di tutto la superficie del carbone, che sostiene il catalizzatore, con una soluzione del polimero perfluorosolfonico acido e successivamente, con l’evaporazione del solvente, in modo tale da poter ottenere, alla fine, l’incorporazione della membrana conduttrice all’interno dello strato catalitico attivo in cui i gas, diffusi attraverso uno strato poroso a base di carbone, reagiscono per dar luogo alle reazioni elettrodiche desiderate. Tutto ciò comporta un’estensione della zona a tre fasi, in maniera simile a quanto avviene in celle a elettrolita liquido, consentendo così di ottimizzare al meglio l’azione del catalizzatore.
Considerando che la disidratazione riduce la conducibilità protonica della membrana, mentre un eccesso d’acqua porta all’allagamento degli elettrodi, la corretta gestione del contenuto d’acqua è un aspetto cruciale nella operazione delle PEMFC. A tal fine vengono utilizzati opportuni sistemi di controllo, che includono la rimessa in circolo dell’acqua accumulata al catodo oppure il rifornimento diretto di acqua attraverso gocciolatoi, che connettono la membrana a una riserva esterna, o anche l’umidificazione dei reagenti gassosi.
Il funzionamento efficace di una PEMFC richiede inoltre il controllo della pressione dei gas di alimentazione e della temperatura di operazione, che non deve eccedere i 100°C per non compromettere le proprietà conduttrici della membrana, così come la completa rimozione di impurezze di CO nel combustibile d’ingresso, al fine di prevenire gli effetti di avvelenamento del catalizzatore di platino. Il controllo può richiedere la filtrazione del gas in ingresso attraverso un reattore dove le tracce di CO sono ossidate selettivamente a CO2, oppure la scelta di un catalizzatore più tollerante verso CO.
Le PEMFC sono state inizialmente sviluppate per i programmi spaziali, dove hanno trovato applicazione agli inizi degli anni Sessanta nei voli Gemini della NASA, per essere poi sostituite dalle AFC nelle missioni Apollo e Space Shuttle. In virtù dell’evoluzione della loro struttura e del conseguente miglioramento delle prestazioni, le celle a membrana polimerica stanno assumendo un ruolo chiave nei programmi di sviluppo di veicoli elettrici. Infatti, tra i diversi tipi di celle a combustibile, sono le PEMFC quelle che assicurano le caratteristiche più idonee per applicazioni nel trasporto di autoveicoli, come la bassa temperatura di esercizio e l’uso di un elettrolita chimicamente inerte. Sono previsti allestimenti a bordo formati da celle multiconnesse dirette o ibride, le prime accoppiate a un motore elettrico, le seconde accoppiate a un motore elettrico munito di batteria di riserva. Sulla base di questi concetti, diverse case costruttrici automobilistiche negli Stati Uniti, in Giappone e in Europa stanno realizzando veicoli elettrici dimostrativi alimentati da celle a membrana polimerica.
Celle a combustibile a metanolo diretto (DMFC)
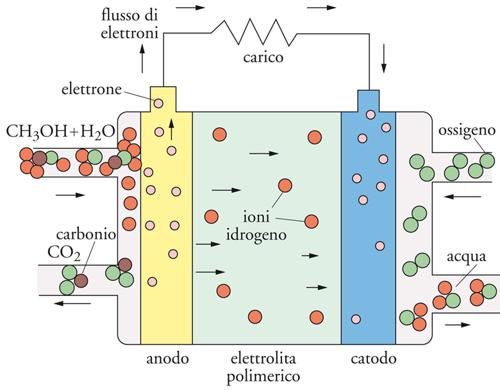
Una caratteristica peculiare di una PEMFC consiste nel poter essere alimentata con metanolo e operare come cella a combustibile a metanolo diretto o DMFC (fig. 9). In questo caso viene a cadere la necessità del reforming del combustibile, dato che il metanolo è direttamente ossidato a diossido di carbonio all’anodo, mentre l’ossigeno è ridotto ad acqua al catodo, secondo il seguente schema di reazione:
anodo: CH3OH + H2O → CO2 + 6H+ + 6e−
[10] catodo: 3/2 O2 + 6H+ + 6e− → 3H2O
totale: CH3OH + 3/2 O2 → CO2 + 2H2O.
I protoni che si formano all’anodo migrano al catodo attraverso la membrana per partecipare alla riduzione dell’ossigeno con formazione di acqua, mentre gli elettroni viaggiano verso il carico nel circuito esterno.
Le DMFC sono particolarmente promettenti per applicazioni nei veicoli elettrici, poiché lavorano a temperature medio-basse e, soprattutto, sono alimentate da metanolo, evitando così la necessità di istallare a bordo un sottosistema di trattamento del combustibile per ottenere idrogeno. Inoltre, il metanolo è un carburante con densità di energia gravimetrica e volumetrica doppia rispetto alla benzina. Tuttavia, lo sviluppo pratico di queste pile è limitato da due importanti fattori operativi. Il primo è legato alla complessità e alla lentezza della reazione di ossidazione del metanolo, con conseguenti perdite significative d’efficienza coulombica. Alcuni progressi in termini di attività elettrocatalitica sono stati recentemente ottenuti con l’uso di leghe catalitiche formate dal 50%Pt-50%Ru. Il secondo fattore è rappresentato dal fatto che il metanolo può passare dall’anodo al catodo attraverso la membrana perfluorosolfonica. Questo inconveniente, comunemente indicato come attraversamento del metanolo (methanol crossover), è causato dal fatto che la membrana è permeabile sia all’acqua che allo stesso metanolo. Il trasporto di quest’ultimo al catodo diminuisce in maniera consistente l’efficienza della cella, a seguito di fenomeni di depolarizzazione degli elettrodi e di perdite di conversione. Per questo motivo, al momento i maggiori sforzi nel campo della ricerca e dello sviluppo delle DMFC sono diretti verso la caratterizzazione di nuovi separatori elettrolitici a membrana, in grado di contrastare il passaggio del metanolo.
Celle a combustibile a carbonati fusi (MCFC)
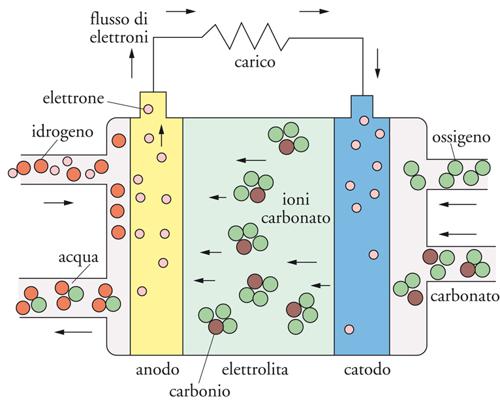
Le MCFC operano a circa 650°C sulla base dei seguenti processi elettrochimici:
anodo: H2 + CO32−→H2O + CO2 + 2e−
[11] catodo: ½ O2 + CO2 + 2e− → CO32−
totale: H2 + ½ O2 → H2O.
Come illustrato nella fig. 10, le specie CO32−, cariche negativamente, sono trasportate attraverso l’elettrolita fuso dal catodo all’anodo e gli elettroni sono trasferiti dall’anodo al catodo attraverso il circuito esterno.
La moderna tecnologia delle MCFC usa anodi porosi Ni-10%Cr, catodi porosi litiati di NiO e una miscela elettrolitica fusa di Li2CO3-K2CO3 (o, alternativamente, Li2CO3-Na2CO3) supportata da una matrice ceramica di γ-LiAlO2. L’idrogeno è prodotto per gassificazione del carbone. Il processo anodico genera CO2, mentre sempre CO2 viene consumato al catodo (tab. 1). Risulta quindi opportuno trasferire il diossido di carbonio dall’anodo al catodo in modo da mantenere costante la composizione dell’elettrolita. Ciò viene ottenuto mescolando parte del gas anodico in uscita con il flusso di gas catodico in entrata.
Il funzionamento di una MCFC è influenzato dalla pressione e dalla temperatura e la sua durata, specialmente nella sua struttura a moduli, è condizionata dai fenomeni di corrosione associati all’ambiente aggressivo dell’elettrolita a carbonati fusi.
Celle a combustibile a ossidi solidi (SOFC)
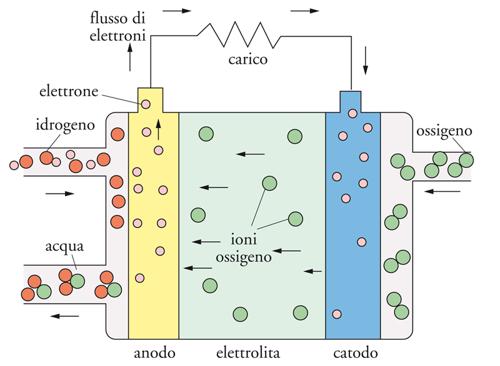
Le SOFC sono dispositivi allo stato solido che lavorano a temperature elevate, ossia intorno a 1000 °C. L’ele-mento chiave di una SOFC è l’elettrolita costituito da un materiale ceramico a base di ossido di zirconio (ZrO2) drogato con 8-10% di ossido di ittrio (Y2O3), indicato con la sigla YSZ (Yttria-stabilized-zirconia). In seguito al drogaggio, alcuni ioni Y3+ sostituiscono lo ione Zr4+ nella struttura tipo fluorite dell’ossido di zirconio, generando un certo numero di siti vacanti per l’ossigeno attraverso i quali gli ioni O2− possono muoversi assicurando così il trasporto ionico. La conducibilità è bassa a temperatura ambiente e richiede un riscaldamento fino a circa 1000 °C per raggiungere valori paragonabili a quelli delle soluzioni liquide, cioè dell’ordine di 0,1 Scm−1.
La struttura di base di una SOFC consiste in due elettrodi porosi separati da uno strato elettrolitico denso di YSZ. L’ossigeno viene rifornito al catodo, dove viene ridotto a ione O2− che migra attraverso l’elettrolita, per raggiungere l’anodo e partecipare all’ossidazione dell’idrogeno di reforming o di una miscela con H2/CO e formare H2O e/o CO2 (fig. 11).
I processi di cella sono:
catodo: O2 + 4e− → 2 O2−
anodo: 2H2 +2 O2− → 2H2O + 4e−
[12] e/o
2CO + 2 O2− → 2CO2 + 4e−
totale: O2 + 2H2 → 2H2O
e/o
2CO + O2 → 2CO2
Gli elettroni fluiscono dall’anodo al catodo attraverso il carico del circuito esterno.
Il potenziale a circuito aperto è più basso di quello di altre celle a combustibile, poiché l’energia libera di formazione dell’acqua diviene meno negativa all’aumentare della temperatura (vedi la [7]). D’altro canto, l’elevata temperatura operativa di una SOFC consente di raggiungere un’elevata efficienza di conversione anche con l’uso di catalizzatori e di materiali elettrodici non eccessivamente costosi. In genere, per il catodo viene impiegato un ossido di lantanio e manganese drogato con elementi alcalini e terre rare, mentre per l’anodo viene usato il nickel. L’elettrolita è preparato in forma di film sottile per mantenere la resistenza della cella entro valori bassi.
Uno dei problemi della SOFC, legato all’elevata temperatura di esercizio, si ritrova nella bassa compatibilità dei componenti dovuta ai loro differenti coefficienti di espansione termica. Inoltre, la temperatura elevata influenza la scelta dei materiali di supporto, così come la geometria della cella. In genere, per i sistemi SOFC vengono scelte due differenti tipologie, tubolare o planare. Nella geometria tubolare, i componenti di cella sono depositati in forma di strati sottili su un catodo a forma di tubo, spesso formato da un film poroso sinterizzato a base di manganite di lantanio drogata con stronzio. L’elettrolita è formato da uno strato di YSZ (depositato elettrochimicamente da fase vapore) e l’anodo è costituito da un film di Ni/YSZ. Nella cella a struttura planare i componenti sono realizzati in forma di lastre sottili e piane. L’elettrolita denso a base di YSZ è preparato o per deposizione su nastro, per sinterizzazione delle polveri, oppure per deposizione chimica da fase vapore, mentre gli elettrodi sono realizzati per stampaggio su lastra oppure mediante vaporizzazione termica.
Per entrambe le tipologie viene preferibilmente adottata la configurazione bipolare, utilizzando generalmente un ossido di cromo e lantanio drogato con magnesio come materiale di interconnessione elettronico. Al momento, alla luce delle loro condizioni operative, le celle a ossido solido appaiono adatte principalmente per impianti localizzati di produzione dell’energia. Tale applicazione è stata sperimentata con successo in Giappone, negli Stati Uniti e in Europa, per la fabbricazione di moduli operativi. Gli obiettivi per pervenire alla commercializzazione delle SOFC rimangono la riduzione dei costi di fabbricazione e la conferma di una vita d’esercizio sufficientemente lunga.
Bibliografia
Brandon 2004: Brandon, Nigel, Fuel cells, in: Encyclopedia of energy, Amsterdam, Elsevier Science, 2004.
Conte 2001: Conte, Mario e altri, Hydrogen economy for asustainable development: state-of-the-art and technologicalperspectives, “Journal of power sources”, 100, 2001, pp.171-187.
Costamagna, Srinivasan 2001: Costamagna, Paola - Srinivasan, Supramanian, Quantum jump in the PEMFC science and technology from the 1960s to the year 2000, Part I. Fundamental scientific aspects; Part II. Engineering, technology development and application aspects, “Journal of power sources”, 102, 2001, pp. 243-270.
Fisher 2000: Fisher, John E., Storing energy in nanotubes, “Chemical innovation”, 30, 2000, pp. 21-27.
Fuller 1997: Fuller, Thomas F., Is a fuel cell in your future?, “Interface”, 6, 1997, pp. 26-39.
Kordesch, Simader 1996: Kordesch, Karl - Simader, Günter, Fuel cells and their applications, Weinheim-Cambridge, VHC, 1996.
Ramanarayanan 2001: Ramanarayanan, Tikur - Singhal, Subhash - Wachsman, Eric D., High temperature ion conducting ceramics, “Interface”, 10, 2001, pp. 22-27.
Ren 2000: Ren, Xiaoming e altri, Recent advances in direct methanol fuel cells at Los Alamos National Laboratory, “Journal of power sources”, 86, 2000, pp. 111-119.
Schlapbach, Züttel 2001: Schlapbach, Louis - Züttel, An-dreas, Hydrogen-storage materials for mobile applications, “Nature”, 414, 2001, pp. 353-358.
Scrosati 2003: Scrosati, Bruno, Celle a combustibile, in:Storia della scienza, IX, La grande scienza, Roma, Istituto della Enciclopedia Italiana, 2003, pp. 303-311.
Wilkinson 1997: Wilkinson, David P., Fuel cells. An electrochemical solution to global climate change in the 21st century, “Interface”, 10, 1997, pp. 22-25.