Cellula. Comunicazione inter- e intracellulare
Cellula. Comunicazione inter- e intracellulare
Si calcola che tra la comparsa dei primi organismi unicellulari e la successiva affermazione degli organismi pluricellulari siano intercorsi 2 miliardi di anni e che questo tempo sia servito in gran parte per promuovere l'evoluzione di meccanismi di comunicazione che permettono di coordinare l'azione delle singole cellule di un individuo. La comunicazione intercellulare avviene sia attraverso l'interazione diretta tra cellule sia attraverso segnali, che vengono prodotti in una parte dell'organismo e influenzano il comportamento di cellule bersaglio in altri distretti. Le singole cellule di un organismo superiore sono così dipendenti dai segnali provenienti da altre cellule che, in loro assenza, non sono in grado di sopravvivere. Questo accade perché, in mancanza di diretta interazione cellula-cellula o in assenza di segnali quali fattori di crescita, le cellule attivano un processo di morte cellulare programmata detto 'apoptosi'.
Le cellule di un animale complesso dipendono da specifici segnali provenienti dall'esterno persino per potersi nutrire; infatti l'espressione sulla superficie cellulare dei trasportatori per nutrienti, quali amminoacidi, glucosio, ecc., è regolata dall'azione di fattori di crescita. Quindi, anche quando il processo di morte programmata è inibito, per esempio tramite la delezione di geni necessari per l'apoptosi, le cellule private di fattori di crescita vanno incontro a una progressiva atrofia dovuta a deficit energetico, anche se sostanze nutritive sono presenti nel mezzo che le circonda.
Una prima distinzione tra i meccanismi di comunicazione cellulare può essere fatta in base alle proprietà chimiche delle molecole responsabili di portare il messaggio. Se si tratta di molecole solubili in ambiente acquoso, quali fattori di crescita, peptidi e trasmettitori, questi non possono attraversare la membrana citoplasmatica e il primo componente del sistema di trasduzione è costituito da un recettore di superficie che lega il segnale con la sua porzione extracellulare e in vari modi inizia una cascata di eventi all'interno della cellula. Nella maggioranza dei casi il bersaglio finale della trasduzione del segnale è la regolazione dell'espressione genica e/o l'induzione della divisione cellulare e/o la morte cellulare per apoptosi o necrosi. Se al contrario il messaggero chimico è liposolubile, come nel caso degli ormoni steroidei, esso è in grado di attraversare la membrana cellulare e di legarsi a un recettore citoplasmatico. In genere recettori di questo tipo sono anche regolatori della trascrizione e in seguito al legame con il loro ligante traslocano nel nucleo dove modulano l'espressione genica. Nel caso degli ormoni liposolubili, quindi, la trasduzione del segnale è più diretta.
Una volta che il segnale proveniente dall'esterno è stato riconosciuto dalla cellula bersaglio attraverso l'attivazione di uno o più recettori, questo deve essere interpretato in maniera corretta in modo da indurre la risposta intracellulare appropriata. Per trasduzione del segnale, o comunicazione intracellulare, si intende l'insieme dei meccanismi molecolari che sono in grado di generare una specifica risposta a un segnale extracellulare. In senso stretto si considera che la trasduzione del segnale si riferisca a un messaggero che ha un significato specifico come possono essere un fattore di crescita o una citochina che portano un'istruzione alla cellula bersaglio. In senso lato si parla di trasduzione del segnale anche quando cellule specializzate rispondono a stimoli esterni quali, per esempio, la luce o la pressione.
La comunicazione attraverso recettori con attività di tirosina-chinasi
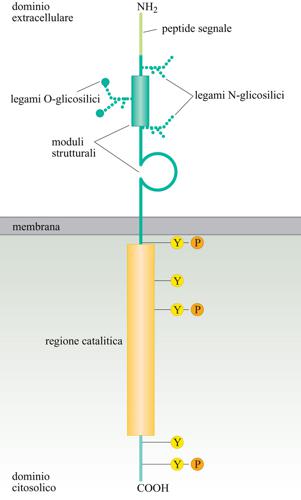
Un gran numero di fattori che controllano processi quali metabolismo cellulare, proliferazione, differenziamento, sopravvivenza e migrazione agiscono attraverso recettori dotati di attività di tirosina-chinasi, RTK (fig.). In genere, inoltre, co-recettori partecipano al riconoscimento del ligante e possono contribuire alla trasduzione del segnale attraverso meccanismi differenti dalla fosforilazione in tirosina. Il tipico recettore RTK ha un dominio extracellulare responsabile del riconoscimento del ligante, una singola elica che attraversa la membrana citoplasmatica, e un dominio intracellulare dotato di attività chinasica. Il dominio intracellulare contiene addizionali sequenze che esercitano un'azione di regolazione sull'attività enzimatica e sono anche substrato per l'autofosforilazione o per la fosforilazione da parte di altre chinasi. Una variazione sul tema è rappresentata da recettori che non possiedono un'attività intrinseca di tirosina-chinasi, ma sono costitutivamente associati, tramite il loro dominio intracellulare, con tirosine-chinasi citoplasmatiche. Liganti per i recettori RTK possono essere fattori solubili quali l'insulina, le neurotrofine o altri fattori di crescita, oppure possono essere proteine ancorate sulla superficie di cellule adiacenti come le eferine che, attivando i recettori EPH, controllano processi quali la migrazione cellulare e la crescita degli assoni.
La segnalazione attraverso i recettori RTK procede secondo il seguente schema: i liganti inducono la dimerizzazione/oligomerizzazione di RTK (o stabilizzano dimeri/oligomeri preesistenti) e in questo modo favoriscono la fosforilazione reciproca delle porzioni intracellulari degli stessi recettori RTK. Tirosine fosforilate presenti nella porzione citoplasmatica dei recettori, funzionano da siti di legame per proteine contenenti specifiche sequenze dette SH2 (Src homology 2) o PTB (Phosphotyrosine binding). L'affinità di questo legame dipende dagli amminoacidi che circondano le singole tirosine fosforilate e cioè, in ultima analisi, dalla sequenza dei recettori RTK. In altre parole i recettori RTK funzionano come una piattaforma per l'assemblaggio di un complesso multiproteico. Proteine con domini SH2 o PTB possono essere dotate di attività enzimatica esse stesse o possono funzionare da adattatori reclutando, tramite interazioni proteina-proteina, ulteriori trasduttori del segnale. Tra le proteine contenenti gruppi SH2 vi sono inoltre tirosine-fosfastasi che, rimuovendo i gruppi fosfato dalle tirosine dei recettori RTK, forniscono un meccanismo di feedback negativo. Tre sono le principali vie attivate a valle dei recettori RTK: (a) la produzione di metaboliti dei fosfolipidi che direttamente o indirettamente, regolando la concentrazione locale di ioni calcio, propagano il segnale attraverso l'attivazione di serine/treonine-chinasi; (b) l'attivazione del proto-oncogene Ras e la conseguente stimolazione della cascata delle MAP-chinasi; (c) la fosforilazione di fattori di trascrizione e la loro rilocalizzazione nel nucleo della cellula. L'attivazione della prima via generalmente porta alla produzione di un segnale di sopravvivenza cellulare che dipende principalmente dall'attivazione di una serina/treonina-chinasi chiamata Akt o PKB. Akt controlla due vie funzionalmente ridondanti per l'inibizione della morte cellulare programmata. Da una parte Akt fosforila, e inattiva, il fattore proapoptotico BAD, dall'altra parte Akt fosforila il fattore di trascrizione FKHR1, promuovendo la sua ritenzione nel citoplasma e quindi impedendo la sua traslocazione nel nucleo. In questo modo Akt previene la trascrizione di geni proapoptotici che sono trascrizionalmente indotti da FKHR1. L'attivazione di Ras generalmente porta a un segnale di proliferazione o di differenziamento. In breve Ras è il membro più noto di una famiglia di proteine, chiamate 'le piccole proteine G' o 'piccole GTPasi'.
Queste proteine esistono in due diverse conformazioni: una attiva, che lega il GTP, e una inattiva, che lega il GDP; inoltre esse hanno un'intrinseca, seppur blanda, attività di GTPasi, cioè la capacità di idrolizzare il GTP a GDP. I recettori RTK sono in grado di attivare Ras reclutando fattori che favoriscono il suo legame con il GTP. Una volta attivato, Ras, che è legato alla membrana citoplasmatica, a sua volta recluta una chinasi della famiglia di Raf; queste chinasi, come precedentemente accennato, agiscono come MEKK. Una volta in membrana Raf viene a sua volta attivato e così si instaura la cascata delle MAP-chinasi. L'attivazione di questo modulo di trasduzione del segnale risulta, tra l'altro, nella traslocazione della MAPK/ERK nel nucleo con conseguente modulazione della trascrizione di geni importanti per la proliferazione cellulare o per il differenziamento. La terza via di segnalazione, la traslocazione di fattori di trascrizione nel nucleo, è stata studiata principalmente nel caso delle citochine, che agiscono attivando tirosine-chinasi legate alla porzione citoplasmatica dei loro recettori. Questa via è comunque essenziale anche per la segnalazione da parte dei recettori con tirosina-chinasi intrinseca. In breve il legame di citochine ai propri recettori attiva delle tirosine-chinasi che fosforilano proteine associate ai recettori chiamate STAT (Signal transducer and activator of transcription). Le STAT contengono un dominio SH2 che interagendo con una fosfotirosina inducono l'omo- o l'eterodimerizzazione delle STAT con conseguente traslocazione nel nucleo dove si legano a sequenze specifiche del DNA e regolano la trascrizione. Tra i meccanismi che forniscono un feedback negativo all'attivazione dei recettori RTK e contribuiscono a limitarne la segnalazione vi sono, oltre al reclutamento di tirosine-fosfatasi precedentemente menzionato, fosforilazioni inibitorie da parte di serina/treonina-chinasi attivate da RTK ed endocitosi e degradazione dei recettori RTK mediate da proteine con gruppi SH2.
L'adesione cellulare come meccanismo di comunicazione
L'adesione tra le cellule di un tessuto non ha soltanto una funzione strutturale, ma regola anche una serie di risposte cellulari, dalla migrazione alla proliferazione, dall'apoptosi al differenziamento. Tra le famiglie di proteine che mediano l'adesione tra cellule, le caderine sono probabilmente quelle studiate più approfonditamente (il nome 'caderine' deriva dal fatto che queste proteine regolano l'adesione in modo dipendente dal calcio extracellulare). Le caderine hanno un dominio extracellulare responsabile per il legame omofilico tra caderine espresse su cellule adiacenti, un singolo dominio transmembrana e un dominio intracellulare. Alla superfamiglia appartengono diverse sottofamiglie tra cui le principali sono: le E-caderine (Epithelial cadherins) che controllano la polarità dei tessuti epiteliali, le VE-caderine (Vascular endotelial cadherins) che regolano la formazione di giunzioni tra le cellule endoteliali che rivestono le pareti dei vasi sanguigni, e le N-caderine (Neuronal cadherins) che contribuiscono alla formazione e stabilizzazione di giunzioni sinaptiche.
Le caderine organizzano due tipi di complessi: le giunzioni di adesione AJ (Adherens junction) e i desmosomi, mentre altre proteine transmembrana, le occludine, le claudine e le JAM (Junctional adhesion molecules) organizzano un terzo tipo di giunzione tra cellule, le giunzioni occludenti (TJ, Tight junctions). In ogni caso le giunzioni di adesione tra cellule sono organizzate con una simile architettura: il dominio intracellulare delle proteine di adesione recluta una serie di scaffolding proteins e in questo modo organizza un grosso complesso multiproteico comprendente: (a) molecole che interagiscono con i componenti del citoscheletro (filamenti di actina o filamenti intermedi) e che regolano le proprietà meccaniche dei contatti intercellulari; (b) proteine della trasduzione del segnale quali chinasi, fosfatasi, ecc.; (c) fattori in grado di legare il DNA e regolare la trascrizione. La comunicazione intracellulare delle giunzioni di adesione quindi procede attraverso almeno due meccanismi distinti: o attraverso gli stessi trasduttori del segnale utilizzati da RTK, o trattenendo legati al di fuori del nucleo fattori trascrizionali e in questo modo inibendo la loro attività. Spesso le giunzioni di adesione reclutano RTK e ne regolano l'attività. Per fare un esempio, la VE-caderina lega il VEGFR2 che è un recettore RTK per un fattore di crescita delle cellule endoteliali, il VEGF (Vascular endothelial growth factor). In presenza di quest'ultimo il VEGFR2 induce proliferazione cellulare e resistenza a segnali apoptotici. Le cellule endoteliali di un vaso sanguigno maturo, da un canto necessitano di segnali antiapoptotici, ma d'altro canto sono cellule postmitotiche, cioè cellule che non proliferano. Reclutando tirosine-fosfatasi in grado di defosforilare specifiche tirosine nella porzione intracellulare del VEGFR2, le AJ di cellule endoteliali sono in grado di prevenire una segnalazione proliferativa da parte del VEGF, mantenendo intatta la via che attraverso l'attivazione di Akt promuove la resistenza all'apoptosi. In maniera analoga la E-caderina lega e modula la funzione del recettore per l'EGF (Epidermal growth factor), e la N-caderina lega e modula la funzione del recettore per l'FGF (Fibroblast growth factor).
La segnalazione delle AJ attraverso la ritenzione di fattori trascrizionali rappresenta il punto di incontro con la segnalazione da parte di una distinta famiglia di fattori di crescita che regolano la proliferazione e la capacità di rinnovamento delle cellule staminali, la famiglia Wnt. Entrambe le vie di segnalazione, infatti, convergono su una proteina, la β-catenina. Questa proteina ha una doppia attività: una prima funzione è quella di regolare le giunzioni di adesione interagendo direttamente con la porzione citoplasmatica delle caderine e formare un ponte con il citoscheletro di actina attraverso l'interazione con un'altra proteina detta α-catenina. In secondo luogo la β-catenina regola l'espressione genica in quanto si lega a un fattore nucleare chiamato TCF/LEF e cambia la sua funzione da repressore ad attivatore della trascrizione. Geni indotti dal complesso β-catenina-TCF/LEF codificano per proteine che promuovono la proliferazione cellulare. In cellule quiescenti il livello di β-catenina libera nel citoplasma è mantenuto basso in quanto quelle molecole di β-catenina che non sono legate alle caderine sono costitutivamente degradate. La segnalazione da parte dei fattori Wnt inibisce la degradazione della β-catenina. La quantità di β-catenina disponibile per l'interazione con TCF/LEF dipende quindi sia dalla segnalazione di Wnt sia dalla integrità delle giunzioni di aderenza. Un ulteriore elemento di dialogo tra diversi meccanismi di comunicazione cellulare deriva dal fatto che RTK, e tirosine-chinasi in genere, fosforilando opportuni residui nella porzione citoplasmatica delle caderine, indeboliscono il legame tra queste ultime e la β-catenina; per di più RTK attivati possono inibire l'espressione delle caderine, aumentando la percentuale di β-catenina disponibile per partecipare alla segnalazione di Wnt.
Recettori a sette domini transmembrana
La famiglia di recettori più numerosa in assoluto è costituita dalle proteine con sette domini transmembrana, ovvero i recettori 7TM. Questa famiglia codifica per oltre 1000 membri distinti capaci di legare una gran varietà di liganti comprendenti neurotrasmettitori, peptidi, ormoni, oppioidi, lipidi, ecc. Esistono inoltre circa 200 recettori 'orfani' identificati come 7TM per omologia di sequenza, ma di cui non si conosce il ligante. Proteine 7TM sono anche i recettori nel sistema olfattorio e sono attivati dalla luce nel sistema visivo. Considerando l'ampio spettro di risposte mediate dai recettori 7TM, non sorprende che circa il 50% di tutti i farmaci esistenti siano diretti a regolare la loro trasduzione del segnale. I recettori 7TM sono anche chiamati GPCRs (G-protein-coupled receptors), in quanto segnalano attraverso l'attivazione di una classe di proteine chiamate proteine G eterotrimeriche, composte da tre distinte subunità α, β, γ. Nel genoma umano, esistono almeno 16 geni diversi che codificano per le subunità α, 5 per la β e 12 per la γ. Sono quindi in teoria possibili 16×5×12=960 distinte proteine G. Non è noto, però, se tutte le possibili combinazioni tra le tre subunità siano effettivamente espresse. La subunità α è una GTPasi, in grado di legare il GTP e idrolizzarlo a GDP. Il meccanismo classico di segnalazione dei recettori 7TM è il seguente: il recettore attivato interagisce con una proteina G e promuove lo scambio del GDP legato alla subunità α con il GTP→ il complesso si dissocia in un monomero α e un dimero βγ ed entrambi sono in grado di interagire con una serie di effettori quali enzimi (adenilato-ciclasi, fosfolipasi, fosfodiesterasi, tirosine-chinasi), canali ionici, attivatori di piccole proteine G della famiglia di Ras, ecc.→ l'attività di GTPasi della subunità α idrolizza il GTP a GDP con conseguente riassociazione del complesso α β γ e terminazione della segnalazione. Negli anni più recenti si è dimostrato che alcuni recettori 7TM possono interagire direttamente con una serie di trasduttori del segnale ‒ quali, per esempio, le tirosine-chinasi ‒ e di conseguenza possono fornire segnali indipendentemente dalle proteine G. Questi recettori rappresentano una esemplificazione di come, attivando più moduli di trasduzione del segnale, sia possibile ottenere una maggiore diversificazione e specificità della risposta cellulare. Infatti risposte biologiche differenti saranno evocate da due recettori 7TM distinti, entrambi interagenti con una stessa G che attiva l'adenilato-ciclasi, ma di cui uno solo è in grado di attivare contemporaneamente anche la tirosina-chinasi Src.
La segnalazione attraverso i recettori 7TM è generalmente utilizzata in situazioni in cui la risposta cellulare deve essere rapida (il caso estremo è la risposta a un segnale luminoso) e rapidamente reversibile. La velocità della trasduzione del segnale è spesso assicurata dall'interazione dei recettori con proteine scaffolding che portano in prossimità gli effettori. Per esempio, nel sistema visivo della Drosophila, una proteina scaffolding tiene insieme la rodopsina (recettore 7TM per la luce), una proteina G, la fosfolipasi C, un canale del calcio e la proteina-chinasi C. Quest'ultima risponde rapidamente al segnale perché i suoi attivatori, lo ione calcio e i metaboliti della fosfolipasi C, sono prodotti localmente.
Vari meccanismi molecolari forniscono feedback negativi alla segnalazione dei recettori 7TM e contribuiscono a terminare il segnale. In primo luogo la fosforilazione dei recettori da parte di proteine-chinasi che agiscono a valle dei recettori stessi, modula la capacità di interagire con proteine G. A questo riguardo un ulteriore meccanismo di complessità è dovuto al fatto che recettori 7TM sono soggetti a fosforilazione sia da parte di chinasi ancorate ai recettori attraverso proteine scaffolding (e in questo caso solo i recettori attivati subiscono il feedback negativo) sia da chinasi libere di interagire con diversi substrati (e in questo caso l'attivazione di un recettore può portare alla fosforilazione di un recettore diverso con conseguente regolazione incrociata dei segnali). Un secondo meccanismo di feedback negativo è fornito da proteine, se ne conoscono almeno venticinque distinte, che promuovono l'attività GTPasica delle proteine G e in tal modo contribuiscono a terminare il segnale più rapidamente. Infine recettori attivati possono essere rimossi dalla superficie cellulare attraverso processi di internalizzazione e essere successivamente degradati.
Seppure in modo frammentario la nostra conoscenza dei meccanismi di comunicazione cellulare ha fatto notevoli progressi negli ultimi tempi anche grazie allo sviluppo di nuovi approcci sperimentali. Il grande interesse che questo tipo di studi ha suscitato è in parte dovuto alla speranza che una farmacologia razionale, basata sulla conoscenza delle basi molecolari della comunicazione cellulare, possa portare a cure innovative per numerose patologie. Alcuni aspetti della nostra conoscenza sull'argomento sono tuttavia particolarmente carenti e rappresentano una sfida per studi futuri. In primo luogo, in contrasto con la relativa facilità di un'analisi genetica o biochimica, sono a tutt'oggi pochi i metodi e gli strumenti che permettono un'analisi cinetica della trasduzione del segnale in vivo. Per fare un esempio, generalmente si pensa che la frequenza con cui un recettore è attivato/deattivato sia importante nella segnalazione. Tuttavia mancano al presente solidi dati sperimentali e modelli concettuali a sostegno di tale ipotesi. In secondo luogo la comunicazione cellulare, come ogni altro problema biologico, può dirsi conosciuta a fondo solo quando siano state comprese le basi evolutive delle sue caratteristiche attuali. Un'interessante ipotesi presentata più di un quarto di secolo fa e chiamata il 'codice metabolico' proponeva che trasduttori della comunicazione cellulare fossero originariamente prodotti di reazioni enzimatiche che avessero assunto il ruolo di regolatori della espressione degli stessi enzimi che li producono. Approcci innovativi saranno necessari per investigare ipotesi di questo tipo o altre che forniscano una spiegazione evolutiva della comunicazione tra cellule.
Bibliografia
Kitano 2004: Kitano, Hiroaki, Biological robustness, "Nature reviews. Genetics", 5, 2004, pp. 826-837.
Papin 2005: Papin, Jason A. e altri, Reconstruction of cellular signalling networks and analysis of their properties, "Nature reviews. Molecular cell biology", 6, 2005, pp. 99-111.
Pierce 2002: Pierce, Kimberly L. - Premont, Richard T. - Lefkowitz, Robert J., Seven-transmembrane receptors, "Nature reviews. Molecular cell biology", 3, 2002, pp. 639-650.
Schlessinger 2000: Schlessinger, Joseph, Cell signaling by receptor tyrosine kinases, "Cell", 103, 2000, pp. 211-225.
Stelling 2004: Stelling, Jörg e altri, Robustness of cellular functions, "Cell", 118, 2004, pp. 675-685.
Tomkins 1975: Tomkins, Gordon M., The metabolic code, "Science", 189, 1975, pp. 760-763.
Venter 2001: Venter, Craig J. e altri, The sequence of the human genome, "Science", 291, 2001, pp. 1304-1351.