staminale, cellula
staminale, cellula
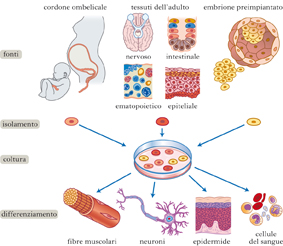
Cellula indifferenziata che può agire da precursore di un clone di cellule differenziate, ma che mantiene la capacità di autorinnovarsi per produrre altre cellule s. identiche. Le cellule s. sono caratterizzate dalla capacità di dividersi indefinitamente e di dare origine a una grande varietà di tipi cellulari specializzati (divisione asimmetrica); possono essere distinte in due categorie principali: le cellule s. embrionali o ESC (Embryonic Stem Cells), e le cellule s. adulte.
ESC
Sono cellule embrionali in grado di espandersi indefinitamente e pluripotenti, ossia il loro sviluppo può dare origine a linee cellulari specializzate, rappresentative dei tessuti provenienti da tutti e tre i foglietti embrionali (ectoderma, mesoderma ed endoderma). Questo processo può essere indotto in vitro in presenza di fattori fisici e biologici. Le ESC si ottengono principalmente estraendo cellule dalla massa interna di embrioni ai primi stadi dello sviluppo (blastocisti); le cellule isolate vengono poi coltivate e differenziate in laboratorio. Le ESC più studiate sono quelle di topo, derivate per la prima volta nel 1981. Esse possono essere coltivate indefinitamente, e se vengono iniettate in una blastocisti si integrano nell’embrione dando origine, durante lo sviluppo, a quasi tutti i tipi di tessuto; pertanto vengono considerate pluripotenti. Se vengono impiantate in un topo adulto, esse sviluppano un tumore detto teratoma, contenente una varietà di tipi tissutali differenziati. Le ESC di topo vengono correntemente usate per creare topi geneticamente modificati da utilizzare come modelli di malattie umane. Nel 1998 vennero isolate le prime linee di ESC umane, anch’esse pluripotenti e in grado di formare una grande varietà di linee differenziate in vitro, e pertanto considerate una possibile fonte di cellule differenziate per la terapia rigenerativa di malattie quali il Parkinson o il diabete. L’uso di ESC umane pone problemi etici in quanto la procedura per ottenerle implica la distruzione della blastocisti embrionale.
Cellule staminali adulte
Le cellule s. adulte, dette anche somatiche o tessuto-specifiche, sono considerate multipotenti in quanto possono dare origine solo ad alcuni tipi cellulari, con diversi gradi di potenzialità; ogni tipo di cellula s. adulta infatti produce un insieme limitato di cellule specializzate caratteristiche di un particolare tessuto. Nell’adulto, le cellule s. si trovano in tutti gli organi, in numero molto piccolo, situate in sedi specifiche, dette nicchie. In alcuni casi esse possono rimanere quiescenti (cioè non dividersi) per molti anni, per poi essere attivate da una malattia o da una lesione, mentre in altri casi sono regolarmente attive, quando ad es. ci sia necessità di sostituire frequentemente le cellule, come avviene per le cellule epiteliali della pelle e dell’intestino. Le cellule s. adulte più facili da isolare sono le cellule s. ematopoietiche, che derivano principalmente dal midollo osseo e, in minore quantità, anche dal sangue periferico e dal sangue del cordone ombelicale; esse danno origine a tutti i diversi tipi di cellule del sangue e del sistema immunitario, e da decenni sono utilizzate nella terapia delle malattie ematologiche (ad es., nei trapianti di midollo osseo per la cura delle leucemie). Gli altri tipi di cellule s. adulte sono più difficili da isolare e coltivare; in genere vengono denominate come il tessuto di origine (cellule s. mesenchimali, endoteliali, del tessuto adiposo, ecc.).
Trapianto di cellule staminali ematopoietiche
L’infusione, per via endovenosa, di cellule staminali ematopoietiche identificate dall’espressione dell’antigene di superficie CD34 è una procedura impiegata nella cura di diverse patologie oncologiche e non oncologiche, come la talassemia, l’anemia aplastica e alcuni disordini autoimmuni. Possono essere utilizzati progenitori ematopoietici autologhi o allogenici, derivanti rispettivamente dal paziente stesso oppure da donatore sano.
Trapianto autologo
Nel trapianto autologo vengono reinfuse cellule staminali prelevate dallo stesso paziente. Viene impiegato per la cura di neoplasie ematologiche e di alcuni tumori solidi, permettendo al paziente di ricevere dosaggi terapeutici altrimenti non tollerabili dal sistema ematopoietico, che viene rigenerato dalle stesse cellule staminali precedentemente raccolte e criopreservate. Le cellule staminali sono raccolte dal midollo osseo o dal sangue periferico dopo un programma di terapia, atto a indurre la remissione clinica del tumore; tali cellule sono criopreservate a −190 °C. Il paziente viene poi sottoposto a un ulteriore trattamento ad alte dosi e successiva reinfusione delle cellule staminali. I limiti sono legati alla possibilità che nella raccolta possano essere presenti cellule patologiche e al rischio di una ripresa di malattia perché manca l’azione immunomediata di controllo sul tumore.
Trapianto allogenico
Il trapianto allogenico è basato sull’infusione di cellule staminali provenienti da un donatore sano. Per verificare la compatibilità tra il ricevente e il donatore si effettua una tipizzazione HLA (Human Leukocyte Antigens), che studia gli antigeni di istocompatibilità di classe I e II del ricevente e del donatore per verificarne il grado di compatibilità. I donatori sono preferibilmente fratelli o sorelle del paziente, oppure possono essere identificati tra individui non familiari (MUD, Mismatch Unrelated Donor) attraverso le banche di donatori o di cordone ombelicale. Prima dell’infusione, si esegue un trattamento chemio-radioterapico (regime di condizionamento) che consente di distruggere il maggior numero possibile di cellule neoplastiche e di inibire la risposta immunitaria che potrebbe impedire l’attecchimento delle cellule staminali del donatore. Dopo il trapianto, viene instaurata una terapia immunosoppressiva per impedire la cosiddetta GVHD (Graft Versus Host Disease), complicanza frequente di cui si riconoscono due tipi: una GVHD acuta, che compare normalmente nei primi 100 giorni dal trapianto, con gravità variabile e danno a carico soprattutto di cute, fegato e tratto gastroenterico e una GVHD cronica, che si manifesta dal 3° mese con un quadro clinico simile alle patologie autoimmuni. Altre complicanze includono le infezioni e, raramente, il rigetto.Il trapianto allogenico è usato nel trattamento dei tumori ematologici (leucemia acuta mieloide e linfoide e, meno frequentemente, mieloma multiplo e leucemia linfatica cronica) e di alcune condizioni non oncologiche (le aplasie midollari e le talassemie) con un regime di condizionamento è a intensità ridotta, poiché la chemioterapia potrebbe indurre tossicità elevata. Il fine del trapianto allogenico è la cura definitiva della malattia: nei pazienti con neoplasie ematologiche, attraverso la rigenerazione del sistema ematopoietico e l’attività antitumorale esercitata dai linfociti T del donatore; nei pazienti non oncologici, attraverso la correzione del difetto dei progenitori ematopoietici del paziente con le cellule staminali del donatore. I limiti sono rappresentati dalla difficoltà di trovare un donatore compatibile e dalla tossicità della procedura stessa, associata a importanti effetti collaterali e a un rischio variabile di mortalità. Attualmente le procedure allotrapiantologiche per pazienti con neoplasie ematologiche sono in aumento, grazie all’allargamento delle banche di donatori e di cordone ombelicale, ai regimi di condizionamento a ridotta tossicità che consentono di trapiantare pazienti meno giovani e con comorbidità, e alla possibilità di effettuare anche trapianti solo parzialmente compatibili.
Sorgenti di cellule staminali: il midollo osseo
Il prelievo viene effettuato dalle creste iliache posteriori ed è ripetuto fino a ottenere un numero congruo di cellule. Le cellule possono essere direttamente reinfuse o congelate. La raccolta di cellule staminali dal midollo osseo è stata la prima procedura impiegata poiché il midollo osseo è la sede fisiologica ematopoietica. Queste cellule possono essere impiegate per trapianti sia allogenici che autologhi.
Sorgenti di cellule staminali: il sangue periferico
Le cellule staminali vengono messe in circolo dopo stimolazione per diversi giorni con un fattore di crescita granulocitario (G-CSF) e successivamente prelevate attraverso leucoaferesi. Possono essere impiegate per trapianti sia allogenici che autologhi.
Sorgenti di cellule staminali: il cordone ombelicale
Il sangue di cordone ombelicale è ricco di cellule staminali. Le cellule vengono raccolte dalla vena ombelicale dopo l’espulsione della placenta: non vi è alcun rischio per la madre e per il bambino. Il sangue di cordone ombelicale deve essere sottoposto a diversi test, tra cui quelli virologici. Le cellule staminali del cordone sono, rispetto alle altre cellule staminali, più immature e possono dare minori problemi di rigetto da parte del ricevente. Il limite principale è dato dal numero di cellule che si possono raccogliere: conseguentemente, l’impiego delle cellule staminali cordonali è spesso possibile solo per i bambini, o comunque per pazienti di peso contenuto, dove è mantenuto un buon rapporto tra peso corporeo del ricevente e numero di cellule infuse. Per renderne possibile l’impiego anche negli adulti e nei pazienti di peso più elevato, si stanno mettendo a punto metodiche di trapianto di due o più unità cordonali contemporaneamente, oppure di espansione dei progenitori ematopoietici. Le cellule di cordone sono impiegate esclusivamente per trapianti allogenici.
Sabina Chiaretti
Roberto Foà