cellule staminali neurali
cellule staminali neurali
Popolazione di cellule multipotenti presenti nell’embrione, capaci di autorinnovarsi e di generare i tre principali tipi di cellule che costituiscono il cervello adulto (neuroni, astrociti e oligodendrociti). Il cervello adulto ha una enorme diversità cellulare, costituita, per la sola componente neuronale, da circa 10.000 tipi di neuroni funzionalmente differenti. Le c. s. n. sono quindi dotate della ragguardevole capacita di generare, in modo coordinato, un repertorio di cellule estremamente diversificato, attraverso una serie di cellule intermedie, con una potenzialità e una capacita di autorinnovamento progressivamente più limitate (precursori/progenitori neuronali e gliali), fino a esaurimento della propria capacità mitotica. L’equilibrio tra il numero e la tempistica delle divisioni simmetriche (con aumento della popolazione staminale) rispetto alle divisioni asimmetriche (generazione di una cellula staminale e di un progenitore multipotente) regola il numero di cellule staminali e l’omeostasi del tessuto nervoso.
Cellule staminali neurali nella neurogenesi
Durante la neurogenesi (➔) embrionale dei mammiferi, i progenitori neuroepiteliali del tubo neurale costituiscono le prime c. s. n., responsabili dell’iniziale onda di neurogenesi, e danno poi origine alla glia radiale (RG, Radial Glia), il principale tipo cellulare staminale nel sistema nervoso in via di sviluppo (➔ cervello, sviluppo del). Le cellule staminali della glia radiale hanno la duplice funzione di progenitori neurali e di impalcatura, lungo cui migrano radialmente i neonati neuroblasti postmitotici, verso i siti di destinazione. Al termine della neurogenesi, le cellule RG perdono la capacità di generare neuroni (tranne che nelle zone neurogeniche adulte) e diventano esclusivamente gliogeniche, generando gli astrociti del parenchima cerebrale adulto.
Cellule staminali neurali nel cervello adulto
Le c. s. n. sono anche presenti in alcune zone del cervello adulto. Fino a non molti anni fa si riteneva che il patrimonio di neuroni del cervello adulto fosse essenzialmente quello originato durante lo sviluppo. Studi effettuati in diverse specie di vertebrati non mammiferi (teleostei e uccelli canori) hanno evidenziato la capacità del sistema nervoso adulto di produrre nuovi neuroni e di integrarli in circuiti funzionali, ma solo nel corso degli ultimi quindici anni si è dimostrato che anche nel cervello dei mammiferi adulti (incluso l’uomo) si riscontra una costante produzione di nuove cellule nervose. La neurogenesi adulta è limitata a due specifiche zone del cervello stesso: la zona subventricolare (SVZ, SubVentricular Zone) dei ventricoli laterali e la zona subgranulare (SGZ, SubGranular Zone) dell’ippocampo. I neuroni nati nella SVZ adulta migrano a lunga distanza, per diventare interneuroni granulari e perigranulari del bulbo olfattivo, mentre i neuroni nati nella SGZ adulta diventano cellule dei granuli del giro dentato dell’ippocampo. Almeno parte degli interneuroni neoformati sfugge alla morte e si integra in circuiti sinaptici preesistenti. Si valuta che, nei roditori, nell’arco di un mese vengano aggiunti circa 250.000 nuovi neuroni al giro dentato (il 6% del numero totale delle cellule nervose di quest’area). Nonostante il significato funzionale della neurogenesi adulta resti ancora incerto, vi è un grande interesse a studiarne i meccanismi e la regolazione, per le potenziali implicazioni terapeutiche per malattie neurodegenerative. Le zone neurogeniche SVZ e SGZ sono persistenze nel cervello adulto degli strati germinativi embrionali e vengono descritte come nicchie neurogeniche che garantiscono la presenza di stimoli molecolari indispensabili al mantenimento e alla regolazione delle c. s. n. nel corso dell’intera vita. La nicchia staminale neurogenica del cervello adulto costituisce un complesso microambiente, dove l’azione dei fattori intrinseci che regolano le c. s. n. (fattori di trascrizione e regolatori dell’espressione genica) converge con l’azione di fattori estrinseci, segnali molecolari tra cellule a contatto e segnali molecolari secreti a breve distanza, necessari per il mantenimento della staminalità delle c. s. n. residenti, per regolarne le divisioni cellulari e per influenzarne il destino. La nicchia staminale neurogenica presenta una citoarchitettura altamente organizzata, che assicura le adeguate interazioni tra i differenti tipi cellulari presenti. Le c. s. n. della nicchia SVZ sono costituite da una sottopopolazione di cellule RG che, sfuggite al generalizzato destino differenziativo astrocitario delle cellule RG, al termine della neurogenesi embrionale, mantengono proprietà di staminalità neurale tripotente, pur conservando molte caratteristiche di tipo astrocitario. Le c. s. n. tripotenti della nicchia della SVZ adulta (dette cellule B) sono relativamente quiescenti, dividendosi lentamente in modo simmetrico, e sono attivate da segnali locali che inducono l’espressione del recettore per il fattore trofico proliferativo EGF (Epidermal Growth Factor), trasformandosi in cellule che si dividono con grande rapidità (dette cellule di amplificazione e transito, o cellule C), in modo asimmetrico, generando un’altra cellula di amplificazione e transito e un neuroblasto o glioblasto postmitotico migrante (cellula A). Le cellule di amplificazione e transito compiono un limitato numero di rapide divisioni asimmetriche, esaurendo infine il loro potenziale generativo di cellule differenziate postmitotiche. Affinché la neurogenesi possa continuare, è necessario quindi che le cellule C siano rigenerate, a spese della popolazione di cellule staminali (cellule B). La nicchia assicura altresì il fatto che, a seguito di una divisione asimmetrica delle cellule C, la cellula staminale figlia resti nella nicchia, mentre la cellula figlia destinata a differenziarsi l’abbandoni. Nel caso della SVZ, i neuroblasti generati nella nicchia staminale adulta migrano verso il bulbo olfattivo, attraverso la cosiddetta corrente migratoria rostrale, con un meccanismo di migrazione collettiva a catena, che coinvolge interazioni omotipiche tra le cellule migranti, all’interno di strutture a forma di tubo, formate da astrociti specializzati.
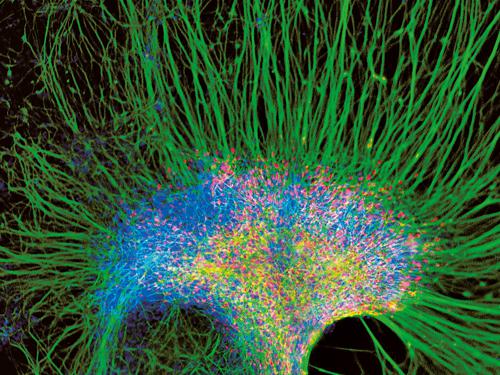
Come si studiano le cellule staminali neurali
L’identificazione delle c. s. n. in situ, nel cervello, è resa difficile dal fatto che le loro proprietà distintive, ossia la multipotenzialità e l’automantenimento, sono sperimentalmente elusive. Infatti, la ‘staminalità’ di una c. s. n. è uno stato funzionale potenziale. A differenza di altri tessuti, quali quello ematopoietico, per le c. s. n. non esistono a tutt’oggi marcatori molecolari affidabili per la loro univoca identificazione in situ, per questo l’identificazione è per lo più retrospettiva, cioè basata sulla determinazione delle loro proprietà in sistemi di coltura cellulare in vitro. L’isolamento e l’espansione di c. s. n. si possono ottenere, in vitro, con il metodo delle neurosfere, aggregati di progenitori neurali in sospensione, ottenuti da microdissezione di tessuto neurale embrionale o di SVZ adulta e coltivati con i fattori di crescita mitogeni EGF e FGF-2 (Fibroblast Growth Factor). La neurosfera ricostituisce, in vitro, un microambiente neurogenico, eterogeneo dal punto di vista cellulare, adatto al mantenimento, proliferazione e differenziamento delle c. s. n., e funzionalmente simile a quello della nicchia staminale, anche se non ne mostra la citoarchitettura ordinata. Dissociando le neurosfere primarie e coltivando le singole cellule così ottenute nelle medesime condizioni, si ottengono nuove neurosfere (automantenimento). Se si sospende la somministrazione di fattori di crescita, le cellule delle neurosfere differenziano, dando luogo ai tre tipi cellulari del sistema nervoso (multipotenzialità). Per superare l’intrinseca eterogeneità cellulare delle neurosfere, sono state messe a punto procedure per isolare, mantenere e propagare linee clonali omogenee di c. s. n. da differenti sorgenti di tessuto nervoso, anche adulto; queste non formano neurosfere, ma sono costituite da monostrati di glia radiale neurogenica che si dividono simmetricamente e che mantengono la capacità differenziativa tripotenziale. Tali colture sono chiamate nicchia-indipendenti, cioè svincolate dal microambiente cerebrale. Per determinare in modo più completo il destino potenziale di c. s. n. che siano state caratterizzate in vitro si usa il loro trapianto nel cervello: il repertorio dei tipi cellulari in cui esse possono differenziare è molto ampio e il destino di tali tipi cellulari sembra essere dettato sia dall’ambiente locale ricevente, sia dalle proprietà intrinseche delle c. s. n. stesse.
Cellule staminali pluripotenti indotte e riprogrammazione cellulare: prospettive terapeutiche
Oltre all’innegabile importanza conoscitiva, lo studio delle c. s. n. è oggetto di grandi (spesso esagerate) speranze per le future potenziali applicazioni terapeutiche. Tuttavia, le potenziali sorgenti di cellule umane per un’eventuale terapia cellulare (cellule staminali embrionali o c. s. n. fetali o adulte) suscitano importanti controversie etiche o presentano serie limitazioni tecniche. Inoltre, l’ipotesi sulla possibilità che cellule staminali somatiche adulte da tessuti non nervosi (per es., ematopoietico) possano dar luogo a cellule nervose differenziate è altamente discussa. Il più recente sviluppo sperimentale delle cosiddette cellule staminali pluripotenti indotte (iPS, Induced Pluripotent Stem cells), cellule somatiche adulte riprogrammate alla pluripotenza staminale, costituisce un significativo progresso verso la messa a punto di sorgenti di cellule staminali umane autologhe, che potrebbero risolvere gli aspetti sia etici sia tecnici. Cellule iPS murine e umane sono state ottenute da cellule somatiche differenziate adulte, indotte a esprimere combinazioni di geni di ‘staminalità’, ossia implicati nella promozione o mantenimento della pluripotenza (tra cui i fattori di trascrizione OCT4, SOX2, c-Myc, KLF4, Nanog, Lin28). Le cellule, per es. fibroblasti della pelle, vengono così riprogrammate e acquistano una pluripotenzialità staminale, con la capacità di generare tutti i tipi di cellule differenziate, sia somatiche sia germinali. Cellule iPS sono state successivamente ottenute da cellule staminali neurali adulte murine e umane, mediante l’espressione del solo fattore OCT4. Cellule iPS sono state anche ottenute da cellule differenziate di pazienti affetti da malattie neurodegenerative. Lo sviluppo di cellule iPS rappresenta un significativo avanzamento non solo verso la comprensione della regolazione epigenetica della trascrizione, per riprogrammare il destino cellulare nelle cellule somatiche terminalmente differenziate, ma anche verso la possibilità di generare cellule staminali pluripotenti individualizzate, a partire da cellule somatiche adulte, per trapianti terapeutici in vivo. Tuttavia, prima che tali prospettive terapeutiche siano realistiche, resta tutta da verificare la capacità del tessuto ricevente nel determinare e influenzare l’identità della cellula riprogrammata in vitro.