Cervello
Cervello
(IX, p. 829)
I vari aspetti evolutivi nell'organizzazione del sistema nervoso sono stati ampiamente trattati nella Enciclopedia Italiana (XXIV, p. 609; App. II, ii, p. 400; III, ii, p. 239; IV, ii, p. 567). In modo particolare nel lemma nervoso, sistema (App. V, iii, p. 644) vengono descritti i progressi più significativi di neurofisiologia generale e, tra l'altro, viene approfondito il problema delle sinapsi e quello dei fenomeni di neuromodulazione e plasticità neuronale; di crescente interesse, inoltre, l'analisi dell'organizzazione modulare e diffusa dei circuiti neuronici e degli approcci all'indagine strumentale dei substrati nervosi dei processi cognitivi. I lemmi neurobiologia (App. V, iii, p. 653) e neuroendocrinologia (App. V, iii, p. 657) completano l'inquadramento generale, fornendo una conoscenza più estensiva dell'argomento. Gli studi sull'attività cerebrale hanno avuto grande impulso dall'adozione di tecniche di microfisiologia elettronica e dall'analisi dei modelli computerizzati, approccio concettuale che nel corso degli anni Novanta ha rappresentato un vero salto di qualità nell'ambito delle indagini sulle funzioni del cervello.
In senso estensivo il termine c. è usato come sinonimo di encefalo per denotare la massa di tessuto nervoso che riempie la scatola cranica e che assieme al midollo spinale costituisce il sistema nervoso centrale. Secondo un'accezione più ristretta il c. è quella parte dell'encefalo che deriva dall'espansione primaria anteriore del tubo neurale embrionale (proencefalo), che a sviluppo ultimato include:
1) il telencefalo con gli emisferi e le commessure cerebrali, i gangli della base, le formazioni ippocampali e altre strutture limbiche;
2) il diencefalo con l'ipotalamo, l'ipofisi posteriore, il talamo, il metatalamo e l'epitalamo.
Pertanto non fanno parte del c. in senso stretto le strutture encefaliche derivate dall'espansione primaria posteriore del tubo neurale (il rombencefalo), e cioè il cervelletto e il tronco encefalico, quest'ultimo formato da mesencefalo, ponte e bulbo. Nel corso della trattazione il vocabolo c. sarà usato nel senso di encefalo.
Significato funzionale e principi generali dell'organizzazione anatomo-fisiologica del cervello
Il c. è la parte più sviluppata e funzionalmente più importante del sistema nervoso dei mammiferi. Esso presiede sia alle funzioni della vita vegetativa sia a quelle della vita di relazione, coordinando e integrando in un tutto armonico le attività dei vari organi del corpo, e consentendo all'individuo di interagire con il suo ambiente in modo di aumentare, in ultima analisi, le sue possibilità di sopravvivenza e riproduzione. Di fatto il funzionamento del c. costituisce il fondamento primario dell'individualità biologica e dell'identità personale, tanto è vero che la legislazione vigente in gran parte del mondo equipara la morte del c. a quella della persona, indipendentemente dalla persistenza del funzionamento di altri organi come il cuore, i reni o il fegato (v. bioetica, in questa Appendice; trapianti: Diritto, App. V).
Le operazioni del c. possono essere descritte, sinteticamente, come computazioni eseguite con l'analisi, la trasmissione e l'immagazzinamento delle informazioni al fine di soddisfare le esigenze della vita.
Nell'esecuzione di queste operazioni il c. opera come una struttura pluristratificata nella quale si riconoscono livelli distinti, interdipendenti e gerarchizzati secondo il rispettivo grado di complessità organizzativa:
1) il livello degli ioni e delle molecole;
2) il livello delle strutture subcellulari;
3) il livello dei neuroni e delle cellule gliali;
4) il livello delle cinque porzioni macroscopiche del c., vale a dire bulbo, ponte e cervelletto, mesencefalo, diencefalo, emisferi cerebrali con relativi centri sottocorticali e aree corticali;
5) il livello degli aggregati multineuronali distribuiti in varie delle suddette porzioni macroscopiche del c., aventi specifici compiti funzionali nell'elaborazione delle informazioni di senso e dei comandi per gli effettori muscolari e ghiandolari.
In accordo con la teoria cellulare classica, si ritiene che l'unità di base del funzionamento cerebrale sia il neurone, cellula specializzata nella generazione e nell'invio di segnali elettrici, nella sintesi e nella secrezione di sostanze chimiche, e nelle reazioni alle sostanze prodotte dal neurone stesso o da altri neuroni. L'attività individuale dei neuroni cerebrali si avvale peraltro del sostegno strutturale e fisiologico delle cellule della glia centrale: macroglia (oligodendrociti, astrociti) e microglia.
Il funzionamento di molti organi non nervosi, come, per es., il fegato o una qualsiasi ghiandola endocrina, può essere visto come la sommatoria delle funzioni delle singole cellule che li costituiscono. Ciò ovviamente non vale per il c., che opera grazie alla capacità dei neuroni di comunicare tra loro tramite connessioni sinaptiche selettive sia eccitatorie sia inibitorie, e di combinarsi in insiemi la cui attività risponde a leggi e persegue finalità che trascendono quelle delle attività dei singoli neuroni. Secondo il principio della specializzazione funzionale, il c. può essere visto come un complesso di sistemi neuronali parzialmente indipendenti, ciascuno adibito all'espletamento di una propria funzione specifica, come, per es., il controllo della respirazione, la visione, il linguaggio. A identificare un sistema neuronale cerebrale concorrono, oltre alla funzione espletata, criteri anatomici, fisiologici, embriologici, comparativi e per alcuni aspetti anche evolutivi. I neuroni di un sistema funzionale cerebrale sono uniti da connessioni altamente selettive, organizzate secondo principi che possono essere propri del sistema stesso ma che più spesso sono comuni ad altri sistemi; la specializzazione funzionale di ogni sistema deriva infatti più dai suoi collegamenti specifici con la periferia di senso e gli effettori muscolari e ghiandolari che dalla sua organizzazione intrinseca. La specificità funzionale dei sistemi neuronali cerebrali non comporta una loro completa segregazione, anzi le loro attività sono coordinate da collegamenti reciproci e da centri con proiezioni diffuse che hanno il compito di conferire unitarietà alle attività del c. e quindi di tutto l'organismo. È solo in questo senso, e non certo per negare la separazione di funzioni differenti in diversi sistemi neuronali cerebrali, che si può affermare che il c. funziona come un tutto unico.
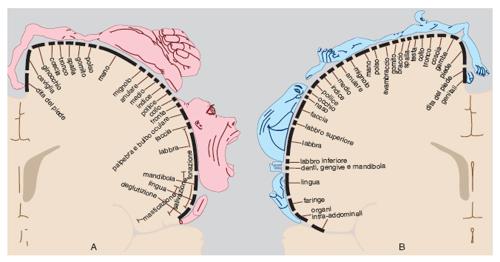
L'aggregazione ordinata di neuroni nel c. è evidente in vari aspetti dell'organizzazione cerebrale. Gran parte dei centri sottocorticali e delle aree corticali è occupata da mappe che rappresentano topograficamente le superfici recettoriali degli organi di senso o la muscolatura. Entro ciascuna mappa, neuroni contigui sono collegati con punti contigui della zona periferica rappresentata, in modo che la disposizione dei neuroni nelle varie strutture cerebrali preservi i rapporti spaziali esistenti in periferia, e quindi, in definitiva, nel mondo esterno. La corrispondenza spaziale fra regioni retiniche, o cocleari, o cutanee da una parte, e le rispettive rappresentazioni cerebrali dall'altra, si esprime in mappe retinotopiche, tonotopiche e somatotopiche sia nei centri sottocorticali sia nelle aree corticali dei relativi sistemi di senso. Analogamente, gli organi motori sono rappresentati anch'essi con una organizzazione somatotopica nei centri sottocorticali e nelle aree corticali che controllano il movimento (fig. 1).
Sia per le mappe di senso che per quelle di moto vale il principio generale che in ciascun emisfero cerebrale è rappresentata la metà controlaterale del corpo; ugualmente, le mappe cerebrali visive e uditive dello spazio extracorporeo si dividono fra i due emisferi cerebrali secondo il principio della corrispondenza crociata. Talvolta a livello corticale le mappe coincidono con aree identificate dalla citoarchitettonica classica, come nel caso dell'area motoria o dell'area visiva primarie (aree 4 e 17 della classificazione di K. Brodmann). In altri casi, una singola area citoarchitettonica può contenere più mappe, come, per es., l'area visiva 19 dei primati nella quale si ritrovano più rappresentazioni adiacenti del campo visivo controlaterale. In effetti, oltre la metà della corteccia cerebrale del macaco (e probabilmente anche dell'uomo) è occupata da più di 30 mappe visive, che differiscono almeno in parte per la loro prevalente specializzazione nell'analisi di diversi parametri degli stimoli visivi: forma, colore, posizione, movimento ecc. Le informazioni specifiche necessarie alla costituzione di queste mappe sono distribuite alle appropriate regioni della corteccia dall'area 17 che le riceve dalla retina tramite il nucleo talamico della visione, il corpo genicolato laterale (Zeki 1993). Anche le mappe delle sensibilità somatiche che rappresentano il corpo nella corteccia dei primati sono molteplici, sebbene non così numerose come quelle visive.
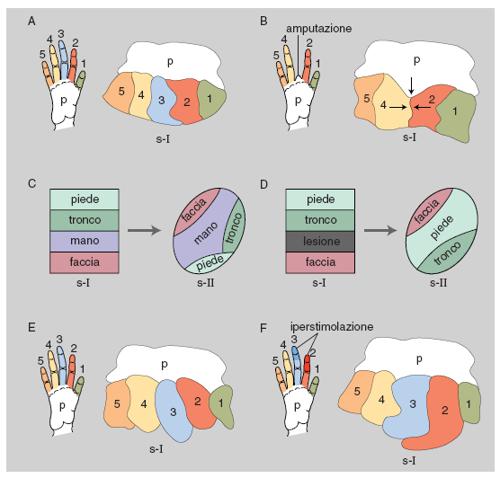
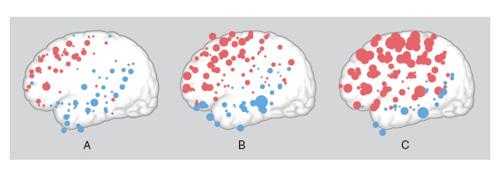
In passato si riteneva che l'organizzazione topografica delle mappe corticali fosse relativamente fissa sia nel singolo individuo sia fra individui della stessa specie, ma oggi si sa che cospicue variazioni possono essere osservate in conseguenza di esperienze specifiche, come l'uso prolungato di una parte del corpo, a cui corrisponde un'espansione della rappresentazione corticale di quella parte, o di alterazioni delle vie afferenti. Per es., dopo l'amputazione di una parte del corpo, la parte della mappa corticale originariamente connessa con la parte amputata può venire invasa da afferenze da altre parti del corpo. Questi esempi di organizzazione plastica si riscontrano non solo nel c. immaturo, ma anche in quello adulto (Berlucchi, Aglioti 1997). L'alto numero di aree corticali dedicate a una particolare modalità di senso o al controllo motorio è uno dei criteri per giudicare il grado di complessità dell'organizzazione cerebrale: il c. di mammiferi come gli insettivori e i roditori, il cui comportamento è assai meno ricco e versatile di quello dei primati, ha solo poche mappe corticali visive (da 2 a 8) e solo un paio di mappe somestesiche (v. oltre; fig. 2).
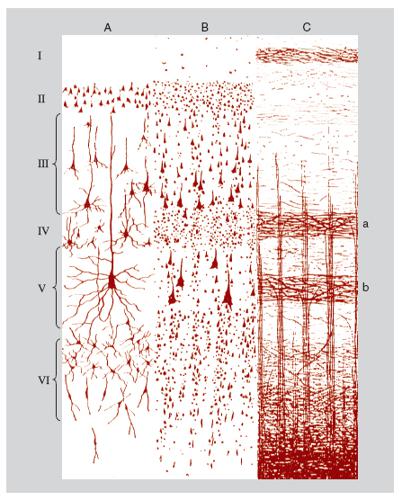
Un altro aggregato organizzato di neuroni cerebrali è la colonna corticale, detta anche modulo (Mountcastle 1997). In tutta la corteccia cerebrale (o più precisamente nella sua parte più estesa, l'isocorteccia, che riveste tutta la superficie degli emisferi cerebrali tranne le porzioni mediali occupate dalla meso- e allocorteccia) si riscontrano aggregati verticali di neuroni uniti fra loro secondo un piano ripetitivo di connessioni interne che si mantiene identico o molto simile da un punto all'altro della corteccia.
La colonna corticale tipica, che ha uno spessore di qualche centinaio di micrometri, si estende dalla superficie alla parte più profonda della sostanza grigia corticale, attraversando perpendicolarmente i sei strati trasversali che si riconoscono in ogni area isocorticale. Essa consta di un fascio di file ugualmente verticali di 80÷250 neuroni (le minicolonne), unite fra di loro da collegamenti orizzontali, in ciascuna delle quali sono riconoscibili tutti i fenotipi di neuroni corticali, piramidali e non piramidali, eccitatori e inibitori (fig. 3). Nell'ontogenesi del c., la minicolonna è prodotta dalla divisione iterativa di un piccolo clone di cellule progenitrici del neuroepitelio primordiale e dalla migrazione di loro discendenti postmitotici lungo cellule di glia radiale. Alcune cellule della colonna, in genere cellule piramidali, si proiettano al di fuori della colonna stessa formando le connessioni estrinseche efferenti, dirette a più parti del sistema nervoso centrale, che variano, a seconda della zona di provenienza delle proiezioni, dal midollo spinale, a diversi centri sottocorticali, ad altre regioni corticali. Le connessioni estrinseche afferenti al modulo provengono dai nuclei talamici, da altri moduli corticali, dal tronco dell'encefalo e dall'ipotalamo, e anche da altre regioni sottocorticali del telencefalo. Se la connettività intrinseca e il modo di operare interno di ciascuna colonna tendono a essere invarianti, la differenziazione delle connessioni estrinseche delle diverse colonne determina il ruolo funzionale specifico di ciascuna di esse. Nella corteccia visiva primaria, per es., si osservano per ciascun punto del campo visivo colonne che elaborano prevalentemente informazioni provenienti da un determinato occhio, o che sono deputate alla visione oggettuale, o cromatica, o spaziale. Le proiezioni efferenti di queste colonne sono dirette separatamente alle già ricordate mappe visive in altre regioni corticali, alle quali contribuiscono a conferire le rispettive specializzazioni di analisi dei parametri dello stimolo visivo.
Aspetti dimensionali, comparativi ed evolutivi del cervello
Non vi sono differenze significative di forma, dimensioni e funzionamento individuale fra i singoli neuroni del c. umano e quelli degli altri mammiferi o anche degli altri vertebrati. Le variabili che differenziano i c. delle diverse specie sono le dimensioni del c., il numero di neuroni che lo costituiscono e il piano dettagliato delle connessioni fra i neuroni. Nelle varie specie di mammiferi la massa del c. varia dai 260 mg del topolino ai 25 g del gatto, dai 1350 g dell'uomo ai 2700 g dell'orca e ai 4200 g dell'elefante (Haug 1987). È evidente che il c. è grande in animali grandi e piccolo in animali piccoli, ma la relazione fra massa cerebrale (C) e massa corporea (S) non è lineare. Essa è descritta al meglio dalla funzione esponenziale generale CS³/⁴, che tuttavia può non valere per il singolo individuo o la singola specie. Più informativo è il quoziente di encefalizzazione, un indice relativo della grandezza del c. rispetto al corpo.
I primati hanno un quoziente di encefalizzazione superiore a quello di tutti gli altri mammiferi, e l'uomo ha un quoziente di encefalizzazione superiore a quello di tutti gli altri primati. Si può ipotizzare che la massa cerebrale includa una componente irrinunciabile che serve al controllo delle attività biologiche elementari, commisurate alle dimensioni del corpo, e una componente variabile al servizio di funzioni che possiamo definire superiori o intelligenti (Passingham 1982; Aboitiz 1996). L'elevato quoziente di encefalizzazione dei primati e soprattutto dell'uomo è dovuto a un maggiore sviluppo della seconda componente rispetto a tutti gli altri mammiferi. Si ritiene che le linee evolutive dell'uomo e dello scimpanzé (il primate non umano esistente biologicamente più vicino all'uomo da un punto di vista genetico e biochimico) si siano divise 5 milioni di anni fa. Dalla capacità dei crani fossili dei primi antenati dell'uomo (varie specie di ominidi australopitechi vissuti in Africa da 4,4 a 2,5 milioni di anni fa) si ricava che il loro c. misurava sui 400 cm³, all'incirca come quello dello scimpanzé attuale; tuttavia, poiché i loro scheletri suggeriscono che essi avessero un corpo più piccolo di quello dello scimpanzé, il loro quoziente di encefalizzazione era già maggiore di quello dei primati non umani tuttora esistenti (Kappelman 1996; Bradshaw 1997). Pertanto sembra che la linea degli ominidi che ha portato all'uomo moderno sia stata soggetta fin dall'inizio a una pressione evolutiva favorente la selezione di individui con c. di grandi dimensioni. Un ulteriore aumento della capacità cranica e quindi delle dimensioni del c. nei progenitori dell'uomo si è avuto in Homo habilis, vissuto da 2,3 a 1,6 milioni di anni fa (500÷800 ml), in Homo erectus, vissuto da 1,9 a 0,3 milioni di anni fa (750÷1250 ml), e soprattutto in Homo sapiens, comparso circa 0,4 milioni di anni fa (1100÷1700 ml).
Resoconti dettagliati su parametri dimensionali del c. dell'uomo attuale sono stati forniti sulla base di numerosi dati autoptici raccolti in Danimarca (Pakkenberg, Gundersen 1997). La media del volume del c. umano in soggetti di ambo i sessi, di età variabile dai 20 ai 90 anni, è risultata pari a circa 1350 ml (1430 ml nel maschio e 1260 ml nella femmina, differenza imputabile principalmente alla dicotomia sessuale riguardo al peso corporeo). L'area della superficie corticale è risultata pari in media a 1850 cm² (1900 cm² nell'uomo e 1680 cm² nella donna), e il volume corticale pari in media a 480 cm³ (517 cm³ nell'uomo e 440 cm³ nella donna). Il numero dei neuroni corticali, che costituiscono circa la metà di tutti i neuroni cerebrali, è risultato pari in media a 21,5 miliardi (22,8 miliardi nell'uomo e 19,3 miliardi nella donna); dai 20 ai 90 anni di età si constata una riduzione del numero di neuroni corticali dell'ordine del 9,5%, valore corrispondente a una perdita media giornaliera di 85.000 neuroni. Comparativamente, il c. umano moderno è circa tre volte più grande di quello che ci si aspetterebbe di trovare in uno scimpanzé di peso corporeo pari a quello dell'uomo. Le parti del c. umano che mostrano uno sviluppo maggiore rispetto alle parti corrispondenti del c. di primati non umani sono la corteccia cerebrale (soprattutto nella regione prefrontale) e il cervelletto, mentre la differenza volumetrica minima con gli altri primati si osserva nel bulbo e nel diencefalo (Passingham 1982). Poiché non vi sono differenze significative fra l'uomo e gli altri primati nello spessore della corteccia cerebrale, che varia da area ad area da 2 a 3 mm, si ritiene che l'espansione relativa della corteccia umana sia dovuta alla produzione embrionale di un maggior numero di minicolonne, con conseguente aumento del numero di colonne e aree corticali. Questo meccanismo avrebbe carattere generale per spiegare le differenze di sviluppo della corteccia cerebrale, e anche di tutto il c., fra le diverse specie di mammiferi e probabilmente anche fra individui della stessa specie (Rakic 1995; Mountcastle 1997). Durante la gravidanza il c. cresce rispetto al corpo con la stessa velocità nello scimpanzé e nell'uomo, ma dopo la nascita la crescita del c. rallenta marcatamente nello scimpanzé, sicché il volume finale raggiunto dal c. è solo due volte quello del c. neonatale, mentre nei primi due anni di vita il c. dell'uomo continua a crescere con la stessa velocità di quello del feto, quadruplicando così il suo volume neonatale (Passingham 1982). In tutti i primati la crescita postnatale del volume cerebrale avviene per aumento non del numero di neuroni, ma dello spazio occupato dall'intreccio dei loro prolungamenti, il neuropilo. Lo scimpanzé adulto ha un c. che gli basta per avere, almeno in forma rudimentale, l'autocoscienza; la capacità di comunicare a gesti (ma non vocalmente, per inadeguatezza della sua laringe) con la competenza di un bambino di due anni e mezzo; la tendenza ad attribuire il comportamento altrui a processi mentali ('teoria della mente'); l'abilità di ideare e costruire semplici arnesi per il raggiungimento di scopi specifici.
Gli aspetti esclusivi, biologici e insieme culturali, della specie umana, - il linguaggio, un'autocoscienza basata su una memoria che può spaziare nel passato vicino e lontano come nel futuro, l'arte, la scienza, la tecnologia, l'organizzazione sociale - possono ascriversi a un c. molto più grande di quello di uno scimpanzé, ma non solo a quello (Bradshaw 1997; Corballis 1998). Nell'evoluzione umana l'aumento dimensionale del c. è stato preceduto da una profonda riorganizzazione della struttura cerebrale primitiva avvenuta presumibilmente in un antenato comune dell'uomo e dello scimpanzé (Holloway 1995).
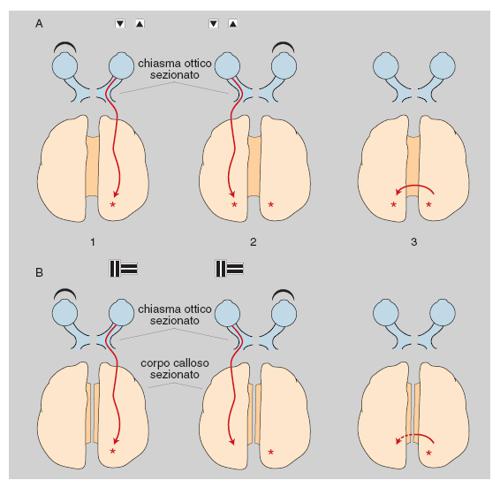
Questa riorganizzazione include: la riduzione della corteccia visiva primaria e l'espansione di aree visive superiori e di aree polisensoriali nei lobi occipitale e parietale, processi avvenuti fra 3 e 4 milioni di anni fa; la modificazione del lobo frontale, avvenuta tra 2,5 e 1,8 milioni di anni fa, soprattutto in corrispondenza dell'area di Broca, specializzata nelle funzioni espressive del linguaggio vocale e probabilmente anche gestuale; la comparsa di un'asimmetria anatomica fra gli emisferi cerebrali, consistente in un maggiore sviluppo relativo della parte anteriore dell'emisfero destro e della parte posteriore dell'emisfero sinistro, e caratterizzata da una maggiore lunghezza e da un andamento più rettilineo della scissura silviana a sinistra rispetto a quella di destra. Nell'uomo, alla differenza del decorso delle scissure silviane dei due lati corrisponde una differenza di estensione della superficie del planum temporale, la corteccia situata in profondità sul labbro inferiore della scissura stessa: in circa il 90% dei soggetti destrimani il planum temporale è più esteso a sinistra, mentre nei mancini la percentuale di soggetti con planum temporale più esteso a sinistra cade a circa il 60% (Steinmetz 1996). Oltre che con la dominanza manuale, la differenza fra il planum temporale di sinistra e quello di destra può essere correlata con la lateralizzazione dei centri del linguaggio (Foundas, Leonard, Gilmore et al. 1994), che in base a risultati clinici e sperimentali appaiono localizzati nell'emisfero sinistro nel 95% circa dei destrimani e nel 70÷80% dei mancini (McKeever, Seitz, Krutsch, van Eys 1995). Più in generale, l'asimmetria funzionale fra gli emisferi del c. umano, dimostrata in primo luogo dagli effetti differenziali delle lesioni cerebrali destre e sinistre, può essere messa in rapporto con l'esistenza di due codici fondamentali per l'elaborazione delle informazioni: un codice simbolico-linguistico, utilizzato prevalentemente da strutture dell'emisfero sinistro, e un codice analogico-figurativo, utilizzato prevalentemente da strutture dell'emisfero destro. È possibile che i meccanismi nervosi necessari all'utilizzazione dei due codici siano incompatibili fra di loro, e che il segregarli in emisferi diversi ne faciliti l'operazione; esempi di simili segregazioni si rilevano, indubbiamente come fenomeni di evoluzione indipendente parallela, nelle asimmetrie di lato morfologiche e funzionali di insetti e crostacei (Berlucchi, Tassinari 1985). Peraltro il corpo calloso, la principale via di collegamento interemisferica, esercita un'azione unificatrice fra le attività cognitive dei due emisferi, come dimostrano i sintomi di disconnessione interemisferica che compaiono dopo lesioni o sezioni callosali (Berlucchi, Aglioti 1990; fig. 4).
La comparsa della comunicazione vocale nella specie umana si fa risalire all'emergenza di Homo sapiens in Africa tra 150.000 e 100.000 anni fa, ma è probabile che il linguaggio vocale sia stato preceduto da un lungo periodo in cui gli ominidi comunicavano con un linguaggio gestuale denotativo, assai più espressivo dei gesti connotativi ed emotivi con cui l'uomo moderno accompagna la parola. La transizione dal linguaggio gestuale al linguaggio vocale può essere stata facilitata dall'emergenza e diffusione di un allele genetico grazie al quale un singolo emisfero, il sinistro nella stragrande maggioranza degli individui, ha assunto il controllo delle mani e dell'emissione vocale (Corballis 1998).
Le esigenze metaboliche del cervello
Il c. si distingue dagli altri organi anche per la sua scarsa flessibilità metabolica, che lo obbliga a ricavare l'energia necessaria al suo funzionamento dalla sola scissione aerobica del glucosio (Sokoloff 1996a e 1996b). Infatti la produzione cerebrale di lattato tramite la glicolisi anaerobica è trascurabile, e una utilizzazione consistente di derivati chetonici degli acidi grassi nel c. si osserva solo nelle condizioni estreme di un digiuno prolungato per molti giorni. Poiché il c. è incapace di immagazzinare quantità significative di glucosio in forma di glicogeno e, al contrario del muscolo, non possiede molecole come la mioglobina, atte a legare reversibilmente l'ossigeno, il suo funzionamento e la sua stessa vita dipendono interamente dal continuo rifornimento di ossigeno e glucosio da parte del circolo sanguigno. Peraltro il c. contrasta la sua vulnerabilità da parte dell'ipossia e dell'ipoglicemia con la sua capacità di regolare la propria perfusione sanguigna tramite meccanismi sistemici e locali anche in presenza di variazioni cospicue della pressione arteriosa.
In condizioni basali il c., pur costituendo solo il 2% della massa corporea, riceve circa 800 ml/min di sangue, pari a un settimo della gettata cardiaca, e consuma circa il 60% del glucosio e il 20% dell'ossigeno di tutto il corpo. La spesa metabolica totale del c. (circa 50 ml/min di ossigeno, necessari per bruciare circa 75 mg di glucosio) e il flusso sanguigno che lo perfonde restano costanti in tutte le condizioni fisiologiche, dal sonno profondo al lavoro mentale intenso, in accordo con il fatto che il numero complessivo di neuroni attivi a ogni istante è statisticamente lo stesso. Ciò che varia nel c. in funzione delle condizioni fisiologiche è il flusso sanguigno regionale, che di volta in volta aumenta nelle aree cerebrali più attive e diminuisce in quelle meno attive, in conseguenza di azioni vasodilatatrici locali di sostanze liberate dai neuroni nello spazio extracellulare, in quantità proporzionale alla loro attività elettrica (ioni potassio) e metabolica (ioni idrogeno da idratazione dell'anidride carbonica, adenosina). Questa regolazione locale del flusso viene utilizzata dalle recenti tecnologie rivolte ad analizzare la specializzazione funzionale di regioni cerebrali (v. oltre; fig. 5).
I nuovi metodi per lo studio del cervello
Nella storia della localizzazione di funzioni nel c. si sono succedute varie metodologie, ciascuna delle quali ha fornito e continua a fornire dati e idee sui rapporti fra le strutture cerebrali identificate dall'anatomia e le loro funzioni fisiologiche, comportamentali e psicologiche. Ai classici metodi dello studio degli effetti delle lesioni e delle stimolazioni focali del c. e delle registrazioni elettrofisiologiche delle attività di singoli neuroni e popolazioni di neuroni si sono aggiunte recentemente nuove metodologie che per la loro scarsa o nulla invasività si sono rivelate particolarmente adatte allo studio del c. umano.
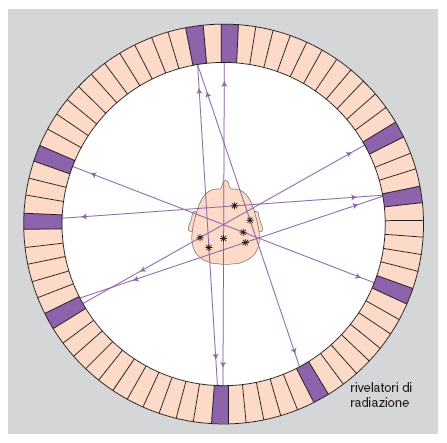
Fin dall'inizio degli anni Settanta la tomografia computerizzata (TC) a raggi X ha permesso di visualizzare strutture cerebrali individuali a cranio chiuso in vivo, e la risoluzione spaziale della tomografia dell'anatomia cerebrale è stata aumentata enormemente dal metodo della risonanza magnetica nucleare (RMN), che utilizza i segnali radio riflessi da atomi di idrogeno previamente orientati da un campo magnetico. Oltre ad avere utilità clinica per il rilevamento e la localizzazione di formazioni patologiche, il metodo è attualmente impiegato per lo studio di vari aspetti del c. normale, come, per es., l'influenza del genotipo sul fenotipo cerebrale. I c. di gemelli monozigotici, dotati dello stesso genotipo, pur molto più simili fra loro di quanto lo siano i c. di gemelli dizigotici (che hanno solo la metà dei geni in comune), non sono affatto identici. L'elevatissima concordanza fra i gemelli monozigotici riguardo al volume cerebrale, significativamente superiore a quella osservata fra i membri di coppie di gemelli dizigotici dello stesso sesso, indica che questo aspetto fenotipico del c. è sotto stretto controllo genetico. Tuttavia i geni non possono specificare da soli i fini dettagli delle connessioni che uniscono i neuroni fra loro e con gli organi di senso e di moto. Ancora prima della nascita, questa specificazione dipende da azioni di ormoni, fattori di crescita, molecole di riconoscimento e di adesione cellulare, che prescindono almeno in parte dal controllo genetico e quindi conferiscono alla microstruttura di ciascun c. caratteristiche di assoluta unicità (Faissner, Kettenmann, Trotter 1996). L'irripetibilità dell'ontogenesi di ogni dato c. è confermata dall'analisi con la risonanza magnetica nucleare dell'organizzazione dei solchi e delle circonvoluzioni della corteccia di individui diversi, inclusi i gemelli monozigotici e dizigotici. La corteccia cerebrale dell'uomo si distribuisce per un terzo sulle circonvoluzioni e per due terzi nei solchi; questa organizzazione tipicamente girencefalica, che consente a un grande volume corticale di essere contenuto in una cavità cranica relativamente piccola, è già presente alla nascita ed è determinata da fattori intrinseci alla corteccia stessa, come la tensione che si sviluppa durante l'accrescimento lungo assoni, dendriti e prolungamenti gliali (van Essen 1997). In ogni specie i ripiegamenti della corteccia seguono uno schema comune, ma almeno in alcune regioni corticali vi è un'elevata variabilità fra individui conspecifici nella posizione di solchi che separano aree corticali con funzioni diverse. L'accertata presenza di questa variabilità in gemelli monozigotici (Bartley, Jones, Weinberger 1997) conferma al di là di ogni dubbio l'unicità fenotipica corticale individuale. L'esame del c. con la risonanza magnetica corticale dimostra anche che la già ricordata asimmetria fra il planum temporale di destra e quello di sinistra varia considerevolmente fra i membri di coppie di gemelli monozigotici, indipendentemente dal fatto che la loro dominanza manuale sia concordante o discordante (Steinmetz, Herzog, Schlaug et al. 1995). Il contributo dell'esperienza postnatale al fenotipo cerebrale, che non si può mettere in dubbio ma è ancora in gran parte sconosciuto, si esprime quasi certamente a un livello microstrutturale, come per es. l'albero dendritico di neuroni corticali, la cui possibile espansione per opera di fattori esperienziali è oggetto di studi ancora a uno stadio del tutto iniziale (Jacobs, Schall, Scheibel 1993).
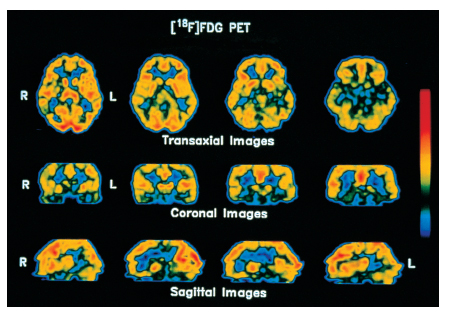
Vari metodi moderni di costruzione di immagini cerebrali tramite la TC permettono di distinguere aree cerebrali più attive da altre meno attive in base alla sopra ricordata regolazione del flusso sanguigno regionale del c. in funzione dell'attività locale dei neuroni. È possibile pertanto osservare le variazioni della distribuzione dell'attività neuronale nel c. in varie condizioni fisiologiche e patologiche e durante l'esecuzione di compiti mentali. Le modificazioni regionali del flusso sanguigno cerebrale si rilevano dall'esterno del cranio in base alla distribuzione di sostanze radioattive di breve emivita (Positron Emission Tomography, PET), o di traccianti che emettono fotoni (Single-Photon Emission Computerized Tomography, SPECT), o di sostanze di contrasto paramagnetiche (risonanza magnetica funzionale, fMR). Con la PET è anche possibile individuare, dopo marcatura, la localizzazione in strutture cerebrali specifiche di traccianti dei neurotrasmettitori o di loro precursori, nonché di recettori delle membrane neuronali che legano neurotrasmettitori e neuromodulatori. Uno sviluppo recente della fMR utilizza la possibilità di misurare l'ossigenazione del sangue grazie alle diverse proprietà magnetiche dell'ossiemoglobina e della deossiemoglobina. Poiché per un fattore di sicurezza l'aumento di flusso collegato all'aumento dell'attività neuronale in un'area del c. è sovradimensionato rispetto al consumo di ossigeno locale, la deossiemoglobina aumenta nel sangue refluo da quell'area, comportandosi così da tracciante endogeno dell'attivazione locale del cervello (fig. 6 e fig. 7).
La straordinaria proliferazione negli ultimi anni degli studi di visualizzazione delle attivazioni regionali del c. tramite la PET, la SPECT e la risonanza magnetica funzionale ha fornito una ricca serie di correlazioni fra diverse configurazioni di attivazioni cerebrali e diversi stati fisiologici e comportamentali, tanto da dare origine a una specie di frenologia moderna, molto meno fantasiosa e molto più credibile di quella ottocentesca. La localizzazione di funzioni con questi metodi ha spaziato dalla visione alla somatoestesia e ad altre modalità di senso, dal linguaggio alla memoria, dall'attenzione al controllo motorio, dalle emozioni alla regolazione del ciclo sonno-veglia (Posner, Raichle 1994; Frackowiak, Friston, Frith et al. 1997), confermando, estendendo e talvolta rivoluzionando le conoscenze basate su metodi più tradizionali. Va comunque ricordato che gli attuali metodi di visualizzazione non invasiva del c. mettono in evidenza regioni compatte di attivazione, ma non i sistemi distribuiti al servizio di funzioni specifiche, formati da neuroni separati spazialmente ma uniti da connessioni anatomiche specifiche e dotati di proprietà funzionali simili. Molto tempo e molti sforzi saranno necessari per approntare metodi adeguati a esplorare il c. con tale grado di finezza, indispensabile peraltro per comprenderne appieno il funzionamento. Vedi tav. f.t.
Bibliografia
R.E. Passingham, The human primate, Oxford-San Francisco 1982;
G. Berlucchi, G. Tassinari, Correlati cerebrali delle differenze comportamentali fra uomo e animali con particolare riferimento alle asimmetrie emisferiche, in Evoluzione biologica e i grandi problemi della biologia. L'evoluzione del comportamento e del sistema nervoso, xi Seminario: Roma 1-3 marzo 1984, in Contributi del Centro linceo interdisciplinare di scienze matematiche e loro applicazioni, 1985, 71, pp. 75-123.
H. Haug, Brain sizes, surfaces, and neuronal sizes of cortex cerebri. A stereological investigation of man and his variability and a comparison with some mammals (primates, whales, marsupials, insectivores, and one elephant), in American journal of anatomy, 1987, 180, pp. 126-42.
G. Berlucchi, S. Aglioti, Le sindromi da disconnessione interemisferica, in Manuale di neuropsicologia. Normalità e patologia dei processi cognitivi, a cura di G. Denes, L. Pizzamiglio, Bologna 1990, 1996², pp. 838-89.
B. Jacobs, M. Schall, A.B. Scheibel, A quantitative dendritic analysis of Wernicke's area in humans, ii: Gender, hemispheric, and experiential factors, in Journal of comparative neurology, 1993, 327, pp. 97-111.
S. Zeki, A vision of the brain, Oxford-Boston 1993.
A.L. Foundas, C.M. Leonard, R. Gilmore et al., Planum temporale asymmetry and language dominance, in Neuropsychologia, 1994, 32, pp. 1225-31.
M.I. Posner, M.E. Raichle, Images of mind, New York 1994.
R.L. Holloway, Towards a synthetic theory of human brain evolution, in Origins of the human brain, ed. J.-P. Changeux, J. Chavaillon, Oxford-New York 1995, pp. 42-54.
W.F. McKeever, K.S. Seitz, A.J. Krutsch, P.L. van Eys, On language laterality in normal dextrals and sinistrals. Results from the bilateral object naming latency task, in Neuropsychologia, 1995, 33, pp. 1627-35.
P. Rakic, Evolution of neocortical parcellation. The perspective from experimental neuroembriology, in Origins of the human brain, ed. J.-P. Changeux, J. Chavaillon, Oxford-New York 1995, pp. 84-100.
H. Steinmetz, A. Herzog, G. Schlaug et al., Brain (a)symmetry in monozygotic twins, in Cerebral cortex, 1995, 5, pp. 296-300.
F. Aboitiz, Does bigger mean better? Evolutionary determinants of brain size and structure, in Brain, behavior and evolution, 1996, 47, pp. 225-45.
A. Faissner, H. Kettenmann, J. Trotter, The establishment of neural cell populations and interneuronal connections, in Comprehensive human physiology. From cellular mechanisms to integration, ed. R. Greger, U. Windhorst, 1° vol., Berlin-New York 1996, pp. 603-22.
J. Kappelman, The evolution of body mass and relative brain size in fossil hominids, in Journal of human evolution, 1996, 30, pp. 243-76.
L. Sokoloff, Cerebral metabolism and visualization of cerebral activity, in Comprehensive human physiology. From cellular mechanisms to integration, ed. R. Greger, U. Windhorst, 1° vol., Berlin-New York 1996a, pp. 579-602. L. Sokoloff, Circulation in the central nervous system, in Comprehensive human physiology. From cellular mechanisms to integration, ed. R. Greger, U. Windhorst, 1° vol., Berlin-New York 1996b, pp. 561-78.
H. Steinmetz, Structure, function, and cerebral asymmetry. In vivo morphometry of the planum temporale, in Neuroscience and biobehavioral reviews, 1996, 20, pp. 587-91.
A.J. Bartley, D.W. Jones, D.R. Weinberger, Genetic variability of human brain size and cortical gyral patterns, in Brain, 1997, 120, pp. 257-69.
G. Berlucchi, S. Aglioti, The body in the brain. Neural bases of corporeal awareness, in Trends in neurosciences, 1997, 20, pp. 560-64.
J.L. Bradshaw, Human evolution. A neuropsychological perspective, Hove 1997.
R.S.J. Frackowiak, K.J. Friston, C.D. Frith et al., Human brain function, San Diego (Cal.) 1997.
V.B. Mountcastle, The columnar organization of the neocortex, in Brain, 1997, 120, pp. 701-22.
R. Pakkenberg, H.J.G. Gundersen, Neocortical neuron number in humans. Effect of sex and age, in Journal of comparative neurology, 1997, 384, pp. 312-20.
D.C. van Essen, A tension-based theory of morphogenesis and compact wiring in the central nervous system, in Nature, 1997, 385, pp. 313-18.
M.C. Corballis, Evolution of the human mind, in Advances in psychological science, 2° vol., Biological and cognitive aspects, ed. M. Sabourin, F.I.M. Craik, M. Robert, Hove 1998, pp. 31-62.