chemotrasduzione
chemotrasduzione
La chemotrasduzione è un processo attraverso il quale uno stimolo chimico esterno a una cellula viene convertito in un segnale interno a essa, ossia in una risposta cellulare. In particolare, la chemotrasduzione olfattiva e quella gustativa sono processi attraverso i quali le cellule recettoriali olfattive e gustative convertono il contatto con specifiche sostanze chimiche in segnale nervoso: solo le molecole con caratteristiche tali da poter essere trasdotte dalle cellule recettoriali olfattive o gustative evocano sensazioni olfattive o gustative. La chemotrasduzione è effettuata anche da cellule nocicettive, sensibili a stimoli chimici, che evocano sensazioni dolorifiche, e da cellule non sensoriali, che fungono da sensori per molecole quali CO2 o O2, allo scopo di mantenere sotto controllo le variabili cruciali per la sopravvivenza dell’organismo.n [➔ gusto; olfatto; recettore nervoso; trasduzione] Nella c. gli stimoli chimici che provengono dall’ambiente sono trasformati in segnali e risposte cellulari. La c. ha particolare importanza nella trasduzione dei segnali olfattivi e gustativi.
La chemotrasduzione olfattiva
La capacità di identificare la presenza di sostanze odorose è essenziale per la sopravvivenza sia dei singoli individui sia delle specie. Il sistema olfattivo identifica migliaia di sostanze odorose diverse, con sensibilità e capacità discriminative dipendenti dalla specie. Possiamo dividere gli stimoli elaborati dal sistema olfattivo in due grandi classi: sostanze odorose, ossia piccole molecole che segnalano la presenza di cibo, pericoli (per es., fuoco) o predatori; feromoni, ossia molecole rilasciate da individui della stessa specie e che convogliano segnali sociali o sessuali. Non sempre è possibile una netta distinzione fra sostanze odorose e feromoni: per es., un feromone rilasciato da una specie può essere una sostanza odorosa per una seconda specie; allo stesso tempo, sostanze odorose possono produrre effetti comportamentali in modo simile a quanto prodotto dai feromoni, come dimostra il comportamento di alcune falene in risposta all’odore di alcuni fiori e il comportamento del gatto in risposta all’odore della Nepeta.
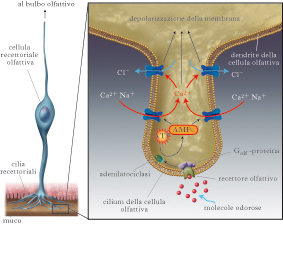
Sistema olfattivo primario e secondario.Nella maggior parte degli animali si sono sviluppati due sistemi olfattivi, il sistema olfattivo principale e il sistema olfattivo secondario o accessorio. Il primo è il responsabile della percezione olfattiva; alla base di questa capacità ci sono le cellule recettoriali olfattive (o chemorecettori olfattivi) dell’epitelio nasale olfattivo, le quali esprimono i recettori olfattivi (RO), in grado di trasdurre il segnale delle sostanze che percepiamo come odorose. Il secondo è specializzato nella detezione di segnali olfattivi specie-specifici, principalmente feromoni, attraverso l’organo vomeronasale (OVN), localizzato in basso nelle cavità nasali e contenente cellule chemorecettoriali che esprimono recettori per i feromoni. La presenza e funzionalità dell’OVN nell’uomo è molto controversa. Le cellule recettoriali olfattive (CRO) del sistema olfattivo principale sono situate in profondità nella parte superiore delle cavità nasali. Circa 6÷10 milioni di CRO, insieme a cellule di supporto e a cellule basali, formano un neuroepitelio, l’epitelio olfattivo, che riveste una serie di rilievi cartilaginosi chiamati turbinati. Nei vertebrati le CRO sono neuroni sensoriali primari, in grado di svolgere il compito della c. e dotati di assone per trasmettere il segnale ai centri superiori. Le CRO sono neuroni bipolari con un singolo dendrite che si estende fino alla superficie del neuroepitelio e termina con un rigonfiamento, a guisa di pomello, dal quale si proiettano 20÷30 cilia molto sottili. Queste cilia, immerse nel muco che riveste l’epitelio, sono il sito in cui si svolge la chemotrasduzione. Dal polo opposto a quello da cui emerge il dendrite, emerge il sottile assone, che proietta direttamente al bulbo olfattivo attraversando la lamina cribrosa. Le molecole odorose si dissolvono nel muco e possono così entrare in contatto con le cilia. Il primo passo verso la c. è il legame delle molecole odorose con i RO presenti sulla membrana delle cilia delle CRO, che determina un cambiamento del potenziale di membrana delle CRO in senso depolarizzante, detto potenziale di recettore (PdR). L’ampiezza del PdR aumenta in funzione dell’aumento del numero di molecole odorose. Se il PdR è di ampiezza sufficiente si innesca un potenziale d’azione nelle CRO il quale, viaggiando lungo l’assone, giungerà al bulbo olfattivo, dove determina il rilascio di un neurotrasmettitore dal terminale assonico delle CRO sul suo bersaglio sinaptico, un neurone del bulbo olfattivo. In questo modo l’informazione inizierà a essere elaborata lungo le vie olfattive.
La detezione degli odori. Come detto, il sistema olfattivo discrimina fra migliaia di sostanze odorose diverse. Questa capacità si basa sia sulla molteplicità dei RO sia sui processi di codifica e di elaborazione dell’informazione provenienti dalle diverse CRO. Qui ci occuperemo solo della c. e quindi dei RO. La detezione delle sostanze odorose nei mammiferi è mediata da diverse centinaia di RO espressi nelle cilia delle CRO. I geni che codificano i RO sono stati scoperti da Linda Buck e Richard Axel nel 1991. Buck e Axel identificarono una famiglia di circa 1.000 geni nell’epitelio olfattivo di ratto. Studi successivi hanno identificato la presenza della famiglia di geni dei RO in moltissime altre specie, incluso l’uomo. I geni dei RO costituiscono la più grande famiglia di geni di cui si conosce l’esistenza nei mammiferi (sono circa il 2% del genoma). Il topo, che fa un forte affidamento sul senso dell’olfatto, ha circa 1.200 di questi geni, la maggior parte dei quali codifica proteine funzionali. Nell’uomo invece, in cui l’olfatto non è il senso principale, quasi due terzi dei circa 1.000 geni dei RO hanno accumulato mutazioni che li rendono inutili. Sembrerebbe che i primati siano andati via via perdendo RO funzionali dal momento in cui la visione tricromatica si è evoluta e la vista è diventata il senso principale. Questi dati indicano comunque che anche l’uomo è in grado di riconoscere numerosissime sostanze odorose in quanto ha mantenuto nel genoma un numero elevato di geni che codificano i RO. Questo fatto suggerisce una differenza concettuale fra l’olfatto e gli altri sistemi sensoriali. La visione dei colori nell’uomo, per es., consente i discriminare fra diverse centinaia di tinte con solo tre tipi di proteine recettoriali visive, i fotopigmenti, espressi ciascuno da uno dei tre tipi di coni, fotorecettori presenti nella retina (➔ fototrasduzione; visione). La percezione olfattiva richiede invece un gran numero di RO: alcuni sono in grado di riconoscere un numero abbastanza vasto di sostanze odorose, altri sono invece più selettivi e ne riconoscono solo un piccolo numero, tra loro strettamente imparentate. Quindi, ciascun RO ha uno spettro distinto di molecole odorose a cui si lega e ciascuna molecola odorosa può essere identificata da una combinazione di RO.
La cascata di eventi che portano alla depolarizzazione delle cellule recettoriali. Una volta che il RO ha legato una molecola odorosa, ha inizio una cascata di eventi che trasforma l’energia chimica di questo legame nella depolarizzazione della CRO. Il RO che ha legato una molecola odorosa attiva una proteina appartenente alla classe delle proteine G, presente solo nelle CRO, detta Golf,, che a sua volta attiva un enzima, l’adenilatociclasi di tipo 3 (ACIII). La ciclasi converte una molecola intracellulare molto abbondante, l’adenosintrifosfato (ATP), in adenosinmonofosfato ciclico (AMPc), che agisce da secondo messaggero (il primo messaggero è la molecola odorosa). L’AMPc è in grado di legarsi a specifici canali ionici sulla membrana delle cilia. Questi canali sono normalmente chiusi, ma, in seguito al legame con nucleotidi ciclici quali l’AMPc, si aprono e consentono l’ingresso di Na+ e Ca2+. L’ingresso di quest’ultimo attraverso i canali aperti da AMPc causa l’apertura di canali Cl- sensibili al Ca2+, determinando l’uscita del Cl-, in quanto le CRO mantengono una concentrazione intracellulare di Cl- inusualmente alta per una cellula nervosa (probabilmente attraverso l’azione di una pompa di membrana), per cui lo ione Cl- tende a uscire dalla cellula. La combinazione di ingresso di Na+ e Ca2+e di uscita di Cl- depolarizza la CRO, causando un PdR. Il fenotipo anosmico (mancanza parziale o totale di olfatto) di topi in cui sono stati eliminati i geni che codificano i diversi componenti di questa cascata di trasduzione indica che la via dell’AMPc sopra descritta gioca un ruolo cruciale nella c. olfattiva. Tuttavia, è stato dimostrato che in una piccola percentuale di CRO, sensibili anche a feromoni, il legame di una sostanza odorosa con i RO espressi sulla membrana delle cilia non attiva la via dell’AMPc, ma cascate intracellulari diverse, che conducono comunque a un PdR. La presenza della cascata di eventi intracellulari tipica di una via a secondo messaggero determina un’amplificazione del segnale. Si può stimare che il legame di una molecola odorosa a un RO possa attivare decine di proteine Golf, ciascuna delle quali attiva una molecola di ACIII capace di produrre circa un migliaio di molecole di AMPc, le quali, a loro volta, determinano l’apertura di centinaia di canali ionici. Una singola molecola odorosa può produrre un PdR misurabile in una CRO, anche se non sufficiente a innescare un potenziale d’azione e quindi a inviare il messaggio ai centri superiori, determinando la percezione cosciente dell’odore. L’ingresso di Ca2+ attraverso i canali aperti da AMPc ha un ruolo importante nel processo di adattamento. L’aumento della concentrazione del Ca2+ intracellulare durante la risposta a una sostanza odorosa, agisce anche sullo stesso canale da cui il Ca2+ entra, riducendone la sensibilità all’AMPc. La sensibilità olfattiva per quell’odore risulterà quindi molto ridotta perché l’amplificazione della c. è ridotta. Altri processi intracellulari, che agiscono sia sul canale sensibile all’AMPc sia sul RO, contribuiscono a ridurre l’amplificazione della c. in presenza di una sostanza odorosa legata al RO, cooperando all’adattamento. Il processo di adattamento nelle CRO serve a conciliare la possibilità di rispondere a piccoli cambi di concentrazione di una sostanza odorosa, che richiedono un elevato guadagno del processo di c., con la necessità di evitare la saturazione già a basse concentrazioni, che sarebbero appunto conseguenza di un guadagno elevato fisso. La soluzione è un guadagno variabile del processo di c. in funzione della quantità di odorante presente, che mantiene la sensibilità al variare della concentrazione attraverso una vasta gamma di concentrazioni di partenza. Ecco spiegato perché entrando in un stanza possiamo avvertire la presenza di un odore che non viene avvertito da coloro che sono nella stanza da diverso tempo e noi stessi, dopo pochi secondi, non avvertiremo più la presenza di quell’odore. Le CRO sono selettive per gli odori: ciascuna di esse esprime solamente uno dei mille geni che codificano i RO. Gli studi di Peter Mombaerts e collaboratori nel 1996 e di Andrea Rinaldi nel 2007 hanno dimostrato come tutte le CRO che esprimono un particolare RO, indipendentemente dal punto dell’epitelio olfattivo in cui si trovano, convergano su un solo bersaglio nel bulbo olfattivo. Si crea quindi una mappa topografica nel bulbo olfattivo sulla quale la distribuzione dei siti attivati identifica un odore (➔ olfatto).
La chemotrasduzione gustativa
Il gusto (➔) consente di valutare il contenuto nutrizionale del cibo (per es., il sapore dolce segnala cibi ad alto contenuto energetico) e di prevenire l’ingestione di sostanze tossiche. Il gusto, insieme all’olfatto, che determina in modo cruciale il sapore percepito, ha il pregio aggiuntivo di contribuire al piacere legato al nutrirsi. Noi siamo in grado di percepire una vasta gamma di sostanze come dotate di sapore, ma, qualitativamente, le sensazioni di sapore si raggruppano in poche, ben definite sensazioni: dolce, amaro, aspro, salato e umami. Quest’ultima è una parola giapponese («sapore delizioso») che denota il gusto sapido della carne, gusto principalmente legato, nell’uomo, alla presenza di L-amminoacidi quali il monosodio L-glutammato e l’aspartato, nonché l’analogo del glutammato, L-AP4. Anche se può apparire modesto, questo repertorio soddisfa efficacemente la necessità di riconoscere e di distinguere componenti dietetiche chiave.
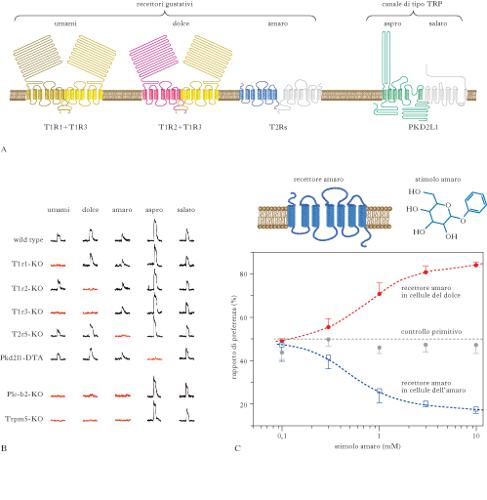
La detezione dei sapori. Il substrato anatomico e l’unità di base della detezione dei sapori sono le cellule recettoriali gustative (CRG). Si tratta di cellule recettoriali non neuronali che operano la trasduzione gustativa e, attraverso il rilascio di un neurotrasmettitore, inviano il segnale risultante dal processo di c. alle cellule nervose da cui sono innervate; queste provvedono a generare potenziali d’azione i quali, viaggiando lungo il loro assone, convogliano l’informazione lungo le vie gustative fino alla percezione cosciente del sapore. Le CRG sono in strutture chiamate bottoni o calici gustativi, le quali si distribuiscono tra le diverse papille gustative della lingua e dell’epitelio del palato. In seguito al contatto tra alcune sostanze e la parte apicale della CRG, che si prolunga fino al poro gustativo, la CRG varia il suo potenziale di membrana; questa variazione (PdR) è il segno che la CRG è stata attivata dalla sostanza chimica, che quindi avrà un sapore. Il modo più semplice di detezione degli odori sarebbe quello di far riconoscere i cinque gusti da CRG diverse, ciascuna specializzata per un gusto. Con questo tipo di codifica alla periferia, si genererebbero fin dall’inizio segnali indipendenti per ciascun gusto, che viaggerebbero lungo vie neurali diverse (ipotesi della linea marcata). Un’ipotesi alternativa, quella prevalente a partire dagli anni Novanta del secolo scorso, propone che le CRG siano solo debolmente selettive per i diversi gusti, in quanto ciascuna di esse esprimerebbe tipi diversi di RG e il riconoscimento di un gusto deriverebbe dalla decodifica dell’attività combinata di diverse classi di CRG. I cinque gusti sono usualmente divisi in due gruppi. Un gruppo è costituito da dolce, amaro e umami ed è caratterizzato dal fatto che la c. coinvolge recettori gustativi (RG) accoppiati a proteine G, come per la c. olfattiva; di conseguenza, dopo aver legato le sostanze per cui sono selettivi, questi recettori attivano una proteina G che, a sua volta, attiva processi intracellulari che determinano l’apertura di canali ionici di membrana, con conseguente passaggio di ioni, variazione del potenziale di membrana e rilascio di neurotrasmettitore. Nel gruppo comprendente il salato e l’aspro invece, la c. non coinvolge RG e sistemi a secondo messaggero, in quanto le sostanze agiscono direttamente sui canali ionici di membrana. Dolce, amaro e umami. Nella c. relativa al primo gruppo sono coinvolte due famiglie di recettori accoppiati a proteine G, ossia T1R (composta da tre diversi RG legati alla trasduzione del dolce e dell’umami) e T2R (composta da circa trenta RG legati alla trasduzione dell’amaro). I dati attuali suggeriscono che il legame ai recettori T1R o T2R attiva una proteina G specifica per le CRG, la gustducina, la quale, attivando l’enzima fosfolipasi C2, determina la produzione di due secondi messaggeri, i quali conducono all’apertura di canali ionici di membrana specifici per le cellule gustative (noti come TRPM5). Topi con delezione della gustducina, della PLC-2 o dei canali ionici TRPM5 presentano gravi deficit nelle risposte delle cellule gustative e nelle sensazioni di dolce, amaro e umami, mentre non presentano alcun deficit nelle sensazioni di salato e aspro, dimostrando che questi due gruppi di gusti utilizzano diverse modalità di trasduzione e lavorano indipendentemente. La combinazione di T1R3 e T1R3 sembra formare l’RG per il dolce in grado di rispondere a tutte le classi di sostanze dolci. La delezione combinata dei T1R2 e T1R3 abolisce qualunque sensazione gustativa, ma già la delezione di T1R2 o T1R3 causa un fortissimo deficit nella percezione del dolce. Un’ulteriore prova a favore del ruolo dei recettori T1R per il dolce viene dalla recente scoperta che i felini, che non rispondono al dolce, hanno una delezione naturale del gene T1R2. La combinazione di T1R1 e T1R3 forma un RG con una discreta selettività per gli L-amminoacidi, suggerendo che le CRG esprimenti tali recettori sono cellule che rispondono all’umami. Nell’uomo, il complesso T1R1 e T1R3 risponde selettivamente al monosodio L-glutammato, all’aspartato e all’L-AP4, con una sensibilità che ricapitola i dati psicofisici che nell’uomo sono relativi al gusto dell’umami. La delezione di T1R1 o T1R3 determina un’enorme perdita del gusto dell’umami e di ogni preferenza per cibi con tale gusto. Le prove più convincenti del ruolo dei T2R per la trasduzione del gusto amaro vengono da esperimenti di delezione o inserzione genica. La mancanza di uno specifico T2R provoca una specifica mancanza di gusto per la sostanza che a esso si lega; viceversa, i topi che esprimono un RG umano che lega una sostanza amara a cui i roditori sono insensibili diventano sensibili a essa e la evitano. Le CRG esprimono la maggior parte, se non tutti, dei T2R, funzionando quindi da cellule recettoriali in grado di rispondere alla maggior parte delle sostanze amare.
Salato e aspro. Numerosi studi hanno dimostrato che sostanze salate o aspre (che contengono acidi) modulano la funzione delle CRG attraverso l’ingresso, rispettivamente, di Na+ e protoni (H+) attraverso canali di membrana specializzati. Nel caso del salato, l’attivazione delle CRG sembra avvenire attraverso l’ingresso di Na+ che entra da canali ionici sensibili all’amiloride. Tuttavia non c’è ancora consenso sul cosiddetto recettore del salato. Per l’aspro sono stati invece proposti, come meccanismi di c., l’attivazione di diversi tipi di canali ionici sensibili ai protoni o di pompe ioniche. Angela L. Huang e collaboratori nel 2006 hanno dimostrato che specifici canali ionici di tipo TRP (chiamati PKD2L1), simili a quelli che mediano il PdR nella trasduzione di dolce, amaro e umami, svolgono un ruolo cruciale nella trasduzione dell’acido. Le evidenze attuali mostrano che le CRG esprimono selettivamente una classe di RG o di canali ionici per il salato o l’acido sopra descritti, fungendo quindi da detettori specializzati per ciascun gusto. Questo favorisce grandemente l’ipotesi della linea marcata. Ulteriori prove a favore di tale ipotesi sono venute da esperimenti recenti nel topo (eseguiti da Ken L. Mueller e collaboratori nel 2005). Per es., introducendo nelle CRG per il dolce il recettore per una sostanza sintetica normalmente priva di sapore per il topo si determina la comparsa di una forte preferenza gustativa degli animali per questa sostanza; questo dimostra che l’attivazione delle CRG per il dolce, e non l’attivazione del RG per il dolce, produce la sensazione di dolce e che è sufficiente attivare un solo tipo di CRG per produrre una sensazione gustativa specifica. A conferma di ciò, se questo recettore viene introdotto nelle CRG per l’amaro, gli animali mostrano forte avversione gustativa per la sostanza sintetica. Non c’è ancora consenso, tuttavia, sull’ipotesi della linea marcata. Un lavoro del 2009 (Jayaram Chandrashekar e collaboratori) ha mostrato che la nostra capacità di percepire il gusto delle bevande frizzanti dipende dalla presenza di CRG che rispondono al CO2 in maniera affidabile e dose-dipendente. Queste cellule appartengono alla classe delle CRG sensibili all’acido ed è la generazione di protoni extracellulari il segnale che media il gusto del CO2. Nicoletta Berardi