Chirurgia cardiaca e vascolare
Chirurgia cardiaca e vascolare
Fino agli inizi del secolo scorso il cuore era considerato inviolabile da un punto di vista chirurgico. In effetti, con l’eccezione di interventi più propriamente vascolari, effettuati per la correzione del restringimento dell’aorta (coartazione aortica), per la chiusura del dotto arterioso di Botallo pervio, per migliorare l’ossigenazione dei bambini affetti da cardiopatia cianogena (tetralogia di Fallot, una malformazione cardiaca congenita) o per il trattamento degli aneurismi dell’aorta toracica e addominale, la cardiochirurgia ha avuto grande espansione solo dopo l’introduzione nel 1953 della circolazione extracorporea. Da allora, grazie anche alla messa a punto di metodiche di protezione miocardica, milioni di persone sono state sottoposte con successo a interventi cardiochirurgici a cuore aperto.
In circa cinquant’anni ci sono stati notevoli progressi e sviluppi: il cuore, non più ‘intoccabile’, è stato fermato, aperto, si è operato al suo interno, è stato rivascolarizzato, è stato completamente sostituito con il trapianto. Grazie alle innovazioni introdotte, è diventato possibile trattare con successo gravi patologie spesso mortali o comunque fortemente invalidanti (poiché provocano dolore anginoso e affanno), quali la cardiopatia ischemica e le complicanze dell’infarto miocardico, le valvulopatie, gli aneurismi dell’aorta toracica, i tumori del cuore. Anche le più complesse cardiopatie congenite sono oggi riparabili, ed è possibile eseguire interventi a cuore battente, talora attraverso piccole brecce di accesso (minitoracotomia); inoltre, sono stati fatti tentativi di interventi a distanza con robot teleguidato.
È poi in costante aumento il numero di interventi eseguiti in pazienti anziani, anche ultraottantenni, e con molteplici fattori di rischio cardiovascolare come il diabete, l’ipertensione arteriosa, le dislipidemie, il fumo e con le patologie più di frequente associate, quali l’insufficienza respiratoria e renale, l’obesità e i problemi circolatori diffusi.
Giunta a quasi un secolo di vita, la chirurgia cardiaca e vascolare è comunque in continua evoluzione. I successi nel trattamento di pazienti precedentemente considerati intrattabili – perché già in uno stato eccessivamente debilitato – testimoniano di una pratica chirurgica sempre più sicura e sempre meno invasiva, che si giova anche degli sviluppi in altri campi della chirurgia, di nuove metodiche operatorie nonché della creazione di biomateriali. Gli impianti di protesi cardiache e vascolari, realizzati con tecniche innovative e anche grazie al ricorso a nuove soluzioni ingegneristiche e all’attento studio della dinamica fisica del circolo sanguigno, stanno ampliando l’indicazione chirurgica per numerose patologie. Inoltre, lo sviluppo della chirurgia in questo ambito sta progressivamente riducendo la necessità di terapie farmacologiche, migliorando la qualità della vita dei pazienti. I trial clinici hanno inoltre confermato che l’approccio chirurgico ha notevole validità anche a lungo termine, dimostrando una mortalità intraoperatoria ormai relativamente contenuta e tassi alti di sopravvivenza negli anni successivi. La capacità di implementare rapidamente le innovazioni della ricerca biomedica di base (per es., il trapianto di cellule staminali per la terapia dell’infarto del miocardio), nonché il miglioramento delle tecniche diagnostiche e interventistiche che consentano di intervenire rapidamente, minimizzando i danni per il paziente, rappresentano le principali sfide future per la chirurgia cardiovascolare.
La nascita della chirurgia cardiacae vascolare
Si deve ad Alexis Carrel e a Rudolph Matas l’introduzione e lo sviluppo della chirurgia vascolare; il primo ebbe il premio Nobel nel 1912 per l’introduzione delle tecniche di anastomosi vascolari, mentre Matas tra il 1888 e il 1940 aveva eseguito oltre 600 interventi tra anastomosi, riparazioni postraumatiche di arterie, suture di aneurismi, ricostruzioni delle arterie con protesi tubulari. Nel 1951 Charles Dubost effettuava il primo intervento di resezione di un aneurisma dell’aorta addominale utilizzando come innesto tubulare un omoinnesto arterioso. Due anni dopo, Michael E. DeBakey e Denton Cooley eseguivano il primo intervento di resezione di un voluminoso aneurisma dell’aorta toracica discendente. Alla fine del decennio, DeBakey, Cooley e Stanley Crawford standardizzavano le tecniche di resezione degli aneurismi dell’aorta toracica e toracoaddominale con l’ausilio della circolazione extracorporea.
Più antica è invece la chirurgia cardiaca. Il primo intervento risale probabilmente al 1893, quando Daniel Hale Williams a Chicago suturava una ferita cardiaca da trauma in un ragazzo di 24 anni. Nel 1908 Frederic Trendelenburg effettuava a cuore chiuso la prima embolectomia dell’arteria polmonare, un intervento che nel 1961 fu realizzato da Edward H. Sharp utilizzando la circolazione extracorporea. La tecnica di pericardectomia (l’asportazione totale o parziale del pericardio) fu descritta nel 1912 da Ludwig Wilhelm Carl Rehn, sebbene già nel 1761 Giovan Battista Morgagni avesse descritto i segni della compressione cardiaca dovuti a pericardite cronica costrittiva.
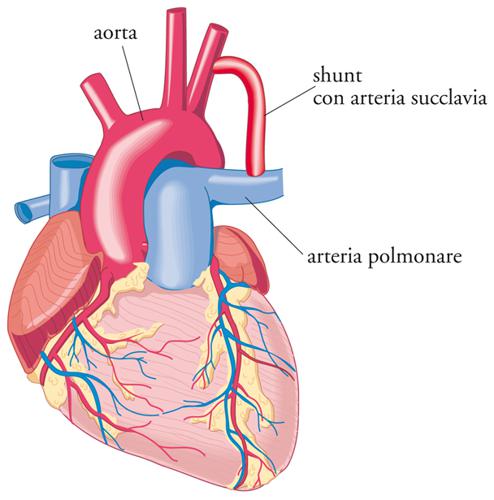
Gli esordi della chirurgia valvolare cardiaca si possono far risalire al 1912 quando Theodore Tuffier dilatava digitalmente una valvola aortica stenotica. Il primo intervento di valvulotomia polmonare veniva effettuato da Thomas H. Sellors nel 1947 in un bambino affetto dalla tetralogia di Fallot, mentre Charles Bailey nel 1948 proponeva la valvulotomia mitralica per stenosi. Il trattamento chirurgico delle cardiopatie congenite iniziava nel 1938 ad opera di Robert Edward Gross al Boston Children’s Hospital che eseguiva con successo la legatura del dotto arterioso di Botallo pervio. Tra il 1944 e il 1945, Clarence Crafoord a Stoccolma e Gross a Boston eseguivano i primi interventi di resezione della coartazione aortica. Nel 1944 veniva introdotto l’intervento di Blalock-Taussig per il trattamento della tettralogia di Fallot: una bambina di 15 mesi cianotica a causa di tale malformazione, veniva sottoposta da Alfred Blalock al Johns Hopkins Hospital a intervento di shunt sistemico-polmonare, al fine di incrementare il flusso in arteria polmonare e migliorare l’ossigenazione del sangue (fig. 3).
Si deve, come detto, a John H. Gibbon una tappa fondamentale: l’avvento della chirurgia a cuore aperto con lo sviluppo e la successiva applicazione clinica della circolazione extracorporea mediante la macchina cuore-polmoni. Per venti anni Gibbon aveva lavorato al progetto di una macchina cuore-polmoni nei laboratori del Massachusetts General Hospital, della Pennsylvania University e della Thomas Jefferson University, e il 6 maggio 1953 effettuò il primo intervento in circolazione extracorporea: la chiusura di un difetto del setto interatriale, in una ragazza di 18 anni. Iniziava così l’era della chirurgia a cuore aperto, una rivoluzione per la chirurgia cardiaca che estese la possibilità di trattamento chirurgico a pressoché tutte le malattie cardiovascolari.
Dopo una lunga sperimentazione animale negli anni Cinquanta e Sessanta a opera essenzialmente di Vladimir Demikhov in Russia e di Norman Shumway negli Stati Uniti, il 3 dicembre del 1967 a Città del Capo (Sudafrica) Christian Barnard stupiva il mondo effettuando il primo trapianto cardiaco in un paziente di 54 anni, Lewis Washkansky, affetto da grave insufficienza cardiaca postinfartuale. Il paziente morì dopo 18 giorni, ma all’autopsia il cuore trapiantato appariva normale e la morte era dovuta a infezione polmonare da immunosoppressione. Il 2 gennaio 1968, Barnard eseguiva con successo il suo secondo trapianto cardiaco: entro l’anno furono effettuati nel mondo altri 100 trapianti. Oggi l’intervento ha un basso rischio (mortalità operatoria 5%) e una sopravvivenza a distanza molto soddisfacente (ca. 50% a 10 anni).
Cenni di anatomia e fisiologiadel cuore
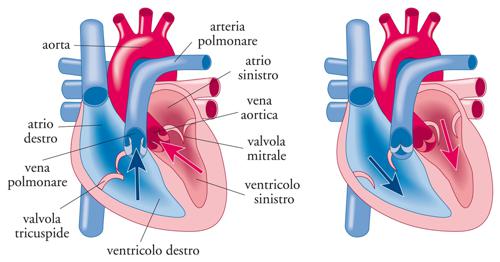
Il cuore è un organo muscolare contrattile irrorato da due arterie coronarie, la destra e la sinistra. È composto da quattro camere: l’atrio destro, il ventricolo destro, l’atrio sinistro e il ventricolo sinistro. Le cavità cardiache di destra sono separate da quelle di sinistra da due setti, il setto interatriale e il setto interventricolare. Funzionalmente, il cuore è una doppia pompa idraulica (ventricolo destro e sinistro) che fa circolare il sangue in tutto il nostro organismo. L’atrio destro riceve il sangue venoso desaturato di ossigeno dalla periferia e si svuota attraverso la valvola tricuspide nel ventricolo destro che con la sua contrazione (sistole) lo invia tramite la valvola polmonare e quindi l’arteria polmonare ai polmoni, dove si ossigena. L’atrio sinistro riceve il sangue ossigenato dai polmoni e attraverso la valvola mitralica si svuota il ventricolo sinistro che, contraendosi, lo spinge nel circolo generale sistemico attraverso l’aorta o arteria magna, ossigenando tutti i tessuti periferici (fig. 4).
Le camere pompanti nel cuore sono i ventricoli (destro e sinistro), mentre la direzionalità del flusso è assicurata dalle valvole cardiache, due per ogni ventricolo, una in entrata e una in uscita. Le valvole del ventricolo destro sono la tricuspide (in entrata) e la polmonare (in uscita), quelle del ventricolo sinistro la mitrale (in entrata) e l’aortica (in uscita).
La circolazione extracorporea
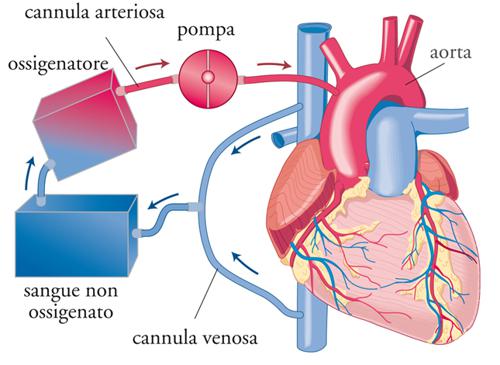
La maggior parte degli interventi di cardiochirurgia sono effettuati a cuore aperto con l’ausilio della circolazione extracorporea, una metodica con la quale la funzione di pompa del cuore e respiratoria dei polmoni sono temporaneamente sostituite dalla cosiddetta macchina cuore-polmoni. In questo modo si può escludere il cuore naturale dal circolo e aprire le cavità cardiache. Il principio della circolazione extracorporea si basa sul ‘bypassare’ il cuore e i polmoni: il sangue desaturato di ossigeno che proviene dalle vene cave viene drenato all’esterno dell’organismo nel circuito extracorporeo. Qui il sangue viene ossigenato per mezzo di un ossigenatore esterno e pompato in aorta (sangue arterioso), perfondendo così il circolo sistemico (fig. 5). Utilizzando l’eparina si evita la coagulazione del sangue quando questo viene a contatto con le superfici esterne (cannule, ossigenatore, filtri, aspiratori ecc.), riducendo al minimo la possibile formazione dei trombi.
La protezione miocardica: la cardioplegia
Mediante la circolazione extracorporea viene assicurata l’adeguata perfusione di tutti gli organi, tranne il cuore stesso che, escluso necessariamente dal circolo, è esposto durante l’intervento al rischio di danno da ischemia. A tal fine sono state proposte diverse metodiche di protezione, tra le quali la più utilizzata è la cardioplegia farmacologica, con infusione di soluzione potassica, preferibilmente ematica, nelle coronarie che consente di arrestare il cuore flaccido nella fase di diastole. Si minimizza così il rischio che l’organo soffra danni irreversibili, in modo che possa riprendere a contrarsi normalmente a fine intervento.
Le tecniche operatoriein chirurgia cardiaca e vascolare
La chirurgia dei vasi si basa essenzialmente su due tecniche operatorie: le suture e anastomosi vascolari e le endoarterectomie (disostruzioni delle arterie). Inoltre, soprattutto in chirurgia cardiaca, si possono impiantare protesi più o meno complesse (patch, tubi, valvole e anelli valvolari, pacemaker, defibrillatori ecc.).
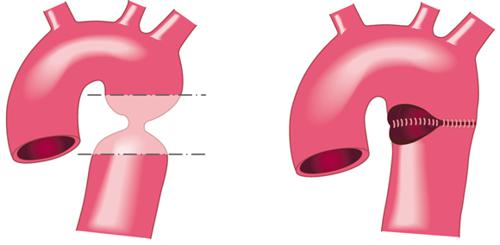
Le anastomosi vascolari consentono di ristabilire l’integrità e la continuità dei vasi sanguigni a tutti i livelli. Di conseguenza rappresentano il presupposto essenziale sia della chirurgia vascolare propriamente detta (che coinvolge l’aorta addominale e i suoi rami, i tronchi epiaortici e le arterie periferiche degli arti superiori e inferiori), sia di quella cardiaca, che interessa le coronarie e le grandi arterie (cioè l’aorta toracica ascendente, l’arco e l’aorta toracica discendente). Le anastomosi vascolari possono essere termino-terminali (l’anastomosi viene eseguita tra gli estremi terminali di due arterie o di un’arteria e una protesi tubulare), termino-laterali (tra estremo terminale di un’arteria e porzione laterale e non terminale di un’altra arteria), o meno frequentemente latero-laterali. Un esempio di anastomosi termino-terminale è la ricostruzione dell’aorta toracica dopo coartectomia con anastomosi diretta dei due capi (fig. 6), o la sostituzione dell’aorta ascendente aneurismatica con una protesi tubulare e due anastomosi termino-terminali (fig. 7). Un esempio tipico di anastomosi termino-laterale è il bypass coronarico, in cui l’estremità terminale dell’innesto (arteria mammaria interna o vena safena) viene suturata all’incisione laterale nella coronaria. Le anastomosi termino-laterali consentono di bypassare le ostruzioni delle arterie coronarie o periferiche (per es., la stenosi di un’arteria dell’arto inferiore). L’endoarterectomia consiste nella rimozione dello strato interno della parete arteriosa interessata dall’aterosclerosi, consentendo così la disostruzione del vaso. Mediante endoarterectomia è possibile trattare processi aterosclerotici estesi delle arterie coronarie, nonché ostruzioni carotidee o arteriose periferiche.
La chirurgia di rivascolarizzazione miocardica (bypass coronarico)
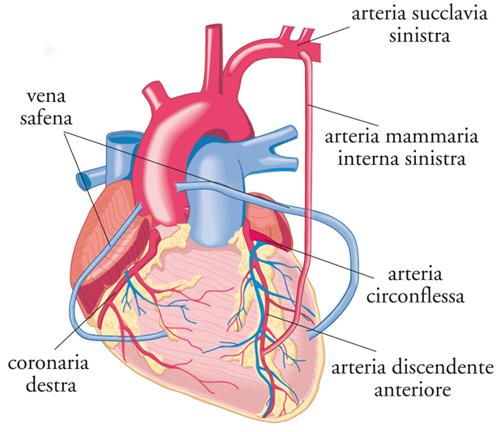
Le coronarie sono arterie che originano dall’aorta subito al di sopra del piano valvolare, e hanno la funzione di portare il sangue al muscolo cardiaco. Il tronco comune della coronaria sinistra dà origine al ramo discendente anteriore, responsabile di più del 50% dell’irrorazione del miocardio ventricolare sinistro (parete anteriore, anterolaterale, setto interventricolare anteriore e apice), e all’arteria circonflessa che con i suoi rami del margine ottuso irrora la parete laterale e posteriore del ventricolo sinistro. La coronaria destra irrora la parete inferiore del cuore, il setto interventricolare posteriore e il ventricolo destro.
La cardiopatia ischemica è determinata da un’ostruzione, in genere aterosclerotica, delle coronarie. Il flusso costante e ininterrotto di sangue ossige-nato attraverso le coronarie è indispensabile per il mantenimento di un’attività cardiaca efficace, in quanto il cuore non cessa mai di lavorare e non è in grado di immagazzinare energia. La presenza quindi di una stenosi ≥50% del tronco comune della coronaria sinistra o di stenosi ≥70% di uno o più dei tre rami coronarici principali (discendente anteriore, circonflessa, coronaria destra) comporta una riduzione significativa del flusso di sangue a valle della stenosi, provocando ischemia miocardica che si traduce clinicamente con manifestazione di dolore toracico o angina pectoris da sforzo di vario grado oppure anche a riposo. La permanente critica riduzione o interruzione del flusso provoca la necrosi, cioè l’infarto del tessuto miocardico, avvertito in genere dal paziente con dolore violento, sudorazione algida, sensazione di morte.
Nel 1962 Frank Mason Sones, presso la Cleveland Clinic riuscì a visualizzare angiograficamente le coro-narie e a evidenziare le ostruzioni che ne ostacolavano il flusso sanguigno. Pochi anni dopo, René Favaloro, un cardiochirurgo argentino di origine italiana, che lavorava nello stesso istituto, proponeva di aggirare (bypassare) le ostruzioni coronariche con dei ‘ponti’ in vena safena, prelevata dagli arti inferiori del paziente stesso. Nasceva così la chirurgia di rivascolarizzazione miocardica, fondata sul bypass coronarico (CABG, Coronary artery bypass graft) che da circa 35 anni è l’intervento chirurgico maggiore più diffuso nel mondo occidentale. La sua diffusione è stata giustificata dagli ottimi risultati clinici in termini di sopravvivenza e libertà da eventi sfavorevoli a distanza.
L’intervento di CABG prevede il prelievo dell’arteria mammaria interna dalla fascia endotoracica e/o della vena safena dall’arto inferiore del paziente stesso. Con l’aiuto della macchina cuore-polmoni, il chirurgo esegue quindi il/i bypass dopo aver praticato una piccola incisione della/e coronaria/e a valle dell’ostruzione, suturando alla coronaria l’arteria mammaria nella sua estremità distale o il segmento di vena safena. L’estremità prossimale della vena safena viene poi suturata all’aorta ascendente, da cui il sangue, attraverso la vena stessa raggiunge l’arteria coronaria, mentre l’estremità prossimale dell’arteria mammaria è già naturalmente collegata al sistema arterioso (all’arteria succlavia) (fig. 8).
L’efficacia del CABG rispetto alla sola terapia medica per il trattamento della cardiopatia ischemica è stata valutata da tre grandi trials randomizzati degli anni Ottanta in Europa e negli Stati Uniti. Il CABG risultava essere la metodica più efficace nel garantire migliore sopravvivenza e libertà da eventi a lungo termine in presenza di malattia del tronco comune della coronaria sinistra (stenosi ≥50%), di malattia coronarica trivasale (discendente anteriore, circonflessa e destra), di malattia bivasale con stenosi prossimale del ramo discendente anteriore. Il beneficio della chirurgia risultava ancor più evidente in presenza di gravi sintomi per angina, prova da sforzo positiva per ischemia, ridotta funzione contrattile del ventricolo sinistro (espressa da un valore di frazione di eiezione 〈50%). Il CABG non offriva invece vantaggi superiori alla terapia medica in presenza di malattia monovasale e bivasale con buona funzione del ventricolo sinistro, senza coinvolgimento prossimale dell’arteria discendente anteriore.
Da allora, le indicazioni del CABG non hanno più avuto sostanziali modifiche e le attuali linee guida dell’American Heart Association e dell’American College of Cardiology per il trattamento della cardiopatia ischemica indicano il CABG come la terapia di scelta, rispetto alla terapia medica o alle metodiche cardiologiche invasive di rivascolarizzazione, per la malattia del tronco comune della coronaria sinistra, per la malattia coronarica trivasale e bivasale con stenosi prossimale del ramo interventricolare anteriore.
Gli innesti più frequentemente utilizzati per la rivascolarizzazione sono l’arteria mammaria interna (AMI) e la vena safena autologa. L’AMI rispetto alla vena safena si è dimostrata avere una superiore pervietà a distanza, stimata a 10 anni del 95% rispetto al 50-60% della vena safena. Quindi il suo utilizzo consente di prevedere una maggiore libertà da infarto miocardico e da reintervento: per tale motivo, particolarmente sul ramo discendente anteriore della coronaria sinistra (che è il vaso più importante ai fini prognostici perché responsabile di oltre il 50% dell’irrorazione del ventricolo sinistro) l’AMI è da preferire (fig. 8).
La maggiore pervietà dell’AMI è legata alle sue caratteristiche istologiche: la media dell’arteria può ricavare nutrimento sia dal lume che dai vasa vasorum, la lamina interna elastica è uniforme, e la vasodilatazione endotelio-dipendente consente di autoregolare il flusso. Inoltre, al contrario del graft di vena safena, il diametro dell’AMI è molto simile a quello della coronaria ricevente, consentendo un flusso più laminare a livello dell’anastomosi. Il trapianto di vena safena è invece più soggetto a processi sclerotici e degenerativi nel tempo.
Per la dimostrata migliore sopravvivenza derivante dall’uso di un’arteria mammaria interna rispetto alla vena safena, si è diffuso l’impiego della doppia arteria mammaria (generalmente la destra per il ramo discendente anteriore, la sinistra per il ramo marginale ottuso dell’arteria circonflessa) che, rispetto all’uso dell’arteria mammaria singola, si è confermato associarsi a un ulteriore miglioramento della sopravvivenza a 20 anni e a una maggiore libertà da reintervento, ridottosi da 3,5% a 0,5% annuo.
I più importanti recenti sviluppi della chirurgia coronarica sono legati essenzialmente al miglioramento delle tecniche di protezione miocardica, di emostasi, di anestesia e rianimazione, all’utilizzo estensivo dei graft arteriosi (in particolare, l’arteria mammaria interna bilaterale) e alla possibilità di eseguire interventi a cuore battente. Quest’ultima metodica, insieme ai microcircuiti di circolazione extracorporea, ha lo scopo di evitare o contenere al minimo i potenziali danni della circolazione extracorporea tradizionale sul sistema emocoagulativo e sulla funzione d’organo, ovvero interventi ibridi che prevedano un minore trauma chirurgico per il paziente. I benefici di tali tecniche e procedure sono ovviamente evidenti soprattutto in pazienti che presentino un rischio operatorio elevato, come in presenza di concomitanti patologie d’organo.
Grazie a tali progressi, nonostante la maggiore età e complessità dei pazienti, la mortalità generale per intervento di CABG è comunque rimasta stabile tra il 2 e 3%.
La chirurgia valvolare cardiaca
Il sintomo più frequentemente riferito dal paziente affetto da valvulopatia aortica o mitralica è la dispnea, che può manifestarsi inizialmente solo durante sforzi intensi, per poi insorgere a causa del progressivo peggioramento anche per sforzi minimi o a riposo. La stenosi della valvola aortica inoltre si accompagna spesso anche ad angina ed episodi sincopali.
La chirurgia delle valvole cardiache, eseguita oggi anche in pazienti novantenni, può essere di tipo sostitutivo (con protesi valvolari meccaniche o biologiche) o riparativo. La sostituzione è necessaria quando i lembi valvolari sono primitivamente malati per processi di sclerosi, calcificazione o erosioni, che impediscono una corretta apertura e chiusura della valvola. La riparazione valvolare è invece indicata in presenza di una disfunzione valvolare secondaria, con lembi sani (come nell’insufficienza aortica secondaria a dilatazione dell’anulus o dell’aorta ascendente) oppure quando la malattia primitiva dei lembi consente una chirurgia riparativa con il pieno recupero della funzionalità, come avviene nell’insufficienza mitralica degenerativa da prolasso.
La storia della chirurgia sostitutiva valvolare risale al 1960, quando Albert Starr e Lowell Edwards impiantarono con successo la protesi meccanica a ‘gabbia e palla’ in una giovane donna affetta da stenosi mitralica. Da allora le protesi valvolari hanno subito una notevole evoluzione: le attuali protesi meccaniche a doppio emidisco, sono silenziose, hanno un flusso a pieno orificio, basso profilo, caratteristiche emodinamiche eccellenti anche sotto sforzo, una durata indefinita e basso rischio tromboembolico.
Le protesi biologiche, utilizzate sin dal 1965 (si impiega soprattutto il pericardio bovino o porcino), non hanno una durata illimitata come le protesi meccaniche; tuttavia, hanno il vantaggio di una libertà da deterioramento a 15 anni molto elevata (superiore al 90%) e, diversamente dalle protesi meccaniche, non richiedono l’anticoagulazione a vita.
L’efficacia della chirurgia sostitutiva, in termini di basso rischio operatorio, di elevate sopravvivenze a distanza, di libertà da eventi cardiaci e di controllo dei sintomi, è indiscutibile; tuttavia, non esiste il sostituto valvolare ideale che non necessiti di anticoagulazione, duri un tempo indefinito, non presenti rischi di endocardite o di complicanze emorragiche e/o tromboemboliche. Pertanto, a fianco della chirurgia sostitutiva, si sono sviluppate tecniche di chirurgia valvolare riparativa (o conservativa), che potenzialmente combinano i vantaggi delle prote-si meccaniche (durevolezza) e biologiche (non trombogenicità).
L’indicazione all’intervento chirurgico tiene perciò in conto, oltre al rischio operatorio, alla sintomaticità e all’età del paziente, alle patologie associate, anche la possibilità di effettuare la riparazione valvolare.
La chirurgia della valvola aortica
La sostituzione della valvola aortica per stenosi e/o insufficienza presenta un rischio operatorio molto contenuto. In caso di stenosi, l’operazione viene eseguita sia in presenza dei sintomi (dispnea, angina, sincope), sia quando, pur non manifestandosi con sintomi evidenti, la stenosi sia di grado severo, con rischio di morte improv-visa o comunque associata ad altre patologie anch’esseindicanti un intervento (per es., malattia coronarica necessitante il CABG). Analogamente, la chirurgia per l’insufficienza della valvola aortica deve essere valutata in rapporto alla gravità dell’insufficienza stessa, dei sintomi, della dilatazione e della funzione contrattile del ventricolo sinistro e anche alla possibilità di potere effettuare un intervento riparativo o sostitutivo.
La chirurgia della valvola mitralica
Le tecniche riparative hanno attualmente un ruolo preponderante nella chirurgia dell’insufficienza mitralica. I vantaggi della riparazione rispetto alla sostituzione sono legati alla possibilità di conservare la funzione dell’apparato sospensore sottovalvolare (utile al mantenimento di una corretta geometria ellittica del ventricolo sinistro) e di evitare rischi e terapie connessi alle protesi valvolari (endocardite e tromboembolia). La possibilità di preservare meglio la geometria e quindi la funzione cardiaca è particolarmente utile nei pazienti con funzione cardiaca depressa. Per tali motivi, grazie a una migliore comprensione della fisiologia dell’apparato valvolare mitralico e all’uso dell’ecocardiografia transesofagea intraoperatoria, l’insufficienza mitralica viene trattata quasi esclusivamente con le tecniche di riparazione.
Nell’insufficienza mitralica da prolasso (che avviene quasi sempre nel lembo posteriore), il tessuto esuberante viene resecato (di norma un frammento quadrangolare), la continuità dell’anello e del lembo ricostruita con suture e quindi la forma e le dimensioni dell’orificio valvolare stabilizzate in genere con l’impianto di un anello protesico.
Nell’insufficienza mitralica secondaria a cardiomiopatia ischemica, l’impianto di un anello protesico è sufficiente a ridurre le dimensioni dell’anulus nativo e quindi l’insufficienza nella maggior parte dei pazienti.
La stenosi mitralica (definita come grave per un’area valvolare inferiore a 1,5 cm2) di origine reumatica nella maggior parte dei casi non viene trattata chirurgicamente, ma mediante metodica cardiologica invasiva di valvuloplastica percutanea, grazie alla dilatazione delle commissure con un pallone gonfiabile. La chirurgia sostitutiva viene riservata ai casi di calcificazione della valvola e/o dell’apparato sottovalvolare (corde tendinee, muscoli papillari) o di insufficienza associata a stenosi.
Per il rischio operatorio molto basso, per l’elevata libertà da reintervento e da morte cardiaca a 10 anni, nonché per gli indiscutibili vantaggi che le tecniche di riparazione presentano rispetto alla sostituzione, l’indicazione chirurgica alla riparazione risulta essere più liberale, anche in presenza di pochi sintomi, poiché l’intervento precoce previene il deterioramento della funzione cardiaca da sovraccarico volumetrico e permette di ottenere più facilmente una riparazione perfetta della valvola.
L’ablazione chirurgica della fibrillazione atriale
La fibrillazione atriale è un’aritmia spesso associata alla valvulopatia mitralica. Infatti, nella stenosi nell’insufficienza mitralica, l’elevata pressione e il volume di sangue nell’atrio sinistro comportano un’alterazione strutturale ed elettrica dell’atrio stesso. L’insorgenza della fibrillazione, oltre a causare un peggioramento dei sintomi (dispnea, cardiopalmo, astenia), comporta il rischio di embolia sistemica dovuta alla formazione di trombi che dall’atrio possono mobilizzarsi in circolo, con possibile grave danno clinico (ictus, insufficienza renale, insufficienza vascolare periferica). Con la tecnica chirurgica di ablazione è possibile con una sonda a radiofrequenza o a freddo (crioablazione) interrompere i circuiti elettrici responsabili di tale aritmia, favorendo contestualmente alla riparazione o alla sostituzione della valvola mitralica e/o aortica il ripristino del ritmo cardiaco sinusale. In effetti uno studio su 100 pazienti sottoposti a chirurgia della valvola mitralica ha mostrato che l’eliminazione della fibrillazione (70% ca. dei casi) migliora la qualità di vita rispetto ai pazienti con persistente aritmia. Il ripristino del ritmo sinusale comporta inoltre a distanza più elevate probabilità di sopravvivenza e di libertà da eventi cardiaci ed embolici cerebrali.
Trapianto cardiaco e terapia chirurgica dello scompenso
Lo scompenso cardiaco da insufficienza contrattile del cuore ha un impatto sociale molto importante in termini di necessità di cure mediche, mortalità, costi elevati. Negli Stati Uniti 5 milioni di pazienti sono affetti da scompenso cardiaco, con una prevalenza di 16 casi/1000, in Europa 10 milioni (14 casi/1000), in Italia un milione di pazienti (17 casi/1000) con un tasso di incidenza di 60.000 nuovi casi per anno. Nonostante i progressi effettuati in campo farmacologico, la mortalità a 2÷5 anni è molto elevata (50%).
Lo scompenso cardiaco può avere un’eziologia ischemica (infarti miocardici estesi e/o multipli, aneurismi postinfartuali del ventricolo sinistro) valvolare (valvulopatie in stadio avanzato) o da malattia intrinseca del muscolo cardiaco (cardiomiopatia dilatativa idiopatica). Il quadro fisiopatologico è rappresentato da una riduzione più o meno grave della funzione di pompa dei ventricoli, da cui deriva il principale sintomo, la dispnea, presente inizialmente solo durante sforzo, per poi manifestarsi anche a riposo.
L’origine e la progressione dello scompenso cardiaco di origine ischemica derivano dal processo negativo di rimodellamento ventricolare che coinvolge architettura e funzione tanto dell’area infartuata quanto di quella vitale del ventricolo sinistro. In fase precoce, l’area necrotica si assottiglia e si allunga, mentre in seguito si hanno dilatazione, ipertrofia, sfericizzazione, disfunzione del ventricolo sinistro, fino all’insufficienza cardiaca irreversibile. Le caratteristiche anatomo-cliniche sono rappresentate dalla disfunzione ventricolare severa, dalla coronaropatia ostruttiva spesso multivasale, dalla presenza di area a/discinetica della parete ventricolare, dall’insufficienza mitralica da disfunzione papillare e dilatazione anulare, sfericizzazione (perdita cioè della fisiologica geometria ellittica) del ventricolo. Le manifestazioni cliniche variano in rapporto all’entità del rimodellamento: angina, dispnea, scompenso, aritmie ventricolari.
La terapia chirurgica dello scompenso può essere di tipo sostitutivo, con il trapianto, o di tipo riparativo.
Il trapianto cardiaco è ormai noto offrire vantaggi ben documentati in termini di sopravvivenza a lungo termine. Tuttavia il limitato numero dei potenziali donatori non consente l’uso estensivo di questa chirurgia: negli Stati Uniti annualmente vengono effettuati circa 2.500 trapianti, in Italia 300. La sopravvivenza a lungo termine (10 anni) dopo il trapianto è in genere migliore nei pazienti affetti da cardiomiopatia dilatativa idiopatica rispetto a quella di origine ischemica postinfartuale (50÷55% rispetto al 30÷40%).
Il fine principale invece della chirurgia riparativa dello scompenso di origine ischemica è di ottenere il recupero della funzione contrattile attraverso la rivascolarizzazione coronarica (CABG) di aree di miocardio ipocontrattile ma vitale (miocardio ibernato), e il ripristino della geometria del ventricolo sinistro. Quest’ultimo fine può essere raggiunto mediante l’aneurismectomia ventricolare e con le varie tecniche di resezione lineare o circolare che mirano a eliminare le aree del ventricolo che presentano contrattilità alterata e non sincrona con il restante ventricolo durante la sistole (aree discinetiche) o che non contribuiscono affatto alla funzione di pompa (aree acinetiche), e a ridurre le dimensioni cardiache.
In considerazione dei risultati molto buoni ed equivalenti in termini di mortalità operatoria e di sopravvivenza a distanza del CABG e dell’aneurismectomia ventricolare, l’obiettivo attuale della chirurgia del rimodellamento è quello di trattare forme anche molto avanzate di scompenso, per le quali attualmente è indicato solamente il trapianto.
In particolari occasioni sono di estrema utilità i sistemi di assistenza ventricolare (VADs, Ventricular assist devices), ossia pompe artificiali di supporto al cuore scompensato che vengono posizionate, come un pacemaker, all’esterno del torace del paziente in attesa del trapianto cardiaco.
Il potenziale ruolo delle cellule staminali nel trattamento dell’infarto miocardico ha suscitato notevole interesse in campo sperimentale e clinico, sebbene i risultati su popolazioni più ampie di pazienti siano ancora in fase investigativa. Il razionale scientifico dell’uso delle cellule staminali si basa sulla possibilità che la rigenerazione dei cardiociti nelle zone infartuate e l’angiogenesi possano evitare preventivamente il processo di rimodellamento del ventricolo sinistro, responsabile della progressione verso lo scompenso cardiaco. Da alcuni iniziali studi su gruppi selezionati di pazienti affetti da infarto miocardico esteso e con funzione ventricolare molto depressa, l’iniezione topica delle cellule staminali (più frequentemente quelle con l’antigene CD34+ e CD45−, cellule di muscolo scheletrico o del midollo osseo) in associazione alla simultanea rivascolarizzazione con il CABG tradizionale, si è dimostrata più efficace rispetto alla sola chirurgia, migliorando significativamente la funzionalità del ventricolo sinistro a sei mesi. Se i risultati preliminari saranno confermati da studi randomizzati più ampi, l’associazione della terapia con cellule staminali alla chirurgia di rivascolarizzazione potrà efficacemente trattare nella fase precoce anche le forme potenzialmente più gravi di cardiomiopatia ischemica.
Aneurismi aortici: trattamento chirurgico ed endovascolare
L’aorta è suddivisa in un tratto toracico e in un tratto addominale. Il tratto toracico a sua volta è suddiviso in aorta ascendente (subito al disopra del piano valvolare aortico), arco aortico, dalla cui convessità originano i vasi epiaortici (arteria anonima, carotide comune sinistra,arteria succlavia sinistra), aorta discendente, che va dall’istmo (subito al di sotto dell’origine dell’arteria suc-clavia sinistra) fino al diaframma, dove inizia l’aortaaddominale.
Si definisce aneurisma una dilatazione patologica del lume normale dei vasi, che può interessare uno o più segmenti. Nell’aneurisma aortico, la dilatazione è almeno 1,5 volte il valore del normale diametro previsto per quel tratto di aorta.
Gli aneurismi dell’aorta possono essere espansivi e dissecanti: per il rischio di possibile rottura o dissecazione, l’indicazione chirurgica al trattamento degli aneurismi espansivi è la prima scelta. Nella dissecazione (slaminamento della parete) acuta dell’aorta ascendente (evenienza catastrofica che esordisce con dolore toracico intenso, lancinante, trafittivo) l’intervento viene invece effettuato in emergenza per prevenire la completa rottura dell’aorta in pericardio e quindi la morte per tamponamento cardiaco, l’estensione del processo dissecante ai vasi epiaortici con possibile danno neurologico grave, alle coronarie con conseguente infarto miocardico, e alla valvola aortica con scompenso cardiaco da insufficienza valvolare acuta. La chirurgia della dissezione acuta dell’aorta ascendente riduce a circa un quarto la mortalità prevista dalla storia naturale di tale patologia: infatti, la dissecazione dell’aorta ascendente se non trattata chirurgicamente presenta a un mese una mortalità del 90% (mentre la mortalità operatoria è del 20÷30%).
Chirurgia degli aneurismi della radice aorticae dell’aorta ascendente
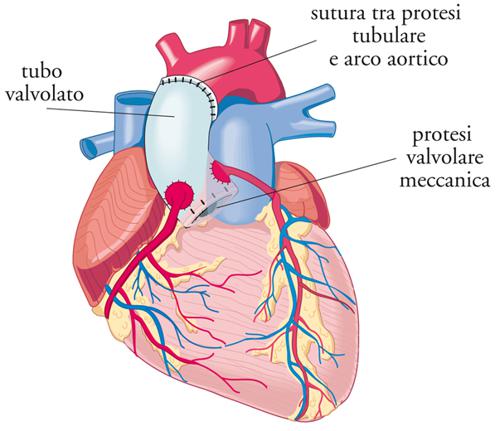
La radice aortica è un’unità anatomica complessa, costituita dall’anulus valvolare aortico, dalle cuspidi della valvola aortica, dai seni di Valsalva con gli osti coronarici e dalla giunzione senotubulare. Il trattamento convenzionale della patologia della radice aortica associata a disfunzione della valvola aortica prevede l’intera sostituzione di tutti i suoi componenti mediante l’uso del tubo valvolato composito, come proposto da Hugh Bentall e Antony DeBono nel 1968 (fig. 9). I risultati di questo tipo di intervento sono eccellenti in termini di mortalità operatoria (3÷4%), di elevata sopravvivenza e libertà da eventi cardiaci a lungo termine (80÷90%).
Tuttavia la necessità dell’anticoagulazione con i relativi rischi di tromboembolia legati alla protesi valvolare meccanica o il deterioramento negli anni della protesi biologica e il rischio di endocardite, hanno stimolato lo sviluppo di procedure chirurgiche che preservassero la valvola aortica nativa (interventi di valve-sparing), in caso di valvola con cuspidi integre e insufficiente in seguito alla dilatazione della radice e/o dell’aorta ascendente (fig. 10).
L’aneurisma dell’arco aortico e dell’aorta toracica discendente
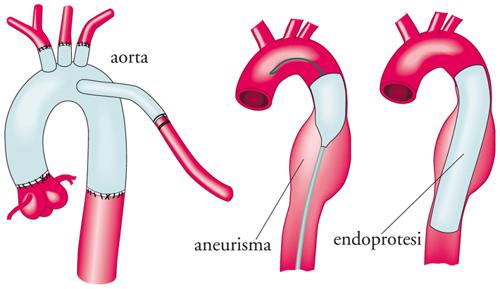
La chirurgia dell’arco aortico e dell’aorta discendente rappresenta ancora oggi uno dei capitoli più impegnativi della chirurgia cardiovascolare. Per eseguire la resezione dell’arco bisogna necessariamente arrestare il circolo per cui, per proteggere l’encefalo durante l’interruzione della circolazione extracorporea e la sostituzione dell’arco, si può adottare l’ipotermia sistemica profonda (a 18÷21 °C), o l’ipotermia moderata (a 24÷26 °C) con perfusione cerebrale anterograda selettiva delle carotidi. L’efficacia della chirurgia nel trattamento della patologia dell’arco è indiscussa: l’arco viene interamente sostituito con reimpianto dei vasi epiaortici in blocco o separatamente sulla protesi tubulare (fig. 10 a sinistra). Una valida recente opzione terapeutica per il trattamento degli aneurismi espansivi dell’arco è rappresentata da un trattamento ‘ibrido’ di chirurgia vascolare e di radiologia interventistica, tramite l’impianto delle endoprotesi aortiche. Effettuando infatti preventivamente la trasposizione chirurgica dei vasi epiaortici mediante bypass aorto-carotideo, si può effettuare successivamente la copertura completa dell’aneurisma dell’arco con un’endoprotesi, evitando così i rischi legati alla chirurgia tradizionale dell’arco.
L’utilizzo delle endoprotesi si sta estendendo anche al trattamento degli aneurismi dell’aorta discendente e appare una valida opzione terapeutica rispetto alla terapia medica o alla chirurgica tradizionale (fig. 10 al centro e a destra). In effetti la terapia medica, che nella fase acuta offre migliori risultati rispetto alla chirurgia, nel lungo termine è meno efficace nell’evitare la progressione della malattia verso l’arco e l’aorta ascendente o l’ulteriore dilatazione dell’aneurisma dissecante cronico dell’aorta toraci-ca discendente, due sviluppi della malattia responsabili dell’elevata mortalità a distanza. L’impianto dell’endoprotesi rispetto alla sola terapia medica appare invece in grado di arrestare tale sfavorevole evoluzione dell’aneurisma.
I risultati ottenuti anche in questo ambito mostrano i progressi compiuti dalla chirurgia cardiovascolare negli ultimi decenni. Essa non sembra più avere oggi controindicazioni assolute, anzi la qualità e l’affidabilità dei suoi risultati sembra possano estendersi a categorie di pazienti sempre più ampie, potendo garantire così sia l’allungamento della vita sia una migliore qualità della stessa.
Bibliografia
American College of Cardiology 2006: American College of Cardiology e altri, 2006 Guidelines for the management of patients with valvular heart disease: executive summary, “Circulation”, 1, 2006, pp. 84-231.
Anderson 2007: Anderson, Jeffrey L. e altri, American College of Cardiology/American Heart Association 2007 Guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction, “Journal of the American College of Cardiology”, 7, 2007, pp. 1-157.
Cameron 1996: Cameron, Airlie e altri, Coronary bypass surgery with internal thoracic artery grafts: effects on survival over a 15-year period, “New England journal of medecine”, 334, 1996, pp. 216-219.
Chiariello 2006: Chiariello, Luigi e altri, Simultaneous hybrid revascularization by carotid stenting and coronary artery bypass grafting, “Annals of thoracic surgery”, 81, 2006, pp. 1883-1885.
Cohn, Edmunds 2003: Cardiac surgery in the adult, editedby Lawrence H. Cohn, Louis H. Edmunds, New York, McGraw-Hill, 2003.
Eagle 2004: Eagle, Kim A. e altri, American College of Cardiology/American Heart Association 2004 Guidelines update for coronary artery bypass graft surgery. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, “Journal of the American College of Cardiology”, 44, 2004, pp. 1146-1310.
Hannan 2005: Hannan, Edward L., Long-term outcomes of coronary artery bypass grafting versus stent implantation, “New England journal of medicine”, 352, 2005, pp. 2174-2183.
Hoffman 2003: Hoffman, Stuart N., A meta-analysis of randomized controlled trials comparing coronary artery bypass graft with percutaneous transluminal coronary angioplasty: one- to eight-year outcomes, “Journal of the American College of Cardiology”, 41, 2003, pp. 1293-1304.
Lytle 1999: Lytle, Bruce W. e altri, Two internal thoracicartery grafts are better than one, “Journal of thoracic andcardiovascular surgery”, 117, 1999, pp. 855-872.
Nardi 2007: Nardi, Paolo e altri, Surgery for type A aortic dissection: long-term results and risk factor analysis, “Giornale italiano di cardiologia”, 8, 2007, pp. 580-585.
Penta de Peppo 2005: Penta de Peppo, Alfonso e altri, Small “functional” size after mechanical aortic valve replacement: no risk in young to middle-age patients, “Annals of thoracic surgery”, 79, 2005, pp. 1915-1920.
Schoder 2007: Schoder, Maria e altri, Endovascular repair of acute type B aortic dissection: long-term follow-up of true and false lumen diameter changes, “Annals of thoracic surgery”, 83, 2007, pp. 1059-1066.
Taggart 2006: Taggart, David P., Coronary artery bypass grafting is still the best treatment for multivessel and left main disease, but patients need to know, “Annals of thoracic surgery”, 82, 2006, pp. 1966-1975.
Tsai 2006: Tsai, Thomas T. e altri, Long-term survival in patients presenting with type B acute aortic dissection: insights from the International Registry of Acute Aortic Dissection, “Circulation”, 21, 2006, pp. 2226-2231.
Versaci 1997: Versaci, Francesco e altri, A comparison of coronary-artery stenting with angioplasty for isolated stenosis ofthe proximal left anterior descending coronary artery, “New England journal of medicine”, 336, 1997, pp. 817-822.