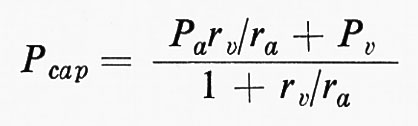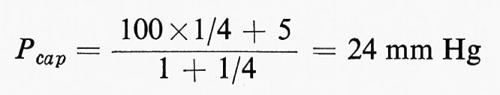Circolazione
Circolazione
Regolazione nervosa della circolazione, di Eric Neil
Elettrofisiologia del cuore, di Wolfgang Trautwein
Regolazione nervosa della circolazione
SOMMARIO: 1. Introduzione. 2. Sviluppo storico dei concetti di regolazione nervosa del cuore e della circolazione. 3. Vene e ritorno venoso. 4. Il cuore come pompa: influenza dei nervi cardiaci efferenti sulla frequenza e sulla forza di contrazione: a) nervi efferenti cardiaci; b) biofisica della contrazione cardiaca e ruolo dei nervi simpatici nella prestazione ventricolare; c) frequenza cardiaca e ruolo dei nervi. 5. Circuito vascolare sistemico e suo controllo nervoso: a) il controllo nervoso dei vasi sanguigni: nervi simpatici vasocostrittori e centro vasomotorio; b) i nervi depressori seno-aortici; c) chemocettori aortici e carotidei. 6. Influenze nervose cortico-ipotalamiche sulla circolazione: a) la reazione di difesa; b) la reazione di ‛morte simulata'; c) centri cardiovascolari termoregolatori. 7. Nervi vasodilatatori e loro ruolo nel controllo circolatorio. □ Bibliografia.
1. Introduzione
Il sangue, circolando, svolge la funzione di apportare l'ossigeno e le sostanze nutritizie ai tessuti e di rimuoverne l'anidride carbonica e gli altri metaboliti. Il punto chiave del sistema vascolare è il circuito capillare, nell'ambito del quale avvengono questi scambi tra il sangue e le cellule dei tessuti.
Il cuore fornisce l'energia necessaria per sospingere il sangue attraverso tutto il circuito vascolare. Più precisamente, nell'uomo, in condizioni di riposo, a ogni battito cardiaco la contrazione del ventricolo sinistro provoca l'espulsione di 80 ml di sangue. Una volta immesso nel lume elastico dell'aorta, questo sangue raggiunge, attraverso le arterie, le varie regioni del corpo, dove la circolazione avviene secondo il seguente sistema di vasi sanguigni: a) piccole arterie a pareti elastiche e muscolari; b) arteriole, con diametro di circa 100 μ, a pareti muscolari; c) sfinteri precapillari a pareti sottili costituite da un singolo strato di cellule muscolari lisce; d) capillari del diametro di circa 6 μ e con pareti costituite da un singolo strato di cellule endoteliali. La superficie totale dei capillari, quando gli sfinteri precapillari sono pervi, è di 700-1.000 m2, ma normalmente, quando solo il 25% di essi è pervio, è dell'ordine di 180-250 m2. Dai capillari il sangue passa alle venule e alle vene, vasi a pareti sottili e distensibili provvisti sia di tessuto elastico sia di muscolatura liscia. Infine, raggiunte le due grandi vene, la vena cava superiore e la vena cava inferiore, il sangue viene convogliato nell'atrio destro e da qui nel ventricolo destro. La contrazione in successione di queste due cavità spinge il sangue venoso dentro l'arteria polmonare che, a sua volta, per mezzo delle sue branche e suddivisioni, lo distribuisce al letto capillare polmonare che ha una superficie di circa 80-90 m2. I capillari polmonari giacciono in intimo contatto con quella miriade di minuscole cavità aeree che sono gli alveoli polmonari ed è proprio in questa parte del circuito polmonare che il sangue venoso guadagna ossigeno dagli alveoli e, al tempo stesso, cede loro anidride carbonica. Quindi il sangue ossigenato (o arterioso) passa attraverso le vene polmonari nell'atrio sinistro e da qui nel ventricolo sinistro. La contrazione dell'atrio sinistro è seguita immediatamente da quella del ventricolo sinistro che, a sua volta, espelle il sangue nell'aorta.
Nell'uomo, in condizioni di riposo, si hanno circa 70 battiti al minuto con un volume di 80 ml per battito, cosicché la gettata cardiaca viene a essere di circa 5,6 litri al minuto. Questa misura corrisponde quasi all'intero volume del sangue, per cui, grazie all'energia sviluppata dalle due pompe lavoranti in serie - il ventricolo destro e il sinistro -, si può dire che l'intero volume del sangue è messo in circolazione a ogni minuto. In tali condizioni il consumo di ossigeno del corpo è di 280 ml al minuto, cosicché per ogni 100 ml di sangue sono ceduti 5 ml di O2 (280/56). In condizioni di intenso lavoro muscolare, in individui giovani e sani, la gettata cardiaca può aumentare fino a 27 litri al minuto; in questi casi la frequenza cardiaca sale sino a 180 battiti al minuto, mentre la gettata sistolica passa da 80 ml a 150 ml. Nello stesso tempo il consumo di ossigeno sale a 3 litri al minuto, per cui per ogni 100 ml di sangue sono ceduti 11 ml di O2 (da un contenuto arterioso di circa 20 ml di O2 per 100 ml di sangue).
2. Sviluppo storico dei concetti di regolazione nervosa del cuore e della circolazione
Nella storia della medicina, nessuna scoperta è, per importanza, paragonabile a quella fatta nel 1628 da William Harvey: egli dimostrò che il sangue circola dalle arterie alle vene e da queste al cuore, il quale, con battiti ritmici, lo immette di nuovo dentro le arterie. L'esistenza di minuscoli capillari, che connettono le arterie con le vene, fu dimostrata dal Borelli nel 1661. Lo stesso Harvey e, più tardi, nel 1669, il suo allievo Richard Lower, descrissero l'importanza della ‛funzione di capacità' delle vene a pareti sottili, dimostrando come il sangue possa accumularsi in tali vene quando entrino in gioco le forze di gravità, come avviene, per esempio, nel caso di un animale da esperimento che sia mantenuto per un certo tempo con la testa sollevata. Si dimostrò che il cuore di un serpente tenuto in posizione verticale diviene privo di sangue per mancanza di ritorno venoso.
Stephen Hales fu il primo, nel 1733, a vedere che la pressione arteriosa media di una giumenta era di circa 100 mm Hg, mentre la pressione venosa centrale era solo pochi millimetri di mercurio al di sopra di quella atmosferica. J.L.M. Poiseuille, nel 1846, studiando il flusso dell'acqua attraverso tubi di diametro molto piccolo, dimostrò sperimentalmente la relazione tra flusso, gradiente di pressione e resistenza, e la espresse nella seguente equazione:
dove P1−P2 è il gradiente di pressione, r è il raggio ed L la lunghezza del tubo, mentre η è la viscosità del fluido. A quell'epoca, G. S. Ohm (1827) aveva già sviluppato la formula del flusso di corrente in un circuito elettrico:
I =E/R
dove I è il flusso, E la forza elettromotrice ed R la resistenza del circuito. Si capì subito che la formula di Poiseuille non era altro che un diverso modo di scrivere la legge di Ohm, ove si sostituisse alla forza elettromotrice E il gradiente di pressione P1−P2 e alla resistenza R l'espressione 8Lη/πr4. Quindi la lunghezza del tubo o, più esattamente, il suo raggio, elevato alla quarta potenza, erano i fattori che determinavano la resistenza: infatti, dimezzando il raggio del tubo, la resistenza aumenta di sedici volte.
Fu proprio nello stesso anno (1846) che C. Ludwig introdusse l'uso del chimografo o ‛scrittore di onde': un cilindro ruotante che registrava graficamente i movimenti di un galleggiante connesso a un manometro a mercurio che, a sua volta, registrava la pressione arteriosa perché collegato a un tubo inserito dentro l'arteria. Così, per la prima volta, poterono essere fatte delle registrazioni continue della pressione arteriosa e della frequenza cardiaca. Già prima di queste registrazioni, e cioè nel 1845, E. H. e E. F. Weber, a Lipsia, avevano osservato che la frequenza cardiaca poteva essere rallentata dalla stimolazione delle branche del nervo vago che vanno al cuore, mentre era aumentata dalla stimolazione delle branche cardiache del simpatico. La tecnica della stimolazione elettrica dei nervi fu di grande aiuto per capirne la funzione. Nello stesso anno, 1852, Claude Bernard e C. E. Brown-Séquard dimostrarono che la stimolazione e la sezione dei nervi simpatici cervicali provocavano rispettivamente il restringimento (vasocostrizione) e l'allargamento (vasodilatazione) dei vasi sanguigni, il che indicava che tali nervi erano tonicamente attivi nel provocare un certo grado di vasocostrizione. Il Bernard, poi, dimostrò che la sezione del midollo cervicale provocava una brusca caduta della pressione, che egli attribuì alla perdita del tono vasocostrittore simpatico (e quindi alla caduta delle resistenze periferiche). C. Ludwig e i suoi allievi - la Scuola di Lipsia - trovarono che la stimolazione delle colonne laterali del midollo spinale cervicale provocava un aumento della pressione sanguigna e conclusero che i nervi simpatici (le cui fibre originano da cellule situate a livello del dodicesimo segmento toracico e dei primi due segmenti lombari, il cosiddetto tronco toraco-lombare) erano eccitati tonicamente dalle fibre nervose che discendono nelle colonne laterali spinali dalle cellule nervose situate a livello sopraspinale. Finalmente Dittmar e Owsjannikow, allievi di Ludwig, scoprirono nel midollo allungato l'esistenza di un addensa- mento di cellule nervose tonicamente attive che si comportano come un centro vasomotore: le fibre originate da queste cellule si dirigevano nelle colonne laterali del midollo spinale e causavano l'attività tonica delle fibre efferenti simpatiche, le quali a loro volta producevano il restringimento del lume dei vasi da loro innervati. Cyon e Ludwig (v., 1866) furono i primi a dimostrare che la stimolazione delle fibre afferenti, provenienti dall'area cardio-aortica, induceva, per via riflessa, una bradicardia e una ipotensione dovute al loro effetto sui ‛centri cardiovascolari' del midollo allungato. Essi stessi, giustamente, dedussero che queste terminazioni afferenti servivano a segnalare il carico di lavoro a cui è sottoposto il cuore e quindi dotavano il sistema cardiovascolare di una autoregolazione riflessa (Selbsteuerung).
Allo stesso tempo, uno dei problemi dell'analisi degli eventi circolatori era costituito dalla mancanza di un metodo utile per misurare la gettata cardiaca. Già allora si capiva chiaramente che le cellule dei tessuti avevano bisogno di un flusso di sangue piuttosto che di una data pressione arteriosa e che detto flusso, attraverso i capillari, forniva l'ossigeno e le sostanze nutritizie necessarie all'attività metabolica, e rimuoveva il CO2 e i prodotti di rifiuto accumulati dal metabolismo.
Tuttavia, fino al 1870 non fu descritto alcun metodo efficace per determinare la gettata cardiaca. A. Fick formulò un principio che da lui stesso prese il nome e ne illustrò un'applicazione pratica usandolo per calcolare la gettata cardiaca: se l'O2 assorbito dai polmoni a ogni minuto fosse stato noto e questo dato fosse stato diviso per la differenza arterio-venosa in contenuto di ossigeno del sangue, allora si sarebbe potuto calcolare il flusso totale di sangue attraverso i polmoni (=gettata cardiaca). Usando dati sperimentali ottenuti dal cane, ed estrapolando quelli che ci si sarebbe dovuti aspettare per l'uomo, egli calcolò una gettata cardiaca di 5,4 litri al minuto (che è quasi l'esatta misura fornita dalle tecniche più moderne). Dovevano passare degli anni prima che N. Zuntz e O. Hagemann (v., 1898) introducessero la tecnica del prelievo di campioni di sangue venoso misto dall'atrio destro del cuore di un cavallo, ma, benché i loro risultati fossero estremamente accurati, questa tecnica non venne sviluppata e neppure applicata all'uomo fino all'inizio degli anni quaranta. La tecnica di Fick è stata poi largamente sostituita dal metodo di diluizione di un colorante di W. F. Hamilton (v., 1953), ma la sua introduzione fu una delle pietre miliari nella fisiologia della circolazione.
L'assenza di metodi adeguati di misurazione del flusso, tuttavia, non impedì il pieno sviluppo delle nostre conoscenze sui valori della pressione nelle diverse sedi strategiche della circolazione, e così, alla fine del secolo scorso, si sapeva già che la pressione media cade solo leggermente dall'aorta alle arterie periferiche di appena 0,2 mm di diametro - anche se, per la verità, questo lo aveva già osservato lo stesso Poiseuille. La pressione venosa fu misurata ripetutamente e si vide che era di 5-10 mm Hg nelle vene periferiche di calibro minimo, ancora cateterizzabili. Le misurazioni della pressione capillare, anche se indirette è inesatte, suggerivano valori di 20-25 mm Hg e quindi si dedusse che la maggior caduta di pressione nell'albero circolatorio doveva avvenire nelle più piccole branche delle arterie, quelle che sono ancora dotate, nelle pareti vasali, di una muscolatura liscia - le cosiddette arteriole - il cui diametro diminuisce da 100 μ a 15 μ via via che si ramificano, finché non danno origine ai capillari. Si dovette arrivare al 1930, quando E. M. Landis (v., 1930) misurò direttamente, con una micropipetta, la pressione capillare in vari animali, incluso l'uomo, perché si sapesse che la pressione capillare, a livello del cuore, era di circa 30-35 mm Hg all'estremo arteriolare, e di 10-15 mm Hg all'estremo venulare del capillare. Il Landis dimostrò che questi valori dipendevano dal grado di costrizione dei vasi precapillari e che questa vasocostrizione era influenzata profondamente dal traffico di impulsi lungo i nervi simpatici locali che innervano le venule e più particolarmente le arteriole. Landis dimostrò anche che il flusso del sangue era lento (0,3-0,5 mm/s) ma continuo (nei capillari il flusso non è più pulsante come al livello delle arterie, a meno che non si produca una vasodilatazione nelle arteriole, come si ha sia bloccando la conduzione degli impulsi nei nervi simpatici, sia inducendo l'accumulo di metaboliti chimici in vicinanza della microcircolazione). Questi cambiamenti chimici potevano essere ottenuti diminuendo artificialmente l'afflusso locale del sangue, oppure provocando un'eccessiva attività metabolica delle cellule tessutali che sono irrorate dal sangue.
In essa è illustrato il duplice ruolo svolto dalle arteriole nel deprimere la pressione pulsatile trasmessa ai capillari e nel far scendere la pressione a un valore che dipende appunto dal grado di costrizione (o tono) dei vasi arteriolari. La vasocostrizione e la vasodilatazione arteriolari alterano il profilo della caduta pressoria e quindi della pressione idrostatica che viene trasmessa ai capillari.
I capillari sono tubi composti di un singolo strato di cellule, il loro raggio è di 3-4 μ e la loro lunghezza di circa 750 μ. Questa modesta lunghezza giustifica il loro relativamente moderato contributo alla resistenza periferica totale. E. H. Starling (v., 1896) fu il primo a intravvedere l'esistenza di un equilibrio di forze attraverso la parete dei capillari tra la pressione idrostatica - che tende a forzare il liquido fuori dei capillari, nell'interstizio o liquido extracellulare (LEC) - e la pressione osmotica effettiva del sangue, dovuta al suo contenuto in molecole proteiche disciolte, che possono attraversare i pori intracellulari della membrana capillare solo con difficoltà. Le sue misurazioni della pressione osmotica effettiva di soluzioni contenenti proteine plasmatiche, quali l'albumina e le globuline, in concentrazioni simili a quelle del sangue, dettero un valore di 25 mm Hg, e i risultati di Landis (v., 1930) e quelli di Pappenheimer e Soto-Rivera (v., 1948) dimostrarono trionfalmente l'ipotesi di Starling di uno scambio di liquidi tra il plasma e il LEC attraverso la parete capillare. È chiaro che il volume del sangue può essere profondamente alterato da uno sbilanciamento prolungato di queste due forze. Un eccesso di pressione idrostatica capillare (dovuta, per es., alla dilatazione arteriolare o all'aumento della pressione venosa) o un abbassamento della pressione osmotica delle proteine plasmatiche (dovuta, per es., a una malattia renale cronica che causa una perdita di proteine con le urine) provocheranno l'accumulo di una quantità eccessiva di liquido nei tessuti - il cosiddetto edema - con la progressiva diminuzione del volume di sangue circolante. Al contrario, una forte caduta della pressione idrostatica capillare favorirà un assorbimento del liquido tessutale da parte del sangue: tale alterazione si verifica dopo una forte emorragia e aiuta a ripristinare il volume sanguigno.
Pappenheimer e Soto-Rivera (v., 1948) dimostrarono che la pressione capillare media era regolata dalla seguente equazione:
dove Pcap è la pressione media capillare, Pa e Pv sono rispettivamente la pressione idrostatica pre- e postcapillare, mentre ra e rv sono i valori di resistenza pre- e postcapillare. Sostituendo una pressione di 100 mm Hg a Pa e di 5 mm a Pv, e se il rapporto di resistenza è ra/rv=4/1, si avrà:
e questo tessuto sarà in condizioni ‛isovolumetriche', non mostrando né aumento né perdita di liquido dal LEC, essendovi equilibrio tra la Pcap (=24 mm) e la pressione osmotica effettiva (24 mm Hg). È chiaro che, se fattori nervosi o chimici influenzano il rapporto di resistenza, l'equilibrio tra liquido del tessuto e volume plasmatico ne risulta alterato. Anche se questi effetti delle variazioni della resistenza pre- e postcapillare sono di grande importanza nel bilanciare l'equilibrio liquido tra il sangue e il LEC, essi però hanno scarso significato in termini di apporto nutritizio alle cellule dei tessuti. Solo 20 litri sfuggono dall'estremità ‛arteriosa' dei capillari nelle 24 ore, e di questi ne vengono riassorbiti 16-18 litri alla terminazione ‛venosa': i 2-4 litri rimanenti sono raccolti dai linfatici che riportano questo liquido al sangue attraverso il dotto toracico. La nutrizione dei tessuti dipende da uno scambio di diffusione di 80.000 litri di liquido che attraversa i pori intracellulari della parete capillare nelle 24 ore. Questi scambi di diffusione dipendono, a loro volta, dalla superficie del letto capillare che è enorme, ma la cui estensione è determinata dal tono degli sfinteri precapillari situati alla congiunzione delle arteriole con i capillari. Il tono degli sfinteri precapillari dipende dall'equilibrio fra la scarica del simpatico, che tende ad aumentarlo, e i fattori chimici locali, che tendono a diminuirlo. In molti tessuti solo il 20-25% del letto capillare è pervio a ogni istante e il fatto che i capillari siano pervi o no dipende soltanto dallo stato di contrazione degli sfinteri e non dalla variazione attiva del loro calibro. I capillari non sono contrattili e non sono innervati. Mentre l'area totale del letto capillare è di circa 700-1.000 metri quadrati, normalmente solo 180-250 metri quadrati di esso sono disponibili (25% pervio). Questa quantità è sufficiente per gli scambi di diffusione delle sostanze solubili nei lipidi come O2 e CO2, che possono attraversare le stesse cellule endoteliali, e persino per quelli delle sostanze solubili in acqua, costrette a passare attraverso i pori intracellulari con raggio di 30-45 Å, che rappresentano lo 0,1% dell'area totale della parete capillare di un tessuto come quello di un muscolo (v. Pappenheimer, 1953).
3. Vene e ritorno venoso
Il gradiente di pressione esistente tra le vene periferiche e l'atrio destro è solo 10 mm Hg. È ovvio che il ritorno venoso deve essere uguale alla gettata cardiaca e, di conseguenza, le vene contribuiscono solo in minima parte alla resistenza periferica. Il ritorno venoso, in un uomo sdraiato e a riposo, dipende prima di tutto e soprattutto dalla vis a tergo, che gli deriva dalla eiezione cardiaca; contribuisce ad esso anche la vis a fronte, una forza di risucchio esercitata dai ventricoli che si contraggono e dagli effetti ritmici dell'aspirazione prodotta dai movimenti inspiratori del torace. In condizioni di esercizio muscolare, il ritorno venoso dai muscoli è aiutato notevolmente dagli effetti di compressione ritmica dovuta alle contrazioni dei muscoli sulle vene in essi contenute, le quali sono tutte fornite di valvole che permettono il flusso soltanto nella direzione del cuore.
L'importanza delle vene è dovuta principalmente alla variabilità della loro capacità. Le loro pareti sottili contengono alcune fibre muscolari lisce, a disposizione circolare, e del tessuto elastico. Quando la pressione transmurale è bassa (come nel caso di un uomo che giace orizzontalmente in una barella, per esempio), le vene sono semicollassate e mostrano, alla sezione trasversale, una forma ellittica. Piccoli aumenti della pressione transmurale trasformano questo profilo in uno più circolare, senza che cambi la lunghezza del perimetro del muscolo liscio. D'altra parte, a parità di perimetro, l'area di una sezione circolare è più grande di una ellittica. Perciò la decantata ‛distensibilità' delle vene è dovuta più a questi fattori geometrici che a una grande differenza in distensibilità tra vene e arterie. Una volta che le vene, per effetto della pressione transmurale, hanno assunto il profilo circolare, un ulteriore aumento della pressione provoca la distensione della loro parete con conseguente aumento del perimetro. Aumenti della pressione venosa transmurale, per effetto della combinazione degli effetti ‛geometrici' e di quelli dovuti a vera distensibilità, fanno aumentare considerevolmente la capacità venosa e quindi alterano la frazione del volume sanguigno contenuto nel circuito venoso. Gli effetti della postura, nell'uomo, sono dovuti soprattutto alle forze gravitazionali che agiscono sulle vene. Quando un uomo giace a letto, in posizione orizzontale, la pressione arteriosa media è identica in tutte le arterie del corpo (100 mm Hg) e così pure la pressione venosa periferica (5-10 mm Hg). Se il letto viene reclinato in modo che il soggetto abbia la testa sollevata, la pressione arteriosa media nei piedi incomincia a salire da 100 mm Hg (che equivale a 135 cm di sangue) e così si comporta la pressione nelle vene del piede. La postura eretta non ha influenzato affatto il gradiente di pressione che spinge il sangue dalle arterie alle vene, ma l'aumento della pressione periferica transmurale venosa aumenta notevolmente l'area della sezione trasversa delle vene degli arti inferiori e quindi la loro capacità; il ritorno venoso al cuore diminuisce e il soggetto avverte momentaneamente un po' di vertigine. I riflessi nervosi assicurano la vasocostrizione periferica non solo delle arteriole, ma anche delle vene e ciò contribuisce ad assicurare un più adeguato ritorno venoso. Bisogna notare che in questa posizione verticale, ‛assunta passivamente', tutte le valvole venose sono aperte e il sangue fluisce al cuore ininterrottamente soltanto grazie alla vis a tergo. Quando però il soggetto mette in esercizio i muscoli degli arti inferiori, questi comprimono ritmicamente i successivi segmenti venosi e quindi pompano attivamente il sangue verso il cuore, assicurando al tempo stesso una caduta della pressione venosa periferica.
4. Il cuore come pompa: influenza dei nervi cardiaci efferenti sulla frequenza e sulla forza di contrazione
Il ritorno venoso al cuore avviene soltanto durante la fase di distensione del ciclo cardiaco (diastole). In un cuore che batte a 70 battiti al minuto, ogni ciclo cardiaco dura circa 0,85 s. La contrazione simultanea di tutti e due i ventricoli (sistole) dura 0,3 s, mentre durante la diastole ventricolare, che dura 0,55 s, avviene il riempimento dei ventricoli. La contrazione contemporanea dei due atri, che dura 0,1 s, occupa l'ultima parte della diastole ventricolare e aiuta a completare il riempimento dei ventricoli da parte del ritorno venoso.
Ogni ciclo cardiaco viene iniziato da variazioni elettriche (depolarizzazione) delle cellule pacemaker situate nel nodo seno-atriale (n.s.a.), elementi specializzati che si trovano in un'area a forma di stella della parete dell'atrio destro. Gli impulsi elettrici, ai quali esse danno origine, si propagano alla velocità di 1 m al secondo alle pareti degli atri, facendoli contrarre, e raggiungono il nodo atrio-ventricolare (n.a.v.), che è costituito anch'esso da cellule del tipo pacemaker. Il nodo atrio-ventricolare trasmette a sua volta gli impulsi al tessuto specializzato (di Purkinje) situato nel setto interventricolare e da qui alle branche di questo tessuto che si diramano nelle pareti interne dei ventricoli. La velocità di conduzione nel sistema di Purkinje è elevata (4 m/s) e l'eccitazione di tutta la massa muscolare dei ventricoli avviene appena 65 ms dopo la propagazione dell'impulso dal nodo atrio-ventricolare. Anche in questo caso, la diffusione dell'impulso eccitatorio elettrico precede la contrazione del muscolo ventricolare. La sistole atriale (0,1 s) completa il riempimento del ventricolo (come mostra la curva del volume ventricolare) e l'inizio della contrazione ventricolare chiude le valvole atrio-ventricolari, causando il primo tono cardiaco. La pressione ventricolare sale rapidamente, ma senza cambiamenti del volume ventricolare, perché le valvole che portano dai ventricoli ai rispettivi vasi di uscita (la valvola polmonare per il ventricolo destro e la valvola aortica per il sinistro) sono ancora chiuse. La contrazione è quindi isometrica e tale fase si chiama isometrica. Quando le pressioni ventricolari superano quelle delle corrispondenti arterie, le valvole si aprono e il sangue viene espulso (fase di eiezione). La pressione arteriosa sale fino al picco sistolico. Via via che la contrazione del muscolo ventricolare diminuisce, anche la pressione ventricolare diminuisce e con essa, ma soltanto all'inizio, quella dell'aorta. Tuttavia l'aorta, come pure l'arteria polmonare, è elastica e l'eiezione ventricolare ha ampliato il vaso: in altre parole, parte dell'energia trasferita dall'eiezione cardiaca è stata convertita in energia potenziale nella parete distesa dell'aorta, la rimanente in energia cinetica trasmessa al sangue. Via via che la pressione aortica diminuisce, le pareti dell'aorta si contraggono di rimbalzo, e questa forza, unita a quella della resistenza periferica offerta dalle arteriole, aiuta a mantenere la pressione arteriosa. La pressione ventricolare cade al di sotto dei valori aortici e le valvole aortiche si chiudono (secondo tono cardiaco). Sopraggiunge quindi la diastole ventricolare, con una fase iniziale di rilassamento isometrico che culmina con l'apertura delle valvole atrio-ventricolari, dopo di che il sangue affluisce nel ventricolo in una fase di riempimento che, rapida all'inizio, si rallenta nella frazione finale della fase diastolica.
Nell'uomo, in condizioni di riposo, il cuore può pulsare con una frequenza di 70 battiti al minuto espellendo a ogni battito 80 ml di sangue. La frequenza e la forza del battito cardiaco dipendono da fattori nervosi e, in misura minore, umorali.
a) Nervi efferenti cardiaci
1. Le fibre nervose vagali hanno origine dalle cellule del nucleo dorsale del vago nel midollo allungato. Dopo aver seguito i vaghi cervicali, questi nervi decorrono dai rami toracici ai gangli situati in vicinanza dei nodi s.a. e a.v. e delle fibre della muscolatura atriale; queste ultime strutture sono innervate da brevi fibre postgangliari che liberano aceticolina (ACh). Il ventricolo invece non riceve fibre vagali efferenti. La stimolazione artificiale del nucleo motore dorsale del vago (o della branca periferica di un vago tagliato) rallenta e può anche fermare il cuore inibendo l'attività pacemaker del nodo s.a.
Normalmente la frequenza cardiaca è lenta (60-80 battiti al minuto) a causa dell'attività tonica delle fibre vagali efferenti cardiache. La sezione dei vaghi aumenta la frequenza cardiaca da questi valori fino a 150 battiti al minuto. Questa ‛influenza frenante' dei vaghi è detta ‛tono vagale' e la sua origine è per lo più riflessa (v. sotto, § c).
2. Fibre simpatiche: i corpi cellulari dei neuroni simpatici cardiaci pregangliari si trovano nei cinque segmenti superiori toracici. Quelli in T2 e T3 sono i più abbondanti e si dirigono, attraverso i rami comunicanti bianchi, al ganglio stellato, dove formano delle sinapsi con le cellule gangliari le cui fibre decorrono per i rami cardiaci al tessuto nodale e alla muscolatura atriale e ventricolare. La stimolazione di queste fibre simpatiche accelera il battito cardiaco e, soprattutto, aumenta la velocità e la forza di ogni contrazione ventricolare. Normalmente le fibre simpatiche cardiache sono eccitate tonicamente da impulsi che provengono dai neuroni del centro cardiovascolare bulbare.
b) Biofisica della contrazione cardiaca e ruolo dei nervi simpatici nella prestazione ventricolare
Il muscolo cardiaco, come i muscoli scheletrici, quando viene eccitato, sviluppa una forza di contrazione che è in relazione alla sua lunghezza iniziale a riposo: più questa è grande (ma fino a un certo punto), più forte risulta la contrazione. Il muscolo cardiaco, tuttavia, differisce completamente da quello scheletrico in quanto manifesta una maggiore forza di contrazione (quando è stimolato a una data lunghezza iniziale) per azione di catecolammine (adrenalina, Ad, e noradrenalina, NAd).
Questi fatti possono essere accertati misurando la tensione sviluppata da un muscolo papillare ventricolare isolato sospeso in un bagno, fissato a una estremità a una piattaforma rigida e collegato con l'altra a un trasduttore meccanico che registra la tensione sviluppata quando il muscolo viene stimolato elettricamente. Quando si varia la lunghezza di riposo del muscolo (muovendo la sbarra che porta il trasduttore meccanico) la forza di contrazione aumenta via via che la lunghezza di riposo è aumentata. In maniera simile la forza e la velocità di contrazione, per ogni determinata lunghezza, sono aumentate quando si aggiunge NAd alla soluzione che bagna il preparato muscolare. Quest'ultimo dato è di estrema importanza, perché la NAd è la sostanza liberata dalle terminazioni nervose simpatiche postgangliari e anche dalla midollare surrenale.
Starling (v., 1918) usò il preparato isolato cuore-polmone per dimostrare che la forza di contrazione ventricolare dipende fondamentalmente dalla lunghezza diastolica delle fibre ventricolari. Il cuore era denervato e la sua frequenza non variava. Un aumento della pressione di riempimento, ottenuta aumentando il serbatoio venoso, aumentava il volume diastolico dei ventricoli e la loro eiezione sistolica. Quindi, a circolazione intatta, un aumento del ritorno venoso, ottenuto per esempio con l'esercizio muscolare, potrebbe aumentare il volume telediastolico e quindi migliorerebbe la forza di contrazione dei ventricoli aumentando, di conseguenza, la gettata cardiaca. Se questo fosse l'unico meccanismo per aumentare la gettata cardiaca, si potrebbe supporre che il volume telediastolico del cuore dovrebbe essere più grande durante l'esercizio muscolare, ma tuttavia ciò non avviene. Esperimenti successivi di S. J. Sarnoff, R. J. Linden e collaboratori hanno chiarito il ruolo delle fibre simpatiche cardiache. I risultati, ottenuti con un preparato di tipo cuore-polmone, possono essere espressi graficamente. Il lavoro del ventricolo sinistro a ogni gettata sistolica (volume della gettata nell'unità di tempo moltiplicato per la pressione aortica media) è rappresentato in funzione della pressione nel ventricolo sinistro alla fine della diastole (PVSFD), che è il principale fattore determinante la lunghezza delle fibre del muscolo ventricolare alla fine della diastole. A mano a mano che la PVSFD sale, la gettata sistolica aumenta, linearmente all'inizio, fino a raggiungere dei valori innaturalmente alti della PVSFD. Quando tale serie di esperimenti viene ripetuta, mentre i nervi cardiaci simpatici che innervano il cuore sono stimolati artificialmente, è ovvio che per ogni PVSFD (e perciò per ogni lunghezza diastolica) il ventricolo compie un maggiore lavoro e produce una gettata sistolica maggiore di quella ottenuta durante il ‛controllo'. In questi esperimenti il cuore era mantenuto artificialmente a frequenza fissa, sia durante la fase di ‛controllo', sia durante la fase di ‛stimolazione del simpatico'.
Questi risultati indicano l'azione reciproca dei due principali fattori dell'eiezione ventricolare durante lo sforzo. L'incremento della scarica simpatica al cuore - che è dovuta all'attività cortico-ipotalamica - ha l'effetto di aumentare la forza e la velocità di ciascuna contrazione. Questa, da sola, tende a svuotare il ventricolo più completamente, assicurando quindi una maggiore eiezione sistolica per ogni volume telediastolico. A questo punto va precisato che a ogni gettata sistolica i ventricoli non si svuotano mai completamente. Un valore accettabile per il volume telediastolico è di 150 ml in un uomo in condizioni di riposo; in atleti bene allenati può essere assai maggiore. L'espulsione di un volume sistolico di 80 ml lascia una riserva telesistolica di 70 ml, e normalmente, durante la successiva diastole, il ritorno venoso di 80 ml riporta il volume telediastolico al valore di 150 ml. Se il successivo battito avvenisse sotto l'influenza di una scarica simpatica di impulsi, il volume sistolico sarebbe più grande, per esempio 100 ml, e il volume telesistolico potrebbe cadere a 50 ml. Se il ritorno venoso rimanesse immutato, la successiva diastole si concluderebbe con un volume telediastolico di soli 130 ml. Tuttavia l'effetto stimolante della NAd (il cosiddetto effetto inotropo positivo) dovrebbe assicurare una gettata pulsatoria più grande, pur in condizioni di minore volume diastolico, di quella ottenuta in assenza di stimolazione simpatica e quindi ne potrebbe risultare un volume sistolico di 80 ml o più. Se questi cambiamenti avvenissero durante l'esercizio fisico, l'azione di pompa dei muscoli scheletrici potrebbe aumentare il ritorno venoso e compensare o persino incrementare il volume telediastolico, cosicché ambedue questi fattori potrebbero aumentare la forza di ciascuna contrazione e quindi la gettata sistolica.
c) Frequenza cardiaca e ruolo dei nervi
Tutti sanno che anche un modesto esercizio muscolare aumenta la frequenza cardiaca in individui non allenati, e che un intenso esercizio fisico la innalza fino a 180 battiti al minuto. In condizioni di forte lavoro muscolare, il volume-minuto può raggiungere i 27 litri in individui sani e giovani, il che comporta l'espulsione di 150 ml per battito, 180 volte ogni minuto. Questo eccezionale valore può anche essere superato in atleti di primo piano, nei quali il volume-minuto può raggiungere i 35-40 litri, pur mantenendo una frequenza cardiaca massima di 180 battiti al minuto. A 180 battiti al minuto ogni ciclo dura 0,33 s, dei quali 0,20 s per la sistole e 0,13 s per la diastole. Qui incontriamo uno dei problemi della tachicardia: i ventricoli possono riempirsi solo durante la diastole, e poiché la durata della diastole si è ridotta ulteriormente, la resistenza offerta al riempimento venoso cresce rapidamente. Un altro problema che deriva dall'alta frequenza cardiaca è, la difficoltà di rifornire lo stesso muscolo cardiaco di ossigeno. I vasi coronari che irrorano il cuore si ramificano tra le stesse fibre del muscolo cardiaco e il flusso di sangue che vi scorre viene arrestato quando questi muscoli si contraggono. La fase diastolica è di primaria importanza nell'assicurare il flusso di sangue coronarico; se questo diviene inadeguato, il muscolo cardiaco soffre di anossiemia e libera dei ‛metaboliti' che eccitano le terminazioni nervose afferenti nocicettive. La stimolazione di tali terminazioni nervose è causa di dolore soggettivo - descritto come angina pectoris - e costituisce per il corpo un allarme allo scopo di mettere fine allo sforzo che ha dato luogo a tali cambiamenti.
Così un'alta frequenza cardiaca comporta diversi svantaggi e presumibilmente il ruolo del vago, in un uomo che svolga una moderata attività o sia in stato di riposo, è di grande importanza. Il tono vagale è di origine riflessa ed è evocato dall'attività dei nervi afferenti, le cui terminazioni giacciono nel lato esterno delle pareti dell'arco aortico e dei due seni carotidei. Queste terminazioni nervose sono recettori sensibili alla distensione e sono stimolati da ogni pulsazione del sistema arterioso derivante dalla eiezione sistolica. Gli impulsi nervosi, così originati, sono condotti dai vaghi (per l'arco aortico) e dai nervi glossofaringei (per i seni carotidei) al nucleo dorsale motorio del vago e lo eccitano. Un aumentato numero di impulsi scende lungo le fibre vagali efferenti cardiache e rallenta la frequenza del cuore. Perciò se la pressione arteriosa è aumentata artificialmente il cuore rallenta in via riflessa e, viceversa, se la pressione arteriosa è fatta diminuire (per es., per perdita di sangue), il cuore accelera la propria frequenza. Questi effetti non solo sono dovuti ai mutamenti del traffico di impulsi vagali efferenti, ma implicano anche cambiamenti dell'attività cardiaca simpatica, sebbene questi avvengano in direzione opposta a quelli dovuti ai vaghi, poiché i nervi afferenti seno-aortici diminuiscono l'attività dei centri del midollo allungato che eccitano i nervi cardiaci simpatici. Così un innalzamento della pressione arteriosa abbassa in via riflessa l'attività efferente delle fibre simpatiche che innervano il cuore.
Probabilmente anche i meccanocettori ventricolari contribuiscono in via riflessa al tono vagale, sebbene questo non sia stato accertato.
La funzione di questi recettori da stiramento, che sono situati in zone di ‛alta pressione' del circuito vascolare, potrebbe essere quella di svolgere un ruolo di ‛freno' della circolazione.
Mentre la loro attività riflessa concerne l'abbassamento della resistenza arteriolare periferica, il forte aumento della loro scarica afferente, dovuta a improvvisi aumenti del traffico di impulsi simpatici - come quelli provocati da una emozione - aiuta presumibilmente a minimizzare quello che altrimenti sarebbe un allarmante aumento della pressione arteriosa con l'inevitabile sovraccarico di lavoro cardiaco che tale ipertensione comporterebbe. Non di meno durante l'esercizio muscolare la loro influenza è largamente annullata, considerando il fatto che la frequenza cardiaca raggiunge i 180 battiti al minuto.
Terminazioni nervose vagali, che funzionano come recettori da distensione, si trovano alla congiunzione della vena cava superiore con l'atrio destro e alla congiunzione delle quattro vene polmonari con l'atrio sinistro. Esse scaricano durante la sistole atriale e/o durante il riempimento dell'atrio per effetto del ritorno venoso. Quando questi recettori sono eccitati dalla distensione della parete venoatriale che li contiene, l'aumento del traffico di impulsi afferenti nelle loro fibre accelera il cuore in via riflessa. Questo effetto sulla frequenza cardiaca non è accompagnato da alcun cambiamento della forza di contrazione ventricolare. La via efferente di questo riflesso è composta dai nervi simpatici che innervano il nodo s.a., ma non da quelli che innervano i ventricoli. Questi recenti risultati di Linden e dei suoi collaboratori probabilmente costituiscono la spiegazione del riflesso di Bainbridge, descritto nel 1915 (v. Bainbridge, 1915) da questo autore che dimostrò che un aumento improvviso, ottenuto artificialmente, del ritorno venoso provocava tachicardia. Comunque, il ruolo di questi recettori atriali in circostanze normali rimane in parte oscuro. Si ritiene che essi provochino un'ulteriore tachicardia in condizioni di esercizio muscolare quando gli atri sono ‛sovraccaricati' dal ritorno venoso a una determinata frequenza cardiaca.
5. Circuito vascolare sistemico e suo controllo nervoso
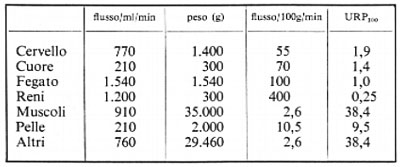
A ogni battito il cuore di un uomo in condizioni di riposo espelle 80 ml di sangue, il che corrisponde a 5,6 litri al minuto. La tabella seguente mostra approssimativamente la distribuzione di questo efflusso sanguigno.
Il termine URP100 (URP=unità di resistenza periferica) si ottiene dalla legge di Ohm dividendo la pressione media (100 mm Hg) per il flusso attraverso 100 g di tessuto.
La tabella mostra che, in un uomo in condizioni di riposo, i muscoli offrono un'alta resistenza al flusso del sangue, e che allo stesso modo si comportano i tessuti compresi sotto il nome di ‛altri' come ossa, tessuto connettivo, tessuto adiposo, ecc. La circolazione nei muscoli si differenzia per un importante aspetto; e cioè perché può aumentare enormemente durante l'esercizio muscolare a causa dell'azione diretta vasodilatatrice dei metaboliti chimici liberati dalle cellule attive del muscolo. Così, durante un'intensa attività muscolare, con una gettata cardiaca di 25-28 litri, almeno 20 litri di sangue scorrono a ogni minuto attraverso il muscolo. Anche se la pressione media del sangue durante l'esercizio muscolare raggiunge un valore di 130 mm Hg, i vasi dei muscoli hanno una resistenza di solo 130/200=0,65 URP durante la massima dilatazione. Nel riposo, l'alta resistenza periferica dei vasi muscolari è in parte dovuta all'attività vasocostrittrice simpatica, ma persino un blocco completo dei nervi simpatici che vanno ai muscoli raddoppia soltanto il flusso di sangue muscolare, per raggiungere un valore di 5-7 ml/100 g/min. Così l'alta resistenza dei vasi nei muscoli in riposo indica che la muscolatura circolare liscia delle loro pareti presenta un alto tono vascolare di base. Tuttavia, per quanto alto sia, esso è anche più alto sotto l'influenza della scarica vasocostrittrice simpatica di riposo. Quando questa scarica simpatica di base è aumentata, come per esempio in seguito a emorragia, il flusso ematico muscolare si riduce a meno di 0,5 ml/100 g/min.
Durante l'esercizio fisico, i metaboliti chimici, come K+ e H+, i derivati dell'adenosina e le sostanze osmoticamente attive prodotte dal lavoro attivo delle cellule muscolari, si raccolgono nel liquido extracellulare ed esercitano un effetto diretto rilasciante sulla muscolatura liscia delle pareti dei vasi precapillari responsabili della resistenza periferica. Questa vasodilatazione chimica diretta annulla l'influenza dei nervi simpatici vasocostrittori che innervano i vasi muscolari e l'iperemia della muscolatura scheletrica durante l'esercizio è quantitativamente quasi la stessa, sia che i vasi muscolari mantengano intatta la loro innervazione simpatica, sia che questa sia stata bloccata da agenti farmacologici.
La pelle, in un uomo in riposo in un ambiente termicamente confortevole, palesa un'alta resistenza vascolare periferica (9,5 URP100) ma, al contrario dei muscoli, questo è dovuto soltanto alla scarica nervosa simpatica. Gli stress termici influenzano i centri ipotalamici che scaricano per inibire il tono simpatico di base nei vasi della pelle, mentre il flusso sanguigno della pelle aumenta enormemente. Una stimolazione calorica della massima intensità può aumentare il flusso di sangue totale della pelle a 2-4 litri/min cosicché la URP100 dei vasi cutanei durante una vasodilatazione massimale è meno di 0,1; d'altronde il loro tono vascolare di base è minimo.
L'economia della circolazione è molto precisa, considerando che il cervello, il cuore, il fegato e i reni, che pesano non più di 3,5 Kg in tutto, ricevono circa due terzi della gettata cardiaca in un uomo in riposo. La restrizione del flusso agli altri tessuti è soprattutto (ma non soltanto, come si è visto sopra) dovuta all'attività tonica dei nervi simpatici vasocostrittori.
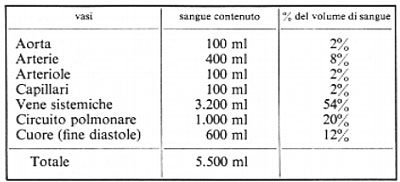
L'influenza di questi nervi sui diversi vasi, accoppiati in serie, del circuito sistemico può essere desunta dalla tabella seguente, che indica la percentuale del volume sanguigno nelle differenti parti, a ogni istante, in un uomo che giaccia orizzontalmente.
È chiaro che tutti gli effetti della scarica vasocostrittrice sulla parte a elevata pressione del circuito circolatorio sistemico si esercitano verosimilmente sulla resistenza, mentre la vasocostrizione che agisce sulle vene ne influenzerà la capacità. La resistenza del circuito polmonare è aumentata solo del 30% dalla stimolazione massimale simpatica; gli effetti di questa stimolazione sulla capacità delle vene polmonari non sono quantitativamente conosciuti, ma possono essere di qualche importanza nella distribuzione del sangue nel ventricolo sinistro all'inizio della sua attività. La distribuzione del sangue tra il circuito polmonare e quello sistemico è modificata dalla gravità, per la quale, ad esempio, in posizione eretta, una maggiore quantità di sangue si raccoglie nelle vene degli arti e una minore nel circuito polmonare e nelle cavità cardiache.
a) Il controllo nervoso dei vasi sanguigni: nervi simpatici vasocostrittori e centro vasomotorio
I vasi sistemici e quelli polmonari sono innervati da fibre simpatiche postgangliari vasocostrittrici (che liberano noradrenalina). Le fibre pregangliari originano dai corpi cellulari che si trovano nel corno intermedio laterale della sostanza grigia dei segmenti toraco-lombari T1−T12 e L1 e L2. Queste fibre lasciano le radici ventrali del segmento per raggiungere un ganglio nella catena simpatica paravertebrale, ove entrano in contatto con le cellule gangliari. Le fibre postgangliari si distribuiscono ai vasi sanguigni, soprattutto alle arterie più piccole e alle arteriole, un po' meno agli sfinteri precapillari; di esse nessuna si porta ai capillari, e un moderato numero giunge alle venule e alle vene. I vasi della testa e del collo ricevono le fibre da T1 e T2, i visceri toracici da T1−T5, le braccia da T5−T9, i visceri addominali da T6−L2 e le gambe da T10−L2.
Queste fibre mostrano un'attività tonica di 1-2 impulsi al secondo nell'animale a riposo; persino la scarica simpatica più alta raramente supera i 10 impulsi al secondo. L'attività tonica di questi nervi vasocostrittori è causata a sua volta dall'attività tonica nei neuroni bulbari, che comprendono il centro cardiovascolare ‛vasomotorio' o ‛bulbare'. Quindi la sezione del tronco dell'encefalo al limite tra il bulbo e il ponte non modifica che scarsamente sia la scarica tonica di riposo delle fibre simpatiche vasocostrittrici periferiche, sia la loro risposta riflessa ai nervi inibitori afferenti (come quelli dalle aree seno-aortiche), o ai nervi eccitatori afferenti (come quelli dai chemocettori dei glomi aortici e carotidei). Questa sezione ha inoltre poco effetto sulla pressione arteriosa media. Sezioni della parte più bassa del bulbo o del midollo spinale cervicale abbassano la pressione sanguigna da 100 a 40 mm Hg, perché le vie eccitatorie (nelle colonne laterali del midollo) alle cellule simpatiche toraco-lombari vengono interrotte
b) I nervi depressori seno-aortici
Sebbene il centro cardiovascolare bulbare sia capace di una scarica autonoma (che eccita la vasocostrizione simpatica), anche quando è separato dalle parti rostrali del sistema nervoso centrale, la sua attività è mantenuta tonicamente sotto controllo dal traffico d'impulsi dei nervi afferenti, le cui terminazioni sono situate sulla parete dell'arco aortico, sulle sue immediate diramazioni e sui seni carotidei. Il seno carotideo è costituito dalla parte dilatata dell'origine dell'arteria carotide interna. Le terminazioni nervose afferenti dell'arco aortico e dei seni carotidei sono recettori da stiramento. Ogni eiezione sistolica fa salire la pressione nelle arterie e distende le loro pareti. In corrispondenza di ogni aumento pressorio sistolico si ha una scarica di impulsi nervosi. Le terminazioni nervose sono depolarizzate dalla distensione e quindi scaricano impulsi. Se la distensione viene impedita circondando l'arteria con un rivestimento rigido, allora, comunque si faccia salire la pressione all'interno del lume arterioso, le terminazioni nervose non danno origine a impulsi.
Il seno carotideo, per la sua struttura anatomica, si presta bene alla perfusione artificiale per mezzo di una pompa (v. Heymans e Neil, 1958). La pressione all'interno del seno può essere aumentata o diminuita a volontà, e al tempo stesso si possono misurare le risposte circolatorie, come quella della pressione sanguigna sistemica. Un aumento della pressione nel circuito artificiale provoca una caduta della pressione sistemica. Questa risposta è riflessa e dovuta in gran parte, se non del tutto, all'effetto inibitorio dell'aumentata scarica di impulsi nervosi afferenti che raggiungono il centro cardiovascolare bulbare. Gli impulsi nervosi afferenti raggiungono, attraverso il seno carotideo, il nervo glossofaringeo e quindi il bulbo.
L'effetto di un aumento della pressione nei seni carotidei con circolazione artificiale è presente solo se i nervi vagali e aortici (che trasportano appunto detti impulsi dall'arco aortico) sono intatti. Se essi sono intatti, allora la caduta riflessa della pressione sanguigna sistemica, evocata appunto in via riflessa dall'aumento della pressione nei seni isolati, provocherà una rapida riduzione dell'attività afferente dei nervi vago-aortici. La riduzione del loro traffico afferente inibitorio diminuisce l'inibizione riflessa che questi impulsi esercitano sull'attività dei neuroni bulbari. Questi a loro volta portano a un aumento della costrizione simpatica e quindi delle resistenze periferiche. Quindi la risposta rivela una netta caduta iniziale della pressione sistemica, seguita da un ritorno graduale della pressione verso i suoi livelli iniziali, nonostante che sia stata mantenuta una pressione elevata nei seni perfusi. La pressione sistemica iniziale è più alta perehè la sezione del nervo vagoaortico ne ha abolito l'influenza tonica inibitoria. Adesso l'aumento artificiale della pressione del seno provoca una maggiore caduta della pressione. Infine, si ha una profonda caduta dovuta a un'ipertensione del seno dopo il taglio del nervo vago-aortico residuo. Tuttavia durante l'ipertensione dei seni non si nota alcun segno di recupero.
Del resto normalmente queste afferenze nei due nervi vago-aortici e nei due nervi del seno agiscono come una entità funzionale. Il nome di ‛nervi tampone' serve a descrivere sinteticamente la loro funzione. Se la pressione sanguigna cade, allora l'attività afferente di questi nervi diminuisce e la riduzione della loro influenza tonica inibitoria porta a una ‛liberazione' del centro cardiovascolare, che a sua volta aumenta la scarica simpatica vasocostrittrice. L'aumento della resistenza periferica tende a bilanciare il fattore primario che aveva prodotto l'ipotensione sistemica iniziale. Invece, i nervi tampone cercano di ridurre al minimo quelle ipertensioni che risultano da un improvviso aumento della gettata sistolica o da una scarica di impulsi simpatici ‛indotti da un'emozione'. I nervi tampone costituiscono un sistema di servocontrollo nel sistema cardiovascolare, non solo perché modificano la resistenza sistemica e la capacità, ma anche perché agiscono sulla frequenza e la forza del cuore.
La stabilizzazione della pressione sistemica media ottenuta con questi riflessi meccanocettivi è esemplificata benissimo dai mutamenti circolatori dovuti a cambiamenti posturali. Come si è riportato nel cap. 3, l'assunzione passiva della posizione eretta della testa provoca la distensione delle vene delle gambe, la riduzione del ritorno venoso, della gettata cardiaca e, quindi, della pressione sanguigna. La diminuita gettata sistolica e quindi una più bassa pressione arteriosa media portano a una riduzione degli impulsi afferenti barocettivi e a un aumento riflesso della scarica simpatica alle arterie, alle vene e anche al cuore, che aumenta la forza e la frequenza delle contrazioni. Questi aggiustamenti riflessi aiutano a mantenere a livelli adeguati la pressione arteriosa media, che ha una grandissima importanza nel mantenere il gradiente di pressione necessario a rifornire di sangue il cervello. Se il soggetto viene ‛simpatectomizzato' con la somministrazione di farmaci che bloccano la trasmissione degli impulsi simpatici, esso resta cosciente finché mantiene una posizione orizzontale. Quando gli viene sollevata la testa, esso sviene subito a causa del ristagno venoso e dell'assenza di ogni riflesso compensatorio di natura simpatica vasocostrittrice. Tuttavia questo svenimento può essere prevenuto insufflando aria nella metà inferiore di una tunica per ipogravità, fino a raggiungere una pressione di 10-20 mm Hg. L'aggiunta di questa pressione abbassa la pressione trasmurale nelle vene delle gambe, impedendone l'aumento nell'area della sezione trasversa responsabile del ristagno.
Una più sorprendente dimostrazione dei meccanismi compensatori è offerta durante l'emorragia. Una perdita di sangue, se sufficientemente lenta, non porta necessariamente a una caduta della pressione sanguigna media. Per questo, prima del 1940, le principali operazioni venivano normalmente condotte senza l'ausilio di trasfusioni di sangue; anche operazioni che duravano un'ora non producevano la caduta della pressione sanguigna media, sebbene per forza di cose del sangue andasse perduto. La spiegazione del mantenimento della pressione media si trova infatti nella presenza di aggiustamenti compensatori. La riduzione del volume sanguigno portava a una riduzione del ritorno venoso, a una minore gettata sistolica e a una minore pressione pulsatile (pressione sistolica meno pressione diastolica). Da questo derivava uno stimolo meno efficiente nell'eccitare i meccanocettori seno-aortici e quindi una progressiva liberazione dei centri simpatici e vasomotori cardiaci. La frequenza cardiaca mostrava un inesorabile aumento (che minimizzava ulteriormente le espansioni pulsatili delle regioni seno-aortiche) e la vasocostrizione sistemica aumentava costantemente, riducendo il flusso di sangue soprattutto ai reni, all'intestino, ai muscoli e alla pelle. L'aumento della resistenza periferica totale aiutava a mantenere la pressione sanguigna e con essa il flusso ematico cerebrale. I segnali di pericolo per l'anestesista erano un polso sottile e filiforme, un pallore ingravescente, cianosi cutanea e tumefazione della pelle e delle membrane mucose. La costrizione arteriolare abbassava la pressione idrostatica capillare e favoriva l'imbibizione osmotica di liquido tessutale che, a sua volta, aiutava a ristabilire il volume ematico, ma produceva il caratteristico ‛aspetto emaciato' proprio dell'emorragia.
Quando la perdita di sangue è più rapida e più grave, la pressione sanguigna cade inevitabilmente ma, anche in tali circostanze, si mantiene a livelli più alti che nel caso dell'animale o del soggetto simpatectomizzato. La vasocostrizione prolungata del muscolo, della pelle e dei visceri addominali nell'animale con vie simpatiche intatte, anche se è di primaria importanza nell'assicurare un miglior gradiente di pressione per il rifornimento di sangue al cervello, tuttavia, quando è troppo prolungata, porta a uno ‛shock circolatorio' con crollo della pressione arteriosa media, che può essere letale. Il rallentamento del rifornimento di materie nutritizie ematiche porta all'accumulo di prodotti del metabolismo anaerobio nei liquidi tessutali del muscolo, della pelle e dei visceri, e questi metaboliti causano un rilassamento delle arteriole per il loro effetto diretto sulla muscolatura liscia della parete dei vasi precapillari responsabili della resistenza periferica. L'unico trattamento efficace di una grave emorragia consiste nel sostituire il sangue prima possibile: infatti non si può contare sugli aggiustamenti compensatori riflessi della circolazione, utili e importanti, ma che possono venire meno in breve tempo.
c) Chemocettori aortici e carotidei
Le terminazioni nervose chemocettive, che sono stimolate da mancanza di ossigeno, da eccesso di CO2 e dall'acidosi, si trovano in piccoli accumuli di tessuto epiteliale in vicinanza dell'arco aortico (glomi aortici) e delle biforcazioni carotidee (glomi carotidei). Le fibre afferenti dei chemocettori carotidei decorrono nel nervo seno-carotideo, si uniscono al IX nervo e terminano nel bulbo. Queste fibre afferenti bulbari eccitano il centro vasomotorio e il centro respiratorio. Per la circolazione di un uomo in stato di riposo, l'influenza chemocettiva sul centro vasomotorio è di trascurabile importanza. Tuttavia specialmente in mancanza di ossigeno, l'aumento della loro attività afferente eccitatoria (v. fig. 19) provoca dei cambiamenti importanti sulle scariche di impulsi simpatici periferici, che producono un generale aumento delle resistenze periferiche. La mancanza di ossigeno può essere anossica (caduta della pressione parziale di ossigeno arteriosa, pO2), anemica (caduta del contenuto in ossiemoglobina, HbO2) e stagnante (caduta del volume del sangue, contenente ossigeno, che va ai tessuti). Ciascuna di queste forme di anossia aumenta la scarica chemocettiva che causa la vasocostrizione simpatica riflessa. Quindi se un animale respira il 5% di O2 in N2, la sua pressione sanguigna media sale, il che aiuta ad aumentare il rifornimento di O2 al cervello; ma se i nervi del seno e i vaghi sono tagliati, abolendo così i riflessi chemocettivi, il centro vasomotore viene rapidamente messo fuori funzione e la pressione sanguigna cade velocemente a valori bassi, letali.
L'aumento degli impulsi chemocettivi che segue una ipotensione emorragica evoca anche una vasocostrizione riflessa periferica, che aiuta a sostenere la pressione sanguigna media, quantunque a spese della circolazione del muscolo, della pelle e dei visceri addominali. Una volta di più, i vasi encefalici, sebbene quasi sprovvisti di una innervazione simpatica costrittrice, godono di un beneficio, di essere cioè riforniti da un flusso prodotto da un più elevato gradiente di pressione.
In un animale che sia stato privato di sangue in modo tale da abbassare la pressione sanguigna media a 60 mm Hg, la sezione dei nervi del seno e vagali provoca un'ulteriore caduta della pressione a causa dell'interruzione delle scariche di impulsi chemocettivi in condizioni di ipossia stagnante prodotta dall'ipotensione emorragica.
In mancanza cronica di ossigeno, come si verifica per coloro che vivono in zone di elevata altitudine, il volume ematico cresce a causa di un aumento del numero di eritrociti in circolazione. La mancanza di ossigeno provoca, infatti, la liberazione dal tessuto renale di un ormone glicoproteico, l'eritropoietina, che eccita la proliferazione di globuli rossi dalle cellule dei sinusoidi del midollo osseo. Naturalmente ci vuole del tempo perché si sviluppi questa policitemia e l'ipossia acuta non è associata ad alcun aumento della quantità dei globuli rossi. In condizioni croniche di anossia, l'aumento della capacità del sangue di trasportare ossigeno in conseguenza della policitemia è importante per migliorare la pO2 tissutale, il che è necessario per il metabolismo aerobico.
6. Influenze nervose cortico-ipotalamiche sulla circolazione
I dati precedenti indicano che molti dei cambiamenti della prestazione cardiaca, della resistenza e della capacità sistemiche possono essere dovuti a riflessi nervosi che agiscono sui centri bulbari, o a cambiamenti locali della composizione chimica dei tessuti in grado di influenzare i vasi sanguigni che decorrono in queste regioni. Tuttavia, anche l'uomo comune sa che la frequenza e la forza del proprio cuore e il proprio colorito sono soggetti a cambiamenti durante un'emozione. Così pure è ben conscio che gli improvvisi rialzi termici causano un diffuso aumento della circolazione della pelle e della sudorazione, e può avere imparato, a proprie spese, che in queste circostanze uno sforzo sproporzionato può provocare capogiro o svenimento.
Questi cambiamenti non sono dovuti ai centri bulbari, ma rappresentano delle alterazioni dell'attività dei neuroni di controllo che si trovano nell'ipotalamo e nella corteccia cerebrale.
Il concetto di un controllo autonomo superiore del sistema cardiovascolare fu introdotto nel 1910 da J. P. Karplus e A. Kreidl, che dimostrarono che la stimolazione dell'ipotalamo modificava sia la frequenza cardiaca che la pressione sanguigna. Da allora, grazie alle ricerche di P. Bard (v., 1928), W. R. Hess (v., 1948) e altri, si è d'accordo nel ritenere che l'ipotalamo contenga un numero di importanti ‛centri' dai quali si può eccitare un insieme di risposte specifiche e ben coordinate. Questo insieme di risposte generalmente concerne le componenti somatomotorie e ormonali e così pure le vie autonome, che sono tra loro collegate in modo da mettere l'intero organismo in grado di reagire in maniera appropriata a particolari situazioni. Anche se reazioni comportamentali molto elaborate possono essere prodotte dalla stimolazione elettrica di certe aree dell'ipotalamo - per esempio in un gatto cosciente si possono indurre le manifestazioni esterne della rabbia con la stimolazione dell'ipotalamo, per cui l'animale soffia, incurva la schiena, dà colpi di zampa all'aria e presenta tachicardia e ipertensione - tuttavia appena cessa la stimolazione, il gatto ritorna al precedente contegno di riposo. In questa reazione non c'è la componente cosciente, perché questa presupporrebbe la partecipazione della corteccia cerebrale. Le vie cortico-ipotalamiche influenzano e presiedono largamente alle scariche ipotalamiche dirette ai neuroni simpatici; la stimolazione artificiale dei neuroni stessi ha quindi saltato i neuroni corticali dai quali originano gli stimoli in condizioni naturali.
Le aree cerebrali del sistema autonomo sono situate soprattutto nel ‛sistema limbico', che deve il suo nome al fatto che circonda l'ipotalamo e il talamo come un anello. Il sistema limbico è il principale responsabile di un insieme di comportamenti complessi ereditari, che aiutano l'animale a sopravvivere, e del comportamento emotivo che è strettamente legato a quello ‛istintivo'. Le zone più importanti del sistema limbico, che influenzano quello cardiovascolare, sono situate: a) nel giro anteriore del cingolo; b) nella corteccia posteriore orbitale; c) nell'insula; d) nelle zone anteromediali dei lobi temporali, con il nucleo dell'amigdala. Queste strutture influenzano il sistema cardiovascolare attraverso le loro connessioni ipotalamiche.
I meccanismi cortico-ipotalamici sono responsabili di due sorprendenti modelli comportamentali che danno luogo a cambiamenti cardiovascolari: la ‛reazione di difesa' e la ‛morte simulata'.
a) La reazione di difesa
Questa può essere provocata, sia con stimolazione ipotalamica (v. Abrahams e altri, 1960 e 1964), sia con stimolazione dell'amigdala, e sia con la stimolazione di zone del giro anteriore del cingolo. Abrahams e collaboratori evocarono la reazione di difesa mediante stimolazione con elettrodi cronicamente impiantati nell'ipotalamo: essi notarono che la dilatazione pupillare, la retrazione della membrana nittitante, il drizzarsi delle orecchie, la piloerezione e le modificazioni respiratorie erano accompagnate da vasocostrizione cutanea, vasodilatazione muscolare, tachicardia e aumento della gettata sistolica anche quando lo stimolo era molto debole. Questi cambiamenti possono essere descritti come parte di una ‛reazione di allarme' che precede quel comportamento più complesso che è la ‛reazione di difesa': essa si manifesta quando si aumenta l'intensità dello stimolo elettrico, ed è caratterizzata dall'esplosione di attività somatomotorie in grado di produrre movimenti sia di lotta sia di fuga.
La vasodilatazione muscolare è di notevole interesse. Eliasson e altri (v., 1951) la provocarono per la prima volta con la stimolazione ipotalamica e dimostrarono che era dovuta all'eccitazione di una via cortico-ipotalamo-me sencefalo-romboencefalo-spinale, ben separata da quelle che sono responsabili dell'eccitazione delle fibre vasocostrittrici simpatiche noradrenergiche postgangliari. Le vie simpatiche vasodilatatrici terminano nei nervi simpatici postgangliari che liberano acetilcolina (colinergiche) e che innervano solo i vasi precapillari del circuito vascolare dei muscoli scheletrici. L'iniezione di atropina, che blocca la trasmissione colinergica, abolisce la vasodilatazione muscolare prodotta dalla stimolazione ipotalamica. Da quando sono stati pubblicati questi dati sul gatto, è stato molte volte dimostrato che, nell'uomo, situazioni che provocano ansietà causano anche vasodilatazione attiva nei muscoli scheletrici e che questa risposta è abolita dall'atropina. Le stesse situazioni provocano al tempo stesso un aumento della frequenza cardiaca e della gettata sistolica associata a ipertensione, ma l'atropina non è in grado di impedire l'aumento della gettata cardiaca o la vasocostrizione cutanea. Sembra che l'eccitazione artificiale della reazione di difesa, ottenuta con la stimolazione ipotalamica, sia molto simile a quella che avviene nell'animale cosciente: gli effetti cardiovascolari che ne derivano sono di natura tale da causare un aumento della gettata sistolica che si riverserà preferenzialmente nei muscoli (dove avviene la vasodilatazione) e nel cervello, a causa dell'aumento della pressione sanguigna (dovuta, sia alla vasocostrizione cutanea e splancnica, sia all'aumento della gettata sistolica).
I vantaggi di tutto ciò (cioè la trasformazione dell'animale in un preparato cuore-polmone e cervello-muscoli, pronto per l'intenso sforzo muscolare necessario sia per la lotta sia per la fuga) sono stati messi in evidenza in modo convincente. Uno stormir di fronde annuncia la presenza di un predatore nascosto alla gazzella che pascola ai limiti della foresta: questa manifesta subito le reazioni di allarme e di difesa e si lancia in fuga, con i muscoli già riforniti di un maggiore flusso di sangue. È stato dimostrato però che i vasodilatatori simpatici non determinano un notevole aumento del flusso ematico nei capillari muscolari e quindi non migliorano granché il rifornimento di ossigeno ai muscoli. L'aumentato flusso ematico muscolare è per la maggior parte deviato attraverso canali a ‛grande circolazione' che non riforniscono i capillari muscolari. Similmente la vasodilatazione indotta nei muscoli scheletrici adempie più la funzione di ‛valvola di sicurezza' che non quella di provvedere un notevole aumento di ossigeno ai muscoli. Siccome la creazione di difesa e accompagnata da un impressionante aumento della gettata sistolica, la forte riduzione della resistenza nella maggior parte dei vasi muscolari impedisce il manifestarsi di un forte aumento della pressione sanguigna. Il cuore, che batte molto più velocemente e con più forza, deve compiere un lavoro maggiore in ogni caso, poiché le richieste metaboliche sono in relazione soprattutto all'indice tempo-tensione, che è il prodotto della pressione sistolica media, della durata della sistole e della frequenza cardiaca. Se l'aumento dell'espulsione cardiaca dovesse verificarsi in corrispondenza ad un aumento della resistenza periferica, allora il lavoro del cuore diverrebbe eccessivo. Poiché le vasocostrizioni cutanea e splancnica avvengono in risposta alle reazioni di ‛allarme' e di ‛difesa', la resistenza periferica aumenterebbe se non si verificasse, contemporaneamente, una vasodilatazione muscolare capace di annullare l'aumento della resistenza periferica totale e di portarla persino a valori più bassi della norma.
Sebbene la vasodilatazione muscolare non aumenti il rifornimento metabolico del tessuto muscolare, questo ha poca importanza se i muscoli stessi divengono attivi, poiché, come è stato sottolineato precedentemente, l'iperemia da esercizio muscolare è interamente dovuta a fattori chimici locali prodotti dall'attività muscolare stessa.
Lo stesso uomo civilizzato è incline ad assumere certi atteggiamenti spontanei che caratterizzano la reazione di difesa, anche quando un'alta educazione sociale lo trattiene da manifesti atteggiamenti di lotta o di fuga. Un aspro rimprovero da parte del capufficio, una discussione accanita con la moglie provocano cambiamenti del sistema autonomo senza che ci sia la possibilità di alleggerire il lavoro del cuore attraverso un'attività somatomotoria che diminuisca le resistenze periferiche per effetto dell'attività muscolare. Individui irascibili con coronarie sclerotiche possono, in questi casi, cadere in terra fulminati per insufficienza coronarica.
Qual è allora, in queste circostanze di emozione e di sforzo, il ruolo dei meccanismi di controllo bulbari barocettivi? Questi sono ovviamente sopraffatti per la preponderante scarica cortico-ipotalamica che si riversa sui centri simpatici bulbari e spinali. Ciò non vuol dire che la loro influenza sia trascurabile: essi possono infatti aiutare a frenare il cuore e a impedire che la sua frequenza salga al di sopra di 180 battiti al minuto (valore al di sopra del quale è facile che insorgano l'aritmia cardiaca e l'insufficienza coronarica). Il controllo generale che essi esercitano sugli individui in riposo viene appunto temporaneamente sospeso in circostanze di emergenza.
b) La reazione di ‛morte simulata'
Alcune specie animali, messe di fronte a un pericolo imminente, manifestano la reazione di ‛morte simulata': questa è abbastanza caratteristica nell'opossum, tanto che si parla di ‛simulazione dell'opossum', ma molte altre specie animali, come i piccoli del cervo, rispondono in maniera analoga al pericolo. L'animale cade a terra come morto, flaccido, quasi in apnea completa, con bradicardia e ipotensione. Questa risposta comportamentale ha valore protettivo. L'animale predatore può essere incapace di trovare la preda, oppure, se la scopre, è confuso dall'apparente morte dell'animale e se ne va dopo averne annusato la carcassa. Löfving ha dimostrato che la stimolazione delle zone del giro anteriore del cingolo, nel gatto, produce un'inibizione generalizzata della scarica simpatica noradrenergica al cuore e ai vasi, con simultaneo aumento del tono vagale, con il risultato di una bradicardia e di una straordinaria caduta della pressione del sangue. La riduzione del tono dei vasi sanguigni muscolari è così marcata che, nonostante la caduta della pressione sanguigna media, il flusso ematico muscolare aumenta temporaneamente. La stimolazione dell'area cingolare ‛inibitoria' deprime anche il tono muscolare scheletrico.
I cambiamenti cardiovascolari e somatomotori, indotti artificialmente nel gatto, possono essere verificati nell'uomo quando sviene. Né l'uomo né il gatto manifestano naturalmente la reazione di ‛morte simulata' in risposta a stress, ma le vie neurologiche responsabili della sua eccitazione sono tuttavia presenti. Alcuni individui reagiscono a shock emotivi crollando su una sedia o svenendo, cosicché la risposta non può essere ignorata. La via di queste ‛fibre inibitorie del cingolo', che è separata da quella responsabile della ‛reazione di difesa' di origine cortico-ipotalamica, è stata ben individuata e si è visto che termina nella parte mediale del bulbo e in vicinanza del nucleo motore dorsale del vago.
c) Centri cardiovascolari termoregolatori
In un ambiente termico uniforme (di 25-30 °C) il flusso ematico cutaneo può essere approssimativamente di 10 ml/100 g/min, anche se vi sono considerevoli differenze regionali. In queste circostanze, la scarica vasocostrittrice è responsabile della limitazione del flusso ematico e il flusso cutaneo locale viene raddoppiato dal blocco dei nervi simpatici regionali.
In un ambiente freddo il flusso cade a 1 ml/100 g/min e in condizioni di intenso stress termico può salire fino a 150 ml/100 g/min. Ne segue che la circolazione cutanea non ha nessuna relazione con le necessità metaboliche della pelle stessa, ma è controllata dalle necessità omeostatiche termiche del corpo che reagisce come un tutto. Questa omeotermia nei Mammiferi dipende dall'integrità dell'ipotalamo e delle sue connessioni afferenti ed efferenti con le varie parti del corpo. Se il tronco dell'encefalo è sezionato sotto il livello dell'ipotalamo, l'animale diventa poichilotermico (temperatura irregolare che dipende da quella dell'ambiente esterno).
Un aumento della temperatura corporea provoca la scarica dei neuroni nell'ipotalamo anteriore, che inibiscono la scarica delle fibre vasocostrittrici noradrenergiche simpatiche che vanno alla pelle, ma che eccitano la scarica dei neuroni colinergici postgangliari alle ghiandole sudoripare. Queste ultime fibre non solo provocano una secrezione di sudore (che evaporando perde 0,58 Kcal/g), ma anche una vasodilatazione cutanea. Quest'ultima è dovuta a un enzima, presente nelle cellule sudoripare, che, uscendo esternamente dai tubuli delle ghiandole sudoripare, demolisce le proteine negli spazi tessutali dando origine a bradichinina: la bradichinina, come è noto, provoca una considerevole vasodilatazione.
Una caduta della temperatura corporea aumenta l'attività dei neuroni, soprattutto dell'ipotalamo posteriore, che stimolano la scarica simpatica vasocostrittrice diretta alla pelle (e al muscolo) facendo scendere il flusso sanguigno cutaneo fino al valore di 1 ml/min.
Le esigenze della omeostasi termica hanno un'importanza più rilevante rispetto a tutti gli altri fattori che influenzano
il sistema cardiovascolare e, come notato in precedenza, uno sforzo durante un prolungato stress da alta temperatura può produrre un collasso circolatorio.
7. Nervi vasodilatatori e loro ruolo nel controllo circolatorio
Nelle pagine precedenti è stata descritta la regolazione nervosa della resistenza periferica e della capacità quasi esclusivamente in termini di modificazione dell'attività tonica di base dei nervi vasocostrittori. Con una'eccezione (l'influenza dilatatrice di natura simpatica colinergica sui vasi muscolari), la vasodilatazione di origine neurologica è stata attribuita ad una riduzione del tono simpatico noradrenergico vasocostrittore, perché questa è di gran lunga il mezzo più importante per ottenere una vasodilatazione di natura nervosa, in quanto nella circolazione le modificazioni avvengono in tutto il corpo.
Nervi specifici vasodilatatori esistono, ma non svolgono che un ruolo di scarsa importanza nel controllo della circolazione. Si tratta dei nervi parasimpatici che innervano soltanto parti specifiche e localizzate del sistema vascolare. Fanno parte di questi i nervi delle ghiandole salivari e gastriche (rispettivamente il VII, il IX e il X nervo cranico, le cui fibre postgangliari sono colinergiche), e quelli dei genitali esterni provenienti dalla parte sacrale del midollo spinale (S2 S3) che forniscono i nervi erigenti: queste fibre postgangliari sono colinergiche e, come dice il nome, provocano la congestione dei tessuti erettili e la conseguente erezione del pene o del clitoride. Anche se di indubbia importanza in particolari circostanze, questi nervi non hanno alcun ruolo nel controllo generale della circolazione; lo stesso vale per le fibre craniali delle ghiandole salivari e gastriche, anche se la loro attività periodica aiuta ad accrescere il rifornimento di ossigeno al sangue e di sostanze nutritizie richieste per il lavoro di secrezione.
Bibliografia
Abrahams, V. C., Hilton, S. M., Zbrozyna, A., Active muscle vasodilatation produced by stimulation of the brain stem: its significance in the defence reaction, in ‟Journal of physiology", 1960, CLIV, pp. 491-513.
Abrahams, V. C., Hilton, S. M., Zbrozyna, A., The role of active muscle vasodilatation in the alerting stage of the defence reaction, in ‟Journal of physiology", 1964, CLXXI, pp. 189-202.
Alexander, R. S., Tonic and reflex functions of medullary sympathetic cardiovascular centres, in ‟Journal of neurophysiology", 1946, IX, pp. 205-217.
Bainbridge, F. A., The influence of venous filling upon the rate of the heart, in ‟Journal of physiology", 1915, L, pp. 65-84.
Bard, P., A diencephalic mechanism for the expression of rage with special reference to the sympathetic nervous system, in ‟American journal of physiology", 1928, LXXXIV, pp. 490-515.
Bernard, C., De l'influence du système nerveux grand sympathique sur la chaleur animale, in ‟Comptes rendus hebdomadaires des séances de l'Académie des Sciences", 1852, XXXIV, pp. 472-475.
Brown-Séquard, C. E., Experimental researches applied to physiology and pathology, in ‟Philadelphia medical examiner", 1852, VIII, pp. 481-504.
Burton, A. C., Physiology and biophysics of the circulation, Chicago 19722.
Cyon, E., Ludwig, C., Die Reflexe eines der sensibeln Nerven des Herzen auf die motorischen Nerven der Blutgefässe, in ‟Berichte über die Verhandlungen der Königlich sächsischen Gesellschaft der Wissenschaften zu Leipzig. Mathematisch-physische Classe", 1866, XVIII, pp. 307-328.
Eliasson, S., Folkow, B., Lindgren, P., Uvnäs, B., Activation of sympathetic vasodilator nerves to the skeletal muscles in the cat by hypothalamic stimulation, in ‟Acta physiologica scandinavica", 1951, XXIII, pp. 333-351.
Folkow, B., Neil, E., Circulation, New York 1971.
Hamilton, W. F., The physiology of the cardiac output, in ‟Circulation", 1953, VIII, pp. 527-543.
Hess, W. R., Die funktionelle Organisation des vegetativen Nerven-systems, Basel 1948.
Heymans, C., Neil, E., Reflexogenic areas in the cardiovascular system, London 1958.
Karplus, J. P., Kreidl, A., Gehirn und Sympathicus. I. Mitteilung. Zwischenhirnbasis und Halssympathicus, in ‟Pflügers Archiv", 1909, CXXIX, pp. 138-144.
Landis, E. M., The capillary blood pressure in mammalian mesentery as determined by the micro-injection method, in ‟American journal of physiology", 1930, XCIII, pp. 353-362.
Linden, R. J., The heart-ventricular function, in ‟Anaesthesia", 1968, XXIII, pp. 566-584.
Pappenheimer, J. R., Passage of molecules through capillary walls, in ‟Physiological reviews", 1953, XXXIII, pp. 387-423.
Pappenheimer, J. R., Soto-Rivera, A., Effective osmotic pressure of the plasma proteins and other quantities associated with the capillary circulation in the hind limbs of cats and dogs, in ‟American journal of physiology", 1948, CLII, pp. 471-491.
Poiseuille, J. L. M., Recherches expérimentales sur le mouvement des liquides dans les tubes de très petits diamètres, in ‟Mémoirs savants étrangers", 1846, IX, pp. 433-544.
Rushmer, R. F., Cardiovascular dynamics, London 1961.
Sarnoff, S. J., Brockman, S. K., Linden, R. J., Mitchell, J. H., Regulation of ventricular contraction. Influence of cardiac sympathetic and vagal nerve stimulation on atrial and ventricular dynamics, in ‟Circulation research", 1960, VIII, pp. 1108-1122.
Sonnenblick, E. H., Force-velocity relations in mammalian heart muscle, in ‟American journal of physiology", 1962, CCII, pp. 931-939.
Starling, E. H., On the absorption of fluids from the connective tissue spaces, in ‟Journal of physiology", 1896, XIX, pp. 312-326.
Starling, E. H., The Linacre lecture on the law of the heart, London 1918.
Weber, E. F. W., Weber, E. H., Experimenta, quibus probatur nervos vagos rotatione machinae galvano-magneticae irritatos, motus cordis retardare et adeo intercipere, in ‟Annali universali di medicina", 1845, CXVI, pp. 227-228.
Zuntz, N., Hagemann, O., Untersuchungen über den Stoffwechsel des Pferdes bei Ruhe und Arbeit, in ‟Landwirtschaftliches Jahrbuch", Ergänzungsband III, 1898, pp. 1-10.
Elettrofisiologia del cuore
di Wolfgang Trautwein
SOMMARIO: 1. Introduzione. 2. Potenziale di riposo e potenziale d'azione delle fibre cardiache: a) stimolo e soglia; b) potenziale pacemaker. 3. Proprietà di cavo del muscolo cardiaco: a) proprietà delle connessioni intercellulari; b) ‛recupero' nel muscolo cardiaco. 4. Il potenziale di riposo, teoria e dipendenza ionica. 5. Le correnti ioniche in relazione all'eccitazione: a) blocco di voltaggio; b) correnti dirette verso l'interno (depolarizzanti) della membrana; c) correnti di membrana dirette verso l'esterno (correnti di K); d) correnti di membrana e potenziale d'azione. 6. Effetto delle concentrazioni ioniche extracellulari sul potenziale d'azione: a) sodio; b) calcio; c) potassio; d) anioni. 7. Refrattarietà nel muscolo cardiaco. 8. Propagazione dell'impulso e velocità di conduzione. 9. Vie di propagazione dell'impulso nel cuore di Mammifero: a) atri; b) nodo a. v.; c) eccitazione ventricolare; d) ripolarizzazione ventricolare; e) propagazione della ripolarizzazione. 10. La relazione tra potenziale di membrana, corrente di membrana e contrazione: a) ruolo degli ioni calcio. 11. Gli effetti dell'innervazione afferente sul cuore: a) innervazione vagale; b) innervazione simpatica. □ Bibliografia.
1. Introduzione
L'elettrofisiologia del cuore ha molti problemi in comune con l'elettrofisiologia del nervo e della muscolatura scheletrica. Infatti, i meccanismi fondamentali dell'eccitazione, della propagazione degli impulsi, degli effetti dei trasmettitori e delle relazioni elettromeccaniche sembrano applicarsi a tutte le strutture eccitabili e contrattili. Tuttavia, a causa della speciale anatomia e della specifica funzione del cuore vi sono per il muscolo cardiaco variazioni tipiche dei principi generali che assicurano l'attività di questo organo.
Il cuore, come una pompa, svolge la sua attività a cicli, ciascuno comprendente un periodo di riempimento (dia- stole) seguito da un periodo di espulsione (sistole). Durante ciascun ciclo un gran numero di singole cellule deve svolgere un'attività coordinata. Le proprietà delle cellule cardiache che permettono tale attività coordinata sono l'argomento primario dell'elettrofisiologia del cuore. Tali proprietà sono: 1) generazione spontanea dell'impulso, che ha luogo normalmente solo nel nodo del seno che è il pacemaker del cuore; 2) propagazione dell'impulso da una cellula all'altra e presenza di vie definite di conduzione che garantiscono una sequenza coordinata della contrazione; 3) potenziale d'azione di lunga durata durante il quale il muscolo non può essere rieccitato (cioè impossibilità di attività tetanica). Queste due proprietà sono sotto la continua iniluenza dell'innervazione del sistema nervoso autonomo, sia dell'innervazione simpatica che vagale. L'attività di questi nervi libera sostanze chimiche, i mediatori, che inibiscono (vago, acetilcolina) o fanno aumentare (simpatico, noradrenalina o adrenalina) l'attività del muscolo.
A causa della sua lunga durata, il potenziale d'azione cardiaco poté essere registrato, con strumenti relativamente lenti, già nel secolo scorso (v. Burdon-Sanderson e Page, 1883). Da quel tempo sono state fatte molte importanti scoperte che hanno grandemente influenzato la teoria e la sperimentazione fino ai nostri giorni. Tra queste ricordiamo, ad esempio, la necessità della presenza di sodio per l'eccitazione (v. Overton, 1902) e la dipendenza del potenziale di lesione (riposo) dalla concentrazione extracellulare del potassio e dalla temperatura. I successivi esperimenti eseguiti da J. Bernstein (v., 1912) portarono alla sua teoria della membrana per i potenziali biologici. Più tardi, nell'era del galvanometro a corda (Einthoven) e del pendolo di H. von Helmholtz, si raggiunsero cognizioni molto approfondite sul potenziale d'azione cardiaco e sull'eccitabilità del cuore durante il ciclo cardiaco. La letteratura molto vasta apparsa fino al 1936 fu presa in esame da E. Schütz. Ciononostante, soprattutto per ragioni di metodo, l'elettrofisiologia cardiaca rimase per tutta la prima metà di questo secolo una scienza piuttosto qualitativa e descrittiva.
Un grande cambiamento si ebbe agli inizi degli anni cinquanta quando divenne possibile misurare il potenziale di membrana di singole cellule cardiache con il microelettrodo di Ling-Gerard (v. Woodbury e altri, 1951). Questa e altre tecniche, come la tecnica dei traccianti e la fotometria a fiamma che permisero lo studio dei movimenti ionici e la misurazione di basse concentrazioni di ioni, fecero fare considerevoli progressi verso l'avvento del momento quantitativo in elettrofisiologia. Negli ultimi 20 anni l'influenza più grande nell'evoluzione dell'elettrofisiologia cardiaca è stata esercitata dalla teoria ionica dell'eccitazione nel nervo (v. i contributi di Hodgkin e Huxley, 1952). Questa teoria spiegò quantitativamente lo spike della fibra nervosa con il flusso di correnti ioniche (sodio e potassio) attraverso la membrana cellulare. Da allora l'aspirazione degli elettrofisiologi del cuore è stata quella di presentare la teoria ionica per il potenziale d'azione cardiaco (v. Weidmann, 1956; v. Noble, 1962). Una tale teoria completa non esiste ancora, ma negli ultimi anni sono stati apportati molti dati alla conoscenza delle correnti ioniche nel muscolo cardiaco.
Un problema classico nell'elettrofisiologia del cuore è la relazione tra potenziale d'azione e contrazione. Sono entrambi di durata quasi uguale e vi sono molti esempi di accorciamento del potenziale d'azione accompagnato da contrazione più debole. Per l'attivazione delle strutture contrattili all'interno delle fibre sembrano in gioco vari stadi dell'attività elettrica, cioè del potenziale d'azione che si ha nella membrana cellulare. Alcuni di questi stadi sono stati analizzati, altri sono attualmente in fase di studio in diversi laboratori.
2. Potenziale di riposo e potenziale d' azione delle fibre cardiache
Come in altre cellule eccitabili, la membrana plasmatica della fibra cardiaca, che separa l'interno dallo spazio extracellulare, è polarizzata: vi è cioè una differenza di potenziale (‛potenziale di membrana') ai due lati del sarcolemma. Il potenziale di membrana può essere misurato inserendo un microelettrodo nella fibra e registrando la differenza di potenziale tra la punta di questo e un elettrodo di riferimento situato extracellularmente. Nel preparato a riposo e durante la diastole questa differenza di potenziale è di 80-90 mV, con l'interno della cellula negativo (‛potenziale di riposo'). In preparati di cuore pulsanti intervengono periodici cambiamenti della polarizzazione della membrana (‛potenziali d'azione'), che sono accompagnati da contrazioni. Tali misurazioni possono essere eseguite molto bene in frammenti isolati del sistema di conduzione specifico (fibre di Purkinje) di cuore di Mammifero o nelle trabecole isolate o nei muscoli papillari del ventricolo di Mammifero tenuti in soluzione ossigenata di Tyrode.
Il potenziale d'azione ha inizio con un rapido innalzamento (durata di circa 1 ms) dal livello di riposo fino a circa 25 mV, con l'interno positivo (overshoot). Questo innalzamento è seguito da un plateau che si mantiene per circa 200 ms e dalla ripolarizzazione finale con ritorno al potenziale di riposo. La durata del potenziale d'azione cardiaco è alquanto variabile. Essa dipende dalla frequenza del battito e diviene più breve quando tale frequenza aumenta (v. Hoffman e altri, 1954; v. Trautwein e Dudel, 1954). Per frequenze uguali la durata differisce pure considerevolmente nei diversi tessuti cardiaci (v. Hoffman e Cranefield, 1960; v. Trautwein, 1961). Come dimostra questa figura, vi sono anche variazioni tipiche nella configurazione del potenziale d'azione. Molto pronunciati sono soprattutto il grande picco e il plateau a potenziale di membrana negativo osservati nel sistema di conduzione specifico, in confronto a quanto si osserva per il miocardio ventricolare, dove il picco iniziale viene a mancare e il plateau si ha a potenziale di membrana positivo. Sembra non esservi alcuna differenza nell'ampiezza e nella configurazione dei potenziali d'azione, sia che essi siano registrati da preparati in vitro, sia da fibre superficiali del cuore esposto in situ.
La configurazione del potenziale d'azione cardiaco è molto labile e sensibile a vari fattori fisici e chimici, che saranno in parte discussi e spiegati più avanti. Oltre alla temperatura (v. Trautwein e altri, 1953) e al pH, la configurazione del potenziale d'azione è notevolmente influenzata dalla composizione ionica extracellulare e dalle alterazioni del metabolismo cellulare, come l'anossia o la presenza di inibitori metabolici (v. Trautwein, 1963).
a) Stimolo e soglia
I potenziali d'azione illustrati nelle figg. 1-3 sono stati ottenuti stimolando con impulsi di corrente e si propagavano dal punto di stimolazione all'elettrodo di registrazione. L'effetto della corrente di stimolazione può essere osservato quando il potenziale di membrana viene registrato in stretta prossimità dell'elettrodo stimolante. Gli impulsi di corrente applicati all'interno di una fibra producono o depolarizzazioni o iperpolarizzazioni (potenziali elettrotonici) a seconda della polarità dell'impulso di corrente. L'ampiezza del potenziale elettrotonico è all'incirca proporzionale all'ampiezza dell'impulso di corrente, indicando una resistenza costante della membrana. A differenza dell'impulso di corrente quadrato, il potenziale elettrotonico cresce e cade esponenzialmente a causa della capacità della membrana che deve essere caricata e scaricata. Quando l'ampiezza dell'elettrotono è di circa 12-15 mV (depolarizzazione da −90 a −75 mV), si raggiunge la soglia per l'eccitazione. A quel punto il potenziale elettrotonico si trasforma nella fase ascendente del potenziale d'azione. L'ampiezza della corrente che depolarizza la membrana fino alla soglia del potenziale d'azione è dell'ordine di 1-5•10-7 A.
b) Potenziale pacemaker
Nelle fibre capaci di autoeccitarsi e di reagire a uno stimolo il potenziale di membrana durante la diastole non è costante, ma si ha una depolarizzazione lenta, detta potenziale pacemaker, fino a che si raggiunge la soglia alla quale compare un nuovo potenziale d'azione. Potenziali pacemaker furono registrati dal seno venoso della tartaruga (v. Brady e Hecht, 1954) e del cuore di rana (v. Trautwein e Zink, 1952), dal nodo del seno (v. West, 1955), dal nodo atrio-ventricolare (v. Hoffman e altri, 1959) e dalle fibre di Purkinje (v. Weidmann, 1951) di Mammifero. Nel nodo a. v. e nelle fibre di Purkinje il potenziale pacemaker ha frequenza minore che nel seno. Esso non raggiunge la soglia in queste fibre, le quali vengono eccitate dalla propagazione del potenziale d'azione che si origina nel seno. Tali fibre di conduzione con capacità di pacemaker sono chiamate ‛pacemakers latenti'. Esse sono riconoscibili per la comparsa improvvisa del picco. In situ la frequenza del potenziale pacemaker nel nodo a. v. e nel sistema di conduzione ventricolare è probabilmente alquanto bassa. A questa conclusione si giunge dall'osservazione che il potenziale pacemaker è soppresso quando la fibra è stimolata elettricamente a una frequenza superiore al suo ritmo intrinseco (v. Vassalle e Carpentier, 1972). Tale soppressione del pacemaker latente da parte del pacemaker dominante del seno potrebbe anche spiegare perché dopo un arresto improvviso dell'attività del seno deve trascorrere qualche tempo prima che si origini un nuovo pacemaker a livello gerarchico più basso.
La depolarizzazione del pacemaker è sotto il continuo controllo dell'innervazione (v. sotto, cap. 11). La velocità di depolarizzazione è drasticamente ridotta quando si abbassa la temperatura, essendo il Q10 circa 6 (v. Coraboeuf e Weidmann, 1954). La velocità decresce pure sotto l'influenza di inibitori metabolici. Entrambi questi fattori, abbassamento della concentrazione del sodio extracellulare e innalzamento della concentrazione del potassio extracellulare, riducono la frequenza del potenziale pacemaker, cioè la frequenza del preparato. Lo stiramento del nodo del seno o delle fibre di Purkinje fa aumentare la velocità di depolarizzazione.
3. Proprietà di cavo del muscolo cardiaco
La resistenza e la capacità della membrana cellulare, così come la resistenza del mioplasma, sono proprietà importanti in rapporto all'eccitabilità, all'eccitazione e alla propagazione del potenziale d'azione. Queste cosiddette ‛costanti di fibra' possono essere facilmente misurate in preparati con le caratteristiche geometriche di un cavo. In elementi delle fibre di Purkinje brevi cellule individuali della lunghezza di circa 150 nm sono sistemate in una colonna formante una struttura del tipo di quella di un cavo, paragonabile a una singola fibra nervosa. Questo presuppone che le cellule non siano isolate l'una dall'altra e che la corrente possa passare attraverso Ri (resistenza del mioplasma e dei dischi intercalari) da una cellula direttamente a un'altra adiacente.
I valori numerici delle componenti del circuito modello possono essere determinati con un'analisi delle proprietà di cavo (v. Hodgkin e Rushton, 1946) dalla resistenza di entrata (R0) e dalla costante di lunghezza λ. Per misurare R0 e λ si applicano impulsi quadrati di corrente di ampiezza I0 e si determina l'ampiezza del potenziale elettrotonico (Vx) in funzione del crescere della distanza x dalla sorgente della corrente (x=0). L'ampiezza declina con x con andamento esponenziale. Sia la resistenza di entrata (R0=V(x=0)/I0) sia la costante di lunghezza λ (distanza alla quale R è scesa al 37%) possono essere ricavate da un grafico dove è riportato il logaritmo dell'ampiezza in funzione di x. Dall'equazione di cavo è possibile determinare Ri ed Rm:
dove Ri è la resistenza di 1 cm di mioplasma e Rm è la resistenza di 1 cm di membrana della fibra.
Come nelle fibre dei nervi e della muscolatura scheletrica, la resistenza specifica della membrana delle fibre cardiache è elevata, mentre la resistenza specifica dell'interno della fibra Ri è relativamente bassa (v. Weidmann, 1952). Questo indica che le membrane cellulari rappresentano delle notevoli barriere alla diffusione, ma che gli ioni possono muoversi con relativa libertà da una cellula a un'altra adiacente attraverso il disco intercalare. Nelle trabecole ventricolari del cuore di Mammifero si è misurata una capacità di membrana di 1 μF/cm2 (v. Weidmann, 1970), molto più piccola che nelle fibre di Purkinje (12 μF/cm2, v. Weidmann, 1952). Anche la resistenza interna è più elevata (470 Ω•cm) nel miocardio che nelle fibre di Purkinje, presumibilmente per la minore lunghezza della cellula, cioè per la presenza di più dischi intercalari per unità di lunghezza del muscolo.
Secondo risultati recenti, lo schema elettrico di un elemento della fibra di Purkinje è più complicato del semplice modello riportato nella fig. 6A. Sono stati proposti altri due modelli sperimentalmente indistingui bili. Nella fig. 6B (v. Fozzard, 1966; v. Dudel e altri, 1966) compare una capacità Ce in serie con la capacità della membrana citoplasmatica attraverso una resistenza Re. Nel muscolo scheletrico di rana si è potuto dimostrare che Ce è una proprietà della membrana dei tubuli trasversi (sistema T), lungo i quali l'eccitazione viene condotta attraverso la membrana dall'esterno all'interno della fibra (v. Falk e Fatt, 1964). Re è presumibilmente da localizzare nel lume del tubulo. Le fibre di Purkinje non hanno un sistema T, ma hanno profondi valli tra le cellule, che possono avere effetti elettrici simili a quelli del tubulo. L'anatomia di elementi delle fibre di Purkinje, consiste di alcune fibre connesse lateralmente e longitudinalmente per mezzo di una struttura chiamata nexus. Entrambi i nexus che connettono le cellule in direzione radiale e longitudinale hanno una resistenza e una capacità.
Usando impulsi quadrati di bassa frequenza la deviazione dell'innalzamento elettrotonico da un singolo esponenziale è piccola e la misura della capacità totale (Cm+Ce) dà valori di 10-12 μF/cm2. Un segnale di alta frequenza, tuttavia, caricherà soltanto Cm, la capacità situata nel sarcolemma che è intorno a 2-3 μF/cm2. Cm e Ce possono essere determinate anche attraverso esperimenti di blocco del voltaggio. La corrente capacitiva che scorre all'on e all'off di un piccolo gradiente di voltaggio mostra un'onda iniziale e una coda più lenta. È stato calcolato che la fase dell'onda contiene circa 2,4 μF/cm2 (Cm) e la fase lenta 7 μF/cm2 (Ce), con una resistenza in serie (Re) di 300 Ω•cm (v. Fozzard, 1966; v. Dudei e altri, 1966). Nel circuito riportato nella fig. 6C si è supposto che la capacità in serie sia localizzata nei nexus che congiungono lateralmente (Cnr) e longitudinalmente (Cnl) le fibre del fascio. Questo circuito equivalente è confermato da misure sia dell'angolo di fase fra una corrente sinusoidale applicata e il cambio di voltaggio, sia dell'impedenza longitudinale, entrambi i parametri come funzione della frequenza (v. Freygang e Trautwein, 1970). Il risultato di entrambi i tipi di esperimento ha indicato la presenza di una capacità Òrientata lateralmente e longitudinalmente, dovuta con ogni probabilità a proprietà delle connessioni (nexus) fra le cellule, sia radialmente sia longitudinalmente.
a) Proprietà delle connessioni intercellulari
Tutte le ricerche sulla distribuzione della corrente nel muscolo cardiaco fanno pensare che la corrente possa passare da una cellula a un'altra adiacente, indicando che la resistenza combinata (resistenza interna) del mioplasma e della connessione intercellulare è bassa in confronto a quella della membrana citoplasmatica. Il basso valore della resistenza interna fa sì che il cuore si comporti dal punto di vista funzionale come un sincizio che permette il passaggio intercellulare della corrente, come è necessario per la propagazione dell'impulso. La bassa resistenza interna implica che la resistenza dei dischi intercalari sia bassa. Misure della resistenza dei dischi basate su misure elettrofisiologiche hanno dato valori di 1-2 Ω•cm2 (v. Woodbury e Crill, 1961). Un valore simile è stato trovato con la misurazione del flusso longitudinale di un radio-tracciante, per esempio il 42K+, attraverso l'interno di un elemento miocardico.
Nella situazione sperimentale della fig. 7 la parte sinistra era sovraccaricata con 42K+, la parte destra veniva lavata continuamente con soluzione inattiva. Se la resistenza attraverso il mioplasma e i dischi (Ri) è bassa in confronto alla resistenza della membrana (Rm), il 42K+, entrando nelle fibre dalla parte sinistra, si sposta intracellularmente verso la parte destra. Alternativamente, per un rapporto Ri/Pm elevato, la radioattività lascerà le cellule al loro bordo per passare nello spazio extracellulare, dal quale essa viene eliminata con il lavaggio. Quando veniva raggiunto l'equilibrio di diffusione, la metà destra del preparato veniva tagliata in fette sottili, nelle quali si eseguiva una misura della radioattività. La radioattività diminuiva con andamento logaritmico fino al 37% in 1-2 mm (=λ). Da λ e da altri parametri la resistenza del disco al passaggio del potassio fu valutata essere da 5.000 a 25.000 volte più bassa della resistenza della membrana della fibra per unità di superficie. Questo corrisponde a un valore massimo della resistenza del disco di 3 Ω•cm2 (v. Weidmann, 1966). In tal modo osservazioni di altro tipo hanno fornito, per la resistenza del disco, un valore all'incirca ugualmente basso. La via di bassa resistenza sembra essere situata nel nexus, che è una struttura speciale all'interno del disco intercalare. È possibile interrompere il nexus immergendo il preparato in una soluzione ipertonica e studiare così gli effetti elettrici dell'interruzione. Nel miocardio di Mammifero si può trovare una correlazione tra il numero di nexus interrotti e la resistenza longitudinale; ciò fa pensare che il nexus rappresenti la via di bassa resistenza tra le cellule (v. Barr e altri, 1965).
b) ‛Recupero' nel muscolo cardiaco
Il nexus sembra essere la struttura a livello della quale compare la demarcazione in seguito a una lesione delle cellule. Th. W. Engelmann nel 1877 osservò che nel muscolo cardiaco la depolarizzazione prodotta da una lesione è solo di breve durata, ma viene a ristabilirsi quando una nuova lesione viene a collocarsi il più vicino possibile alla precedente. Egli ipotizzò la formazione di una nuova barriera ionica come meccanismo di questo effetto di ‛recupero'. Il ripristino del potenziale di riposo che fa seguito alla lesione si attua in uno o pochi minuti. Il recupero non compare in soluzione di Tyrode priva di Ca2+ ed è ritardato per un basso livello di Ca2+ extracellulare (v. Délèze, 1970). Questa osservazione fa supporre un ruolo preponderante degli ioni calcio nella demarcazione. Nelle cellule di ghiandole salivari intatte è stata dimostrata, mediante iniezione di ioni calcio, l'interruzione della connessione elettrica e si è pensato che la nuova barriera venga formata a livello di membrane di giunzione paragonabili al nexus. Sembra, perciò, che la demarcazione risulti da un aumento della resistenza del nexus, che interviene quando la concentrazione del calcio intracellulare in una cellula lesa divenuta permeabile raggiunge il valore di quella del liquido extra-cellulare.
4. Il potenziale di riposo, teoria e dipendenza ionica
Il potenziale di riposo è determinato dalla permeabilità agli ioni sodio, potassio e cloro e dal rapporto fra le concentrazioni extracellulari e intracellulari di questi ioni. Come per il nervo e per le fibre della muscolatura scheletrica, la relazione della permeabilità e delle concentrazioni con il potenziale di membrana (Em) può essere espressa quantitativamente dall'equazione di Goldman (v. Goldman, 1943)
dove PK, PNa e PCl sono i coefficienti di permeabilità dei rispettivi ioni, (K+)i, (Na+)i, (Cl-)i rappresentano l'attività degli stessi ioni all'interno della cellula e (K+)a, (Na+)a (Cl-)a l'attività nel liquido extracellulare.
Se la costante di permeabilità per uno ione è molto grande in confronto alle altre, cioè PK≫PNa, PCl, l'equazione di Goldman si riduce all'equazione di Nernst:
dove EK è il potenziale di equilibrio per il potassio, che è circa −100 mV alla concentrazione di potassio nella soluzione di Tyrode. Se PNa≫PK, PCl allora
dove ENa è il potenziale di equilibrio per il sodio, che è circa +50 mV. L'equilibrio per lo ione cloro fu valutato intorno a −80 mV (v. Hutter e Noble, 1961). Il potenziale di equilibrio è definito come il potenziale al quale le forze osmotiche ed elettriche si equivalgono, la corrente cioè non passa attraverso la membrana. Nella cellula a riposo i rapporti tra le permeabilità PK:PCl:PNa sono all'incirca 20:2:1 (v. Carmeliet, 1961). Il potenziale di riposo, pertanto, è vicino (ma non identico) al potenziale di equilibrio per il potassio. Come previsto dall'equazione di Goldman, il potenziale di riposo varierà allora con la concentrazione del potassio extracellulare, mentre variazioni nelle concentrazioni extracellulari del sodio o del cloro non avranno un'influenza apprezzabile sul potenziale di riposo. Per una concentrazione 2,7 mM di potassio extracellulare il potenziale di riposo è di 20 mV più positivo rispetto al potenziale di equilibrio per il potassio. Questa osservazione è prevista dal momento che la permeabilità al potassio si riduce per basse concentrazioni di potassio extracellulare e la permeabilità ad altri ioni diversi dal potassio non è infinitamente piccola, cosicché questi ioni contribuiscono al potenziale di riposo. Poiché il potenziale di riposo è più positivo rispetto al potenziale di equilibrio per il potassio e circa di 150 mV più negativo rispetto al potenziale di equilibrio per il sodio, la cellula dovrebbe perdere potassio e accumulare lentamente sodio fino a raggiungere un equilibrio della diffusione. Questi movimenti ionici avvengono effettivamente, ma sono compensati da un trasporto attivo, un meccanismo con cui una pompa regolata metabolicamente assorbe potassio ed espelle sodio dalla cellula contro le forze osmotiche ed elettriche. Quando il trasporto attivo è bloccato da inibitori metabolici o da un abbassamento della temperatura, la cellula perde potassio e guadagna sodio, mentre il potenziale di riposo lentamente diminuisce. Il trasporto attivo non sembra contribuire direttamente al potenziale di riposo; ciò indica che per ogni ione sodio che si sposta fuori della cellula, viene preso uno ione potassio. Tale meccanismo di pompaggio è elettricamente neutro e non contribuisce in modo diretto al potenziale di riposo. In certe condizioni, tuttavia, la pompa può essere elettrogena. Quando, dopo un lungo periodo di raffreddamento, la temperatura veniva riportata al valore normale, si osservò che il potenziale di membrana degli atri di cavia era negativo rispetto al potenziale di equilibrio per il potassio in base a una misurazione della concentrazione di potassio extra- e intracellulare (v. Glitsch, 1969). Questo è stato spiegato con una corrente di iperpolarizzazione dovuta alla pompa elettrogena, che espelle più sodio di quanto potassio non venga assunto nella cellula. Quando il preparato veniva avvelenato con uabaina che, come è noto, blocca il trasporto attivo, non si osservavano potenziali di riposo negativi rispetto all'EK.
5. Le correnti ioniche in relazione all'eccitazione
Le permeabilità della membrana descritte per lo stato di riposo non sono costanti, ma dipendono dal potenziale di membrana e per un potenziale variano nel tempo. Ogniqualvolta il potenziale di membrana varia, la conduttanza della membrana per una o per diverse specie ioniche risulterà modificata, dando origine a una corrente ionica. In aggiunta alle correnti ioniche (Ii) che passano attraverso la membrana in entrambe le direzioni, passerà corrente anche nella capacità di membrana (Cm). Allora, la corrente di membrana totale Im risulta dalla corrente capacitiva (Ic) più Ii, cioè:
Im=Ic+Ii.
La corrente capacitiva è determinata dal valore della capacità e dalla velocità del cambiamento di voltaggio nella capacità (dV/dt), cioè:
Di qui,
dove Ii=INa+IK+ICa+Ianioni. La forza motrice per la corrente ionica specifica per un dato potenziale di membrana Vm è definita come una differenza tra Vm e il rispettivo potenziale di equilibrio, ad esempio (Vm−EK). La conduttanza è definita dalla legge di Ohm:
gK=IK/(Vm−EK)
(v. Hodgkin e Huxley, Currents..., 1952). Se il potenziale di membrana varia, le conduttanze ioniche specifiche sono funzioni complesse del potenziale di membrana e del tempo. Queste funzioni, precisamente gNa, gK, gCa, f(Vm, t), determinano il decorso temporale della variazione di potenziale durante l'eccitazione, cioè la configurazione del potenziale d'azione. Durante l'eccitazione il potenziale di membrana varia dallo stato di riposo a −90 mV fino a un potenziale interno positivo vicino all'equilibrio per il sodio (ENa). La variazione è dovuta a un notevole aumento transitorio della conduttanza per il sodio, che ha come risultato il flusso della corrente del sodio all'interno della fibra. Durante il plateau del potenziale d'azione del miocardio attivo il potenziale è positivo, cioè la corrente effettiva è diretta verso l'interno; possibili candidati al trasporto delle cariche sono sodio e/o calcio. La ripolarizzazione è prodotta dalla diminuzione delle correnti dirette verso l'interno e/o dall'aumento di una corrente di ripolarizzazione diretta verso l'esterno, presumibilmente sostenuta da ioni potassio.
a) Blocco di voltaggio
Le correnti di membrana possono essere misurate con la tecnica del blocco di voltaggio, che è stata applicata sia alle fibre di Purkinje sia al miocardio attivo del cuore di rana e di Mammifero. Il principio di questa tecnica consiste nel bloccare il potenziale a un dato valore e nel misurare la corrente di membrana che risulta dal grado di voltaggio applicato per ottenere il blocco. Le tecniche di blocco di voltaggio usate nel muscolo cardiaco sono illustrate nella fig. 10. La corrente di membrana misurata in un esperimento di blocco di voltaggio comprende tutte le singole correnti ioniche come INa, IK, e ICa. Per separare le singole correnti ioniche dalla corrente di membrana registrata, è necessario impiegare serie di blocchi a vari gradi di voltaggio, preferibilmente intorno al potenziale di equilibrio di uno ione per il quale questa corrente specifica sia zero o cambi direzione di flusso. Tale procedimento, combinato con variazioni delle concentrazioni extracellulari al fine di modificare il potenziale di equilibrio e la forza motrice, permette la separazione di correnti ioniche specifiche dalla corrente netta registrata.
Sono stati fatti tentativi per misurare direttamente il movimento di ioni radioattivi attraverso la membrana cellulare durante le variazioni del potenziale di membrana. Il metodo presenta molti imprevisti e la risoluzione temporale è scarsa se paragonata con misure elettriche; si potrebbe però dimostrare che i flussi ionici di riposo variano durante l'attività in modi compatibili con quelli dimostrati con metodi elettrici, più veloci ma aspecifici.
b) Correnti dirette verso l'interno (depolarizzanti) della membrana
Corrente di sodio (corrente rapida diretta verso l'interno)
Le correnti di membrana registrate da un elemento atriale di rana sono illustrate nella fig. 11. Depolarizzazioni a scala al di sotto della soglia provocano un aumento progressivo della corrente transitoria verso l'interno (A), che diminuisce in ampiezza per potenziali di membrana positivi. Ovviamente il picco della corrente verso l'interno è funzione della grandezza del salto di voltaggio e del tempo trascorso dopo tale salto, diventando la corrente inattiva in 10 ms anche se viene mantenuta la depolarizzazione. Un grafico della corrente di picco in funzione del voltaggio presenta un massimo di corrente a circa −10 mV e due intersezioni della corrente con l'asse del voltaggio, precisamente alla soglia di −65 mV e a +40 mV. Quest'ultimo valore è molto vicino al potenziale di equilibrio previsto per il sodio (ENa), il che fa pensare che la corrente sia portata da ioni sodio. Questa interpretazione è convalidata dalle seguenti osservazioni:
1) l'ampiezza della corrente scende a zero quando la soluzione extracellulare è priva di ioni sodio;
2) per variazioni della concentrazione del sodio extracellulare il potenziale di rovesciamento (ENa) varia in accordo con l'equazione di Nernst;
3) la tetrodotossina, un veleno estratto dalle ovaie di un pesce giapponese che, come noto, blocca specificamente la corrente rapida verso l'interno nelle fibre nervose, blocca anche la corrente di sodio nelle fibre cardiache.
Decorso temporale e ampiezza della conduttanza del sodio gNa (gNa=INa/(Vm−ENa)) in seguito a salti di voltaggio dal potenziale di mantenimento (VH) a vari potenziali di blocco, ottenuti su una fibra di Purkinje, sono illustrati nella fig. 12. Le curve mostrano che nella fase di depolarizzazione si ha un aumento del gNa (attivazione), seguito da diminuzione (inattivazione). La cinetica del gNa, in effetti, ricorda fortemente curve simili ottenute da fibre nervose giganti (v. Hodgkin e Huxley, A quantitative..., 1952). Questi autori hanno descritto il gNa per mezzo di due parametri rappresentanti l'attivazione (m) e l'inattivazione (h) di un sistema di trasporto del sodio nella membrana. Secondo Hodgkin e Huxley (ibid.):
dove -g-N-a è una costante (la conduttanza massima del sodio), m e h variano tra 0 e 1 per descrivere l'on e l'off della conduttanza del sodio con le velocità αm e βm. αm determina la velocità con la quale l'attivazione si sviluppa dopo un brusco scalino di depolarizzazione e βm la velocità con la quale l'attivazione diminuisce dopo un brusco scalino di ripolarizzazione. αm e βm sono funzioni dei potenziali, ma non del tempo. La dipendenza dal potenziale dell'attivazione (m∞), così come le costanti di velocità αm e βm, possono essere determinate tramite la soluzione delle equazioni (2) e (3) usando un procedimento descritto da Hodgkin e Huxley (v., A quantitative..., 1952, eq. 19). Le curve tracciate sui punti ottenuti sperimentalmente nella fig. 12 sono state calcolate con i parametri αm, βm e m∞. Appare chiaro dalla fig. 12 e dalla dipendenza dal potenziale di αm, βm e m∞ (non riportata) che la cinetica della corrente eccitatoria del sodio nel muscolo cardiaco può essere descritta dallo stesso modello matematico usato per la descrizione della cinetica di gNa nelle fibre nervose (v. Dudel e Rüdel, 1970). La somiglianza non riguarda solo i meccanismi di attivazione, ma anche quelli di inattivazione. La dipendenza dal potenziale del parametro h∞ che rappresenta l'inattivazione è riportata nella fig. 13. h∞ determina l'‛efficienza' del sistema di trasporto del sodio, cioè l'ampiezza della corrente di sodio che può scorrere nella depolarizzazione. Come nelle fibre nervose, h∞ è funzione del potenziale di membrana che precede la depolarizzazione. Se il potenziale di membrana è ridotto, l'‛efficienza' del sistema, cioè la capacità di trasportare ioni sodio, è ridotta, il sistema cioè è parzialmente inattivato (v. Hodgkin e Huxley, The dual effect..., 1952).
Depolarizzazioni di blocco a livello costante provocheranno un massimo della corrente del sodio per Eh>−85 mV (h∞=1) e nessuna corrente di sodio per Eh〈− 55 mV (h∞=0). Se la membrana è depolarizzata a livello costante, l'inattivazione ha inizio con una velocità data da βh•αh determina la velocità alla quale l'inattivazione viene annullata per una brusca ripolarizzazione. La dipendenza di αh e di βh dal potenziale è stata determinata nelle fibre di Purkinje e nell'atrio di rana. Nelle fibre di Purkinje, il tempo necessario a ripristinare l'efficienza del sistema di trasporto del sodio dopo una brusca ripolarizzazione è stato valutato tra 1 e 3 ms, in relazione al potenziale di membrana (v. Weidmann, The effect..., 1955). Negli atri di rana, sono stati trovati tempi di 100-500 ms (v. Haas e altri, 1971). Questa costante di tempo determina il momento in cui, dopo la ripolarizzazione del potenziale d'azione, la fibra è di nuovo eccitabile.
La ripida funzione di voltaggio dell'inattivazione (h∞) è la base della refrattarietà nel muscolo cardiaco (v. sotto, cap. 7). Durante il plateau e parte della ripolarizzazione finale, il potenziale di membrana è positivo rispetto a -55 mV e pertanto il sistema del sodio è inattivato; di conseguenza, una corrente di stimolazione non può dare l'avvio a una corrente verso l'interno, cioè non può provocare un potenziale d'azione. In tali fibre il sistema del sodio non è disponibile, o non lo è completamente, durante la depolarizzazione per trasportare attraverso la membrana la corrente eccitatoria del sodio. Poiché tale corrente rappresenta lo stimolo per la cellula adiacente, ancora in stato di riposo, la conduzione risulterà più lenta quando la corrente eccitatoria del sodio è ridotta.
Corrente lenta verso l'interno (corrente di Ca). - Nelle fibre di Purkinje (v. Reuter, 1968; v. Vitek e Trautwein, 1971), nel miocardio di Mammifero (v. Mascher e Peper, 1969; v. Beeler jr. e Reuter, Membrane calcium..., 1970; v. New e Trautwein, 1972) e di Anfibio (v. Rougier e altri, 1968) è stata osservata una seconda corrente diretta verso l'interno con decorso temporale circa 50 volte più lento e con ampiezza molto più piccola di quella della corrente rapida del sodio.
Questa corrente lenta verso l'interno è di particolare interesse per due ragioni:
a) è una corrente di depolarizzazione di durata relativamente lunga, che presumibilmente produce il plateau che segue il picco del potenziale d'azione;
b) sembra essere trasportata dagli ioni calcio all'interno della fibra. Poiché il calcio è l'attivatore della contrazione, la corrente lenta verso l'interno merita speciale interesse nella relazione tra eccitazione e contrazione (accoppiamento elettromeccanico, v. sotto, cap. 10, § a). La soglia di questa corrente è a −35 mV e il potenziale di rovesciamento si ha tra +70 mV e +80 mV, essendo entrambi, soglia e potenziale di rovesciamento, chiaramente positivi rispetto alla soglia della corrente del sodio e al potenziale di equilibrio del sodio, rispettivamente. Il tempo di attivazione e di inattivazione della corrente lenta verso l'interno sono funzioni del voltaggio. Il tempo di attivazione è più breve per potenziali di blocco più positivi, inferiore a 10 ms a potenziale zero. A questo potenziale la costante di tempo di inattivazione è circa 60-70 ms (miocardio del gatto). Analogamente alla corrente iniziale del sodio, l'‛efficienza' del canale lento verso l'interno è funzione del potenziale di membrana che precede la depolarizzazione. L'inattivazione, tuttavia, si ha tra −50 mV e −20 mV, in confronto a −80 e −55 mV per la corrente del sodio.
La corrente lenta verso l'interno diminuisce in ampiezza quando si riduce la concentrazione extracellulare del calcio e scompare del tutto in soluzioni praticamente prive di calcio con normale concentrazione extracellulare di sodio. Questo è stato osservato nel miocardio di cane e di gatto e fa pensare che la corrente lenta verso l'interno sia principalmente veicolata dagli ioni calcio. La forza motrice per tale flusso all'interno è molto grande (a causa della bassissima concentrazione intracellulare di calcio libero) e un piccolo aumento della conduttanza della membrana per il calcio (fattore 2) è sufficiente a permettere il flusso di una corrente di calcio relativamente piccola. La variazione dell'andamento temporale della conduttanza fa ritenere che la configurazione dei tracciati della corrente nella fig. 14 sia dovuta solo alle variazioni della corrente del calcio.
c) Correnti di membrana dirette verso l'esterno (correnti di K)
Nelle fibre nervose la corrente di potassio verso l'esterno cresce rapidamente nella fase di depolarizzazione e permane aumentata finché si mantiene la depolarizzazione (nessuna attivazione). L'aumento della corrente di potassio, insieme col rapido aumento della corrente di sodio, ha come risultato una depolarizzazione rapida, cioè una breve durata del potenziale d'azione nelle fibre nervose (v. i contributi di Hodgkin e Huxley, 1952). Nel tessuto cardiaco la conduttanza verso l'esterno si comporta in maniera molto diversa: anzitutto essa diminuisce alla depolarizzazione (v. Deck e Trautwein, 1964), e inoltre l'aumento con il tempo (rettificazione ritardata) è lento e piccolo in paragone a quanto si verifica nelle fibre nervose (v. Noble e Tsien, Outward membrane..., 1969). Un grafico della corrente verso l'esterno che passa alla fine di un impulso di blocco della durata di 500 ms in funzione del potenziale di membrana ha forma di N.
A differenza di quello che avviene nelle fibre nervose, la corrente verso l'esterno non aumenta nella fase di depolarizzazione, ma rimane costante e perfino diminuisce. Al crescere della forza motrice nella fase di depolarizzazione, la conduttanza cade. Questo fenomeno è chiamato rettificazione anomala. Nella fig. 16, la corrente che passa a circa −30 mV è, in prima approssimazione, la corrente che passa in un preparato senza blocco alla fine del plateau del potenziale d'azione. Come si vede dalla figura, la corrente verso l'esterno aumenta nella fase di ripolarizzazione. Poiché l'ampiezza di questa corrente è proporzionale alla velocità di ripolarizzazione, quest'ultima sarà accelerata durante la ripolarizzazione definitiva del potenziale d'azione.
La corrente riportata nella fig. 16 è principalmente sostenuta dagli ioni potassio. Questa interpretazione è convalidata dagli effetti della variazione del potassio extracellulare (v. Dudel e altri, The dynamic..., 1967). Aumentando (K+)0, la corrente verso l'esterno aumenta e l'intersezione con l'asse del voltaggio viene spostata in direzione positiva, mostrando il ben noto effetto del potassio nella depolarizzazione della membrana.
La relazione corrente-voltaggio nella fig. 16 non dà informazioni sulla dipendenza temporale della corrente. In questo caso il punto interessante è vedere se durante il potenziale d'azione la corrente di ripolarizzazione verso l'esterno cresca, terminando di conseguenza il plateau. L'aumento della corrente verso l'esterno è stato osservato nel miocardio di Mammifero e di rana, a potenziale di blocco positivo e in fibre di Purkinje nell'ambito di potenziale del plateau. Nelle fibre di Purkinje si osserva un'altra corrente verso l'esterno, che è correlata con il potenziale pacemaker. Queste correnti verso l'esterno sono considerate indipendenti, passanti cioè attraverso canali differenti della membrana.
Corrente verso l'esterno riferita al plateau. - Nelle fibre di Purkinje l'aumentare e il diminuire delle correnti dirette verso l'esterno, in risposta rispettivamente a depolarizzazioni e ripolarizzazioni a scalino, sono stati studiati da Noble e Tsien (v., Outward membrane..., 1969). Questi autori hanno descritto due componenti della corrente verso l'esterno ix1 e ix2. Entrambe le componenti vengono lentamente attivate al plateau, essendo π di 0,5 s per ix1 e di 5 s per ix2, quest'ultimo troppo lento per giocare un ruolo nel corso di un potenziale d'azione. L'ampiezza delle correnti nello stato stazionario varia da circa 0 a −50 mV, fino a un massimo intorno a +20 mV. La relazione di voltaggio della ix1 attivata presenta una rettificazione diretta verso l'interno che dà alla curva nella fig. 16 la caratteristica forma di N. Pertanto la relazione corrente-voltaggio della fig. 16 è prodotta non solo dall'inattivazione della corrente verso l'interno, ma anche dall'attivazione di correnti lente verso l'esterno positive rispetto a −50 mV. Durante il potenziale d'azione entrambi i meccanismi potrebbero produrre ripolarizzazione. È ancora controverso quale dei due fattori giochi il ruolo più importante per la fine del plateau e se l'aumento della corrente verso l'esterno contribuisca alla configurazione del potenziale d'azione. Noble e Tsien (ibid.) hanno dato un modello matematico della cinetica di ix1 e ix2 che è simile a quello usato da Hodgkin e Huxley per la loro descrizione della cinetica del sistema del potassio nelle fibre nervose. Una ricostruzione fatta per mezzo del calcolatore del potenziale d'azione dopo il picco, considerando solo la corrente verso l'esterno, trascurando cioè la corrente lenta verso l'interno, dava potenziali d'azione di circa 800 ms di durata, ma per il resto di configurazione tipica (v. Noble e Tsien, Reconstruction..., 1969). Normalmente la durata del potenziale di azione nelle fibre di Purkinje di pecora è pari a circa la metà di quel valore. Nondimeno, ix1 è una corrente verso l'esterno che almeno nei potenziali d'azione di lunga durata contribuisce alla parte terminale del plateau. Si dovrebbe menzionare che le correnti verso l'esterno, funzioni del tempo nell'ambito del plateau, sono molto labili e spesso molto piccole. Potenziali d'azione di configurazione e di durata normali sono stati registrati nelle fibre di Purkinje in cui non si era osservata alcuna corrente verso l'esterno, funzione del tempo, nell'ambito di potenziale del plateau (v. Vitek e Trautwein, 1971).
Corrente verso l'esterno in relazione al potenziale pacemaker. - Nelle fibre di Purkinje c'è un'altra corrente verso l'esterno attivata per valori di potenziale tra −100 mV (non attivata) e −50 mV (completamente attivata). Questa corrente è più evidente nella ripolarizzazione come ‛coda' discendente (v. Deck e Trautwein, 1964; v. Noble e Tsien, 1968; v. fig. 17, A-C). Per una concentrazione di K+ eguale a 3 mM la corrente coda è zero a circa −100 mV (potenziale di equilibrio per il potassio) e inverte direzione di discesa (corrente verso l'interno decrescente) a potenziali più negativi di −100 mV. Questo potenziale di rovesciamento varia con la concentrazione esterna del potassio secondo l'equazione di Nernst (v. Peper e Trautwein, 1969; v. fig. 17D), come ci si dovrebbe aspettare se questa corrente fosse trasportata da ioni potassio. Nel preparato in cui il potenziale di membrana non è bloccato, l'inattivazione di questa conduttanza verso l'esterno in seguito alla ripolarizzazione dovrebbe depolarizzare la fibra e produrre un potenziale pacemaker. La depolarizzazione dovuta ad una diminuzione della conduttanza del potassio può verificarsi solo se si ha una corrente di depolarizzazione verso l'interno relativamente grande. Tale corrente di depolarizzazione verso l'interno di natura sconosciuta, presumibilmente dovuta a una permeabilità aspecifica, si osserva nell'ambito dei valori del potenziale pacemaker ed è questa corrente che depolarizza la fibra alla soglia quando la conduttanza per il potassio diminuisce.
d) Correnti di membrana e potenziale d'azione
Una ricostruzione quantitativa del potenziale d'azione dalle correnti di membrana sarebbe possibile se fosse disponibile per ogni conduttanza un modello matematico simile alla descrizione di Hodgkin e Huxley della corrente di sodio e potassio nella fibra nervosa. Un tale modello completo comprendente la corrente lenta verso l'interno non è stato ancora sviluppato; pertanto, si può fare solo un confronto qualitativo tra correnti e potenziale.
La fase ascendente del potenziale d'azione è dovuta alla forte corrente di sodio verso l'interno. Nelle fibre di Purkinje è stato misurato un massimo della corrente di sodio di 1-2 mA/cm2 e questa corrente scaricherebbe la capacità della membrana di 2,5 μF/cm2 a una velocità di 400-750 V/s. Questo valore è dell'ordine della velocità di salita del picco misurata in questa struttura. In qualche tessuto cardiaco (miocardio di rana, nodo del seno, nodo a. v. di Mammifero) (v. Paes de Carvalho e altri, 1969) il picco del potenziale d'azione sembra essere composto di una fase rapida dovuta all'entrata del sodio, seguita da una fase molto più lenta al plateau. La fase più lenta è sensibile al calcio; ciò fa supporre che la carica depolarizzante sia portata dagli ioni Ca2+, cioè dalla corrente lenta verso l'interno (v. Niedergerke e Orkand, The dual effect..., 1966). Nel nodo del seno e in certe cellule della via atrio-ventricolare la velocità del picco è molto bassa e non è influenzata dalla concentrazione esterna del sodio; è però sensibile al calcio. È stato dimostrato che in queste strutture gli ioni calcio trasportano la corrente di depolarizzazione nella fase eccitatoria.
Nel miocardio di Mammifero si vede spesso una piccola fase di ripolarizzazione rapida che segue il picco. Nelle fibre di Purkinje la fase di depolarizzazione rapida iniziale fino al livello del plateau a −20 mV è molto più pronunciata. Corrispondentemente, è stata osservata una forte corrente transitoria verso l'esterno in scalini di blocco di voltaggio positivi rispetto a −20 mV (v. Dudel e altri, The potassium..., 1967).
Nel miocardio il potenziale positivo durante il plateau e la leggera ripolarizzazione sono presumibilmente dovuti alla corrente lenta verso l'interno e alla sua inattivazione. Nella situazione di assenza di blocco di voltaggio, questa corrente depolarizza la membrana a potenziale positivo. I fattori responsabili per la terminazione del plateau sono o l'inattivazione della corrente lenta verso l'interno, o l'aumento della corrente verso l'esterno, o entrambi. La ripolarizzazione dal plateau al potenziale di riposo è determinata dalla corrente verso l'esterno funzione del voltaggio, come si vede nella fig. 16. La corrente verso l'esterno aumenta nella ripolarizzazione e questo aumento accelera la ripolarizzazione finale del potenziale d'azione.
6. Effetto delle concentrazioni ioniche extracellulari sul potenziale d'azione
Poiché il potenziale d'azione è prodotto dal flusso di correnti ioniche, esso è influenzato praticamente da ogni cambiamento delle concentrazioni ioniche extracellulari normali, causato da variazioni o della forza motrice o della permeabilità di un dato ione. Molto prima che le correnti ioniche fossero misurate nel muscolo cardiaco, erano state accumulate molte osservazioni a favore di una teoria ionica dell'eccitazione, studiando l'effetto delle variazioni delle concentrazioni extracellulari degli ioni sulla configurazione del potenziale d'azione.
a) Sodio
La riduzione della concentrazione extracellulare del sodio fa diminuire l'ampiezza dell'overshoot (v. Draper e Weidmann, 1951). Anche la velocità di salita del picco è ridotta in accordo con l'equazione di Nernst. La riduzione del sodio extracellulare sotto il 10% della concentrazione normale rende il muscolo cardiaco ineccitabile: nelle fibre di Purkinje non si ha più propagazione quando la concentrazione di sodio è ridotta a 20 mM. Queste osservazioni sono in accordo con l'ipotesi che la corrente eccitatoria sia portata da ioni sodio. Risultati simili sono stati ottenuti nell'atrio di rana. In questa struttura la curva della dipendenza dell'ampiezza dell'overshoot dal logaritmo della concentrazione extracellulare di sodio era meno ripida (v. Niedergerke e Orkand, The dependence..., 1966). In altre specie l'ampiezza non era affatto influenzata dall'abbassamento della concentrazione extracellulare del sodio (v. Coraboeuf e Otsuka, 1956). Tale risultato contrario alle previsioni può essere spiegato dall'osservazione, condotta sul ventricolo di rana, che la parte finale del picco, dal potenziale di circa O al livello del plateau, non è prodotta dall'entrata del sodio, ma dalla corrente lenta di calcio verso l'interno. In molte specie la riduzione della (Na)0 abbreviava il potenziale d'azione e faceva spostare il plateau a un livello di potenziale più negativo. Questo effetto potrebbe essere dovuto a una più piccola corrente lenta verso l'interno (che potrebbe essere in parte sostenuta dal sodio) e/o a un effetto della rimozione del sodio sulla corrente verso l'esterno, che fu trovata aumentata in queste condizioni.
b) Calcio
Il calcio in quanto ione bivalente esercita un'azione stabilizzante sulla membrana, gli ioni calcio, cioè, hanno una tendenza a ridurre la permeabilità ad altri ioni. Una piccola concentrazione di ioni calcio (circa 0,1 mM) nella soluzione di Tyrode è necessaria per l'integrità della membrana. In una soluzione di Tyrode praticamente priva di calcio le fibre si depolarizzano reversibilmente e la relazione corrente-voltaggio diviene una linea retta, indicando che la membrana è diventata molto ‛permeabile'.
Oli ioni calcio influenzano anche il sistema di trasporto del sodio, nel senso di stabilizzare il sistema nello stato di riposo (v. Weidmann, Effects of calcium..., 1955). Come sopra descritto, il sistema del sodio esiste in tre stati diversi legati nel modo seguente:
L'aumento della concentrazione del calcio fa spostare queste relazioni verso sinistra, mantenendo così il sistema di trasporto del sodio nello stato di riposo a un alto grado di ‛efficienza' anche quando il potenziale di membrana è leggermente depolarizzato. Questo effetto appare particolarmente chiaro nello spostamento verso destra della curva di inattivazione all'aumentare della concentrazione extracellulare di calcio (v. fig. 13). Uno spostamento di questa curva a potenziali di membrana meno negativi, provocato dagli ioni calcio, ha come risultato una maggiore corrente di sodio nella depolarizzazione dal potenziale di membrana ridotto. Così, per un potenziale di membrana ridotto la velocità del picco del potenziale d'azione può essere più che raddoppiata per un aumento di 4 volte del calcio extracellulare rispetto alla concentrazione normale. Come conseguenza, la velocità di conduzione degli impulsi diventerà considerevolmente più alta (v. sotto, cap. 8).
Altri effetti del calcio sono in linea con la sua azione stabilizzatrice. Il calcio fa spostare il potenziale soglia a valori più bassi, cosicché si richiede una maggiore depolarizzazione (e una maggiore corrente di stimolo) prima che la fibra risponda. Analogamente, il livello di potenziale di membrana dal quale parte il potenziale d'azione per il pacemaker della fibra di Purkinje risulta spostato a valori meno negativi; perciò, per concentrazioni elevate di calcio la diastole diviene più lunga e, naturalmente, la frequenza viene ridotta.
Per quanto riguarda gli effetti degli ioni calcio sulla configurazione del potenziale d'azione, sembra essere importante il loro ruolo di trasportatori di cariche della corrente lenta verso l'interno. Nelle fibre di Purkinje è stato riportato un innalzamento del plateau all'aumentare del calcio extracellulare e una depressione del plateau al diminuire della concentrazione di calcio. Effetti simili sono stati visti nel miocardio ventricolare variando le concentrazioni extracellulari di calcio. Essi potrebbero essere spiegati con il previsto effetto della concentrazione extracellulare di calcio sull'ampiezza della corrente lenta verso l'interno (v. fig. 14).
Come precedentemente posto in rilievo, la corrente lenta di Ca2+ verso l'interno è stata osservata in soluzioni di immersione prive di sodio. Ci si dovrebbe attendere, pertanto, che un forte stimolo alla soglia di questa corrente a −35 mV provochi un potenziale d'azione con velocità di picco, relativamente lenta, dovuta all'ampiezza della corrente piccola in confronto a quella osservata in presenza di sodio. Tali ‛potenziali d'azione da calcio' sono stati osservati ed è stato dimostrato che essi sono molto sensibili alla concentrazione extracellulare di calcio (v. Mascher, 1971).
c) Potassio
Gli ioni potassio depolarizzano le fibre cardiache, secondo l'equazione di Nernst. La concentrazione extracellulare di potassio influenza anche la conduttanza della membrana per il potassio, la quale è tanto maggiore quanto maggiore è la concentrazione esterna. Simili osservazioni sono state fatte studiando l'influenza della concentrazione extracellulare di potassio sull'uscita del 42K nelle fibre di Purkinje (v. Carmeliet, 1961). Il potenziale d'azione diviene più breve se si aumenta la concentrazione di potassio nella soluzione di immersione. Questo accorciamento si spiega con l'aumento della conduttanza per il potassio (v. Dudel e altri, The potassium..., 1967). La più forte corrente di ripolarizzazione verso l'esterno abbrevia il plateau e accelera la ripolarizzazione del potenziale di azione. Se la concentrazione extracellulare di potassio è ridotta al di sotto di 2 mM, la corrente verso l'esterno, nell'ambito del plateau, diviene molto piccola fino a 0. Allora il potenziale d'azione è o prolungato o arrestato al plateau. In queste condizioni tra −30 mV e 0 mV si hanno spesso piccole oscillazioni ripetitive (extrasistoli).
d) Anioni
La distribuzione degli anioni (cloruro) non contribuisce apprezzabilmente al potenziale di riposo perché la permeabilità al cloro è piccola (circa il 10%) rispetto a quella per il potassio. Per potenziali di membrana meno negativi la permeabilità al cloro sembra essere maggiore e la corrente di ioni cloruro verso l'interno potrebbe contribuire alla ripolarizzazione. Questo è convalidato da una più forte corrente verso l'esterno nella relazione corrente-voltaggio quando il cloro è rimpiazzato da anioni più grandi meno permeabili (v. Dudel e altri, The dynamic..., 1967) e dall'effetto di tale rimpiazzamento sulla configurazione del potenziale d'azione (v. Hutter e Noble, 1961). La sostituzione del cloro con acetilglicinato o con propionato prolunga il plateau, mentre la sostituzione con anioni iodato, più piccoli, abbrevia il potenziale d'azione. In conclusione, il movimento passivo degli anioni attraverso la membrana sembra contribuire alla configurazione del potenziale di azione.
7. Refrattarietà nel muscolo cardiaco
Nell'esperimento presentato nella fig. 19 la fibra veniva stimolata con impulsi quadrati in punti differenti nel tempo durante il ciclo. Gli stimoli liminari per la diastole avevano un'intensità di 10-7 A. Tuttavia, quando il preparato veniva stimolato prima della fine della ripolarizzazione, lo stimolo di soglia doveva essere tanto più grande quanto più precocemente veniva applicato. Stimoli di qualunque intensità, applicati durante la ripolarizzazione, non erano in grado di produrre un potenziale d'azione propagato per tutto il tempo in cui il potenziale di membrana era positivo rispetto a −55 mV. Durante il plateau e parte della fase di ripolarizzazione il cuore si trova in stato di refrattarietà assoluta. Il periodo che intercorre tra la fine della refrattarietà assoluta e il momento in cui il cuore può essere nuovamente eccitato con uno stimolo liminare diastolico è detto periodo refrattario ‛relativo' (v. Schütz, 1936; v. Hoffman e altri, 1957). Potenziali d'azione indotti durante questo periodo di recupero dell'eccitabilità hanno un'ascesa più lenta, una ampiezza inferiore e sono di durata più breve. Lo stato di refrattarietà è dovuto all'inattivazione del sistema del sodio nella fibra depolarizzata. L'efficienza del sistema di trasporto degli ioni sodio è progressivamente ripristinata via via che la ripolarizzazione procede. Pertanto durante il periodo di refrattarietà relativa i potenziali d'azione hanno un'ampiezza minore e una velocità di ascesa più lenta.
Come sopra ricordato, il muscolo cardiaco è ineccitabile o meno eccitabile e la propagazione degli impulsi è bloccata o rallentata quando il potenziale di riposo è ridotto, come nel caso di un'elevata concentrazione extracellulare di potassio o nel muscolo ischemico o altrimenti danneggiato nel suo metabolismo. La natura di questa ‛refrattarietà' è la stessa di quella che si ha durante il potenziale d'azione, cioè inattivazione del sistema del sodio.
8. Propagazione dell'impulso e velocità di conduzione
La propagazione dell'impulso è una conseguenza dell'organizzazione elettrica del sincizio cardiaco, cioè della resistenza relativamente bassa delle connessioni cellulari e della bassa resistenza del mioplasma in confronto alla resistenza della membrana citoplasmatica. La distribuzione del voltaggio lungo il cavo (circuito equivalente riportato nella fig. 6A) durante la propagazione di un potenziale d'azione è data dall'equazione seguente:
dove a è il diametro delle fibre, Ri la resistenza specifica interna, V il voltaggio di membrana e Ii la corrente di sodio. Se un potenziale d'azione con forma dell'onda costante è condotto lungo la fibra ad una velocità costante (ϑ), allora le forme delle curve della relazione tra V e t per x costante, e tra V e x per t costante, sono identiche. In queste condizioni x può essere sostituita da −ϑ•dt. Si ha allora
La soluzione numerica di questa equazione usando i dati ottenuti dalle fibre nervose di calamaro ha dato valori di ϑ in buon accordo con quelli ottenuti sperimentalmente. L'equazione (5) può essere riscritta:
dove K=2Riϑ2Cm/a. In questa forma si riconoscono facilmente i fattori determinanti della velocità di conduzione. Se Cm è costante e is si mantiene una funzione costante di V e di t, allora K può essere costante. Pertanto, la velocità di conduzione è proporzionale alla radice quadrata del diametro della fibra. Essa è pure proporzionale a 1/√-R-i. ϑ è ulteriomente determinato dalle funzioni che mettono in relazione Ii con V e t. La velocità di conduzione decresce col decrescere della massima corrente verso l'interno Ii, come già descritto per i potenziali d'azione provocati durante il periodo refrattario relativo o in preparati a basso potenziale di riposo. ϑ dipende anche in larga misura dalla velocità con cui aumenta Ii, cioè dal tempo di attivazione della membrana. Per esempio, ϑ sarà più lenta se si riduce la temperatura della soluzione di immersione.
Velocità di conduzione da 0,5 m/s a 1 m/s sono state misurate nel miocardio di Mammifero, valori 2-3 volte più alti nelle fibre di Purkinje (v. Trautwein, 1961, tab. IV). Le velocità più elevate in queste ultime strutture potrebbero essere dovute a diversi fattori, quali il diametro cellulare più largo, la resistenza interna di 150 Ω/cm, più bassa in confronto ai 500 Ω/cm misurati nel miocardio, e la grande velocità massima della fase ascendente (600 V/s) in confronto a 200 V/s nel miocardio, fatti questi che riflettono una maggiore corrente eccitatoria del sodio.
9. Vie di propagazione dell'impulso nel cuore di Mammifero
a) Atri
Dal nodo del seno l'eccitazione si propaga, quasi radialmente, con una velocità fra 0,5 e 0,8 m/s, per l'atrio destro e si trasmette lungo il fascio muscolare tra l'aorta e l'arteria polmonare all'atrio sinistro. Circa 40 ms dopo il picco del potenziale d'azione nel seno, l'eccitazione arriva al bordo atriale del nodo a. v. (v. Brendel e altri, 1951; v. Puech, 1956).
b) Nodo a. v.
Questa struttura è normalmente la sola via per la propagazione dell'impulso dagli atri ai ventricoli. Il tempo di passaggio attraverso il nodo, che è di circa 80 ms (ritardo a. v. nell'ECG), è lungo in confronto alla lunghezza della via. Sulla base del diametro della fibra, che varia da 3 a 11 nm nel nodo del cuore umano, gli anatomici distinguono una porzione craniale o atriale da una porzione caudale o ventricolare. Corrispondentemente, sono state trovate differenze nella velocità di conduzione e anche nella configurazione del potenziale d'azione tra la parte superiore e la parte inferiore del nodo. Nella fig. 20A i potenziali di azione registrati lungo la via che va dal seno al fascio di His sono riportati sullo stesso asse dei tempi. Il ritardo più grande nel tempo di conduzione si verifica nella porzione craniale del nodo a. v. vicino al bordo atriale. Effettivamente, appare ovvio nel grafico del tempo di conduzione in funzione della distanza che quasi tutta la latenza a. v. ha sede in questa porzione craniale del nodo, dove sono state misurate velocità di conduzione basse fino a 0,05 m/s.
Diversi fattori sembrano contribuire alla bassa velocità di conduzione nel nodo a. v.:
1) il piccolo diametro delle fibre, in quanto la velocità di conduzione è proporzionale alla radice quadrata del diametro, quando tutti gli altri valori restano costanti (v. sopra);
2) la geometria del sincizio: i dati istologici fanno supporre che dalla parte atriale del bordo a. v. relativamente poche fibre atriali si mettano in contatto con un gran numero di fibre nodali di diametro più piccolo; pertanto, la corrente a direzione longitudinale dell'onda che avanza passa attraverso un'area di superficie di membrana molto più vasta, scaricando la capacità della membrana più lentamente;
3) la parte ascendente del potenziale d'azione registrato nella porzione craniale del nodo è molto lenta, benché il potenziale diastolico possa essere −85 mV, valore per il quale l'inattivazione del sodio non dovrebbe essere apprezzabile; se da un lato tali fasi ascendenti potrebbero essere il risultato di speciali condizioni geometriche (v. sopra, cap. 5, § d), esse potrebbero altrettanto bene indicare l'assenza del sistema di trasporto del sodio in queste fibre o l'intervento del solo sodio. Questa ipotesi è sostenuta dall'osservazione che la tetrodotossina, che blocca selettivamente il canale rapido del sodio nelle fibre nervose, non influenza la trasmissione a. v. pertanto possibile, ma non provato, che nel nodo a. v. la corrente di depolarizzazione verso l'interno sia fornita attraverso il canale lento, le cariche essendo trasportate sia dagli ioni calcio sia dagli ioni sodio.
In una via ristretta in cui, per le ragioni sopra esposte, il fattore di sicurezza per la conduzione è basso, la velocità di conduzione dovrebbe essere suscettibile a lievi variazioni delle proprietà della membrana indotte dai trasmettitori del sistema autonomo (v. sotto) o da un'elevata velocità di trasferimento degli impulsi. Il nodo a. v. si comporta come un filtro passabasso; gli impulsi atriali a frequenza superiore a 180/min non vengono condotti attraverso questa struttura. La massima frequenza condotta attraverso il nodo dipende dalla direzione di propagazione ed è più bassa nella conduzione retrograda dal ventricolo all'atrio. Tali effetti sono stati spiegati dalla mancanza di uniformità geometrica lungo la via.
c) Eccitazione ventricolare
Una volta che l'eccitazione ha oltrepassato il nodo a. v., essa si propaga rapidamente lungo il fascio di His, le branche del sistema di conduzione e le fibre di Purkinje, a tutto il miocardio attivo. Grazie, alla sua elevata velocità di conduzione e all'abbondante ramificazione periferica, il sistema di conduzione agisce come un distributore dell'eccitazione che raggiunge quasi simultaneamente vaste aree della superficie interna della parete ventricolare. Di conseguenza, l'intervallo di tempo per la comparsa dell'eccitazione nelle diverse parti del ventricolo è breve (circa 30 ms) e così è anche per la latenza nella comparsa di tensione all'interno dei ventricoli.
Registrando con elettrodi bipolari ravvicinati, sono state costruite mappe della direzione della diffusione e della latenza all'interno dei ventricoli, con risultati simili per il cuore di cane, di scimmia e di uomo (v. Scher e Young, 1957; v. Durrer e altri, 1963). L'eccitazione si diffonde soprattutto dall'interno all'esterno attraverso le pareti dei ventricoli con una leggera preferenza verso il basso in direzione della parte apicale del ventricolo sinistro. Le parti dorsali del ventricolo sinistro sono le ultime raggiunte dall'onda di propagazione. Nella fig. 21 sono riportati dettagli della tecnica di misurazione, nonché modelli di eccitazione. La modalità e la sequenza dell'eccitazione ventricolare sono state ampiamente studiate, in quanto rappresentano una informazione necessaria per una teoria del complesso QRS nell'ECG. Il fronte d'onda che si propaga attraverso la parete ventricolare produce aree di dipolo che si modificano continuamente in dimensione e forma durante l'attivazione dei ventricoli. Queste aree di dipolo sono ‛viste' dagli elettrodi di registrazione posti sulla superficie del corpo, i quali registrano un potenziale in accordo con le proprietà fisiche del conduttore di volume.
d) Ripolarizzazione ventricolare
Molto meno si sa sulle modalità di ripolarizzazione ventricolare. Generalmente, le fibre della parete interna dei ventricoli, che vengono precocemente attivate, hanno un potenziale d'azione più lungo, esse cioè sono ripolarizzate più tardi di quelle della superficie esterna dei ventricoli (v. Trautwein, 1963). Questo modello generale ha come risultato la positività dell'onda T dell'ECG. La causa dell'apparente differenza nella durata del potenziale d'azione nelle diverse aree dei ventricoli non è nota. È stata supposta una relazione tra la configurazione del potenziale d'azione e le diverse funzioni meccaniche o i diversi carichi di pressione delle fibre della parete interna ed esterna dei ventricoli.
e) Propagazione della ripolarizzazione
Sembra evidente che la ripolarizzazione normale o il rilasciamento dei ventricoli sia un processo propagato. Un rilasciamento locale seguito da un'onda propagata di rilasciamento è stato osservato già fin dal 1895 da W. Biedermann (v., 1895) nella stimolazione anodica del cuore di rana in sistole. Gli impulsi di corrente anodica di intensità crescente ripolarizzano la membrana che si depolarizza nuovamente fino al plateau all'interruzione del passaggio di corrente. Se, tuttavia, con uno stimolo più forte, si raggiunge un livello critico, il potenziale non ritorna al plateau all'interruzione della corrente, ma continua a ripolarizzarsi fino al potenziale di riposo. Questo fenomeno è stato detto ripolarizzazione ‛tutto o nulla' (v. Weidmann, 1951). La prematura ripolarizzazione forzata è condotta lungo la fibra con una velocità che non è nota, ma che è certamente molto più lenta di quella dell'onda di depolarizzazione. La ripolarizzazione ‛tutto o nulla' è stata osservata sia nelle fibre di Purkinje sia nel miocardio (v. Cranefield e Hoffman, 1958). La soglia per la ripolarizzazione è più elevata (intorno a −50 mV) precocemente durante il plateau che non in seguito, quando essa si sposta verso il livello del plateau. Verso la fine del plateau qualunque impulso ripolarizzante abbrevia il potenziale d'azione, indicando che la corrente di membrana dipende unicamente dal voltaggio. Nella ripolarizzazione all'inizio del plateau, passerà verso l'interno una corrente lenta che depolarizza la membrana all'interruzione dell'impulso. Tuttavia, quando la corrente lenta verso l'interno viene inattivata (specialmente nell'impulso di uno stimolo più prolungato) e/o la corrente verso l'esterno è più grande, sia per una rettificazione ritardata o solo in dipendenza del voltaggio, si avrà infine una ripolarizzazione completa.
10. La relazione tra potenziale di membrana, corrente di membrana e contrazione
Il potenziale d'azione mette in moto una catena di eventi che portano da ultimo all'attivazione meccanica del muscolo. Molto probabilmente, come nella muscolatura scheletrica, nelle fibre miocardiche di Mammifero l'eccitazione si propaga nelle fibre lungo le membrane del sistema tubulare trasverso, il cui lume appartiene allo spazio extracellulare. Il sistema tubulare prende rapporto con il reticolo sarcoplasmatico a livello delle cosiddette cisternae. Il reticolo sarcoplasmatico forma cisternae anche con il sarcolemma. Con modalità non ancora conosciuta, l'eccitazione, presumibilmente a livello delle cisternae, viene trasmessa al reticolo sarcoplasmatico, che a sua volta cede calcio alle miofibrille circostanti. La concentrazione di calcio intorno alle miofibrille sale allora da 10-5 a 10-4 M, mentre viene attivata la scissione di ATP e si produce tensione. Il rilasciamento si verifica quando il calcio viene riportato dal trasporto attivo nel sistema longitudinale e la sua concentrazione si riduce a meno di 10-7 M.
Il lungo plateau del potenziale d'azione cardiaco ha spesso fatto nascere l'ipotesi di una relazione diretta tra depolarizzazione e tensione. Effettivamente, quando il potenziale d'azione veniva abbreviato dal passaggio di corrente, la contrazione corrispondente risultava più debole (v. fig. 24B). Una depressione simile della contrazione si verifica quando il potenziale d'azione è reso più breve dall'innalzamento della concentrazione extracellulare di K+ (v. fig. 24A) o dall'applicazione di acetilcolina. La relazione tra tensione e potenziale di membrana è stata studiata quantitativamente depolarizzando le fibre o con KCl o sotto controllo del voltaggio in un esperimento di blocco. Il muscolo cardiaco sviluppa tensione (contrattura) se il muscolo è depolarizzato con KCl. In un frammento di ventricolo di rana la relazione tra contrattura-tensione e il potenziale di membrana è una curva a forma di S. La tensione aumenta da 0 a circa il 75% della tensione massima nell'intervallo tra −55 mV (soglia meccanica) e 0 mV (v. Niedergerke, 1956). La relazione tra l'ampiezza della contrazione e il potenziale di membrana è riportata nella fig. 25A. L'aumento dell'ampiezza della contrazione per gradi maggiori di depolarizzazione nella fig. 25 è dovuto alla ripida salita della tensione, essendo costante la durata della contrazione. Per l'interpretazione della stretta relazione tra depolarizzazione e tensione è interessante che l'ampiezza della contrazione non solo aumenta istantaneamente al crescere dell'ampiezza di uno scalino di depolarizzazione, ma aumenta ulteriormente nei successivi 5-8 scalini di depolarizzazione fino a uno stato costante (v. fig. 25B). Tale osservazione è stata fatta anche abbreviando il potenziale d'azione con il passaggio di corrente, caso questo in cui non solo era più debole la contrazione corrispondente, ma lo erano anche alcune delle successive (v. Antoni e altri, 1969). Questi effetti durevoli delle variazioni di potenziale sulle contrazioni successive si osservano solo nel miocardio di Mammifero, ma non nel miocardio di rana e sono spiegati dalle variazioni della quantità di calcio trattenuto nella cellula e pronto a essere rilasciato ai battiti successivi.
a) Ruolo degli ioni calcio
La contrazione cardiaca è fortemente influenzata dalla concentrazione extracellulare del calcio. In una soluzione priva di calcio la contrazione scende quasi a zero dopo pochi battiti. Come si è sopra ricordato, l'assunzione di calcio nella cellula si verifica con il passaggio di una corrente ionica durante il potenziale d'azione. Nel miocardio di Mammifero vi è una stretta relazione tra corrente di Ca e contrazione. La soglia è identica (−35 mV) per entrambi, corrente di Ca e contrazione. La contrazione diminuisce al potenziale di rovesciamento di circa +60 mV, in dipendenza dalla concentrazione extracellulare del calcio. Oltre a ciò vi è una stretta correlazione tra l'ampiezza della corrente di calcio e l'ampiezza della contrazione quando varia la concentrazione extracellulare del calcio.
Ci si potrebbe chiedere se nell'eccitazione l'arrivo del calcio attivi direttamente la contrazione concomitante, o se il calcio arrivato nell'interno agisca indirettamente con un meccanismo sconosciuto. Diverse considerazioni parlano a favore della seconda alternativa: 1) la quantità di calcio che passa all'interno della fibra durante un impulso depolarizzante, paragonabile al potenziale d'azione, sembra essere troppo piccola per un'attivazione diretta; 2) in base ai battiti non vi è relazione diretta tra forza e corrente lenta verso l'interno; tuttavia, il livello stabile della contrazione dipende dall'ampiezza della corrente lenta verso l'interno. L'effetto di scala, quando si aumenta l'ampiezza dell'impulso depolarizzante o all'inizio di una serie di impulsi, non è accompagnato da variazioni nell'ampiezza della corrente lenta verso l'interno, come visto nella fig. 25B, dove già la prima depolarizzazione di una serie di impulsi di blocco fa partire una corrente lenta diretta verso l'interno, che rimane costante anche se aumenta l'ampiezza delle successive contrazioni. Questo e altri risultati sono spiegati dall'ipotesi che il calcio che passa nell'interno sia depositato nei punti di legame, dai quali viene messo in libertà nella successiva depolarizzazione (v. Wood e altri, 1969). Quanto al meccanismo di liberazione, osservazioni recenti sulle fibre del muscolo scheletrico ‛spellato' suggeriscono l'ipotesi che l'applicazione di una piccola quantità di calcio possa provocare la liberazione di una quantità molto maggiore di calcio legato intracellularmente (v. Ford e Podolsky, 1969). Se questo valesse anche per il muscolo cardiaco, il passaggio del calcio all'interno avrebbe il duplice effetto di ricostituire le riserve e di liberare calcio da tali riserve per l'attivazione contrattile. La più piccola corrente di calcio verso l'interno che si ha con la riduzione del calcio extracellulare avrebbe allora come risultato una più piccola saturazione dei punti di legame con il calcio, dai quali può essere messo in libertà meno calcio attivatore. Dopo una variazione del calcio esterno, lo svuotamento o il riempimento delle riserve fino a un nuovo equilibrio si verificherebbero in poche contrazioni.
È ben noto che una riduzione del sodio extracellulare accresce la forza facendo aumentare il rapporto dP/dt analogamente a un aumento del calcio extracellulare. In queste condizioni la corrente lenta verso l'interno è inalterata, cioè l'aumento della forza non è accompagnato da una maggiore assunzione di calcio. È dimostrato che il flusso verso l'esterno di 45Ca si riduce quando si abbassa il sodio extracellulare (v. Langer, 1968). Il risultante accumulo di calcio nelle cellule dovrebbe portare a una saturazione di tutti i punti di legame e a un notevole aumento dell'ampiezza della contrazione. Recenti risultati fanno pensare che l'uscita del calcio sia legata al trasporto attivo del sodio nello spazio extracellulare (v. Blaustein e Hodgkin, 1969). Questo trasporto attivo sodio-potassio viene inibito, e di conseguenza l'uscita del calcio è ridotta, quando si abbassa il sodio extracellulare. La spiegazione è interessante nel contesto del ben noto effetto inotropo dei glicosidi digitalici, che inibiscono anche il trasporto attivo sodio-potassio e causano probabilmente un aumento del calcio intracellulare. In tal modo, gli effetti inotropi mostrati da un basso valore del sodio extracellulare e dai glicosidi digitalici sembrano essere dovuti a un meccanismo, se non identico, almeno strettamente analogo.
11. Gli effetti dell'innervazione afferente sul cuore
a) Innervazione vagale
All'incirca 500 fibre nervose di ciascun lato prendono contatto sinaptico con le cellule gangliari, le cui fibre postsinaptiche innervano il seno (raggiunto preferibilmente dal nervo vago di destra), gli atri e il nodo a. v. (raggiunti preferibilmente dal nervo vago di sinistra). Non vi sono sinapsi neuromuscolari, le fibre nervose postsinaptiche passano attraverso le guaine delle cellule muscolari, nelle quali l'acetilcolina liberata dalla stimolazione vagale si diffonde fino a 50 μ. L'acetilcolina in concentrazioni fino a 10-9 M esercita effetti profondi sulla permeabilità della membrana delle cellule muscolari nel nodo del seno, nel nodo a. v. e negli atri (v. Trautwein, 1963). Le cellule del sistema di Purkinje e le cellule miocardiche ventricolari non sono influenzate dall'acetilcolina, neppure alla concentrazione 10-4 M (v. Schmidt, 1958).
Effetti della stimolazione vagale e dell'acetilcolina
L'effetto più drammatico della stimolazione del vago è il rallentamento della frequenza cardiaca o, per stimolazione più intensa, l'arresto del cuore. Questo effetto, studiato in una singola fibra del seno venoso di rana, è riportato nella fig. 26. La stimolazione del vago sopprime immediatamente il potenziale pacemaker e iperpolarizza la fibra. Se si sospende la stimolazione, la membrana si depolarizza lentamente fino alla soglia in cui viene riassunto un ritmo spontaneo. Una stimolazione più debole del nervo vago deprime unicamente il potenziale pacemaker, che raggiunge più tardi la soglia per la propagazione dell'impulso, mentre la frequenza del seno viene rallentata. Un altro effetto della stimolazione del vago è il drastico accorciamento del potenziale d'azione osservato nelle fibre del seno, degli atri e del nodo a. v. Insieme alla durata del potenziale d' azione, diviene più corto il periodo refrattario. Questo effetto favorisce una ripresa dell'attività, che può avere come risultato una fibrillazione degli atri.
La stimolazione del vago o l'applicazione di acetilcolina ritardano la trasmissione a. v., ciò che si riconosce nel prolungamento del tratto PQ nell'ECG. Il rallentamento della conduzione o l'eventuale blocco è localizzato prevalentemente nella porzione craniale del nodo, in cui la velocità di conduzione è normalmente molto bassa (v. Cranefield e altri, 1959). A causa della scarsa corrente di depolarizzazione verso l'interno in queste fibre (ascesa lenta del potenziale d'azione), la velocità di conduzione è molto sensibile a un piccolo aumento della permeabilità al potassio, cioè a un piccolo aumento della corrente di ripolarizzazione verso l'esterno.
L'eccitabilità viene normalmente misurata come ‛reobase' o ‛cronassia', dove la reobase è l'ampiezza della corrente continua appena sufficiente a stimolare la fibra e la cronassia è la più breve durata di una corrente di intensità doppia della reobase. L'acetilcolina riduce la resistenza della membrana. Pertanto, la reobase aumenta, ovvero l'eccitabilità diminuisce, in quanto si richiede maggiore corrente per depolarizzare la fibra fino alla soglia. D'altra parte, a causa della riduzione della resistenza della membrana, la costante di tempo della salita e della discesa del potenziale elettrotonico è molto più breve. La cronassia pertanto può, in presenza di acetilcolina, essere inalterata o addirittura più breve, l'eccitabilità cioè può essere aumentata. Quando l'effetto vagale è intenso e la conduzione rallentata o bloccata, l'eccitabilità viene a essere depressa o addirittura soppressa.
L'ampiezza della contrazione di trabecole o di elementi degli atri di Mammifero viene a essere fortemente ridotta quando si applica acetilcolina. Questo effetto è presumibilmente dovuto all'accorciamento del potenziale d'azione.
Meccanismi d'azione dell'acetilcolina
Gli effetti dell'acetilcolina testé descritti possono essere spiegati con una ipotesi coerente: il trasmettitore in contatto con le molecole di recettore nella membrana fa aumentare specificamente la permeabilità agli ioni potassio. In accordo con l'equazione di Goldman (v. sopra, inizio cap. 4), questo induce il potenziale di riposo a spostarsi verso il potenziale di equilibrio per il potassio (iperpolarizzazione). L'aumento della permeabilità al potassio farà anche aumentare la corrente di ripolarizzazione del potassio diretta verso l'esterno, il che fa accelerare la ripolarizzazione del potenziale d'azione.
L'aumentata permeabilità al potassio indotta dall'acetilcolina è stata dimostrata sia elettrofisiologicamente (v. Trautwein e Dudel, 1958), sia con esperimenti mediante radioisotopi (v. Harris e Hutter, 1956). L'esperimento elettrofisiologico deve dimostrare un potenziale di rovesciamento per effetto dell'acetilcolina e deve provare che questo potenziale di rovesciamento è identico al potenziale di equilibrio per il potassio. La fig. 27 riproduce un esperimento di questo tipo, in cui il potenziale di membrana era stato alternativamente spostato dagli impulsi di corrente a valori positivi e negativi rispetto a EK. L'applicazione di acetilcolina faceva spostare il valore positivo in direzione negativa (iperpolarizzazione) e il valore negativo in direzione positiva (depolarizzazione). Il potenziale di rovesciamento al cui valore l'acetilcolina non modifica il potenziale di membrana - benché l'effetto inibitore possa essere molto forte - dipende dalla concentrazione extracellulare di potassio, in accordo con l'equazione di Nernst (v. fig. 9). Questo risultato prova che il potenziale di rovesciamento è identico a EK e che la permeabilità della membrana è specificamente aumentata per gli ioni potassio. Una prova diretta dell'aumento della Pk è presentata nell'esperimento della fig. 28. Un seno venoso del cuore di rana veniva mantenuto in soluzione di Ringer con potassio radioattivo (42K+) fino al raggiungimento dell'equilibrio. L'aggiunta di acetilcolina ha come risultato un grande aumento dell'effiusso di 42K+ (misurato come diminuzione della radioattività del preparato). L'effetto è più marcato nel seno che non negli atri, corrispondentemente al più debole effetto inibitore in quest'ultima struttura. L'atropina, che blocca l'effetto vagale, rimuove anche l'effetto dell'acetilcolina sull'efflusso di 42K+. Questi esperimenti dimostrano in modo convincente che l'effetto inibitore dell'acetilcolina è dovuto a un aumento della PK, che ‛stabilizza' il potenziale di membrana a un valore vicino al potenziale di equilibrio per il potassio.
b) Innervazione simpatica
Tutte le parti del cuore sono abbondantemente fornite di fibre simpatiche. Le fibre postgangliari che raggiungono il cuore provengono dal ganglio stellato o dal plesso cardiaco. La stimolazione di queste fibre provoca liberazione dei trasmettitori simpatici adrenalina e noradrenalina, che hanno effetti marcati sulla frequenza cardiaca e sulla forza della contrazione ventricolare.
Effetti dei trasmettitori simpatici. - L'attività spontanea del seno viene esaltata quando si stimolano le fibre simpatiche (v. Hutter e Trautwein, 1956). La più elevata frequenza dell'attività cardiaca è dovuta a una più veloce depolarizzazione diastolica, restando apparentemente invariata la soglia per il picco. Nella stimolazione delle fibre simpatiche l'effetto si sviluppa con una certa latenza e quando la stimolazione cessa, diminuisce in pochi secondi. L'applicazione di noradrenalina o di adrenalina ha lo stesso effetto sul pacemaker. L'adrenalina esalta la generazione di impulsi spontanei non solo a livello del seno, ma anche nel nodo a. v. e nel sistema di conduzione specifico (v. Otsuka, 1958); l'applicazione topica sulla superficie di una fibra di Purkinje in stato di riposo provoca la comparsa di un pacemaker.
La velocità di conduzione è aumentata dall'adrenalina, ma solo a livello del nodo a. v. Nel miocardio ventricolare intatto, la propagazione dell'impulso non sembra influenzata dall'adrenalina. Se, tuttavia, si applica adrenalina a una fibra parzialmente depolarizzata, o con KCl (v. Engstfeld e altri, 1961) o a causa di deterioramento anossico (v. Trautwein e Schmidt, 1960), si può avere il ripristino di una conduzione già interrotta. Anche la configurazione del potenziale d'azione può essere restaurata, cioè in queste condizioni può essere riparata una perdita del plateau. Questi effetti dell'adrenalina possono essere osservati senza alcuna modificazione del potenziale di riposo. Analogamente alla conduzione, l'eccitabilità viene migliorata dall'adrenalina solo nel muscolo cardiaco leso. Nel tessuto normale il potenziale soglia e la corrente richiesta per destare l'eccitazione non vengono modificati dall'adrenalina. La forza della contrazione viene grandemente aumentata dall'adrenalina senza alcun cambiamento del potenziale di riposo. La contrazione più forte è dovuta a una salita più ripida della tensione; anche il rilasciamento può essere accelerato (v. Tritthart e altri, 1968).
Meccanismi degli effetti simpatici. - Non vi è un unico meccanismo mediante il quale possano essere spiegati tutti gli effetti dell'adrenalina. L'adrenalina, almeno nel muscolo cardiaco, non è un trasmettitore tipico che modifica rapidamente in pochi millisecondi la permeabilità della membrana agli ioni depolarizzanti o ripolarizzanti. Questa sostanza esercita effetti piuttosto vari e profondi sulla membrana della cellula e sul metabolismo cellulare. Molto interessante e recente è l'osservazione di un notevole aumento della corrente lenta verso l'interno in un esperimento di blocco di voltaggio in presenza di adrenalina, indicante il passaggio di una maggiore quantità di calcio all'interno della fibra nel corso del potenziale d'azione (v. Vassort e altri, 1969). In concomitanza con questo aumento dell'ampiezza della corrente lenta verso l'interno, aumenta l'ampiezza della contrazione. Il potenziale di rovesciamento della corrente lenta verso l'interno per potenziale di membrana positivo si sposta verso 0 mV, facendo supporre che la concentrazione del calcio libero nella cellula durante la depolarizzazione sia elevata. Anche la soglia della corrente lenta verso l'interno (normalmente a −35 mV in presenza di Ca2+ 3,6 mM) si sposta verso un potenziale di membrana più negativo. Una notevole assunzione di 45Ca2+ in presenza di adrenalina è stata osservata da vari ricercatori (v. Reuter, 1965). L'effetto inotropico dei trasmettitori simpatici potrebbe essere spiegato con l'assunzione, e probabilmente con concentrazioni intracellulari maggiori, di calcio libero. L'aumento della corrente lenta di depolarizzazione verso l'interno potrebbe anche spiegare il miglioramento della conduzione e dell'eccitabilità nelle fibre con bassi potenziali di riposo (sistema del sodio inattivato). Sono stati pure descritti vari altri effetti dell'adrenalina, per esempio un aumentato efflusso di 24Na+ (v. Haas e Trautwein, 1963) e una assunzione di 42K+ (v. Vassalle e Barnabei, 1971), facendo supporre un aumentato trasporto attivo del sodio attraverso la membrana. L'adrenalina attiva l'adenilciclasi della membrana, che a sua volta fa aumentare l'attività di molti enzimi intracellulari. Le possibili conseguenze degli effetti metabolici per il metabolismo degli ioni non sono ancora conosciute.
Bibliografia
Antoni, H., Jacob, R., Kaufmann, R., Mechanische Reaktionen des Frosch- und Säugetiermyokards bei Veränderung der Aktionspotential-Dauer durch konstante Gleichstromimpulse, in ‟Pflügers Archiv", 1969, CCCVI, pp. 33-57.
Barr, L., Dewey, M. M., Berger, W., Propagation of action potentials and the structure of the nexus in cardiac muscle, in ‟Journal of general physiology", 1965, XLVIII, pp. 797-823.
Beeler, G. W. Jr., Reuter, H., Voltage clamp experiments on ventricular myocardial fibres, in ‟Journal of physiology", 1970, CCVII, pp. 165-190.
Beeler, G. W. Jr., Reuter, H., Membrane calcium current in ventricular myocardial fibres, in ‟Journal of physiology", 1970, CCVII, pp. 191-209.
Beeler, G. W. Jr., Reuter, H., Membrane calcium current in ventricular myocardial fibres, in ‟Journal of physiology", 1970, CCVII, pp. 191-209.
Beeler, G. W. Jr., Reuter, H., The relation between membrane potential, membrane currents and activation of contraction in ventricular myocardial fibres, in ‟Journal of physiology", 1970, CCVII, pp. 211-229.
Bernstein, J., Elektrobiologie, Braunschweig 1912.
Biedermann, W., Elektrophysiologie, Jena 1895.
Blaustein, M. P., Hodgkin, A. L., The effect of cyanide on the efflux of calcium from squid axons, in ‟Journal of physiology", 1969, CC, pp. 497-527.
Brady, A. J., Hecht, H. H., On the origin of the heart beat, in ‟American journal of medicine", 1954, XVII, p. 110.
Brendel, W., Raule, W., Trautwein, W., Die Leitungsgeschwindigkeit und Erregungsaubreitung in den Vorhöfen des Hundes, in ‟Pflügers Archiv", 1951, CCLIII, pp. 106-113.
Burdon-Sanderson, J., Page, F. J. M., On the electrical phenomena of the excitatory process in the heart of the frog and of the tortoise, as investigated photographically, in ‟Journal of physiology", 1883, IV, pp. 327-338.
Carmeliet, E. E., Chloride and potassium permeability in cardiac Purkinje fibres, Bruxelles 1961.
Coraboeuf, E., Otsuka, M., L'action des solutions hyposodiques sur les potentiels cellulaires du tissu cardiaque des mammifères, in ‟Comptes rendus hebdomadaires des séances de l'Académie des Sciences", 1956, CCXLIII, pp. 441-446.
Coraboeuf, E., Weidmann, S., Temperature effects on the electrical activity of Purkinje fibres, in ‟Helvetica physiologica et pharmacologica acta", 1954, XII, pp. 32-41.
Cranefield, P. F., Hoffmann, B. F., Propagated repolarization in heart muscle, in ‟Journal of general physiology", 1958, XLI, pp. 633-649.
Cranefield, P. F., Hoffman, B. F., Paes de Carvalho, A., Effects of acetylcholine on single fibres of the atrioventricular node, in ‟Circulation research", 1959, VII, pp. 19-23.
Deck, K. A., Kern, R., Trautwein, W., Voltage clamp technique in mammalian cardiac fibres, in ‟Pflügers Archiv", 1964, CCLXXX, pp. 50-62.
Deck, K. A., Trautwein, W., Ionic current in cardiac excitation, in ‟Pflügers Archiv", 1964, CCLXXX, pp. 63-80.
Délèze, J., The recovery of resting potential and input resistance in sheep heart injured by knife or laser, in ‟Journal of physiology", 1970, CCVIII, pp. 547-562.
Draper, M. H., Weidmann, S., Cardiac resting and action potentials recorded with an intracellular electrode, in ‟Journal of physiology", 1951, CXV, pp. 74-94.
Dudel, J., Peper, K., Rudel, R., Trautwein, W., Excitatory membrane current in heart muscle (Purkinje fibres), in ‟Pflügers Archiv", 1966, CCXCII, pp. 255-293.
Dudel, J., Peper, K., Rüdel, R., Trautwein, W., The dynamic chloride component of membrane current in Purkinje fibres, in ‟Pflüges Archiv", 1967, CCXCVI, pp. 308-327.
Dudel, J., Rüdel, R., Voltage and time dependence of excitatory sodium current in cooled sheep Purkinje fibres, in ‟Pflügers Archiv", 1970, CCCXV, pp. 136-158.
Durrer, D., Roos, J. P., Buller, J., The spread of excitation in canine and human heart, in Electrophysiology of the heart (a cura di B. Taccardi e G. Marchetti), Oxford 1963, pp. 203-214.
Engelmann, Th., W., Vergleichende Untersuchungen zur Lehre von der Muskel- und Nervenelektrizität, in ‟Pflügers Archiv", 1877, XV, pp. 116-148.
Engstfeld, G., Antoni, H., Fleckenstein, A., Die Restitution der Erregungsfortleitung und Kontraktionskraft des K+-gelähmten Frosch-und Säugetiermyokards durch Adrenalin, in ‟Pflügers Archiv", 1961, CCLXXIII, pp. 145-163.
Engsteld, G., Kotowski, H., Antoni, H., Nast, A., Elektrophysiologische Untersuchungen zur Aufhebung der Kaliumlähmung des Froschmyokards durch Adrenalin, in ‟Pflügers Archiv", 1960, suppl., p. 87.
Falk, G., Fatt, P., Linear electrical properties of striated muscle fibres observed with intracellular electrodes, in ‟Proceedings of the Royal Society" (Series B), 1964, CLX, pp. 69-123.
Ford, L. E., Podolsky, R., Regenerative calcium release within muscle cells, in ‟Science", 1969, CLXVII, pp. 58-59.
Fozzard, H. A., Membrane capacity of the cardiac Puyrkinje fibre, in ‟Journal of physiology", 1966, CLXXXII, pp. 255-267.
Freygang, W. H., Trautwein, W., The structural implications of the linear electrical properties of cardiac Purkinje strands, in ‟Journal of general physiology", 1970, LV, pp. 524-547.
Glitsch, H. G., Über das Membranpotential des Meerschweinchenvorhofes nach Hypothermie, in ‟Pflügers Archiv", 1969, CCCVII, pp. 29-46.
Goldman, D. E., Potential, impedance, and rectification in membranes, in ‟Journal of general physiology", 1943, XXVII, pp. 37-60.
Haas, H. G., Kern, R., Einwätcher, H. M., Tarr, M., Kinetics of Na inactivation in frog atria, in ‟Pflügers Archiv", 1971, CCCXXIII, pp. 141-157.
Haas, H. G., Trautwein, W., Increase of sodium efflux in the frog heart induced by epinephrine, in ‟Nature", 1963, CXCVII, pp. 80-81.
Harris, E. J., Hutter, O. F., The action of acetylcholine on the movements of potassium ions in the sinus venosus of the heart, in ‟Journal of physiology", 1956, CXXXIII, pp. 58-59.
Hodgkin, A. L., Huxley, A. F., Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVI, pp. 449-472.
Hodgkin, A. L., Huxley, A. F., The components of membrane conductance in the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVI, pp. 473-496.
Hodgkin, A. L., Huxley, A. F., The dual effect of membrane potential on sodium conductance in the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVI, pp. 497-506.
Hodgkin, A. L., Huxley, A. F., A quantitative description of membrane current and its application to conduction and ecitation in nerve, in ‟Journal of physiology", 1952, CXVII, pp. 500-544.
Hodgkin, A. L., Rushton, W. A. H., The electrical constants of a crustacean nerve fibre, in ‟Proceedings of the Royal Society" (Seris B), 1946, CXXXIII, pp. 444-479.
Hoffman, B. F., Cranefield, P. F., Electrophysiology of the heart, New York 1960.
Hoffman, B. F., Kao, C. Y., Suckling, E. E., Refractoriness in cardiac muscle, in ‟American journal of physiology", 1957, CXC, pp. 473-482.
Hoffman, B. F., Paes de Carvalho, A., Mello, W. C. de, Cranefield, P. F., Electrical activity of single fibres of the atrioventricular node, in ‟Circulation research", 1959, VII, pp. 11-18.
Hoffman, B. F., Siebens, A. A., Suckling, E. E., Effect of heart rate on cardiac membrane potentials and the unipolar electrogram, in ‟American journal of physiology", 1954, CLXXIX, pp. 123-130.
Hutter, O. F., Mode of action of autonomic transmitters on the heart, in ‟British medical bulletin", 1957, XIII, pp. 176-180.
Hutter, O. F., Noble, D., Anion conductance of cardiac muscle, in ‟Journal of physiology", 1961, CLVII, pp. 335-350.
Hutter, O. F., Trautwein, W., Vagal and sympathetic effects on the pacemaker fibres in the sinus venosus of the heart, in ‟Journal of general physiology", 1956, XXXIX, pp. 715-733.
Langer, G. A., Ion fluxes in cardiac excitation and contraction and their relation to myocardial contractility, in ‟Physiological reviews", 1968, XLVIII, pp. 708-757.
Ling, G., Gerard, R. W., The normal membrane potential of frog sartorius fibres, in ‟Journal of cellular and comparative physiology", 1949, XXXIV, pp. 383-396.
Mascher, D., Electrical and mechanical events in depolarized cardiac muscle fibres during low sodium perfusion, in ‟Pflügers Archiv", 1971, CCCXXIII, pp. 284-296.
Mascher, D., Peper, K., Two components of inward current in myocardial muscle fibres, in ‟Pflügers Archiv", 1969, CCCVII, pp. 190-203.
New, W., Trautwein, W., Inward membrane currents in mammalian myocardium, in ‟Pflügers Archiv", 1972, CCCXXXIV, pp. 1-38.
Niedergerke, R., The potassium chloride contracture of the heart and its modification by calcium, in ‟Journal of physiology", 1956, CXXXIV, pp. 584-599.
Niedergerke, R., Orkand, R. K., The dual effect of calcium on the action potential of the frog's heart, in ‟Journal of physiology", 1966, CXXXIV, pp. 291-311.
Niedergerke, R., Orkand, R. K., The dependence of the action potential of the frog's heart on the external and intracellular sodium concentration, in ‟Journal of physiology", 1966, CXXXIV, pp. 312-334.
Noble, D., A modification of the Hodgkin-Huxley equations applicable to Purkinje fibre action and pacemaker potentials, in ‟Journal of physiology", 1962, CLX, pp. 317-352.
Noble, D., Tsien, R. W., The kinetics and rectifier properties of the slow potassium current in cardiac Purkinje fibres, in ‟Journal of physiology", 1968, CXCV, pp. 185-214.
Noble, D., Tsien, R. W., Outward membrane currents activated in the plateau range of potentials in cardiac Purkinje fibres, in ‟Journal of physiology", 1969, CC, pp. 205-231.
Noble, D., Tsien, R. W., Reconstruction of the repolarization process in cardiac Purkinje fibres based on voltage clamp measurements of membrane current, in ‟Journal of physiology", 1969, CC, pp. 233-254.
Otsuka, M., Die Wirkung von Adrenalin auf Purkinje-Fasern von Säugetierherzen, in ‟Pflügers Archiv", 1958, CCLXVI, pp. 512-517.
Overton, E., Beiträge zur allgemeinen Muskel- und Nervenphysiologie, in ‟Pflügers Archiv", 1902, XCII, pp. 346-386.
Paes de Carvalho, A., Hoffman, B. F., Paula Carvalho, M. de, Two components of the cardiac action potential, in ‟Journal of general physiology", 1969, LIV, pp. 607-635.
Peper, K., Trautwein, W., A note on the pacemaker current in Purkinje fibres, in ‟Pflügers Archiv", 1969, CCCIX, pp. 356-361.
Puech, P., L'activité électrique auriculaire normale et pathologique, Paris 1956.
Reuter, H., Über die Wirkung von Adrenalin auf den cellulären Ca-Umsatz des Meerschweinchenvorhofs, in ‟Naunyn-Schmiedeberg Archiv für experimentelle Pathologie und Pharmakologie", 1965, CCLI, pp. 401-412.
Reuter, H., Slow inactivation of currents in cardiac Purkinje fibres, in ‟Journal of physiology", 1968, CXCVII, pp. 233-253.
Rougier, O., Vassort, G., Garnier, D., Gargouil, Y. M., Coraboeuf, E., Existence and role of a slow inward current during the frog atrial action potential, in ‟Pflügers Archiv", 1969, CCCVIII, pp. 91-110.
Rougier, O., Vassort, G., Stämpfli, R., Voltage clamp experiments on frog atrial heart muscle fibres with the sucrose gap technique, in ‟Pflügers Archiv", 1968, CCCI, pp. 91-108.
Scher, A. M., Young, A. C., Ventricular depolarization and the genesis of QRS, in Electrophysiology of the heart, in ‟Annals of the New York Academy of Sciences", 1957, LXV, pp. 768-778.
Schmidt, R. F., Über die Acetylcholin-Empfindlichkeit verschiedener Herzabschnitte, in ‟Archiv für Pathologie und Pharmakologie", 1958, CCXXXIII, pp. 531-541.
Schütz, E., Elektrophysiologie des Herzens bei einphasischer Ableitung, in ‟Ergebnisse der Physiologie", 1936, XXXVIII, pp. 493-620.
Trautwein, W., Elektrophysiologie der Herzmuskelfaser, in ‟Ergebnisse der Physiologie", 1961, LI, pp. 131-198.
Trautwein, W., Generation and conduction of impulses in the heart as affected by drugs, in ‟Pharmacological reviews", 1963, XV, pp. 277-332.
Trautwein, W., Dudel, J., Aktionspotential und Mechanogramm des Warmblüterherzmuskels als Funktion der Schlagfrequenz, in ‟Pflügers Archiv", 1954, CCLX, pp. 24-39.
Trautwein, W., Dudel, J., Zum Mechanismus der Membranwirkung des Acetylcholin an der Herzmuskelfaser, in ‟Pflügers Archiv", 1958, CCLXVI, pp. 324-334.
Trautwein, W., Gottstein, U., Federschmidt, K., Der Einfluss der Temperatur auf den Aktionsstrom des excidierten Purkinje-Fadens, gemessen mit einer intrazellulären Elektrode, in ‟Pflügers Archiv", 1953, CCLVIII, pp. 243-260.
Trautwein, W., Schmidt, R. F., Zur Membranwirkung des Adrenalins an der Herzmuskelfaser, in ‟Pflügers Archiv", 1960, CCLXII, pp. 715-726.
Trautwein, W., Zink, K., Über Membran- und Warmblüterherzens, in ‟Pflügers Archiv", 1952, CCLVI, pp. 68-84.
Tritthart, H., Fleckenstein, A., Kaufmann, R., Die spezifische Beschleunigung des Erschlaffungsprozesses durch sympathische Überträgerstoffe und die Hemmung dieses Effektes durch β-Rezeptoren-Blockade, in ‟Pflügers Archiv", 1968, CCCIII, pp. 350-365.
Vassalle, M., Barnabei, O., Norepinephrine and potassium fluxes in cardiac Purkinje fibers, in ‟Pflügers Archiv", 1971, CCCXXII, pp. 287-303.
Vassalle, M., Carpentier, R., Overdrive excitation. Onset of activity following fast drive in cardiac Purkinje fibres exposed to norepinephrine, in ‟Pflügers Archiv", 1972, CCCXXXII, pp. 198-205.
Vassort, G., Rougier, O., Garnier, D., Sauviat, M., Coraboeuf, E., Gargouil, Y., Effects of adrenaline on membrane inward currents during the cardiac action potential, in ‟Pflügers Archiv", 1969, CCCIX, pp. 70-81.
Vitek, M., Trautwein, W., Slow inward current and action potential in cardiac Purkinje fibres, in ‟Pflügers Archiv", 1971, CCCXXIII, pp. 204-218.
Weidmann, S., Effect of current flow on the membrane potential of cardiac muscle, in ‟Journal of physiology", 1951, CXV, pp. 227-236.
Weidmann, S., The electircal constants of Purkinje fibres, in ‟Journal of physiology", 1952, CXVIII, pp. 348-360.
Weidmann, S., The effect of the cardiac membrane potential on the rapid availability of the sodium carrying system, in ‟Journal of physiology", 1955, CXXVII, pp. 213-224.
Weidmann, S., Effects of calcium ions and local anaesthetics on electrical properties of Purkinje fibres, in ‟Journal of physiology", 1955, CXXIX, pp. 568-582.
Weidmann, S., Elektrophysiologie der Herzmuskelfaser, Bern 1956.
Weidmann, S., The diffusion of radiopotassium across intercalated disks of mammalian cardiac muscle, in ‟Journal of physiology", 1966, CLXXXVII, pp. 323-342.
Weidmann, S., Electrical constants of trabecular muscle from mammalian heart, in ‟Journal of physiology", 1970, CCX, pp. 1041-1054.
West, T. C., Ultramicroelectrode recording from the cardiac pacemaker, in ‟Journal of pharmacology", 1955, CXV, pp. 283-290.
Wood, E. H., Heppner, R. L., Weidmann, S., Inotropic effects of electric currents. I. Positive and negative effects of constant electric currents or current pulses applied during cardiac action potentials. II. Hypotheses: calcium movements, excitation, contraction, coupling and inotropic effects, in ‟Circulation research", 1969, XXIV, pp. 409-445.
Woodbury, L. A., Crill, W. E., On the problem of impulse conduction in the atrium, in Neurons inhibition, Oxford 1961, pp. 125-135.
Woodbury, L. A., Hecht, H. H., Christopherson, A. R., Membrane resting and action potentials of single cardiac muscle fibres of the frog ventricle, in ‟American journal of physiology", 1951, CLXIV, pp. 307-318.