Circuiti molecolari di regolazione del reclutamento leucocitario
Circuiti molecolari di regolazione del reclutamento leucocitario
II reclutamento dei leucociti dal torrente ematico costituisce un processo a più stadi che vede coinvolti molecole solubili (citochine primarie e secondarie) e recettori di superficie (principalmente molecole di adesione) espressi sui leucociti stessi e sul/'endotelio. Come sistema modello vengono analizzate le proprietà dell'interleuchina 1, un mediatore primario prototipico dotato di circuiti di regolazione peculiare, e delle chemochine, una superfamiglia emergente di mediatori secondari solubili. Questi mediatori offrono nuovi paradigmi per comprendere patologie diverse, come illustrato dal ruolo dei recettori delle chemochine quali cofattori essenziali per l'ingresso del virus HIV-1 e di altri patogeni nelle cellule. Inoltre essi costituiscono strumenti e bersagli per strategie terapeutiche innovative.
Introduzione
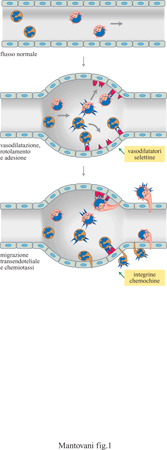
La fuoriuscita dei leucociti dal sangue circolante e il loro afflusso nei tessuti sono un momento essenziale dei processi infiammatori e immunitari. Il reclutamento dei leucociti dal circolo sanguigno e il loro accumulo nei tessuti costituiscono un processo a più stadi che coinvolge un primo momento costituito dalla vasodilatazione, seguito da rotolamento e adesione all'endotelio vascolare e infine dal passaggio attraverso l'endotelio e la membrana basale (fig. 1). La fuoriuscita dal torrente ematico è controllata essenzialmente dalle proprietà dell'endotelio vascolare e dai segnali chemiotattici di origine tissutale, capaci di indurre la migrazione direzionale dei leucociti (Mantovanietal., 1992; Springer, 1994; Carlos e Rarlan, 1994; Butcher e Picker, 1996; Mantovani et al., 1997). Il processo di reclutamento leucocitario è in genere molto selettivo, in quanto determina l'accumulo preferenziale in questo o in quel distretto dell'una (eosinofili) o dell'altra popolazione (linfociti B) di globuli bianchi. Per esempio, si accumulano eosinofili nelle sedi di reazioni allergiche; oppure, i linfociti B associati alle mucose sono arricchiti di cellule producenti IgA (immunoglobulina A). La selettività del reclutamento leucocitario non è determinata da una sola molecola, selettiva per l'una o per l'altra popolazione cellulare, ma è il risultato di una combinazione di vari determinanti molecolari (molecole adesive e fattori chemiotattici). Il paradigma corrente è dunque quello del 'codice di avviamento postale' (area code) dove l'indirizzo è determinato dall'insieme delle lettere e dei numeri che lo costituiscono.
L'identificazione dell'endotelio vascolare come componente cruciale, capace di svolgere un ruolo attivo nei processi trombotici, infiammatori e immunitari, è relativamente recente; infatti il rivestimento endoteliale era tradizionalmente visto come un elemento passivo, dotato di proprietà in negativo (per esempio, la non trombogenicità). Nel corso degli anni Novanta vi è stata una notevole crescita di interesse nei confronti della biologia dell'endotelio e questi studi hanno identificato la parete vascolare come un elemento primario, capace di svolgere un ruolo attivo nei processi di emostasi-trombosi, infiammazione e in alcune fasi della risposta immunitaria (Mantovani et al., 1992; Mantovani et al., 1997).
Il secondo elemento coinvolto nel reclutamento leucocitario è costituito dai fattori di origine tissutale, capaci di indurre migrazione direzionale dei globuli bianchi in risposta a un gradiente di concentrazione (chemiotassi). l segnali chemiotattici classici sono costituiti da peptidi formilati di origine batterica, il cui prototipo è il tripeptide formilato fMet-Leu-Phe, e da prodotti della cascata del complemento, in particolare C5a.
Questi segnali chemiotattici classici ovviamente non sono in grado di spiegare l'accumulo di leucociti in situazioni quali le reazioni di ipersensibilità ritardata o le infiammazioni croniche, in cui non vi sono processi infettivi né attivazione della cascata del complemento. Le conoscenze classiche sul reclutamento leucocitario non spiegano, inoltre, l'accumulo selettivo dell'una o dell'altra popolazione leucocitaria in una varietà di condizioni fisiopatologiche. L'identificazione di cito chine capaci di indurre migrazione direzionale delle diverse popolazioni leucocitarie costituisce la premessa per la comprensione delle basi molecolari che regolano il reclutamento dei leucociti appartenenti al compartimento ematico; inoltre essa permette di progettare metodiche sperimentali per la ricerca di farmaci agonisti o antagonisti.
Infine, bisogna ricordare come le caratteristiche del flusso ematico siano estremamente importanti nel permettere il reclutamento leucocitario (Mantovani et al., 1992; Mantovani et al., 1997). Infatti, le sedi di infiammazione sono caratterizzate da vasodilatazione, con rallentamento del flusso, e queste alterazioni reolo giche sono 'permissive' per l'azione degli altri due fattori (fattori chemiotattici e molecole adesive). È importante osservare come anche alterazioni del flusso siano controllate in parte dalle cellule endoteliali che, quando vengono esposte a segnali infiammatori come quello rappresentato dall'interleuchina l (lL-l), producono monossido di azoto (NO), prostaglandina 12 ed endotelina. Le citochine sono mediatori polipeptidici che svolgono un ruolo centrale nell'immunità e nell'infiammazione. Schematicamente, possiamo distinguere mediatori primari dell'infiammazione (IL-l; TNF, Tumor Necrosis Factor, fattore di necrosi tumorale; IL-6, interleuchina 6), prodotti da macrofagi che mettono in movimento la cascata delle citochine, e mediatori secondari, come le chemochine e le molecole adesive, che vengono indotti dai mediatori primari e agiscono a valle.
In questo saggio prenderemo in esame innanzi tutto i circuiti di regolazione molecolare di IL-l, scelta come mediatore primario prototipico (Dinarello, 1996). Successivamente concentreremo la nostra attenzione sul ruolo della parete vascolare, attraverso l'analisi di molecole adesive e chemochine.
Citochine primarie: il sistema IL-1
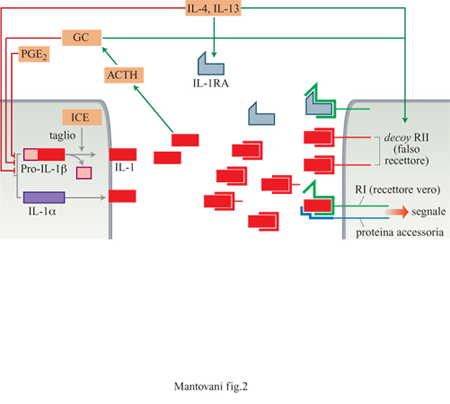
IL- I è il termine utilizzato per identificare due polipeptidi, α e β, che sono fra gli attivatori più potenti e multifunzionali descritti in immunologia e in biologia cellulare. Lo spettro d'azione di IL-l comprende cellule di origine ematopoietica, dai precursori midollari ai leucociti differenziati, la parete vasale, cellule di origine mesenchimale, nervosa ed epiteliale. È sufficiente l'occupazione di pochi recettori per cellula per dare la risposta. L'attività di IL-l si sovrappone in larga misura a quella del TNF e di altre citochine come IL-6 (tab. I). IL-l è inoltre un sistema complesso dotato di peculiari circuiti di regolazione negativa (fig. 2).
L'identificazione di IL-l è stata il risultato di due filoni indipendenti di ricerca. Da una parte gli studi sulla patogenesi della febbre avevano condotto all'identificazione di prodotti solubili di origine leucocitaria come possibili mediatori; nel 1943 T. Menkins aveva suggerito che i leucociti liberassero una sostanza pirogenica che chiamò piressina; nel 1955 A. Atkins e G. Wood identificarono un fattore pirogenico circolante nel coniglio, denominato pirogeno endogeno (EP), successivamente purificato. Dall'altra parte si è invece sviluppata una linea di lavoro squisitamente immunologica; A. Graye B. Waksman nel 1973 identificarono un fattore di attivazione dei linfociti (LAF, Lymphocyte Activating Factor), cui seguì la descrizione di diverse attività regolatrici mediate dallo stesso fattore. Come previsto dagli studi di caratterizzazione fisico-chimica e biologica di LAF/EP, nel 1984 il clonaggio molecolare identificò due geni (α e β) i cui prodotti erano responsabili sia delle attività immunologiche, sia delle attività di tipo infiammatorio-pirogenico descritte in precedenza. Contemporaneamente verso la fine degli anni Settanta diversi laboratori avevano descritto l'esistenza di inibitori di IL-l. Un inibitore di IL-l (IL-IRA, IL-l Receptor Antagonist, antagonista recettoriale di IL-l) è stato recentemente clonato e identificato come membro della famiglia di IL-l (Muzio et al., 1995; Dinarello, 1996). IL-l si presenta dunque come prototipo di cito china infiammatoria pleiotropica, appartenente a un sistema complesso costituito da IL-l α e β nelle loro diverse forme molecolari, da IL-IRA e da almeno due strutture recettoriali (tab. 2).
Struttura di IL-1
Nella loro forma secreta, IL-l α e β hanno massa molecolare di 17 kDa ma punto isolettrico diverso (pH 5,2 per IL-l α e pH 7 per IL-l β). Le due forme sono codificate da geni distinti e mostrano una modesta omologia di sequenza. L'omologia amminoacidica fra α e β (umana) è del 26%, mentre a livello delle sequenze nucleotidiche l'omologia è del 45%. Benchè la forma matura extracellulare sia di 17 kDa, lL-l è prodotta come un precursore di 31 kDa che viene quindi modificato nella forma matura. IL-l α e IL-l β mancano di una sequenza segnale e il meccanismo di secrezione di queste proteine rimane non chiarito. La pro-IL-lβ viene processata da un enzima proteolitico, ICE (IL-l Converting Enzyme, enzima di conversione di IL-l), la cui attività è a sua volta soggetta a regolazione proteolitica. ICE appartiene a una famiglia di cisteinproteasi coinvolte nella regolazione della morte cellulare; inoltre è probabilmente coinvolto nel trasporto e nella secrezione di IL-lβ. IL-IRA è una proteina di 17 ÷ 20 kDa e ha un'omologia particolarmente significativa con IL-l β. Sono state cIonate tre isoforme di IL-IRA di cui una secreta e due intracellulari (Muzio et al., 1995; Dinarello, 1996).
Recettori di IL-1
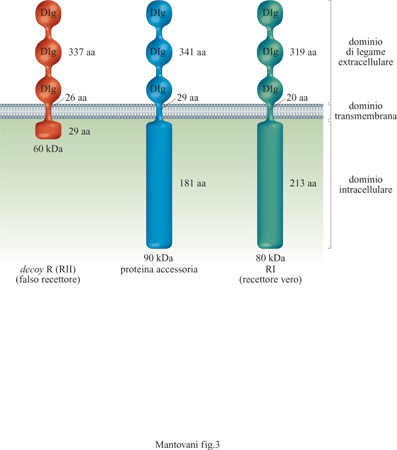
Vi sono due strutture recettoriali distinte (Colotta et al., 1994), entrambe capaci di legare IL-l α e IL-lβ, distribuite in modo differenziale in cellule diverse (fig. 3). Un recettore di 80 kDa è espresso in linfociti T, fibroblasti, cellule epiteliali, endoteli. Il recettore di 80 kDa (detto anche di tipo I) è in grado di trasdurre segnali in seguito a formazione del legame con IL-l e attiva le cellule che lo esprimono. Una proteina accessoria (90 kDa) aumenta l'affinità del recettore di tipo I per IL-l e probabilmente coopera nella trasduzione del segnale. Il recettore di 60 kDa (di tipo II) è un recettore incapace di dare segnali (decoy receptor); esso lega e sequestra IL-l riducendo così la genesi di segnali di attivazione tramite il recettore di tipo I (Colotta et al., 1993; Colotta et al., 1994; Re et al., 1994; Colotta et al., 1995; Re et al., 1996). Il recettore decoy è espresso prevalentemente su mielomonociti e cellule B. Un altro meccanismo che consente di inibire le risposte a IL-l è fornito dalle molecole antagoniste (IL-IRA). Queste ultime legano preferenzialmente il recettore di tipo I con un'affinità paragonabile a quella di IL-l, senza però indurre risposte biologiche. Anch'esse inibiscono l'attività di IL-l competendo per lo stesso recettore. È interessante notare come molecole immunosoppressive/antinfiammatorie (glicocorticoidi, citochine quali IL-4 o IL-13) agiscano in modo coordinato su componenti diversi del sistema, bloccando la produzione di IL-l, aumentando quella di antagonisti e stimolando espressione e rilascio del recettore di tipo II (Colotta et al., 1993; 1994; Re et al., 1994).
Cellule produttrici di IL-1 e regolazione
IL-l è stata descritta originariamente come una monochina, cioè un prodotto delle cellule appartenenti allo stipite differenziativo monocito-macrofagico. Studi succeSSIVI hanno però rivelato che pressoché ogni tipo cellulare è in grado di produrre IL-l se appropriatamente stimolato, benché i monociti-macrofagi rimangano la sorgente quantitativamente più importante di questa citochina. Le cellule capaci di produrre IL-l comprendono, tra le altre, linfociti B e T, cellule Natural Killer (NK), fibroblasti, cellule della sinovia e del mesangio, cheratinociti e cellule endoteliali. La produzione di IL-l può essere indotta da molti stimoli differenti. Batteri e prodotti batterici, fra cui in particolare le endotossine, sono potenti induttori di IL-l, che a sua volta costituisce uno dei mediatori essenziali della risposta dell'organismo a questi microrganismi. Altri induttori di IL-l rilevanti in fisiopatologia sono i prodotti della cascata del complemento (C5a in particolare), i complessi antigene-anticorpo e le citochine, quali TNF e IL-l stessa. IL-IRA è stato identificato in termini molecolari grazie al fatto che complessi antigene-anticorpo sono in grado di indume la produzione. Non è ancora chiaro se IL-l e IL-IRA condividano stimoli e cellule produttrici.
Effetti biologici di IL-1
IL-l è il prototipo di una cito china pleiotropica, attiva cioè su una varietà di cellule e organi (tab. 3). È possibile raggruppare le attività biologiche di IL-l in due grandi gruppi di effetti: quelli collegati al sistema immunitario ed emopoietico e quelli collegati al controllo dell'infiammazione.
Sistema immunitario ed emopoietico
IL-l aumenta la velocità di replicazione di timo citi in risposta a mito geni quali concanavalina A e fitoemoagglutinina (PHA). IL-l aumenta inoltre la produzione di IL-2 da parte di linfociti T. Queste proprietà biologiche di IL-l costituiscono la base dei saggi biologici mediante i quali è possibile misurarne l'attività. IL-l induce inoltre la produzione di IL-6 in una varietà di tipi cellulari, inclusi i linfociti T, e probabilmente l'effetto a questo livello è, almeno in parte, mediato dall'induzione della seconda citochina. Il ruolo effettivamente svolto da IL-l (eventualmente via IL-6) nella presentazione dell'antigene ai linfociti T è stato lungamente dibattuto. Benché non sia stato stabilito con certezza che IL-l svolga un ruolo essenziale e necessario nella presentazione dell'antigene, i dati disponibili suggeriscono che questa citochina possa essere importante nell'induzione della risposta da parte di linfociti T vergini, cioè mai venuti in contatto con l'antigene. IL-l agisce anche sulla proliferazione e sulla differenziazione delle cellule B. L'induzione di IL-6, che è un potente regolatore della funzione B, costituisce inoltre un'importante via con cui ILl agisce sui linfociti B. IL-l agisce sui precursori midollari emopoietici con attività di tipo CSF (Colony Stimulating Faetor, fattore che stimola la formazione di colonie) e come tale è stata anche in passato identificata (emopoietina l); agisce inoltre su precursori emopoietici immaturi. Oltre ad avere attività CSF di per sé, essa induce la produzione di CSF da parte di una varietà di tipi cellulari (granulo citi, granulociti-monociti e monociti). L'attività CSF è probabilmente una componente importante dell'attività radioprotettiva di IL-l.
Cellule non emopoietiche
I neuroni termoregolatori dell'ipotalamo sono il bersaglio della prima attività descritta di IL-l: l'induzione di febbre. L'attività pirogenica di IL-l è mediata dall'induzione di prostaglandine e bloccata dalla somministrazione di inibitori delle ciclossigenasi. Altri effetti di IL-l sul sistema nervoso centrale sono l'induzione del sonno slow wave (letteralmente, onda lenta) e dell'anoressia. IL-l stimola la produzione di CRF (Cortieotropin Releasing Faetor, fattore di rilascio della corticotropina) che a sua volta attiva la produzione di ACTH e glicocorticoidi. Poichè i glicocorticoidi sono importanti inibitori della sintesi di IL-l, questo rappresenta un circuito di feedback negativo della produzione di IL-l. Un secondo meccanismo di feedback inibitorio della sintesi di IL-l è costituito dalle prostaglandine, PGE in particolare. Infatti, gli stimoli che inducono la produzione di IL-l a livello macrofagico e IL-l stessa inducono anche produzione di PGE. Un ulteriore meccanismo inibitorio il cui potenziale terapeutico è oggetto di studio è costituito dagli acidi grassi w3, di cui sono ricchi alcuni pesci e il cui meccanismo d'azione non è ancora stato ben definito.
IL-l è un mediatore, probabilmente il principale, della risposta di fase acuta, di quell'insieme cioè di eventi (alterazioni di parametri ematochimici e cellulari) con i quali l'organismo risponde a una situazione d'emergenza come quella rappresentata dall'esposizione sistemica ai batteri o ai loro prodotti, in particolare endotossine. A livello epatico, IL-l induce la produzione di proteina C reattiva, fibrinogeno, antiproteasi (per esempio, α-l-antitripsina) e amiloide A. Per alcune di queste proteine (amiloide A), IL-l agisce direttamente sulla cellula epatica, mentre per altre (fibrinogeno) essa agisce indirettamente, stimolando la produzione di IL-6. IL-l induce anche altre alterazioni tipiche della risposta di fase acuta, come ipozinchemia e iposideremia.
Ritornando ai meccanismi di reclutamento leucocitario, IL-l induce una complessa riprogrammazione della funzione dell'endotelio vascolare. L'identificazione degli effetti di IL-l a questo livello ha modificato profondamente la comprensione del ruolo svolto dal rivestimento endoteliale nei processi immunitari, infiammatori e trombotici. Infatti, se per lungo tempo le cellule endoteliali sono state considerate essenzialmente un rivestimento passivo, dotate di proprietà negative (per esempio, la non trombogenicità), esse sono viste ora come cellule che svolgono un ruolo di primaria importanza in una varietà di condizioni fisiopatologiche. IL-l altera le proprietà emostatiche e infiammatorie delle cellule endoteliali inducendo la sintesi di tromboplastina (attività procoagulante, PCA), e di P AF (Platelet Aetivating F aetor, fattore di attivazione delle piastrine), inibendo il meccanismo di anticoagulazione mediato dalla trombomodulina (TM) e dalla proteina C e inibendo anche la dissoluzione di trombi tramite l'induzione dell'inibitore dell'attivatore del plasminogeno (PAI). Inoltre, l'endotelio esposto a IL-l produce prostaciclina (PGI) e NO, due potenti vasodilatatori. Le modificazioni vascolari fin qui descritte spiegano, almeno in parte, la vasodilatazione in sedi infiammatorie e i fenomeni coagulativi (reazioni di Schwartzman) associati alla presenza in circolo di endotossine batteriche (tab. 4). Il reclutamento dei leucociti è un aspetto essenziale dei processi infiammatori ed è regolato da IL-l a due livelli. Innanzi tutto, IL-l induce in vari tipi di cellule, e in particolare nelle cellule vascolari, la produzione di citochine chemiotattiche, capaci cioè di indurre migrazione direzionale dei leucociti. Inoltre, IL-l induce l'espressione, aumentata o ex novo, sulla superficie luminale dell' endotelio, di strutture adesive che vengono riconosciute da diverse popolazioni leucocitarie. La comparsa di molecole adesive sulla superficie endoteliale e la produzione di cito chine chemiotattiche stanno alla base del reclutamento leucocitario indotto da IL-l a livello dei tessuti.
Mediatori secondari: azione delle molecole adesive sui leucociti e sull'endotelio vascolare
In tutta la loro storia naturale, le cellule leucocitarie sperimentano un'interazione stretta con l'endotelio vascolare. Durante l'embriogenesi, cellule ematopoietiche ed endoteliali hanno origine comune a livello delle isole ematiche. Successivamente, durante l'intera vita dell'organismo, le cellule endoteliali rappresentano un costituente cruciale del microambiente ematopoietico, producendo quantità cospicue di citochine con attività di CSF: questi mediatori regolano la proliferazione e la differenziazione dei precursori ematopoietici. Una volta immessi in circolo, i leucociti devono interagire con le cellule della parete vascolare che regolano in vari modi la loro fuoriuscita dal torrente ematico. Infine, lo sviluppo e l'espressione di reazioni immunitarie e infiammatorie nei tessuti necessitano della partecipazione attiva delle cellule endoteliali, che regolano le varie popolazioni leucocitarie e da queste sono a loro volta regolate.
L'interazione fra endotelio vascolare e leucociti del sangue coinvolge due sistemi di comunicazione, strettamente connessi. Una prima modalità di comunicazione è costituita dall'interazione fisica dei due tipi cellulari, mediata da recettori e controrecettori, espressi in modo regolato. Un secondo sistema di comunicazione è costituito dal rilascio di mediatori solubili di natura polipeptidica (citochine) o lipidica (per esempio, il PAF) che influenzano in modo bidirezionale le due cellule.
Nell'analizzare l'interazione fra endotelio vascolare e leucociti si riscontrano similitudini esistenti fra cellule del sistema dei fagociti mononucleati ed endotelio vascolare. Queste similitudini includono l'espressione di strutture di membrana comuni e alcune proprietà funzionali (per esempio, la produzione di alcune cito chine e la risposta a citochine ematopoietiche). Queste similitudini e interrelazioni richiamano alla mente il vecchio termine, ora in disuso, di 'sistema reticolo-endoteliale', coniato in passato dai patologi che acutamente avevano colto il rapporto simbiotico fra fagociti ed endotelio.
L'endotelio vascolare svolge un ruolo centrale sia nell'immunità innata sia nell'immunità specifica. Il ruolo dell' endotelio nell'immunità specifica è legato da una parte alla ricircolazione linfocitaria e dall'altra alla sua capacità di fungere da cellula accessoria nell'induzione di risposte immuni. I linfociti T e B, a differenza delle cellule NK, dei polimorfonucleati e dei fagociti mononucleati, hanno la capacità di ricircolare; le cellule linfoidi infatti, fuoriuscite dal sangue, entrano nel sistema linfatico e, attraverso il dotto toracico, rientrano nel circolo sanguigno. La ricircolazione dei linfociti da una parte esercita una funzione generale di sorveglianza di tutti gli organi e tessuti e dall' altra consente di localizzare in sedi ben definite popolazioni linfoidi specializzate. Il substrato anatomico più caratteristico della ricircolazione linfocitaria è costituito dall' endotelio alto. Questo endotelio, formato da cellule cuboidi, è stato inizialmente descritto a livello delle venule postcapillari con endotelio alto (HEV, High Endothelial Venules) dei linfonodi. È principalmente a questo livello che avviene, per diapedesi, la fuoriuscita dei linfociti dal torrente ematico. Le HEV aumentano nei linfonodi durante la risposta immunitaria e sono presenti nei tessuti stessi coinvolti in reazioni di immunità cellulomediata; esse sono invece pressoché assenti in animali congenitamente atimici o privi di timo a seguito di rimozione chirurgica dell' organo. Finora non è stato possibile coltivare in vitro endotelio alto e identificare con certezza i mediatori responsabili di questa morfologia peculiare. L'esempio primo e più illuminante di ricircolazione e localizzazione selettiva di una popolazione linfoide è costituito dai linfociti B che producono IgA. Queste cellule tendono infatti a localizzarsi in modo preferenziale nelle mucose, in quello che viene generalmente chiamato MAL T (Mucosal Associated Lymphoid Tissue, tessuto linfoide associato alla mucosa). Nel paragrafo successivo concentreremo la nostra attenzione sulle molecole adesive coinvolte nell'interazione fra cellule dell'immunità innata ed endotelio.
Endotelio e infiammazione
In generale l'adesione dei leucociti all'endotelio è un processo fisiologico: in condizioni normali, infatti, una percentuale significativa (le stime sono variabili e arrivano all'80%) dell'insieme intravascolare dei neutrofili è marginata, resta cioè aderente all' endotelio del microcircolo della milza, del polmone e di altri organi. Quest'insieme marginato è in equilibrio rapido con l'insieme delle cellule circolanti e, in seguito a stimoli acuti come la liberazione di adrenalina, le cellule marginate possono entrare in circolo. I neutro fili marginati possono anche migrare attraverso la parete vascolare ma, in questo caso, non possono poi ricircolare e vengono eliminati. llinfociti aderiscono e migrano normalmente a livello di vasi specializzati, come le venule postcapillari dei tessuti linfoidi (vedi sopra). Dopo qualche ora, i linfociti ritornano poi in circolo attraverso il sistema linfatico.
Accanto a questo tipo di interazioni, presenti in condizioni normali, i leucociti aderiscono ai tessuti e li infiltrano a seguito di reazioni di tipo immunitario e infiammatorio. L'endotelio contribuisce a questi processi essenzialmente liberando sostanze chemiotattiche, in grado di richiamare e di attivare i leucociti nella zona di infiammazione, esprimendo sulla membrana molecole adesive per i leucociti e producendo mediatori (PGI2 e NO) che causano vasodilatazione (v. tabella 4). Da qui in avanti tratteremo delle molecole adesive espresse dall'endotelio e riconosciute da recettori corrispondenti localizzati sui leucociti. In assenza di stimoli l' endotelio vascolare esprime alcune molecole adesive, in particolare lCAM-l e lCAM-2 (Inter Cellular Adhesion Molecule, molecola di adesione intercellulare). Queste molecole, oltre ad assicurare un 'tono adesivo' che consente la fuoriuscita dei leucociti in condizioni fisiologiche, aiutano il reclutamento iniziale durante l'infiammazione.
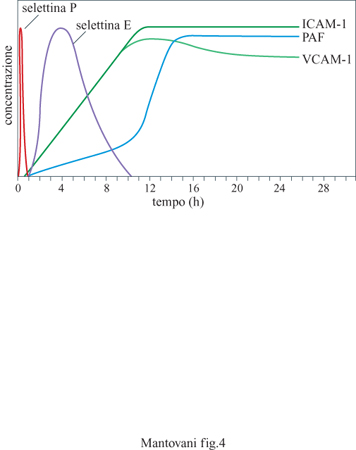
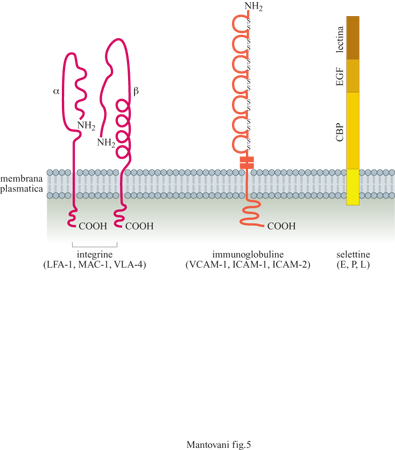
In seguito al contatto con stimoli diversi come lL-l e TNF (vedi oltre) l'endotelio esprime sulla propria membrana molecole adesive per i leucociti polimorfonucleati, i monociti e i linfociti. Alcune di queste molecole compaiono solo dopo diverse ore (sono neo sintetizzate ) e persistono per tempi relativamente lunghi (fino a 24 ÷ 48 ore); altre vengono solo trasportate dall'interno delle cellule sulla membrana pIasmatica e quindi sono presenti sulla superficie endoteliale già pochi minuti dopo la stimolazione, per scomparire poi rapidamente (fig. 4). Questi fenomeni sono legati alla necessità di avere un reclutamento iniziale rapido che possa poi venire stabilizzato da molecole diverse ed essere seguito dalla migrazione dei leucociti negli strati extravascolari. Le molecole a induzione lenta finora caratterizzate sull'endotelio sono: ELAM-l (Endothelial Leukocyte Adhesion Molecule, molecola di adesione endoteliale dei leucociti) o selettina E, lCAM-l e VCAM-l (Vascular Cell Adhesion Molecule, molecola di adesione delle cellule vascolari). Finora sull' endotelio è stata identificata solo una proteina adesiva a espressione rapida. Si tratta della PADGEM (Piatelet Activation Dependent Granule External Membrane protein, proteina della membrana esterna dei granuli dipendente dall'attivazione piastrinica) o selettina P o GMPI40. Strutturalmente le selettine E e P appartengono alla stessa famiglia chiamata delle selettine o LECAM (Leukocyte Endothelium Cell Adhesion Molecules, molecole di adesione tra leucociti e cellule endoteliali); esse hanno cioè omologia di sequenza e di funzione. La selettina E è espressa solo dalle cellule endoteliali, ha una massa molecolare di circa 110 kDa ed è una proteina integrale di membrana (ha cioè una parte che attraversa la membrana, una parte citoplasmatica e una extracellulare); non è espressa in condizioni normali, ma solo dopo attivazione dell'endotelio con stimoli infiammatori, come lL-l e TNF. L'espressione della selettina E raggiunge il picco a 4 ore e declina poi a valori non misurabili entro 8 ÷ 10 ore. Questa molecola è riconosciuta essenzialmente dai polimorfonucleati, dai monociti e dai linfociti T della memoria. In vivo la selettina E si ritrova soprattutto nelle venule postcapillari in condizioni infiammatorie ma anche nelle venule dei linfonodi in diverse condizioni patologiche, come nelle linfoadeniti re attive e nei linfomi. La selettina P è invece sempre presente nell' endotelio ma, in condizioni di non attivazione, è intracellulare, localizzata in corpuscoli detti di Weibel e Palade. Quando l'endotelio è attivato da stimoli come istamina o trombina, un rapido cambiamento della dislocazione intracellulare della selettina P fa sì che essa venga a contatto con il sangue e sia quindi disponibile per le cellule circolanti. Come accennato sopra, questo processo è molto rapido (raggiunge il picco di espressione in 10 ÷15 minuti) e reversibile in circa un'ora. La selettina P è riconosciuta solo dai polimorfonucleati. Tutte le selettine hanno la caratteristica di avere una zona altamente omologa alle lectine, di fondamentale importanza per la loro attività adesiva.
Sono stati identificati i ligandi specifici di selettina E e P. Si tratta di due gruppi glicidici già noti in precedenza (denominati basi di Lewis x e a) in quanto identificati come gruppi sanguigni, legati a proteine o a lipidi. È interessante che, per questi processi adesivi, il riconoscimento di due cellule tra loro si svolga grazie al legame di una proteina con uno zucchero e non, come nella maggioranza dei casi, grazie al legame tra due proteine.
Le altre due proteine indotte lentamente sull' endotelio sono lCAM-l e VCAM-l. Queste due molecole hanno una struttura simile fra loro ma diversa dalla selettina E. Appartengono infatti alla famiglia delle immunoglobuline la quale, oltre agli anticorpi, include anche un grande numero di molecole adesive. lCAM-l e VCAM-l sono espresse, anche se a bassa concentrazione, sulle cellule a riposo ma possono aumentare dopo attivazione dell' endotelio con stimoli infiammatori, come lL-l e TNF. Sono entrambe riconosciute dai monociti e dai linfociti mentre i polimorfonucleati legano solamente lCAM-1. Anche i recettori per queste due molecole sono stati identificati: sono due proteine appartenenti alla famiglia delle integrine. LFA-l (Leukocyte Function Antigen, antigene funzionale dei leucociti) o CDlla/CDl8 è ilrecettore per ICAM-l, mentre CX4β1 VLA-4 (Very Late Antigen, antigene molto tardivo) è il recettore per VCAM-l. ICAM-l può essere legata anche da un'altra integrina, denominata MAC-I (Membrane Attack Complex, complesso di attacco alla membrana) o CDllb/CDl8.
In condizioni di riposo, l'endotelio esprime anche un recettore detto ICAM-2, una molecola simile a ICAM-I con cui condivide il controrecettore LFA-l. Questa proteina non è regolata da stimoli infiammatori. La struttura molecolare dei principali recettori adesivi responsabili dell' interazione tra endotelio e leucociti è schematizzata in figura (fig. 5).
A completare il quadro delle molecole che possono promuovere l'adesione dei polimorfonucleati bisogna considerare anche un fosfolipide, il PAF. In condizioni di riposo questo fosfolipide non è presente sull'endotelio ma stimoli infiammatori, come istamina o citochine, possono indurne l'espressione. Il PAF potrebbe essere definito come un agente chemiotattico in grado di attivare polimorfonucleati e monociti. È interessante notare che, al contrario della maggior parte degli agenti chemiotattici, il PAF resta associato alla membrana plasmatica e solo in minima parte viene liberato in circolo. In questa maniera esso è protetto dall 'inattivazione, può raggiungere concentrazioni locali relativamente alte e ha un raggio di azione limitato.
A molecole adesive endoteliali corrispondono controrecettori specifici sui leucociti. In particolare, tutti i leucociti esprimono LFA-I (controrecettore per ICAM-I e ICAM-2 endoteliali); i monociti e i linfociti esprimono molecole di adesione CX4β1 (controrecettore per VCAM-I); i polimorfonucleati e i monociti esprimono il carboidrato sialil-Lewis x (sLα), che lega la selettina E, e MAC-I, che può legare ICAM-I; i polimorfonucleati esprimono il carboidrato Lα (controrecettore per la selettina P).
Anche qui, al di là della conoscenza delle proteine specifiche, si possono trarre alcune considerazioni generali. Tutti i recettori adesivi dei leucociti sono presenti sulla membrana esterna; tuttavia, per essere in grado di legare, alcuni hanno bisogno che le cellule siano attivate da stimoli chemiotattici specifici (come leucotrieni, PAF, cito chine ). Le integrine LFA-I e MAC-I fanno parte di questo gruppo. È probabile che durante la risposta infiammatoria l'endotelio venga attivato per primo e che i leucociti siano reclutati nella zona in seguito all'adesione a selettina P, ELAM-I e VCAM-I, che essi possono riconoscere anche senza attivazione. Le sostanze chemiotattiche liberate localmente attivano poi le molecole adesive presenti sui leucociti, come LFA-l e MAC-I, e questo porta a una stabilizzazione dell'adesione, all'attivazione e alla migrazione delle cellule negli strati extravasali.
È inoltre importante per l'interazione con l'endotelio la molecola nota come LAM-I (Leukocyte Adhesion Molecule, molecola di adesione per i leucociti) o selettina L. La selettina L, espressa dai fagociti circolanti e sui linfociti, interagisce con strutture glicidiche presenti sull' endotelio. Questa struttura viene poi perduta dai leucociti subito dopo il passaggio nei tessuti.
È interessante osservare che esiste una patologia ereditaria relativamente rara, LAD-I (Leukocyte Adhesion Deficiency, deficit di adesione leucocitaria), caratterizzata dall'assenza dei recettori adesivi (LFA-l, MAC-I) sui leucociti. l pazienti affetti da LAD-I mancano di una normale risposta di difesa alle infezioni batteriche. Il dato sottolinea come i processi adesivi descritti siano essenziali per le normali difese dell'organismo. È stata recentemente identificata una seconda sindrome da deficit di adesione (LAD-2), caratterizzata da un difetto di produzione di sLex.
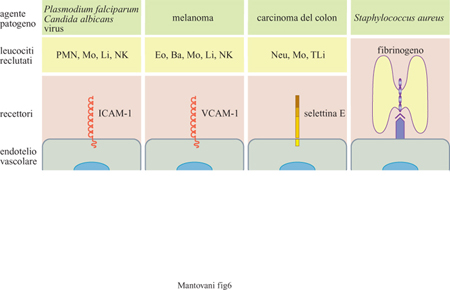
Abbiamo visto come l'endotelio vascolare esprima in modo regolato molecole adesive utilizzate per il reclutamento di 'professionisti della migrazione' come sono i leucociti circolanti. Più recentemente è stato dimostrato che molti patogeni utilizzano gli stessi strumenti molecolari per interagire con l'endotelio e diffondersi (fig. 6). Alcuni virus (rhinovirus), batteri (Klebsiella pneumoniae), funghi (Candida albicans) e protozoi (Plasmodium falciparum infettante le emazie) interagiscono con ICAM-l. Nel caso di Piasmodiumfalciparum, l'interazione con l'endotelio è centrale nella patogenesi della malaria cerebrale, caratterizzata da arresto delle emazie nei vasi cerebrali e da produzione di citochine infiammatorie. Inoltre, cellule tumorali utilizzano le stesse molecole per diffondersi e metastatizzare a distanza. l melanomi sono le uniche cellule non ematopoietiche a esprimere l' integrina VLA-4 che riconosce VCAM-I, mentre i carcinomi del colon esprimono glicidi riconosciuti dalla selettina E (o ELAM-I). Rimangono da definire le molecole endoteliali riconosciute da cellule tumorali di altra origine istologica. Infine, Staphylococcus aureus interagisce con l'endotelio vascolare grazie all'intermediazione del fibrinogeno; questo batterio, infatti, lega il fibrinogeno che a sua volta è riconosciuto da uno specifico recettore endoteliale. L'interazione con l' endotelio è probabilmente importante nella patogenesi di quadri di disseminazione e impianto a distanza di Staphylococcus aureus, come nel caso dell' endocardite settica.
Mediatori secondari: le chemochine
Il termine chemochina (in inglese chemokine, che proviene da chemotactic cytokine, citochina chemiotattica) identifica una superfamiglia di proteine dotate di attività chemiotattica (Oppenheim et al., 1991; Baggiolini et al., 1994). Il nome chemochina, ufficialmente adottato nel corso del terzo convegno internazionale sulle cito chine (Vienna, 1991), sostituisce una serie di nomi alternativi precedentemente utilizzati, quali intercrine, SlS (Small lnducible Secreted cytokines, piccole citochine a secrezione inducibile) e scy (small cytokines, piccole citochine). Le chemochine costituiscono una famiglia di più di venti proteine che condividono alcune caratteristiche strutturali. Sono proteine basiche di dimensioni relativamente piccole (60 ÷ 80 amminoacidi) con massa molecolare compresa tra 8 e 10 kDa e caratterizzate dalla presenza di quattro cisteine che danno origine a due ponti disolfuro tra la prima e la terza e la seconda e la quarta. Questo motivo strutturale determina una struttura tridimensionale cruciale per l'interazione con i recettori. Infatti, la distruzione dei ponti disolfuro causa la perdita dell' attività biologica. La posizione relativa delle prime due cisteine consente di identificare due sotto famiglie di chemochine (tab. 5). Nella prima di esse il tandem cisteinico è interrotto da un terzo amminoacido, diverso da caso a caso, per cui si parla di Cys-X-Cys (o C-X-C) o di chemochine Ci. La seconda famiglia è invece caratterizzata da una coppia di residui cisteinici contigui e viene identificata con il nome di Cys-Cys (o C-C) o chemochine β. l geni delle chemochine α sono localizzati sul cromosoma 2 dell'uomo, mentre le chemochine β sono localizzate sul cromosoma 17, con l'unica eccezione di RANTES (Regulated on Activation, Normal T Cell Expressed and Secreted, regolata durante l'attivazione, espressa e se creta dalle cellule T normali), localizzata sul cromosoma 4. Le chemochine α mostrano un livello di omologia amminoacidica del 25 ÷ 50%; per le chemochine β l'omologia è del 30 ÷70%, e l'omologia tra i membri delle due famiglie non supera il 40%. Recentemente è stata identificata una proteina dotata di attività chemiotattica che mostra una discreta omologia con le chemochine β (30%) ma che possiede caratteristiche peculiari, quali la presenza di due soli residui cisteinici (rispettivamente il primo e il terzo) e la localizzazione sul cromosoma 1. Questa proteina, chiamata linfotactina, sembra rappresentare una terza famiglia di chemochine: le Cys (C) o chemochine γ (vedi tabella 5).
Cellule produttrici e cellule bersaglio
Le chemochine α attualmente comprendono quattordici proteine, di cui le meglio caratterizzate sono IL-8, Gro (di cui esistono tre forme: α, β e y), lP-lO, NAP-2 (Neutrophil Activating Protein, proteina di attivazione dei neutro fili) e ENA-78. Le chemochine β sono costituite da almeno dodici proteine tra cui MCP-l (Monocyte Chemotactic Protein, proteina chemiotattica dei monociti), MCP-2, MCP-3, LD78/lP-lα, MlP-lβ (Macrophage Inflammatory Protein, proteina infiammatoria dei macrofagi), RANTES ed Eotaxin. Come si può notare, la nomenclatura è ancora piuttosto confusa e ciò è in parte dovuto al fatto che spesso più laboratori hanno identificato lo stesso fattore utilizzando approcci diversi e coniando spesso nomi fantasiosi. Come mostrato nella tabella 5, le chemochine α sono spesso attive su neutro fili e linfociti T ma inattive su monociti. Le chemochine β mostrano invece un ampio spettro di attività pur essendo inattive su neutro fili. l dati disponibili per la linfotactina sono ancora limitati. lL-8 è il membro più studiato della famiglia delle chemochine α. Questa citochina fu identificata inizialmente come fattore chemiotattico per neutro fili prodotto da monociti del sangue periferico stimolati con lipopolisaccaride e venne originariamente denominata NAP-1. È chiaro che lL-8 viene prodotta da diversi tipi cellulari, quali fibroblasti, cellule epiteliali, cellule nervose, da alcuni tipi di cellule trasformate e da cellule con funzione di barriera, quali cellule endoteliali, cellule mesoteliali e cellule muscolari lisce. lL-8 è prodotta come un precursore di 99 amminoacidi di cui 20 costituiscono il peptide segnale. La forma matura può venire ulteriormente processata per opera di proteasi all'estremità amminoterminale, dando origine a proteine di diverse dimensioni (69 ÷ 79 amminoacidi). La forma a 77 amminoacidi è prodotta prevalentemente da fibroblasti ed endotelio, mentre i monociti producono essenzialmente una proteina composta di 72 amminoacidi. In vitro, la forma a 72 amminoacidi è biologicamente più attiva di quella a 77. L'azione delle proteasi è cruciale anche per la produzione di NAP-2. Questa proteina viene prodotta in seguito a secrezione e digestione proteolitica di un precursore, PBP (Piatelet Basic Protein, proteina base delle piastrine) presente nei granuli α delle piastrine.
Le chemochine α sono dotate essenzialmente di azione chemiotattica sia in vitro sia in vivo. Recenti studi in vitro hanno mostrato che lL-8 è in grado di legarsi sulla superficie dell' endotelio di venule postcapillari e di legare glicosamminoglicani. Il legame a queste molecole limita la diffusibilità di lL-8 e contemporaneamente ne aumenta le capacità funzionali, come per esempio l'attivazione dei neutrofili. lL-8 immobilizzata a questi substrati mostra una aumentata capacità di attivazione dei neutro fili. In presenza di agenti primari, quali TNF-α o IL-l, le chemochine α sono anche in grado di indurre l'attivazione di altre risposte biologiche, quali la degranulazione e la produzione di intermedi re attivi dell' ossigeno. Queste funzioni svolgono un ruolo rilevante nello sviluppo della risposta infiammatoria.
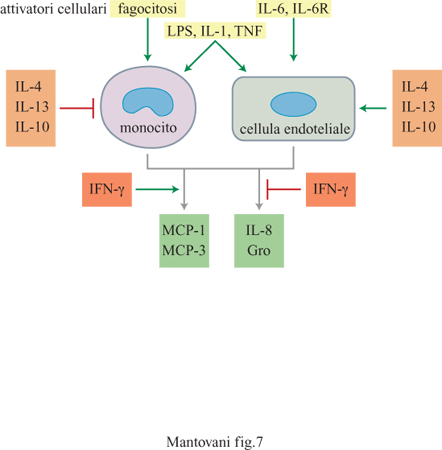
MCP-l è la citochina più studiata fra quelle appartenenti alla famiglia delle chemochine β. Essa è costituita da 76 amminoacidi, è glicosilata e viene prodotta da diversi tipi cellulari, in particolare dalle cellule endoteliali, dai fibroblasti e dai monociti in seguito ad attivazione cellulare (fig. 7). Diversi tipi di cellule trasformate, quali sarcomi, gliomi e carcinomi, producono MCP-l costitutivamente (Mantovani et al., 1992). MCP-l costituisce uno stimolo chemiotattico per monociti, linfociti T, cellule NK, baso fili e cellule dendritiche. Nei basofili funziona anche come secretagogo inducendo il rilascio di istamina. Questo effetto viene aumentato dal pretrattamento delle cellule con lL-3, lL-5 o GM-CSF (Granulocyte MacrophageColony Stimulating Factor, fattore che stimola la formazione di colonie di granulo citi macrofagi). MCP-l è invece inattiva su eosinofili e rappresenta l'unico stimolo finora noto in grado di discriminare tra queste due popolazioni leucocitarie. MCP-3 ed Eotaxin sono potenti stimoli per gli eosinofili. Queste proteine rappresentano quindi importanti candidati per la regolazione delle reazioni allergiche. MCP-l, MCP-2, MCP-3, RANTES, MlP-lα e MlP-lβ sono anche chemiotattici per linfociti T, anche se presentano alcune differenze. RANTES è attiva sia su cellule a riposo sia su cellule attivate, mentre le altre chemochine sono attive prevalentemente su cellule preattivate. RANTES e MCPl prediligono linfociti T della memoria (CD45RO+), mentre MlP-l α e MlP-l β sono preferenzialmente attive rispettivamente sui linfociti T CDS+ e CD4+. MCP-3 e altre chemochine β sono attive sulle cellule dendritiche (Sozzani et al., 1994; 1995).
Attività non legate alla chemiotassi
Se le chemochine hanno come attività principale quella di indurre la migrazione direzionale dei leucociti, esperimenti recenti suggeriscono che alcune di queste molecole possano fungere da regolatrici della crescita cellulare. Così, Gro e lL-8 sono stimolatrici della crescita in vitro di alcuni melanomi. MIP-lα ha un'attività del tutto peculiare, in quanto inibisce selettivamente e reversibilmente la capacità proliferativa di precursori ematopoietici molto immaturi. Sulla base di tale unica proprietà, questa chemochina β viene attualmente studiata in vista di un suo possibile impiego nella protezione dei precursori midollari dalla tossicità collegata alla chemioterapia.
Recettori per le chemochine
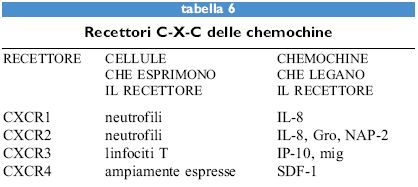
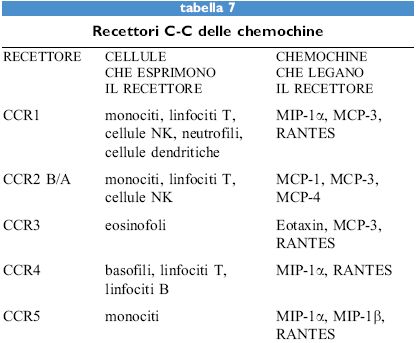
Le chemochine, sia α sia β, agiscono attraverso recettori di membrana che appartengono alla famiglia dei recettori di tipo rodopsinico, caratterizzati da sette domini transmembrana (tabb. 6, 7). Questi recettori sono associati a proteine G eterotrimeriche la cui attivazione causa l'aumento della concentrazione di calcio intracellulare e del metabolismo dei fosfolipidi di membrana a opera di fosfolipasi C, D e A2. Attualmente sono noti cinque recettori per le chemochine α (da CCRI a CCR5) e quattro per quelle β (da CXCRI a CXCR4). Fra i recettori per le chemochine α, il primo a essere donato è stato c-c Receptor, CCRl, un recettore promiscuo per MIP-lα, RANTES e MCP-3. CCR2 esiste in due forme A e B, ottenute tramite splicing alternativo, e lega sia MCP-l sia MCP-3. Più recentemente CCR3 è stato donato come un recettore promiscuo per RANTES, MCP-3 ed Eotaxin. l recettori per le chemochine sembrano quindi obbedire a una doppia regola: un singolo recettore generalmente lega più di una chemochina e la stessa chemochina può legare più di un recettore.
Chemochine e virus
Di particolare interesse è la scoperta che alcuni virus sono in grado di codificare proteine che presentano un elevato livello di omologia rispetto ai recettori delle chemochine. Finora sono state identificate due proteine virali omologhe a recettori per chemochine. US28 è una proteina codificata dal citomegalovirus che mostra all'estremità amminoterminaIe extracellulare il 60% di omologia con CCRI. ECRF3 è invece codificata dal virus Herpes saimiri e ha un elevato livello di omologia (44% all'estremità amminoterminale) con il recettore di lL-8, CXCR2. Entrambe le proteine sono in grado di legare le rispettive chemochine e di trasdurre un segnale. Non è tuttavia ancora chiaro come, nel corso dell'evoluzione, i virus abbiano trovato vantaggioso appropriarsi dei due geni che codificano queste proteine. lnfine, sulla superficie dei globuli rossi esiste una proteina transmembrana in grado di legare chemochine sia della famiglia α (IL-8, Gro e platelet factor 4) sia β (MCP-l e RANTES). Questa proteina corrisponde all'antigene Duffy che costituisce il recettore attraverso il quale Plasmodium vivax invade l'eritrocita. Questo recettore lega una sequenza di lL-8 diversa da quella riconosciuta dai recettori CXCRI e 2. È quindi possibile ipotizzare l'impiego di mutanti di lL-8 come agenti farmacologici antimalarici.
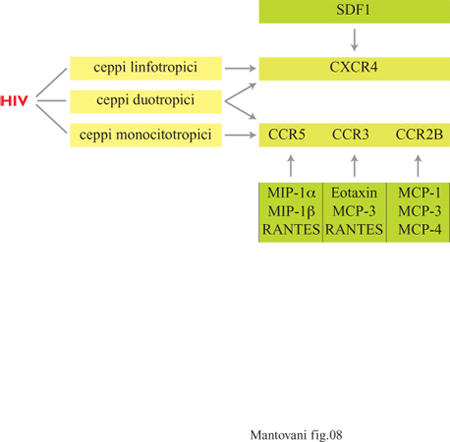
Di recente è emerso che i recettori per le chemochine costituiscono i fattori essenziali per la fusione di HIV (Human lmmunodeficiency Virus, virus dell'immunodeficienza umana) con le cellule bersaglio (fig. 8). In particolare CCR5 è coinvolto nell'infezione da parte dei ceppi monocitotropici mentre CXCR4, detto anche fusina, è usato dai ceppi linfocitotropici. Le chemochine come RANTES che 'occupano' questi recettori bloccano in vitro l'infezione da HIV; in vivo si osserva che soggetti omozigoti per un allele di CCR5, che dà luogo a non espressione della proteina sulla membrana cellulare, sono resistenti alI'HIV (Moore e Koup, 1996).
Chemochine e tumori
Esistono diverse indicazioni sperimentali che suggeriscono un ruolo cruciale delle chemochine nella formazione dell'infiltrato leucocitario intratumorale (Mantovani et al., 1992). Studi iniziali, condotti da A. Mantovani e collaboratori, avevano evidenziato che la quantità di macrofagi infiltranti il tumore è correlata direttamente alla capacità delle cellule tumorali di rilasciare in vitro attività chemiotattica per i monociti. Più recentemente, esperimenti di trasferimento genico hanno dimostrato in modo diretto il ruolo delle chemochine nel reclutamento leucocitario a livello della massa tumorale. Molte linee tumorali umane e murine producono in vitro svariate chemochine e in alcuni casi esse hanno costituito la fonte da cui inizialmente queste molecole sono state purificate. Melanomi umani e sarcomi di Kaposi, caratterizzati da un rilevante infiltrato di cellule fagocitiche, producono MCP-l e lL-8 in vitro. In alcuni casi, come nel sarcoma di Kaposi e nel carcinoma ovarico, la produzione di MCP-l da parte delle cellule tumorali è stata evidenziata attraverso ibridazione in situ e immunoistochimica di lesioni tumorali. Elevati livelli di MCP-l e lL-8 sono stati trovati nell'ascite di pazienti con carcinoma ovarico e nell'essudato pleurico associato al carcinoma polmonare. Complessivamente queste osservazioni indicano che le chemochine rappresentano effettivamente molecole di grande importanza nel processo di reclutamento leucocitario intratumorale. Come già menzionato, le cellule tumorali sono forti produttrici di chemochine. Nella maggior parte dei casi, non è stata osservata alcuna attività di queste proteine sulla crescita cellulare in vitro; in alcune situazioni è stato però dimostrato un ruolo di fattore di crescita. È questo il caso di groa/MGSA, una chemochina della famiglia C-X-C inizialmente identificata e purificata come fattore di crescita autocrino prodotto da una linea di melanoma umano e per questo motivo designata MGSA (Melanoma Growth Stimulatory Activity, fattore ad attività stimolatrice della crescita del melanoma). In analogia con queste osservazioni, alcune linee cellulari di melanoma umano si sono dimostrate dipendenti, per la crescita, da IL-8 prodotta in modo autocrino. In alcuni casi anche l'azione mitogenica svolta da IL-8 su alcune linee tumorali umane si è rivelata mediata dall'induzione di groa/MGSA. Infine, IL-8 e altri membri della famiglia C-X-C contenenti il motivo ELR (acido glutammico, leucina, arginina) all'estremità amminoterminale sono chemiotattici per cellule endoteliali e dotati di azione angiogenetica.
Per studiare l'effetto di chemochine sulla crescita tumorale, cellule di melanoma transfettate con il gene MCP-l sono state inoculate in vivo. I tumori ottenuti mostravano un rilevante infiltrato macrofagico e mantenevano un fenotipo tumorigenico, ma esprimevano un indice di crescita inferiore rispetto ai controlli. L'effetto era evidente anche in topi atimici ed era verosimilmente in relazione all'infiltrato macrofagico. Studi analoghi condotti con cellule CRO (Chinese Hamster Ovary, ovario di criceto cinese) inoculate in topi allogenici hanno evidenziato una inibizione della crescita tumorale in condizioni di sovrapproduzione di MCP-l (C-C) o di IL-8 e MIP-lα (C-X-C). In tutti questi casi, le chemochine non erano in grado di influenzare la crescita cellulare in vitro.
Il reclutamento monocitario a livello tumorale coesiste con uno stato di immunosoppressione e con una ridotta capacità di generare una risposta infiammatoria a livello sistemico. È possibile che l'aumentata produzione locale di chemochine contribuisca all'instaurarsi di una inibizione sistemica della funzione macrofagica. MCP-l è infatti in grado di inibire la generazione di monossido di azoto da parte di cellule macrofagiche J774. Inoltre, diversi fattori chemiotattici, incluse le chemo chine , inducono il rilascio rapido del recettore di tipo II di IL-l (Colotta et al., 1995) e del recettore p75 del TNF. Questa duplice azione potrebbe contribuire al mantenimento della risposta infiammatoria a livello locale e ridurre l'azione sistemica delle cito chine proinfiammatorie.
Conclusioni
La fuoriuscita dei leucociti dal torrente ematico verso i tessuti costituisce un momento centrale dei processi infiammatori e immunitari in una varietà di condizioni fisiologiche e patologiche. L'identificazione delle chemochine e del loro spettro d'azione ha fornito un nuovo e più approfondito livello di comprensione delle basi molecolari del reclutamento leucocitario e della sua selettività. Si intravedono infatti gli elementi (citochine chemiotattiche, molecole adesive) che, sommati, consentono di reclutare, selettivamente e con cinetiche diverse, l'una o l'altra popolazione leucocitaria nel sito desiderato. Benché in questo campo gli studi di patologia animale e umana siano ancora in fase iniziale, i dati disponibili concordano con l'ipotesi che queste cito chine siano coinvolte nella patogenesi di numerose condizioni morbose che vanno dall'aterosclerosi alle infiammazioni acute e croniche, alle malattie allergiche. Vari gruppi di studio sono attivamente interessati a questa superfamiglia emergente di cito chine infiammatorie, alla ricerca di antagonisti o per sfruttame alcune proprietà agoniste.
Bibliografia citata
BAGGIOLINI, M., DEWALD, B., MOSER, B. (1994) Interleukin-8 and related chemotactic cytokines-CXC and CC chemokines. Adv. Immunol., 55, 97-179.
BUTCHER, E.C., PICKER, L.J. (1996) Lymphocyte homing and homeostasis. Science, 272, 60-66.
CARLOS, T.M., HARLAN, I.M. (1994) Leukocyte-endothelial adhesion molecules. Blood, 84, 2068-2101.
COLOTTA, F., DOWER, S.K., SIMS, J.E., MANTOVANI, A. (1994) The type II 'decoy' receptor: novel regulatory pathway for interleukin-1. Immunol. Today, 15, 562-566.
COLOTTA, F., ORLANDO, S., FADLON, E.I., SOZZANI, S., MATTEUCCI, c., MANTOVANI, A. (1995) Chemoattractans induce rapid release of the interleukin 1 type II decoy receptor in human polymorphonuclear cells. J Exp. Med., 181, 2181-2186.
COLOTTA, F., RE, F., MUZIO, M., BERTINI, R., POLENTARUTTI, N., SIRONI, M., GIRI, lG., DOWER, S.K., SIMS, I.E., MANTOVANI, A. (1993) Interleukin-I type II receptor: a decoy target for IL-I that is regulated by IL-4. Science, 261, 472-475.
DINARELLO, C.A. (1996) Biological basis for IL-I in disease. Blood, 87, 2095-2147.
MANTOVANI, A., BOTTAZZI, B., COLOTTA, F., SOZZANI, S., Ruco, L. (1992a) The origin and function oftumor-associated macrophages. lmmunol. Today, 13, 265-270.
MANTOVANI, A, BUSSOLINO, F., DEJANA, E. (1992b) Cytokine regulation of endothelial cell function. FASEB J., 6, 2591-2599.
MANTOVANI, A., BUSSOLINO, F., INTRONA, M. (1997) Cytokine regulation of endothelial cell function: from molecular level to the bed side. lmmunol. Today, 18, 231-240.
MOORE, lP., Koup, R.A (1996) Chemoattractans attract HIV researchers. J Exp. Med., 184,311-313. MUZIO, M., POLENTARUTTI, N., SIRONI, M., POLI, G., DE GIOIA, L., INTRONA, M., MANTOVANI, A., COLOTTA, F. (1995) Cloning and characterization of a new isoform of the interleukin-I receptor antagonist. J. Exp. Med., 182, 623-628.
OPPENHEIM, J.J., ZACHARIAE, C.O., MUKAIDA, N., MATSUSHIMA, K. (1991) Properties of the novel proinflammatory supergene 'intercrine' cytokine family. Annu. Rev. lmmunol., 9, 617-648.
RE, F., MUZIO, M., DE ROSSI, M., POLENTARUTTI, N., GIRI, J.G., MANTOVANI, A, COLOTTA, F. (1994) The type II 'receptor' as a decoy target for IL-I in polymorphonuclear leukocytes: characterization on of induction by dexamethasone and ligand binding properties of the released decoy receptor. J. Exp. Med., 179, 739-743.
RE, F. et al. (1996) Inhibition of interleukin-I responsiveness by type II receptor gene transfer: a surface 'receptor' with antiinterleukin-I function. J. Exp. Med., 183, 1841-1850.
SOZZANI, S., SALLUSTO, F., LUINI, W., ZHOU, D., PIEMONTI, L., ALLAVENA, P., VAN DAMME, J., VALITUTTI, S., LANZAVECCHIA, A, MANTOVANI, A. (1995) Migration of dendritic cells in response to formyl peptides, C5a and a distinct set of chemokines. J. lmmunol., 155, 3292-3295.
SOZZANI, S., ZHOU, D., LOCATI, M., RIEPPI, M., PROOST, P., MAGAZIN, M., VITA, N., VAN DAMME, J., MANTOVANI, A. (1994) Receptors and transduction pathways for monocyte chemotactic protein-2 and monocyte chemotactic protein-3: similarities and differences with MCP-l. J. lmmunol., 152, 3615-3622.
SPRINGER, T.A (1994) Traffic signal for Iymphocyte recirculation and leucocyte emigration: the multistep paradigm. CelI, 76, 301-314.