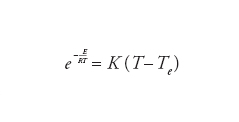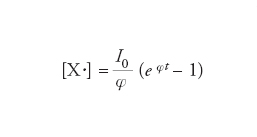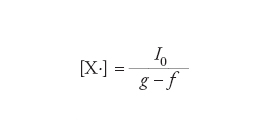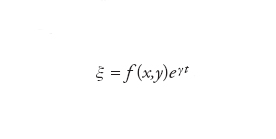Combustione
Combustione
I processi di combustione hanno costituito, sin dalla Preistoria, la più importante sorgente di energia per l'umanità e tuttora rivestono un ruolo centrale nella nostra economia poiché forniscono quasi il 90% dell'energia che utilizziamo. Le principali fonti energetiche, infatti, sono: (a) il gas naturale, contenente prevalentemente metano; (b) i prodotti petroliferi costituiti da miscele di idrocarburi; (c) il carbone. Combinandosi con l'ossigeno, formano anidride carbonica (CO2) e acqua (H2O) attraverso una serie di reazioni chimiche che avvengono in diversi stadi e coinvolgono molte specie intermedie. Tali reazioni sono caratterizzate da elevata esotermicità, ossia esse avvengono con rilascio nell'ambiente di una notevole quantità di calore, essendo i prodotti di combustione molecole molto stabili, con un contenuto energetico molto più basso delle specie reagenti. Le reazioni globali, attraverso le quali dai combustibili menzionati si formano i prodotti di combustione, si scrivono come segue:
per il metano
CH4 + 2 O2 → 2 H2O + CO2
per un generico idrocarburo
[2] CnHm + (n + m/4)O2 →
nCO2 + (m/2)H2O
per il carbone
[3] C + O2 → CO2.
Accanto alle precedenti si deve aggiungere la combinazione dell'ossigeno con l'idrogeno, per formare acqua.
Lo studio dei processi di combustione è divenuto sempre più centrale nella ricerca di base e nella tecnologia, sia per il suo intrinseco interesse scientifico sia per le sue ampie ricadute applicative. Infatti, le moderne economie industriali sono basate sul carbonio e la loro attività principale è la combustione di materiali di diversa natura. Oltre che nel settore energetico, i processi di combustione vengono utilizzati in diverse tecnologie industriali che riguardano la trasformazione di alcuni composti chimici organici e la sintesi di materiali solidi, condotte entrambe a temperatura elevata. Un'ulteriore fonte di interesse riguarda la tutela dell'ambiente atmosferico attraverso il controllo delle sostanze inquinanti, quali gli ossidi d'azoto e le particelle ultrafini di nerofumo, che costituiscono alcuni sottoprodotti della combustione stessa.
La peculiarità dei processi di combustione deriva dall'interazione di fenomeni fisici e chimici che danno origine a situazioni particolari e diversificate. Se una miscela gassosa, per esempio di metano e di ossigeno, viene riscaldata sino a una particolare temperatura, detta temperatura di ignizione, s'innesca una reazione esotermica molto veloce con conseguenti brusche variazioni, nel tempo e nello spazio, della temperatura e delle concentrazioni dei reagenti.
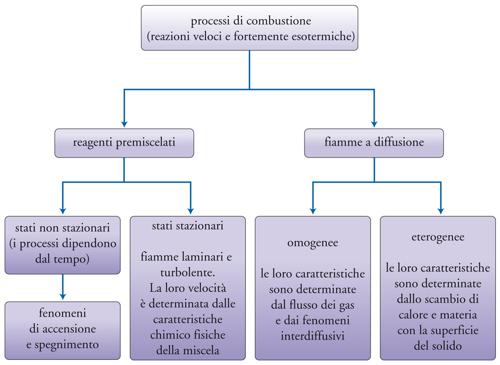
Nei fluidi in moto si possono distinguere due tipi di fiamme: premiscelate e a diffusione. Nelle prime la miscela gassosa di ossigeno (o di aria) e di combustibile fluisce in un condotto tubolare. L'evento reattivo che dà luogo alla fiamma si manifesta in un sottile spessore che identifica il fronte di reazione che procede nella direzione opposta a quella del fluido. La temperatura subisce un'impennata, mentre ha luogo anche una brusca diminuzione della concentrazione dei reagenti che si trasformano nei prodotti di reazione. Nelle fiamme a diffusione i due reagenti convergono verso la zona in cui avviene la reazione e la cinetica è regolata soprattutto dal trasporto dei reagenti.
Ulteriori distinzioni possono poi essere operate in base al tipo di moto dei fluidi coinvolti e allo stato fisico in cui si presenta il combustibile.
Tipologia dei processi di combustione
Sia nelle fiamme a diffusione, sia in quelle premiscelate occorre distinguere le situazioni corrispondenti al fatto che il moto delle correnti sia, rispettivamente, di tipo laminare oppure di tipo turbolento: nel primo caso i processi di mescolamento avvengono solo su scala molecolare, mentre nel secondo anche grazie all'azione dei vortici turbolenti.
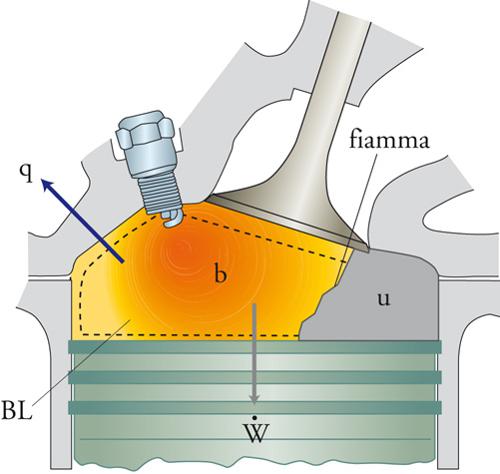
Per esempio, nel carburatore di un motore a combustione interna una miscela di benzina e di aria viene compressa sino a raggiungere la temperatura di ignizione, in corrispondenza della quale si innesca un fronte di combustione che si propaga nella camera stessa (fig. 2). Viceversa, in una candela il calore liberato dalla fiamma vaporizza la cera di cui è costituita, che viene così a contatto con l'aria nella zona prossima allo stoppino, dove ha luogo il processo di combustione, con le caratteristiche tipiche di una fiamma a diffusione.
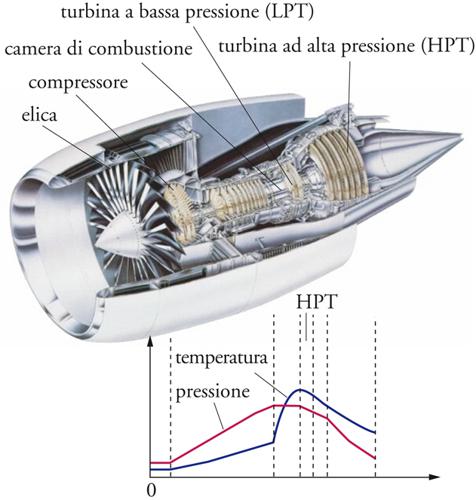
Altri esempi di fiamme a diffusione sono presenti negli ugelli dei bruciatori o nei motori a reazione degli aerei, di cui viene illustrata una tipica struttura nella fig. 3. Nei processi di combustione eterogenea si utilizzano come combustibili le particelle di un solido, per esempio il carbone, oppure le goccioline di idrocarburi liquidi. Nel primo caso la reazione avviene per l'interazione delle molecole di ossigeno con gli atomi di carbonio che costituiscono il materiale solido, e i processi diffusivi che hanno luogo nel film gassoso adiacente alla superficie del solido influenzano in modo significativo la cinetica del processo stesso di combustione.
Ancora più complessa è la combustione delle gocce di un liquido, poiché il riscaldamento dovuto alla reazione provoca la parziale evaporazione dei componenti liquidi volatili che diffondono nella fase gassosa, reagendo con l'ossigeno.
In conclusione, i processi di combustione presentano una molteplicità di situazioni che includono anche le caratteristiche fluidodinamiche del sistema e il fatto che il processo abbia luogo in condizioni stazionarie o transitorie (fig. 4).
Aspetti chimici e cinetici della combustione degli idrocarburi
La velocità ri di una reazione di combustione, ossia il numero di moli del combustibile trasformate per unità di tempo e di volume, dipende dalla temperatura e dalla composizione del sistema; nella sua forma più semplice si può esprimere come segue:
[4] r = k(T)[combustibile]a[ossigeno]b .
Le parentesi quadre indicano le concentrazioni molari dei componenti corrispondenti, mentre k(T) è la costante di velocità di reazione, che dipende dalla temperatura sulla base della relazione di Arrhenius k(T)=Aexp(−E/RT), dove E è l'energia di attivazione e R è la costante dei gas; a e b sono due parametri empirici chiamati ordini di reazione. L'equazione [4] esprime la velocità del processo di combustione nella sua globalità, ossia senza tenere conto del fatto che, in realtà, la trasformazione avviene attraverso diversi stadi che coinvolgono molte specie intermedie, per lo più costituite da frammenti molecolari. Questo approccio aggregato, o lumped, se pure approssimato, fornisce tuttavia un efficace punto di partenza per esaminare alcuni aspetti tipici dei processi di combustione.
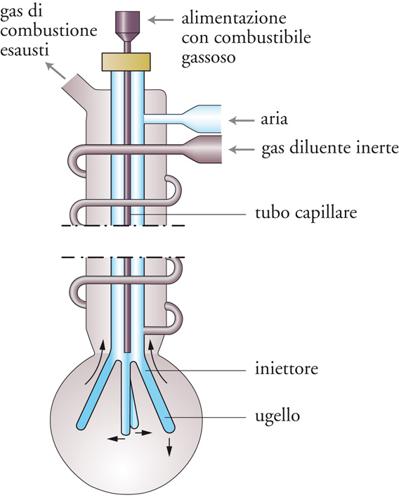
Facendo uso di sofisticate tecniche diagnostiche, sono state ottenute interessanti informazioni sui dettagli delle reazioni di combustione degli idrocarburi. Oltre alle tradizionali tecniche analitiche, quali la cromatografia e la spettrometria di massa, vengono impiegate anche quelle basate su dispositivi a laser. Per esempio, mediante il procedimento denominato LIF (Laser induced fluorescence) le specie molecolari vengono individuate attraverso la loro eccitazione mediante un raggio laser e la successiva analisi della radiazione emessa per fluorescenza. In questo modo si riesce a individuare la presenza di specie transitorie, anche se presenti in concentrazioni molto piccole (10−9÷10−10 molecole/cm3) a causa della loro vita media molto breve. Inoltre sono state messe a punto metodologie sperimentali accurate per determinare la velocità delle reazioni di combustione rapide. A titolo di esempio, nella fig. 5 viene illustrata la configurazione di una di tali apparecchiature, contrassegnata dall'acronimo JSTR (Jet stirred tank reactor), impiegata per lo studio delle cinetiche delle reazioni di combustione.
Infine, è importante menzionare che anche l'impiego delle metodologie della chimica computazionale, grazie allo sviluppo dei supercalcolatori, permette di valutare con ragionevole accuratezza la costante di velocità di reazione dei processi elementari che intervengono nei processi di combustione.
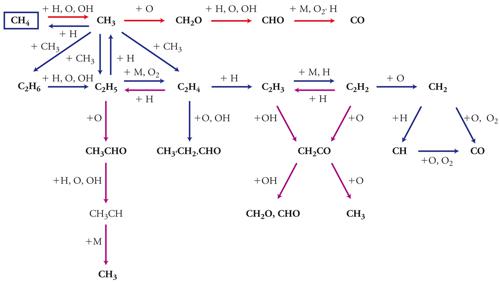
Uno dei casi più profondamente indagato riguarda l'ossidazione del metano a elevata temperatura, che ha portato allo schema generale illustrato nella fig. 6. In esso vengono indicate le più importanti reazioni che coinvolgono i composti in cui sono presenti uno o più atomi di carbonio. Si può osservare che la molecola del metano viene attaccata dalle specie radicaliche H∙, O∙, OH∙, che sono molto reattive perché presentano un elettrone spaiato, generalmente viene indicato mediante un punto. Si formano radicali CH3∙ che reagiscono con gli atomi di ossigeno per dare formaldeide. Per rimozione di un atomo di idrogeno si ottiene il radicale formico che per decomposizione termica forma ossido di carbonio (CO) e idrogeno atomico. Inoltre due gruppi CH3∙ possono combinarsi fra loro per formare l'etano, che successivamente può essere attaccato da H∙, OH∙, O∙ per formare il radicale etile il quale, a sua volta, viene ossidato. Anche gli idrocarburi con un peso molecolare superiore a quello del metano e dell'etano vengono attaccati da tali radicali formando alcune specie instabili soggette a una rapida demolizione con formazione di frammenti molecolari di minori dimensioni. Pertanto il problema dell'ossidazione degli idrocarburi superiori viene ricondotto a quello degli spezzoni di piccole dimensioni, quali il radicale etilico e quello metilico, le cui caratteristiche sono note dalle indagini condotte sull'ossidazione del metano.
È interessante osservare che, nella complessa sequenza delle reazioni elementari coinvolte in tali processi, quelle che giocano un ruolo cinetico importante sono:
[5] H∙ + O2 → OH∙ + O∙
[6] CO + OH∙ → CO2 + H∙
che curiosamente sono indipendenti dalla natura del combustibile impiegato.
Poiché le reazioni di combustione vengono solitamente condotte con l'aria ‒ e quindi in presenza di azoto ‒ si formano anche alcuni composti azotati, in particolare gli ossidi di azoto (NOx). Se si opera ad alta temperatura e per elevati tempi di contatto, la formazione del monossido d'azoto NO può aver luogo attraverso il meccanismo di reazione detto di Zeldovič:
[7] O∙ + N2 → NO + N∙
[8] N∙ + O2 → NO + O∙
il cui interesse è dovuto al fatto che gli ossidi d'azoto costituiscono alcuni fra i principali agenti inquinanti dell'atmosfera.
Punto e temperatura di ignizione
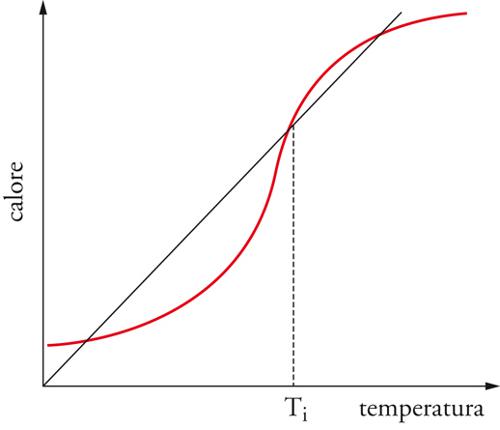
L'esistenza di un punto di ignizione trae origine dall'andamento esponenziale dell'equazione di Arrhenius che esprime la dipendenza dalla temperatura della velocità di reazione. Il metodo per determinare la temperatura di ignizione è stato proposto originariamente dal premio Nobel russo Nikolai Nikolaevič Semenov. Esso è basato sul presupposto che la miscela si mantenga ben rimescolata e che la velocità con la quale viene scambiato il calore fra la zona in cui ha luogo la combustione e l'ambiente esterno sia proporzionale alla differenza (T−Te) fra le loro temperature. A sua volta, il calore liberato per unità di tempo è proporzionale alla velocità di reazione e dipende dalla temperatura in modo esponenziale in accordo all'equazione di Arrhenius. Il bilancio energetico, formulato eguagliando il calore liberato per unità di tempo (che è proporzionale alla velocità di reazione) a quello disperso, conduce alla relazione:
[9] formula
dove K è un coefficiente numerico che congloba diversi parametri fisici e il cui valore riflette l'efficienza con la quale il calore viene disperso. La precedente equazione può essere risolta per via grafica, come è illustrato nella fig. 7, individuando le intersezioni fra la curva (in rosso) che descrive l'espressione al primo membro e la retta (in nero) corrispondente al secondo membro, la cui inclinazione è proporzionale a K. Se esso è elevato, il calore disperso per unità di tempo è superiore a quello liberato e pertanto esiste un solo punto di intersezione a bassa temperatura, privo di interesse perché il sistema è spento. Diminuendo l'inclinazione la retta diviene tangente alla curva del calore liberato e alla temperatura corrispondente al punto di tangenza ha luogo l'ignizione. Diminuendo ulteriormente l'inclinazione, e quindi la velocità di dispersione del calore, si riscontrano tre punti di intersezione: quello ad alta o a bassa temperatura indica lo stato stazionario stabile della fiamma, mentre quello intermedio rappresenta uno stato instabile che, per effetto di una fluttuazione termica, si sposta in modo autonomo verso uno dei due stati stabili.
Le specie radicaliche che si formano nei processi di combustione per interazione con altre molecole possono generare frammenti molecolari, in uno stadio d'iniziazione che dà origine a una reazione a catena. Nelle reazioni di propagazione il numero di radicali si mantiene inalterato; ciò avviene, per esempio, nella reazione fra il radicale OH∙ e il metano per dare acqua e il radicale metilico:
[10] OH∙ + CH4 → H2O + CH3.
La propagazione è ramificata quando il numero dei radicali prodotti è superiore a quello dei radicali che partecipano alla reazione. Un esempio è offerto dalla reazione:
[11] H∙ + O2 → OH∙ + O∙.
Se le reazioni di ramificazione non vengono controllate dalle reazioni di terminazione ha luogo un aumento catastrofico del numero dei radicali che si generano nel sistema. In un sistema chiuso agli scambi di materia, la variazione nel tempo della concentrazione dei radicali, che verrà indicata genericamente con [X∙], risulta espressa dalla seguente equazione:
[12] formula
dove I0 indica la velocità di produzione dei radicali nella reazione d'iniziazione, mentre φ=f−g, in cui f e g indicano rispettivamente due funzioni della temperatura e della pressione i cui valori riflettono l'efficacia degli stadi di ramificazione e terminazione. Se f〈g, la concentrazione dei radicali tende asintoticamente alla soluzione stazionaria:
[13] formula.
Nel caso contrario, invece, essa aumenta esponenzialmente, e il sistema è soggetto a una catastrofica evoluzione esplosiva, poiché la produzione dei radicali attraverso il processo di ramificazione prevale sulla loro distruzione per terminazione.
Ruolo della turbolenza
La turbolenza è caratterizzata da un moto irregolare casuale delle particelle di un fluido che si sovrappone a quello medio della corrente gassosa. La transizione dal moto laminare a quello turbolento avviene bruscamente quando il gruppo adimensionale detto numero di Reynolds, R=ul ϱ/μ (dove l è una dimensione tipica del sistema), supera un valore critico, che per un fluido che scorre in una tubazione vuota è dell'ordine di 2300. Anche se molti aspetti fenomenologici della turbolenza sono noti, non esiste ancora una teoria generale del tutto soddisfacente, per cui la descrizione dei corrispondenti processi di trasporto viene effettuata fruendo di opportuni modelli. Solitamente il campo di velocità turbolenta viene scisso in due componenti: una più lenta che agisce su larga scala e una più rapida, fluttuante, che agisce su piccola scala. Per effetto di quest'ultima sul campo di moto lento si manifesta una viscosità detta turbolenta, con un meccanismo simile a quello esercitato dalle collisioni molecolari nei moti laminari. Purtroppo, non esiste un chiaro criterio di separazione tra le scale in questione. Per sopperire a questa difficoltà Ludwig Prandtl ha introdotto il concetto di percorso di mescolamento, analogo al cammino libero medio delle molecole, in base al quale si assume che i vortici percorrano una lunghezza tipica prima di integrarsi con il fluido circostante, scambiando quindi con esso le loro specifiche proprietà.
In un approccio più moderno, giustificato dall'ipotesi che esista un'invarianza di scala dei vortici turbolenti, il moto del fluido viene descritto con le consuete equazioni di conservazione facendo però uso di parametri di trasporto che riflettono le caratteristiche turbolente del moto stesso. In particolare, in un modello largamente impiegato, chiamato ε-k, la viscosità viene espressa in funzione di due tipici parametri che rappresentano rispettivamente la velocità di dissipazione dell'energia e l'energia cinetica turbolenta.
Nei processi di combustione, la turbolenza aumenta la velocità di propagazione di una fiamma e inoltre agevola lo scambio di calore rilasciato dal fronte di fiamma, con conseguente miglioramento del processo di accensione. Poiché una fiamma laminare presenta un fronte piano che si propaga con velocità Su, è importante approfondire i fattori che la rendono instabile, creando i presupposti per la sua degenerazione verso la turbolenza. La prima analisi fisico-matematica della stabilità delle fiamme laminari è stata condotta dal premio Nobel Lev Davidovič Landau allo scopo di investigare la risposta data dal fronte piano alle perturbazioni aventi la forma di piccoli corrugamenti della superficie di ampiezza ξ. Il metodo applicato da Landau costituisce un esempio classico di analisi della stabilità dei sistemi dinamici, nella quale l'evoluzione temporale del corrugamento viene espressa mediante una funzione esponenziale del tipo:
[14] formula.
La f (x, y) è una funzione delle due coordinate che giacciono sul piano della fiamma le cui caratteristiche specifiche non ci interessano. Viceversa, un ruolo importante spetta al segno del parametro γ, poiché se esso è positivo ξ aumenta esponenzialmente e la fiamma risulta instabile; se, invece, è negativo ξ tende asintoticamente a zero e la fiamma risulta stabile poiché dopo aver subito la perturbazione recupera la configurazione iniziale.
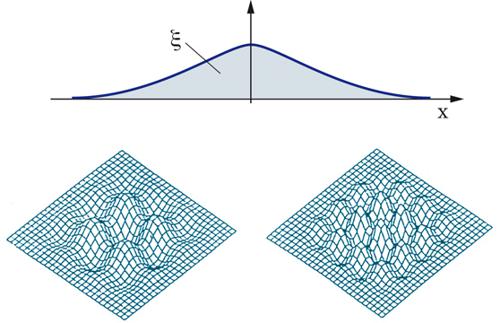
Nell'analisi sviluppata da Landau venivano presi in esame solo gli aspetti fluidodinamici, ignorando i processi di scambio di materia e calore. La fiamma veniva caratterizzata da una discontinuità della densità del gas, maggiore per la miscela incombusta che si trova a bassa temperatura e minore per la miscela combusta che invece ha raggiunto un'elevata temperatura, che si muove con velocità Su. In questa impostazione il parametro γ risultava sempre positivo, in vistoso disaccordo con i fatti sperimentali che confermano l'esistenza delle fiamme laminari. Questo risultato dimostra che la semplice analisi fluidodinamica è inadeguata per affrontare il problema, perché trascura l'influenza dei fenomeni di trasporto di materia e di calore, che sono gli autentici protagonisti dei fenomeni di combustione.
In un approccio diametralmente opposto al precedente, Jakov Borisovič Zeldovič ha arbitrariamente assunto, per semplicità, che la densità si mantenga inalterata nel passaggio dai gas incombusti a quelli combusti, ponendo però l'accento sui processi di scambio di materia e di calore. Gli sviluppi matematici hanno messo in evidenza come in una fiamma laminare esistano zone di stabilità dovute al fatto che il suo corrugamento aumenta localmente la velocità di reazione depauperando così la zona dal reagente. S'instaura allora un effetto diffusivo di retroazione che tende a conferire nuovamente alla fiamma una configurazione piana. In corrispondenza delle soluzioni instabili, invece, si riscontra che l'evoluzione del sistema dà origine a configurazioni cellulari come quelle illustrate nella fig. 8. Esse sono state ottenute simulando con un calcolatore il comportamento delle fiamme instabili mediante un modello più generale del precedente nel quale vengono presi in considerazione sia gli effetti fluidodinamici sia termodiffusivi. L'esistenza di tali strutture cellulari è stata confermata sperimentalmente per le fiamme di diversi idrocarburi. In realtà la loro formazione rappresenta il preludio di un'evoluzione verso un comportamento caotico che precede la turbolenza.
Non esiste ancora una trattazione fisico-matematica facilmente fruibile per descrivere il comportamento di una miscela soggetta a combustione in un fluido in moto turbolento. La simulazione di questi fenomeni costituisce un'autentica sfida, che si presume potrà essere affrontata grazie all'impiego dei sempre più potenti calcolatori elettronici, per esempio attraverso i metodi di simulazione diretta o DSM (Direct simulation method), la cui applicazione, allo stato attuale, è però limitata a situazioni molto semplici.
In un approccio semiempirico semplificato, si assume che il fronte della fiamma abbia una configurazione corrugata e che si muova con una velocità superiore a quella che compete alla corrispondente fiamma laminare. Si assume poi che la velocità della fiamma turbolenta sia data dal prodotto della velocità della fiamma laminare per il rapporto Ωf /Ω fra la superficie della fiamma corrugata (Ωf ) e quella della fiamma piatta laminare(Ω). È stato inoltre proposto di valutare Ωf assimilando il fronte della fiamma turbolenta a un oggetto frattale le cui caratteristiche, osservate su scale diverse, restano invariate.
Ruolo della matematica computazionale
La possibilità di simulare mediante calcoli i profili di temperatura, la velocità dei gas e le concentrazioni dei composti chimici fornisce importanti informazioni per la progettazione degli impianti di combustione rendendo più affidabili i passaggi dalla scala di laboratorio pilota alle dimensioni industriali. L'obiettivo viene perseguito mediante l'impiego di modelli matematici che compendiano in una serie di equazioni la conservazione, in un elemento di volume della miscela reagente, della materia, della quantità di moto associata al flusso e dell'energia. La conservazione della quantità di moto porta alle equazioni fondamentali della dinamica dei fluidi, note come equazioni di Navier-Stokes.
Per esempio, se si considera una situazione nella quale i due reagenti convergono nella zona di combustione rispettivamente in un cilindro interno e nella zona anulare che lo circonda, la configurazione del fronte di fiamma in corrispondenza del quale la corrente gassosa assume un'intensa luminosità ha simmetria cilindrica. Sistemi a iniezione di questo tipo sono molto comuni poiché vengono impiegati sia nei bruciatori delle fornaci industriali, sia nei motori a reazione.
Le menzionate equazioni di conservazione assumono la forma di un sistema di equazioni differenziali non lineari di secondo ordine alle derivate parziali la cui soluzione fornisce i desiderati profili di temperatura, di velocità della miscela fluida e della concentrazione dei reagenti. Questi risultati si possono perseguire solo per via numerica attraverso l'impiego di supercalcolatori.
Formazione delle particelle carboniose
Oltre agli ossidi di carbonio e d'azoto, un'ulteriore fonte di inquinamento è dovuta alla formazione di particelle di carbone che raggiungono il diametro di decine di nanometri e che si manifestano come polvere sottile. Tale formazione risulta agevolata nelle fiamme ricche di combustibile che, a elevata temperatura, per la loro presenza acquisiscono una spiccata luminosità. Tali particelle hanno un elevato contenuto di idrocarburi policiclici aromatici o PAH (Policyclic aromatic hydrocarbons), ovvero idrocarburi formati da più anelli benzenici condensati, che sono potenzialmente cancerogeni.
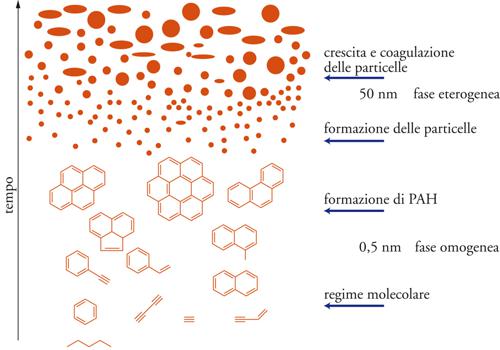
La formazione delle particelle di carbone avviene attraverso un meccanismo complesso non ancora compreso nei suoi dettagli; esso coinvolge comunque una serie di stadi che, nelle loro linee essenziali, comportano la formazione di idrocarburi insaturi e radicalici che combinandosi fra loro generano il più semplice degli idrocarburi aromatici, il benzene (C6H6). Le molecole di questo, condensandosi fra loro, portano successivamente alla formazione degli idrocarburi policiclici quali il naftalene, l'antracene, il fenantrene e così via. La condensazione di questi composti porta alla formazione di piccole particelle che, attraverso un meccanismo di coagulazione e crescita, aumentano di dimensione. E ciò anche se intervengono reazioni di ossidazione che limitano in parte il processo di crescita.
Il meno compreso degli stadi menzionati è il primo, che procede attraverso la combinazione di piccole molecole di idrocarburi insaturi con 2 e 4 atomi di carbonio che si formano nella combustione, per dare infine molecole cicliche. Per esempio, l'interazione dell'acetilene con il radicale del butadiene porta alla formazione del benzene:
[15] HC ≡ CH + CH2 = CH − CH =CH∙ C6H6 + H∙ .
Alternativamente la formazione del benzene può avere luogo per combinazione di due radicali propargilici:
[16] 2HC = C− CH2→ C6H6 .
Questi meccanismi sono stati oggetto di studi approfonditi, con metodi sperimentali e con quelli della chimica computazionale, per confermarne la validità e valutarne la rilevanza relativa.
Per interpretare l'ampliamento degli anelli verso la formazione di idrocarburi polinucleari si invoca un meccanismo a stadi, il primo dei quali porta alla formazione di un radicale aromatico Ar∙, in seguito alla reazione di un atomo di idrogeno con una molecola di un idrocarburo aromatico ArH:
[17] ArH + H∙ → Ar∙ + H2.
La successiva reazione del radicale così ottenuto con una molecola di acetilene porta all'ottenimento di un derivato insaturo che successivamente forma il più semplice idrocarburo poliaromatico, ovvero il naftalene:
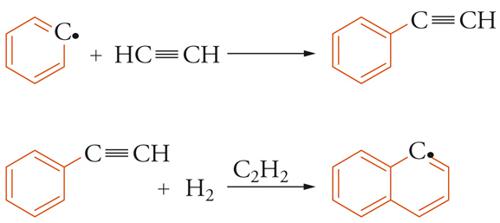
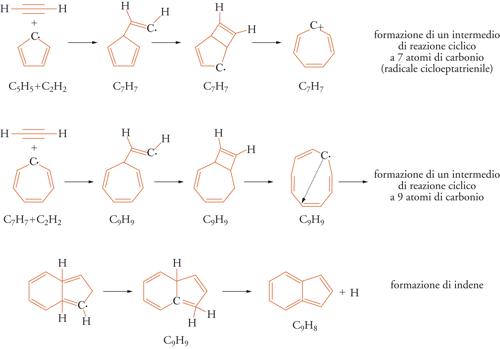
Tuttavia va osservato che porre l'attenzione solo sul meccanismo precedente potrebbe risultare riduttivo poiché il processo di formazione delle particelle carboniose potrebbe prendere l'avvio anche da specie diverse dal benzene o addirittura attraverso la formazione di idrocarburi aromatici con più di un anello condensato. Per esempio, si potrebbe formare l'indene, nel quale è presente un anello con 6 atomi di carbonio condensato con un anello a 5, per interazione dell'acetilene con il radicale del ciclopentadiene. Fra i diversi possibili cammini di reazione si è rivelato particolarmente favorevole quello riportato nella fig. 9. La presenza di strutture cicliche con 7 e 9 atomi di carbonio rivela la complessità e l'interesse dei processi chimici che avvengono nelle fiamme, confermata dal fatto che in esse sono stati identificati anche gli idrocarburi con la caratteristica struttura dei fullereni.
L'evoluzione del processo porta alla formazione di idrocarburi poliaromatici di dimensioni sempre maggiori, che per coagulazione formano aggregati, o cluster, aventi diametri di 1 o 2 nm. Ovviamente in atmosfera ossidante le particelle si possono ulteriormente trasformare poiché tendono a reagire con O2, O∙ e OH∙.
La velocità del processo di coagulazione delle particelle risulta espressa da un'equazione cinetica del secondo ordine, in base alla quale la velocità di formazione delle particelle aventi particolari dimensioni risulta proporzionale al prodotto delle concentrazioni di quelle di origine. Attraverso questo processo di crescita, le particelle raggiungono così le dimensioni delle decine di nm, tipiche di tali dispersioni. Nell'insieme, quindi, il meccanismo di formazione del particolato risulta adeguatamente riassunto dallo schema evolutivo illustrato nella fig. 10.
La transizione dalle specie gassose alle particelle solide costituisce comunque un aspetto poco compreso del processo di formazione del particolato, pur risultando favorita l'ipotesi che gli idrocarburi poliaromatici ‒ dopo aver raggiunto una dimensione critica, per effetto delle collisioni reciproche ‒ aderiscano reciprocamente formando dimeri, trimeri e così via, aumentando in tal modo di dimensioni. Accanto a questo meccanismo è presente anche un processo di crescita per adesione delle molecole gassose sulle superfici dei cluster.
Bibliografia
Barman, Ragland 1998: Barman, Gary L. - Ragland, Kenneth W., Combustion engineering, Boston, McGraw-Hill, 1998.
Fascella 2005: Fascella, Simone e altri, The peculiar kinetics of the reaction between acetylene and the cyclopentadienyl radical, "Journal of physical chemistry A", 2005, 109, pp. 7546-7557.
Glassman 1977: Glassman, Irvin, Combustion, New York-London, Academic Press, 1977.
Kanury 1975: Kanury, Anjaneya M., Introduction to combustion phenomena: for fire, incineration, pollution and energy applications, New York-London, Gordon and Breach, 1975.
Kuo 1986: Kuo, Kenneth K., Introduction to combustion phenomena, New York, Wiley, 1986.
Lewis, von Elbe 1951: Lewis, Bernard - von Elbe, Günter, Combustion, flames and explosions of gases, New York, Academic Press, 1951 (3. ed.: Orlando, Academic Press, 1987).
Williams 1985: Williams, Forman A., Combustion theory, Reading (Mass.), Addison-Wesley, 1985.