Costruzione di tessuti e organi: adesione e riconoscimento tra cellule
Costruzione di tessuti e organi: adesione e riconoscimento tra cellule
Nei vertebrati sono presenti tre tipi di recettori adesivi che determinano l'organizzazione delle cellule in aggregati, con formazione di tessuti e organi: le caderine, le molecole CAM e le integrine. Questi recettori sono connessi al sistema di filamenti del citoscheletro, garantendo in tal modo una continuità fisica tra le strutture di sostegno interne e quelle esterne alla cellula. L'analisi molecolare ha evidenziato l'esistenza di numerosi recettori adesivi che, durante lo sviluppo dell'organismo, sono espressi in maniera differenziale nel tempo e nello spazio, suggerendo l'esistenza di un codice di riconoscimento basato sulla presenza, a livello della superficie cellulare, di una determinata combinazione di recettori adesivi. In seguito all'interazione cellula-cellula o cellula-matrice extracellulare, i recettori adesivi attivano circuiti di reazioni intracellulari che modificano sia l'organizzazione del citoscheletro sia la risposta cellulare a stimoli differenziativi e proliferativi. L'adesione cellulare esercita, quindi, un controllo importante sul differenziamento e sulla proliferazione cellulare, necessario per uno sviluppo coordinato dei tessuti.
Introduzione
La costituzione di organismi pluricellulari richiede il movimento delle cellule e la loro aggregazione in masse che, durante le fasi dello sviluppo embrionale, costituiranno tessuti e organi. Questi processi morfogenetici implicano la capacità delle cellule di riconoscersi reciprocamente e di instaurare interazioni stabili sia con altre cellule sia con la matrice extracellulare, formando un reticolato di proteine fibrose e di carboidrati polimerici che funge da sostanza cementante nei tessuti adulti e che permette la migrazione e il movimento delle cellule durante le fasi di sviluppo dell'organismo.
Negli organismi pluricellulari, l'aggregazione delle cellule nei tessuti comporta l'acquisizione di funzioni specializzate, come si verifica per esempio nei tessuti muscolare, nervoso o epiteliale; anche la capacità proliferativa di tali cellule è controllata rigorosamente. Infatti, mentre negli organismi unicellulari un'unica cellula è in grado di svolgere tutte le funzioni necessarie, in quelli pluricellulari i gruppi di cellule, aggregate in singoli tessuti, assumono funzioni specifiche.
La proliferazione, negli organismi unicellulari, dipende unicamente dalla disponibilità di nutrimento, mentre negli organismi pluricellulari dipende da caratteristici sistemi di controllo che permettono al tessuto da una parte di raggiungere un certo volume e dall'altra di mantenerlo costante nel tempo.
Appare quindi chiaramente che la capacità delle cellule di riconoscersi e di formare strutture pluricellulari è legata alla loro capacità di differenziarsi, acquisendo caratteristiche funzionali specifiche, e di controllare la proliferazione in modo coordinato. Ricerche che sono state effettuate nella seconda metà degli anni Novanta hanno permesso di definire le basi molecolari attraverso le quali le interazioni adesive regolano il differenziamento e la proliferazione cellulare (per un'ulteriore discussione sulle molecole di adesione, vedi il saggio di R. Bruzzone e P. Meda, nel II volume).
Scoperta dei recettori dell'adesione cellulare
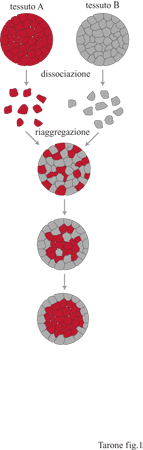
La capacità delle cellule appartenenti a uno stesso tessuto di riconoscersi è stata suggerita inizialmente da una serie di esperimenti di aggregazione cellulare: quando le cellule provenienti da tessuti differenti venivano mescolate in un mezzo adeguato, esse si aggregavano in agglomerati contenenti tipi cellulari omogenei. Era quindi chiaro che le cellule provenienti dallo stesso tessuto erano in grado di riconoscersi e di stabilire interazioni che permettevano la formazione di aggregati (fig. 1).
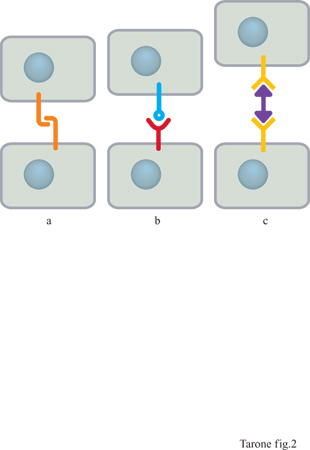
La capacità delle cellule di riconoscersi e di aggregarsi veniva meno se cellule isolate erano trattate con enzimi proteolitici, quali la tripsina o la pronasi, che rimuovono le proteine presenti sulla superficie cellulare. Questo indica che il riconoscimento e l' aggregazione cellulare richiedono l'interazione tra proteine specifiche poste sulla membrana e definite genericamente recettori adesivi. Lo studio di queste proteine ha permesso di comprendere che esistono almeno tre differenti meccanismi molecolari di riconoscimento tra le cellule (Takeichi, 1990): quello basato su interazioni omofiliche, in cui un recettore su una cellula lega un recettore uguale a se stesso sulla cellula adiacente; quello eterofilico, che si verifica quando i recettori che mediano l'interazione tra cellule adiacenti sono di tipo differente; quello mediato da una molecola bifunzionale che fa da ponte tra due recettori su cellule adiacenti (fig. 2).
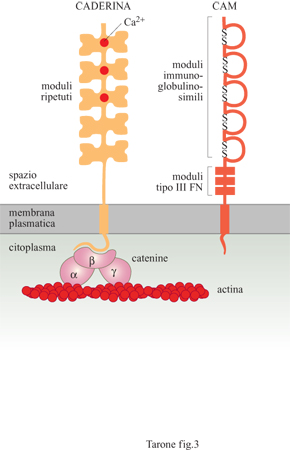
l recettori adesivi che mediano il riconoscimento e l'adesione tra cellule appartengono a due gruppi distinti per struttura e proprietà (fig. 3): le caderine (Ca²+-aderine) che funzionano solamente in presenza di ioni calcio (Ca²+) e le molecole CAM (Cell Adhesion Molecules, molecole di adesione cellulare), appartenenti alla superfamiglia delle immunoglobuline, che mediano l'adesione in assenza di Ca²+.
Caderine
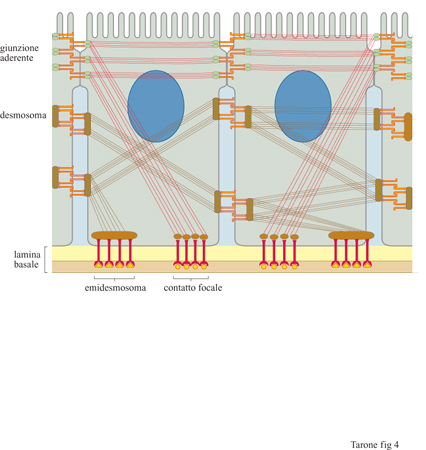
Le caderine costituiscono una famiglia comprendente una dozzina di molecole distinte, con una distribuzione tissutale caratteristica. La caderina E (epiteliale), la prima molecola di questa famiglia a essere stata descritta, è espressa molto precocemente durante lo sviluppo embrionale, allo stadio di morula, dove è responsabile della reazione di compattazione (Fleming et al., 1993), processo mediante il quale le cellule dello strato esterno della morula formano tra loro delle giunzioni, sigillando la struttura. In questo modo i fluidi pompati all'interno della morula da parte delle cellule degli strati più esterni permettono il rigonfiamento e la formazione di una sfera cava, la blastula, entro cui si organizzeranno le prime strutture embrionali vere e proprie. Questo è uno dei fenomeni più precoci dello sviluppo embrionale in cui un processo di adesione cellulare permette l'organizzazione di cellule in strutture specifiche. La caderina E è presente anche in diversi epiteli dell'animale adulto ed è localizzata in zone circoscritte della membrana, le giunzioni aderenti, che rappresentano siti di contatto specifici tra cellule adiacenti (fig. 4). Oltre alla caderina E, sono state identificate diverse altre molecole di adesione tra cui le caderine P e N, presenti rispettivamente nella placenta e nel tessuto nervoso, e le caderine VE e M, presenti in modo selettivo nell'endotelio vasale e nel muscolo striato (Takeichi, 1995). Le caderine sono glicoproteine che attraversano la membrana da parte a parte e che presentano, nella porzione di molecola esposta al mezzo esterno, cinque moduli strutturali ripetuti, stabilizzati dal legame con ioni Ca²+ (v. figura 3).
Nel modulo più esterno verso l'estremità amminoterminaIe di molte caderine è presente una sequenza di tre amminoacidi, istidina-alanina-valina, che interviene nel processo di riconoscimento omofilico tra caderine e che, quindi, è importante per la funzione adesiva di questi recettori. L'evidenza che le caderine mediano un tipo di adesione omofilica è stata dimostrata esprimendo la caderina E, mediante transfezione del gene corrispondente, in cellule prive di questa molecola. Le cellule così modificate si aggregano tra loro in presenza di Ca²+, ma non si aggregano con cellule prive di caderina E, né con cellule in cui è espressa la caderina P. Dal mescolamento delle cellule che esprimono la caderina E con quelle in cui vengono espresse le caderine N o P, si ottiene la formazione di aggregati omogenei contenenti cellule con un unico tipo di caderina. Il legame omofilico tra le caderine e l'espressione di tipi differenti di tali molecole di adesione rappresentano, quindi, un meccanismo automatico di segregazione delle cellule in gruppi omogenei. Tuttavia, per generare un'adesione stabile è necessaria anche la regione citoplasmatica della proteina. Questa porzione della caderina interagisce, infatti, con i filamenti di actina del cito scheletro contrattile della cellula tramite tre proteine chiamate a-, β- e y-catenina (v. figura 3). L'interazione delle caderine con il sistema cito scheletrico è indispensabile per trasmettere alla cellula la forza meccanica dell' adesione.
Un tipo particolare di caderine, caratterizzate da una regione citoplasmatica molto estesa, è presente nei desmosomi, che rappresentano delle giunzioni specializzate tra le cellule epiteliali; qui le caderine sono in contatto con i filamenti intermedi di cheratina e formano giunzioni adesive, dotate di resistenza meccanica elevata, responsabili della coesione tra le cellule dei tessuti epiteliali (v. figura 4).
Molecole CAM
Un secondo importante sistema di recettori adesivi è rappresentato dalle molecole CAM che, a differenza delle caderine, mediano il riconoscimento e l'adesione tra le cellule in modo indipendente dalla presenza di ioni Ca²+ (Edelman e Crossin, 1991). La prima molecola di questo gruppo a essere identificata è stata la N-CAM (Neural Cell Adhesion Molecule, molecola di adesione cellulare neurale), espressa principalmente sulle cellule nervose, che media l'adesione con un meccanismo di tipo omofilico. È costituita da moduli strutturali proteici di tipo immunoglobulinico e di tipo III della fibronectina, una proteina della matrice extracellulare (v. figura 3). Questa molecola di adesione è codificata da un gene unico che, tuttavia, può generare differenti forme proteiche mediante un meccanismo di splicing alternativo. Una di queste è una forma solubile di N-CAM non legata alla membrana, in quanto mancante del tratto transmembrana e citoplasmatico. Nonostante il significato fisiologico sia ancora oscuro, è stato ipotizzato che questa forma solubile abbia una funzione antiadesiva; legando le molecole di N-CAM sulla membrana, infatti, la forma solubile ne blocca l'interazione con altre molecole sulle cellule adiacenti.
Come tutte le proteine di membrana, N-CAM è una glicoproteina, tuttavia il suo grado di glicosilazione può variare considerevolmente. Infatti, N-CAM può portare legate alla regione extracellulare quantità variabili di catene oligosaccaridiche ricche di acido sialico, in grado di regolare la sua funzione adesiva.
L'alto contenuto di acido sialico, grazie all'abbondanza di cariche negative che generano forze repulsive, favorisce una bassa attività adesiva. Le forme di N-CAM ricche in acido sialico sono presenti prevalentemente durante le prime fasi dello sviluppo embrionale, quando sono in atto notevoli processi di migrazione cellulare, e scompaiono con il progredire dello sviluppo, quando le cellule cominciano a organizzarsi in tessuti e formano legami stabili. Questa proteina può, quindi, fungere da recettore adesivo o repulsivo in funzione del grado di glicosilazione o dello splicing alternativo; ciò suggerisce che queste modificazioni proteiche siano utilizzate dalla cellula per regolare i processi adesivi.
Durante lo sviluppo, la molecola N-CAM media l'adesione omofilica delle cellule nervose. Le molecole CAM, tuttavia, rappresentano un gruppo molto numeroso ed eterogeneo di recettori adesivi e alcune di esse mediano le interazioni di tipo eterofilico. Tra queste ricordiamo lCAM-l (lntercellular Adhesion Molecule-I, molecola di adesione intercellulare-l) e VCAM (Vascular Cell Adhesion Molecule, molecola di adesione della cellula vascolare) che legano recettori della famiglia delle integrine (v. oltre) e che, nella risposta infiammatoria, mediano il riconoscimento tra l'endotelio vasale e i leucociti.
Mentre le caderine possono dare origine a giunzioni specializzate tra le cellule, come le giunzioni aderenti e i desmosomi (v. figura 4), le CAM non organizzano giunzioni specializzate, ma mediano contatti 'non giunzionali' diffusi sulla membrana.
Matrice extracellulare
Come accennato precedentemente, l'organizzazione dei tessuti richiede, oltre ai legami cellula-cellula, anche le interazioni da parte delle cellule con la matrice extracellulare. Quest'ultima è particolarmente abbondante nei tessuti connettivi dove, al contrario degli epiteli, le cellule non sono in stretto contatto tra loro. Le proteine principali che costituiscono questa struttura extracellulare sono i collageni, la fibronectina e le laminine, molecole proteiche che presentano una struttura fibrosa e sono capaci di interazioni reciproche garantendo, in tal modo, la formazione di un reticolato di supporto meccanico per i tessuti. Inoltre, tutte queste proteine interagiscono con i recettori cellulari (v. oltre) permettendo l'ancoraggio delle cellule al reticolato proteico di supporto.
Collageni
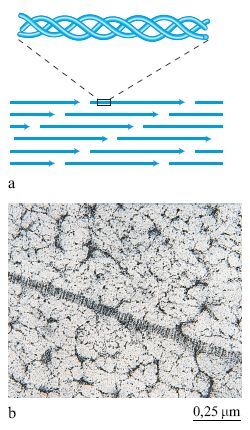
Sono molecole costituite solitamente da tre catene polipeptidiche ricche di prolina e di glicina e avvolte a elica, in modo da formare una molecola allungata e rigida (fig. 5). Sono state identificate circa 25 catene polipeptidiche differenti che si possono combinare generando 15 tipi di collagene i quali presentano proprietà e distribuzione tissutale specifiche (Lisenmayer, 1991). Le molecole dei collageni di tipo l e III polimerizzano spontaneamente formando delle lunghe fibre estremamente resistenti alla trazione meccanica (v. figura 5). Le molecole di collagene presentano siti capaci di interagire con altre molecole della matrice, quali la fibronectina (collageni di tipo l e lll), le laminine (collagene tipo IV) e i proteoglicani (v. oltre). l collageni, inoltre, presentano siti di interazione con i recettori localizzati sulla superficie cellulare permettendo, in tal modo, un'interazione diretta delle cellule con la matrice (v. oltre).
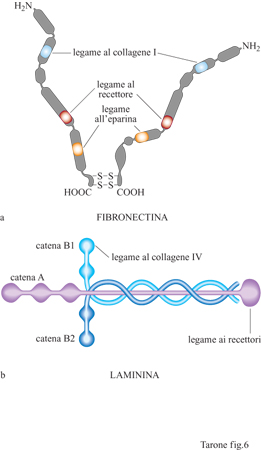
Fibronectina e laminine. - Il reticolato di fibre collagene e la sua interazione con le cellule sono rafforzati ulteriormente dalla presenza di molecole quali la fibronectina e le laminine (fig. 6). La fibronectina è una proteina fibrosa costituita da due catene polipeptidiche legate da due ponti disolfuro all'estremità carbossiterminale (Hynes e Yamada, 1982). Entrambe le catene contengono tre siti di legame: uno per il collagene, un secondo per un recettore presente sulla membrana cellulare e un terzo per l'eparina, un glicosamminoglicano della matrice (v. oltre). Pur esistendo un unico gene, mediante un meccanismo di splicing alternativo la fibronectina viene prodotta in forme diverse che differiscono per corti tratti di sequenza. Queste forme sono espresse in momenti differenti dello sviluppo e in tessuti diversi dell'organismo, suggerendo ruoli specifici delle singole forme. Le laminine sono molecole costituite da tre catene polipeptidiche avvolte a formare una struttura a croce latina (v. figura 6b). Come nel caso dei collageni, esistono diverse catene polipeptidiche che, associandosi in varie combinazioni, formano almeno 10 tipi di laminine presenti in tessuti differenti (Timpl, 1996). Inoltre, anche le laminine possiedono siti di interazione con il collagene e legano recettori cellulari. In associazione con il collagene di tipo IV le laminine formano strutture planari, note come lamine basali, che fungono da ancoraggio per gli epiteli (v. figura 4); queste lamine, inoltre, avvolgono in modo continuo e sostengono meccanicamente le cellule nervose e quelle muscolari. Nel glomerulo renale, oltre alla funzione di sostegno, la lamina basale, posta tra l'endotelio capillare e i podociti, svolge una funzione particolare di controllo della filtrazio ne del sangue. La fibronectina e le laminine, formando legami crociati con le fibre di collagene, stabilizzano il reticolato e, interagendo con i recettori cellulari, forniscono alle cellule un ulteriore sistema di ancoraggio al reticolato di fibre collagene.
Proteoglicani. - Un altro componente importante delle matrici extracellulari è rappresentato dai proteo glicani, proteine complessate in modo stabile con glicosamminoglicani, lunghe molecole polisaccaridiche acide. Questi polimeri interagiscono con i siti specifici presenti sulla fibronectina, sulle laminine e sui collageni, stabilendo così un'associazione con gli altri componenti della matrice. Esistono differenti tipi di glicosamminoglicani accomunati dalla proprietà di essere molecole idrofile ricche di cariche negative e, pertanto, estremamente avide di acqua e di cationi. Grazie a questa proprietà, i proteoglicani svolgono due funzioni importanti nella matrice: trattengono grandi quantità di acqua e sali minerali, generando il turgore necessario a rendere la matrice resistente alla compressione meccanica; legano polipeptidi basici, quali numerosi fattori di crescita, di importanza cruciale per regolare diverse funzioni cellulari.
Le proprietà e le caratteristiche fisico-chimiche della matrice extracellulare possono differire enormemente in tessuti diversi. Ciò dipende dai rapporti quantitativi tra i vari componenti e dalla presenza di forme specifiche di collageni, fibronectina e laminine, nonché dalla presenza di altre proteine, quali la trombospondina, la vitronectina, l'entactina o la tenascina. La matrice dei connettivi lassi, come il derma, è caratterizzata dalla presenza di collageni di tipo I e III, dalla fibronectina e da un elevato contenuto di proteoglicani. Nei connettivi densi, quali il tendine, la matrice è caratterizzata da un'elevata presenza di collagene e da una mancanza pressoché assoluta di proteoglicani. Le lamine basali consistono di collagene tipo IV, laminina, entactina ed eparansolfato, un particolare tipo di glicosamminoglicano. In altri casi ancora, come l'osso, la matrice ha assunto una funzione specializzata trasformandosi in tessuto calcificato a causa della deposizione, tra le fibrille di collagene, di fosfato di calcio insolubile.
Integrine e interazione cellula-matrice
Scoperta delle integrine
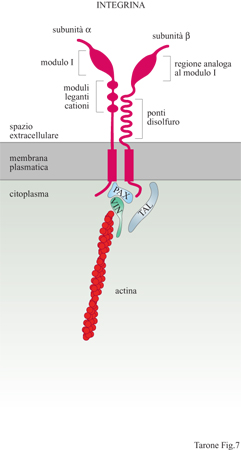
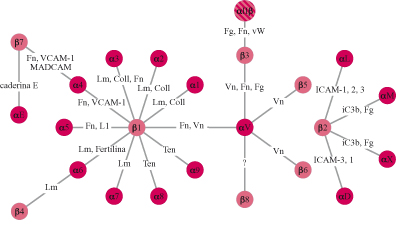
Le cellule si ancorano alla matrice extracellulare utilizzando particolari recettori noti come integrine, glicoproteine che attraversano la membrana da parte a parte (fig. 7), mettendo in connessione la matrice extracellulare con il citoscheletro, il quale rappresenta il sistema di filamenti intracellulari preposto al movimento cellulare (Hynes, 1987). Le integrine sono state scoperte negli anni Ottanta grazie a studi finalizzati all'identificazione del recettore della fibronectina. In quel periodo era noto che le cellule in coltura depositano una grande quantità di fibronectina sulla superficie della capsula di coltura e, legandosi a questa proteina, aderiscono alla capsula formando un monostrato cellulare. Alcuni laboratori, tra cui il mio, utilizzando tecniche differenti, avevano identificato un gruppo di glicoproteine di membrana, con massa molecolare intorno a 140 kDa, che permetteva l'adesione delle cellule alla fibronectina. Contemporaneamente, il laboratorio di E. Ruoslahti, analizzando la struttura della fibronectina, era arrivato all'identificazione della sequenza amminoacidica minima necessaria per la sua attività adesiva. Questa sequenza, costituita dagli amminoacidi arginina-glicina-acido aspartico, era sufficiente, una volta adsorbita alla superficie delle capsule di coltura, per l'adesione delle cellule e quindi doveva rappresentare la sequenza riconosciuta dal recettore della fibronectina presente sulle membrane cellulari. Questa predizione si rivelò esatta e le glicoproteine di 140 kDa, descritte precedentemente, si rivelarono capaci di legare la sequenza arginina-glicina-acido aspartico. Sulla base di questi risultati si arrivò presto alla caratterizzazione molecolare del recettore e alla scoperta che questo era costituito da due subunità glicoproteiche, α e β, associate in modo non covalente sulla membrana cellulare. Immediatamente apparve chiaro che il recettore della fibronectina aveva caratteristiche molecolari simili ai recettori di membrana identificati in altri sistemi cellulari e legati a funzioni che, apparentemente, nulla avevano a che fare con il recettore della fibronectina. Tra questi vi erano il recettore per il fibrinogeno delle piastrine, due classi di antigeni defrniti VLA (Very Late Antigen, antigene molto tardivo) e LFA (Leukocyte Function Antigen, antigene funzionale dei leucociti) presenti sui linfociti e coinvolti nei meccanismi della risposta immune, nonché un gruppo di recettori, identificato nel moscerino della frutta Drosophila melanogaster, che riveste un ruolo importante nel determinare l'organizzazione dell'ala. L'isolamento dei geni corrispondenti alle subunità di questi recettori rivelò in modo inequivocabile che tutte queste molecole avevano un' origine evolutiva comune, poiché possedevano sequenze amminoacidiche strettamente correlate. Fu così evidenziata l'esistenza di una famiglia di recettori a cui fu dato il nome di integrine (Hynes, 1987) per sottolineare la loro capacità di integrare funzionalmente la matrice e il cito scheletro attraverso la membrana. Attualmente sono conosciute 16 subunità α e 8 subunità β che si associano formando 22 integrine dimeriche con attività recettoriale per differenti ligandi (fig. 8). La complessità della famiglia delle integrine è ulteriormente aumentata dalla presenza di diverse isoforme di subunità α e β generate per splicing alternativo con distribuzione tissutale e attività funzionale specifica. Struttura molecolare e funzione delle integrine Le subunità α sono caratterizzate dalla presenza, nella porzione amminoterminale esposta all'ambiente extracellulare, di tre moduli strutturali ripetuti, omologhi ai cosiddetti motivi strutturali EF in grado di legare cationi bivalenti, presenti in proteine che legano il Ca²+, come la calmodulina. Cationi bivalenti, quali Ca²+, Mg²+ e Mn²+ sono, infatti, indispensabili al legame dell'integrina-ligando. Alcune subunità β presentano inoltre, in prossimità delle sequenze leganti i cationi, un tratto di sequenza definito modulo I, responsabile del legame alligando (v. figura 7). Sono, infatti, le subunità α a determinare la specificità di legame delle integrine, come indicato dal fatto che integrine che legano proteine della matrice differenti condividono la subunità β ma presentano subunità α distinte (v. figura 8). Le subunità β partecipano anch'esse al legame con illigando attraverso una porzione amminoterminale che ha caratteristiche strutturali simili al modulo I delle subunità Ci. Una caratteristica importante delle integrine è la bassa affrnità con cui legano i rispettivi ligandi. Questa proprietà è in contrasto con l'elevata affrnità di legame che caratterizza la maggior parte dei recettori per gli ormoni. La bassa affrnità di legame, tuttavia, è fondamentale per le integrine che, durante la migrazione cellulare, devono stabilire interazioni dinamiche con la matrice; se l'affinità fosse molto elevata, infatti, le cellule rimarrebbero in contatto stabile con la matrice senza potersi muovere su questa. Una seconda proprietà importante delle integrine è quella di poter regolare il proprio stato di attivazione. Gli stimoli che giungono alla cellula possono agire, attraverso una serie di reazioni intracellulari, sulla conformazione spaziale dell' integrina: in tal modo, la proteina assumerà o una conformazione attiva e potrà interagire con il ligando, o una conformazione inattiva, che non permetterà che tale evento si verifichi. Grazie a questa proprietà, una cellula può modificare lo stato di adesione alla matrice extracellulare regolando la funzione delle integrine. Questo processo avviene, per esempio, durante la divisione cellulare quando la cellula si arrotonda staccandosi transitoriamente dalla matrice per poi, appena terminata la mitosi, aderirvi di nuovo.
La regolazione dello stato di attivazione rappresenta, quindi, un importante sistema di controllo dell'adesività cellulare. Infatti, a differenza degli ormoni e dei neurotrasmettitori che vengono prodotti e rilasciati per brevi periodi, le proteine della matrice extracellulare sono presenti costantemente e la loro interazione con i recettori può essere regolata unicamente dalla capacità del recettore stesso di modificare lo stato di attivazione. Quando sulla membrana sono attivate tutte le molecole di integrina, la cellula sarà ancorata stabilmente alla matrice con una forza identica alla somma delle forze delle singole interazioni. Inattivando un numero progressivamente crescente di integrine, la cellula potrà indebolire il contatto con la matrice e, grazie alla bassa affinità di legame, le singole interazioni potranno rompersi permettendo il movimento della cellula sulla matrice stessa. Questi meccanismi hanno un'importanza cruciale nel regolare la motilità delle cellule, non solo durante l'organogenesi embrionale, ma anche nell'organismo adulto quando, in seguito a una lesione, si renda necessario riparare i tessuti.
La porzione delle integrine rivolta verso il lato citoplasmatico della membrana cellulare lega le molecole di actina del cito scheletro contrattile (v. figura 7). Nelle cellule in coltura, le integrine si trovano concentrate in siti specifici della membrana ventrale - in stretto contatto con la superficie della piastra di coltura - noti come contatti locali. In queste zone confluiscono le estremità terminali dei filamenti di actomiosina che si ancorano alle integrine tramite una serie di proteine cito scheletriche quali la talina, la vincolina, la paxillina, la tensina e l' α-actinina. È probabile che la talina e la paxillina interagiscano direttamente con la regione citoplasmatica della subunità β delle integrine e che, a loro volta, leghino la vincolina e, quindi, la F-actina. Tuttavia, non esistono ancora prove defrnitive che chiariscano le interazioni molecolari a questo livello e i modelli attuali si basano sostanzialmente su dati morfologici di colocalizzazione di queste molecole con le integrine a livello dei contatti focali.
Come per le caderine, anche nel caso delle integrine esiste una forma molecolare specifica che media il legame alla membrana dei filamenti di citocheratine, anziché di actina. L'integrina coinvolta in questo processo è la subunità β4 che si localizza negli emidesmosomi, strutture di adesione specifiche delle cellule dell'epidermide, alla lamina basale (v. figura 4).
Gli esempi delle caderine e delle integrine indicano come questi recettori adesivi siano in grado di esercitare la loro funzione in modo corretto, solamente interagendo contemporaneamente con illigando extracellulare e con il citoscheletro. In questo modo le sollecitazioni meccaniche esterne, cui una cellula è sottoposta nell'ambito di un tessuto (si pensi alla cute come caso estremo), possono essere trasmesse a una struttura intracellulare in grado di fornire una resistenza adeguata. In mancanza di interazioni con il citoscheletro, le forze applicate al recettore adesivo potrebbero essere sufficienti a estrarlo dal doppio strato lipidico della membrana stessa che, di per sé, ha una consistenza meccanica pressoché nulla.
Ruolo morfogenetico dei recettori adesivi
I diversi sistemi di adesione cellulare funzionano in modo coordinato determinando il destino delle cellule e la loro capacità di migrare, interagire e organizzarsi in tessuti. Un esempio classico di questi processi è rappresentato dalla formazione del tubo neurale durante lo sviluppo embrionale (Takeichi, 1995).
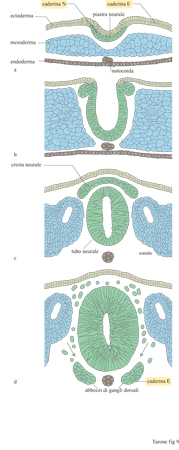
Il tubo neurale, l'abbozzo del sistema nervoso centrale, si forma per invaginazione dell'ectoderma, lo strato di cellule più esterno dell'embrione che darà origine anche all'epidermide e alle strutture di rivestimento. L'ectoderma esprime la caderina E, ma la zona dove si sta formando il tubo neurale cessa di esprimere questo recettore ed esprime la caderina N (fig. 9). Una volta formato, il tubo neurale dà origine, nella sua porzione dorsale, alle cellule della cresta neurale che, essendo molto mobili, si staccano dal tubo neurale e iniziano a migrare ventralmente formando strutture diverse nella porzione craniale e addominale dell'embrione. Nel momento in cui si staccano dal tubo neurale e iniziano a migrare, queste cellule cessano di esprimere la caderina N. La migrazione avviene all'interno del mesoderma indifferenziato ricco di fibronectina e richiede l'attiva partecipazione in vivo delle integrine, come dimostrano eleganti lavori in cui la migrazione in vivo delle cellule della cresta neurale viene bloccata dalla microiniezione di anticorpi che interferiscono con il legame della fibronectina al recettore. Nel momento in cui le cellule cessano di migrare e iniziano ad aggregarsi, formando gli abbozzi dei gangli dorsali, compare nuovamente la caderina E. Queste osservazioni indicano che, durante lo sviluppo, l'espressione dei recettori adesivi sulla superficie delle cellule è regolata in modo molto preciso e suggeriscono l'esistenza di un meccanismo di segregazione cellulare basato sull'uso di un codice di riconoscimento molecolare, definito dall' espressione differenziale di recettori adesivi specifici, responsabile della separazione di due popolazioni cellulari. D'altro canto, quando popolazioni cellulari differenti esprimono lo stesso recettore adesivo, possono entrare in contatto e organizzarsi in una struttura unica.
I recettori adesivi non sono importanti solamente per la formazione dei tessuti durante lo sviluppo embrionale, ma rivestono un ruolo rilevante anche nel mantenere l'integrità nei tessuti adulti, come possiamo osservare in alcune patologie umane, per esempio l'epidermolisi bollosa. Negli individui affetti, la cute e gli epiteli di rivestimento interni formano bolle e ulcerazioni gravi, in seguito anche ai più lievi insulti meccanici. Questo difetto è dovuto allo scollamento dello strato epiteliale dal connettivo sotto stante (v. figura 4) causato da alterazioni genetiche a carico di vari elementi del sistema di connessione citoscheletro-matrice nelle cellule dello strato basale (Epstein, 1996). Le analisi genetiche hanno dimostrato che le alterazioni possono essere a carico dei filamenti intermedi del cito scheletro costituiti da citocheratina, dell'integrina α6β4 che connette questi filamenti alla laminina, della laminina stessa o, ancora, di altre proteine della matrice extracellulare, quali il collagene VII. Anche nel caso delle caderine sono stati individuati casi patologici che dimostrano l'importanza di queste molecole nell'integrità tissutale. In particolare, in alcuni carcinomi, la capacità delle cellule tumorali di invadere i tessuti circostanti e di generare metastasi in tessuti distanti richiede la perdita di espressione della caderina E da parte delle cellule tumorali (Birchmeier e Behrens, 1994). Questo ruolo è stato confermato dall'analisi di tumori sperimentali nel topo dove il blocco dell' espressione della caderina E porta a un aumento del grado di malignità del tumore in vivo e, di converso, la riespressione della caderina, mediante transfezione, porta a una riduzione delle capacità metastatiche. La caderina funziona quindi come un gene oncosoppressore in quanto, impedendone il distacco dal tumore originario, previene la migrazione delle cellule tumorali nei tessuti circostanti e la generazione di metastasi.
Recettori adesivi e generazione di segnali all'interno della cellula
Finora abbiamo discusso il ruolo meccanico della matrice extracellulare e dei recettori adesivi nel mediare i processi di riconoscimento tra le cellule e la loro aggregazione in masse funzionalmente omogenee. l recettori adesivi, tuttavia, hanno una funzione cruciale anche nel regolare i processi di differenziamento e di proliferazione cellulare. Uno degli esempi più chiari di questa proprietà è rappresentato dall' epidermide, un epitelio le cui cellule, i cheratinociti, sono disposte in strati sovrapposti. Lo strato basale di questo tessuto è costituito da cheratinociti proliferanti che aderiscono alla laminina della lamina basale, mentre le cellule degli strati superiori non sono in contatto con la lamina basale e hanno smesso di proliferare, per intraprendere il processo differenziativo che le porterà a divenire cheratinociti maturi. Se una cellula degli strati superiori viene mantenuta in contatto forzato con la matrice extracellulare, si assiste a un blocco della sua capacità differenziativa (Adams e Watt, 1989). Ciò suggerisce che le interazioni con le cellule circostanti e con i componenti della matrice extracellulare forniscono alla cellula informazioni che ne regolano il differenziamento, oltre che la posizione nel tessuto.
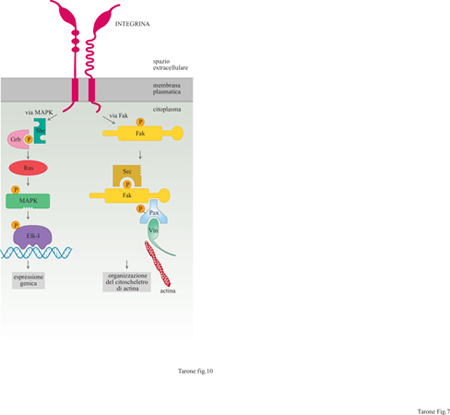
Queste proprietà sono rese possibili dal fatto che i recettori adesivi, così come i recettori per gli ormoni, funzionano da interruttori capaci di attivare circuiti di reazioni intracellulari. Le prime dimostrazioni che le integrine, interagendo con le proteine della matrice, generano dei segnali all'interno della cellula risalgono all'inizio degli anni Novanta quando i laboratori di R.G. Hynes, R. Juliano e J. Brugge, lavorando con fibroblasti e piastrine, hanno dimostrato che l'interazione delle integrine βl e β3 con i loro rispettivi ligandi, fibronectina e fibrinogeno, porta alla fosforilazione in tirosina di due gruppi di proteine intracellulari con massa molecolare di 120 ÷ 130 kDa e di 60 ÷ 70 kDa. Tra queste molecole troviamo la p125Fak, una tirosinchinasi citoplasmatica, e la paxillina, che è in grado di funzionare da adattatore molecolare; entrambe queste proteine sono localizzate in maniera specifica nei contatti focali (Clark e Brugge, 1995).
La fosforilazione della p125Fak e della paxillina, stimolata dalle integrine, permette l'organizzazione dei filamenti di actina durante l'adesione e la migrazione cellulare, come indicato da una serie di esperimenti in cui la fosforilazione di queste molecole veniva inibita o stimolata con l'uso di inibitori specifici delle tirosinchinasi o delle tirosinfosfatasi (Defilippi et al., 1994; Retta et al., 1996). In aggiunta all'attivazione di tirosinchinasi, le integrine attivano altri circuiti di segnalazione intracellulare (Clark e Brugge, 1995; Schwartz et al., 1995; Wary et al., 1996), quali l'aumento dei livelli di Ca²+ citoplasmatico, l'alcalinizzazione del citoplasma e l'attivazione delle MAPK (Mitogen Activated Protein Kinases, proteinchinasi attivate da mito geni); queste ultime sono chinasi attivate da stimoli proliferativi, che costituiscono un anello fondamentale nella catena di eventi che portano alla divisione cellulare (fig. 10).
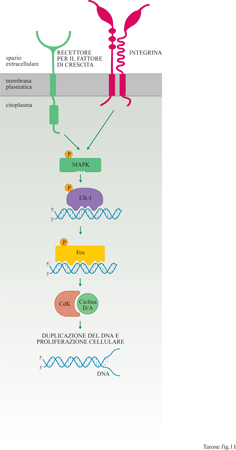
Tutti questi circuiti di segnalazione, e le proteine MAPK in particolare, sono anche attivati da molti recettori dei fattori di crescita (v. il saggio di A. Pandiella, nel II volume). Queste proteine agiscono a livello del nucleo della cellula fosforilando, e quindi attivando, proteine, quali Elk-l, che regolano l'espressione in cascata di numerosi geni responsabili della proliferazione cellulare, tra cui fos e i geni che codificano le cicline D e A (fig. 11). In particolare le cicline, regolando l'attività delle chinasi dipendenti da ciclina (Cdk, Cyclin dependent kinase), controllano in modo cruciale l'avvio della sintesi del DNA e quindi l'inizio del ciclo di proliferazione (per una discussione più approfondita sulle cicline si rimanda al saggio di G. Draetta, nel II volume). Il laboratorio di R. Assoian ha dimostrato che l'induzione delle cicline D e A richiede l'azione combinata dei fattori di crescita e dell'adesione alla matrice (Zhu et al., 1996). Infatti, la stimolazione con fattori di crescita di cellule non aderenti alla matrice extracellulare non è sufficiente a indurre né la produzione di cicline, né la proliferazione cellulare; la sintesi di cicline è indotta unicamente se i fattori di crescita possono agire su cellule adese in contatto con la matrice.
Questi esperimenti hanno fornito una spiegazione molecolare alle osservazioni classiche di S. Penman e A. Moscona degli anni Settanta (Farmer et al., 1978; Folkman e Moscona, 1978), secondo le quali la maggioranza delle cellule mesenchimali ed epiteliali prolifera in vitro solamente se adesa alla superficie della piastra di coltura. Se queste cellule vengono mantenute in sospensione, pur in presenza di fattori di crescita e di sostanze nutrienti appropriate, non si osserva la sintesi di DNA. La proliferazione cellulare è, quindi, controllata dalla combinazione di almeno due segnali: da una parte fattori solubili, che possono agire a distanza, quali i fattori di crescita e le citochine; dall'altra i fattori insolubili della matrice extracellulare ad azione strettamente locale, quali la fibronectina, la laminina, i collageni o i contatti cellula-cellula. I meccanismi di segnalazione dei due sistemi recettoriali non differiscono in modo sostanziale in quanto, come accennato sopra, sia le integrine sia i recettori dei fattori di crescita stimolano l'attivazione delle proteine MAPK. Tuttavia, solo quando queste chinasi sono attivate contemporaneamente da entrambi gli stimoli si raggiungono livelli di attivazione sufficienti a indurre le cicline e, quindi, a innescare la proliferazione cellulare (v. figura 11). In questo modo si può spiegare, per esempio, come nell'epidermide solamente le cellule dello strato basale, che sono esposte agli stimoli mitogenici e ancorate alla laminina, siano capaci di proliferare. Questo doppio meccanismo di controllo fa sì che la cellula risponda agli stimoli proliferativi e differenziativi solamente quando si trova nel corretto contesto tissutale. L'importanza di questo controllo è sottolineata in modo evidente dal comportamento della cellula tumorale che, a differenza della cellula normale derivata da un tessuto sano, è in grado di proliferare in assenza di adesione a una matrice extracellulare. Questa proprietà, nota frn dai primi anni Settanta come crescita indipendente da ancoraggio, permette alla cellula di crescere in modo smisurato anche in tessuti differenti da quello di origine, formando metastasi. L'indipendenza della proliferazione dall' adesione alla matrice è dovuta a mutazioni genetiche dominanti che si accumulano nella cellula tumorale portando a un'attivazione costitutiva delle proteine che trasmettono il segnale mitogenico all'interno della cellula, attivando in modo abnorme le proteine MAPK e, di conseguenza, le cicline.
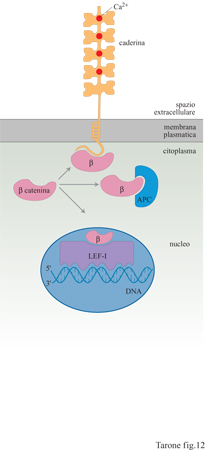
Anche le caderine sono capaci di generare segnali intracellulari in risposta all'adesione fra le cellule. In questo caso è la β-catenina a giocare un ruolo molto interessante, anche se non ancora del tutto conosciuto. Questa proteina citoplasmatica ha due importanti funzioni: infatti non si limita a garantire il legame dei filamenti di actina alla membrana, fungendo da ponte tra la regione citoplasmatica della caderina e i filamenti stessi di actina, ma ha un ruolo rilevante nella regolazione dell'espressione genica. È stato, infatti, dimostrato che la β-catenina può legare un fattore trascrizionale, la proteina LEF -l, e, associata a questo, migrare nel nucleo dove agisce regolando l'espressione dei geni (fig. 12). La formazione di legami tra le cellule favorirebbe l'associazione della β-catenina alla caderina, inibendone l'interazione con LEF-l e, quindi, l'azione a livello genico (Peifer, 1997). La β-catenina può legare anche una proteina citoplasmatica nota con il nome di APC (Adenomatous Poliposis Coli, polipo si adenomatosa del colon), che ha la funzione di sequestrarla alle caderine e a LEF-l e di indume la degradazione. APC è stato scoperto come gene la cui perdita o inattivazione è legata allo sviluppo del carcinoma del colono Si può ipotizzare che la mancanza della proteina APC porti all'accumulo di un eccesso di β-catenina citoplasmatica disponibile per l'interazione con le caderine e la proteina LEF-I; questo potrebbe portare a uno squilibrio dell' espressione genica e dell'adesione cellulare alla base della trasformazione neoplastica. l livelli di β-catenina citoplasmatica sono anche regolati dal recettore di Wntl, una proteina secreta che riveste un ruolo importante sia nell'oncogenesi sia nella formazione dei tessuti durante l'embriogenesi. Stimolando il proprio recettore, Wntl attiva una cascata di reazioni che coinvolgono proteine con nomi curiosi come Dishevelled e Shaggy, inducendo un aumento dei livelli di β-catenina citoplasmatica. Wntl produce, quindi, un effetto analogo a quello indotto dall'inattivazione o dall'assenza della proteina APC.
Conclusioni
Possiamo affermare che la funzione dei recettori adesivi nell'organizzazione dei tessuti è duplice: agendo da sistemi di connessione transmembrana tra strutture cito scheletriche ed extracellulari, essi garantiscono processi di riconoscimento e di coesione cellula-cellula e cellula-matrice extracellulare. Allo stesso tempo, però, i recettori adesivi svolgono una funzione cruciale nel determinare le caratteristiche differenziative e proliferative della cellula nel tessuto stesso. Questo processo è possibile grazie alla loro capacità di scatenare reazioni biochimiche intracellulari che portano alla regolazione dell'espressione genica. Come dimostrano i tumori, quando questa duplice funzione è in qualche modo alterata, la cellula perde sia il controllo della proliferazione sia l'interazione coordinata con l'ambiente circostante, necessaria per la formazione dei tessuti nell'organismo sano. La conoscenza più approfondita dei meccanismi di funzionamento dei recettori adesivi potrà portare a un approccio più razionale della cura dei tumori, nonché allo sviluppo di tecnologie che permetteranno di 'fabbricare' in vitro tessuti utili per rimpiazzare quelli gravemente danneggiati o in de generazione.
Bibliografia citata
ADAMS, I.C., WATT, F.M. (1989) Fibronectin inhibits the terminaI differentiation of human keratinocytes. Nature, 340, 307-309.
BIRCHMEIER, W., BEHRENS, J. (1994) Cadherin expression in carcinomas: role in the formation of cell junctions and the prevention of invasiveness. Biochim. Biophys. Acta, 1198, 11-26.
CLARK, E.A., BRUGGE, J.S. (1995) Integrins and signal transduction pathways: the road taken. Science, 268, 233-239.
DEFILIPPI, P., Bozzo, C., VOLPE, G., ROMANO, G., VENTURINO, M., SILENGO, L., TARONE, G. (1994) Integrin-mediated signal transduction in human endothelial cells: analysis of tyrosine phosphorylation events. Cell Adhes. Commun., 2, 75-86.
EDELMAN, G.M., CROSSIN, K.L. (1991) Cell adhesion molecules: implications for a molecular histology. Annu. Rev. Biochem., 60, 155-190.
EPSTEIN, E.H. J.R. (1996) The genetics of human skin diseases. Curr. Opin. Genet. Dev., 6, 295-300.
FARMER, S.R., BEN-ZE'AV, A., BENECKE, B.J., PENMAN, S. (1978) Altered translatability of messenger RNA from suspended anchorage-dependent fibroblasts: reversal upon cell attachment to a surface. Cell, 15, 627-637.
FLEMING, T.P., JAVED, Q., COLLINS, J., HAY, M. (1993) Biogenesis of structural intercellular junctions during cleavage in the mouse embryo. J. Cell. Sci. Suppl., 17, 119-125.
FOLKMAN, J., MOSCONA, A. (1978) Role of cell shape in growth control. Nature, 273, 345-349.
HYNES, R.O. (1987) Integrins: a family of cell surface receptors. Cell, 48, 549-554.
HYNES, R., Y AMADA, K.M. (1982) Fibronectins: multifunctional modular glycoproteins. J. Cell. Biol., 95, 369-377.
LISENMAYER, T.F. (1991) Collagen. In Cell biology of extracellufar matrix, a c. di Hay E.D., New York, Plenum Press, 2a ed., pp. 7-44.
PEIFER, M. (1997) Beta-catenin as oncogene: the smoking gun. Science, 275, 1752-1753.
RETTA, S.F., BARRY, S.T., CRITCHLEY, D.R., DEFILIPPI, P., SILENGO, L., TARONE, G. (1996) Focal adhesion and stress fiber formation is regulated by tyrosine phosphatase activity. Exp. Cell Res., 229, 307-317.
SCHWARTZ, M.A., SCHALLER, M.D., GINSBERG, M.H. (1995) Integrins: emerging paradigms of signal transduction. Annu. Rev. Cell Dev. Biol., 11, 549-599.
TAKEICHI, M. (1990) Cadherins: a molecular family important in selective cell-cell adhesion. Annu. Rev. Biochem., 59, 237-252.
TAKEICHI, M. (1995) Morphogenetic roles of classic cadherins. Curr. Op. Cell Biol., 7, 619-627.
TIMPL, R. (1996) Macromolecular organization of basement membranes. Curr. Opin. Cell Biol., 8, 618-624.
WARY, K.K., MAINIERO, F., ISAKOFF, S.J., MARCANTONIO, E., GIANCOTTI, F.G. (1996) The adaptor protein Shc couples a class of integrins to the control of cell cycle progression. Cell, 87, 733-743.
ZHU, X., OHTSUBO, M., BOHMER, R.M., ROBERTS, J.M., ASSOIAN, R.K. (1996) Adhesion-dependent cell cycle progression linked to the expression of cyclin DI, activation of cyclin E-cdk2, and phosphorylation of the retinoblastoma protein. J. Cell Biol., 133, 391-403.