Dallo yogurt il 'taglia-DNA'
Dallo yogurt il ‘taglia-DNA’
Il CRISPR, nuovo metodo per tagliare e ricucire il DNA, è stato messo a punto dalla Danisco, un’industria alimentare danese, interessata a migliorare la produzione casearia studiando l’immunità adattativa di alcuni batteri. Può sostituire gli OGM, ma anche modificare il nostro genoma.
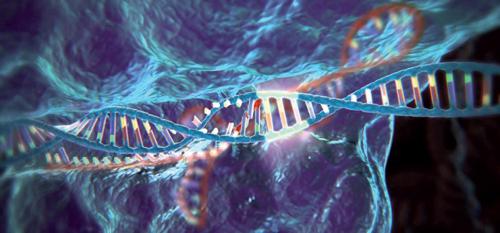
È stato individuato e perfezionato un metodo quasi infallibile per tagliare una molecola di DNA in punti specifici prefissati dallo sperimentatore, aprendo così la strada a una vera e propria rivoluzione nel campo della biologia sperimentale, tanto dal punto di vista scientifico e tecnologico, quanto da quello economico e sociale. Il nuovo metodo può servire, infatti, a eliminare specifici difetti genetici in cellule o in organismi interi, oppure, al contrario, a creare nuove mutazioni da studiare o selezionare, agendo in vitro, in vivo o anche in una popolazione naturale. Si presta inoltre particolarmente bene a modificare e ‘ingegnerizzare’ interi genomi.
Appena scoperta la struttura del DNA ci si è resi conto del fatto che il nastro a doppia elica da esso rappresentato può essere facilmente tagliato e ricucito, indipendentemente dalla specie biologica dalla quale è stato estratto, permettendo così la costruzione di molecole diverse da quelle originali e rendendo possibile la produzione di un’enorme vastità di nuove molecole di DNA. L’operazione può servire a introdurre lacune più o meno grandi in una specifica molecola di DNA, mimando così la comparsa di una mutazione; a produrre rimaneggiamenti assai più complessi all’interno di una stessa molecola; oppure infine a produrre una molecola che include anche parti di DNA appartenenti ad altre specie, comprese quelle batteriche. Quest’operazione di ‘taglia e cuci’, detta spesso in inglese cut and paste, ha condotto all’avvento delle biotecnologie a scopo di ricerca o a fini applicativi.
Per quanto possa sembrare strano, ricucire il DNA non è per niente difficile; il difficile è tagliarlo in punti specifici. Questa operazione è però cruciale, se si vogliono raggiungere obiettivi prestabiliti.
Occorre quindi affidarsi a sistemi in grado di riconoscere sequenze specifiche, più o meno lunghe, in una molecola di DNA, e tagliare la stessa in corrispondenza di quelle. Negli ultimi 30 anni per fare quest’operazione sono stati per lo più usati i cosiddetti enzimi di restrizione. Tali enzimi sono prodotti dalle cellule di molti ceppi batterici per frammentare, e quindi inattivare, il DNA di virus batterici invasori. Ogni tipo di enzima di restrizione è in grado di tagliare il DNA sempre e soltanto in corrispondenza di determinati motivi nucleotidici, lunghi tipicamente da 4 a 6 nucleotidi.
L’enzima di restrizione chiamato EcoRI, per fare un esempio, taglia il filamento di DNA solamente dove trova una sequenza del tipo GAATTC, mentre l’enzima di restrizione chiamato BamHI taglia il DNA solamente dove trova la sequenza GGATCC. È chiaro che se si taglia una molecola di DNA con un dato enzima, si può poi farla richiudere su se stessa con molta facilità; ma, ancora più importante, se si tagliano 2 diverse molecole di DNA con lo stesso enzima di restrizione è possibile poi congiungere l’una all’altra e produrre così una molecola ibrida che contiene un tratto dell’una e un tratto dell’altra. Un numero enorme di molecole ibride è stato prodotto negli anni con questo metodo, che però presenta anche qualche difetto. Per prima cosa, si può soltanto approfittare della presenza casuale di un certo
motivo nucleotidico in un dato punto di una molecola d’interesse; in secondo luogo, si rischia sempre di produrre frammenti di DNA troppo corti.
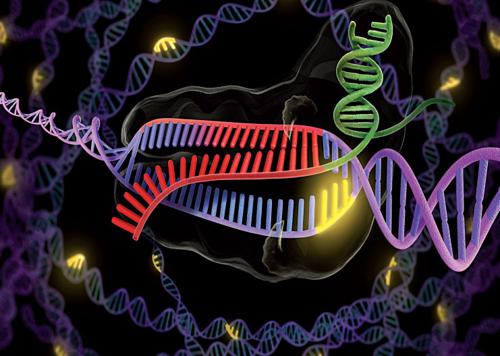
Ed ecco che adesso, sempre partendo dai batteri, è stata messa a punto una nuova metodica chiamata sistema CRISPR o, meglio, CRISPR/Cas, di uso pressoché universale, molto efficace e pratica. Per quanto riguarda gli enzimi di restrizione, la funzione di riconoscimento è inseparabile da quella di taglio.
Qua, invece, le due funzioni sono separate: la parte CRISPR è implicata nel riconoscimento delle sequenze, mentre la parte Cas (seguita da un numero, di solito 9) si riferisce alla funzione di taglio della molecola di DNA. CRISPR è un acronimo che sta per Clustered regularly interspaced short palindromic repeats, come dire ‘grappolo di corte sequenze ripetute aventi certe caratteristiche e distribuite uniformemente nel DNA’. Tra le diverse sequenze ripetute si trova spesso un breve tratto di DNA, chiamato spaziatore, la cui sequenza può essere decisa dallo sperimentatore a suo piacimento. Queste corte sequenze ripetute, con i loro spaziatori, possono essere prelevate dal DNA del batterio d’origine e inserite in posizioni specifiche del DNA della specie sulla quale ci interessa operare. Variando opportunamente la sequenza dello spaziatore si possono creare complessi CRISPR assolutamente specifici, che possono a loro volta essere inseriti dove si desidera. Il complesso CRISPR in questione può essere poi tagliato da una nucleasi (un enzima che taglia il DNA) specifica, la Cas appunto, il cui nome sta per CRISPR-associated.
Il riconoscimento e quindi il taglio sono assolutamente specifici e mediati da un’apposita molecola di RNA. Il metodo è piuttosto complicato da descrivere ed elaborato nella fase preparatoria, ma si rivela, invece, estremamente veloce ed efficace, oltre che non particolarmente costoso.
In estrema sintesi, s’inserisce in un punto prefissato del genoma della specie che interessa una sequenza che un enzima riconosce e taglia in maniera assolutamente specifica; la sequenza riconosciuta non deve essere necessariamente corta e può essere scelta a piacimento. La nuova tecnica permette di fare meglio ciò che già si faceva e di fare cose alle quali non si era proprio pensato prima.
Va detto che mentre le scoperte di biologia molecolare fatte fino a oggi sono maturate tutte in ambienti di ricerca per lo più pubblici e in parte privati, il sistema CRISPR è nato e cresciuto quasi totalmente in una company biotecnologica, la Danisco del gruppo DuPont, e questo introduce aspetti nuovi anche sul piano giuridico e sociale. In effetti, le prospettive sono eccitanti ma anche un po’ inquietanti. Con questa metodologia si possono fare tante cose buone e utili, ma anche un paio che fanno intravedere possibili sviluppi che non sappiamo dove ci condurranno.
Parliamo prima di quello che si sta facendo o si farà sulle piante. In questi ultimi decenni è stata prodotta una gran varietà di piante geneticamente modificate e chiamate perciò OGM, cioè Organismi geneticamente modificati, che mostrano le più diverse caratteristiche biologiche, in genere resistenze a questo o a quell’assalto di natura biologica o inconveniente di natura non biologica come siccità o freddo intenso. Molti sono stati commercializzati ma hanno incontrato l’ostinata resistenza psicologica di molte popolazioni, così che i governi ne hanno dovuto disciplinare la coltivazione e l’utilizzazione con leggi e decreti.
Le cose adesso potrebbero cambiare con l’immissione sul mercato di piante geneticamente modificate con queste nuove metodologie. Il punto in questione è se queste nuove piante possono essere considerate OGM, e quindi ricadere sotto le stesse leggi, oppure no.
Dal punto di vista della condizione biologica finale, queste nuove ipotetiche piante sono indistinguibili da quelle OGM: possiedono un genoma modificato ad arte per ottenere uno specifico scopo, produttivo, economico o nutritivo. Secondo gli scienziati sono innocue come gli OGM; secondo molta gente, invece, sono pericolose, per chi le mangia e per l’ambiente, e la loro diffusione va disciplinata.
Dal punto di vista della procedura seguita per ottenerle, queste nuove piante sono molto diverse dagli OGM, e molto più simili a quanto ottenuto per secoli dagli agricoltori ai quattro angoli del mondo. Non s’introduce un gene dall’esterno, dotato di determinate caratteristiche, né se ne toglie qualcuno che già c’era per rimpiazzarlo con un altro. Si sottopone, invece, una certa popolazione di piante a una ‘pioggia’ di modificazioni genetiche sostanzialmente casuali e si va a scegliere poi il gruppo di organismi che presenta, in laboratorio o sul campo, quelle caratteristiche che più si avvicinano agli obiettivi da raggiungere, come fanno da sempre gli agricoltori diciamo così tradizionali, ammesso che ce ne siano ancora.
La seconda prospettiva, forse ancora più inquietante, è rappresentata dalla possibilità di modificare il genoma umano, di poco o di tanto, nelle cellule somatiche ma anche nella linea germinale, così da rendere ereditabili le modificazioni. La cosa ha già ovviamente sollevato una molteplicità di dibattiti e molti altri ne solleverà. Il punto in discussione è che cosa modificare e in che direzione, sempre che si decida di modificare qualcosa del nostro genoma.
Breakthrough Prize, più ricco del Nobel
Se il Nobel assegna annualmente circa 900.000 dollari ai vincitori dell’ambito riconoscimento, ben più consistente, 3 milioni di dollari, è la cifra che viene riconosciuta dal Breakthrough Prize agli scienziati che maggiormente hanno determinato un progresso nelle scienze. Il Breakthrough Prize è un’iniziativa volta a stimolare la ricerca scientifica mondiale promossa da alcuni big della Silicon Valley, come Sergey Brin (Google) e Mark Zuckerberg (Facebook), e dall’imprenditore del commercio on-line Jack Ma (Ali baba Group) e molti altri ancora. Per ora esistono 3 settori di ricerca, Fisica, Scienza della vita (biologia) e Matematica, rispetto ai quali viene assegnato il premio, ma i vincitori possono essere più di 3, e più persone possono riceverlo per la stessa branca. Per esempio l’anno scorso ben 4 matematici, 3 fisici e 6 biologi hanno ricevuto 3 milioni di dollari ciascuno.
Tra i premiati della prima edizione del Breakthrough Prize anche un italiano, Napoleone Ferrara, direttore del Moores cancer centre alla Università della California a San Diego, per le scoperte in meccanismi dell’angiogenesi che hanno portato a terapie antitumorali. Nel 2015 il premio è andato, tra gli altri, a Jennifer Doudna, biochimica americana dell’Università della California a Berkeley e a Emmanuelle Charpentier, una microbiologa francese, che attualmente lavora all’Helmholtz centre for infection research di Braunschweig in Germania. A loro si deve l’idea di prendere in prestito il CRISPR/Cas, il taglia-DNA batterico, per usarlo al fine di eliminare qualsivoglia gene in qualunque cellula.
Le implicazioni etiche
Jennifer Doudna, una delle ricercatrici che ha messo a punto il nuovo tipo di editing genetico, è stata tra i primi scienziati a lanciare l’allarme: «È una tecnica troppo flessibile e semplice. Serve una discussione sulle sue implicazioni etiche; non si dovrà tentare di modificare la linea germinale degli uomini» perché «gli uomini non sono animali di laboratorio». Sulle riviste Science e Nature vengono pubblicati nel marzo 2015 degli appelli in favore di una moratoria internazionale sull’uso della nuova tecnica perché, a detta dei firmatari, gli scienziati e l’opinione pubblica devono avere il tempo necessario per approfondire tutte le implicazioni di questa tecnica rivoluzionaria, che potrebbe cambiare il DNA umano in modo tale da rendere ereditaria la manipolazione. Tale editing genetico potrebbe infatti servire a curare malattie genetiche, ma anche, sconfinando nell’eugenetica, ad accrescere la bellezza o l’intelligenza.
Fa discutere intanto la contemporanea notizia che in Cina, un team di ricerca dell’Università Sun Yat-sen di Canton, utilizzando proprio la tecnica CRISPR/Cas, ha modificato per la prima volta 86 embrioni umani per cercare di correggere il difetto che porta a una malattia rara, la beta talassemia. Di questi embrioni modificati ne sono sopravvissuti 71 e solo in una piccola percentuale è stata ottenuta la modifica voluta, mentre diversi altri hanno riportato modifiche indesiderate.
Proprio a causa dei dilemmi etici che questa ricerca comporta, le prestigiose riviste Nature e Science avevano respinto la pubblicazione dell’esperimento, tanto che il gruppo cinese aveva dovuto ripiegare su una rivista di secondo piano, Protein & cell.
Il batterio che ha fatto bene alla ricerca
Alla Danisco, industria danese del settore caseario del gruppo DuPont, lavoravano nel 2007 due tecnologi alimentari, Rodolphe Barrangou e Philippe Horvath, i quali, studiando gli Streptococcus thermophilus, i batteri che trasformano il latte in yogurt, si accorsero che quelli sopravvissuti all’attacco di virus conservavano nella loro discendenza una resistenza specifica a quegli stessi virus, avendo incorporato le sequenze CRISPR nel loro DNA: sostanzialmente Barrangou e Horvath avevano scoperto che tali batteri si erano dotati di una sorta di immunità adattativa basata sul sistema CRISPR.
400
gli articoli relativi al sistema CRISP/Cas pubblicati nell’arco di soli 5 anni dopo la pubblicazione di Barrangou e collaboratori apparsa su Science nel 2007.