elettrofisiologia del sistema nervoso
Elettrofisiologia del sistema nervoso
L’elettrofisiologia del sistema nervoso (SN) si occupa di studiare le proprietà elettriche dell’SN centrale e periferico. La misura e la caratterizzazione delle proprietà elettriche sono utilizzate per inferire la funzione delle singole cellule neuronali o di più neuroni interagenti e organizzati in reti di varia complessità. In questa disciplina, durante gli ultimi decenni si sono affiancate nuove tecniche di indagine al tradizionale studio dei tessuti neuronali in coltura. L’elettrofisiologo ha quindi a disposizione una vasta serie di strumenti, in vitro e in vivo, sia in modelli animali sia nell’uomo, per studiare le risposte elettriche di singoli neuroni e di reti complesse (circuiti). Ciò ha consentito importanti progressi nella comprensione del funzionamento del SN e nella diagnosi e terapia di malattie gravi neurologiche psichiatriche, come per es. il morbo di Parkinson o la depressione. [➔ codice di comunicazione neuronale; diagnostica strumentale neurofisiologica; elettroencefalografia; neurone; sinapsi]
I neuroni comunicano tra loro − o con cellule di natura non neuronale − grazie alla capacità di generare segnali elettrochimici a livello dei corpi cellulari, dove risiede il nucleo, e di trasmettere questi segnali, servendosi di speciali prolungamenti cellulari chiamati assoni. Il punto di contatto tra un assone e una cellula ricevente è chiamato sinapsi. A livello della sinapsi, il segnale è trasmesso tramite una sostanza chimica, il neurotrasmettitore, che viene rilasciato nell’ambiente extracellulare. La presenza di un recettore specifico sulla membrana del neurone ricevente rende possibile il passaggio dell’informazione. Comportamenti semplici di natura riflessa, come la risposta adattativa della pupilla al variare dell’intensità luminosa, o complessi, quali la percezione, il comportamento idoneo e orientato di un animale in presenza di un pericolo o di un oggetto di interesse, il ragionamento astratto, sono tutti controllati da un insieme più o meno vasto di neuroni che interagiscono tra loro in maniera coordinata. La misurazione e l’analisi delle strutture anatomiche, dei tempi di comunicazione neuronale e del tipo di segnali che le cellule nervose si scambiano, hanno numerose e utili ricadute in campo clinico.
Misura delle proprietà elettriche dell’SNC
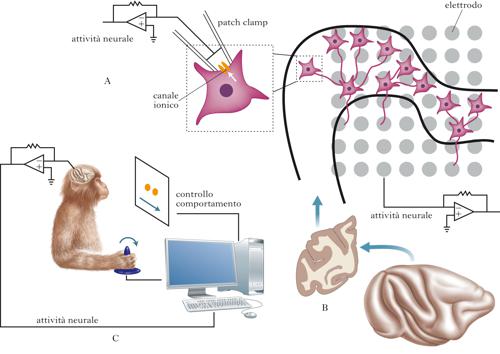
È possibile descrivere le proprietà elettriche del tessuto neurale grazie a metodi diretti o indiretti. I principali metodi diretti si basano sull’utilizzo di elettrodi di natura differente. Un elettrodo è genericamente formato da un conduttore solido (un metallo) o liquido (un elettrolita che riempie, per es., una pipetta microscopica di vetro). Gli elettrodi più frequentemente utilizzati sono quelli in metallo, di forma e dimensione differenti secondo la risoluzione spaziale necessaria per misurare il segnale. Così, si è soliti usare un sottile filo di metallo con una punta dell’ordine di poche decine di micron per studiare le variazioni elettriche della membrana di una singola cellula neuronale, o un disco di diversi millimetri di diametro quando è necessario evitare l’approccio invasivo ma ci si accontenta del contributo al segnale di diverse migliaia di neuroni, come avviene nel caso della registrazione del segnale neurale raccolto a livello dello scalpo (➔ elettroencefalografia). Le misure indirette sfruttano la capacità, intrinseca o potenziata in seguito all’uso di specifiche sostanze (cromofori), della membrana dei neuroni di modificare le sue proprietà di rifrangenza alla luce incidente al variare del potenziale. Metodi puramente ottici (senza utilizzo di cromofori), o basati su differenti sostanze opportunamente ingegnerizzate, sono stati usati per studiare le proprietà elettriche di cellule isolate, di sottili sezioni di tessuto cerebrale (studiate e tenute vitali in vitro) o di vaste regioni cerebrali, esposte in animali sperimentali e nell’uomo nel corso di procedure chirurgiche. Si fa riferimento a queste metodiche con il termine generico di optical imaging. Metodi invasivi per lo studio delle proprietà elettriche del tessuto nervoso sono utilizzati anche nell’uomo, nel corso di protocolli diagnostici e terapeutici. Il segnale elettrico cerebrale può essere derivato da elettrodi posizionati a diretto contatto con la corteccia (➔ elettrocorticografia) quando è necessario lo studio più dettagliato di alcune regioni cerebrali, di solito prima di eseguire interventi chirurgici per la rimozione di un focus epilettico. Gli stessi elettrodi possono essere usati anche per mappare funzionalmente le aree cerebrali, come nel caso della corteccia motoria. La stimolazione del tessuto nervoso nell’uomo è solitamente usata in maniera non invasiva per lo studio della conducibilità dei nervi periferici, anche se è sempre più frequente l’utilizzo di stimolatori cronici impiantati chirurgicamente in diverse regioni del cervello per il controllo di sintomi (per es., il tremore nel morbo di Parkinson) o il trattamento di dolore neuropatico. La magnetoencefalografia (➔) o MEG, metodica di non routinaria disponibilità a causa del costo elevato della strumentazione necessaria e delle difficoltà di gestione, misura in maniera del tutto non invasiva le variazioni del campo magnetico generate dalle variazioni del campo elettrico nel tessuto cerebrale ed è utilizzata soprattutto in ambito di ricerca per la delimitazione del focus epilettico.
Elettrofisiologia in vitro di singoli neuroni
A livello cellulare, l’attività elettrica dei neuroni può essere descritta dal movimento di cariche (ioni) a cavallo della membrana cellulare. Gli ioni principalmente coinvolti sono quelli di sodio (Na+), potassio (K+), calcio (Ca2+) e cloro (Cl–). Attraverso il doppio strato fosfolipidico, il movimento di cariche è possibile solo grazie alla presenza di proteine di membrana che formano pori o canali che attraversano la membrana stessa. La selettività relativa o assoluta dei canali, insieme alla differenza di concentrazione delle specie ioniche, al potenziale esistente ai due lati della membrana, alla regolazione basata sull’azione diretta di neurotrasmettitori o mediata da proteine (quali le proteine G leganti il guanosintrifosfato, GTP), determinano il flusso assoluto di cariche attraverso la membrana. Le proprietà funzionali dei singoli canali possono essere studiate grazie all’ausilio di tecniche specifiche quali quella del patch clamp, che, nella sua versione più semplice, permette di studiare le proprietà farmacologiche ed elettriche di discrete porzioni di membrana cellulare contenenti un solo canale. Alcune proprietà elettriche dell’intera cellula neuronale possono essere studiate con lo stesso strumento dopo la creazione di uno spazio citoplasmatico comune tra pipetta di vetro (con funzioni di elettrodo) e neurone. La tecnica del patch clamp, ideata da Erwin Neher e Bert Sakmann (che per questi studi furono insigniti del premio Nobel per la medicina o la fisiologia nel 1991), ha portato a risultati imprevisti, permettendo di approfondire su basi molecolari la conoscenza del processo di eccitabilità e trasmissione del segnale nervoso. Diversi canali ionici sono stati isolati e studiati ed è stato possibile dimostrare, per es., che nelle membrane non vi sono solo i canali per il Na+ e per il K+ con le caratteristiche previste dal modello matematico inizialmente proposto da Alan L. Hodgkin e Andrew Huxley (che per questi studi furono insigniti del premio Nobel per la medicina o la fisiologia nel 1963) per descrivere il processo di depolarizzazione della membrana, ma vi sono complesse famiglie di questi canali, oltre a canali per il Ca2+, il Cl–, e canali regolati dalla concentrazione di diverse specie ioniche. L’approccio in vitro, rivolto ai singoli canali o alle singole cellule neuronali, non può però studiare una delle caratteristiche peculiari del tessuto neuronale, coincidente con l’idea stessa di sistema in quanto formato da neuroni comunicanti. L’attività di un singolo neurone infatti ha poca influenza sull’attività elettrica di un neurone postsinaptico. Un neurone riceve sinapsi da migliaia di altri neuroni, e molti di questi input possono essere attivati in maniera sincrona e asincrona. Il modo in cui il neurone postsinaptico utilizza gli input ricevuti e modifica, di conseguenza, il proprio potenziale di membrana è il fondamento dell’integrazione neuronale e di quanto è racchiuso nell’espressione information processing nel cervello. Le proprietà di integrazione del cervello, che risiedono nella capacità di generare funzioni a partire dalla coordinata attività di popolazioni neuronali, sono investigabili grazie alla disponibilità di numerosi strumenti e modelli che sono tutti stati sviluppati, nell’evoluzione più recente della storia dell’elettrofisiologia, per lo studio dei neuroni organizzati in reti.
Studio dei circuiti neuronali tramite sezioni di tessuto cerebrale
Colture primarie di neuroni possono formare sinapsi e quindi permettere lo studio di circuiti semplici, che in ogni caso rappresentano estrazioni sperimentali in vitro degli originali circuiti neurali. La tecnica basata sullo studio di sottili sezioni di cervello mantenute vitali in vitro è stata ampiamente usata per studiare circuiti ben definiti dal punto di vista anatomico. Un preparato molto utilizzato è basato su sezioni ottenute da corteccia ippocampale ed entorinale. Una sola di queste sezioni può contenere almeno diecimila neuroni. Questa consistente popolazione neuronale organizzata in maniera ordinata, nei diversi strati e nei vari addensamenti neuronali che caratterizzano la corteccia ippocampale ed entorinale, può essere studiata con metodi elettrofisiologici tradizionali o meglio ancora con sistemi multielettrodici, dove matrici formate da elettrodi di silicio con punta metallica sono usate per analizzare le proprietà dinamiche e di integrazione di vaste aree della sezione. Un importante vantaggio delle sezioni in vitro, rispetto agli approcci di singola cellula o a popolazioni neuronali studiate in coltura, è quindi quello di poter esaminare le cellule neuronali nel rispetto della normale organizzazione citoarchitettonica e di connettività tra aree funzionali differenti. Un ulteriore vantaggio è quello di poter spesso identificare con sufficiente facilità gruppi neuronali rispetto ad altri anatomicamente adiacenti. Ne è un esempio la facile identificazione del locus coeruleus (importante centro troncoencefalico coinvolto, tra l’altro, nel controllo del ciclo sonno-veglia), nei preparati che lo comprendono, come gruppo di cellule translucide situate in prossimità del quarto ventricolo. Il principale svantaggio della metodica è che le sezioni e i circuiti in studio sono completamente isolati da input fisiologici o connessioni verso target esterni, come avviene invece nell’animale intatto. Nonostante questo, gli studi basati sull’uso delle sezioni di tessuto in coltura hanno permesso di meglio definire alcune caratteristiche delle reti neurali, inclusi alcuni meccanismi di regolazione sinaptica, plasticità e sviluppo, o la generazione e il mantenimento dei ritmi di scarica all’interno di reti neurali definite.
Studio in vivo dell’attività di popolazioni neuronali interagenti
La necessità di studiare l’SN in una situazione quanto più vicina possibile a quella reale ha portato allo studio delle proprietà elettriche del tessuto neurale in vivo, principalmente in animali da laboratorio. Il primo approccio, anche storicamente, è stato quello di registrare l’attività elettrica in animali anestetizzati. In questi preparati di laboratorio è stato possibile registrare i livelli di risposta dell’SN, sia periferico sia centrale, alle diverse tipologie di stimoli sensoriali. Molte conoscenze del funzionamento del sistema visivo, del sistema acustico o somatosensoriale derivano da questo approccio. David H. Hubel e Torsten Wiesel (premi Nobel per la medicina o la fisiologia nel 1981) hanno registrato l’attività di singoli neuroni a livello della corteccia visiva primaria del gatto anestetizzato, descrivendone l’organizzazione funzionale. Lo studio dell’animale in vivo è spesso multidisciplinare, basato sull’integrazione di metodiche di neuroanatomia (per es., l’uso di sostanze che una volta iniettate in un’area cerebrale sono trasportate dai neuroni verso il corpo cellulare seguendo il flusso assonico, comportandosi così da traccianti retrogradi, in grado di evidenziare connessioni funzionali) e di farmacologia (per es., la microdialisi e l’iniezione di sostanze attive) con metodiche standard di elettrofisiologia (stimolazione o registrazione con microelettrodi, e optical imaging). Lo studio nell’animale anestetizzato manca però della possibilità di comprendere le proprietà più emergenti dell’SN: le relazioni tra attività elettrica e controllo del comportamento. Questo significa che le metodiche in vivo su animali anestetizzati, rispetto a quelle in vitro, ci permettono di fare osservazioni sempre più accurate sull’organizzazione ‘di rete’ dell’SN, e a livelli sempre più complessi, ma sono ancora insufficienti per descrivere il funzionamento del sistema stesso, in partic. per quanto riguarda le relazioni tra attività neurale e comportamento. La possibilità di studiare le funzioni superiori, come quelle che permettono il ragionamento o le emozioni, richiede un ulteriore avanzamento metodologico. La registrazione di dati elettrofisiologici in maniera cronica (invasiva) in animali non anestetizzati offre questa possibilità. Grazie all’utilizzo di microelettrodi, inseriti in differenti regioni del tessuto neuronale, è possibile studiare il contributo di singoli neuroni registrando a livello extracellulare i potenziali d’azione (spikes). Lo stesso elettrodo permette l’accesso al risultato dell’integrazione dei segnali sinaptici, i cosiddetti potenziali locali (LFP, Local Field Potentials) in un volume corrispondente a circa 300 μm intorno alla punta dell’elettrodo. La metodica prevede, nella sua formulazione più avanzata, il controllo del comportamento con tecniche tipiche della psicologia sperimentale. La variabile controllata (per es., il tempo di risposta a un segnale visivo che richieda un adeguamento comportamentale) può essere così messa in relazione con la variabile dipendente (la frequenza di scarica dei neuroni isolati o le variazioni in ampiezza dell’LFP), permettendo di fare inferenze sul ruolo dell’area cerebrale nella determinazione della variabile controllata. Il metodo soffre però della mancanza di alcuni dei vantaggi disponibili nell’approccio in vitro, soprattutto se confrontato con lo studio su sezioni cerebrali. Spesso, infatti, non è possibile concludere nulla sulla natura dei neuroni in studio. Neuroni di proiezione e interneuroni sono tutti studiati allo stesso modo e solitamente considerati funzionalmente equivalenti. In alcuni casi, il neurone di proiezione può essere identificato grazie all’uso di metodi aggiuntivi quali la stimolazione antidromica, tecnica che prevede l’eccitazione del terminale assonico a livello della struttura target e la registrazione di uno spike evocato a livello dell’elettrodo registrante. Più difficile è distinguere un interneurone dai neuroni di proiezione e dalle altre classi di interneuroni presenti, anche se sono state proposte metodiche che si basano sulla differenza, all’interno di queste classi, di parametri quali la forma d’onda dello spike o la frequenza di scarica a riposo. È inoltre spesso necessario, anche quando la struttura viene indagata con un approccio multielettrodico, ottenere misure da un buon numero di neuroni prima di fare inferenze sulla relazione esistente tra attività della regione del cervello e comportamento in studio. Lo studio invasivo è solitamente limitato ad animali sperimentali.
Elettrofisiologia del sistema nervoso nell’uomo
Nell’uomo, se si escludono alcune procedure neurochirurgiche, l’elettrofisiologia dell’SN, sia centrale sia periferico, è per la maggior parte dei casi non invasiva e di pertinenza clinica. Le registrazioni di singole unità sono difficili da ottenere se non nel corso di interventi chirurgici, e certamente non sono utilizzate per lo studio sistematico del funzionamento dell’SN. L’approccio più diffuso è lo studio del segnale EEG ottenibile dallo scalpo (➔ elettroencefalografia). Il metodo soffre di problemi di risoluzione spaziale dovuti essenzialmente all’effetto filtro dei tessuti che il segnale deve attraversare prima di giungere all’elettrodo, ma ha un’ottima risoluzione temporale. La risoluzione spaziale può essere migliorata usando modelli realistici di volume conduttore, basati su dati di risonanza magnetica cerebrale ottenuti dallo stesso soggetto (EEG ad alta risoluzione). La registrazione dei cosiddetti potenziali evocati è basata sull’utilizzo del segnale EEG mediato e coincidente con la presentazione dello stimolo (acustico, visivo, somatosensoriale, ecc.). Lo studio della conducibilità delle fibre nervose è comunemente utilizzato per l’SN periferico. Le metodiche di stimolazione del tessuto nervoso, oltre a essere applicate in modi differenti in neurochirurgia per quelle che sono le esplorazioni utili a delimitare le zone funzionali nelle vicinanze di un tessuto patologico da rimuovere, vengono sempre più utilizzate per scopi terapeutici. Esempi già citati sono la stimolazione profonda di strutture specifiche, quali il nucleo subtalamico, per il trattamento del morbo di Parkinson, e la stimolazione epicorticale per il trattamento del dolore neuropatico, ma anche la stimolazione transcranica con uso di corrente continua (tDCS, Transcranial Direct Current Stimulation) e la stimolazione magnetica transcranica (TMS, Transcranial Magnetic Stimulation), entrambe proposte per il trattamento di disturbi dfifferenti, sino alla grave depressione, o di supporto alla terapia riabilitativa dell’ictus cerebrale. Stefano Ferraina