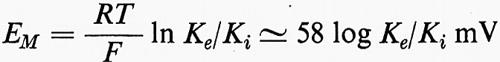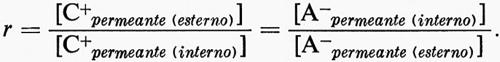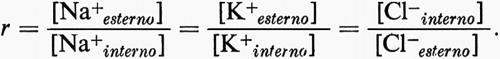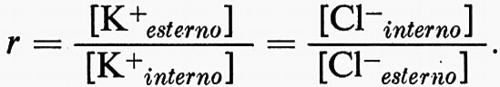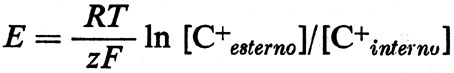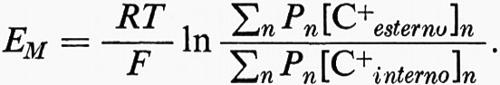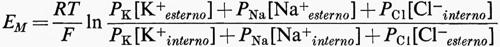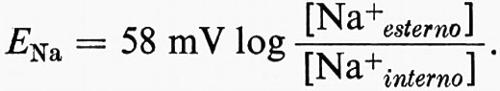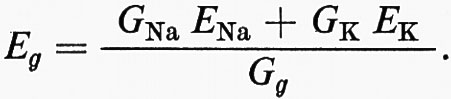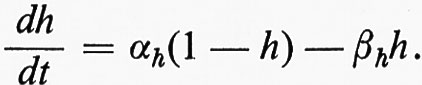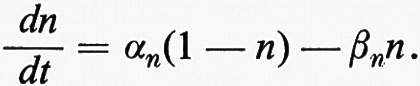Elettrofisiologia
Elettrofisiologia
di Harry Grundfrst
SOMMARIO: 1. Introduzione. □ 2. Profilo storico: a) il concetto di elettricità animale; b) teorie di Bernstein sulla funzione della membrana; c) l'era moderna; d) la teoria ionica della bioelettrogenesi; e) teorie che mettono in relazione elettrogenesi e trasmissione. □ 3. Struttura della membrana cellulare: a) la membrana come doppio strato lipidico; b) differenti funzioni della membrana cellulare; c) la membrana unitaria; d) capacità della membrana; e) differenze locali nelle proprietà della membrana. □ 4. L'ambiente della membrana cellulare. □ 5. Proprietà generali delle membrane cellulari: a) permeabilità all'acqua e ai sali; b) selettività della permeabilità ionica. □ 6. Evoluzione del neurone. □ 7. I generatori bioelettrici: a) elementi funzionali per la segnalazione elettrica; b) bioelettricità; la condizione di Donnan; c) bioelettricità; la relazione di Nernst-Planck. □ 8. La risposta delle membrane eccitabili: a) il potenziale d'azione; b) modalità d'origine del potenziale d'azione; c) batterie ioniche per il generatore e l'elettrogenesi sinantica; d) altre batterie ioniche; e) caratteristiche lineari; f) caratteristiche non lineari; g) caratteristiche del blocco di voltaggio di una membrana che genera potenziali d'azione; h) caratteristiche generali del blocco di voltaggio; i) fondamento e significato delle caratteristiche a pendenza negativa. □ 9. Manifestazioni elettrofisiologiche di differenti processi elettrogenici: a) specie ioniche nell'elettrogenesi del potenziale d'azione; b) induzione dell'elettrogenesi del potenziale d'azione per uno spostamento di E0; c) risposte di inattivazione. □ 10. Eventi della membrana durante l'elettrogenesi: a) ‛chiuse' e canali; b) separazione dei canali ionici; c) la permeabilità selettiva dei diversi canali; d) densità dei canali; e) funzionamento delle ‛chiuse' dei canali eccitabili elettricamente; f) funzionamento delle ‛chiuse' dei canali non eccitabili elettricamente; g) processi in altre membrane recettrici; h) trasmissione per diminuzione della conduttanza. □ 11. Conclusione. □ Bibliografia.
1. Introduzione.
Gli animali, attraverso il loro sistema nervoso, ricevono ed elaborano informazioni che riguardano la loro sopravvivenza, il loro nutrimento e altri aspetti della vita. La mobilità di moltissimi animali dotati di un sistema nervoso contrasta nettamente con la modalità generalmente sessile di vita delle piante, che mancano di un siffatto sistema o di vari tipi di muscolatura. In virtù della loro mobilità gli animali possono sopravvivere nonostante l'assenza della robusta struttura protettiva che è caratteristica delle piante. In verità, i primitivi animali dotati di armatura nella competizione evoluzionistica cedettero a forme che mantennero solo un leggero scheletro interno, nei Vertebrati, e un esoscheletro, negli Artropodi. La mobilità è acquisita per mezzo di giunture articolari attraverso muscoli scheletrici organizzati in modo complicato e finemente controllati dal sistema nervoso.
I vantaggi della mobilità sono raggiunti assai bene, tuttavia, solo se l'animale può reagire rapidamente allo stimolo, e soltanto un sistema di comunicazione elettrica può rispondere a questa esigenza. Così l'elettrofisiologia riguarda fondamentalmente la particolare capacità di cellule eccitabili elettrogeniche di subire cambiamenti del loro stato elettrico in risposta a stimoli appropriati. Suscitano soprattutto interesse quelle varietà di elettrogenesi che riguardano e rendono possibile il funzionamento del sistema nervoso, la cui unità predominante è il ‛neurone'. I ‛neuroni recettori' o ancora più specializzate ‛cellule recettrici' che sono in connessione con i neuroni percepiscono specifici mutamenti dell'ambiente interno o esterno (v. Grundfest, The general electrophysiology..., 1971). L'informazione che riguarda l'intensità e la durata dello stimolo è quindi codificata come potenziali d'azione (‛potenziali a punta'), che si propagano lungo la fibra nervosa (assone) del neurone fino a punti appropriati nel sistema nervoso. Qui l'informazione è trasmessa ad altri neuroni ed eventualmente prosegue per manifestarsi infine come comandi perentori a vari organi specializzati, come muscoli e ghiandole.
I movimenti controllati e programmati per via nervosa vengono eseguiti dalle fibre muscolari. Comandi, provenienti dai nervi che li innervano, generano nei muscoli segnali elettrici, provocando attività contrattile. Elettroplacche, cellule derivate generalmente da fibre muscolari che hanno perduto il loro meccanismo contrattile, costituiscono le unità elettrogeniche di organi elettrici che vengono utilizzati da alcuni pesci elettrici per difesa, per attacco, o come mezzi di locomozione. Anche l'attività di cellule sensoriali e secretive può essere accompagnata da elettrogenesi. L'analisi del funzionamento di questo insieme di sistemi è lo scopo della neurofisiologia, che è la parte pratica più importante dell'elettrofisiologia.
Le capacità specializzate delle cellule elettrogeniche riflettono una serie di proprietà generali che derivano dalla capacità della cellula di cambiare la sua permeabilità a varie sostanze, e particolarmente a ioni, in modi ben specifici e stereotipati.
Così, l'elettrofisiologia generale, in relazione a studi comparati, permette di penetrare più profondamente nella natura della bioelettrogenesi e nel suo substrato fisico, cioè la membrana cellulare. L'elettrofisiologia generale e comparata, concentrata sull'analisi del comportamento della membrana cellulare, ha approfondito le conoscenze delle sue proprietà e capacità fondamentali assai più delle scarse informazioni che sono a nostra disposizione sulla sua struttura fine e sulla sua chimica.
2. Profilo storico.
Le principali idee che dettero sviluppo all'elettrofisiologia sono brevemente delineate da Grundfest (v., Excitation at..., 1957). I due fondatori della moderna elettrofisiologia, C. Matteucci (v., 1844) ed E. Du Bois-Reymond (v., 1848-1849), nelle loro monografie dettero dei resoconti pressoché contemporanei della prima parte della storia.
a) Il concetto di elettricità animale.
Assai prima che si scoprisse l'elettricità, era noto che toccare alcuni pesci, la torpedine (Torpedo), il pesce gatto elettrico (Malapterurus) e il gimnoto (Electrophorus), poteva provocare dolore o anche essere pericoloso. Tali pesci erano definiti ‛fulminanti' nelle varie lingue, ma gli scienziati del XVII e dell'inizio del XVIII secolo specularono vanamente sulla natura della loro forza, finché B. Franklin ed altri svilupparono la teoria di un ‛fluido' elettrico (v. Grundfest, The mechanisms..., 1957). Galvani, osservando che un muscolo di rana si contraeva quando esso ed i suoi nervi venivano connessi tramite un arco metallico, giunse alla conclusione che il metallo chiudeva un circuito che permetteva un flusso di un fluido elettrico contenuto nei tessuti. Volta, che dapprima appoggiò questa affermazione, contrastò in seguito decisamente l'interpretazione di Galvani. Egli sostenne che i contatti tra i due diversi metalli nell'‛arco' di Galvani e il tessuto davano luogo a una differenza di potenziale che stimolava il nervo o il muscolo. Questa era, in effetti, la spiegazione degli originali esperimenti di Galvani del 1789, e per dimostrare che l'elettricità poteva essere generata da contatti di superfici di due diversi metalli con un sale, Volta giunse a inventare la pila elettrochimica, che egli trionfalmente denominò ‟un organo elettrico artificiale". Questo contributo di Volta fu così rilevante e di così grande importanza per ulteriori ricerche che gli esperimenti di Galvani furono ignorati.
L'‛elettricità animale' divenne sospetta anche se Galvani aveva dimostrato nel 1797 che contrazioni possono avvenire anche in assenza di metalli, toccando un nervo del corpo di un animale. Vennero anche ignorate le dimostrazioni che gli organi elettrici dei pesci elettrici di fatto generano una corrente elettrica.
Il progresso che seguì la scoperta della pila da parte di Volta condusse a miglioramenti nelle misurazioni elettriche. L'invenzione del galvanometro da parte di L. Nobili risuscitò interesse per l'elettricità animale intorno al 1827. Matteucci (v., 1844) e Du Bois-Reymond (v., 1848) trovarono una netta differenza di potenziale quando un elettrodo era sistemato su un nervo intatto o su un muscolo, e l'altro posto su una parte lesa (tagliata, bruciata o schiacciata) di tessuto. Questo potenziale di ‛lesione' o di ‛demarcazione' fu esattamente interpretato da Du Bois-Reymond come manifestazione di una negatività interna nella cellula a riposo. Esso è, in effetti, il potenziale di riposo, attenuato perché il flusso di corrente tra le parti lese e quelle intatte è in una certa misura messo in corto circuito dalla bassa resistenza del tessuto inerte e del liquido interposti tra gli elettrodi.
Si scoprì, inoltre, che il potenziale di lesione diminuiva quando il tessuto veniva stimolato, e Du Bois-Reymond concluse che il nervo o il muscolo generavano impulsi i quali facevano sì che l'elettrodo che si trovava su un tessuto intatto divenisse negativo rispetto allo stato di riposo e che gli stessi impulsi viaggiavano nel nervo dal punto di stimolazione al sito di innervazione del muscolo. La velocità secondo la quale l'impulso o il potenziale d'azione si muoveva lungo il nervo fino ad eccitare il muscolo venne misurata da Helmholtz (v., 1850). La forma dell'impulso fu più difficile da determinarsi a causa dell'estrema lentezza dei galvanometri del tempo. Tuttavia, Bernstein (v., 1868) usando il reotomo differenziale riuscì a eseguire tali misure (v. fig. 1). Du Bois-Reymond (v., 1877) suggerì che l'impulso era dovuto al riorientamento delle ‛molecole elettriche' nella cellula intatta.
b) Teorie di Bernstein sulla funzione della membrana.
La teoria della ‛molecola elettrica' di Du Bois-Reymond sul potenziale d'azione implicava l'esistenza di uno strato di superficie. La funzione della membrana nella bioelettrogenesi venne formulata da Bernstein in due tempi (v., 1902 e 1912). Nel primo si occupò dell'origine del potenziale di riposo, che egli sviluppò dalle ricerche di elettrochimica di Nernst e di altri. Bernstein avanzò l'ipotesi che il confine della cellula o membrana non era una barriera assoluta al movimento di ioni e che la mobilità del K+ era più alta di quella degli altri ioni. Tale condizione dovrebbe dare luogo ad una differenza di potenziale (EM) come previsto da Nernst e Planck nell'ultimo decennio del secolo scorso (v. MacInnes, 1961):
in cui R è la costante dei gas, T è la temperatura assoluta, F è il Faraday. L'interno della cellula contiene molto più K+ di quanto sia presente nel mezzo esterno. Così, EM, il potenziale di riposo, dovrebbe essere all'interno negativo, confermando l'interpretazione data da Du Bois-Reymond del potenziale di lesione.
Nel secondo momento della sua indagine Bernstein avanzò l'ipotesi che, quando uno stimolo eccita una regione localizzata della membrana, quest'ultima cambia così da diventare più o meno egualmente permeabile a tutti gli ioni. La polarizzazione di riposo con la negatività interna allora scompare e la membrana nella zona di attività diventa depolarizzata. Poiché l'impulso nasce laddove uno stimolo elettrico depolarizza l'interno della cellula, fu così anche possibile render conto del fatto che quando l'impulso è generato esso può eccitare altre regioni ed essere quindi causa della sua propagazione.
Il fatto che la membrana eccitata diviene più permeabile agli ioni fu dimostrato (v. fig. 2) da misurazioni con un ponte in c. a. (v. Cole e Curtis, 1939). Il ponte veniva bilanciato per la resistenza della fibra a riposo. Quando era generato un impulso il ponte diveniva sbilanciato nella direzione di una diminuita resistenza o di una aumentata conduttanza. Il decorso temporale dello sbilanciamento, nell'assone di anfibio, è quasi identico al decorso temporale del potenziale d'azione. Nel calamaro, tuttavia, c'è una notevole differenza. Come sarà descritto più avanti, tali differenze denotano diversità nelle cinetiche dei processi elettrogenici dei due assoni, che portano a differenze nell'ampiezza e nella forma dei potenziali d'azione di cellule diverse.
Bernstein (v., 1868) aveva osservato originariamente che il picco dell'impulso nervoso rappresenta un'inversione di polarizzazione della membrana da una negatività interna ad una positività interna (v. fig. 1A). Sebbene questo fatto venisse confermato da altri (v. Grundfest, Julius Bernstein..., 1965), la più recente teoria di Bernstein (v., 1912) implicava che la polarizzazione negativa interna a riposo semplicemente spariva in corrispondenza del picco del potenziale d'azione (v. fig. 1B) e questa erronea formulazione venne ad essere generalmente accettata insieme alle sue esatte osservazioni fondamentali sulla funzione della membrana e sulle permeabilità ioniche. Ad eccezione di pochi ricercatori, i neurofisiologi del tardo Ottocento e del primo Novecento erano soprattutto concentrati sull'analisi del funzionamento del sistema nervoso. Tuttavia, strumenti elettronici, quali amplificatori e l'oscillografo a raggi catodici, divennero disponibili dopo la prima guerra mondiale. Erlanger e Gasser, che per primi applicarono questi due nuovi strumenti nello studio del potenziale di azione del nervo (v. Erlanger e Gasser, 1937), concentrarono la loro attenzione ancora sull'impulso nervoso.
c) L'era moderna.
La scoperta dell'assone gigante di calamaro (v. Young, 1936) ha offerto un preparato molto favorevole per l'applicazione della nuova tecnica ed i nuovi dati, con la dimostrazione che la membrana diventa positiva all'interno durante il potenziale d'azione (v. Hodgkin e Huxley, 1939 e 1945; v. Curtis e Cole, 1942), hanno rivoluzionato la struttura concettuale dell'elettrofisiologia. La teoria di Bernstein sulla membrana fu perfezionata soprattutto dal lavoro di Hodgkin e dei suoi colleghi (v. Hodgkin e Katz, 1949; v. Hodgkin, Huxley e Katz, 1952; v. Hodgkin e Huxley, Currents carried..., e A quantitative description..., 1952).
Con gli studi sugli assoni di calamaro la singola cellula era diventata un agevole oggetto di indagine. In breve tempo, inoltre, gli stessi metodi furono applicati ad altre cellule - neuroni, assoni, fibre muscolari, cellule ghiandolari, elettroplacche e recettori. È doveroso ricordare, tuttavia, che fondamentali contributi furono dati in studi più antichi condotti su preparati meno favorevoli. Hermann (v., 1879 e 1899) aveva dedotto precisamente la modalità con la quale una corrente elettrica applicata si diffonde lungo la fibra nervosa (elettrotono) ed aveva anche avanzato l'idea che è il propagarsi della corrente associata al potenziale d'azione che permette all'impulso di eccitare nuovi punti della fibra. Ciò fu confermato molti anni più tardi da Hodgkin (v., 1937) sul nervo di rana. Similmente, la conduzione saltatoria negli assoni mielinici di Vertebrati che era stata prevista da R. S. Lillie (v., 1925) fu dimostrata da Erlanger e Blair (v., 1934) e subito dopo in modo ancor più convincente da Tasaki (v., 1959) e confermata da Huxley e Stämpfli (v., 1949). Hodgkin (v., 1938) dimostrò la presenza di un'elettrogenesi subliminare (risposta locale), precedente alla comparsa del potenziale d'azione.
d) La teoria ionica della bioelettrogenesi.
La scoperta fatta nell'assone di calamaro che durante il potenziale d'azione la membrana rovescia la sua polarità portò ad una trasformazione della teoria della membrana di Bernstein in una più largamente accettata, e cioè la teoria ionica (o dell'Na+) di Hodgkin e Huxley (v., A quantitative description..., 1952; v. Hodgkin, 1964). Come Bernstein aveva proposto, la conduttanza della membrana aumenta quando c'è uno stimolo sufficienterncnte ampio (soglia o soprasoglia), ma l'aumento è di natura specifica. Nell'assone di calamaro e in molte altre cellule, la permeabilità della membrana all'Na+ aumenta. Come sarà chiarito più avanti, la accresciuta permeabilità all'Na+ (dovuta al processo denominato attivazione dell'Na+) porta la membrana a depolarizzarsi. La depolarizzazione aumenta l'attivazione dell'Na+ che a sua volta provoca una depolarizzazione maggiore. Quest'ultima è terminata da altri due processi, entrambi controllati dall'elettrogenesi depolarizzante che risulta dall'attivazione dell'Na+. Una diminuzione della conduttanza all'Na+ è indotta dalla inattivazione dell'Na+ depolarizzante, e si verifica un aumento nella conduttanza al K+ (attivazione del K+ depolarizzante).
La teoria ionica è stata recentemente estesa fino a comprendere altri fenomeni elettrogenici e la maggior parte di quelli noti al presente possono essere spiegati in base ad essa (v. Grundfest, Excitation triggers..., Electrical inexcitability..., e The mechanisms..., 1957; Ionic mechanisms..., e General physiology..., 1961; The general electrophysiology..., e The varieties..., 1971). La membrana cellulare sembra contenere un insieme di ‛canali' o ‛pori' che sono piuttosto specificamente selettivi per differenti ioni. Tali canali sono aperti o sbarrati da ‛chiuse' che rispondono ad appropriati stimoli. Le ‛chiuse' elettricamente eccitabili sono aperte (attivate) o sbarrate (inattivate) da mutamenti nel campo elettrico attraverso la membrana. Le ‛chiuse' elettricamente ineccitabili rispondono solo a stimoli specifici (chimici, meccanici, luminosi o termici).
e) Teorie che mettono in relazione elettrogenesi e trasmissione.
Le scoperte del generatore elettrostatico e della bottiglia di Leida hanno consentito di dimostrare che nervo e muscolo possono essere eccitati da stimoli elettrici. L'elettrofisiologia classica si concentrò quindi sulle risposte agli stimoli elettrici e, in verità, giunse a generalizzare il punto di vista per cui tutte le forme di eccitabilità potrebbero essere spiegate in termini di attività elettrica del nervo e del muscolo. Così, sulla scia delle scoperte di Galvani e quasi 100 anni più tardi, W. Kühne ritenne che un muscolo è spinto a contrarsi dalla ‛corrente di azione' del nervo. Questa teoria della trasmissione elettrica fu criticata da Du Bois-Reymond (v., 1877), ma fu poi generalmente accettata. Nel 1849 Cl. Bernard aveva dimostrato che il curaro bloccava la trasmissione dal nervo al muscolo senza intaccare la sensibilità dei due tessuti agli stimoli elettrici. Tuttavia, l'implicazione di questo fatto fu ignorata per quasi mezzo secolo. Quando questo fatto venne ripreso in esame dal punto di vista teorico, K. Lucas avanzò l'ipotesi che il curaro bioccasse la sensibilità di un ipotetico tessuto funzionante come intermediario tra le fibre nervose e quelle muscolari. L. Lapicque, d'altra parte, pensò che il farmaco inducesse un contrasto (eterocronismo) nelle caratteristiche temporali di eccitabilità dei due tessuti, prolungando grandemente la ‛cronassia' delle fibre muscolari. Si dimostrò che entrambe le teorie erano inesatte.
Nella sua critica della trasmissione elettrica dal nervo al muscolo Du Bois-Reymond aveva proposto l'alternativa che la trasmissione potesse coinvolgere la liberazione secretoria di un agente dalle terminazioni nervose. All'inizio del secolo Th. R. Elliott riprese tale ipotesi per spiegare gli effetti dell'adrenalina nei gangli simpatici, ed in seguito trovò sostenitori in Loewi, Dale, Cannon e Rosenblueth (v. Rosenblueth, 1950). La maggior parte degli elettrofisiologi, tuttavia, rimase legata alla teoria della trasmissione elettrica.
La teoria della trasmissione elettrica a livello della sinapsi, è stata ora abbandonata in favore della trasmissione chimica. La prova fondamentale di quest'ultima opinione deriva dalla scoperta che la zona recettrice specializzata della membrana nelle sinapsi come nei neuroni sensoriali è ‛elettricamente ineccitabile' (v. Grundfest, Electrical inexcitability..., 1957; General physiology..., 1961; Comparative electrobiology..., 1966). Stando così le cose, è obbligatoria una trasmissione chimica. Essa è realizzata dalla liberazione di un trasmettitore dalle terminazioni presinaptiche del nervo (v. sinapsi; v. neurone e impulso nervoso).
La trasmissione elettrica avviene (v. Grundfest, Synaptic..., 1959; General physiology..., 1961) in ‛giunzioni efaptiche' con resistenza relativamente bassa, ma è rara nel sistema nervoso centrale. La trasmissione efaptica può essere funzionalmente valida come mezzo per accelerare e/o sincronizzare le risposte di un gruppo di cellule (v. Bennett, 1966; v. Grundfest,. 1967; per notizie relative alle pubblicazioni meno recenti, v. Grundfest, Excitation at..., 1957).
3. Struttura della membrana cellulare.
Circa il 20% del contenuto della cellula vivente è costituito da macromolecole che sono estremamente caratteristiche della specie, del tipo cellulare e dello stato metabolico dell'animale. Queste macromolecole si trovano nella membrana cellulare. Nella maggior parte delle cellule esse hanno carica prevalentemente negativa. Come vedremo, la predisposizione verso gli anioni è un fattore significativo nell'elettrofisiologia delle cellule eccitabili.
a) La membrana come doppio strato lipidico.
Sebbene gli elettrofisiologi del XIX e dei primi del XX secolo ritenessero che la superficie della cellula elettrogenica fosse una barriera elettrica, selettivamente permeabile a certi ioni, essi non possedevano mezzi per descrivere la struttura della superficie di questa cellula. In verità, fino all'avvento del microscopio elettronico, la vera esistenza di una membrana cellulare, diversa nelle sue proprietà dal citoplasma, era fortemente discussa sia da citologi sia da fisiologi. Nondimeno, ed anche prima che il microscopio elettronico mettesse in evidenza l'esistenza della membrana, dati chimici (v. Gorter e Grendel, 1925) e considerazioni fisicochimiche relative alla permeabilità della cellula a vari agenti (v. Davson e Danielli, 1943) portarono alla conclusione che la superficie cellulare dovesse essere fondamentalmente una palizzata di molecole lipidiche, probabilmente fosfolipidi, sistemati come un doppio strato (v. fig. 3A). Si suppone che le estremità polari idrofile delle molecole formino le superfici esterne della membrana, mentre le estremità idrocarburiche idrofobe dei due strati siano disposte l'una di fronte all'altra e formino la regione centrale. Studi recenti sulle membrane lipidiche a due strati (v. Mueller e Rudin, 1968 e 1969) confermano questa struttura generale. Infatti quando certi additivi sono incorporati in queste membrane, essi imitano in modo straordinario il comportamento delle membrane viventi.
b) Differenti funzioni della membrana cellulare.
All'inizio di questo secolo Sherrington (v., 1906, p. 17) delineò quanto pensava sulle capacità della membrana cellulare. ‟Una tale superficie può frenare la diffusione, arginare la pressione osmotica, limitare il movimento degli ioni, accumulare cariche elettriche, sostenere un doppio strato elettrico, cambiare forma e tensione superficiale con mutamenti di differenza di potenziale, o cambiare la differenza di potenziale con mutamenti di tensione superficiale o di forma, oppure intervenire come una membrana tra soluzioni diluite di elettroliti a diversa concentrazione o sospensioni colloidali con diversi segni di carica". Solamente l'effetto prodotto da variazioni dello stato elettrico sulla ‟forma e sulla tensione superficiale" non è stato visto in modo chiaro sperimentalmente, e questo probabilmente a causa di difficoltà tecniche (v. Barry, 1970).
c) La membrana unitaria.
Per spiegare le capacità funzionali della membrana, per es. come luogo di attività enzimatica, si suppone che essa sia costituita da due superfici lipidiche sovrapposte, ricoperte da macromolecole proteiche di forma globulare (v. fig. 3B) o, più probabilmente, con una configurazione estesa (elicoidale e/o a spirale irregolare, v. fig. 3C). Tale complesso è stato definito da Robertson (v., 1960) ‛membrana unitaria'. Il rivestimento delle due superfici può essere uguale o diverso, cosicché la membrana può rispondere in modo asimmetrico a un dato stimolo o può essere sensibile in maniera diversa ad agenti chimici secondo che questi siano applicati dall'esterno o dall'interno. Sono state avanzate varie ipotesi su questa struttura basale, come pure sono state fatte speculazioni sulla composizione dei componenti lipidici. Numerosi autori hanno discusso sull'intero concetto della struttura della membrana unitaria: una revisione critica dell'argomento pro e contro il concetto di membrana unitaria è stata fatta da Hendler (v., 1971); Malhotra (v., 1970) ha passato in rassegna i dati sulla struttura e sulla chimica delle membrane cellulari, mentre i dati dell'analisi ai raggi X della struttura della membrana sono riassunti da Worthington (v., 1971). È stata anche operata un'ampia rassegna sulla selettività ionica delle membrane cellulari (v. Diamond e Wright, 1969). Discussioni di membrane modello si troveranno in Bangham (v., 1968), Mueller e Rudin (v., 1969). e Haydon e Hladky (v., 1972): Goldman (v., 1971) ha delineato i requisiti per modelli di membrane eccitabili. Due recenti lavori sulle proprietà elettriche di membrane a due strati cariche e non cariche (v. i contributi di Muller e Finkelstein, 1972) offrono un'eccellente presentazione di dati sperimentali e di posizioni teoriche in questo campo. In conclusione, la maggior parte dei risultati sperimentali è a favore del concetto di membrana unitaria.
Poiché sia le componenti lipidiche sia quelle proteiche dell'unità di membrana sono molecole grandi con varie cariche ioniche distribuite entro le loro strutture, la membrana è ‛carica' ed ha proprietà che scaturiscono da questa circostanza (v. Teorell, 1953 e 1956). Membrane cariche sono ‛scambiatori di ioni', sistemi elettrochimici la cui teoria si è molto ben sviluppata per il loro ampio impiego nella tecnologia (v. Helfferich, 1962; v. Eisenman, 1962 e 1969).
Nelle fotografie al microscopio elettronico di tutte le cellule che sono state studiate finora la membrana cellulare appare come una struttura a tre strati, ma i dettagli delle sue dimensioni e l'aspetto variano molto a seconda del metodo di preparazione. In generale la membrana unitaria è costituita da una coppia di ‛binari ferroviari' elettron-densi, separati da una zona di minore densità; lo spessore totale varia da circa 60 Å a 120 Å.
La membrana unitaria ha essenzialmente lo stesso aspetto in tutte le cellule e in ogni punto della stessa cellula. Questo è in forte contrasto con le numerose differenze fisiologiche e farmacologiche che si possono intravedere entro la superficie di una data cellula e tra differenti tipi di cellule. Tuttavia, in un recente lavoro Cartaud e altri (v., 1971) comunicano che quando la membrana di elettroplacche di gimnoto è ridotta in frammenti, forma due specie di ‛microsacchi', alcuni ricchi di attività adenosintrifosfatasica (ATPasi) ed altri ricchi in acetilcolinesterasi: il primo tipo ha un'‛unità di membrana' dello spessore di circa 110 Å (v. fig. 4), mentre la membrana del secondo ha una struttura ‛sottounitaria' con elementi globulari di circa 40 Å di diametro che hanno rivestimenti elettron-densi e parti interne meno dense.
d) Capacità della membrana.
Le catene idrofobe nel doppio strato lipidico formano un isolante che ha una costante dielettrica (ε) variamente valutata tra 2 e 7. Così, la membrana si comporta come una capacità che è determinata dallo spessore (δ) del doppio strato in rapporto alla relazione:
C (10-12 Farad) = ε/4πδ.
In molte cellule C = 1 μF/cm2. Poiché la membrana è permeabile almeno in parte ai vari ioni, essa è anche un conduttore elettrico a resistenza piuttosto elevata. Così, il circuito equivalente della membrana è quello di un condensatore in parallelo con una resistenza (v. fig. 10). La capacità rimane essenzialmente immutata in ogni condizione nella cellula vivente, ma la resistenza varia con il variare della permeabilità della membrana ai diversi ioni in risposta agli stimoli.
e) Differenze locali nelle proprietà della membrana.
Sebbene la membrana abbia lo stesso aspetto generale in ogni cellula, il che indica l'esistenza di qualche principio comune nella sua costruzione, essa è, tuttavia, una struttura labile ed eterogenea. Per es., il sistema tubulare trasverso (STT) del muscolo è un sistema estesamente ramificato di invaginazioni della membrana cellulare entro la fibra muscolare. Esso è probabilmente coinvolto nel processo di accoppiamento eccitazione-contrazione che dà al muscolo il segnale di contrazione. Nelle fibre muscolari di Artropodi le regioni terminali dell'STT possono essere costituite in modo da rigonfiarsi rapidamente a seguito della fuoriuscita di Cl- dalla cellula (v. Girardier e altri, 1963), e il rigonfiamento dà luogo a un ampio aumento dell'area della membrana delle terminazioni; inoltre, il rigonfiamento può essere invertito nel muscolo del gambero attraverso un flusso di Cl- nella direzione opposta (v. fig. 5), e questo è collegato con un restringimento dell'area di superficie della membrana. Questi mutamenti reversibili nell'area della membrana implicano che il materiale che forma la membrana può essere mobilitato e incorporato o eliminato, come richiesto, entro un breve intervallo di tempo (v. Brandt e altri, 1968). Presumibilmente il materiale è disponibile entro il citoplasma della cellula. Un altro esempio è il cambiamento nelle proprietà farmacologiche e fisiologiche che avviene nella membrana delle fibre muscolari di Vertebrato quando esse siano denervate (v. Thesleff, 1960; v. Redfern e Thesleff, 1971; v. Fambrough, 1970). Questi mutamenti possono essere ritardati da agenti che agiscono sulla sintesi delle proteine (v. Fambrough, 1970; v. Grampp e altri, 1972). È verosimile che gli agenti che bloccano la sintesi proteica alterino le proprietà della membrana privandola di una sorgente di materiale di recente produzione. Mentre la composizione dei siti attivi sulla membrana cellulare non è ancora definita, studi recenti sul recettore dell'acetilcolina di elettroplacche di gimnoto rivelano un'affinità abbastanza omogenea, dovuta a un complesso dimerico di circa 42.000 di peso molecolare (v. Reiter e altri, 1972).
4. L'ambiente della membrana cellulare.
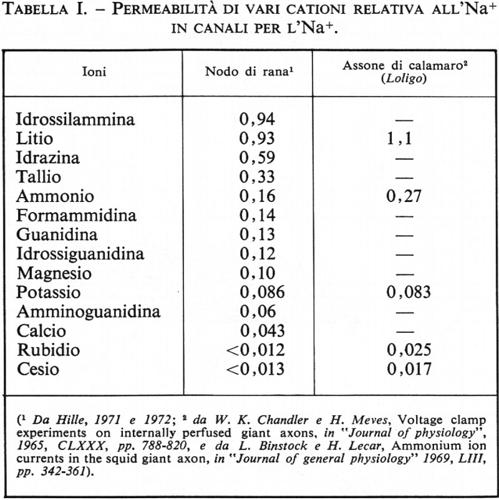
Le cellule dei Metazoi marini si trovano immerse in liquidi dell'organismo che più o meno rassomigliano alla composizione dell'acqua di mare. Il sale predominante è NaCl e generalmente il liquido contiene, come l'acqua di mare, circa 0,45 moli NaCl/litro di acqua. Tuttavia, nelle forme terrestri il liquido dell'organismo è una soluzione più diluita che ha una concentrazione in sali tra 100 mM e 250 mM (v. Prosser, 1950).
La concentrazione intracellulare in sali è di solito circa la medesima di quella del liquido dell'organismo, cioè l'osmolarità e la forza ionica dei due liquidi sono assai simili. Tuttavia le specie ioniche dei sali intracellulari sono notevolmente differenti dai soluti extracellulari. All'interno della cellula predominano i sali di K+ e i grandi anioni organici che di solito non possono muoversi attraverso la membrana cellulare. Na+ ed alcuni anioni inorganici sono pure presenti, ma in grado assai inferiore. La concentrazione di cationi bivalenti e particolarmente di Ca2+ è di solito molto bassa. Le concentrazioni di sali ionizzati (rappresentati dalle loro attività) possono essere considerevolmente inferiori a quanto indicato dalle analisi degli elementi (v. Hinke, 1969). La differenza significa che alcuni ioni, particolarmente i cationi bivalenti (C2+), ma anche ioni inorganici monovalenti, possono essere legati da strutture o sostanze intracellulari. Un chiaro esempio di un tale legame per mezzo di un organulo intracellulare è la captazione di Ca2+ da parte del reticolo sarcoplasmatico (RS) delle fibre muscolari (v. fig. 6).
5. Proprietà generali delle membrane cellulari.
Come vedremo, l'asimmetria nella composizione ionica ai lati della membrana riflette numerose proprietà specializzate della membrana cellulare stessa. Date queste proprietà, l'asimmetria nasce dall'effetto di condizioni fisicochimiche definibili. A loro volta, queste danno luogo ad alcune conseguenze elettrochimiche ed elettrofisiologiche che giustificano le capacità elettrogeniche delle cellule eccitabili. Alcune proprietà della membrana cellulare sono anche comuni a barriere non-viventi, le quali ultime vanno da membrane artificiali a doppio strato (v. Mueller e Rudin, 1968 e 1969) a resine a scambio ionico (v. Helfferich, 1962), vetri (v. Eisenman, 1962 e 1969) e crete (v. Diamond e Wright, 1969). Tali aspetti saranno discussi più avanti. Tuttavia, di immediato interesse è il fatto che entrambi i liquidi, interno ed esterno, che bagnano la membrana cellulare sono soluzioni di elettroliti abbastanza forti e abbastanza concentrati. Essi sono, perciò, relativamente buoni conduttori ionici di elettricità.
a) Permeabilità all'acqua e ai sali.
La membrana cellulare è permeabile all'acqua, ancor più che ai sali. Così, essa si comporta come un rapido osmometro (v. Reuben e altri, 1964). Tuttavia l'‛alta' permeabilità all'acqua è un termine relativo (v. Robinson, 1965). Il flusso reale di acqua attraverso la membrana cellulare è basso, da circa 1 a 5×10-2μs-1atm-1. Così, il flusso attraverso 1 cm2 e con un gradiente di pressione di circa 10 m d'acqua sarebbe di circa 1 ml in 10 o più giorni: è questo il ‛numero giorni' (flusso di acqua in cm3 al giorno attraverso 1 cm2 di area per 1 atm) che è stato usato da Krogh (v., 1939) come unità di permeabilità all'acqua.
Il rapido cambiamento in volume di un assone soggetto a mutamenti osmotici (v. fig. 7) è dovuto alle sue dimensioni relativamente piccole. È anche degno di nota il fatto che le membrane dei due assoni, di calamaro e d'aragosta, si comportino in modo alquanto differente rispetto al medesimo stimolo osmotico, rappresentato da un aumento dell'osmolarità per aggiunta di KCl alla soluzione del bagno di controllo, che è 450 mM in NaCl (v. Freeman e altri, 1966): l'assone di aragosta si restringe in maniera transitoria, quindi si rigonfia e, se si riduce l'osmolarità rimuovendo il KCl, subisce un ulteriore rigonfiamento, prima di ritornare lentamente al volume originale; il volume dell'assone di calamaro, invece, si restringe in modo più considerevole, e così rimane fino a quando, rimosso il KCl, ritorna rapidamente al valore iniziale.
La diversità di comportamento indica che le membrane dei due assoni differiscono nelle loro permeabilità agli ioni. L'assone di calamaro sembra essere impermeabile al KCl, mentre quello di aragosta è permeabile al sale. Il restringimento iniziale dell'assone di aragosta indica che il flusso d'acqua verso l'esterno, in risposta alla condizione di iperosmosi, è più rapido del flusso di KCl verso l'interno. Tuttavia, la penetrazione di questo sale si accompagna a quella dell'acqua, cosicché il volume della cellula aumenta ancora, e infatti il flusso verso l'interno di sale ed acqua causa un rigonfiamento di circa il 30%; nel momento in cui l'osmolarità originale del mezzo liquido viene ripristinata, la parte interna della cellula possiede un considerevole eccesso di KCl, e il breve rigonfiamento aggiuntivo indica penetrazione di acqua per compensare l'osmolarità momentaneamente alta entro la cellula. Il volume diminuisce non appena il KCl fuoriesce dalla cellula.
La depolarizzazione dell'assone di calamaro provocata dall'aumento del K+ (v. fig. 11) dimostra che la sua membrana è permeabile al K+. Così, l'impermeabilità della membrana dell'assone di calamaro al KCl riflette la sua impermeabilità al Cl-, mentre la membrana dell'assone dell'aragosta è permeabile sia al K+ sia al Cl-.
b) Selettività della permeabilità ionica.
La membrana cellulare differisce da molte membrane non viventi anche per il suo alto grado di ‛permselettività' (permeabilità selettiva). Per es., membrane a scambio ionico sono generalmente selettive per cationi quando le cariche fisse sono negative e per anioni quando le cariche fisse sono positive. La membrana cellulare, tuttavia, offre un alto grado di discriminazione per i diversi cationi, e una minore discriminazione per i diversi anioni. Anche sistemi non viventi, come vetri sensibili ai cationi, possono discriminare tra diversi ioni, ed è stata elaborata una coerente teoria di questa proprietà (v. Eisenman, 1962 e 1969; v. Diamond e Wright, 1969).
La selettività dei vetri è una proprietà statica dipendente dalla composizione del vetro, mentre quella della membrana vivente è una caratteristica dinamica che può essere mutata, perché canali specificamente selettivi della permeabilità sono controllati da ‛chiuse' (aperte o sbarrate) sotto l'azione di stimoli appropriati. Questa caratteristica fondamentale delle membrane cellulari eccitabili, la loro capacità di cambiare il tipo e il grado di ‛permselettività' in opportune condizioni (eccitazione per effetto di uno stimolo adeguato) sono state recentemente accostate al comportamento delle membrane lipidiche a doppio strato trattate con vari agenti (v. Mueller e Rudin, 1968; v. Haydon e Hladky, 1972). Tuttavia, la ricchezza delle risposte che le membrane di varie cellule eccitabili possono elaborare conduce ad una vasta gamma di fenomeni elettrogenici, che sono stati avvicinati solo alla lontana a sistemi non-viventi (v. i contributi di Muller e Finkelstein, 1972).
6. Evoluzione del neurone.
I dati elettrofisiologici offrono indicazioni delle tracce evoluzionistiche dello sviluppo del modo specializzato di comunicazione intercellulare che è incluso nel sistema nervoso dei Metazoi (v. Grundfest, Evolution..., 1959; Excitation by..., 1961; 1964). Tale sviluppo avvenne assai presto nella storia dei Metazoi, poiché è già presente nei Celenterati. Invero, l'acquisizione di un sistema nervoso può essere considerata come un evento cruciale nella differenziazione tra le piante, essenzialmente sessili, e gli animali, altamente mobili. Prive di mobilità, le piante si sono evolute in strutture massicce, che hanno un esteso sistema di radici per l'approvvigionamento nutritizio ad una estremità e una simile estesa ramificazione all'altra per assorbire e utilizzare l'energia solare. Tuttavia, gli animali hanno abbandonato la sperimentazione di specie gigantesche, pesantemente corazzate, e sono giunti a dipendere da sistemi nervosi sempre più elaborati che coordinano movimenti rapidi e precisi.
I neuroni probabilmente originarono come adattamenti evoluzionistici da speciali cellule secretorie di forme coloniali. Queste cellule primitive presentano due facce funzionali, un'entrata-recettore che reagisce a uno stimolo più o meno specifico, e un'uscita-effettore, che rilascia materiale più o meno specifico che è elaborato e/o immagazzinato dalla cellula. Queste primitive specializzazioni persistono negli animali superiori nella forma non solo di cellule ghiandolari, ma anche di cellule recettrici (v. Grundfest, Excitation by..., 1961; 1964; Electrophysiology..., 1965; The general electrophysiology..., 1971). L'uscita tuttavia non necessita di essere limitata alla secrezione di sostanze chimiche: alcune cellule sono specializzate per un'uscita meccanica, come nei nematociti dei Celenterati (v. Blanquet, 1970).
L'accoppiamento intracellulare tra le terminazioni di entrata e di uscita può coinvolgere una sequenza più o meno elaborata di mutamenti chimici specifici nella cellula, come è esemplificato dalla complessa catena di reazioni iniziate dai pigmenti fotochimici delle cellule recettrici visive. L'accoppiamento può, tuttavia, coinvolgere un meccanismo meno specifico, un mutamento nello stato elettrico della cellula. La liberazione di catecolammine da cellule surrenali può essere prodotta da un'alta concentrazione di K+, che come la liberazione di acetilcolina dalla loro innervazione produce un mutamento nello stato elettrico (v. Douglas e altri, 1967). Similmente, una corrente elettrica applicata intracellularmente può evocare una risposta secretoria delle terminazioni nervose.
La velocità, l'efficacia e la specificità di comunicazione intercellulare tra recettore o cellule ghiandolari e le loro cellule bersaglio sono limitate rispettivamente dal tempo richiesto perché i prodotti secretori raggiungano l'entrata. della cellula bersaglio, dalla diluizione o distruzione dei prodotti quando questi si muovono nelle cavità del corpo e dalla diffusione dell'informazione a cellule con varie funzioni, piuttosto che dalla sua trasmissione lungo canali specifici. Così, questa modalità di comunicazione è sopravvissuta nei sistemi dove il recettore o le cellule ghiandolari sono poste a stretto contatto con le loro cellule bersaglio e tali cellule possono rispondere rapidamente, come nei sistemi sensoriali craniali dei Vertebrati. Nei sistemi endocrini agenti che circolano in permanenza producono risposte delle cellule bersaglio con un notevole ritardo.
Il bisogno di una comunicazione rapida e specifica tra l'entrata di una cellula e quella di un'altra cellula lontana è soddisfatto dalla presenza nel neurone di un elemento conduttore, l'assone (v. fig. 8): questo è interposto tra le terminazioni d'entrata e quelle di uscita del neurone. L'assone agisce effettivamente come un cavo elettrico, trasportando un'informazione ricevuta all'ingresso come un messaggio codificato in un treno di potenziali d'azione. Di solito il messaggio passa lungo l'assone-cavo senza distorsioni significative e, all'arrivo alle terminazioni nervose presinaptiche, causa una liberazione di materiale secretorio che a sua volta porta (‛trasmette') l'informazione attraverso lo spazio sinaptico, per influenzare la membrana postsinaptica di entrata della cellula bersaglio. Così, le componenti di entrata e di uscita possono geograficamente essere separate, essendo ciascuna situata nel luogo strategicamente più adatto alla sua funzione, ma entrambe legate funzionalmente dall'accoppiamento elettrico dovuto al cavo assone.
Le proprietà specifiche delle componenti di entrata e di uscita sono state conservate dal neurone non semplicemente come tracce residue di cellule più primitive. Queste proprietà sono state adattate in modo da permettere al neurone di agire come un sistema completo che riceve informazioni di uno specifico tipo alla terminazione d'entrata e le trasforma in un segnale elettrico (generatore o potenziale postsinaptico eccitatorio) che costituisce l'accoppiamento elettrico sul nuovo elemento conduttore. Sotto l'influenza dell'attività elettrica dell'entrata, il cavo-assone genera impulsi che possono costituire un messaggio elettrico codificato; le proprietà del cavo sono tali che il messaggio lo percorre senza distorsioni. Arrivando alla terminazione di uscita, più o meno distante, il messaggio elettrico vi si accoppia così da iniziare la liberazione di uno specifico agente trasmettitore chimico. La contiguità anatomica con la cellula postsinaptica e la specificità del trasmettitore si combinano così da incanalare il messaggio abbastanza precisamente. Dal momento che i neuroni sono in rapporto senza le rigide e strette connessioni di continuità anatomica, le interconnessioni formate dalle loro giunzioni sinaptiche permettono un considerevole grado di plasticità nel sistema nervoso, tuttavia nei limiti di un quasi rigido ‛schema di connessioni' come quello che viene usato in un circuito elettrico fatto dall'uomo. Sono le interazioni dei diversi componenti del neurone e le interazioni delle serie di neuroni che forniscono al sistema nervoso le sue ricche capacità (v. Grundfest, Synaptic..., 1959; 1967; v. sinapsi).
L'analisi della divisione tripartita della funzione nel neurone (v. Grundfest, Electrical inexcitability..., 1957) seguì il riconoscimento (v. Altamirano e Grundfest, 1954; v. Altamirano e altri, 1955; v. Grundfest, The mechanisms..., 1957) che l'attività di trasformazione da parte delle componenti d'entrata, che converte uno stimolo specifico in una risposta elettrica, non può, come regola generale, essere provocata da uno stimolo elettrico. Così, la componente d'entrata, sebbene elettrogenica, è elettricamente ineccitabile in contrasto con l'assone conduttore capace di generare impulsi, ché è necessariamente eccitabile elettricamente. L'attività della componente secretoria delle terminazioni nervose è probabilmente eccitata elettricamente dal messaggio contenuto nei potenziali d'azione dell'assone, ma le terminazioni nervose non necessitano della capacità di generare impulsi. Le diverse caratteristiche delle tre componenti sono costantemente presenti (v. fig. 9), tranne che in alcuni tipi di neuroni ‛anassonici' che, insieme con le cellule recettrici specializzate, mettono in evidenza l'origine evolutiva dei neuroni.
Dati elettrofisiologici indicano che ci deve essere stata una sperimentazione considerevole nel corso dell'invenzione dell'assone che genera e conduce il segnale e della sua integrazione con le componenti di entrata e di uscita del neurone. Nel riprendere e spiegare alcuni di questi esperimenti l'elettrofisiologia generale a questo proposito offre una prospettiva sulle capacità di adattamento della cellula e in particolare della membrana cellulare.
È utile rievocare la storia dell'evoluzione del telegrafo (v. Garratt, 1958). La trasmissione dell'elettricità statica lungo un filo era stata dimostrata attorno al 1730 da S. Oray e il suo uso per il telegrafo fu suggerito intorno al 1750. Seri sforzi per sviluppare un telegrafo elettrico dovettero attendere l'invenzione della pila elettrochimica di Volta, intorno al 1800. Nel frattempo il telegrafo segnalatore a braccio mobile di C. Chappe fu un mezzo pratico che contribuì alle vittorie dell'esercito rivoluzionario francese. Con la disponibilità della sorgente di forza elettrica della pila, la telegrafia elettrica progredì rapidamente come altri aspetti dell'elettrotecnologia dei primi anni dell'Ottocento. Un progresso importante fu il concetto dell'alfabeto Morse digitale, che fu sviluppato da S. Morse, forse perché era professore di arte all'Univesità di New York. Nonostante tutti i mezzi a disposizione dell'elettrotecnologia, tuttavia, la comunicazione telegrafica pratica ad alta velocità e quella telefonica a lunga distanza dovettero aspettare lo sviluppo degli amplificatori elettronici e dei circuiti ripetitori, che in principio usarono gli stessi mezzi dell'assone, ma in maniera meno economica.
7. I generatori bioelettrici.
a) Elementi funzionali per la segnalazione elettrica.
Come sistema di segnalazione elettrica, il neurone deve svolgere un numero di funzioni separate che possono essere definite in termini di modelli analoghi costruiti dall'uomo. Il primo requisito è una sorgente di energia elettrica. Il segnale elettrico deve essere fatto scattare all'entrata ed il segnale generatore del cavo-assone deve essere capace di condurre il messaggio senza serie distorsioni. Il messaggio deve codificare l'informazione ricevuta all'entrata in una forma che sia intelligibile alla sezione di uscita, cosicché quest'ultima possa trasmettere un messaggio appropriato agli elementi recettivi (postsinaptici) delle cellule successive. Nel sistema vivente tutte queste funzioni sono condensate nei confini di una singola cellula e devono essere acquisite entro le limitazioni della disponibilità di mezzi imposta dalla struttura della cellula. Sistemi di segnalazione creati dall'uomo, al contrario, possono disporre di un gran numero di componenti, compresi enormi generatori di energia elettrica.
b) Bioelettricità; la condizione di Donnan.
Come già esposto, la membrana cellulare contiene in larga misura macromolecole cariche negativamente all'interno della cellula. La membrana deve, tuttavia, permettere lo scambio di vari materiali, compresa l'acqua, e di sali tra le fasi interna ed esterna (v. fig. 7). In stato di equilibrio questa permeabilità all'acqua e ai sali dà luogo a una differenza di potenziale elettrico attraverso la membrana, come fu inizialmente osservato da F. G. Donnan. Un sistema Donnan in cui (per semplicità) tutti gli ioni siano monovalenti richiede le seguenti condizioni.
1. Elettroneutralità totale. In ogni fase separata della membrana la somma delle cariche positive deve essere eguale alla somma delle cariche negative. Per la fase interna,
Σ[C+permeante] = Σ[A-permeante] + Σ[X-non permeante].
2. Tutte le specie di ioni permeanti si distribuiscono secondo il rapporto di Donnan:
Poiché Na+, Cl- e K+ sono gli ioni principali
3. Da qui ha origine la relazione del prodotto costante:
[Na+esterno]•[Cl-esterno] = [Na+interno]•[Cl-interno]
[K+esterno]•[Cl-esterno] = [K+interno]•[Cl-interno].
4. Il potenziale di Donnan è:
essendo il segno quello dello ione non permeante, internamente negativo nella cellula.
Secondo la relazione di cui al punto 2, il principale catione esterno, Na+, dovrebbe anche essere il principale catione intracellulare. Tuttavia, l'entrata di Na+ dovrebbe richiedere il flusso verso l'interno di una considerevole quantità di Cl-, per conservare costante il prodotto Na+ Cl- (condizione di cui al punto 3). Così, la fase interna avrebbe una concentrazione considerevolmente più alta del mezzo esterno e l'acqua entrerebbe, provocando rigonfiamento e possibile rottura della membrana cellulare.
Questo pericolo è stato superato da un altro adattamento, quello di rendere la membrana cellulare praticamente impermeabile all'Na+, ma permeabile al K+. Così, K+ può diffondere in modo da diventare il principale catione diffusibile intracellulare. Poiché [K+esterno] è piccolo (circa 1-20 mM nella maggior parte dei liquidi del corpo) la relazione [K+interno]•[Cl-interno] = [K+esterno]•[Cl-esterno] veniva prontamente soddisfatta da un grande valore di [K+interno] ed uno piccolo di [Cl-interno]. In generale il rapporto [K+interno]/[K+esterno] si aggira da circa 5 a circa 30, cosicché la membrana è polarizzata all'interno negativamente da circa − 30 a − 100mV o più.
Così l'adattamento a risolvere difficoltà osmotiche crea un sistema ‛Donnan doppio' con l'esclusione della penetrazione del catione principale della fase esterna nella cellula e della fuoriuscita da essa delle macromolecole anioniche (v. Boyle e Conway, 1941). Come risultato il rapporto Donnan può applicarsi per quanto riguarda K+ e Cl-:
c) Bioelettricità; la relazione di Nernst-Planck.
Molti dati, tuttavia, dimostrano che la membrana è di fatto anche permeabile all'Na+ e a molti altri ioni e che in molte cellule
[K+esterno]/[K+interno]≠[Cl-interno]/[Cl-esterno].
Nondimeno, ulteriori adattamenti, come il trasporto attivo di ioni (pompe ioniche), mantengono alto il [K+interno] e basso l'[Na+interno], e regolano anche i gradienti di concentrazione di altri ioni. Tali adattamenti mutano la natura del potenziale di membrana. Questo non è più un potenziale Donnan, che è un potenziale di interfase (superficie), incapace di dare una corrente apprezzabile (v. Overbeek, 1956). La membrana cellulare, selettivamente permeabile a vari ioni, diventa ora il sito di potenziali di concentrazione, che riflettono i differenti gradienti ionici e le relative mobilità (conduttanza o permeabilità) di differenti specie ioniche attraverso la membrana (v. fig. 10). La forza elettromotrice (fem) di ciascuna batteria ionica è data dalla relazione di Nernst:
dove z è la valenza dello ione con il suo segno.
Se la membrana a riposo è selettivamente permeabile solo al K+ come suggerito da Bernstein (v., 1902), EM = 58 mV log [K+esterno]/[K+interno] o 58 mV con la negatività all'interno per un gradiente di dieci volte ([K+esterno]/[K+interno] = 0,1). Ciò è approssimativamente vero per molte cellule e la membrana si comporta praticamente come un elettrodo al K+ per una considerevole serie di valori di [K+esterno] (v. fig. 11). Una relazione più precisa si ottiene prendendo in considerazione i contributi di altre batterie ioniche, caricate dalla permeabilità relativa di ciascuna specie ionica nella membrana. Per i cationi monovalenti
Quando Na+ e Cl- sono entrambi implicati, così come K+
(v. Goldman, 1943; v. Hodgkin e Katz, 1949). Particolarmente importante è la fem della batteria all'Na+
Poiché [Na+esterno]/[Na+interno] si aggira da circa 5 a 20, ENa è internamente positiva da circa 40 a circa 80 mV o più. Tuttavia, l'effettiva permeabilità dell'Na+ (PNa) è di solito così bassa che ENa riduce EM relativamente poco dal suo valore vicino a EK, eccetto quanto [K+esterno] è vicina allo zero. Il potenziale di membrana è anche modificato dalla presenza di cariche fisse nella struttura della membrana (v. Teorell, 1953 e 1956).
8. La risposta delle membrane eccitabili.
a) Il potenziale d'azione.
Il potenziale di riposo internamente negativo serve come un potenziale di polarizzazione per mantenere la membrana cellulare nella sua permeabilità di riposo, e perciò maschera l'esistenza della fem interno-positiva che è dovuta ai gradienti inversi per l'Na+, Ca2+ o altri cationi. Questa stabilità della membrana dovrebbe essere, tuttavia, disturbata da ogni stimolo che aumenti la permeabilità (o conduttanza) della membrana agli ioni che formano le batterie ioniche con la positività all'interno. Nelle membrane elettricamente eccitabili un tale disturbo è causato da uno stimolo elettrico e dà luogo a un potenziale d'azione (v. figg. 2 e 11). Una depolarizzazione relativamente piccola provoca un aumento della permeabilità (conduttanza) della membrana per l'Na+ (attivazione dell'Na+). La membrana perciò tende a depolarizzarsi ulteriormente e questo provoca un ulteriore aumento della permeabilità e una maggiore depolarizzazione (v. fig. 12). Questo effetto ‛rigenerativo' tende a trasferire la membrana dal suo potenziale di riposo internamente negativo al potenziale ENa internamente positivo.
Il più grande mutamento nel potenziale durante l'elettrogenesi del potenziale d'azione si avvicina come limite a ENa. Così, mentre la membrana è simile ad un elettrodo al K+ a riposo, essa tende a divenire un elettrodo all'Na+ durante il picco del potenziale d'azione. Tale picco di conseguenza dipende dai mutamenti di [Na+esterno] come previsto dalla relazione di Nernst (v. fig. 11), mentre il potenziale di riposo dipende soprattutto dal [K+esterno] e risente poco del mutamento in [Na+esterno]. Nel tempo l'attivazione dell'Na+ è invertita dalla depolarizzazione (inattivazione dell'Na+) e la sensibilità alla fem della batteria all'Na+ è ridotta. La depolarizzazione provoca anche un'aumentata permeabilità per il K+ (attivazione del K+) che tende ad aumentare l'influenza dell'EK negativa internamente. Entrambi gli effetti collaborano a ripristinare la membrana nella sua condizione di riposo internamente negativa (v. fig. 13). Così, il segnale che è stato scatenato da una depolarizzazione è un impulso relativamente breve, di ampiezza e forma abbastanza fisse (v. figg. 2 e 13).
b) Modalità d'origine del potenziale d'azione.
Di solito per provocare la risposta è richiesta solo una piccola depolarizzazione, mentre il cambiamento di potenziale durante il potenziale d'azione è abitualmente da 5 a 10 volte più grande della depolarizzazione scatenante (v. fig. 13). Così, una volta che un potenziale d'azione è evocato in un qualsiasi punto lungo un assone da uno stimolo ivi applicato, esso stesso può eccitare regioni adiacenti ancora quiescenti della membrana, e a causa del grande rapporto tra risposta e potenziale scatenante (grande fattore di sicurezza) può passare saltando piccole regioni danneggiate o ad elevata soglia.
c) Batterie ioniche per il generatore e l'elettrogenesi sinaptica.
Nella loro normale attività i potenziali d'azione dei neuroni o delle cellule effettrici sono evocati dall'elettrogenesi depolarizzante indotta da una stimolazione specializzata della componente d'ingresso. Un potenziale generatore che dura per tutto il tempo in cui è applicato uno stimolo specifico è rappresentato nel diagramma della fig. 8. I potenziali postsinaptici (v. fig. 14) sono controllati dalle caratteristiche dell'attività secretoria delle terminazioni presinaptiche, che è indotta dal messaggio dei potenziali d'azione, inducendo di solito ogni potenziale d'azione un ‛getto' di liberazione di trasmettitore. L'ampiezza del potenziale postsinaptico (PPS), come pure la sua durata, sono regolate dalla quantità di trasmettitore disponibile come risultato dell'attività secretoria. L'uscita del trasmettitore dalle terminazioni può aumentare o diminuire con potenziali d'azione successivi nell'assone (rispettivamente facilitazione o defacilitazione) e questi effetti temporali sono importanti nell'elaborazione del messaggio. Un altro fattore in tale elaborazione è la sommazione di PPS in successione che è resa possibile perché l'elettrogenesi non eccitabile elettricamente può durare per tutto il tempo in cui l'eccitante (trasmettitore) è disponibile per la membrana postsinaptica. Facilitazione e sommazione sono entrambe rappresentate nella fig. 14A. Le grandezze dei singoli PPS sono assai maggiori nella fig. 14B che nella 14A, perché il preparato in B è stato trattato maniera tale da aumentare grandemente l'uscita del trasmettitore indotto da un singolo impulso nervoso (v. Gainer e altri, 1967).
La depolarizzazione all'entrata differisce da quella dell'elettrogenesi del potenziale d'azione non solo perché essa è evocata da uno stimolo specifico (chimico, meccanico, ottico o termico), ma anche per il fatto che gli aumenti della conduttanza all'Na+ e al K+ sono essenzialmente simultanei. Così, l'effetto depolarizzante di un'accresciuta GNa è contrastato in parte dal simultaneo aumento in GK. Il cambiamento totale di conduttanza (Gg) della membrana di ingresso è dunque Gg = GNa + GK e questo provoca un flusso di corrente ionica Ig = INa + IK, muovendosi ciascuna specie ionica secondo il proprio gradiente elettrochimico, il K+ verso l'esterno e l'Na+ verso l'interno. Il flusso di corrente produce un mutamento nel potenziale di membrana tale che GgEg = GNaENa + GKEK. La fem ‛effettiva' Eg della batteria è
Eg può variare a seconda delle relative conduttanze GNa e GK e delle fem delle loro batterie. Nella maggior parte delle cellule che sono state studiate GNa≅Gk. Se ENa = 58 mV e EK = − 80 mV, Eg = − 11 mV e un potenziale generatore massimo sarebbe una depolarizzazione di 69 mV. Molti assoni producono impulsi quando sono depolarizzati da circa 10 a 40 mV. Così, stimoli relativamente piccoli all'ingresso possono suscitare impulsi nell'assone.
Può anche verificarsi un aumento elettricamente ineccitabile nella conduttanza del K+ o del Cl- (v. fig. 10). La fem effettiva Eg è resa allora ancor più negativa dall'aumento in GK o dall'aggiunta di un'altra componente internamente negativa GCl•ECl. Il potenziale generatore o PPSE viene quindi ridotto e la generazione dei potenziali d'azione può essere inibita, per cui questo tipo di elettrogenesi è inibitorio. Essa è di solito indotta in membrane sinaptiche specializzate e l'elettrogenesi è un PPSI.
d) Altre batterie ioniche.
Nella sezione precedente sono stati descritti i processi elettrogenetici principali che sono implicati nell'operazione di un neurone come sistema specializzato a ricevere un'informazione, a elaborarla come un messaggio elettrico e a trasportarla a una componente di uscita che trasmette tale informazione ad altre cellule. Tali processi coinvolgono mutamenti nella permeabilità della membrana agli ioni, principalmente Na+ e K+. Tuttavia, come indicato nella fig. 10, la membrana è anche permeabile ad altri ioni, e di questi in modo significativo al Cl- ed a cationi bivalenti (C2+), in modo predominante al Ca2+ e in molti casi all'Mg2+. Generalmente, questi ioni non sono in equilibrio elettrochimico, cosicché ciascuna specie di ioni forma una batteria di concentrazione con una specifica fem. La concentrazione esterna in ogni caso è molto più ampia che all'interno della cellula, cosicché EC è positiva internamente, mentre ECl è internamente negativa; più o meno rispetto al potenziale di riposo. Così, un cambiamento nella permeabilità della membrana per ognuno di questi ioni sarà pure elettrogenico.
Mutamenti nelle permeabilità della membrana agli ioni si possono osservare in vari modi. In circostanze favorevoli i mutamenti possono essere misurati da analisi chimiche o da studi con traccianti dei cambiamenti dei movimenti di ioni e/o delle distribuzioni attraverso la membrana. Qui noi ci interesseremo solo di misurazioni elettriche, che descrivono la conduttanza (G = 1/R) della membrana come funzione della corrente applicata o del voltaggio. La misura più semplice consiste nell'applicare una corrente costante attraverso la membrana e nell'osservare il potenziale quando la corrente è stata applicata tanto a lungo che i cambiamenti transitori sono scomparsi. Questi dati descrivono le caratteristiche I-E nello stato stabile della membrana, come è mostrato nella fig. 15, che traccia la corrente I in relazione al voltaggio E.
e) Caratteristiche lineari.
La caratteristica I-E più semplice è quella della membrana nella quale la conduttanza rimane costante anche se si varia I o E. Questo è stato osservato nella membrana ‛elettrogenicamente inerte' entro gli ampi limiti di ±800 mV (v. Wright e altri, 1971). Ciò è stato anche osservato in una membrana elettrogenica ‛ineccitabile elettricamente'. Se la conduttanza aumenta (come avviene di solito), la caratteristica sposterà la sua origine sull'ordinata, a seconda del segno e del grado dell'elettrogenesi, e cambierà la sua pendenza in proporzione all'aumento della conduttanza, ma rimarrà lineare, secondo la legge di Ohm.
Queste due linee sono mostrate nel diagramma della fig. 15 (a sinistra). Una si riferisce ad una conduttanza aumentata che genera un forte PPSE depolarizzante o un potenziale generatore. L'altra si riferisce ad una conduttanza aumentata che coinvolge una piccola elettrogenesi iperpolarizzante, che avverrebbe se EK o ECl fosse negativa rispetto a EM.
Sebbene il mutamento della conduttanza non dipenda dal mutamento dello stato elettrico della membrana, l'ampiezza della risposta ed anche il suo segno cambieranno, poiché la corrente applicata cambia il potenziale di membrana. Secondo la legge di Ohm la corrente generata dalla membrana d'ingresso è:
I = G(EM − Eg)
dove Eg è la fem effettiva del generatore d'entrata. In tal modo, quando EM è mutata dalla corrente applicata così da essere uguale a Eg, la corrente del generatore d'entrata sarà zero. Questo è rappresentato dalla coincidenza della caratteristica I-E nello stato di attività con quella della membrana a riposo polarizzata al medesimo potenziale.
Questo punto, che può essere determinato sperimentalmente in molti casi, è detto potenziale di inversione, perché da una parte e dall'altra l'elettrogenesi appare di segno inverso relativamente al potenziale di membrana a riposo. Esso si avvicina alla fem del generatore dell'attività. Come già descritto, la fem dell'elettrogenesi depolarizzante si trova tra EK e ENa ed è considerevolmente positiva rispetto al potenziale di riposo. La fem dei PPSI è sia EK sia ECl e può essere positiva o negativa, ma vicina al potenziale di riposo. L'ampiezza delle risposte osservate varia con il grado di polarizzazione della membrana a riposo da parte della corrente applicata. Per l'elettrogenesi depolarizzante la risposta diminuisce quando EM diventa meno negativa e si accosta al potenziale di inversione. L'elettrogenesi iperpolarizzante, d'altra parte, aumenta quando EM è resa meno negativa (v. fig. 15, a sinistra).
Sebbene la proprietà della ineccitabilità elettrica è probabilmente una traccia dell'origine del neurone da cellule piu primitive, essa è di grande vantaggio funzionale per la cellula. In primo luogo, la sensibilità selettiva a stimoli specifici fornisce mezzi per il riconoscimento dei differenti tipi di stimoli. Analogamente, la selettività della membrana postsinaptica per un dato agente trasmettitore fornisce mezzi per migliorare la canalizzazione dell'informazione e minimizza un ‛discorso incrociato' che potrebbe sorgere se l'ingresso del neurone fosse sensibile ai campi elettrici (v. Grundfest, 1956).
La caratteristica lineare delle componenti non eccitabili elettricamente è anche utile nella trasformazione dell'informazione d'entrata nel messaggio dei potenziali d'azione. La risposta è un potenziale graduato e come prima approssimazione l'ampiezza del potenziale generatore o di uno postsinaptico è funzione lineare della intensità dello stimolo. Inoltre, la risposta elettrica evocata dallo stimolo può, in linea di principio, rimanere costante per tutto il tempo in cui lo stimolo è applicato. Queste due caratteristiche forniscono i mezzi per codificare il messaggio come treno di potenziali d'azione. L'informazione contenuta in ciascun potenziale d'azione è un bit digitale. Tuttavia, se il potenziale generatore aumenta oltre la soglia e persiste per qualche tempo, sarà generato un treno di potenziali d'azione (v. fig. 8) la cui frequenza tenderà ad aumentare quando aumenti la depolarizzazione. Così la frequenza ed il numero dei potenziali d'azione formano il codice del messaggio a seconda dell'intensità dello stimolo all'ingresso.
f) Caratteristiche non lineari.
Le caratteristiche I-E delle componenti della membrana elettricamente eccitabile (sensibile a una d d p) (v. fig. 15, a destra) mostrano un comportamento non lineare, dal momento che il cambiamento della conduttanza è indotto esso stesso da uno stimolo elettrico applicato. Il cambiamento può essere un aumento nella conduttanza (processo di attivazione) o una diminuzione (processo di inattivazione). Così, la caratteristica è lineare solo in quella regione dove il potenziale di membrana è al di sotto della soglia per iniziare il cambiamento nella conduttanza. Appena la conduttanza aumenta, la pendenza della caratteristica diventerà meno ripida. Questa non linearità, che è stata definita ‛rettificazione' in analogia con le caratteristiche non lineari delle componenti elettroniche, è più precisamente denominata attivazione depolarizzante e iperpolarizzante, a seconda che l'aumento della conduttanza sia indotto da correnti dirette verso l'esterno o verso l'interno. Una diminuzione della conduttanza provocherà un mutamento inverso. La pendenza allora aumenterà, e la corrente applicata provocherà un potenziale più grande attraverso la più alta resistenza della membrana. Questi cambiamenti sono rispettivamente denominati inattivazione depolarizzante ed iperpolarizzante. L'elettrogenesi depolarizzante di un potenziale d'azione o di una risposta graduata a uno stimolo elettrico è rappresentata da una linea tratteggiata, come si può vedere nella fig. 15.
Nello schema del circuito equivalente della fig. 10, l'attivazione è rappresentata da una freccia rivolta verso l'alto e l'inattivazione da una freccia rivolta verso il basso. I due processi possono essere prodotti da stimoli depolarizzanti (D) o iperpolarizzanti (I) nella membrana eccitabile elettricamente, e la risposta può coinvolgere ogni genere di ioni che sono presenti nel sistema, ciascuno con la sua propria forza motrice elettrochimica.
Le caratteristiche I-E di una membrana elettricamente eccitabile rappresentate nella fig. 15, a destra, sono ottenute variando la corrente ed osservando il voltaggio risultante della membrana. Questa misurazione in ‛blocco di corrente' è adeguata a definire lo stato stabile raggiunto dopo che è stata applicata per qualche tempo la corrente e il potenziale si è stabilizzato al suo valore finale. Non è, tuttavia, sufficiente a caratterizzare le cinetiche del cambiamento nella conduttanza, o le specie ioniche coinvolte, e ciò particolarmente quando il cambiamento di potenziale è rigenerativo, come avviene nel potenziale d'azione. Per questo scopo è necessario studiare la caratteristica quando il voltaggio è controllato e si misura la corrente, cioè in condizioni di ‛blocco di voltaggio'.
g) Caratteristiche del blocco di voltaggio di una membrana che genera potenziali d'azione.
In principio il blocco di voltaggio è relativamente semplice, sebbene la sua applicazione alle cellule nervose richieda strumenti elaborati e precauzioni considerevoli per evitare errori. La membrana è posta e mantenuta ad un certo potenziale da un circuito elettronico che fornisce una corrente per ‛bloccare' la membrana a quel potenziale. L'ampiezza del picco della corrente misura la massima conduttanza a quel potenziale ed il decorso temporale della corrente indica le cinetiche del cambiamento nella conduttanza, per mezzo della relazione I/G = E oppure I = GE.
Un esempio di tali dati, ottenuti sul nodo di Ranvier di una fibra nervosa di anfibio, è rappresentato nella fig. 16 (v. Dodge, 1963). Il grafico B mostra tre diverse caratteristiche. La linea sottile (IL) denota il rapporto chimico della componente non reattiva elettrogenicamente, la corrente diretta all'esterno aumentando linearmente quando la membrana è depolarizzata. Il piccolo mutamento nella corrente indica che la conduttanza della membrana a riposo è bassa. La linea è una continuazione della caratteristica di ‛perdita' che si osserva per potenziali più negativi dei potenziali di riposo (v. figg. 15 e 17).
Dopo che il potenziale supera alquanto il livello di riposo (v. fig. 16B) ed è stato bloccato per un certo periodo di tempo, la corrente diretta verso l'esterno assume un valore essenzialmente stabile (I∞ = IK) e la caratteristica si avvicina ad una conduttanza di un nuovo stato stabile (cerchi pieni), che è notevolmente più grande di quella della membrana a riposo. Una estrapolazione della pendenza limitante di questa caratteristica proietta sull'asse del voltaggio dietro alla fem della batteria al K+ e numerose prove sperimentali confermano che la grande corrente diretta verso l'esterno è dovuta all'attivazione del K+. Il decorso temporale ed i valori finali di IK sono mostrati nelle registrazioni della fig. 16C per una serie di blocchi di potenziali.
La terza caratteristica della fig. 16B descrive l'iniziale, ma transitoria, corrente verso l'interno (Ipicco = INa) che si osserva immediatamente dopo che la membrana è bloccata ad un dato potenziale al di sopra di un valore soglia. Questa corrente risulta dalla sequenza di un'accresciuta conduttanza per l'Na+ (attivazione dell'Na+) e di una diminuzione (inattivazione dell'Na+), entrambe influenzate dalla depolarizzazione (v. Hodgkin e Huxley, A quantitative description..., 1952).
La corrente iniziale è rivolta all'interno a causa della grande forza motrice elettrochimica, la differenza tra EM (circa − 70 mV a riposo) ed ENa (circa 50 mV in questo assone). La corrente è INa = GNa (EM − ENa). Il suo aumento con la depolarizzazione indica che GNa aumenta mentre la forza motrice diminuisce. Tuttavia, dopo che GNa raggiunge un valore massimo, INa tende a decrescere quando il potenziale di membrana si avvicina a ENa. La caratteristica diviene ora lineare con una pendenza positiva, GNa. Questa linea differisce dalla caratteristica di GK non solo nella pendenza (GK e GNa, rispettivamente) ma anche nel fatto che il punto dove INa = 0 è fortemente positivo rispetto al potenziale di riposo, poiché esso è il valore di ENa.
La parte iniziale della caratteristica GNa ha, tuttavia, una pendenza negativa. Una regione a pendenza negativa è una caratteristica di sistemi metastabili ed è responsabile del processo rigenerativo di elettrogenesi del potenziale d'azione. La regione a pendenza negativa è una ‛zona proibita' quando il potenziale di membrana non è controllato dal blocco di voltaggio. In questo caso, lo spostamento del potenziale in questa regione da parte di un breve stimolo liminare depolarizzante causa uno spostamento rigenerativo nel senso di un'ulteriore depolarizzazione verso ENa internamente positiva. La membrana rimarrebbe a questo potenziale in un nuovo stato stabile, ma l'inattivazione dell'Na+ tende a ridurre GNa al suo valore originario vicino allo zero, abolendo quindi la forza motrice verso la positività interna. Questo fatto da solo sarebbe sufficiente a dissipare il potenziale ottenuto dall'elettrogenesi del potenziale d'azione. Tuttavia, nella maggior parte delle cellule l'aumento in GK indotto dall'attivazione del K+ introduce una spinta addizionale verso la negatività interna e quindi viene accelerata la ripolarizzazione della membrana.
Tali cambiamenti sono mostrati nella fig. 17, che rappresenta i mutamenti nella conduttanza calcolati in un assone di calamaro ed il risultante potenziale d'azione. Una piccola depolarizzazione provoca una conduttanza per l'Na+ accresciuta (GNa nella figura) e induce depolarizzazione che porta il picco del potenziale d'azione vicino a ENa (VNa nella figura). Questa depolarizzazione provoca inattivazione dell'Na+ e GNa cade al suo valore di riposo. La depolarizzazione provoca anche attivazione del K+ e GK aumenta. Tutti e due i fattori conducono alla ripolarizzazione. Nell'assone di calamaro il potenziale di riposo è notevolmente positivo rispetto a EK (VK) e la membrana si iperpolarizza, si accosta a Ek, mentre GK è al di sopra del suo valore di riposo.
h) Caratteristiche generali del blocco di voltaggio.
Ciascuna delle differenti varietà di processi elettrogenici che avvengono in membrane eccitabili (v. figg. 10 e 15) mostra caratteristiche specifiche nel blocco di voltaggio, come schematicamente rappresentato nella fig. 18. Le caratteristiche dei processi ineccitabili elettricamente rimangono lineari (B) come nella fig. 15, escluso il fatto che l'accresciuta conduttanza è ora rappresentata da un aumento nella pendenza. Durante l'elettrogenesi depolarizzante (PPSE o potenziale generatore) la caratteristica interseca l'asse del voltaggio a destra dell'origine. L'elettrogenesi iperpolarizzante (PPSI) sposta la caratteristica a sinistra. Potenziali invertiti sono messi in evidenza dall'intersezione delle caratteristiche rispettive della membrana attivata con quelle della membrana a riposo.
Come dimostrato nei dati della fig. 16 e nel diagramma A della fig. 18, le misurazioni con blocco di voltaggio offrono una informazione che non è disponibile dalle misurazioni con blocco di corrente di componenti elettricamente eccitabili. Le caratteristiche (v. fig. 18A) sono quindi necessariamente qualcosa di più complesso. Tuttavia, ogni mutamento dello stato di riposo può essere rappresentato da un mutamento nella pendenza appropriato al grado di mutamento nella conduttanza e dal valore di corrente-zero della caratteristica riferita alla fem della batteria ionica interessata. Così, l'aumentata conduttanza per il K+ o per il Cl- può essere approssimata da una rotazione in senso antiorario della caratteristica vicino all'origine e l'inattivazione del K+ da una rotazione in senso orario. In alcune cellule l'attivazione depolarizzante può aumentare la conduttanza per un catione bivalente (C++, di solito Ca2+ o più raramente Mg2+) che, come l'Na+, formano batterie con fem che sono positive rispetto al potenziale di riposo. La caratteristica dell'alta conduttanza lineare, appropriatamente spostata sull'asse del voltaggio, è connessa con la caratteristica di riposo attraverso una regione a pendenza negativa. Una regione a pendenza negativa è anche rappresentata nel passaggio da uno stato di alta conduttanza ad uno di bassa conduttanza, durante l'inattivazione sia iperpolarizzante sia depolarizzante.
i) Fondamento e significato delle caratteristiche a pendenza negativa.
Lo spostamento esplosivo del potenziale di membrana da una negatività interna ad una positività trova paralleli in molti altri tipi di sistemi metastabili, chimici e meccanici come pure elettrici. Comune a questi sistemi è un sistema a retroazione positiva che sviluppa lo spostamento rigenerativo da uno stato stabile ad un altro, essendo questi separati da una regione a pendenza negativa transizionale, instabile e proibita della caratteristica.
Il sistema a retroazione positiva nella membrana elettricamente eccitabile è prodotto da una elettrogenesi depolarizzante che è indotta in primo luogo dalla depolarizzazione ed è aumentata da una depolarizzazione ancora più grande (v. fig. 12). Questa elettrogenesi depolarizzante deriva da un'aumentata conduttanza per una specie ionica che forma una batteria con una fem positiva all'interno, relativa al potenziale di riposo (v. figg. 16-18). Durante il passaggio dallo stato di bassa conduttanza iniziale di questa batteria ionica vi è una corrente diretta verso l'interno
I = G (EM − E0)
dove E0 è la fem della batteria positiva all'interno. Il mutamento nella conduttanza allorché è cambiato il potenziale di membrana è:
dI/dEM = dG/dEM (EM − E0) + G
dove dI/dEM è la pendenza, cioè la conduttanza dinamica o differenziale.
Per piccoli mutamenti depolarizzanti in EM, EM − E0 è fortemente negativo, la corrente è negativa, o diretta verso l'interno, e la pendenza, cioè la conduttanza, è negativa. Il fatto che la corrente aumenti inizialmente mentre EM − E0 diminuisce, indica che la conduttanza G aumenta. Quando dI/dE = 0, la corrente diretta verso l'interno raggiunge il massimo, dipendendo il luogo di questa condizione dai parametri EM, E0 e G. Quindi la pendenza dI/dEM diviene positiva.
Si deve notare che la natura della batteria ionica non è specificata oltre il fatto che la sua fem E0 è considerevolmente positiva rispetto al potenziale di riposo. Questo fatto è indicato nello schema della fig. 19A. La membrana non reattiva è rappresentata dalla, caratteristica della linea 1, che è anche la caratteristica della componente di ‛perdita' della fig. 16. La linea 2 (v. fig. 19A) è la caratteristica del sistema ionico con una fem positiva all'interno. Negli assoni di rana e di calamaro questa è rappresentata da INa (v. fig. 16) e GNa (v. fig. 17). La linea 3 della fig. 19A è l'equivalente di IK (v. fig. 16) o GK (v. fig. 17). La fig. 19A mostra che un cambiàmento nel gradiente ionico che cambia la fem della batteria per il K+ o il Cl-, sposta la caratteristica dalla linea 1 alla linea 3. Potenziali d'azione potrebbero allora essere generati da un'accresciuta conduttanza per il K+ o il Cl-. Queste previsioni sono state confermate sperimentalmente.
La risposta (v. fig. 13) che è prodotta come risultato della caratteristica a pendenza negativa delle fig. 16, 17, e 19A, è ‛autogenetica' (v. Grundfest, Comparative electrobiology...., 1966). Una volta che la membrana è depolarizzata sufficientemente così da portare la caratteristica nella zona proibita, lo stimolo può essere tolto ed il mutamento nel potenziale di membrana continua finché si raggiunge il picco del potenziale d'azione sotto la spinta del potenziale elettrochimico della cellula stessa. La risposta si sviluppa così al suo massimo valore.
Processi di inattivazione (v. figg. 18 e 19B) mostrano anche caratteristiche con pendenza negativa, ma queste differiscono nella proprietà fondamentale, nel fatto che esse non sono autogenetiche, né si mantengono da sé. La caratteristica a pendenza negativa si sviluppa poiché la conduttanza decresce dal suo valore di riposo (v. fig. 19B, linea 1) ad un nuovo valore (linea 2), quando il potenziale di membrana è mutato oltre un valore soglia. Dal momento che il cambiamento può verificarsi in una direzione come nell'altra, si producono due tipi di risposta, rispettiva- mente risposte di inattivazione depolarizzante o iperpolarizzante.
Lo schema della fig. 19B mostra solamente un'unica fem per le caratteristiche ad alta e bassa conduttanza, ciò che è o si avvicina al potenziale di riposo. Questa è un'approssimazione tollerabile, poiché GK è di solito la conduttanza più alta ed il potenziale a riposo è o si avvicina a EK. Una diminuzione in GK è l'unico processo di inattivazione che sarà messo in evidenza dalle misurazioni. Per produrre lo stato di bassa conduttanza, deve essere mantenuta la corrente che lo provoca e le risposte di inattivazione verranno meno quando la corrente stimolante è tolta.
La conduttanza a riposo è o si avvicina al suo valore più basso in molte cellule, cosicché queste normalmente non danno risposte di inattivazione. Tuttavia, la conduttanza può essere accresciuta immergendo le cellule in una soluzione con elevata concentrazione di K+. Tale trattamento depolarizza di solito le cellule (v. fig. 11) così come aumenta la conduttanza (v. fig. 19C, linea 1). Applicando una corrente diretta verso l'interno, le cellule vengono ripolarizzate e, quando il potenziale si sposta entro la regione non lineare a pendenza negativa, la conduttanza si sposta indietro al valore basso (linea 2) e la corrente applicata provoca un notevole spostamento verso una maggiore iperpolarizzazione.
La regione a pendenza negativa è una zona proibita quando è avvicinata da entrambe le direzioni. Anche la fig. 19C mostra la condizione in cui una cellula depolarizzata è ripolarizzata da una corrente applicata al potenziale di riposo originale (linea tratteggiata verticale). Questa corrente deve essere mantenuta per mantenere ripolarizzata la cellula. Tuttavia, quando si applica una breve depolarizzazione scatenante, la membrana si depolarizzerà momentaneamente appena la caratteristica si sposta dalla condizione di bassa conduttanza (linea 1′) a quella di alta conduttanza (linea 2′). Nonostante si sia mantenuta la corrente ripolarizzante, il potenziale si sposta al valore positivo, perché la caduta di voltaggio della corrente applicata attraversa ora una bassa resistenza. Il basso potenziale ripolarizzante è quindi troppo piccolo per riportare indietro la caratteristica attraverso la regione a pendenza negativa.
9. Manifestazioni elettrofisiologiche di differenti processi elettrogenici.
I vari processi elettrogenici delle membrane eccitabili, descritti nelle figg. 15-19, possono avvenire indipendentemente l'uno dall'altro, salvo per l'accoppiamento di fenomeni suscitabili elettricamente attraverso mutamenti nel potenziale di membrana provocati da vari processi. Essi possono unirsi in diverse proporzioni in differenti cellule. Tali differenze possono causare così numerose manifestazioni elettrofisiologiche. Alcuni esempi saranno illustrati ed elaborati in base ai principi sopra discussi.
a) Specie ioniche nell'elettrogenesi del potenziale d'azione.
Per ragioni già illustrate, nella maggior parte delle condizioni l'Na+ è il principale catione del liquido extracellulare e la sua concentrazione intracellulare è relativamente bassa. E per questa ragione e solo per questa che l'elettrogenesi del potenziale d'azione è associata ad un aumento di GNa. Un'accresciuta conduttanza per il Ca2+ può anche generare potenziali d'azione; questo tipo di elettrogenesi si osserva nelle fibre muscolari dei Crostacei (v. Fatt e Ginsborg, 1958; v. Werman e Grundfest, 1961; v. Hagiwara e Nakajima, 1966). In alcuni casi l'elettrogenesi del potenziale d'azione coinvolge un aumento nella conduttanza sia per l'Na+ sia per il Ca2+ (v. Werman e Grundfest, 1961); questo si osserva anche in alcuni tipi di muscolo cardiaco.
La fig. 20 mostra misure in blocco di voltaggio sul muscolo atriale di rana. Una caratteristica a pendenza negativa, significativa, come abbiamo visto, dell'elettrogenesi del potenziale di azione, avviene in presenza di TTX (tetrodotossina), che come è noto elimina specificamente l'aumentata conduttanza associata con l'attivazione dell'Na+ (v. Narahashi e altri, 1964; v. i contributi di Nakamura e altri, 1965). Una diversa caratteristica a pendenza negativa perdura anche in presenza di Mn2+ che selettivamente blocca una conduttanza aumentata per il Ca2+ (v. Hagiwara e Nakajima, 1966; v. Suarez-Kurtz e altri, 1972). Entrambe le componenti con caratteristiche a pendenza negativa sono eliminate quando sono presenti sia TTX sia Mn2+. Così, questo muscolo ha due componenti di conduttanza che generano il potenziale d'azione, e cioè attivazione dell'Na+ e attivazione del Ca2+. L'attivazione del Ca2+ è principalmente o interamente responsabile dell'elettrogenesi del potenziale d'azione in alcuni neuroni di Molluschi (v. Geduldig e Junge, 1968), e nel protozoo di acqua dolce Paramecium (v. Eckert, 1972). Una conduttanza aumentata per il Ca2+ è stata anche osservata durante l'elettrogenesi del potenziale di azione nell'assone gigante del calamaro (v. Baker e altri, 1971) e nell'assone del gambero (v. Yamagishi e Grundfest, 1971). L'aumento di conduttanza coinvolto nell'attivazione del Ca2+ è di solito relativamente piccolo ed insufficiente a produrre una depolarizzazione abbastanza grande da provocare un potenziale d'azione dovuto al Ca2+. Tuttavia in speciali condizioni ioniche potenziali d'azione dovuti al Ca2+ si possono provocare nel calamaro. D'altro canto nelle fibre muscolari del verme della farina l'elettrogenesi dei potenziali di azione può avvenire alla presenza di Mg2+ ma non di Ca2+ (v. Grundfest e Kusano, 1970).
b) Induzione dell'elettrogenesi del potenziale d'azione per uno spostamento di E0.
Come discusso in relazione alla fig. 19A, i processi ionici che normalmente non provocano potenziali d'azione possono far ciò se le condizioni elettrochimiche sono opportunamente alterate. Le elettroplacche della torpedine non generano potenziali d'azione, ma presentano un'attivazione depolarizzante per il Cl-, come mostrato nelle misure in blocco di voltaggio della fig. 21 (v. Hille e altri, 1965). La resistenza di ‛perdita' della cellula (cerchi pieni) era di circa 6,5×103 ohm. La depolarizzazione dell'elettroplacca di circa 15-20 mV ha provocato un aumento nella conduttanza che è cresciuto fino al massimo valore (resistenza che cade a circa 500 ohm) per più grandi depolarizzazioni. ECl è di circa 7 mV positivo rispetto al potenziale di riposo (circa − 65 mV). L'aumento nella conduttanza è alquanto lento, come si può osservare dallo schema inserito e dai tracciati della fig. 21.
Rimpiazzando tutto il Cl- nel mezzo di immersione con un anione non permeante, ECl può essere reso positivo all'interno relativamente al potenziale di riposo (v. Cohen e altri, 1961). Questo mutamento è equivalente allo spostamento della linea 3 (v. fig. 19A) alla linea 3′. Un breve stimolo depolarizzante applicato all'elettroplacca provoca così un potenziale d'azione (v. fig. 22) che è dovuto all'aumento di GCl, interamente analogo all'elettrogenesi del potenziale d'azione sviluppato dall'aumento di GNa o di GC2+. In questo caso, tuttavia, la corrente diretta verso l'interno è dovuta ad un flusso di anioni verso l'esterno. Il potenziale d'azione è prolungato, dimostrando che non vi è aumento significativo nella conduttanza del K+, che tenderebbe a rendere più rapida la ripolarizzazione, come nell'assone del calamaro. Il declino in GCl dal suo massimo valore è lento in confronto con la rapida inattivazione depolarizzante dell'Na+ durante il potenziale di azione dell'assone. Il potenziale d'azione scompare se si introduce nuovamente Cl- nel liquido di immersione (v. fig. 22 E-H), dimostrando che ECl ritorna quindi verso EM. Potenziali d'azione al Cl- si verificano normalmente nelle alghe d'acqua dolce Chara e Nitella (v. Gaffey e Mullins, 1958; v. Mullins, 1962). Le concentrazioni di Na+, K+ e Cl- nel mezzo di immersione sono molto basse, cosicché ENa, come Ek, è negativo all'interno, mentre ECl è positivo.
Uno spostamento di EK verso valori più positivi provoca di solito depolarizzazione della membrana a riposo, cosicché EM − EK non cambia notevolmente. Si conoscono alcuni casi nei quali, tuttavia, il cambiamento del potenziale di riposo con l'aumento di [K+esterno] è lento. Le fibre muscolari del verme della farina (Tenebrio molitor) rimangono per molte ore al loro potenziale di riposo iniziale dopo che [K+esterno] è aumentata così da rendere EK positivo all'interno (v. Belton e Grundfest, 1962). In tale condizione un breve stimolo depolarizzante genera un potenziale di azione dovuto al K+, durante il quale si ha inversione del potenziale di membrana, che presenta l'aspetto generale del potenziale d'azione dovuto al Cl- della fig. 22. È questa una elettrogenesi prolungata che indica che l'aumentata conduttanza al K+, provocata dal breve stimolo, diminuiva molto lentamente, cioè che l'inattivazione al K+ è piccola o assente.
Potenziali d'azione generati come descritto nello schema della fig. 19C sono mostrati nella fig. 23. Neuroni del pesce palla hanno di solito un potenziale di riposo di circa − 70 mV e si depolarizzano (a circa − 14mV) quando sono messi in una soluzione salma isosmotica di K+. I dati in blocco di voltaggio nel grafico della fig. 23 mostrano che la cellula può ripolarizzarsi al potenziale di riposo originale (freccia), quando si applica una corrente diretta verso l'interno. La conduttanza della membrana, che è alta nello stato di depolarizzazione, ritorna approssimativamente al basso valore iniziale di ripolarizzazione (v. Grundfest, Ionic mechanisms..., 1961). Il passaggio da una alta a una bassa conduttanza genera una caratteristica a pendenza negativa come quella indicata nella fig. 19B e sarà discussa più avanti. Per ora esamineremo solo l'effetto di un breve stimolo depolarizzante. Se la depolarizzazione è grande abbastanza da portare il potenziale di membrana nella regione a pendenza negativa, la cellula genera un potenziale d'azione quando la caratteristica si sposta allo stato di alta conduttanza. Queste tre risposte si vedono nelle registrazioni riportate nella fig. 23. Gli stimoli erano impulsi che duravano circa 50 ms, e quando essi erano terminati la membrana rimaneva depolarizzata producendo potenziali d'azione al K+ di lunga durata. L'ampiezza del potenziale di azione declinava gradualmente e questo era collegato (registrazione C) con un aumento nella resistenza della membrana. Tale mutamento è anche messo in evidenza dai dati in blocco di voltaggio. La pendenza della parte positiva della caratteristica ad alta conduttanza diminuiva col tempo, ruotando intorno ad un punto (circa − 5mV) che rappresenta EK. Quando la pendenza diminuiva gradualmente, anche la corrente diretta verso l'interno diminuiva.
In condizioni normali, quando [K+esterno] è di solito assai inferiore a [K+interno], EK è molto negativo internamente. L'attivazione del K+ allora, verosimilmente, non è in grado di provocare mutamenti nel potenziale di membrana, tranne che quando EK ed EM differiscono marcatamente. Nella maggior parte dei casi, come nell'assone gigante di calamaro (v. fig. 13 e 17), l'elettrogenesi prodotta dall'attivazione del K+ è un'iperpolarizzazione. Così, i potenziali d'azione al K+ non si verificano normalmente, mentre le normali condizioni elettrochimiche possono favorire la produzione di potenziali d'azione al Ca2+, come nel muscolo di crostaceo o nel Paramecium, e potenziali d'azione al Cl-, come nelle alghe. È tuttavia importante l'elettrogenesi sperimentale dei potenziali d'azione al K+, per stabilire che il principale processo implicato nell'elettrogenesi del potenziale d'azione è un aumento nella conduttanza. La natura dello ione è secondaria, poiché richiede solo che l'aumento coinvolga uno ione che forma una batteria positiva all'interno.
c) Risposte di inattivazione.
Una diminuzione della conduttanza dallo stato di riposo porta pure ad una caratteristica a pendenza negativa, come schematizzato nella fig. 19B. Come già osservato, la diminuzione della conduttanza diviene evidente quando il cambiamento interessa la conduttanza più alta della membrana a riposo, che è quella di GK. Così, le risposte note di inattivazione riguardano i casi di inattivazione al K+.
La presenza di inattivazione al K+ depolarizzante è stata osservata nel tessuto cardiaco (v. fig. 20, grafico inferiore). La corrente non aumentava quando aumentava il potenziale, a dimostrazione che dI/dE è negativo. L'inattivazione del K+ depolarizzante è ancora più evidente nelle elettroplacche di gimnoto, in cui l'elettrogenesi del potenziale d'azione produce una diminuita conduttanza al K+ (v. Nakamura e altri, Analysis of.., 1965; v. Morlock e altri, 1968). Nelle misurazioni della fig. 24 l'elettrogenesi del potenziale d'azione era eliminata immergendo la cellula in una soluzione salina isosmotica di K+. La conduttanza a riposo rappresenta così la somma di una componente di dispersione non reattiva (GL) e della conduttanza al K+ (GK). Quando la cellula veniva depolarizzata da una corrente diretta verso l'esterno, il potenziale di membrana si spostava attraverso una zona proibita, mentre la conduttanza si spostava da (GL + GK) ad un valore più basso, GL solo. La risposta di inattivazione è illustrata nelle registrazioni della fig. 24B. Una corrente diretta verso l'esterno, della durata di circa 15 ms e pienamente idonea a produrre inattivazione del K+, causava una depolarizzazione iniziale appropriata all'alta conduttanza (GL + GK). Tuttavia, a questo potenziale la conduttanza diminuiva col tempo e si sviluppava un nuovo valore di condizione stabile del potenziale. Questa risposta veniva meno quando la corrente cessava.
Le elettroplacche di gimnoto mostrano anche inattivazione del K+ in risposta a correnti dirette verso l'interno, come è pure mostrato nel grafico e nelle registrazioni della fig. 24. Lo spostamento da (GL + GK) alla bassa conduttanza (GL) in iperpolarizzazione richiedeva una maggiore corrente ed il potenziale di condizione stabile della risposta di inattivazione iperpolarizzante era più ampio di quello indotto dalla corrente depolarizzante di soglia. Anche il passaggio dall'iperpolarizzazione iniziale allo stato di stabilità era più lento. La risposta di inattivazione iperpolarizzante veniva anch'essa a mancare quando la corrente era interrotta.
Le risposte di inattivazione mostrate nella fig. 24 implicano un passaggio di un solo valore da uno stato di alta conduttanza ad uno di più bassa conduttanza. Tale caso non si verifica sempre. Nel muscolo cardiaco, per esempio (v. fig. 20), l'inattivazione del K+ depolarizzante èo mascherata o abolita da un'ulteriore depolarizzazione, cosicché la conduttanza aumenta ancora. Risposte di inattivazione iperpolarizzante possono anche mostrare cambiamenti più complessi nella conduttanza. La conduttanza a riposo delle fibre muscolari di aragosta è relativamente alta, poiché forse riflette la somma GL + GK, come nelle elettroplacche di gimnoto. Quando una fibra è iperpolarizzata da una corrente diretta verso l'interno, si sviluppa inattivazione del K+ e la membrana diventa ancor più iperpolarizzata (v. fig. 25). Tuttavia, mentre la corrente stimolante è ancora presente, l'iperpolarizzazione decresce e la risposta appare come un ‛potenziale d'azione negativo', che diventa più breve quando si aumenta la corrente. Il livello del plateau di iperpolarizzazione rimane più piccolo mentre si applica la corrente, ma con correnti più prolungate possono avvenire ulteriori mutamenti nel potenziale. La diminuita iperpolarizzazione al plateau indica che la conduttanza dopo diminuzione durante il ‛potenziale d'azione negativo', era di nuovo aumentata. Tale aumento può persistere per un lungo tempo dopo che la corrente è finita. Mentre la diminuita conduttanza è dovuta a inattivazione del K+ iperpolarizzante, l'accresciuta conduttanza appare dovuta ad attivazione del Ca2+ iperpolarizzante. Tale cambiamento appare come una piccola persistente depolarizzazione successiva all'interruzione della corrente diretta verso l'interno.
L'accresciuta conduttanza al Ca2+ durante il plateau della risposta iperpolarizzante dovrebbe dare luogo ad un flusso di Ca2+ verso l'interno della fibra muscolare e tale flusso dovrebbe essere messo in evidenza da una contrazione della fibra muscolare. In effetti è stata osservata una contrazione provocata dalla persistenza di una corrente diretta verso l'interno (v. Reuben e altri, 1967; v. Uchitel e García, 1974). Essa si correla nel tempo con la fase di conduttanza aumentata ed è abolita in presenza di Mn2+.
Perché una cellula generi una risposta di inattivazione la conduttanza a riposo deve includere una notevole componente di GK (v. fig. 24). In molte cellule, come per es. negli assoni di calamaro e di rana o nei neuroni del pesce palla (v. fig. 23), la conduttanza a riposo è soprattutto quella della componente non reattiva. Per provocare una risposta di inattivazione al K+ osservabile, la conduttanza a riposo può essere accresciuta depolarizzando la cellula con alta [K+esterno]. La condizione di alta conduttanza può essere quindi capovolta da una corrente diretta verso l'interno, come si è visto nei dati in blocco di voltaggio della fig. 23. Nel neurone di pesce palla e nell'assone di rana il cambiamento verso una bassa conduttanza persiste mentre la corrente è applicata, cosicché la risposta di inattivazione iperpolarizzante appare come nell'elettroplacca di gimnoto (v. fig. 24). Nell'assone di calamaro, tuttavia, si sviluppa un aumento secondario della conduttanza, come nelle fibre muscolari di aragosta (v. fig. 25).
Le risposte di inattivazione sono di importanza teorica, poiché riflettono la capacità della membrana elettricamente eccitabile di sviluppare una diminuzione della conduttanza in risposta agli stimoli. Tuttavia, il significato funzionale delle risposte di inattivazione è limitato. L'inattivazione del K+ depolarizzante elimina l'elettrogenesi ripolarizzante dovuta all'attivazione del K+ (v. fig. 17) e se GK a riposo è alta, come avviene nelle elettroplacche di gimnoto, la corrente diretta verso l'interno associata all'elettrogenesi del potenziale d'azione è spinta al massimo dall'inattivazione del K+ depolarizzante. La corrente d'azione dell'organo elettrico è usata come difesa e offesa. La mancanza di corrente diretta verso l'esterno permette un maggiore rendimento durante la scarica dell'organo elettrico.
L'inattivazione del K+ depolarizzante nel muscolo cardiaco (v. fig. 20) riduce la ripolarizzazione ed è probabilmente responsabile della fase di plateau del potenziale d'azione del cuore. La depolarizzazione mantenuta tende ad aumentare la forza e la durata della contrazione. Finora non è stato attribuito un significato funzionale alle risposte diinattivazione iperpolarizzante.
10. Eventi della membrana durante l'elettrogenesi.
Le sezioni precedenti descrivono e documentano una generalizzazione della teoria ionica della bioelettrogenesi. Le membrane delle diverse cellule mostrano, in varie proporzioni, diminuzione ed aumento della conduttanza e questi cambiamenti possono coinvolgere vari ioni. La risposta iniziale dipende dallo stato della membrana. Naturalmente, se si deve mettere in evidenza una diminuzione della conduttanza, questa per il corrispondente ione deve essere relativamente alta allo stadio iniziale. Tale limitazione non è pertinente quando la risposta consiste in un aumento della conduttanza. Infatti, la conduttanza a riposo della maggior parte delle cellule è bassa, e corrisponde o è vicina a quella della componente non reattiva di ‛perdita', GL (v. figg. 16, 17, 20, 21 e 23).
a) ‛Chiuse' e canali.
Come molti ulteriori lavori hanno confermato ed elaborato, la teoria ionica di Hodgkin e Huxley (v., A quantitative description..., 1952) comprende due elementi qualitativamente differenti nelle reazioni delle membrane eccitabili. Uno stimolo appropriato agisce su chiuse che controllano il movimento di ioni attraverso canali o pori selettivamente permeabili. Lo stimolo può aprire o chiudere l'uno o l'altro sistema di canali. Le cinetiche dei processi di regolazione delle chiuse non sono ancora note. Il movimento di ioni attraverso canali selettivamente permeabili è una funzione del gradiente elettrochimico, che è la forza motrice per lo ione particolare.
b) Separazione dei canali ionici.
La prima identificazione sperimentale dei flussi indipendenti di una corrente precoce e tardiva durante un blocco di voltaggio, con movimenti rispettivamente di Na+ e di K+, venne (v. Hodgkin e Huxley, Currents carried..., e A quantitative description..., 1952) da studi nei quali la corrente iniziale era o ridotta o eliminata mettendo l'assone in un mezzo a basso contenuto o privo di Na+. Studi più recenti hanno utilizzato vari agenti in grado di indurre inattivazione farmacologica selettiva e la possibilità di perfondere l'interno di cellule con varie soluzioni. La tetrodotossina (TTX) e la sassitossina (STX) bloccano l'attivazione dell'Na+ (v. Narahashi e altri, 1964; v. i contributi di Nakamura e altri, 1965), mentre il tetraetilammonio (TEA+) e gli ioni a struttura simile possono eliminare l'aumento della conduttanza per il K+ (v. Tasaki e Hagiwara, 1957; v. Hagiwara e Saito, 1959; v. i contributi di Hille, 1967; v. Koppenhbfer, 1967). Questi due effetti possono avvenire indipendentemente. Quando l'attivazione dell'Na+ è eliminata dalla TTX o dall'STX il potenziale d'azione è abolito, mentre l'eliminazione dell'attivazione del K+ per opera del TEA+ prolunga solo la fase di caduta del potenziale d'azione, poiché è presente l'elettrogenesi depolarizzante, mentre manca l'elettrogenesi ripolarizzante.
I dati con il blocco di voltaggio della fig. 26 sui nodi di rana mostrano la separazione delle due componenti per opera della TTX e del TEA. La sequenza A e B dei tracciati fu fatta con il nodo immerso in una soluzione salma di controllo (Ringer). Le registrazioni rappresentano una successione graduale di depolarizzazioni in aumento, e le correnti iniziali dirette verso l'interno, che aumentano e diminuiscono in ampiezza (come nella fig. 16), sono seguite da correnti dirette verso l'esterno che raggiungono uno stadio stabile appropriato a ciascun livello di depolarizzazione.
In presenza di TTX le correnti iniziali venivano eliminate, ma le correnti tardive dirette verso l'esterno persistevano invariate. Esse aumentavano gradualmente e, per i primi ms dopo l'inizio della depolarizzazione, è evidente una piccola corrente diretta verso l'esterno, o questa manca del tutto. In presenza di TEA, d'altra parte, la componente tardiva è assente, mentre la corrente diretta verso l'interno si vede svilupparsi rapidamente e decrescere quando il potenziale di membrana è bloccato. Quando il potenziale è divenuto fortemente positivo all'interno, la corrente iniziale transitoria è diretta verso l'esterno. Questo è in armonia con quanto notato nella fig. 16, quando il potenziale di membrana è reso più positivo dell'ENa. La forza motrice per l'Na+ è allora diretta verso l'esterno.
c) La permeabilità selettiva dei diversi canali.
Fra le altre cose, la fig. 26 mostra che i rispettivi sistemi di canali dell'Na+ e del K+ sono fortemente selettivi nei riguardi di altri cationi. C'è una corrente al K+ piccola o non osservabile verso l'esterno quando il TEA blocca i canali del K+, ma non c'è alterazione dei canali dell'Na+. Verosimilmente, quando i canali dell'Na+ sono bloccati dalla TTX il flusso di Na+ attraverso i canali del K+ è piccolo o manca. La permeabilità selettiva non è tuttavia assoluta. Alcuni ioni, come l'idrossilammina ed il Li+, sono permeanti attraverso i ‛canali dell'Na+' quasi come lo stesso Na+ (v. tab. I). Il K+ è permeante soltanto di circa 1/12 rispetto all'Na+ e l'Rb+ ed il Cs+ circa da 1/50 a 1/100. Li+, N+ e Cs+ sono quasi completamente non permeanti ai canali del K+, mentre Rb+ e NH+4 sono abbastanza permeanti.
Alcune regioni della membrana cellulare possono essere permeabili ad anioni piuttosto che a cationi. Questo è il caso dei siti della membrana per i PPS di molti tipi di cellule (v. fig. 10), delle elettroplacche di torpedine (v. figg. 21 e 22), e delle terminazioni dell'STT delle fibre muscolari di Artropodi (v. fig. 5). Si è pensato che i canali selettivamente permeabili agli anioni siano regioni di membrana a prevalente carica positiva, mentre le regioni selettivamente permeabili ai cationi siano caricate negativamente. Una teoria generale sulle permeabilità selettive osservate in sistemi non viventi (per es. elettrodi di vetro) è stata sviluppata da Eisenman (v., 1962 e 1969) ed è applicabile a varie membrane biologiche (v. Diamond e Wright, 1969). Secondo questa teoria la preferenza nella selettività ionica è governata da interazioni elettrostatiche tra uno ione di un dato raggio, molecole di acqua e siti caricati della membrana. Il dipolo e l'intensità del campo determinano la sequenza di selettività. Zone di intensità di campo molto bassa mostrano preferenza per il legame con Cs+> Rb+> K+> Na+> Li+ (I sequenza di Eisenman), essendo il catione più grande e più idratato che lega più fortemente. Nelle zone di intensità di campo molto alta, la preferenza di legame è per Li+> Na+> K+> Rb+> Cs+ (XI sequenza). Nelle zone di intensità di campo intermedia (II-X) l'uno o l'altro degli ioni intermedi (Na+, K+ o Rb+) può essere quello che si lega più fortemente. Anche le membrane biologiche mostrano lo stesso tipo di selettività per gli ioni (v. Diamond e Wright, 1969). È, tuttavia, assai verosimile che le ‛chiuse' che controllano il movimento degli ioni siano collegate con zone canali di intensità di campo che determinano la selettività osservata durante l'attivazione da parte di stimoli elettrostatici o specifici (v. anche Hille, 1972).
È anche verosimile che l'architettura dei canali della membrana svolga una funzione nel determinare la loro permeabilità ai diversi ioni. Hille (v., 1971) ha correlato le permeabilità relative di una serie di cationi organici, misurate dalle correnti iniziali dirette verso l'interno, con la loro struttura. Egli concluse che il canale dell'Na+ è un poro acquoso con una sezione trasversa di circa 3×5 Å e che le sue pareti sono probabilmente allineate con una serie di 6 atomi di ossigeno. L'azione della TTX o dell'STX nel bloccare i pori dell'Na+ probabilmente deriva da un'attrazione elettrostatica dell'agente per il poro dell'Na+ e dalla sua incapacità a passare attraverso il poro a causa della sua grandezza.
Un semplice modello di questo tipo di controllo della selettività si applica ai canali GK dell'elettroplacca di gimnoto (v. Ruiz-Manresa e Grundfest, 1973). In stato di riposo, questi canali sono aperti, ma si possono chiudere con l'aggiunta di piccole concentrazioni di Cs+, Rb+ o Ba2+ (v. Nakamura e altri, The action..., 1965; v. Ruiz-Manresa e altri, 1970). Gli effetti del Ba2+ sulle caratteristiche differiscono da quelli del Cs+ o dell'Rb+ (v. fig. 27).
Si possono spiegare le modalità dell'interazione (v. fig. 28) ammettendo che il poro GK sia abbastanza ampio da ricevere sia K+ sia Ba2+ (raggi del cristallo 1,33 e 1,55 Å, rispettivamente), ma troppo piccolo per Cs+ (raggio del cristallo 1,67 Å). Si pensa anche che il poro abbia un ‛montante' caricato negativamente presso il bordo esterno della membrana. Questo sito caricato potrebbe limitare il movimento del Ba2+ una volta che quest'ultimo sia entrato nel poro, e potrebbe anche attrarre gli ioni Cs+. L'attrazione di Cs+ potrebbe essere intensificata da un campo che muova una corrente all'interno ed essere ridotta dal passaggio di una corrente diretta verso l'esterno. La caratteristica corrente-voltaggio dell'elettroplacca mostra infatti una tale asimmetria quando è presente Cs+ (v. fig. 27). I canali GK sono allora chiusi alle correnti dirette verso l'interno, ma vengono aperti da piccole depolarizzazioni e sono di nuovo chiusi quando la membrana è diventata più fortemente positiva all'interno. I canali, tuttavia, sono chiusi a tutti i valori del potenziale di membrana quando è presente Ba2+.
I canali del K+ dell'assone di calamaro possono essere bloccati dal TEA+, ma solo se quest'ultimo è presente nell'assoplasma (v. Tasaki eHagiwara, 1957). Lo ione entra nei canali del K+ quando c'è una corrente diretta verso l'esterno attraverso la membrana, e apparentemente è posto in alcuni restringimenti che permettono al K+ o all'Rb+, ma non al TEA+, di passare (v. Armstrong, 1969 e 1971). Questo grande ione è dislocato dalla corrente come il Cs+ è dislocato nelle elettroplacche di gimnoto (v. figg. 27 e 28), ma da una corrente diretta verso l'interno nell'assone, poiché il sito di blocco si trova nella superficie interna della membrana.
d) Densità dei canali.
Poiché i canali dell'Na+ e del K+ appaiono come entità separate, il loro numero per unità di area della membrana determinerà la conduttanza. Ammettendo che i pori abbiano conduttanza media uniforme in differenti membrane, una membrana a bassa conduttanza per l'Na+ e il K+ deve avere bassa densità di pori, mentre la densità può essere alta nelle membrane che hanno un'alta conduttanza durante l'attività. Nelle elettroplacche dei pesci fortemente elettrici la corrente diretta verso l'interno attraverso i canali dell'Na+; può avvicinarsi a 100 mA/cm2 richiedendo una densità di pori corrispondentemente alta. La densità dei canali può essere valutata dalla presunta conduttanza di ciascun poro ionico (v. Hille, 1970). Si ritiene che un poro GNa abbia una conduttanza di circa 10-10 mho. Misurazioni delle correnti ioniche di picco (INa, v. fig. 16) danno quindi valori della densità dei pori che appaiono essere di circa 2,7×1010/cm2 nell'assone di calamaro, 12×1010/cm2 negli assoni di aragosta e di circa 7.500/nodo negli assoni mielinici di rana. Se distribuiti uniformemente sulla superficie della membrana, i pori dovrebbero essere messi ad intervalli di circa 6.000 Å, 3.000 Å e 600 Å l'uno dall'altro in queste cellule. Si pensa che la conduttanza dei pori GK negli assoni di calamaro sia notevolmente più bassa (da 10-11 a 10-12 mho). La densità di questi pori dovrebbe essere corrispondentemente più alta se ÀK≅ÀNa. La densità dei pori eccitabili elettricamente dell'elettroplacca di gimnoto deve essere molto più grande non solo perché la conduttanza della membrana è alta, ma anche perché una grande porzione della membrana eccitabile è occupata da una membrana eccitabile sinapticamente, ma non eccitabile elettricamente.
e) Funzionamento delle ‛chiuse' dei canali eccitabili elettricamente.
Il processo di regolazione delle ‛chiuse' fa sì che i singoli pori dei canali a differente permeabilità selettiva vengano aperti o chiusi. Esso implica chiaramente l'intervento di forze elettriche nella membrana che genera potenziali d'azione, ma il suo meccanismo è ancora ignoto. Tra le possibilità vi sono mutamenti nella distribuzione delle cariche lungo i pori dovuti sia a forze elettrostatiche sia al movimento di ioni critici sotto la spinta della corrente stimolante e di cambiamenti di struttura del canale.
Le cinetiche che determinano la durata dei processi che regolano le chiuse sono naturalmente diverse nei casi dei pori a diversa permeabilità selettiva (v. figg. 26 e 29). Come già notato, la membrana degli assoni di rana è abbastanza permeabile al Li+, ma solo nella misura di circa l'8% di quanto sia permeabile al K+ (v. tab. I). Negli esperimenti della fig. 29, i canali del K+ sono bloccati con TEA+. La corrente causata dal flusso di Li+ (v. fig. 29E) era grande quasi quanto quella trasportata dall'Na+ (A e D), mentre quella trasportata dal K+ (B) è molto piccola. Tuttavia le correnti, se trasportate da Na+, Li+ o K+, hanno simili decorsi temporali, cosa che indica che la cinetica dei loro processi di regolazione delle chiuse è simile se non identica, e propria solo dei canali sensibili alla TTX (C).
La teoria ionica di Hodgkin e Huxley (v., A quantitative description..., 1952) ha adottato una descrizione empirica della cinetica dei processi di regolazione delle chiuse nell'assone gigante di calamaro che è stata provata essere applicabile, con qualche variante, anche ad altre cellule. Questi autori hanno supposto che il canale GNa venisse aperto (attivazione dell'Na+) quando si verificavano tre eventi (o ‛chiuse') ciascuno di probabilità m con le cinetiche dm/dt = αm(1 − m) − βmm; αm e βm sono le costanti di velocità delle reazioni in avanti e indietro sensibili al voltaggio per aprire una ‛chiusa'. Le costanti di velocità dipendono dal potenziale, dalla temperatura, dalla concentrazione in Ca2+ e probabilmente anche dal pH. La depolarizzazione provoca anche sbarramento di una ‛chiusa' (inattivazione dell'Na+) con la cinetica
Così la conduttanza istantanea per il sistema GNa è:
GNa = ÀNam3h
in cui ÀNa è la conduttanza massima di questi canali, quando presumibilmente essi sono tutti aperti. GNa aumenterà con il potenziale di membrana e diminuirà nel tempo mano a mano che si sviluppa l'inattivazione (v. figg. 16, 17, 26 e 29).
L'aumento nella conduttanza al K+ può essere spiegato da una formulazione simile, salvo che non c'è bisogno di richiamarsi all'inattivazione depolarizzante del K+ per l'elettrogenesi del potenziale d'azione nell'assone di calamaro. Mentre una tale inattivazione del K+ avviene nel calamaro (v. Ehrenstein e Gilbert, 1966) così come in altre cellule (per es. nei neuroni di pesce palla, v. fig. 23), essa è un processo troppo lento nella scala del tempo di un normale potenziale d'azione. Così, GK = ÀKn4 in cui ÀK è la massima conduttanza al K+ e n è la probabilità,
Quattro ‛eventi n' sono implicati nell'apertura di una ‛chiusa' K+.
Queste equazioni e i valori sperimentali per le costanti α e β permisero a Hodgkin e Huxley (v., A quantitative description..., 1952) di calcolare le conduttanze attribuite alle correnti dell'Na+ e del K+ misurate in esperimenti in blocco di voltaggio (v. fig. 17). Da tali dati si ottenne la completa descrizione della densità di corrente e del potenziale di membrana durante un potenziale di azione e la forma di quell'impulso (v. Hodgkin e Huxley, A quantitative description..., 1952; v. Hodgkin, 1964).
Potenziali d'azione generati dall'attivazione del Ca2+ nel muscolo di artropodo sono di solito piuttosto prolungati (v. Fatt e Ginsborg, 1958), come sono i potenziali di azione al K+ generati artificialmente (v. fig. 23) o i potenziali di azione al Cl- (v. fig. 22). Le cinetiche della regolazione delle ‛chiuse' dei canali selettivamente permeabili al Ca3+ non sono ancora state studiate profondamente, ma si può supporre che la regolazione delle ‛chiuse' per inattivazione depolarizzante sia un processo lento in confronto allo sbarramento delle ‛chiuse' dell'Na+.
Le cinetiche del processo di regolazione delle ‛chiuse' sono dipendenti dalla temperatura in grado diverso nelle diverse cellule. L'effetto del cambiamento di temperatura ha un coefficiente (Q10) di circa 2,5 per gli eventi m, n e h nell'assone di calamaro (v. Hodgkin e Huxley, A quantitative description..., 1952). Tuttavia, nelle elettroplacche di gimnoto, l'apertura (e la chiusura) delle ‛chiuse' del K+ e l'apertura di quelle dell'Na+ sono piuttosto indipendenti dalla temperatura (Q10 = 1,2), mentre il coefficiente di temperatura per l'inattivazione dell'Na+ è molto alto (Q10 = da 8 a 10; v. Ruiz-Manresa, Temperature effects..., 1970). Alcuni agenti farmacologici possono prolungare notevolmente la durata della corrente all'Na+ (v. Narahashi, 1971). La tossina del Condylactis è un agente particolarmente efficace (v. Narahashi e altri, 1969). La veratridina (v. Ulbricht, 1972) e il veleno di scorpione (v. Schmitt e Schimdt, 1972) agiscono egualmente nel mantenere negli assoni un'alta conduttanza per l'Na+.
Non è, tuttavia, sempre chiaro se un cambiamento nella risposta sia dovuto a un'azione sul processo di regolazione delle ‛chiuse' o sul numero di pori selettivamente permeabili. L'inattivazione farmacologica della conduttanza dell'Na+ per opera della TTX o della conduttanza al K+ con TEA, Ba2+ o Cs+ (v. figg. 26-28) è da attribuire al blocco fisico dei canali selettivamente permeabili. La tossina di Condylactis, il veleno di scorpione e la veratridina mantengono apparentemente aperte le ‛chiuse' dei canali dell'Na+.
f) Funzionamento delle ‛chiuse' dei canali non eccitabili elettricamente.
Una netta distinzione tra processi di regolazione delle ‛chiuse' e permeabilità selettiva ionica è offerta dalle risposte di vari tipi di membrane di neuroni ineccitabili elettricamente (v. fig. 30). Lo stesso agente, acetilcolina, agisce sulle ‛chiuse', cambiando la conduttanza per l'elettrogenesi depolarizzante nelle cellule D di Aplysia e per l'elettrogenesi iperpolarizzante nelle cellule H. La noradrenalina agisce in senso inverso, causando iperpolarizzazione nelle cellule D e depolarizzazione nelle cellule H. Così, l'acetilcolina impedisce un aumento in GK e GNa nelle cellule D, nelle quali agisce come un trasmettitore eccitatorio. Per le cellule H, tuttavia, l'acetilcolina è un trasmettitore inibitorio, poiché fa aumentare GCl. La noradrenalina è similmente un trasmettitore sia inibitorio sia eccitatorio. I canali selettivamente permeabili che hanno ‛chiuse' attivate dall'adrenalina sono reciproci a quelli controllati dalle ‛chiuse' colinergiche. È verosimile che quelli controllati da ‛chiuse' (o recettori) colinergici delle cellule D e H abbiano strutture fondamentalmente simili e che le ‛chiuse' adrenocettive dei due tipi di cellule siano pure simili. In ciascun caso il tipo di elettrogenesi è determinato dai canali ionici che sono aperti quando il trasmettitore appropriato agisce sulla chiusa.
Tuttavia, uno studio più vicino al modello di reattività di varie sinapsi ad agenti farmacologici differenti, indica (come è mostrato nella fig. 30) che le strutture del recettore devono differire in fini dettagli (v. anche Grundfest, Generalproblems..., 1957; General physiology..., 1961; Comparative electrobiology..., 1966).
Particolarmente interessante in questa connessione è la recente scoperta (v. Kehoe, Ionic mechanism..., e The physiological..., 1972) secondo la quale alcuni neuroni nell'Aplysia posseggono tre tipi di ‛chiuse' colinocettive. Un gruppo controlla l'elettrogenesi depolarizzante dei PPSE. Un altro gruppo di ‛chiuse' apre canali selettivamente permeabili al Cl- dando luogo ai PPSI. Un terzo controlla i canali selettivamente permeabili al K+ che egualmente aumentano i PPSI, ma queste ‛chiuse' si aprono più lentamente e restano aperte per un tempo più lungo. Inoltre, ciascuno dei tre tipi di ‛chiuse' mostra diversi modelli di reattività ai vari agenti inattivatori di sinapsi.
Gli stessi neuroni hanno anche recettori attivati dalla dopammina (DA), che produce elettrogenesi sia depolarizzante sia iperpolarizzante (v. Ascher, 1972). Un'attività depolarizzante è bloccata dalla d-tubocurarina e dalla stricnina, mentre l'iperpolarizzazione, che è dovuta ad aumento di GK, non è alterata. Così, i due tipi di ‛chiuse' attivate da DA sono presenti anche nei neuroni.
Un legame chimico è chiaramente implicato nei processi di regolazione delle ‛chiuse' da parte di componenti di membrane sinaptiche e di altre membrane chemosensibili ed elettricamente ineccitabili. Uno schema relativamente semplice (v. fig. 31) è stato proposto per spiegare la regolazione delle ‛chiuse' dei canali sinaptici nelle elettroplacche di gimnoto (v. Karlin, 1969). Due zone della membrana sembrano essere interessate. Una zona è un legame S-S e l'altra è una regione caricata negativamente. A riposo, quando i canali sinaptici sono chiusi, i due siti sono distanti circa 12 Å o poco più. L'attivazione del canale da parte dell'acetilcolina ha luogo quando questo ione fa da ponte allo spazio vuoto e avvicina i due siti fino a circa 9 Å. Il decametonio (C10), sebbene sia una molecola troppo lunga per adattarsi, può anche farlo ripiegandosi su se stessa ed è un attivatore della sinapsi, mentre l'esametonio (C6) che è pure troppo lungo non può piegarsi e non diviene attivo. Tuttavia, unendosi al sito caricato negativamente, C6 ostacola la combinazione dell'intero complesso recettore con un attivatore. Per cui C6 è farmaco inattivatore che compete con l'acetilcolina o altri attivatori per il sito.
g) Processi in altre membrane recettrici.
Cambiamenti nella permeabilità della membrana in risposta a cambiamenti di temperatura sono noti e possono quindi spiegare la regolazione delle ‛chiuse' nei termorecettori. I recettori meccanici, come i corpuscoli di Pacini e i recettori da stiramento del gambero, che sono neuroni sensoriali primari (v. fig. 9), o le cellule recettrici come quelle auditive o del labirinto (v. Grundfest, The general electrophysiology..., 1971), possono rispondere in modo accettabile ad effetti piezo-strittivi, ma non abbiamo notizie sicure su questi sistemi. Le componenti elettrogeniche di tutti i fotorecettori hanno le ‛chiuse' controllate probabilmente da prodotti delle reazioni fotochimiche formati intracellularmente.
h) Trasmissione per diminuzione della conduttanza.
Mentre segnali codificati come potenziali d'azione sono evocati da potenziali generatori depolarizzanti, la trasmissione di informazione da una cellula non eccitabile elettricamente ad un'altra non richiede l'intervento di un particolare tipo di elettrogenesi (v. Grundfest, 1958, e The general electrophysiology..., 1971). Questo fatto viene dimostrato particolarmente negli eventi sensoriali della retina di Vertebrati. Illuminando le cellule recettrici primarie si provoca un'iperpolarizzazione che è dovuta ad una diminuzione della conduttanza (v. Baylor e Fuortes, 1970; v. Witkovsky, 1971). L'illuminazione produce anche una diminuita conduttanza e una iperpolarizzazione nei successivi recettori secondari (v. Dowling e Ripps, 1973), che è apparentemente provocata dall'interruzione dell'attività secretoria dei bastoncelli o dei coni a riposo quando vengono illuminati. Così, la sospensione della liberazione di trasmettitore serve come un segnale adeguato nella retina. Infine, tuttavia, viene indotta un'elettrogenesi depolarizzante nelle cellule gangliari che producono i potenziali di azione ditali neuroni.
Le cellule gustative del ratto producono egualmente segnali per mezzo di prodotti secretori che agiscono sulle terminazioni nervose afferenti. La risposta al chinino consiste in una diminuita conduttanza, ma altri stimoli provocano un aumento nella conduttanza (v. Ozeki, 1971). I dettagli della trasmissione del segnale sono ancora ignoti.
11. Conclusione.
Le cellule viventi devono essere passate attraverso diverse esperienze nel corso dell'evoluzione dei meccanismi atti a far funzionare il sistema nervoso dei Metazoi. Alcuni risultati di queste esperienze hanno probabilmente piccola validità per l'animale, o non ne hanno affatto, ma sono sta- ti mantenuti in alcune cellule come processi rudimentali. I dati dell'elettrofisiologia generale offrono un documento di queste esperienze e servono per stabilire i principî basilari dei meccanismi che conducono allo sviluppo di una capacità di comunicazione rapida tra le cellule.
Il sistema di comunicazione degli animali presenta alcune analogie con modelli non viventi. Le cellule nervose, tuttavia, si servono a questo scopo di proprietà generali e specifiche comuni a tutte le cellule. Per poter diffondere rapidamente l'informazione, le cellule diventano generatori bioelettrici che producono impulsi, ma per percepire e trasmettere l'informazione esse utilizzano la specifica reattività di trasduttori sensoriali e la specializzazione di funzioni secretorie. Come generatori bioelettrici le cellule utilizzano i sottili strati della membrana cellulare. Quest'ultima agisce non solo con la sua proprietà generale di barriera selettivamente permeabile per mantenere la integrità della struttura cellulare. L'ulteriore possibilità per la bioelettrogenesi sorge perché la membrana cellulare deve stabilire la condizione per un equilibrio ionico ‛Donnan duplice'. Le ineguaglianze che risultano nella distribuzione ionica sono quindi utilizzate per costituire generatori bioelettrici nella forma di celle a concentrazione ionica. Soluzioni saline diventano i conduttori di elettricità e la membrana cellulare agisce anche come un isolante che incanala il flusso dei segnali da una cellula all'altra.
I vari tipi di selettività ionica delle membrane cellulari possono non essere diversi in teoria dalle selettività dei vari sistemi non-viventi. Anche la caratteristica saliente delle membrane eccitabili di generatori bioelettrici, la loro capacità di subire mutamenti piuttosto specifici nella permeabilità selettiva è imitata, sebbene ancora solo parzialmente, da membrane artificiali a due strati. È perciò verosimile che anche i dettagli dei meccanismi di regolazione delle ‛chiuse' della selettività saranno chiariti in un prossimo futuro (v. Grundfest, 1975; v. Keynes, 1975; v. Mullins, 1975).
L'interazione di componenti a diverse funzioni offre alle cellule specializzate del sistema nervoso la capacità di percepire, formare, modulare e trasmettere un'ampia varietà di segnali. Le varietà delle risposte osservate nelle singole cellule sono quindi utilizzate per fornire il sistema nervoso delle sue numerose capacità di accettare, coordinare e sviluppare tale informazione.
Bibliografia.
Altamirano, M., Coates, C. W., Grundfest, H., Mechanisms of direct and neural excitability in electroplaques of electric eel, in ‟Journal of general physiology", 1955, XXXVIII, pp. 319-360.
Altamirano, M., Grundfest, H., Three excitable systems of the synaptic unit in the innervated electroplaque preparation, in ‟Transactions of the American Neurological Association", 1954, LXXIX, pp. 35-38.
Armstrong, C. M., Inactivation of the potassium conductance and related phenomena caused by quaternary ammonium ion injectionin squid axons, in ‟Journal of general physiology", 1969, LIV, pp. 553-575.
Armstrong, C. M., Interaction of tetraethylammonium ion derivatives with potassium channels of giant axons, in ‟Journal of general physiology", 1971, LVIII, pp. 413-437.
Ascher, P., Inhibitory and excitatory effects of dopamine on Aplysia neurones, in ‟Journal of physiology", 1972, CCLV, pp. 173-209.
Baker, P. F., Hodgkin, A. L., Ridgway, E. B., Depolarization and calcium entry in squid giant axons, in ‟Journal of physiology", 1971, CCIX, pp. 709-755.
Bangham, A. D., Membrane models with phospholipids, in ‟Progress in biophysics and molecular biology", 1968, XVIII, pp. 29-95.
Barry, P. H., Volume flows and pressure changes during an action potential in cells of Chara australis. II. Theoretical considerations, in ‟Journal of membrane biology", 1970, III, pp. 335-371.
Baylor, D. A., Fuortes, M. G. F., Electrical responses of single cones in the retina of the turtle, in ‟Journal of physiology", 1970, CCVII, pp. 77-92.
Belton, P., Grundfest, H., Potassium activation and K-spikes in muscle fibers of the mealworm larva (Tenebrio molitor), in ‟American journal of physiology", 1962, CCIII, pp. 588-594.
Bennett, M. V. L., Physiology of electrotonic juntions, in ‟Annals of the New York Academy of Sciences", 1966, CXXXVII, pp. 509-539.
Bernstein, J., Über den zeitlichen Verlauf der negativen Schwankung der Nervenstroms, in ‟Pflügers Archiv", 1868, I, pp. 173-207.
Bernstein, J., Untersuchunghen zur Thermodynamik der bioelektyrischen Ströme, in ‟Pflügers Archiv", 1902, XCII, pp. 521-562.
Bernstein, J., Elektrobiologie, Braunscwheig 1912.
Blanquet, R., Ionic effects on discharge of the isolated and in situ nematocysts of the sea anemone, Aiptasia pallida. A possible role of calcium, in ‟Comparative biochemistry and physiology", 1970, XXXV, pp. 451-461.
Bodian, D., Neurons, circuits and neuroglia, in Neurosciences. A study program (a cura di G. C. Quarton, T. Melnechuk e F. O. Schmitt), New York 1967, pp. 6-24.
Boyle, P. J., Conway, E. J., Potassium accumulation in muscle and associated changes, in ‟Journal of physiology", 1941, C, pp. 1-63.
Brandt, P. W., Reuben, J. P., Grundfest, H., Correlated morphological and physiological studies on isolated single muscle fibers. II. The properties of the crayfish transverse tubular system. Localization of the sites of reversible swelling, in ‟Journal of cell biology", 1968, XXXVIII, pp. 115-129.
Cartaud, J., Benedetti, E. L., Kasai, M., Changeux, J. P., In vitro excitation of purified membrane fragments by cholinergic agonists. IV. Ultrastructure at high resolution of the AcChE-rich and ATPase-rich microsacs, in ‟Journal of membrane biology", 1971, VI, pp. 81-88.
Cohen, B., Bennett, M. V. L., Grundfest, H., Electrically excitable responses in Raia erinacea electroplaques, in ‟Federation proceedings", 1961, XX, p. 339.
Cole, K. S., Curtis, H. J., Electric impedance of the squid giant axon during activity, in ‟Journal of general physiology", 1939, XXII, pp. 648-670.
Curtis, H. J., Cole, K. S., Membrane resting and action potentials from the squid giant axon, in ‟Journal of cellular and comparative physiology", 1942, XIX, pp. 135-144.
Davson, H., Danielli, J. F., The permeability of natural membranes, Cambridge 1943.
Diamond, J. M., Wright, E. M., Biological membranes. The physical basis of ion and nonelectrolyte selectivity, in ‟Annual review of physiology", 1969, XXXI, pp. 581-646.
Dodge, F. A., A study of ionic permeability changes underlying excitation in myelinated nerve fibre of the frog. Ph. D. thesis, New York 1963.
Douglas, W. W., Kanno, T., Sampson, S. R., Effects of acetylcholine and other medullary secreagogues and antagonists on the membrane potential of adrenal chromaffin cells. An analysis employing techniques of tissue culture, in ‟Journal of physiology", 1967, CLXXXVIII, pp. 107-120.
Dowling, J. E., Ripps, H., Effects of Mg++ on skate horizontal cell activity in the skate retina, in ‟Nature", 1973, CCXLII, pp. 101-103.
Du Bois-Reymond, E., Untersuchungen über thierische Elektricität, vol. I, Berlin 1848, vol. II, Berlin 1849.
Du Bois-Reymond, E., Experimentalkritik der Entladungshypothese über die Wirkung von Nerv auf Muskel, in Gesammelte Abhandlungen zur allgemeinen Muskel- und Nervenphysik, vol. II, Leipzig 1877, pp. 698-736.
Eckert, R., Bioelectric control of ciliary activity, in ‟Science", 1972, CLXXVI, pp. 473-481.
Ehrenstein, G., Gilbert, D. L., Slow changes in potassium permeability in squid giant axon, in ‟Biophysical journal", 1966, VI, pp. 553-566.
Eisenman, G., Cation selective glass electrodes and their mode of operation, in ‟Biophysical journal", 1962, II (parte 2), pp. 259-323.
Eisenman, G., Theory of membrane electrode potentials. An examination of the parameters determining the selectivity of solid and liquid ion exchangers and of neutral ion-sequestering molecules, in Ion-selective electrodes (a cura di R. A. Durst), Washington 1969, pp. 1-56.
Erlanger, J., Blair, E. A., Manifestation of segmentation in myelinated axons, in ‟American journal of physiology", 1934, CX, pp. 287-311.
Erlanger, J., Gasser, H. S., Electrical signs of nervous activity, Philadelphia 1937.
Fambrough, D. M., Acetylcholine sensitivity of muscle fiber membrane. Mechanism of regulation by motoneurons, in ‟Science", 1970, CLXVIII, pp. 372-373.
Fatt, P., Ginsborg, B. L., The ionic requirements for the production of action potentials in crustacean muscle fibres, in ‟Journal of physiology", 1958, CXLII, pp. 516-543.
Freeman, A. R., Reuben, J. P., Brandt, P. W., Grundfest, H., Osmometrically determined characteristics of the cell membrane of squid and lobster giant axons, in ‟Journal of general physiology", 1966, L, pp. 423-445.
Gaffey, C. T., Mullins, L. J., Ion fluxes during the action potential in Chara, in ‟Journal of physiology", 1958, CXLIV, pp. 505-524.
Gage, P. W., Morre, J. W., Synaptic current at the squid giant axon, in ‟Science", 1969, CLXVI, pp. 510-512.
Gainer, H., Grundfest, H., Permeability of alkali metal cations in lobster muscle. A comparison of electrophysiological and osmometric analyses, in ‟Journal of general physiology", 1968, LI, pp. 399-425.
Gainer, H., Reuben, J. P., Grundfest, H., The augmentation of post-synaptic potentials in crustacean muscle fibers by cesium. A presynaptic mechanism, in ‟Comparative biochemistry and physiology", 1967, XX, pp. 877-900.
Garratt, G. R. M., Telegraphy, in A history of technology (a cura di C. Singer, E. J. Holmyard, A. R. Hall e T. J. Williams), vol. IV, New York-London 1958, pp. 644-662.
Geduldig, D., Junge, D., Sodium and calcium components of action potentials in one Aplysia giant neurone, in ‟Journal of physiology", 1968, CIC, pp. 347-365.
Gerschenfeld, H. M., Lasansky, A., Action of glutamic acid and other naturally occurring amino-acids on snail central neurons, in ‟International journal of neuropharmacology", 1964, III, pp. 301-314.
Gerschenfeld, H. M., Tauc, L., Pharmacological specificities of neurones in an elementary central nervous system, in ‟Nature", 1961, CLXXXIX, pp. 924-925.
Girardier, L., Reuben, J. P., Brandt, P. W., Grundfest, H., Evidence for anion permselective membrane in crayfish muscle fibers and its possible role in excitation-contraction coupling, in ‟Journal of general physiology", 1963, XLVII, pp. 189-214.
Goldman, D. E., Potential, impedance, and rectification in membrane, in ‟Journal of general physiology", 1943, XXVII, pp. 37-40.
Goldman, D. E., Excitability models, in Biophysics and physiology of excitable membranes (a cura di W. J. Adelman, Jr.), New York 1971, pp. 337-358.
Gorter, E., Grendel, F., On bimolecular layers of lipoids on the chromocytes of the blood, in ‟Journal of experimental medicine", 1925, XLI, pp. 439-443.
Grampp, W., Harris, J. B., Thesleff, S., Inhibition of denervation changes in skeletal muscle by blockers of protein synthesis, in ‟Journal of physiology", 1972, CXXI, pp. 743-754.
Grundfest, H., Electric field effects and synaptic potentials in the functioning of the nervous system, in Problems of modern physiology of the nerve and muscle systems, Tbilisi 1956, pp. 81-97.
Grundfest, H., Electrical inexcitability of synapses and some of its consequences in the central nervous system, in ‟Physiological reviews", 1957, XXXVII, pp. 337-361.
Grundfest, H., Excitation at synapses, in ‟Journal of neurophysiology", 1957, XX, pp. 316-324.
Grundfest, H., Excitation triggers in post-junctional cells, in Physiological triggers (a cura di T. H. Bullock), Washington 1957, pp. 119-151.
Grundfest, H., General problems of drug action on bioelectric phenomena, in ‟Annals of the New York Academy of Sciences", 1957, LXVI, pp. 537-591.
Grundfest, H., The mechanisms of discharge of the electric organs in relation to general and comparative electrophysiology, in ‟Progress in biophysics and molecular biology", 1957, VII, pp. 1-85.
Grundfest, H., An electrophysiological basis for cone vision in fish, in ‟Archives italiennes de biologie", 1958, XCVI, pp. 135-144.
Grundfest, H., Evolution of conduction in the nervous system, in Evolution of nervous control (a cura di A. D. Bass), Washington 1959, pp. 43-86.
Grundfest, H., Synaptic and ephaptic transmission, in Handbook of physiology (a cura di J. Field), vol. I, Neurophysiology, Washington 1959, pp. 147-197.
Grundfest, H., Excitation by hyperpolarizing potentials. A general theory of receptor activities, in Nervous inhibition (a cura di E. Florey), London 1961, pp. 326-341.
Grundfest, H., General physiology and pharmacology of junctional transmission, in Biophysics of physiological and pharmacological actions (a cura di A. M. Shanes), Washington 1961, pp. 329-389.
Grundfest, H., Ionic mechanisms in electrogenesis, in ‟Annals of the New York Academy of Sciences", 1961, XCIV, pp. 405-457.
Grundfest, H., Dynamics of ion permeability in resting and excited membranes, in Proceedings of the XXII International Union of the Physiological Societies, vol. I (parte 2), 1962, pp. 590-593.
Grundfest, H., Impulse conducting properties of cells, in The general physiology of cell specialization (a cura di D. Mazia e A. Tyler), New York 1963, pp. 277-322.
Grundfest, H., Evolution of electrophysiological varieties among sensory receptor systems, in Essays on physiological evolution (a cura di J. W. S. Pringle), London 1964, pp. 107-138.
Grundfest, H., Electrophysiology and pharmacology of different components of bioelectric transducers, in ‟Cold Spring Harbor symposium on quantitative biology", 1965, XXX, pp. 1-14.
Grundfest, H., Julius Bernstein, Ludimar Hermann and the discovery of the overshoot of the axon spike, in ‟Archives italiennes de biologie", 1965, CIII, pp. 483-490.
Grundfest, H., Comparative electrobiology of excitable membranes, in Advances in comparative physiology and biochemistry (a cura di O. E. Loewenstein), vol. II, New York 1966, pp. 1-116.
Grundfest, H., Heterogeneity of excitable membrane. Electreophysiological and pharmacological evidence and some consequences, in ‟Annals of the New York Academy of Sciences", 1966, CXXXVII, pp. 901-949.
Grundfest, H., Synaptic and ephaptic transmission, in The neurosciences. A study program (a cura di G. C. Quarton, T. Melnechuck e F. O. Schmitt), New York 1967, pp. 353-372.
Grundfest, H., The general electrophysiology of input membrane in electrogenic excitable cells, in Handbook of sensory physiology (a cura di W. R. Loewenstein), vol. I, Principles of receptor physiology, Berlin 1971, pp. 135-165.
Grundfest, H., The varieties of excitable membranes, in Biophysics and physiology of excitable membranes (a cura di W. J. Adelman, Jr.), New York 1971, pp. 477-504.
Grundfest, H., Physiology of electrogenic excitable membranes, in The nervous system (a cura di D. B. Tower), vol. I, The basic neurosciences, New York 1975, pp. 153-164.
Grundfest, H., Aljure, E., Janiszewski, L., The ionic nature of conductance increases induced in Rajid electroplaques by depolarizing and hyperpolarizing currents, in ‟Journal of general physiology", 1962, XLV, p. 598.
Grundfest, H., Kusano, K., Role of various cations in depolarizing electrogenesis of mealworm muscle fibers, in ‟Journal of general physiology", 1970, LV, p. 139.
Hagiwara, S., Nakajima, S., Differences in Na and Ca spikes as examined by application of tetrodotoxin, procaine and manganese ions, in ‟Journal of general physiology", 1966, XLIX, pp. 793-806.
Hagiwara, S., Saito, N., Voltage-current relations in nerve cell membrane of Onchidium verruculatum, in ‟Journal of physiology", 1959, CXLVIII, pp. 161-179.
Haydon, D. A., Hladky, S. B., Ion transport across thin lipid membranes. A critical discussion of mechanism in selected systems, in ‟Quarterly review of biophysics", 1972, V, pp. 187-282.
Helfferich, F., Ion exchange, New York 1962.
Helmholtz, H., Messungen über den zeitlichen Verlauf der Zuckung animalischer Muskelen und die Fortpflanzungsgeschwindigkeit der Reizung in den Nerven, in ‟Archiv für Anatomie, Physiologie und wissenschafltiche Medizin", 1850, pp. 276-365.
Hendler, R. W., Biological membrane ultrastructure, in ‟Physiological reviews", 1971, LI, pp. 66-97.
Hermann, L., Allgemeine Nervenphysiologie, in Handbuch der Physiologie, vol. II, Leipzig 1879, pp. 1-196.
Hermann, L., Zur Theorie der Erregungsleitung und der elektrischen Erregung, in ‟Pflügers Archiv", 1899, LXXV, pp. 574-590.
Hille, B., A pharmacological analysis of ionic channels of nerve. Ph. D. thesis, New York 1967.
Hille, B., The selective inhibition of delayed potassium currents in nerve by tetraethylammonium ion, in ‟Journal of general physiology", 1967, L, pp. 1287-1302.
Hille, B., Ionic channels in nerve membranes, in ‟Progress in biophysics and molecular biology", 1970, XXI, pp. 3-32.
Hille, B., The permeability of the sodium channel to organic cations in myelinated nerve, in ‟Journal of general physiology", 1971, LVIII, pp. 599-610.
Hille, B., The permeability of the sodium channel to metal cations in myelinated nerve, in ‟Journal of general physiology", 1972, LIX, pp. 637-658.
Hille, B., Bennett, M. V. L., Grundfest, H., Voltage clamp measurements of the Cl-conductance changes in skate electroplaques, in ‟Biological bulletin", 1965, CXXIX, p. 407.
Hinke, J. A. M., Glass microelectrodes in the study of binding and compartmentalization of intracellular ions, in Glass microelectrodes (a cura di M. Lavallé, O. F. Schanne e N. Hebert), New York 1969, pp. 348-375.
Hodgkin, A. L., Evidence for electrical transmission in nerve, in ‟Journal of physiology", 1937, XC, pp. 183.
Hodgkin, A. L., Evidence for electrical transmission in nerve, in ‟Journal of physiology", 1937, XC, pp. 183.
Hodgkin, A. L., The subthreshold potentials in a crustacean nerve fibre, in ‟Proceedings of the Royal Society" (Series B), 1938, CXXVI, pp. 87-121.
Hodgkin, A. L., The ionic basis of electrical activity in nerve and muscle, in ‟Biological reviews", 1951, XXVI, pp. 339-407.
Hodgkin, A. L., The conduction of the nervous impulse, Liverpool 1964.
Hodgkin, A. L., Huxley, A. F., Action potential recorded from inside a nerve fibre, in ‟Nature", CXLIV, pp. 710-711.
Hodgkin, A. L., Huxley, A. F., Resting and action potentials in single nerve fibres, in ‟Journal of physiology", 1945, CIV, pp. 176-195.
Hodgkin, A. L., Huxley, A. F., Current carried by sodium and potassium ions through the membrane of the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVI, pp. 449-472.
Hodgkin, A. L., Huxley, A. F., The components of membrane conductance in the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVI, pp. 473-496.
Hodgkin, A. L., Huxley, A. F., The dual effect of membrane potential on sodium conductance in the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVI, pp. 497-596.
Hodgkin, A. L., Huxley, A. F., A quantitative description of membrane current and its application to conduction and excitation in nerve, in ‟Journal of physiology", 1952, CXVII, pp. 500-544.
Hodgkin, A. L., Huxley, A. F., Katz, B., Measurement of current voltage relations in the membrane of the giant axon of Loligo, in ‟Journal of physiology", 1952, CXVII, pp. 424-448.
Hodgkin, A. L., Katz, B., The effect of sodium ions on the electrical activity of the giant axon of the squid, in ‟Journal of physiology", 1949, CVIII, pp. 37-77.
Huxley, A. F., Stämpfli, R., Evidence for saltatory conduction in peripheral myelinated nerve fibres, in ‟Journal of physiology", 1949, CVIII, pp. 315-339.
Karlin, A., Chemical modification of the active site of the acetylcholine receptor, in ‟Journal of general physiology", 1969, LIV, pp. 245s-264s.
Kehoe, J., Ionic mechanisms of a two-component cholinergic inhibition in Aplysia neurones, in ‟Journal of physiology", 1972, CCXXV, pp. 85-114.
Kehoe, J., Three acetylcholine receptors in Aplysia neurones, in ‟Journal of physiology", 1972, CCXXV, pp. 115-146.
Kehoe, J., The physiological role of three acetylcholine receptors in synaptic transmission in Aplysia, in ‟Journal of physiology", 1972, CCXXV, pp. 147-172.
Keynes, R. D., Organization of the ionic channels in nerve membranes, in The nervous system (a cura di D. B. Tower), vol. I, The basic neurosciences, New York 1975, pp. 165-175.
Koppenhöfer, E., Die Wirkung von Tetraäthylammoniumchlorid auf die Membranströme Ranviersche Schnürringe von Xenopus laevis, in ‟Pflügers Archiv", 1967, CCXCIII, pp. 34-55.
Kordaš, M, The effect of membrane polarization on the time course of the end-place current in frog sartorius muscle, in ‟Journal of physiology", 1969, CCIV, pp. 493-502.
Kordaš, M., An attempt at an analysis of the factors determining the time course of the end-plate current, in ‟Journal of physiology", 1972, CCXXIV, pp. 317-348.
Krogh, A., Osmotic regulation in aquatic animals, Cambridge 1939.
Lillie, R. S., Factors affecting transmission and recovery in the passive iron nerve model, in ‟Journal of general physiology", 1925, VII, pp. 473-507.
Macinnes, D. A., The principles of electrochemistry, New York 1961.
Malhotra, S. K, Organization of the cellular membranes, in ‟Progress in biophysics and molecular biology", 1970, XX, pp. 67-131.
Matteucci, C., Traité des phénomènes électro-physiologiques des animaux, Paris 1844.
Morlock, N. L., Benamy, D. A., Grundfest, H., Analysis of spike electrogenesis of eel electroplaques with phase plane and impedance measurements, in ‟Journal of general physiology", 1968, LII, p. 22-45.
Mueller, P., Rudin, O., Resting and action potentials in experimental bimolecular lipid membranes, in ‟Journal of theoretical biology", 1968, XVIII, pp. 222-258.
Mueller, P., Rudin, D. O., Translocators in bimolecular lipid membranes. Their role in dissipative and conservative bioenergy transduction, in ‟Current topics of bioenergetics", 1969, III, pp. 157-249.
Muller, R. U., Finkelstein, A., Voltage-dependent conductance induced in thin lipid membranes by monazomycin, in ‟Journal of general physiology", 1972, LX, pp. 263-284.
Muller, R. U., Finkelstein, A., The effect of surface charge on the voltage-dependent conductance induced in thin lipid membrane by monoazomycin, in ‟Journal of general physiology", 1972, LX, pp. 285-306.
Mullins, L. J., Efflux of chloride ions during the action potential of Nitella, in ‟Nature", 1962, CXCVI, pp. 986-987.
Mullins, L. J., Ion selectivity of carriers and channels, in ‟Biophysical journal", 1975, XV, pp. 921-931.
Nakajima, S., Analysis of K-inactivation and TEA action in the supramedullary cells of puffer, in ‟Journal of general physiology", 1966, IL, pp. 629-640.
Nakajima, S., Kusano, K., Behavior of delayed current under voltage-clamp in the supramedullary neurons of puffer, in ‟Journal of general physiology", 1966, IL, pp. 613-628.
Nakamura, Y., Nakajima, S., Grundfest, H., The action of tetrodotoxin on electrogenic components of squid giant axons, in ‟Journal of general physiology", 1965, XLVIII, pp. 985-996.
Nakamura, Y., Nakajima, S., Grundfest, H., Analysis of spike electrogenesis and depolarizing K-inactivation in electroplaques of Electrophorus electricus. L., in ‟Journal of general physiology", 1965, IL, pp. 321-349.
Narahashi, T., Neurophysiological basis for drug action. Ionic mechanism, site of action and active form in nerve fibers, in Biophysics and physiology of excitable membranes (a cura di W. J. Adelman, Jr.), New York 1971, pp. 423-462.
Narahashi, T., Moore, J. W., Scott, W. R., Tetrodotoxin blockage of sodium conductance increase in lobster giant axons, in ‟Journal of general physiology", 1964, XLVII, pp. 965-974.
Narahashi, T., Moore, J. W., Shapiro, B. I., Condylactis toxin. Interaction with nerve membrane ionic conductances, in ‟Science", 1969, CLXIII, pp. 680-681.
Overbeek, J. Th. G., The Donnan equilibrium, in ‟Progress in biophysics and biophysical chemistry", 1956, VI, pp. 57-84.
Ozeki, M., Conductance change associated with receptor potentials of gustatory cells in rat, in ‟Journal of general physiology", 1971, LVIII, pp. 688-699.
Prosser, C. L., Comparative animal physiology, vol. I, Philadelphia 1950.
Redfern, P., Thesleff, S., Action potential generation in denervated rat skeletal muscle. II. The action of tetrodotoxin, in ‟Acta physiologica scandinavica", 1971, LXXXII, pp. 70-78.
Reiter, M. J., Cowburn, D. A., Prives, J. M., Karlin, A., Affinity labelling of the acetylcholine receptor in the electroplaque. Electrophoretic separation on sodium dodecyl sulfate, in ‟Proceedings of the National Academy of Sciences", 1972, LXIX, pp. 1168-1172.
Reuben, J. P., Brandt, P. W., García, H., Grundfest, H., Excitation-contraction coupling in crayfish, in ‟American zoologist", 1967, VII, pp. 623-645.
Reuben, J. P., Brandt, P. W., Grundfest, H., Excitation-contraction coupling in crayfish, in ‟American zoologist", 1967, VII, pp. 623-645.
Reuben, J. P., Brandt, P. W., Grundfest, H., Regulation of myoplasmic calcium concentration in intact crayfish muscle fibres, in ‟Journal of mechanochemistry and cell motility", 1974, II, pp. 269-285.
Reuben, J. P., Girardier, L., Grundfest, H., Water transfer and cell structure in isolated crayfish muscle fibers, in ‟Journal of general physiology, 1964, XLVII, pp. 1141-1174.
Reuben, J. P., Werman, R., Grundfest, H., The ionic mechanisms of hyperpolarizing responses in lobster muscle fibers, in ‟Journal of general physiology", 1961, XLV, pp. 243-265.
Robertson, J. D., The molecular structure and contact relationship of cell membranes, in ‟Progress in biophysics and molecular biology", 1960, X, pp. 344-418.
Robinson, J. R., Water regulation in mammalian cells, in ‟Symposium of the Society for Experimental Biology", 1965, XIX, pp. 237-258.
Rosenblueth, A., The transmission of nerve impulses at neuroeffector junctions and peripheral synapses, New York 1950.
Rougier, O., Vassort, G., Garnier, D., Gargouil, Y. M., Coraboeuf, E., Existence and role of a slow inward current during frog atrial action potential, in ‟Pflügers Archiv", 1969, CCCVIII, pp. 91-110.
Ruiz-Manresa, F., Electrogenesis of eel electroplaques. Conductance components and impedance changes during activity. Ph. D. thesis, New York 1970.
Ruiz-Manresa, F., Temperature effects on the various ionic components of spike electrogenesis in eel electroplaques, in ‟Journal of general physiology", 1970, LV, pp. 144-145.
Ruiz-Manresa, F., Grundfest, H., Synaptic electrogenesis in eel electroplaques, in ‟Journal of general physiology", 1971, LVII, pp. 71-92.
Ruiz-Manresa, F., Grundfest, H., Ionic pharmacology of the electrically excitable potassium conductance system (GK) of eel electroplaque, in ‟Journal of general physiology", 1973, LXI, p. 268.
Ruiz-Manresa, F., Ruarte, A. C., Schwartz, T. L., Grundfest, H., Potassium inactivation and impedance changes during spike electrogenesis in eel electroplaques, in ‟Journal of general physiology", 1970, LV, pp. 33-47.
Schmitt, O., Schmidt, H., Influence of calcium ions on the ionic currents of nodes of Ranvier treated with scorpion venom, in ‟Pflügers Archiv", 1972, CCCXXXIII, pp. 51-61.
Sherrington, C. S., The integrative action of the nervous system, Edinburgh 1906, Cambridge 1947.
Suarez-Kurtz, G., Reuben, J. P., Brandt, P. W., Grundfest, H., Membrane calcium activation in excitation-contraction coupling, in ‟Journal fo general physiology", 1972, LIX, pp. 676-688.
Tasaki, I., Conduction of the nerve impulse, in Handbook of physiology (a cura di J. Field), vol. I, Neurophysiology, Washington 1959, pp. 75-121.
Tasaki, I., Nerve excitation. A macromolecular approach, Springfield, Ill., 1968.
Tasaki, I., Hagiwara, S., Demonstration of two stable potential states in the squid giant axon under tetraethylammonium chloride, in ‟Journal of general physiology", 1957, XL, pp. 859-885.
Teorell, T., Transport processes and electrical phenomena in ionic membranes, in ‟Progress in biophysics", 1953, III, pp. 305-369.
Teorell, T., Transport phenomena in membranes, in ‟Discussion of the Faraday Society", 1956, XXI, pp. 9-26.
Thesleff, S., Effects of motor innervation on the chemical sensitivity of skeletal muscle, in ‟Physiological reviews", 1960, XL, pp. 734-752.
Uchitel, O., Garcia, H., Muscle contraction during hyperpolarizing currents in the crab, in ‟Journal of general physiology", 1974, LXIII, pp. 111-122.
Ulbricht, W., Rate of veratridine action on the nodal membrane. I. Fast phase determined durings ustained depolarization in the voltage clamp, in ‟Pflügers Archiv", 1972, CCCXXXVI, pp. 187-1989.
Werman, R., Grundfest, H., Graded and all-or-none electrogenesis in arthropod muscle. II. The effect of alkali-earth and onium ions on lobster muscle fibers, in ‟Journal of general physiology", 1961, XLIV, pp. 997-1027.
Witkovsky, P., Peripheral mechanisms of vision, in ‟Annual review of physiology", 1971, XXXIII, pp. 257-280.
Worthington, C. R., X-ray analysis of nerve myelin, in Biophysics and physiology of excitable membranes (a cura di W. J. Adelman, Jr.), New York 1971, pp. 1-46.
Wright, E. M., Barry, P. H., Diamond, J. M., The mechanism of cation permeation in rabbit gallbladder. Conductances, the current-voltage relation, the concentration dependence of anion-cation discrimination, and the calcium competition effect, in ‟Journal of membrane biology", 1971, IV, pp. 331-357.
Yamagishi, S., Grundfest, H., Contributions of various ions to the resting and action potentials of crayfish medial giant axons, in ‟Journal of membrane biology", 1971, V, pp. 345-365.
Young, J. Z., Structure of nerve fibres and synapses in some invertebrates, in ‟Cold Spring Harbor symposia on quantitative biology", 1936, IV, pp. 1-6.