endorfine
endorfine
Neurotrasmettitori di natura peptidica, rilasciati dalle cellule nervose, che hanno come bersaglio i recettori oppiacei. Le e. sono state individuate nel 1975, dopo la scoperta dei recettori μ, κ, δ per la morfina (1973), nel tentativo di identificare i ligandi endogeni per questa famiglia di recettori, così importanti per molte risposte dell’SNC; era infatti difficile immaginare che esistessero nel sistema nervoso recettori per sostanze esogene (morfina) non presenti nell’organismo.
Il sistema oppioide
Le e. fanno parte del gruppo dei peptidi oppioidi endogeni, cui appartengono anche altre quattro famiglie: le encefaline, le dinorfine, le nocicettine e le endomorfine. Oltre che nel sistema nervoso i peptidi oppioidi sono presenti anche nella pelle di molte rane; queste ultime possono costituire la base per la ricerca di nuovi possibili farmaci, come suggerì il farmacologo italiano Vittorio Erspamer. I neuropeptidi endogeni, attraverso la loro interazione con i tre tipi di recettori oppioidi finora identificati, regolano la funzione del sistema oppioide, che ha un ruolo centrale nel controllo del dolore e nella sua percezione, nel governo dell’umore, nella modulazione della sensazione di benessere e nel controllo del comportamento di dipendenza e assuefazione alle droghe. Il sistema oppioide è inoltre importante nella risposta allo stress, nel controllo della respirazione, della motilità intestinale e di molte funzioni endocrine e immunologiche.
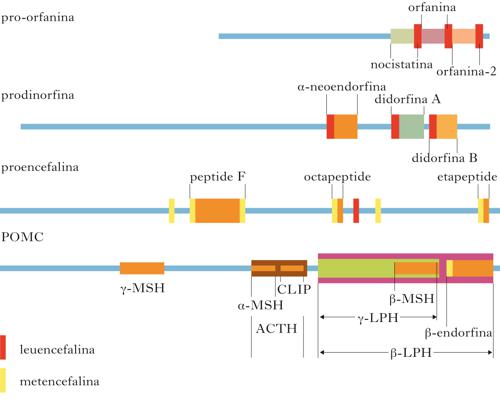
Biosintesi dei neuropeptidi
Ogni famiglia deriva da un precursore, pre-propeptide, codificato da geni distinti, che attraverso processi proteolitici dà origine ai vari peptidi attivi. Da ogni propeptide si possono formare più peptidi, anche con funzioni diverse, che coesistono in una singola vescicola e che verranno rilasciati durante lo stimolo nervoso. Il precursore della β-e. è la prepro-opiomelanocortina (POMC, ProOpioMelanoCortin), da cui derivano anche ACTH, α-MSH e β-lipotropina, che hanno funzioni metaboliche molto diverse. I neuropeptidi agiscono stimolando in modo specifico i recettori per gli oppiacei che sono accoppiati con proteine G; queste agiscono inibendo l’enzima adenilatociclasi e causando una diminuzione di AMP ciclico; di conseguenza si modificano i canali per il potassio e il calcio che, a loro volta, provocano iperpolarizzazione e quindi una minore eccitabilità neuronale. L’affinità per i recettori oppioidi è data dalla sequenza iniziale dei primi quattro amminoacidi del neuropeptide, mentre l’affinità per i sottotipi di recettori (μ, κ, δ) è dettata dalla restante sequenza amminoacidica. I recettori per questi peptidi sono in generale presinaptici e regolano in modo inibitorio la liberazione di altri neurotrasmettitori. Una volta secreti nella sinapsi, i peptidi sono distrutti da peptidasi presenti nelle membrane plasmatiche. Quando iniettati nel cervello, i peptidi oppioidi producono un effetto analgesico (sono anche implicati nell’analgesia da agopuntura), ma modulano anche gli altri effetti tipici degli oppioidi sul comportamento (per es., aggressività/sottomissione, attrazione sessuale, assunzione di droghe, memoria). Ci sono evidenze che essi siano anche implicati in patologie psichiatriche come la schizofrenia e l’autismo. Oltre a un effetto sul sistema nervoso centrale, questi peptidi hanno effetti anche sul sistema oppioide periferico e sulla modulazione del sistema immunitario. Essi non sono utilizzabili come farmaci perché, a causa della loro struttura chimica, non sono facilmente assorbibili per via orale e difficilmente passano attraverso la barriera ematoencefalica. Sono di grande utilità per lo studio delle funzioni del sistema oppioide e per il suo coinvolgimento nelle patologie sia del cervello sia del sistema immunitario.