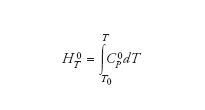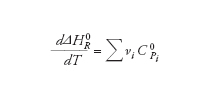entalpia
entalpia
Funzione di stato della termodinamica. Si tratta di una grandezza estensiva, solitamente indicata con la lettera H e che nel sistema internazionale è espressa in joule (J). Se, invece, viene riferita all’unità di massa, è espressa in J/kg. L’entalpia è legata all’energia interna U del sistema dalla relazione
H = U + PV
dove P è la pressione e V il volume. Nelle trasformazioni che avvengono a pressione costante la variazione di entalpia rappresenta la quantità di calore scambiato dal sistema con l’ambiente esterno. Si può quindi scrivere
ΔH = QΠ
dove QΠ è la quantità di calore scambiato. Ai diversi processi chimici viene associata una variazione di entalpia denominata, rispettivamente, di combustione, di transizione di fase, di formazione e così via. Per es., l’entalpia di formazione ΔHφ0 è la variazione di entalpia, alla pressione di riferimento di 1 atm, associata alla formazione di un composto a partire dai suoi elementi. Secondo una comune convenzione, se il suo valore è negativo la reazione rilascia energia, se invece è positivo occorre fornire energia al sistema per consentire alla reazione di procedere. Secondo la legge di Hess tale variazione di entalpia è proporzionale alla quantità di sostanza che partecipa alla reazione ed è la stessa sia che la reazione avvenga in un unico stadio sia che avvenga in più stadi. In altre parole, la variazione di entalpia di una reazione, che può essere scomposta in più reazioni parziali, è pari alla somma algebrica delle variazioni di entalpia dei singoli stadi. La variazione dell’entalpia in un sistema aperto a pressione costante e senza apprezzabili variazioni di volume si determina misurando il calore di reazione che a pressione costante si identifica con ΔH. L’entalpia è legata al calore specifico Cπ a pressione costante attraverso la relazione
CH0
CΠ0 = (____)Π
∂T
dove l’esponente indica la pressione di riferimento di 1 atm. Se è nota la dipendenza di CΠ0 dalla temperatura è possibile risalire ai valori dell’entalpia a varie temperature mediante un’integrazione
essendo T0 una temperatura di riferimento. Solitamente la dipendenza della capacità termica dalla temperatura viene espressa mediante una relazione polinomiale del tipo Cπ=a+bT+cT2 +…, per cui risulta
HΤ0 = a(T−T0) + 1/2(T2−T02) +
+1/3(T3−T30) + ...
Di particolare importanza è la variazione di entalpia ΔHΡ, associata a una reazione chimica, la cui dipendenza dalla temperatura può essere espressa mediante la nota equazione di Kirchhoff:
dove νι sono i coefficienti stechiometrici dei diversi composti che partecipano alla reazione.
→ Metalli