epigenetica
epigenetica
Studio delle modifiche chimiche, a carico del DNA o delle regioni che lo circondano, che non coinvolgono cambiamenti nella sequenza dei nucleotidi. Tali modifiche regolano l’accesso dei fattori di trascrizione ai loro siti di legame sul DNA e regolano in modo diretto lo stato di attivazione funzionale dei geni. Poiché l’esperienza ambientale modula i livelli e la natura dei segnali epigenetici, essi sono considerati fondamentali nel mediare la capacità dell’ambiente di regolare il genoma. L’e. svolge un ruolo fondamentale in tutti i processi di riorganizzazione o ristrutturazione neurale, compresi quelli che presiedono alla plasticità cerebrale.
Trascrizione genica e segnali epigenetici
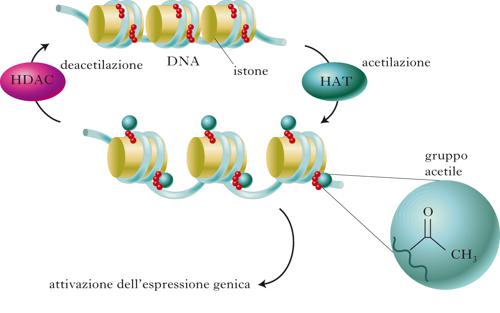
La trascrizione del genoma è un processo altamente regolato, nel quale un ruolo cruciale è svolto dai fattori di trascrizione, proteine che si legano a specifiche sequenze di regolazione poste sul DNA, attivando o reprimendo l’attivazione di singoli geni e, da ultimo, la sequenza di eventi che porta alla sintesi di proteine essenziali per le funzioni cellulari. Il DNA è una struttura complessa, organizzata in subunità denominate nucleosomi contenenti ca. 140÷150 paia di basi nucleotidiche ciascuna, avvolte attorno a un nucleo centrale di natura proteica, costituito dagli istoni. L’insieme del DNA e degli istoni costituisce la cromatina. Il maggiore o minore livello di impacchettamento del DNA a livello dei nucleosomi controlla i livelli di trascrizione genica. In condizioni di ridotta attivazione, la stretta associazione elettrostatica tra il DNA carico negativamente e le proteine istoniche a carica positiva comporta una configurazione nucleosomica chiusa, che impedisce il legame dei fattori di trascrizione. Il passaggio a una configurazione più ‘rilassata’ dipende da modifiche chimiche a carico degli istoni. L’acetilazione, ossia l’aggiunta di un gruppo acetile a livello di specifiche lisine delle code istoniche operata da enzimi chiamati acetiltransferasi istoniche, riduce la carica negativa degli istoni, rilassando la cromatina e facilitando l’accesso dei fattori di trascrizione. La reazione inversa è catalizzata dalle deacetilasi istoniche (HDAC, Histone DeACetylase) che, rimuovendo i gruppi acetile, riducono localmente i livelli di trascrizione del gene. Altre modifiche di tipo epigenetico sono la metilazione (sia a carico delle code amminoacidiche istoniche sia a carico del DNA), la fosforilazione e l’ubiquitinazione. In generale, la metilazione del DNA a livello del promotore che regola l’attivazione di un gene ne riduce i livelli di trascrizione. L’acetilazione degli istoni e la metilazione del DNA sono eventi reciprocamente regolati: da una parte, l’acetilazione degli istoni consente l’accesso al DNA anche delle demetilasi responsabili della rimozione dei gruppi metilici; dall’altra, la metilazione del DNA ne aumenta l’affinità per le deacetilasi istoniche.
Stimolazione ambientale e regolazione epigenetica del genoma
Fino a qualche tempo fa era opinione diffusa che il pattern di metilazione del genoma andasse incontro a cambiamenti importanti solo durante lo sviluppo embrionale, regolando l’attivazione o la repressione di classi specifiche di geni nei vari tessuti come base essenziale per il differenziamento cellulare. Lo stato di metilazione alla nascita era ritenuto irreversibile, con gli esempi paradigmatici dell’inattivazione di uno dei due cromosomi X nelle femmine dei mammiferi e dell’imprinting genico, ossia l’inattivazione di uno dei due alleli ereditati dai genitori attraverso un processo di metilazione embrionale. Studi più recenti mostrano, invece, che la metilazione del DNA può cambiare anche nei neuroni maturi, in risposta a segnali cellulari diretti dagli stimoli ambientali. Piccoli di ratto che ricevono alti livelli di stimolazione materna (➔ cure materne, effetti dell’ambiente sulle) vanno incontro a una demetilazione del gene del recettore dei glicocorticoidi (cui fa seguito l’aumento dell’acetilazione istonica) nell’ippocampo, con un incremento a lungo termine dei livelli di trascrizione. Ciò si traduce, nell’adulto, in maggiori quantità del recettore e in un fenotipo caratterizzato da ridotti livelli di stress, poiché esso è responsabile della regolazione del circuito di risposta allo stress operata dall’asse ipotalamo-ipofisario. Cambiamenti epigenetici cruciali sono implicati anche nella regolazione dei processi di apprendimento e memoria. Nel topo, l’acetiltranferasi istonica creb è essenziale per molteplici forme di memoria a lungo termine mediate dall’ippocampo, mentre il condizionamento alla paura (➔ emozioni) determina la metilazione e il conseguente silenziamento del gene che codifica la proteina fosfatasi 1 (pp1), che inibisce l’apprendimento. Anche lo stato funzionale del fattore neurotrofico derivato dal cervello (BDNF, Brain-Derived Neurotrophic Factor), che ha un ruolo cruciale nella plasticità cerebrale, è regolato su base epigenetica. Nei neuroni inattivi, il promotore del BDNF è metilato e legato al fattore MECP2 (MEthyl Cytosine phosphate guanine binding Protein 2) e a un complesso di repressione della trascrizione. La depolarizzazione neuronale innescata dagli stimoli ambientali demetila il promotore, provocando il distacco del complesso di repressione dipendente da MECP2. Mutazioni che causano la perdita di funzione del gene per MECP2 sono responsabili, nell’uomo, di gravi deficit di coordinazione motoria e nelle abilità cognitive e di socializzazione (sindrome di Rett). L’esposizione di topi transgenici modello di tale sindrome a condizioni di arricchimento ambientale (➔ ambiente e cervello) induce un recupero dai deficit, dipendente dall’aumento dei livelli di BDNF. L’arricchimento ambientale è anche capace di curare i deficit di apprendimento e memoria in topi che vanno incontro a perdita massiva di neuroni nell’ippocampo e nella corteccia; in questo caso, la stimolazione dell’acetilazione istonica operata dall’ambiente consente il raffinamento dei circuiti nervosi rimasti intatti.