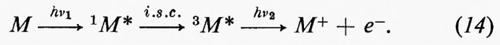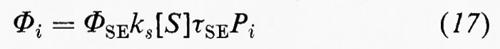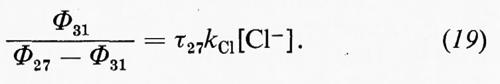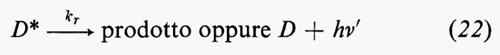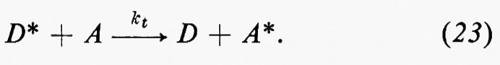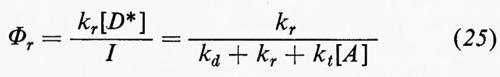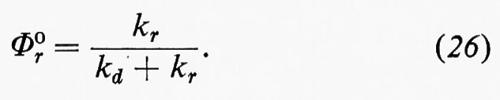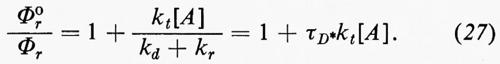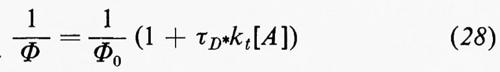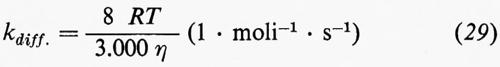Fotochimica
Fotochimica
di Kurt Schaffner e Paul Margaretha
Fotochimica
Sommario: 1. Introduzione. 2. La fotochimica nel XIX secolo. 3. Il XX secolo: sviluppo, conquiste e future tendenze della fotochimica: a) le basi teoriche; b) lo sviluppo della fotochimica; c) processi fotofisici primari; d) disattivazione (quenching) degli stati eccitati; e) tecniche sperimentali; f) studio dei meccanismi di reazione. □ Bibliografia.
1. Introduzione
Una suddivisione fondamentale della chimica è quella che si basa sulla distinzione tra reazioni che hanno luogo tra atomi e molecole nel loro stato elettronico fondamentale e quelle in cui sono coinvolti stati elettronici eccitati. Nello stato fondamentale tutti gli elettroni occupano, in termini semplici di orbitali molecolari, i livelli di energia più bassi possibili, mentre ogni altra distribuzione rappresenta uno stato elettronico eccitato. Tutto questo costituisce la cosiddetta approssimazione dell'eccitazione di un singolo elettrone, che descrive in maniera soddisfacente la maggior parte dei processi di assorbimento. Una tale situazione è illustrata nella fig. 1 per un sistema di due elettroni con il numero minimo di orbitali di legame e di antilegame. In generale l'energia richiesta per la transizione dallo stato fondamentale a quello eccitato, cioè per la promozione di un elettrone a un livello inizialmente non occupato, è dell'ordine di 42-190 kcal/mole. Essa è dello stesso ordine di grandezza o superiore all'energia necessaria per molte reazioni tra molecole allo stato fondamentale, come la rottura di legami. La precedente popolazione dei livelli di energia vibrazionali che conducono a tali processi formali è evitata da eccitazioni monoquantiche che creano direttamente lo stato elettronico eccitato. Normalmente l'origine determinante di una tale eccitazione energetica è l'assorbimento di un fotone la cui lunghezza d'onda si trova nella regione visibile o ultravioletta dello spettro elettromagnetico (700-150 nm).
La molecola eccitata si trova necessariamente in uno stato di minore stabilità rispetto allo stato fondamentale corrispondente e possiede perciò una tendenza intrinseca sia a liberare nuovamente l'eccesso di energia, sia a utilizzano in reazioni chimiche. I processi puramente fisici di liberazione dell'energia eccedente riportano la molecola nel suo stato fondamentale originario. Le trasformazioni chimiche dello stato eccitato sono appropriatamente chiamate reazioni fotochimiche, in considerazione del fatto che hanno inizio per mezzo dell'assorbimento di luce. La fotochimica pertanto riguarda in primo luogo tali eventi chimici, che avvengono ovviamente con atomi, a livello molecolare in sistemi organici e inorganici, in vitro e anche in biologia. A prescindere da questo, tuttavia, la fotochimica presenta anche interessi che si sovrappongono a quelli della spettroscopia in assorbimento e in emissione e della fisica riguardante le dissipazioni elettroniche non radianti, la variazione della molteplicità di spin e il trasferimento di energia. In altre parole essa rappresenta un soggetto caratteristico, nella sua natura interdisciplinare, di molti sviluppi attuali nelle scienze naturali e biologiche.
La chimica delle radiazioni si occupa degli effetti di radiazioni più energetiche; normalmente sotto i 100 nm e includenti i raggi X, i raggi gamma e i bombardamenti elettronici, che producono specie ionizzate oltre che stati neutri eccitati. Per tradizione questo è considerato un soggetto vicino alla fotochimica, ma distinto da essa.
2. La fotochimica nel XIX secolo
W. Cruickshank dell'Università di Londra fu il primo a riconoscere e descrivere una reazione fotochimica. Nel 1801 egli osservò che l'idrogeno e il cloro reagiscono violentemente per dare cloruro d'idrogeno (acido cloridrico) quando siano esposti a luce ultravioletta o violetta, mentre la miscela dei due gas rimane inalterata per un periodo illimitato se è tenuta all'oscuro. Th. von Grotthuss (nel 1818 in Curlandia, ora Repubblica Socialista Sovietica di Lettonia) e J. W. Draper (nel 1841 a New York) conclusero che soltanto la luce assorbita dalla molecola può iniziare una reazione chimica, osservazione che viene spesso riportata come la prima legge della fotochimica.
Durante tutto il XIX secolo la radiazione solare non condensata, ogniqualvolta disponibile, rimase l'unica sorgente di luce utile per il fotochimico sperimentale, e una teoria quantitativa dell'interazione tra luce e materia doveva ancora essere concepita. Non deve perciò sorprendere che le ricerche nel campo della fotochimica fossero relativamente poche e in pratica limitate all'isolamento e alla caratterizzazione di prodotti di reazione ottenuti in conseguenza dell'irraggiamento di sostanze organiche. Non vi è dubbio che la parte più imponente di tale lavoro sperimentale sia dovuta a G. Ciamician e P. Silber, che lo realizzarono tra il 1880 e la prima guerra mondiale all'Università di Bologna. Fu il talento di Ciamician nel combinare le osservazioni sperimentali con una quasi profetica visione della futura importanza della fotochimica, che lo pose al primo posto tra i suoi contemporanei. Numerose fotoreazioni organiche furono infatti scoperte prima del 1900 da questi e da altri pionieri, come H. B. de Saussure in Francia, E. Paternò e G. Chieffi in Italia, A. H. Benrath, J. H. H. Stobbe e R. Störmer in Germania. Mezzo secolo più tardi, la riscoperta dei loro risultati dette un importante stimolo alla rinascita della fotochimica organica.
La fotografia costituisce un altro importante risultato basato su di una reazione fotochimica scoperta all'inizio del secolo. L.-J.-M. Daguerre in Francia, W. H. F. Talbot e sir J. F. W. Herschel in Inghilterra, ognuno indipendentemente dagli altri, introdussero i processi fotografici a base di alogenuro d'argento negli anni 1835-1839. Benchè indistinguibili nel primo periodo, fotochimica e fotografia si svilupparono poi indipendentemente, dopo che Choiselet e Ratel ebbero constatato nel 1843 che una riduzione fotochimica dello ioduro di argento era responsabile della produzione di un'immagine fotografica. Il principale interesse rimasto comune ai due campi fu quello della determinazione dell'intensità della luce. Intorno al 1855 R. W. Bunsen e sir H. E. Roscoe costruirono a Heidelberg un preciso fotometro che utilizzava la fotoreazione fra idrogeno e cloro e migliorarono un sistema similare inventato da Draper. Questo strumento li mise in grado di confermare con sicurezza la legge della reciprocità di Grotthuss-Draper e i suoi limiti, cioè che lo scambio fotochimico ubbidiva alla legge dell'inverso del quadrato dopo un periodo di induzione, quando una fiamma veniva tenuta a distanze variabili. Da allora in poi lo sviluppo della fotografia in bianco e nero consistette essenzialmente nella soluzione di problemi tecnologici fino all'avvento della fotografia a colori nella metà del XX secolo.
3. Il XX secolo: sviluppo, conquiste e future tendenze della fotochimica
a) Le basi teoriche
Le basi necessarie per lo sviluppo della teoria e dei lavori quantitativi in fotochimica furono stabilite principalmente da M. Planck, da J. Stark e da A. Einstein. Il concetto quantistico di Planck (1900) definisce l'energia E di un fotone in funzione della sua frequenza ν o della sua lunghezza d'onda λ:
E=hν=hc/λ,
con h, la costante di Planck, uguale a 6,6•10-27 erg. secondo. Stark ed Einstein stabilirono, con la loro legge sull'equivalenza fotochimica, che nel processo fotochimico primario ogni quanto assorbito attiva una sola molecola. Da questo principio sorse il concetto di resa quantica, che determina il numero di molecole che hanno emesso luminescenza (fluorescenza o fosforescenza), o hanno reagito, o sono state formate, per ogni quanto di luce assorbito. Una delle prime tra tali misure deriva da una ricerca di O. H. Warburg sulla formazione di ozono per azione di luce ultravioletta sull'ossigeno molecolare (1910). Presupposto fondamentale per la misura quantitativa della luce assorbita da una sostanza data è la registrazione del suo spettro di assorbimento nella regione di lunghezze d'onda usate per l'irraggiamento, per cui l'assorbimento molare ε (precedentemente indicato come coefficiente di estinzione molare) - una costante per ogni sostanza a una lunghezza d'onda data e proporzionale alla probabilità della transizione della molecola dallo stato fondamentale allo stato eccitato - è determinato dall'equazione
log I0/I=εcd,
dove I0 e I sono le intensità della luce incidente e trasmessa, rispettivamente, c è la concentrazione della soluzione in moli/litro, e d lo spessore della cella in cm. Questa equazione fu formulata da A. Beer e J. H. Lambert ed esprime la legge secondo cui l'energia radiante non è assorbita ugualmente da tutte le sostanze.
Durante gli anni quaranta le teorie fondamentali della chimica quantistica, dell'ottica e della spettroscopia atomica sono state completate da molti importanti sviluppi nel campo degli aspetti teorici e fisici degli stati eccitati. Tali sviluppi sono l'introduzione della spettroscopia e della fotocinetica molecolare, e l'uso accresciuto dei termini della teoria dei gruppi in connessione con la teoria degli orbitali molecolari di R. S. Mulliken; comprendono anche la regola di Hückel, il concetto di conservazione della simmetria degli orbitali e le correlazioni degli stati nei processi concertati. Essi hanno fornito non soltanto una notevole capacità d'osservazione della natura e della dinamica degli stati eccitati, ma hanno anche iniziato gradualmente a rimuovere la barriera tra la chimica dello stato fondamentale e quella dello stato eccitato. Invece è ancora da sviluppare un modello fisico unificato della reazione chimica che estenda l'approccio tradizionale monosuperficie a una chimica di sistemi a molte superfici.
b) Lo sviluppo della fotochimica
Negli anni venti e trenta i chimico-fisici studiarono ampiamente la fotochimica degli atomi e delle molecole semplici in fase gassosa. Svariate tecniche sono state sviluppate da allora per realizzare potenti sorgenti di luce ultravioletta, per ottenere fasci monocromatici, e per l'analisi spettroscopica e chimica dei prodotti ottenuti in questo campo. L'uso di questi metodi, la rivelazione e la misura quantitativa, per mezzo di essi, di processi fotofisici e di processi fotochimici relativamente semplici in fase gassosa, segnarono l'inizio della formazione di molti concetti base della fotochimica moderna.
Lo studio di fotoreazioni in soluzione, tradizionale dominio dei chimici organici e inorganici, durante questo periodo si trovava ancora in una fase di stasi, in quanto non erano ancora state perfezionate le tecniche indispensabili per controllare tali sistemi di reazione, per risolvere miscele complesse di prodotti e per delucidare efficacemente strutture molecolari complesse.
Tuttavia, ci furono parecchie anticipazioni e notevoli eccezioni; tra le altre i primi esperimenti nel campo dell'ergosterolo-vitamina D da parte di A. Windaus intorno al 1927.
Un interesse molto più diffuso e fattivo nel campo della fotochimica, seguito da una rapida espansione in tutte le sue multidisciplinari direzioni, fu determinato principalmente da due risultati ottenuti l'uno indipendentemente dall'altro dopo la seconda guerra mondiale. Con l'acquisizione di nuovi metodi in grado di realizzare la separazione cromatografica e la determinazione delle strutture per via spettroscopica, la chimica classica dei prodotti naturali raggiunse il suo apice nell'era delle determinazioni strutturali, tra la fine degli anni quaranta e quella degli anni cinquanta. Questo a sua volta condusse anche all'interpretazione di numerosi fotoprodotti derivati da sostanze naturali, già descritti decine di anni prima da altri ricercatori. Tali risultati spronarono immediatamente i chimici organici a irradiare deliberatamente prodotti naturali e loro derivati, che forniscono un ampio insieme di cromofori, spesso complessi, inseriti in differenti combinazioni strutturali. Sono state così scoperte molte trasformazioni fotochimiche fondamentali. Questo approccio fu seguito, e spesso affiancato, dalla preparazione di composti modello che rappresentano sistemi progenitori di rilevante importanza dal punto di vista fotochimico e che, generalmente, si prestano più direttamente all'introduzione sistematica di variazioni strutturali di interesse meccanicistico e a indagini quantitative. Le indagini empiriche nel campo dei prodotti naturali e i risultati sempre più numerosi di studi più dettagliati, convergendo poi fra loro e completandosi gli uni con gli altri, costituirono un significativo stimolo all'approccio fisico-organico dei problemi della fotochimica.
Un altro importante sviluppo parallelo riguardò l'introduzione e il perfezionamento di metodi per la rilevazione, come pure per l'analisi cinetica e strutturale, di stati eccitati e di specie transitorie aventi vita breve. I più recenti progressi nella strumentazione includono miglioramenti della risoluzione temporale e della rilevazione fotoelettrica, tecniche a bassa temperatura, accumulo di informazioni e deconvoluzioni per mezzo di calcolatori in combinazione con sorgenti monocromatiche di alta potenza e precisione e con rivelatori di emissione, assorbimento e risonanza magnetica.
c) Processi fotofisici primari.
Dopo che una molecola ha assorbito luce ed è passata in uno stato eccitato, diversi sono i meccanismi possibili per la liberazione dell'energia elettronica di eccitazione e per riportare infine la molecola allo stato fondamentale di partenza senza nessun cambiamento permanente. Molte di queste vie per la dissipazione dell'energia sono costituite da processi fotofisici monomolecolari. Alcuni servono alla ripartizione dell'energia di eccitazione tra i vari livelli di energia molecolare e alcuni intervengono ancora quando l'eccitazione dà luogo, alla fine, a una trasformazione chimica. La tab. I elenca i più comuni tra questi processi fisici di disattivazione, per ciascuno dei quali sono dati gli intervalli approssimativi dei valori delle costanti di velocità, tipiche delle molecole organiche. Tali processi sono schematizzati nella fig. 2.
La maggior parte delle molecole possiede un numero pari di elettroni i quali, nello stato fondamentale, occupano orbitali con spins opposti appaiati (stato fondamentale di singoletto, S0). Negli stati elettronici eccitati i due elettroni non accoppiati sono in orbitali differenti e possono avere ancora la stessa molteplicità di spin (stati eccitati di singoletto, S1, S2, ecc.) o spins simili invertiti (stati di tripletto, T1, T2, ecc.). Tutti questi stati sono specie distinte con differenti strutture e reattività. Lo stato di tripletto è invariabilmente di energia più bassa del corrispondente stato di singoletto. Questa differenza nasce dal fatto che elettroni non accoppiati che hanno spins paralleli non possono occupare simultaneamente lo stesso spazio (principio di Pauli). La repulsione tra elettroni è perciò ridotta nello stato di tripletto.
L'assorbimento di un fotone è soggetto a regole di selezione che favoriscono notevolmente la conservazione dello spin. Inoltre il principio di Franck-Condon stabilisce che nessuna variazione delle coordinate nucleari o dell'energia cinetica nucleare avviene nell'intervallo di tempo estremamente breve del processo di assorbimento. Di conseguenza, i più comuni processi di assorbimento permessi per quanto riguarda i momenti di spin portano lo stato di singoletto fondamentale S0 al primo stato eccitato di singoletto o a uno più alto, a seconda dei livelli di energia e della lunghezza d'onda della luce incidente. La transizione T1→T2 è pure permessa per quanto riguarda lo spin, ma ovviamente è osservabile solo nella speciale condizione che la concentrazione del più basso stato di tripletto sia sufficientemente elevata. Questa condizione può realizzarsi nel caso che si verifichino l'uno, l'altro o entrambi i seguenti fenomeni: un tempo di vita molto lungo per lo stato eccitato e un'intensità molto alta della luce, come avviene negli esperimenti con una radiazione continua fornita da un laser o nella fotolisi a lampo (flash photolysis). Poiché i vari stati elettronici all'equilibrio hanno generalmente conformazioni diverse, l'assorbimento in generale popola inizialmente un livello vibrazionale alto dello stato eccitato, che è seguito da rilassamento vibrazionale - attraverso una distribuzione di Boltzmann dell'energia - all'interno dello stesso stato.
La trasformazione non irradiante di un qualsiasi stato eccitato termicamente equilibrato in un altro stato elettronico di energia più bassa comporta una transizione tra livelli vibrazionali-rotazionali isoenergetici di questi stati, seguita di nuovo da rilassamento vibrazionale. Queste transizioni sono classificate come conversioni interne, quando i due stati hanno la stessa molteplicità di spin, e come passaggi dallo stato di singoletto a quello di tripletto (intersystem crossing), quando la transizione è accoppiata a una variazione di spin e lega due stati di differente molteplicità. Lo stato fondamentale originale della molecola può cosi essere restaurato mediante lo spopolamento puramente fisico di uno dei suoi stati eccitati. C'è una correlazione inversa tra la velocità di transizioni non irraggianti e la differenza di energia tra i livelli zero degli stati elettronici interessati. Poiché i più elevati stati di eccitazione sono raggruppati con notevole densità, le conversioni interne avvengono con notevole rapidità. Benché l'intersystem crossing sia un processo non permesso per quanto riguarda lo spin, la velocità della transizione S1→T1 può pure essere molto alta a causa di una separazione di energia ugualmente piccola. Comunque i divari energetici tra S0 ed S1 e tra S0 e T1 sono molto più grandi; è generalmente in questi più bassi stati di eccitazione che altri processi, come la luminescenza, il trasferimento di energia e la reazione chimica, trovano la massima probabilità di competere con altri processi di decadimento non irradianti.
La luminescenza è provocata dall'emissione spontanea di un fotone. La fluorescenza è una transizione molto rapida che avviene con emissione di radiazione fra due stati della stessa molteplicità, abitualmente S1→S0, mentre la fosforescenza è l'analoga più lenta transizione T1→S0, che non è permessa per quanto riguarda lo spin. Il trasferimento di energia e la reazione chimica, come per esempio la formazione di un nuovo prodotto stabile, possono essere processi sia monomolecolari sia bimolecolari. Tali processi saranno descritti brevemente in questo paragrafo e in quello successivo.
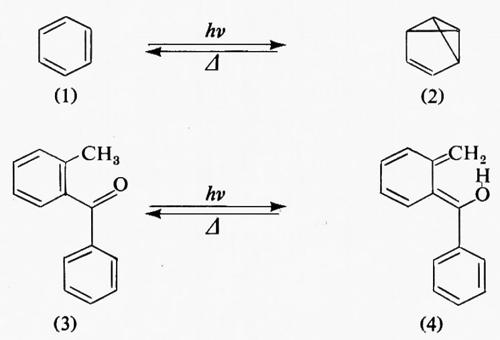
In molte molecole le costanti di velocità della conversione interna S1→S0 e dell'intersystem crossing T1→S0 hanno lo stesso ordine di grandezza nonostante la legge sulla differenza di energia. In un numero sempre maggiore di casi questa apparente anomalia della disattivazione fisica verso lo stato fondamentale risulta derivata infatti dalla formazione di fotoprodotti isomerici instabili che si riconvertono per via termica nel materiale di partenza a una velocità sufficientemente rapida da sfuggire alla rivelazione. Il benzene (1) è un sistema che mostra questo fenomeno. Per irraggiamento (1) viene trasformato nel benzovalene (2) che isomerizza di nuovo a benzene a temperatura ambiente. L'o-metilbenzofenone (3) dà luogo a una foto-enolizzazione reversibile (→4) per estrazione di un atomo di idrogeno attraverso uno stato di transizione ciclico a sei termini.
La situazione è descritta nella fig. 3 per il ritorno di una molecola dallo stato eccitato di singoletto allo stato fondamentale, attraverso un intermedio fotochimico. Invece che mediante un diagramma di stato del tipo di A. Jablonski (v. fig. 2), gli stati sono presentati come sezioni delle ipersuperfici corrispondenti a variazioni in un'unica distanza internucleare. La differenza in energia (S1−S0)>(S1−S0′) favorisce la conversione interna allo stato fondamentale S0′ del fotoisomero. Se la barriera di energia ΔE tra gli stati S0′ e S0 equilibrati dal punto di vista vibrazionale può essere superata grazie all'attivazione termica, l'isomero altrimenti metastabile riformerà il materiale di partenza. Il risultato netto di questo sarà un aumento della velocità di ‛conversione interna' S1→S0.
Questa breve escursione nell'aspetto meccanicistico della fotochimica può servire a illustrare come una conseguenza dell'attuale rapido sviluppo possa essere l'integrazione finale delle reazioni fotochimiche nella teoria delle transizioni che avvengono senza emissione di radiazione. Attualmente, tuttavia, si usano ancora altri concetti per un'adeguata razionalizzazione del corso di tali reazioni.
d) Disattivazione (quenching) degli stati eccitati.
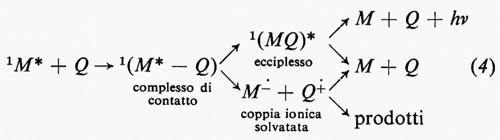
Il decadimento di uno stato elettronicamente eccitato, M*, al suo stato fondamentale, M, può essere accelerato mediante interazione con un'altra sostanza (Q) che viene detta ‛disattivatore' (quencher). Tale disattivazione, espressa nella sua forma più generale dall'equazione
può procedere secondo diversi meccanismi. Eccetto che per certi tipi di trasferimento di energia elettronica, i processi di disattivazione comportano la formazione di un complesso di contatto oppure di un eccimero o di un ecciplesso. Mentre nel primo i componenti hanno orientamenti relativi casuali a distanze di 7 Å o più, i secondi sono entità a geometria definita che occupano posizioni di minima energia sulla superficie dell'energia potenziale dello stato eccitato. Dal momento che questi processi di disattivazione sono collisionali, essi sono soggetti alla regola di Wigner sulla conservazione dello spin, la quale stabilisce che il momento angolare di spin complessivo del sistema non deve variare.
Formazione di eccimeri ed ecciplessi. - Gli ecciplessi sono complessi eccitati formati dall'associazione di uno stato eccitato e di uno stato fondamentale di specie diverse; gli eccimeri sono gli analoghi dimeri eccitati che coinvolgono componenti della stessa specie. Una seconda via per la formazione di eccimeri di singoletto consiste nel processo di ‛annichilimento' tripletto-tripletto, che può essere provocato dalla collisione di due molecole nello stato di tripletto. Il decadimento di eccimeri ed ecciplessi con ripristino di M (si confronti con l'equazione 1) può avvenire in due maniere principali, come riassunto nelle equazioni seguenti (X=M: eccimero; X=Q: ecciplesso):
(MX)*→M+X(+hν) (2)
(MX)*→M+X*. (3)
La fluorescenza o la conversione interna (da un complesso di singoletto) e la fosforescenza o il passaggio da un sistema all'altro (intersystem crossing) (da un complesso di tripletto) danno direttamente i due componenti dissociati nello stato fondamentale (equazione 2). Alternativamente la dissociazione può anche avere luogo con ritenzione dell'eccitazione elettronica (equazione 3). Questo corrisponde al trasferimento cinetico dell'energia se viene coinvolto un ecciplesso e la molecola disattivante (quencher) rimane eccitata (EQ*〈EM*). Nel caso di eccimeri questo corrisponde alla migrazione dell'eccitazione elettronica fra molecole uguali (migrazione ‛eccitonica').
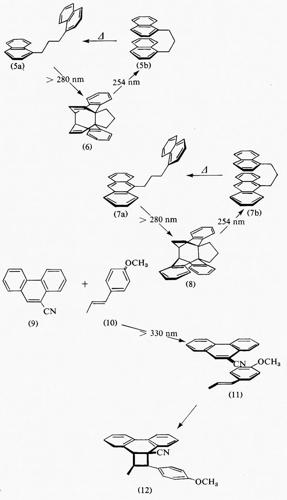
La formazione di eccimeri è particolarmente diffusa tra i composti aromatici, che possono assumere una struttura ‛a sandwich', cioè a piani molecolari paralleli disposti molto vicini. Se le condizioni strutturali lo permettono, tali situazioni possono anche verificarsi in seguito alla complessazione intramolecolare di un cromoforo eccitato con un altro nello stato fondamentale. Un'illustrazione particolarmente elegante di questi punti proviene dallo studio della conformazione estesa stabile (5a) e di quella instabile a sandwich (5b) dell'1,3-bis(1-naftil)-propano. La fotolisi di (5) in soluzione liquida con luce a lunghezza d'onda maggiore di 280 nm provoca la ciclizzazione per dare il fotoprodotto (6), previo collegamento delle posizioni 1,1′ e 4,4′ dei due nuclei naftalenici.
L'irraggiamento di (6) a 254 nm in metilcicloesano solido a 77 °K rigenerò il prodotto di partenza a catena aperta, con la struttura geometrica (5b) bloccata dalla matrice rigida, che mostrò una fluorescenza simile all'emissione degli eccimeri di derivati naftalenici in soluzione liquida. Per fusione della soluzione vetrosa il sistema (5b) poté rilassarsi nella conformazione estesa (5a), che a sua volta fu fissata ricongelando la soluzione. In conseguenza l'emissione cambiò e divenne strettamente simile alla fluorescenza dell'1-metil-naftalene monomero.
Simili osservazioni sono state fatte nel caso dell'analogo dimero antracene-naftalene (7) e del suo fotoprodotto (8). La conformazione a sandwich (7b) mostra fluorescenza di ecciplesso intramolecolare che, sulla base del confronto con le emissioni di eccimero del 9-metilantracene e della struttura a sandwich naftalene-naftalene (6), indica una certa maggior stabilizzazione derivante da interazioni di polarizzazione e trasferimento di carica. Dal momento che la separazione di una coppia di elettroni spesso rende più polari gli stati eccitati, questi possono comportarsi sia da migliori donatori che accettori di elettroni rispetto ai corrispondenti stati fondamentali. Una natura a trasferimento di carica con momenti dipolari elevati è perciò caratteristica degli ecciplessi; di conseguenza la loro formazione risulta, prevedibilmente, piuttosto comune. Il sistema N,N-dietilanilina-antracene nello stato eccitato di singoletto costituisce un tipico esempio di ecciplesso fluorescente fortemente stabilizzato dal trasferimento di un elettrone dal primo al secondo componente.
Eccimeri ed ecciplessi non forniscono semplicemente meccanismi particolari per la disattivazione degli stati eccitati (equazioni 2 e 3), ma sono anche coinvolti in molti processi fotochimici. Nella maggior parte dei casi tali intermedi di reazione non emettono e manca quindi una prova diretta della loro formazione. Un'eccezione è costituita, per esempio, dal 9-cianofenantrene (9) e dall'(E)-p-metossi-β-metilstirene (10), che formano lo stato di singoletto eccitato con la struttura a sandwich (11), dove la fluorescenza e il ritorno (collasso) al prodotto di cicloaddizione [2+2] (12) competono nella disattivazione dell'ecciplesso.
Trasferimento elettronico. - Il trasferimento elettronico è un processo importante per la disattivazione degli stati eccitati di singoletto, in particolare di idrocarburi aromatici e azocomposti da parte di dieni e di olefine. Tale processo può già avere luogo in un complesso di contatto e dare origine direttamente a coppie ioniche solvatate, sia competendo con sia prendendo il posto di un processo che coinvolge un ecciplesso come intermedio. L'equazione (4) riassume tali possibili alternative.
Disattivazione da parte di atomi pesanti e specie paramagnetiche. - La probabilità di transizioni S−T, sia con assorbimento, sia con emissione o in assenza di radiazioni, dipende dalla quarta potenza del numero atomico in sistemi atomici attraverso un meccanismo di accoppiamento spin-orbita. Benché questa relazione non sia rigorosamente valida per le molecole organiche, le velocità di transizione S−T sono ancora fortemente aumentate in presenza di atomi pesanti, di molecole, per esempio, contenenti xeno, bromo e iodio. L'effetto di atomi pesanti è quello di aumentare la concentrazione del tripletto incrementando l'intersystem crossing all'interno di un ecciplesso di singoletto (o di un complesso di contatto), con conseguente dissociazione dell'ecciplesso di tripletto secondo l'equazione (5):
1M*+Q→1(MQ)*→3(MQ)*→3M*+Q. (5)
Gli ecciplessi sembrano essere operanti anche nella disattivazione controllata dalla diffusione di stati eccitati da parte dell'ossido di azoto e dell'ossigeno (equazioni 6 e 7):
1M*+2NO→2(MNO)*→3M*+2NO (6)
1M*+3O2→3(MO2)*→3M*+3O2. (7)
Nel secondo caso lo stato di tripletto 3M* è ulteriormente disattivato per l'incontro con ossigeno nello stato fondamentale, dando luogo a un processo di trasferimento dell'energia del tripletto che genera ossigeno nello stato eccitato di singoletto (equazione 8):
3M*+3O2→1M+1O*2. (8)
Trasferimento dell'energia elettronica. - Il trasferimento dell'energia elettronica è un fenomeno di cruciale importanza in fotochimica. Esso implica la disattivazione di una molecola di donatore eccitata D* al suo stato fondamentale e il simultaneo trasferimento della sua energia di eccitazione a una molecola di accettore A (equazione 9):
D*+A→D+A*. (9)
Come risultato si osserva la disattivazione di D* e l'attivazione, con processi simili, di A, benché i fotoni siano stati assorbiti da D. Il metodo basato sulla generazione di processi derivati da A* attraverso questa tecnica viene chiamato fotosensibilizzazione.
Fra i principali processi di trasferimento dell'energia elettronica si possono distinguere quelli che avvengono con irraggiamento e quelli che avvengono senza irraggiamento; questi ultimi comportano interazioni di tipo coulombiano e interazioni basate sullo scambio di elettroni.
La probabilità del trasferimento di energia con irraggiamento, secondo lo schema
D*→D+hν
hν+Α→A*, (10)
dipende dall'efficienza quantica dell'emissione da parte del donatore, dalla concentrazione delle molecole dell'accettore, dal loro potere di assorbire la luce e dalla sovrapposizione degli spettri di emissione del donatore e di assorbimento dell'accettore. Tale trasferimento di energia, compreso il caso speciale della migrazione dell'energia radiante fra molecole uguali, può avere luogo a distanze notevolmente elevate.
Il trasferimento senza irraggiamento può avvenire a distanze molto più grandi delle dimensioni molecolari, qualora venga indotto da interazioni di tipo coulombiano, mentre il meccanismo di scambio elettronico richiede che donatore e accettore si avvicinino a distanze comparabili con i diametri di collisione. Le molteplicità relative dei componenti eccitati sono governate dalla conservazione di spin e da altri fattori; le comuni situazioni del trasferimento di energia vengono perciò ristrette a quelle delle equazioni (11-13) e al caso speciale della generazione di ossigeno nello stato di singoletto (equazione 8):
trasferimento di energia S−S:
1D*+1A→1D+1A* (11)
trasferimento di energia T−S:
3D*+1A→1D+1A* (12)
trasferimento di energia T−T:
3D*+1A→1D+3A*. (13)
La teoria della ‛perturbazione dipendente dal tempo' predice che un'interazione tra D* e A dà luogo all'accoppiamento di transizioni non radianti sia in D che in A, così che l'energia di eccitazione si delocalizza su livelli degeneri (D*+A) e (D+A*). Nelle molecole complesse un grande numero di sottolivelli vibrazionali e rotazionali rende rapidamente disponibile la degenerazione dei due sistemi. Dal momento che la costante specifica di velocità per il rilassamento vibrazionale è normalmente più piccola di quella per il trasferimento dell'energia, il trasferimento avviene dal più basso livello vibrazionale di D*, e A*, quando si forma, rilassa prontamente al suo più basso livello vibrazionale. La degenerazione dei due sistemi (D*+A) e (D+A*) viene così eliminata. La fig. 4 mostra che la condizione per il trasferimento monodirezionale dell'energia nell'equazione (9) è che l'energia (ED) di eccitazione O−O di D sia maggiore di quella (EA) di A.
Nel trasferimento a lungo raggio dell'energia coulombiana o dell'energia di eccitazione per risonanza il contributo predominante alla interazione tra D* e A è del tipo dipolodipolo. Questa interazione è massima se lo spin non cambia nelle corrispondenti transizioni di dipolo dei due componenti, come nel trasferimento singoletto-singoletto, che è completamente permesso (equazione 11). Nel trasferimento tripletto-singoletto (equazione 12) la violazione della legge dello spin può essere compensata da un tempo di vita relativamente lungo del donatore nello stato di tripletto. Come mostrato da T. Förster nel 1948, la costante specifica di velocità per il trasferimento di energia, kt.e., diminuisce con la sesta potenza della distanza critica di trasferimento fra D* e A. Perciò kt.e. può essere maggiore della costante di velocità di diffusione, kdiff.. Il trasferimento dell'energia per interazione dipolare è perciò in gran parte indipendente dalla viscosità del solvente e può avere luogo a distanze fino a 50-100 Å.
Il trasferimento dell'energia può anche includere termini di scambio elettronico. Il loro effetto fu mostrato in una analisi di D. L. Dexter (1953) mirante a rendere kt.e. indipendente dalla forza oscillatoria sia dell'emissione di D* sia dell'assorbimento di A, in contrasto con l'interazione di tipo coulombiano. Dal momento che questo processo richiede scambio di elettroni e perciò sovrapposizione di orbitali tra D* e A, il meccanismo comporta l'intervento di un intermedio bimolecolare, come un complesso di contatto o un ecciplesso, ed è soggetto alla conservazione dello spin elettronico. Il più importante trasferimento di energia, il trasferimento fra tripletti (equazione 13), appartiene a questa categoria, come stabilito per la prima volta da A. Terenin e V. Ermolaev nel 1956. Quando l'energia trasferita è maggiore di 3-4 kcal/mole, il processo diviene unidirezionale e kt.e. uguaglia la costante di disattivazione kq, avvicinandosi molto a quella di diffusione kdiff..
La fig. 5 esemplifica un tale trasferimento di tripletto fra il benzofenone (13; ET=69 kcal/mole) e il cis-1,3-pentadiene (14; ET=57 kcal/mole). Quando una soluzione liquida di questi due composti viene irradiata con luce di lunghezza d'onda maggiore 9 uguale a 313 nm, la luce incidente viene assorbita selettivamente dalla banda n→π* del chetone (13) (il diene assorbe soltanto al disotto di 300 nm). Il passaggio quantitativo dallo stato di singoletto a quello di tripletto (intersystem crossing) S1→T1, caratteristico dei chetoni aromatici come (13), e la disattivazione del tripletto del chetone che si avvicina al limite controllato dalla diffusione portano nello stato eccitato di tripletto il diene che quindi isomerizza a trans-1,3-pentadiene (15). Dal momento che i due diastereoisomeri, (14) e (15), possiedono stati di tripletto simili per quanto riguarda la loro energia, la fotoreazione è reversibile e si stabilisce un equilibrio fotostazionario cis-trans quando l'irraggiamento fotosensibilizzato viene mantenuto per un periodo di tempo sufficientemente lungo. Con un tempo di vita del tripletto del benzofenone di circa 10-6 s e con la kdiff. uguale a circa 10-10 1/mole•s (in soluzione benzenica a 20 °C), è sufficiente una concentrazione minima di 10-4 M per disattivare ogni molecola eccitata di chetone.
e) Tecniche sperimentali
Sembra opportuno a questo punto descrivere brevemente le più importanti tecniche sperimentali disponibili per eccitare le molecole, per studiare gli stati eccitati e i loro processi fisici primari e per investigare il meccanismo delle reazioni fotochimiche.
Sorgenti di luce. - Negli strumenti moderni per l'irraggiamento, la luce del sole, che era stata in un primo tempo usata come la sorgente principale di luce ultravioletta, è stata sostituita da lampade artificiali, più efficienti. Tra queste le più usate sono quelle ad arco di mercurio, poi i tubi fluorescenti a scarica in gas rari (ad esempio xeno) e le lampade combinate a mercurio-xeno. Nel loro insieme esse forniscono un'illuminazione continua con un'intensità di luce relativamente elevata distribuita complessivamente su tutto l'intervallo spettrale di maggiore interesse in fotochimica (cioè da lunghezze d'onda inferiori a 200 nm fino al visibile).
Circa il 90% dell'emissione delle lampade a mercurio a bassa pressione è concentrata a 253,7 nm. Queste lampade sono usate per reazioni in fase gassosa fotosensibilizzate dal mercurio e forniscono anche una sorgente monocromatica molto conveniente della radiazione di 254 nm da usare in fotolisi dirette. La loro brillanza specifica piuttosto bassa, che ne limita l'uso in sintesi fotochimiche, può essere compensata parzialmente dalla possibilità di avvolgere il recipiente di reazione con una lampada a forma di spirale.
Le lampade a mercurio a media pressione hanno una distribuzione spettrale molto più ampia e perciò un più vasto campo di applicazioni. La presenza di bande intense e larghe è notevole nella regione sopra i 300 nm, con intensità particolarmente elevata intorno a 313 e 366 nm. Le sorgenti più intense di radiazione ultravioletta sono le lampade ad alta pressione che, nella versione a sorgente (quasi) puntiforme vengono particolarmente usate in applicazioni qualitative e semipreparative, nelle quali il campione da irradiare è piccolo. Nelle tecniche fotolitiche a lampo (flash photolysis) si richiedono impulsi di radiazione di alta energia e di durata brevissima. Le lampade convenzionali di questo tipo sono per lo più basate su tubi a scarica nei gas, caratterizzati dall'erogazione di energia elettrica fino a 5.000 joule per lampo e da un tempo di decadimento del lampo dell'ordine di 10-3. Tuttavia questi lampi sono policromatici e l'energia degli impulsi più brevi è enormemente ridotta, con una dissipazione dell'ordine di 10-9 joule soltanto, per tempi di lampo di alcuni miliardesimi di secondo.
Un considerevole progresso è stato raggiunto con l'avvento della tecnica delle sorgenti laser, che fu introdotta per la prima volta nel 1960 da T. H. Maiman negli Hughes Research Laboratories seguendo un suggerimento dato nel 1958 da A. L. Schawlow e C.H. Townes della Columbia University. Come implicito nel nome, che deriva dall'espressione inglese light amplification by stimulated emission of radiation, i laser sfruttano il principio dell'amplificazione ottenuta mediante emissione stimolata di radiazioni, diversamente dalle sorgenti convenzionali che operano mediante l'emissione spontanea. Essi producono un raggio altamente collimato, monocromatico e coerente di enorme luminosità. Mediante appropriati otturatori, come quello a Q, impiegante, per esempio, una cella di Kerr, o quello a bloccaggio dei modi (mode-locking) che impiega soluzioni diluite di coloranti, gli impulsi relativamente lunghi di laser semplici (circa 10-6 s) possono essere ridotti a lampi singoli con durata dell'impulso di circa 10-8 s e una coda di impulsi dell'ordine di 10-12 s, rispettivamente. Sono stati preparati anche laser a ioni a emissione continua che sono utili come potenti sorgenti monocromatiche in spettroscopia e fotolisi. Le lunghezze d'onda disponibili per emissione dei laser sono state ristrette a linee nella regione 325-700 nm, anche se esiste una certa varietà di laser continui a colorante con lunghezza d'onda regolabile. Un altro approccio per raggiungere lunghezze d'onda più corte è possibile grazie alla tecnica di raddoppiare o quadruplicare la frequenza della luce laser (benché questo comporti una contemporanea perdita nel flusso di fotoni) che ha permesso attualmente di raggiungere 265 nm come limite inferiore. La tecnologia dei laser si sviluppa molto rapidamente ed è ragionevole attendersi considerevoli progressi, in particolare per quanto concerne la sintonizzazione al di sotto di 300 nm. Tali progressi possono rendere obsolete in futuro sorgenti di luce convenzionali, come le lampade a mercurio e a xeno.
Filtri ottici e monocromatori. - Gli studi fotochimici richiedono di frequente l'uso selettivo di certe lunghezze d'onda o regioni di lunghezza d'onda. A meno che la sorgente di luce stessa non sia monocromatica, la selezione viene fatta per mezzo di monocromatori o di filtri. I monocromatori sono basati sulla rifrazione (tipo a prisma di quarzo) o sulla diffrazione (reticolo); quest'ultima è una scelta più frequente grazie a una maggiore dispersione nel visibile e alla registrazione lineare in lunghezza d'onda. I monocromatori, in combinazione con una lampada a mercurio a bassa pressione, costituiscono il mezzo migliore per isolare bande molto strette di lunghezze d'onda.
Filtri di vetro riflettenti che lavorano sulla base del principio di interferenza sono molto utili per ottenere ampiezze di banda relativamente strette (5-20 nm). Sono disponibili filtri di tipo assorbente basati su vari vetri colorati, e soluzioni liquide di uno o più composti che assorbono in determinate regioni dello spettro.
Recipienti per reazioni fotochimiche. - Nella progettazione di un qualsiasi reattore per fotochimica si deve considerare un numero di caratteristiche di base che sono essenzialmente indipendenti dallo scopo e dal tipo dell'esperimento. Esse riguardano in primo luogo la scelta del materiale da costruzione per il recipiente o quella parte di esso che deve essere trasparente alle lunghezze d'onda incidenti desiderate. La scelta di tali materiali va da vetri teneri ordinari (trasmissione di luce con lunghezza d'onda all'incirca >330 nm), a vetri pirex (circa >280 nm) e quarzo (circa >170-190 nm), al fluoruro di calcio (circa >140 nm) e al fluoruro di litio (circa >110 nm). Altri fattori sono l'opportuno orientamento della sorgente di luce per l'utilizzazione ottimale della radiazione, l'omogeneizzazione del volume di reazione (nell'irraggiamento di materiali non rigidi) e la prevenzione della formazione di depositi sulle pareti trasparenti del reattore.
La migliore disposizione geometrica per il lavoro sintetico è di avere la lampada, circondata da una camicia refrigerante, immersa nel reagente. Per adeguare il reattore a qualsiasi uso si possono aggiungere numerosi accessori comuni. Il sistema della lampada a immersione può essere integrato con un mantello addizionale per soluzioni-filtro, ovvero si può interporre un filtro ad assorbimento fra la lampada e il sistema di refrigerazione. Un ingresso per gas attraverso un disco di vetro sinterizzato posto sul fondo, sistema di agitazione, e attrezzatura per far circolare il reagente e convertire il sistema statico in uno in movimento sono tra gli accessori di cui può essere fornito il pallone di reazione.
Un apparecchio che permette l'irradiazione analitica simultanea di campioni diversi sotto condizioni identiche è costituito da un reattore rotabile. Le provette contenenti i campioni sono equidistanti dalla sorgente di luce (una lampada centrale o un gruppo di lampade avvolgenti) e il supporto delle provette ruota intorno a un asse centrale. Ciascuna provetta riceve la stessa quantità di radiazione e gli errori dovuti a una distribuzione radiale non uniforme della luce vengono così minimizzati.
La forma più comune delle celle di reazione per studi quantitativi su campioni in fase gassosa e liquida è quella cilindrica con pareti ottiche piatte saldate per fusione alle due estremità. Celle per liquidi a forma quadrata vengono preferite quando lo studio include l'analisi spettrofotometrica del sistema fotochimico, come ad esempio durante l'irraggiamento con eccitazione e con i raggi spettrofotometrici orientati ad angoli retti.
Solo pochi dei numerosi accessori disponibili per la fotolisi possono essere qui menzionati. Per la maggior parte degli studi diversi da quelli sintetici si usa una serie ottica che consiste nella sorgente di luce, lenti, monocromatore o sistema a filtro, interruttore della luce, cella di fotolisi e rivelatore della luce. Il suo scopo è quello di combinare la massima omogeneità e il massimo parallelismo del raggio di luce monocromatica all'interno della cella di reazione con un sistema di controllo dei quanti assorbiti dal reagente.
Studi quantitativi in fase gassosa richiedono che la cella sia incorporata in un sistema chiuso che comprende una pompa ad alto vuoto, un indicatore di pressione e un sistema di separazione dei prodotti per la loro purificazione e analisi. Un termostato, che avvolge la cella senza ostruire il raggio di luce nella successione ottica, completa il dispositivo.
L'irraggiamento a basse temperature richiede l'uso di celle munite di un sistema a vaso di Dewar per l'isolamento termico. A seconda della temperatura a cui si lavora e delle altre condizioni, il disegno di tale cella varia ed è alquanto complicato. Tali condizioni sono, per esempio, quelle richieste per la fotolisi in mezzi rigidi alla temperatura dell'azoto liquido (77,3 °K) o in matrici di gas inerte a temperature bassissime, come quella dell'elio liquido (4,2 °K), e quelle richieste per osservazioni spettrofotometriche all'ultravioletto o all'infrarosso di variazioni dei reagenti e dei prodotti di reazione.
Attinometria. - La determinazione dei rendimenti quantici delle fotoreazioni richiede la valutazione quantitativa dei prodotti formati (o dei materiali di partenza consumati) in un dato periodo di tempo e la corrispondente quantità di radiazione assorbita nello stesso tempo. Misure fisiche dirette dell'intensità della radiazione si basano su metodi radiometrici (termopile, termistori) o fotoelettrici (fotocellule e fotomoltiplicatori). I procedimenti sviluppati più di recente misurano la differenza del flusso di luce prima e dopo la cella contenente il campione, mediante la capacità di assorbimento e fluorescenza di uno scintillatore accoppiato con un appropriato fotoelemento. Una tale misura continua differenziale è indipendente dalla lunghezza d'onda incidente entro un'ampia regione ed è direttamente proporzionale ai quanti di luce assorbiti.
Tuttavia viene molto spesso usata un'attinometria di tipo chimico. Questa richiede meno impegno per la costruzione dello strumento e usa, come standard secondario, una reazione fotochimica la cui resa quantica è nota e può essere riprodotta con accuratezza. Comuni sistemi standard sono la produzione di ossido di carbonio per fotolisi in fase gassosa dell'acetone e le reazioni di ossidoriduzione fotochimica di ossalati di metalli di transizione, come il ferriossalato di potassio in fase liquida.
Tempi di vita della luminescenza. - I tempi di vita degli stati eccitati sono parametri importanti per la cinetica dei processi fotochimici e fotofisici. Il metodo più diretto, tra quelli disponibili pet determinare tali tempi di vita, consiste nella misura del tempo di decadimento dell'emissione mediante fluorimetria e fosforimetria, a impulsi, in cui vengono usati, per eccitare il campione, rispettivamente impulsi di luce con tempi di nanosecondi e microsecondi. Il decadimento dell'emissione viene controllato dopo ciascun impulso con un fotomoltiplicatore veloce e con un oscilloscopio. Un approccio più sensibile e veloce è basato su di un'estensione di questa tecnica, che impiega il metodo di campionatura del singolo fotone (single photon sampling method), in cui i fotoni dovuti alla fluorescenza vengono contati individualmente e il tempo della loro osservazione è messo in relazione elettronicamente col tempo di eccitazione. Esso permette di misurare il tempo di vita di sostanze con una luminescenza estremamente debole nell'intervallo compreso fra 10-6 e 10-10 secondi.
Quest'ultima tecnica, di limitata applicazione, è stata investigata per primo da Rentzepis. Essa fa uso di una successione di impulsi, con larghezza di banda di pochi picosecondi, che viene fatta passare attraverso una soluzione del campione e riflessa all'indietro lungo lo stesso cammino ottico di andata. L'impulso riflesso incontrerà in un certo punto del suo cammino, inter alia, molecole che sono rimaste nello stato già eccitato, S1, e darà luogo perciò a una eccitazione complessiva S2 dovuta a due fotoni. Dopo la correzione dovuta alla larghezza dell'impulso, la dimensione di questo ‛punto', dove ha luogo la transizione S1→S2 è messa in relazione con le costanti di velocità per il decadimento dallo stato S1. Questo metodo fu applicato all'azulene che fluoresce dallo stato S2 piuttosto che dallo stato S1 e in cui quest'ultimo viene primariamente disattivato per passaggio dallo stato di singoletto a quello di tripletto S1→T1. Il cammino lungo il quale ha luogo l'assorbimento di due fotoni è caratterizzato, in questo caso, dalla fluorescenza (S2→S0) e ha permesso di stimare un tempo di vita di circa 4.10-12 s e un valore per ki.s.c. di circa 2,5•1011 s-1 per lo stato S1 dell'azulene.
Tempi di vita di fosforescenza più lunghi di un millisecondo possono essere misurati in un fosforimetro convenzionale con una sorgente di luce stazionaria. Il decadimento viene osservato durante la fase oscura prodotta dal sistema interruttore o ruotando il settore che interrompe alternativamente il raggio di luce eccitante ed emessa.
Fotolisi a lampo (flash photolysis). - La fotolisi a lampo (a flash) è stata introdotta nel 1949 da R. G. W. Norrish e G. Porter, ai quali fu assegnato nel 1967 il premio Nobel per lo sviluppo di questa importante tecnica atta allo studio qualitativo e quantitativo degli stati eccitati e degli intermedi a vita breve nei processi fotochimici. Il principio di questo metodo si basa sulla produzione di un'alta concentrazione di molecole eccitate con un impulso luminoso di intensità molto alta e di breve durata. Varie tecniche di rivelazione basate sulla spettroscopia di assorbimento e di emissione vengono usate per analizzare il sistema poco tempo dopo il lampo di luce. Lo spettro di emissione di una specie transiente può essere registrato usando uno spettrografo; similmente lo spettro di assorbimento può essere misurato se un raggio analitico è predisposto a dare il lampo a un intervallo di tempo predeterminato dopo l'impulso iniziale. Alternativamente il processo di decadimento della o delle specie transienti può essere seguito cineticamente controllando l'emissione o l'assorbimento (di un raggio di luce continuo invece che di un lampo di luce analitico) a una lunghezza d'onda particolare.
I metodi di fotolisi a lampo si sono sviluppati rapidamente negli ultimi anni con l'avvento dei laser, particolarmente con l'uso delle sorgenti a bloccaggio dei modi (mode-locking), che forniscono una successione di impulsi laser aventi ciascuno la durata di pochi picosecondi. Si possono così studiare, grazie a quest'ultimo stadio di miglioramento della risoluzione temporale, costanti di velocità intorno ai 1011-1012 s-1, quali quelle dei processi di rilassamento vibrazionale.
f) Studio dei meccanismi di reazione.
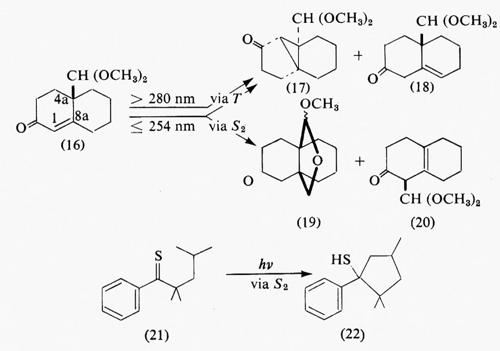
Lo stato eccitato reattivo. - Nell'istante della loro formazione, la maggior parte degli stati eccitati sono dotati di un eccesso di energia vibrazionale e occasionalmente anche di energia elettronica, quando vengono inizialmente prodotti stati eccitati a energia più, alta del primo stato eccitato. In fase gassosa, dove la frequenza collisionale è bassa, tali stati eccitati transienti possono reagire prima che abbia luogo il rilassamento energetico. Al contrario, in soluzione l'eccesso di energia viene in genere rapidamente dissipato per collisione e le reazioni, così come la luminescenza (regole di Kasha e di Vavilov), hanno luogo di norma a partire dagli stati più bassi S1 e T1. Vi sono tuttavia eccezioni degne di nota, come la fluorescenza dell'azulene (v. sopra) e certe reazioni di altri composti che procedono dallo stato S2, così come processi da stadi eccitati superiori generati dall'assorbimento consecutivo di due fotoni. Ad esempio il composto nello stato di tripletto eccitato (16), generato mediante passaggio per intersystem crossing dallo stato S1 (n, π*), dà luogo per riarrangiamento tipo cicloesenone al (17) e per spostamento del doppio legame a (18). Quando (16) viene irradiato selettivamente in corrispondenza della banda S0→S2 (π, π*), la reazione che dà i prodotti (19) (per trasferimento di un idrogeno del gruppo metossilico al C-1 e ciclizzazione al C-8a) e (20) (per rottura del legame σ al C-4a e ricombinazione accoppiata al C-1) compete con la conversione interna S2→S1.
La reattività degli stati eccitati superiori è tuttavia, più generalmente, caratteristica dei tiochetoni. Similmente alla situazione dell'azulene, la separazione energetica tra i livelli S2 (π, π*) ed S1 (n, π*) è grande; quindi il tempo di vita di S2 è abbastanza elevato da permettere che a partire da questo stato possano aver luogo dei processi che competono efficacemente con la conversione interna. Aril-alchil-tioni, come (21), partendo dallo stato S2, danno luogo sia alla fluorescenza che alla inserzione formale di zolfo nel legame Cσ−H (→22).
I processi a due fotoni mostrano una dipendenza caratteristica della formazione dei prodotti dal quadrato dell'intensità della luce. Oggi è noto che parecchi casi del genere si verificano in vetri rigidi; basti ricordare la fotoionizzazione di composti aromatici a partire da uno stato di tripletto più alto che viene popolato quando un tripletto più basso metastabile assorbe un altro fotone di sufficiente energia, come è indicato dall'equazione (14):
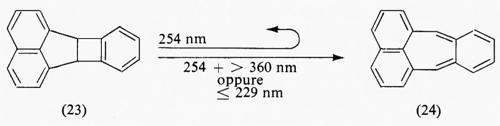
Una situazione simile è osservata nella reazione elettrociclica (23)→(24). L'irraggiamento simultaneo di (23) con
lunghezze d'onda di 254 nm (eccitazione del singoletto) e maggiore di 360 nm (assorbita dal tripletto del naftalene) permette di ottenere (24). Il prodotto (24) è ottenibile anche attraverso una via alternativa diversa dal percorso basato sui due fotoni; questa via alternativa consiste nell'eccitare (23) solamente con luce avente lunghezza d'onda inferiore o uguale a 229 nm, che fornisce energia sufficiente per passare al tripletto superiore notevolmente reattivo, in modo da competere con il ritorno allo stato S1 termicamente equilibrato.
Nella maggior parte dei sistemi, con reazioni che hanno luogo a partire dagli stati a più basso livello energetico, l'identificazione dei reagenti si limita alla determinazione della molteplicità e della cinetica. In certi composti, come quelli contenenti elementi del V, VI o VII gruppo, l'eccitazione può coinvolgere anche elettroni di valenza del guscio esterno non leganti. Dal momento che è spesso molto difficile predire l'ordine delle energie delle differenti configurazioni elettroniche nella molteplicità del tripletto, può essere necessario un assegnamento configurazionale degli stati di tripletto reattivi.
Gli studi che impiegano il trasferimento bimolecolare (collisionale) dell'energia in esperimenti scelti di sensibilizzazione e di disattivazione costituiscono in generale il metodo più valido per differenziare tra di loro e analizzare le specie reattive S1 e T1. Un'oculata scelta del sensibilizzatore o del disattivatore (quencher) richiede che si conoscano le velocità di trasferimento e le energie di eccitazione. In particolare l'abilità relativa di un dato composto a disattivare singoletti e tripletti deve essere stabilita, per esempio, mediante disattivazione di emissione.
La sensibilizzazione del singoletto è utile raramente, salvo il caso in cui gli stati di singoletto e di tripletto siano ambedue reattivi e sia disponibile un composto capace di trasferire selettivamente l'energia del singoletto, ma che disattiva i tripletti.
La sensibilizzazione del tripletto e la sua disattivazione permettono di determinare se una fotoreazione si origina solo da singoletti o da tripletti, oppure da ambedue. La composizione quantitativa dei fotoprodotti nella reazione diretta e in quella sensibilizzata permette di discriminare fra le ulteriori possibilità, che un tempo di vita molto breve (inferiore a 0,1 ns) prevenga la disattivazione (quenching) di un reagente obbligatoriamente nello stato di tripletto e che il singoletto reagisca prima dell'intersystem crossing nel caso di irraggiamento diretto, dal momento che difficilmente singoletto e tripletto reagiscono in maniera identica.
Rese quantiche. - La resa quantica (equazione 15) deve essere necessariamente nota qualora si vogliano derivare le costanti di velocità dello stato eccitato, poiché è l'unico parametro cinetico associato con una fotoreazione che sia direttamente misurabile in condizioni di stato stazionario. Le equazioni cinetiche per le rese quantiche di reazioni mono- e bimolecolari sono riportate nelle equazioni (16) e (17) rispettivamente:
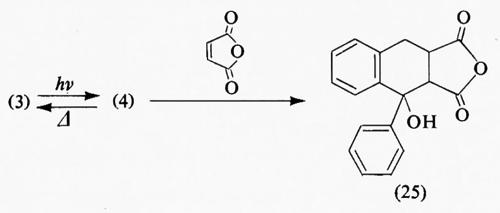
Quattro di questi parametri, Φi, ΦSE, τSE e Pi, sono in linea di principio misurabili mediante esperimenti separati. ΦSE è la probabilità che l'assorbimento di luce dia origine allo stato eccitato richiesto; kr e ks sono le costanti di velocità con cui lo stato eccitato dà luogo alla fotoreazione primaria (con il substrato S in processi bimolecolari) necessaria per il processo i, e τSE è il tempo di vita di tale stato. Pi è la probabilità che un qualsiasi stato metastabile intermedio porti a un prodotto stabile e cioè completi il processo i piuttosto che formare altri prodotti o riportare il reagente allo stato fondamentale. L'inclusione di questo fattore non è perciò necessaria se i è un processo irreversibile direttamente dallo stato fondamentale, come un'emissione o una riorganizzazione in un solo passaggio di un legame chimico. Tuttavia gli intermedi reattivi contribuiscono molto spesso a determinare le rese quantiche totali. Mentre nel caso di reazioni bimolecolari Pi può essere spesso misurato mediante tecniche cinetiche dirette, questo non è possibile in reazioni monomolecolari, e l'intermedio deve essere quantitativamente intrappolato in maniera misurabile. Un agente adatto per l'intrappolamento deve essere selettivamente reattivo nei confronti dell'ipotetico intermedio, ma non reattivo nei confronti del materiale di partenza, dello stato eccitato, di ogni altro intermedio e del prodotto finale. Parecchi di tali agenti sono stati usati con successo: i tioli alchilici per il blocco di radicali, l'incorporazione di deuterio per gli enoli, i dienofili per i dieni e i nucleofili per gli ioni anfoteri; ad esempio il fotoenolo, la cui formazione reversibile è stata proposta per spiegare la fotostabilità dell'o-metilbenzofenone (v. 3⇄4), può essere catturato mediante aggiunta dell'anidride maleica come dienofilo (→25).
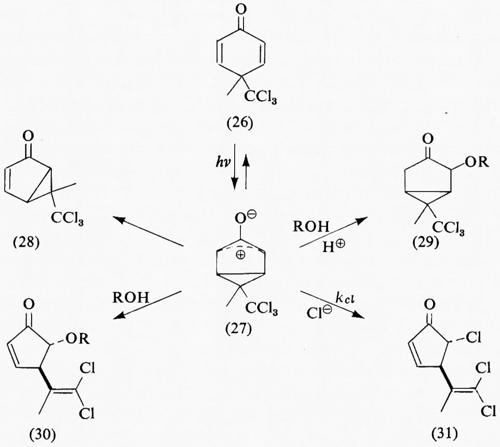
La prova diretta che uno ione anfotero (27) deve intervenire nella fototrasposizione del cicloesandione (26) a dare (28) è stata stabilita mediante cattura nucleofila. In soluzione alcolica acida, (27) viene protonato e infine stabilizzato per aggiunta di alcool a dare (29). In assenza di un elettrofilo appropriato, un attacco nucleofilo diretto dell'alcool e dello ione alogenuro aggiunto porta, dopo frammentazione anionica ed eliminazione del cloruro, ai prodotti (30) e (31). Assumendo che Φ27 sia circa eguale all'unità, le rese relative misurate in assenza (Φ°) e in presenza (Φ) dell'alogenuro (v. equazioni 18 e 19) mostrano una dipendenza lineare dalla concentrazione [Cl-] dello ione alogenuro, con pendenza comune uguale a kClτ27 (vide infra per la cinetica della disattivazione):
Questi risultati provano lo schema cinetico in cui uno ione anfotero come (27) è il comune precursore dei prodotti (28), (30) e (31), e anche di (29) per analogia.
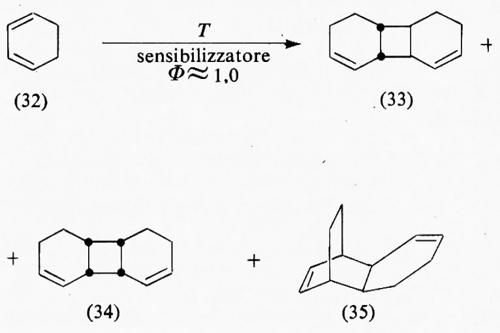
Probabilità di formazione di stati reattivi eccitati. - Nell'irraggiamento diretto la probabilità che l'assorbimento della luce produca lo stato eccitato richiesto ΦSE è uguale a 1, se si sta studiando una reazione di singoletto e se la resa quantica della reazione non dipende dalla lunghezza d'onda. Nel caso che sia coinvolto uno stato di tripletto, ΦSE risulta uguale alla resa quantica dell'intersystem crossing, Φi.s.c., che viene comunemente misurata per sensibilizzazione di un appropriato processo di tripletto facendo riferimento a un sensibilizzatore avente un Φi.s.c. noto (tecnica di ‛conteggio del tripletto'). I sistemi più frequentemente usati per tale conteggio sono la fosforescenza del diacetile, l'isomerizzazione cis-trans dell'1,3-pentadiene (14⇄15) e la dimerizzazione dell'1,3-cicloesadiene (32→33-35). La fosforescenza e il ritorno non irraggiante allo stato fondamentale sono i soli modi di disattivazione del diacetile nel tripletto, i due isomeri dell'1,3-pentadiene hanno uno stato di tripletto comune e sono disattivatori (quenchers) ugualmente validi purché il trasferimento di energia sia esotermico per ambedue; infine i dimeri (33)-(35) normalmente non agiscono come disattivatori. Queste proprietà rendono la cinetica di sensibilizzazione di questi sistemi sufficientemente semplice da permettere di porre in relazione diretta le rese quantiche osservate con quella della formazione del tripletto del donatore (Φi.s.c.).
Tempi di vita dello stato eccitato. - Questi possono essere misurati direttamente mediante spettroscopia a lampo (flash spectroscopy) o indirettamente mediante tecniche di disattivazione (quenching). Ambedue i metodi danno τ−S1E=Σk, cioè la somma delle velocità di tutti i processi di disattivazione che competono tra loro.
Una disattivazione quantitativa comporta determinazioni di rese quantiche che sono anche richieste per scomporre τ−S¹E nei suoi vari componenti. Nelle equazioni (20-27) viene derivata la classica espressione di Stern-Volmer, che fu formulata per la prima volta nel caso della disattivazione della fluorescenza:
I è l'intensità della luce assorbita o velocità di formazione di D* (ammettendo ki.s.c.=1,0 per uno stato eccitato di tripletto D*), kd rappresenta la somma di tutti i processi di decadimento, sia irradianti che non irradianti, di D* diversi da kr e kt. Queste due ultime sono rispettivamente la costante di velocità del processo sotto misura (formazione di prodotto o emissione) e la costante di velocità bimolecolare per la disattivazione.
Applicando l'approssimazione dello stato stazionario per la concentrazione di D* si ottiene:
I=[D*](kd+kr+kt[A]). (24)
Le rese quantiche in presenza (Φr) e in assenza (Φ0r) del disattivatore (queneher) sono date da
Quindi
L'espressione di Stern-Volmer (equazione 27) predice una relazione lineare tra Φ0r/Φr e la concentrazione del disattivatore, con una pendenza uguale a τD*kt, dove τD* è il tempo di vita dello stato eccitato da disattivare (in assenza del disattivatore A).
Se in un dato sistema solamente uno stato eccitato è reattivo, si deve avere una pendenza uniforme per tutti i coprodotti nella relazione di Stern-Volmer e i rapporti tra i prodotti non variano con l'entità della disattivazione.
L'inverso della resa quantica dipende linearmente dalla concentrazione del disattivatore (equazione 28). La pendenza di tale retta divisa per l'intercetta, 1/Φ0, è uguale a τD*kt.
Le velocità specifiche per il trasferimento di energia, kt, vengono determinate nel modo migliore mediante esperimenti con luce lampeggiante (flash). Tuttavia, specialmente quando si debbono studiare tripletti, lo stato eccitato reattivo ha vita troppo breve. Per fortuna il trasferimento di energia esotermico in solventi mobili è in generale molto vicino a quello controllato dalla diffusione, cioè kt≈kdiff.. Un'espressione approssimata per la costante di velocità del processo controllato dalla diffusione, kdiff., è data dalla equazione di Debye (29)
dove R è la costante dei gas, T la temperatura assoluta ed η la viscosità in poise.
Non è raro che più di uno stato eccitato sia implicato nella cinetica complessiva. L'analisi dei tempi di vita diventa allora più complicata poiché viene a dipendere da dettagliati eventi di disattivazione e la relazione di SternVolmer può deviare dalla linearità verso l'alto o verso il basso.
Bibliografia
Ageno, M., Le radiazioni e i loro effetti, Torino 1962.
Arnold, D. R., The protocycloaddition of carbonyl compounds to unsaturated systems: the syntheses of oxetanes, in ‟Advances in photochemistry", 1968, VI, pp. 301-423.
Ausloos, P. J., Lias, S. G., Photochemistry in the far ultraviolet, in ‟Annual review of physical chemistry", 1971, XXII, pp. 85-107.
Bunsen, R. W., Roscoe, H. E., Photochemical researches, 5 tomi, London 1858-1863.
Calvert, J. G., Pitts, J. N. Jr., Photochemistry, New York 1966.
Ciamician, G., La fotochimica dell'avvenire, Bologna 1913.
Cundall, R. B., Gilbert, A., Photochemistry, London 1970.
Daniels, F. (a cura di), Photochemistry in the liquid and solid states, New York 1960.
Draper, J. W., Scientific memoirs, being experimental contributions to a knowledge of radiant energy, New York 1878.
Einstein, A., Thermodynamische Begründung des photochemischen Äquivalentgesetzes, in ‟Annalen der Physik" (4), 1912, XXXVII, pp. 832-838.
Grotthuss, Th., von, Über die chemische Wirksamkeit des Lichtes und der Elektrizität, in ‟Jahresverhandlungen der Curlandischen Gesellschaft für Literatur und Kunst", 1819, I, pp. 119-124.
Herschel, J. F. W., On the action of the rays of the solar spectrum on vegetable colours and some new photographic processes, in ‟Philosophical transactions of the Royal Society" (Series A), 1842, CXXXII, pp. 181-214.
Jablonski, A., Über den Mechanismus der Photolumineszenz von Farbstoffphosphoren, in ‟Zeitschrift für Physik", 1935, XCIV, pp. 38-46.
Kan, R. O., Organic photochemistry, New York 1966.
Lamola, A. A., Turro, N. J., Energy transfer and organic photochemistry, in Techniques of organic chemistry (a cura di P. A. Leermakers e A. Weissberger), vol. XIV, New York-London 1969.
Levine, A. K., Lasers, New York 1967.
Matsen, F. A., Klein, D. J., Spin conservation, in ‟Advances in photochemistry", 1969, VII, pp. 155.
Mulliken, R. S., Molecular orbitals in chemistry, physics and biology, New York-London 1964.
Neckers, D. C., Mechanistic organic photochemistry, New York 1967.
Norrish, R. G. W., Photochemistry and reaction kinetics, Cambridge 1967.
Noyes, W. A. Jr., Leighton, P. A., The photochemistry of gases, New York 1966.
Noyes, W. A. Jr., Unger, I., Singlet and triplet states: benzene and simple aromatic compounds, in ‟Advances in photochemistry", 1966, IV, pp. 49-79.
Orchin, M., Jaffé, H. H., Symmetry, orbitals and spectra, New York 1971.
Parker, C. A., Photoluminescence of solutions, Amsterdam 1968.
Paternò, E., Chieffi, G., Sintesi in chimica organica per mezzo della luce. Nota II. Composti degli idrocarburi non saturi con aldeidi e chetoni, in ‟Gazzetta chimica italiana", 1909, XXXIX, pp. 341-361.
Pitts, J. N. Jr., Wilkinson, F., Hammond, G. S., The ‛vocabulary' of photochemistry, in ‟Advances in photochemistry", 1963, I, pp. 1-21.
Porter, G. B., Balzani, V., Moggi, L., Primary process and energy transfer: consistent terms and definitions, in ‟Advances in photochemistry", 1974, IX, pp. 147-196.
Reid, C., Excited states in chemistry and biology, London 1957.
Saussure, H. B. de, Effects chimiques de la lumière, in ‟Mémoires de l'Académie de Turin" (1788-1789), 1790, IX, pp. 441-453.
Schaffner, K., Photochemische Umwandlungen ausgewählter Naturstoffe, in ‟Fortschritte der Chemie organischer Naturstoffe", 1964, XXII, pp. 1-114.
Schaffner, K., Photochemical rearrangements of conjugated cyclic ketones: the present state of investigations, in ‟Advances in photochemistry", 1966, IV, pp. 81-112.
Simons, J. P., Photochemistry and spectroscopy, New York 1971.
Terenin, A., Ermolaev, V., Sensitized phosphorescence in organic solutions at low temperature. Energy transfer between triplet state, in ‟Transactions of the Faraday Society", 1956, LII, pp. 1042-1052.
Turro, N. J., Molecular photochemistry, New York-Amsterdam 1965.
Wagner, P. J., Hammond, G. S., Properties and reactions of organic molecules in their triplet state, in ‟Advances in photochemistry", 1968, V, pp. 21-156.
Wayne, R. P., Photochemistry, London 1970.
Wilkinson, F., Electronic energy transfer between organic molecules in solution, in ‟Advances in photochemistry", 1964, III, pp. 241-268.
Wolf, H. P., Bohning, J. J., Schnieper, P. A., Weiss, K., Apparatus for the measurement of quantum yields and rates of photochemical reactions, in ‟Photochemistry and photobiology", 1967, VI, pp. 321-329.