geni omeotici e cervello
geni omeotici e cervello
Geni specifici, espressi in sequenze programmate, che regolano la complessa serie di eventi che, dalla fecondazione della cellula uovo, conducono alla costruzione del piano corporeo del nuovo individuo. Questi geni hanno un’azione fondamentale anche nella maturazione dei circuiti nervosi del cervello, guidando la formazione degli assi fondamentali e, successivamente, nella specificazione dell’identità cellulare nei vari tessuti.
Geni Hox
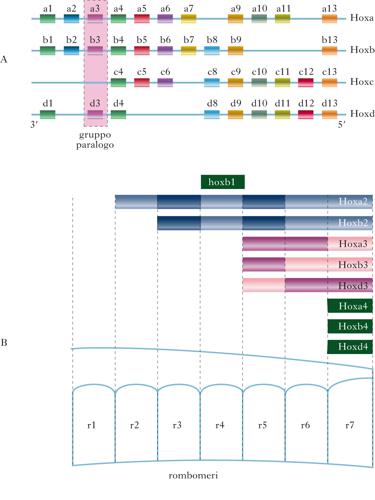
I geni Hox sono una grande famiglia di geni che codificano fattori di trascrizione (➔) con motivo strutturale ‘elica-ansa-elica’ (helix-turn-helix). In molte specie animali, questi geni hanno un ruolo fondamentale nella regolazione della specificazione delle identità di posizione dei tessuti dell’asse anteroposteriore. Nella maggior parte dei vertebrati, sono presenti 39 geni Hox, organizzati in quattro cluster distribuiti su cromosomi diversi; sono comparsi nel corso dell’evoluzione per duplicazione e divergenza di un comune complesso ancestrale. All’interno di ciascun cluster tutti i geni presentano lo stesso verso di trascrizione. Una caratteristica fondamentale dei geni Hox e la colinearità, cioè la correlazione diretta tra la posizione lineare che essi occupano lungo il cromosoma e i limiti spaziali e temporali di espressione lungo l’asse anteroposteriore nel corso dello sviluppo. L’insieme di geni posti su cluster diversi, ma accomunati dalla stessa finestra temporale e dallo stesso territorio di espressione, individua un gruppo paralogo (13 gruppi in tutto). La colinearità porta allo stabilirsi di domini ordinati di espressione caratterizzati da un codice combinatorio (codice Hox) che specifica proprietà regionali distinte lungo l’asse dell’embrione (➔ cervello, sviluppo del). Nei vertebrati, i prodotti dei geni Hox fissano l’identità di posizione nel mesoderma parassiale, nel neuroectoderma, nella cresta neurale e nell’endoderma. Nello sviluppo del cervello, i geni Hox hanno un ruolo cruciale per la segmentazione del rombencefalo (➔) in rombomeri, compartimenti cellulari distinti formati da cellule a destino differenziativo definito. I confini di espressione dei geni Hox lungo l’asse anteroposteriore coincidono con i confini tra i diversi rombomeri. Nella maggior parte dei casi, geni adiacenti di uno stesso cluster presentano un limite di espressione anteriore lungo l’asse anteroposteriore spostato in avanti di due rombomeri (regola della periodicità di due segmenti). A titolo di esempio, il gene Hoxb2 è espresso fino al confine tra il rombomero r2 e il rombomero r3, mentre il gene adiacente, Hoxb3, è espresso fino al bordo tra il rombomero r4 e il rombomero r5, e così via. I geni Hox appartenenti allo stesso gruppo paralogo hanno invece gli stessi confini anteriori di espressione (i membri dei gruppi paraloghi 2, 3 e 4 presentano confini di espressione nel rombencefalo corrispondenti, rispettivamente, ai bordi fra i rombomeri r2/r3, r4/r5 e r6/r7). Durante lo sviluppo del rombencefalo, l’espressione dei geni Hox è innescata dall’acido retinoico e dai fattori di crescita dei fibroblasti FGF3 e FGF8. Si sa con certezza che l’acido retinoico, disposto lungo un gradiente di concentrazione caudo-rostrale, attiva i geni Hoxa1, Hoxa4, Hoxb4 e Hoxd4, mentre FGF3 e FGF8 attivano, in numerose specie di vertebrati, l’espressione dei geni Krox20 e Kreisler. La proteina KROX20 è un fattore di trascrizione che attiva i geni Hoxa2, Hoxb2 e EphA4 nei rombomeri r3 e r5, dove invece reprime l’espressione di Hoxb1. Il prodotto del gene Kreisler, invece, è un attivatore dell’espressione dei geni Hoxa3 e Hoxb3 nei rombomeri r5 e r6. Sia l’acido retinoico sia i fattori FGF, inoltre, regolano l’espressione del gene Vhnf1 (Variant hepatocyte nuclear factor), a livello dei futuri rombomeri r5 e r6.
Geni dello sviluppo e specificazione regionale del telencefalo
Dopo la formazione dei primordi del telencefalo, durante lo sviluppo si assiste all’espressione del gene Foxg1, quando il neuroepitelio è ancora costituito da un singolo strato di cellule. Subito dopo, il telencefalo viene suddiviso in territori distinti, i cui confini sono inizialmente indicati dall’espressione di marcatori molecolari specifici e in seguito da differenze regionali nei livelli di proliferazione cellulare. La specificazione dei domini telencefalici dorsale e caudale è operata, rispettivamente, dai prodotti dei geni Gli3 e Shh. Il gene Gli3, che è responsabile della dorsalizzazione, è inizialmente espresso in tutto il telencefalo. Successivamente, il prodotto del gene Shh promuove l’identità ventrale per via indiretta, reprimendo così l’azione del gene Gli3. La proteina SHH agisce anche da attivatore dei fattori di crescita dei fibroblasti (FGF), morfogeni che esplicano un’azione ventralizzante di tipo diretto. Il fattore FOXG1, inoltre, agisce in concerto con il segnale di FGF nella generazione del telencefalo ventrale. Sia FOXG1 sia i membri della classe FGF cooperano anche nel partizionare il telencefalo dorsale nei territori anterolaterali e posteromediali della neocorteccia, un processo nel quale è coinvolto anche il gene Pax6, che codifica un fattore di trascrizione essenziale nella demarcazione del confine tra telencefalo dorsale e telencefalo ventrale. I prodotti dei geni Pax6 ed Emx2 interagiscono nell’indirizzare verso un destino differenziativo corticale i precursori cellulari telencefalici. Successivamente, il telencefalo dorsale viene suddiviso in due domini: la corteccia cerebrale, che dà origine alla neocorteccia e all’ippocampo, e la linea mediana dorsale, che dà origine al plesso coroideo. La specificazione delle cellule della corteccia cerebrale è operata principalmente dal gene selettore Lhx2, mentre lo sviluppo della linea mediana dorsale è promosso dalle molecole secrete della classe BMP (Bone Morphogenetic Protein) e WNT (Wingless/ Int protein). Lo sviluppo dell’ippocampo richiede i prodotti dei geni Emx1 e Emx2.