idrocarburi
idrocarburi
In chimica, composti costituiti esclusivamente da carbonio (C) e idrogeno (H). In ambito energetico, gli i. sono invece le fonti costituite prevalentemente da composti di C e H, ma anche da altri composti organici e inorganici. La classificazione degli i. è effettuata, in base ai tipi di legame fra gli atomi di C che costituiscono lo scheletro della molecola.
Idrocarburi saturi
Gli i. saturi, o paraffine, sono quelli in cui gli atomi di C, legati fra loro con legami semplici a formare catene aperte (aciclici) o chiuse (ciclici), sono legati anche con atomi di H, in numero tale da impegnare tutti gli elettroni di valenza. Gli i. saturi aciclici sono denominati anche alcani e la loro formula generale è CnH2n+2 (ovvero per ogni atomo di C ve ne sono il doppio di H, più 2). I primi alcani sono: metano (CH4), etano (C2H6), propano (C3H8), butano (C4H10), pentano (C5H12), esano (C6H14). All’aumentare del numero di atomi di C si innalza la temperatura di ebollizione e, quindi, in condizioni standard i primi 4 alcani (fino al butano) sono gassosi, mentre quelli con un numero di atomi di C da 5 a 15 sono liquidi, e gli altri solidi. Gli i. saturi ciclici (o cicloalcani) vengono anche indicati con il nome di nafteni.
Idrocarburi insaturi
Sono quelli in cui gli atomi di C sono uniti fra loro anche con legami doppi o tripli. Rispetto agli alcani, diminuisce il numero di atomi di H in relazione a quelli di C. Quando è presente un legame doppio, gli i. sono detti alcheni o olefine e la loro formula generale è CnH2n. La serie di tali composti è denominata etilenica, e i primi sono: etene o etilene (C2H4), propene o propilene (C3H6), butene o butilene (C4H8). Quando è presente un legame triplo, gli i. sono chiamati alchini o acetilenici e la loro formula generale è CnH2n−2. La serie è detta acetilenica e i primi sono: acetilene (C2H2), metilacetilene (C3H4), etilacetilene (C4H6).
Idrocarburi aromatici
Sono quelli in cui sono presenti uno o più anelli costituiti da 6 atomi di carbonio (anello aromatico), congiunti da un particolare legame (detto aromatico), convenzionalmente rappresentato graficamente da legami semplici e doppi alternati, o da una circonferenza all’interno dell’esagono. Il capostipite degli i. aromatici è il benzene (C6H6).
Idrocarburi come patrimonio energetico
In ambito energetico le fonti primarie usualmente denominate i. sono il gas naturale (➔), il petrolio (➔ p) e il bitume.
Il gas naturale è costituito prevalentemente da metano (più del 90%) e da piccole percentuali di altri i., quali etano, propano e butano, e di altri componenti, quali H2S, He, N2 e CO2.
Il petrolio è un liquido costituito da una miscela di numerose specie di i., di altri composti organici contenenti anche elementi diversi (essenzialmente S, O e N) e, in una percentuale modesta, di composti inorganici.
Il bitume è un solido costituito anch’esso da una miscela di vari i. e di altri composti organici e inorganici, ma con peso molecolare mediamente più elevato di quello del petrolio. Il carbone fossile, sebbene sia costituito in misura variabile anche da composti organici, non è usualmente compreso tra gli idrocarburi.
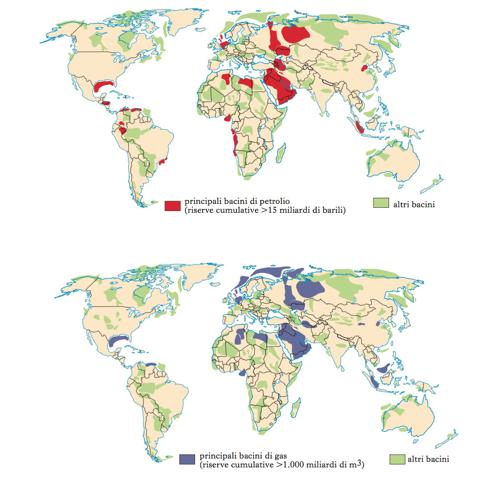
Giacimenti
Gli accumuli di i. (superficiali o a profondità anche di alcuni chilometri) sono denominati giacimenti. La loro origine, sebbene esistano diverse teorie, sembra essere legata a una serie di lunghi processi di fermentazione anaerobica (in assenza di ossigeno) di materiale biologico marino (principalmente plancton e alghe). Gli i. si sarebbero generati grazie al rapido seppellimento di una roccia (roccia madre), costituita da sedimenti marini, anche di materia organica, e ai successivi aumenti di pressione e temperatura nel corso della storia geologica. Gli i. sarebbero poi migrati, a causa della loro minore densità rispetto all’acqua, attraverso rocce porose e permeabili (rocce serbatoio), fino a incontrare un livello di rocce impermeabili, formando così un giacimento. Oltre ai giacimenti convenzionali, esistono anche altre forme di accumulo di i. non convenzionali, come, per es., scisti, formazioni sabbiose a bassa permeabilità e accumuli di i. in giacimenti di carbone (➔). Vanno, inoltre, citati i giacimenti di gas naturale sotto forma di composti solidi, chiamati idrati di metano (clatrati idrati), presenti nei fondali marini e nel permafrost delle regioni polari. I principali prodotti energetici commerciali ottenibili dagli i. sono il gas naturale depurato e i prodotti ottenuti dalla raffinazione (➔) del petrolio, quali benzina, gasolio (➔), oli combustibili (➔), kerosene, gas di petrolio liquefatto o GPL. Tali prodotti possono tuttavia essere ottenuti a partire anche da altre fonti come carbone o biomasse (biocombustibili e biocarburanti). L’uso degli i. è molto vasto, anche al di fuori del settore energetico. Essi sono infatti alla base della produzione (➔ petrolchimica, industria) di gomma, materie plastiche, detergenti, solventi, fibre, coloranti, schiume, esplosivi, vernici, profumi.