Idrocarburi
Idrocarburi
La grande varietà di molecole con strutture e proprietà differenti, che caratterizza gli idrocarburi, trova la sua origine nella formazione fra gli atomi di idrogeno e carbonio di legami covalenti stabili e opportunamente orientati nello spazio. Le molte combinazioni che possono essere assunte dalle molecole idrocarburiche sono dovute alla capacità dell'atomo di carbonio di formare legami covalenti, singoli, doppi e tripli. All'ampia classe degli idrocarburi alifatici appartengono gli alcani, gli alcheni e gli alchini. I primi, detti anche paraffine, sono caratterizzati dall'avere tutti i legami del carbonio semplici saturati con atomi di idrogeno o con altri atomi di carbonio. L'alcano più semplice è il metano, scoperto nel 1776 da Alessandro Volta durante una gita in barca sul lago Maggiore nei pressi di Angera, dove osservò salire dal fondale melmoso delle bollicine gassose di un gas fino ad allora sconosciuto e che chiamò 'aria infiammabile nativa delle paludi'. Oltre a possedere strutture lineari e ramificate, gli alcani sono presenti anche sotto forma di composti ciclici e policiclici. Gli alcheni sono molecole caratterizzate dalla presenza di almeno un doppio legame fra due atomi di carbonio. In questi composti, denominati anche olefine, il doppio legame può essere interpretato come il risultato di una deidrogenazione del corrispettivo alcano. Gli atomi di carbonio che partecipano al doppio legame sono ibridizzati sp2 e, oltre all'atomo di carbonio con cui condividono il doppio legame, sono legati ad altri due atomi di carbonio o d'idrogeno. I tre legami dell'atomo di carbonio insaturo sono planari e formano fra loro legami di 120°. Infine, gli alchini, il cui capostipite è l'acetilene, sono idrocarburi insaturi nei quali è presente un triplo legame carbonio-carbonio che coinvolge atomi di carbonio ibridizzati sp, legati a un altro atomo, di carbonio o d'idrogeno, e formano fra loro angoli di 180°.
L'altra grande classe di composti formati da idrogeno e carbonio è quella degli idrocarburi aromatici. Il capostipite di questa classe è il benzene, scoperto da Michael Faraday nel 1825 poco dopo la sua nomina a direttore del laboratorio della Royal Institution, isolandolo dai prodotti di distillazione di un olio ottenuto come sottoprodotto della fabbricazione del gas illuminante. Si tratta di un composto molto stabile per il quale Friedrich August Kekulè propose la tipica struttura ciclica con tre doppi legami adiacenti che sembra gli sia stata ispirata da un sogno. Lo studio approfondito delle caratteristiche del benzene ha dato origine a un importante settore della chimica organica teorica.
Le principali fonti di idrocarburi sono attualmente il gas naturale, il petrolio e il carbone, che rappresentano le principali fonti energetiche attualmente disponibili, ma sono anche usate come materie prime dell'industria chimica. La loro composizione dipende principalmente dai luoghi di estrazione. In generale è possibile classificarle in funzione del rapporto tra l'idrogeno e il carbonio contenuti: si passa quindi da rapporti H/C compresi tra 3 e 4 per il gas naturale, a valori compresi tra 1,2 e 2,5 per il petrolio e inferiori all'unità nel carbone.
Gas naturale
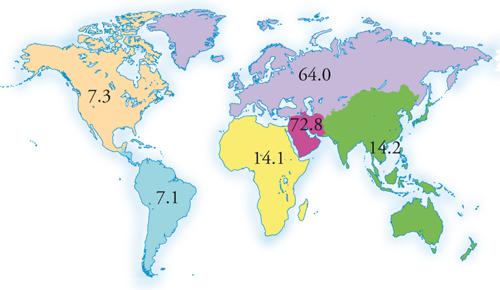
Il gas naturale è composto prevalentemente da metano (più del 90%) con una piccola percentuale di altri idrocarburi quali etano, propano e butano. Sono anche presenti altri componenti che però non sono idrocarburi quali: H2S, He, N2 e CO2 in percentuali variabili, generalmente inferiori al 2-3%. Le riserve di gas naturale provate sulla Terra alla fine del 2004, ammontavano a circa 180.000 miliardi di metri cubi (mld m3); per 'riserve provate' si intendono le quantità accertate e recuperabili utilizzando le odierne tecnologie e rispettando i costi attuali. Occorre precisare che negli ultimi anni le previsioni pessimistiche circa le quantità disponibili di gas naturale e di idrocarburi in generale, si sono fortunatamente rivelate non corrette. Il miglioramento delle tecnologie di estrazione e lo sviluppo di metodi di localizzazione più sofisticati, infatti, hanno in parte ridimensionato e posticipato l'incubo dell'esaurimento delle fonti di idrocarburi. Per quanto riguarda il gas naturale, le riserve provate sono passate da poco meno di 100.000 mld m3 nel 1984, a quasi 145.000 mld m3 nel 1994. Questo significa che in 20 anni le riserve provate invece che diminuire a causa del loro continuo sfruttamento sono addirittura quasi duplicate. Per tener conto del continuo sviluppo tecnologico, le riserve finali di gas naturale, di petrolio e di carbone tengono conto anche delle riserve probabili (reserves) e possibili (resourches). Le prime indicano tutte le riserve, comprese quelle che potranno essere sfruttate in seguito a un miglioramento delle tecnologie e a un abbattimento dei costi di estrazione, mentre le seconde tengono conto anche dello sfruttamento di possibili giacimenti che non sono ancora stati isolati ma per i quali è stata ragionevolmente accertata l'esistenza. Un'ulteriore parametro che costituisce un indice dello sfruttamento del gas naturale è il rapporto tra le riserve provate R e la produzione annua P. Questo rapporto indica il numero di anni per i quali si ritiene possibile estrarre la materia prima tenendo conto dei ritmi odierni e ipotizzando che le riserve siano pari a quelle provate. Nella tab. 1 è riportata la produzione annua di gas naturale e il rapporto R/P degli ultimi 25 anni, mentre nella fig. 2 viene evidenziata la distribuzione mondiale delle riserve provate alla fine del 2004. La vistosa disuniformità della localizzazione delle riserve sulla Terra, anche all'interno delle aree geografiche rappresentate nella fig. 2, unita al fatto che generalmente i paesi che maggiormente usufruiscono di queste materie prime (America settentrionale, Europa, Giappone) non sono i principali produttori, richiede la costruzione di gasdotti che permettano di trasportare la materia prima anche per migliaia di chilometri dal luogo di estrazione a quello di utilizzazione.
Attualmente suscitano particolare interesse i giacimenti di metano presenti nei fondali oceanici e nelle regioni polari caratterizzati dalla presenza di questo idrocarburo in composti solidi formati da acqua e dall'idrocarburo stesso, chiamati idrati del metano (clatrati idrati).
Questi composti solidi si formano a bassa temperatura e alta pressione (condizioni esistenti nei fondali marini a profondità superiori a 500 m e nel permafrost delle regioni polari). La maggior quantità di idrati del metano è stata individuata negli spazi porosi dei sedimenti presenti sui fondali di tutti gli oceani della Terra (in particolare nel Golfo del Messico) per uno spessore di diverse centinaia di metri. Attualmente si stima che gli idrati del metano rappresentino la maggior concentrazione di carbonio organico del globo. Essi costituiscono un'enorme riserva di metano (circa 1015 km3) corrispondente a una quantità qualche centinaio di volte maggiore rispetto al metano ancora sfruttabile nei giacimenti e pari a circa il doppio del metano equivalente di tutti i depositi fossili conosciuti (carbone, petrolio e gas naturale). In previsione di uno sfruttamento intensivo di questi giacimenti di metano numerose nazioni tra le quali gli Stati Uniti d'America hanno già investito ingenti somme per ricerche da svolgere nei prossimi anni. Inoltre, è utile segnalare come numerose società petrolifere stiano studiando la possibilità di sfruttare questi composti per trasportare il combustibile, non più in forma liquida nelle metaniere, ma in forma solida sotto forma di idrati. Il trasporto di idrati del metano permetterebbe di eludere il problema delle esplosioni (gli idrati del metano bruciano ma non esplodono) e di concentrare l'idrocarburo 164 volte di più che in condizioni standard.
Il gas naturale trova impiego sia come fonte energetica che come materia prima dell'industria chimica. Con il suo potere calorifico di circa 50.000 kJ/kg il gas naturale ricopre circa il 22,5% della richiesta energetica totale del pianeta, pari a 10,15 miliardi di tonnellate equivalenti di petrolio.
L'impiego del gas naturale (essenzialmente metano) come materia prima dell'industria chimica, necessita la produzione del gas di sintesi (CO + H2) mediante la combustione parziale con ossigeno o lo steam reforming in cui viene fatto reagire con vapore in presenza di opportuni catalizzatori.
In realtà, uno dei problemi importanti della chimica sintetica è quello di funzionalizzare il metano, o comunque gli idrocarburi alifatici, attraverso la sostituzione selettiva di un atomo di idrogeno con un atomo diverso, per esempio un gruppo ossidrilico. La difficoltà di perseguire questo obbiettivo è dovuta alla elevata forza del legame C-H, che rende difficile un attacco selettivo della molecola del metano nel quale uno solo dei legami venga rotto, sostituendo l'idrogeno con un altro gruppo, quale, per esempio il gruppo O−H. In questo caso si otterrebbe direttamente, senza passare attraverso il gas di sintesi, metanolo (CH3OH) che costituisce oltre che un carburante un intermedio utile per le sintesi chimiche. Infatti, nel processo di combustione del metano si formano diversi intermedi parzialmente ossidati, ma in quantità molto piccola poiché la reazione procede rapidamente verso la formazione di anidride carbonica e acqua.
Petrolio
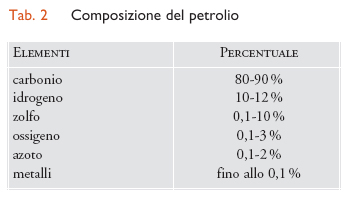
Il petrolio è composto da una miscela di idrocarburi, per circa l'80% alifatici e per il 20% aromatici. Gli alifatici sono alcani lineari o ramificati (paraffine) e cicloalcani (nafteni), mentre gli aromatici hanno come capostipite il benzene. La composizione del petrolio è variabile in base al giacimento e viene definita dalla concentrazione relativa dei diversi elementi come appare nella tab. 2.
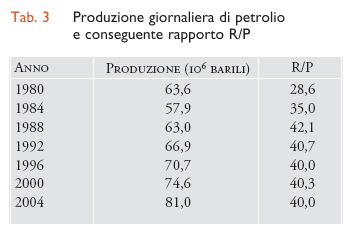
Nel 1859 il 'colonnello' Edwin Drake perforò il primo pozzo petrolifero a Titusville in Pennsylvania, ponendo la prima pietra dell'industria petrolifera moderna. Da allora l'utilizzazione del petrolio ha mostrato un andamento incessantemente in crescita, tanto che attualmente risulta essere la principale fonte energetica del pianeta (38%) e si stima che il suo impiego come materia prima idrocarburica nell'industria chimica occupi più del 70%. Le riserve di petrolio provate sono passate da 0,76 a 1,02 miliardi di barili rispettivamente 20 e 10 anni fa (1 barile corrisponde a circa 159 litri) fino ad arrivare a circa 1,2 miliardi di barili alla fine del 2004. Il rapporto R/P tra le riserve e la produzione annua è minore di quello del gas naturale e negli ultimi 15 anni ha oscillato tra i 40 e i 43 anni (tab. 3). Come per il gas naturale, anche il petrolio è distribuito sulla Terra in maniera disomogenea e viene trasportato mediante oleodotti o via mare tramite petroliere. Visto il ruolo primario che riveste nel campo chimico ed energetico, è stato (ed è tutt'ora) al centro di interessi economici, politici e militari in zonechiave del globo come il Medio Oriente (fig. 4).
Attraverso la raffinazione e la distillazione, dal petrolio è possibile ottenere un elevato numero di frazioni idrocarburiche che trovano impiego come carburanti. Gli idrocarburi con atomi di carbonio da C4 a C10 sono impiegati come carburanti per autotrazione; quelli da C9 a C16 come carburanti avio e per autotrazione; infine, come carburanti per motori Diesel, gli idrocarburi con un numero di atomi di carbonio compresi tra C15 e C25. Gli idrocarburi con peso molecolare più alto vengono convertiti attraverso processi di cracking in composti più leggeri e utilizzati come lubrificanti e come fonte primaria di componenti aromatici.
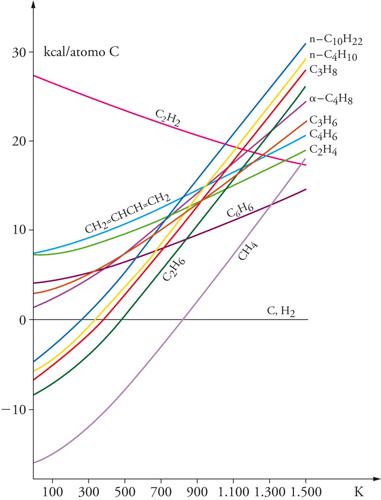
I trattamenti del petrolio, per ottenere combustibili, vengono condotti attraverso operazioni di raffineria, nel cui ambito domina il cracking catalitico, grazie all'impiego di opportuni catalizzatori fra i quali prevalgono le zeoliti. Attraverso questo processo le cariche idrocarburiche pesanti (generalmente composte da catene con un numero di atomi di carbonio superiore a 12) vengono convertite in idrocarburi a peso molecolare minore ma con elevata ramificazione. Il processo viene condotto in particolari reattori e la composizione della miscela prodotta è determinata dalla stabilità relativa degli idrocarburi che la compongono. In base alla termodinamica tale stabilità relativa risulta tanto più elevata quanto più piccoli sono i valori delle energie libere standard di formazione ΔG0f dei singoli idrocarburi (fig. 5).
Dalla fig. 5 è possibile osservare come gli idrocarburi risultino meno stabili all'aumentare del numero di atomi di carbonio e al crescere della temperatura. Inoltre, sopra una certa temperatura gli alcheni diventano più stabili dei rispettivi alcani (per es., sopra i 710 K il propilene è più stabile del propano). Nei reattori di cracking, però, occorre operare con tempi di residenza relativamente bassi per evitare la decomposizione degli idrocarburi negli elementi di base (C ed H2) che nelle condizioni operative sarebbero le specie nettamente favorite dal punto di vista termodinamico.
L'uso degli idrocarburi, e quindi del petrolio, per l'ottenimento dei prodotti di largo impiego, è alla base della petrolchimica, la cui affermazione ha costituito una delle maggiori rivoluzioni industriali della seconda metà del secolo scorso. Il cracking termico, condotto in presenza di vapore e in assenza di catalizzatori, produce la frammentazione verso prodotti leggeri e insaturi quali l'etilene, il propilene, il butene e il butadiene, oltre all'idrogeno. Essi sono alla base dell'industria chimica mondiale, poiché costituiscono le materie prime per l'industria della gomma e delle materie plastiche. Dalle paraffine si ottengono emulsionanti, composti chimici di base, detergenti e tensioattivi. Dalla frazione aromatica, invece, si estraggono benzene, toluene e xileni, dai quali si ricavano molti prodotti impiegati come solventi, materie plastiche, resine, fibre, coloranti, schiume, esplosivi, plastificanti, vernici, e altri.
Carbone
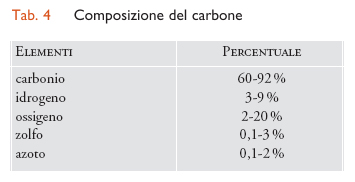
Il carbone è costituito essenzialmente da carbonio, idrogeno e ossigeno e in piccole percentuali da azoto e da zolfo. Come per gli altri combustibili fossili, la composizione del carbone non è fissa ma compresa entro certi intervalli (tab. 4).
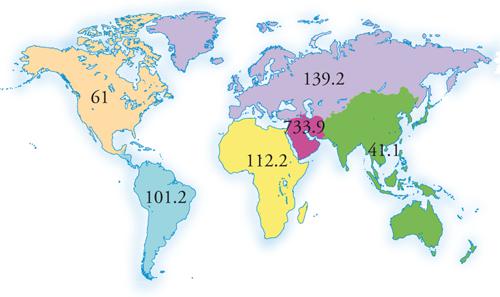
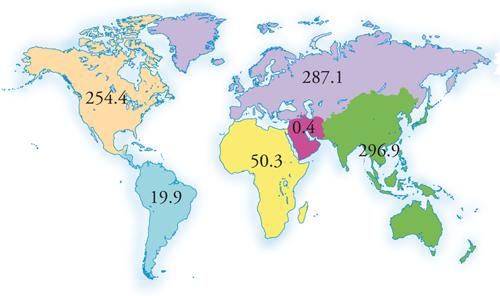
Il carbone ha costituito, fino alla fine della Seconda guerra mondiale, la principale fonte energetica del pianeta. Attualmente i paesi più industrializzati ne hanno limitato l'impiego, mentre nei paesi in via di sviluppo, come la Cina, rappresenta ancora la fonte di approvvigionamento principale. Le riserve mondiali provate di carbone sono superiori a quelle di petrolio e di gas naturale (fig. 6). Se, inoltre, si confrontano i rapporti R/P annui è possibile osservare come il carbone sarà di gran lunga la fonte fossile primaria disponibile per più anni (valori medi superiori a 200 anni).
Dal carbone è possibile estrarre, tramite distillazione secca, la maggior parte degli idrocarburi, principalmente aromatici, in esso contenuti: benzene, toluene, etil-benzene, xileni, naftalene, antracene, polifenili, fenantrene, naftaceni, e così via. Frazioni idrocarburiche a elevato peso molecolare ‒ che possono essere impiegate come carburanti, combustibili e cariche pesanti per processi di cracking ‒ si possono ottenere, invece, mediante estrazione con solvente. Il trattamento termico del carbone permette di ottenere il gas di cokeria composto principalmente da idrogeno, metano e monossido di carbonio con percentuali minori di idrocarburi leggeri come l'etilene. La gassificazione del carbone, basata su un trattamento combinato di ossigeno e di vapor d'acqua ad alta temperatura permette di ottenere una miscela di ossidi di carbonio, idrogeno e metano.
Ruolo degli idrocarburi nella chimica e in particolare nella chimica organica
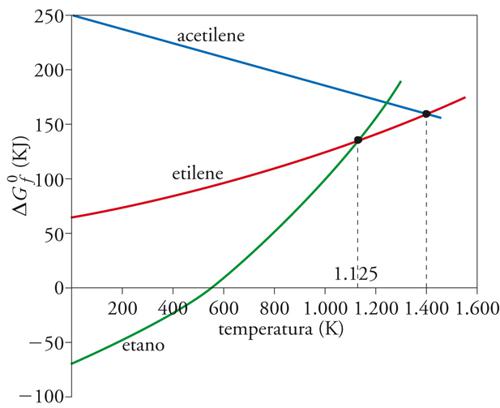
Tutti gli idrocarburi hanno una enorme importanza nell'economia e nella geopolitica moderne, sia per il loro ruolo come fonte primaria di energia, sia, contemporaneamente, per il vastissimo numero di prodotti di largo consumo che si preparano attraverso le loro trasformazioni. Nel secolo scorso l'intermedio di base dell'industria chimica era l'acetilene (CH≡CH), che in virtù della sua elevata insaturazione può consentire la realizzazione di un'ampia gamma di prodotti intermedi: per esempio, attraverso l'addizione di alogeni, o in particolare di acqua, usando il mercurio quale catalizzatore, si può produrre l'acetaldeide. L'acetilene è ancor oggi utilizzato in alcune sintesi organiche, anche se il suo impiego risulta pericoloso e il suo costo elevato. È risultata importante la scoperta di catalizzatori in grado di attivare, in maniera selettiva ed economicamente vantaggiosa, il doppio legame olefinico: per esempio, il cloruro di palladio viene impiegato per l'ossidazione in fase liquida dell'etilene ad acetaldeide. L'acetilene, quindi, è stato sostituito dall'etilene come prodotto di base della chimica industriale organica, con una produzione superiore a 20 milioni di tonnellate negli anni Novanta. Questo avvicendamento ha una sua logica ben definita che può essere ricondotta al depauperamento di idrogeno dell'etano con formazione di idrocarburi aventi maggiore insaturazione, e quindi funzionalità, quali rispettivamente l'etilene e l'acetilene. Poiché il contenuto energetico di un idrocarburo dipende dal valore della sua energia libera standard di formazione, ΔG0f è opportuno confrontarne i valori corrispondenti ai tre idrocarburi menzionati in funzione della temperatura (fig. 7).
Accanto all'etilene, anche il propilene e la frazione idrocarburica C4 rappresentano composti base della grande industria chimica organica. Le loro trasformazioni coinvolgono spesso uno stadio di ossidazione parziale, o selettiva.
Funzionalizzazione del legame C-H
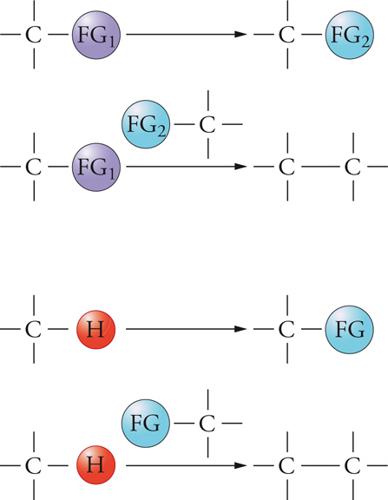
I legami C-H sono presenti nella maggior parte degli idrocarburi, inclusi i poliareni costituiti da idrocarburi aromatici condensati, così come nei polimeri, nei principî attivi farmaceutici e nella quasi totalità dei composti biologici (fig. 8). Pertanto la possibilità di funzionalizzare questo legame può contribuire ad ampliare la chimica sintetica in numerosi ambiti.
La sostituzione diretta e selettiva dei legami C-H, molto stabili e quindi poco reattivi, con nuovi legami ‒ quali C-O, C-N, C-C ‒ costituisce, come già evidenziato, un importante obiettivo per la chimica organica sintetica. Nelle sintesi tradizionali, infatti, tale sostituzione deve essere preceduta dall'inserimento di gruppi funzionali (GF), caratterizzati da una certa reattività chimica, come i gruppi ossidrile, amminici e gli alogeni. Nella fig. 8 sono rappresentati entrambi gli approcci sintetici.
Per la diffusa presenza dei legami C-H, in particolar modo negli idrocarburi, la sostituzione diretta e selettiva di legami C-H esorta a trovare nuove soluzioni sintetiche. Il problema maggiore che si incontra è costituito dalla difficoltà di raggiungere una selettività adeguata riguardo ai differenti legami C-H presenti nei composti organici. Le metodologie per operare queste sintesi chimiche innovative sono innumerevoli e passano dall'utilizzazione di catalizzatori metallici complessi, alla formazione di composti di coordinazione con metalli pesanti e all'impiego di reazioni radicaliche intramolecolari. Benché l'impiego di tali processi abbia già dimostrato la sua efficacia in un discreto numero di sintesi organiche, la possibilità di estendere tale strategia alla preparazione di un elevato numero di composti rimane ancora una sfida aperta. La calibrazione di un'adeguata metodologia rende possibile la riprogettazione di processi sintetici tradizionali, oltre che l'introduzione di nuove vie sintetiche per produrre sostanze organiche già note o addirittura nuovi prodotti chimici.
Bibliografia
Davies 2005: Davies, Peter, BP statistical review of world energy 2005, London, june 2005.
Godula, Sames 2006: Godula, Kamil - Sames, Dalibor, C-H bond functionalization in complex organic synthesis, "Science", 312, 2006, pp. 67-72.
Graham Solomons 1976: Graham Solomons, Thomas W., Organic chemistry, New York, Wiley, 1976.
Moscatelli, Cavallotti 2007: Moscatelli, Davide - Cavallotti, Carlo, Tipologia e struttura degli idrocarburi, in: Enciclopedia degli idrocarburi, Roma, Istituto della Enciclopedia Italiana, 2007.
Natta 1993: Natta, Giulio - Pasquon, Italo - Centola, Paolo, Principi della chimica industriale, Rozzano, Città Studi, 1993.
Stern, Stern 1971: Stern, Joy P. - Stern, Edward S., Petrochemicals today, London, Arnold, 1971.