Immunodeficienza acquisita, sindrome da
Immunodeficienza acquisita, sindrome da
(App. V, ii, p. 618; v. anche retrovirus, App. V, iv, p. 489)
Le conoscenze sulla sindrome da i. a. (AIDS) hanno avuto una consistente espansione nel corso degli anni Novanta e i progressi hanno riguardato sia il complesso degli approfondimenti biologico-patogenetici, sia gli aspetti epidemiologici, clinici e terapeutici.
Breve sintesi storica
La malattia venne identificata nel 1981 in Georgia (USA) dai CDC (Centers for Diseases Control and Prevention) di Atlanta, che riportarono cinque casi di polmonite da Pneumocystis carinii in omosessuali di sesso maschile (Los Angeles) e 26 forme di un tumore cutaneo relativamente raro, noto come sarcoma di Kaposi, sempre in individui omosessuali (New York e Los Angeles). In breve tempo si comprese che la malattia è trasmissibile per via ematica e sessuale (omo- ed eterosessuale), e i primi rilievi epidemiologici consentirono una previsione drammatica della sua diffusione a carattere pandemico, sebbene non fosse stato ancora identificato l'agente patogeno. Nel biennio 1983-84 fu isolato il virus HIV (Human Immunodeficiency Virus) e venne dimostrata con chiarezza la sua correlazione con la genesi del difetto immunitario. Nel 1985 venne messo a punto un valido test (ELISA, Enzyme Linked Immune Sorbent Assay) per identificare lo stato di infezione (sieropositività per anticorpi anti-HIV), si diede avvio alle indagini su gruppi di individui con comportamento definito a rischio (tossicodipendenti con l'abitudine di scambiarsi siringhe per iniettarsi droga endovena, omosessuali ed eterosessuali con numerosi partner) e si segnalarono i casi di soggetti contagiati per via ematica (trasfusione di sangue o di derivati ematici non adeguatamente controllati e trattati, come nei pazienti affetti da emofilia). Vennero segnalati i primi bambini nati con infezione acquisita da madri precedentemente contagiate (i casi di AIDS in età pediatrica risultano particolarmente numerosi in Africa).
Nella seconda metà degli anni Ottanta si è assistito in tutto il pianeta, grazie anche all'impegno assunto su vasta scala dall'Organizzazione mondiale della sanità, a un incremento sostanziale delle conoscenze sulla malattia, sulla sua diffusione e sulle misure educazionali e profilattiche messe in atto nei diversi paesi per contenere la pandemia. Negli anni Novanta il problema viene inquadrato in modo più esteso ai diversi livelli di complessità sociale con i quali si presenta, si considerano gli aspetti macroeconomici (influenza sul lavoro, costo delle cure, spese assicurative), vengono introdotti farmaci antivirali che consentono un parziale ma significativo ridimensionamento del pessimismo iniziale sulla gestione del quadro morboso, si prende atto della diversità dell'andamento epidemico in funzione dell'impegno e della disponibilità economica delle varie nazioni coinvolte.
Un ruolo non secondario, sin dal primo emergere dell'epidemia, hanno assunto e continuano ad assumere i massmedia, anche per il forte impatto emotivo che induce il fenomeno AIDS sulla vita di relazione tra individui e, in parte, a causa delle dichiarazioni di alcuni personaggi noti al grande pubblico (attori, campioni dello sport, stilisti di moda) che, colpiti dal virus, hanno reso pubblica la loro condizione al fine di incrementare gli sforzi economici per la lotta alla malattia e raccogliere fondi per la ricerca. In campo biologico e medico si verificano progressi sulla conoscenza della struttura del virus, sulla patogenesi del danno immunitario, sulle modalità attraverso le quali il sistema immunitario stesso è in grado di contenere l'aggressione del virus; notevoli sono gli sviluppi per il trattamento delle infezioni opportunistiche, grazie all'introduzione di nuovi farmaci capaci di aggredire gli agenti infettivi che causano le malattie correlate all'immunodepressione da HIV. Sul piano sociologico, l'AIDS ha posto nuovi problemi, non solo quelli legati alle modalità dell'assistenza o al rischio professionale degli operatori sanitari, ma anche nel settore assicurativo e medico-legale, dei diritti civili, della discriminazione sul posto di lavoro o nelle più semplici relazioni individuali. Ne scaturisce, di conseguenza, il fiorire di numerose associazioni di volontariato (in Italia la prima a nascere nel 1985 e fra le più attive nel settore è l'ANLAIDS, Associazione Nazionale per la Lotta contro l'AIDS), variamente impegnate per assistere i malati con AIDS e fornire supporto ai loro familiari, per limitare i danni di una discriminazione che, almeno all'inizio della pandemia e della sua presa d'atto collettiva, ha assunto risvolti assai preoccupanti. La lettura del problema AIDS dev'essere effettuata, pertanto, inserendolo in una dimensione culturale del tutto nuova, quale mai si era verificata in precedenza nella storia della medicina, soprattutto rispetto a epidemie che nel passato recente o lontano hanno colpito la specie umana. Per motivi biomedici, sociali e di politica sanitaria l'AIDS costituisce senza alcun dubbio uno dei problemi strategici della sanità mondiale all'alba del 21°secolo.
Storia naturale
Nell'ambito dell'inquadramento epidemiologico e clinico-immunologico delle conseguenze legate all'infezione da HIV è possibile definire, dal momento del contagio iniziale, una storia naturale dell'infezione che include una prima fase acuta (nella quale si ha una sindrome simil-mononucleosica), a cui può seguire un lungo periodo di relativa asintomaticità. Si instaura in tal modo il quadro, impropriamente così definito nel linguaggio comune, della sieropositività (apparentemente non si osservano segni clinici, ma il danno biologico progredisce e il paziente, spesso in forma inconsapevole, continua a diffondere il contagio soprattutto per via sessuale). È bene ricordare come l'intervallo tra momento del contagio (infezione) e comparsa delle manifestazioni cliniche possa essere assai variabile, in un periodo che si estende anche fino a 15 anni. Possono tuttavia, a breve termine rispetto al contagio iniziale, manifestarsi vari segni clinici che sono stati definiti inizialmente come LAS (Lymphadenopathy Syndrome) o PGL (Persistent Generalized Lymphadenopathy) e, se in fase più avanzata, ARC (AIDS Related Complex). Queste definizioni e acronimi, che in principio hanno creato qualche problema per l'inquadramento di una corretta impostazione nosologica, sono stati successivamente sistematizzati e modificati in modo opportuno dai CDC, in varie occasioni e con successivi aggiustamenti, fino al 1993. In tale anno la definizione di sorveglianza epidemiologica per l'AIDS è stata ulteriormente ampliata e sono state identificate tre condizioni con severità crescente sia clinica sia immunologica. In pratica, si distinguono tre categorie cliniche: A (stato asintomatico, infezione primaria acuta da HIV o PGL secondo le precedenti classificazioni); B (espressione clinicamente sintomatica senza nessuna condizione inclusa in A e in C: si tratta di individui con manifestazioni infettive minori quali la candidosi faringea, o con sintomi sistemici che possono essere riferiti alla sola presenza del virus, ovvero febbre persistente, dimagramento, diarrea cronica, profusa sudorazione prevalentemente notturna per almeno un mese); C (stato clinico e condizioni definitorie di AIDS in forma conclamata: sono comprese tutte le forme cliniche di natura infettiva e non infettiva che vengono elencate nella definizione di caso di AIDS). In particolare, precisando quanto sopra riferito, il gruppo B include varie condizioni che possono essere attribuite al virus HIV con difetto della risposta cellulo-mediata, o con assunzione di un carattere evolutivo che richiede comunque un trattamento conseguente alla presenza di HIV; nel gruppo B si includono specificamente: angiomatosi bacillare, candidosi orofaringea, candidosi vulvovaginale persistente e poco sensibile a farmaci, displasia cervicale e carcinoma cervicale in situ, persistenza per oltre un mese di sintomi sistemici, leucoplachia villosa del cavo orale, infezione da Herpes zoster manifestatasi con due episodi o coinvolgimento di più di un dermatomero, porpora trombocitopenica idiopatica, listeriosi, malattia infiammatoria della pelvi, neuropatia periferica. Per il gruppo C le condizioni definitorie di caso AIDS sono: candidosi bronco-polmonare e della trachea, candidosi dell'esofago in forma diffusa, forma invasiva di cancro della cervice uterina, coccidioidomicosi disseminata o extrapolmonare, criptosporidiasi intestinale cronica, malattia da Cytomegalovirus (non a localizzazione epatica, splenica o linfonodale), retinite da Cytomegalovirus con perdita della vista, encefalopatia HIV correlata, Herpes simplex (ulcera cronica, esofagite o broncopolmonite), istoplasmosi disseminata o extrapolmonare, isosporiasi intestinale cronica, sarcoma di Kaposi, linfoma di Burkitt, linfoma immunoblastico, linfoma cerebrale primitivo, infezione da Mycobacterium avium o da Mycobacterium kansasii disseminata o extrapolmonare, Mycobacterium tuberculosis in qualsivoglia sede, forme di infezioni disseminate da specie di Mycobacterium, polmonite da Pneumocystis carinii, polmoniti ricorrenti, leucoencefalopatia multifocale progressiva, sepsi a carattere ricorrente da Salmonella, toxoplasmosi cerebrale, wasting syndrome HIV correlata (quadro di grave cachessia).
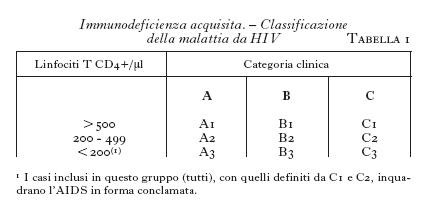
Sempre alla fine del 1993, nella nuova revisione del sistema classificatorio della storia naturale della malattia da HIV furono introdotte dai CDC tre condizioni, che precedentemente non erano state incluse nel gruppo C (tubercolosi polmonare, polmonite a carattere ricorrente, cancro cervicale invasivo), e per la prima volta venne inserita una condizione discriminante di laboratorio (numero di linfociti T CD4+/μl inferiore a 200 o inferiore al 14% del numero totale dei linfociti circolanti). Questi criteri di revisione vennero adottati per individui di età maggiore o eguale a 13 anni. In particolare, nell'inquadrare la nuova definizione di caso i CDC proposero uno schema che mette in relazione il numero dei linfociti T CD4+ e le singole categorie cliniche A, B, C (tab. 1).
Dati epidemiologici
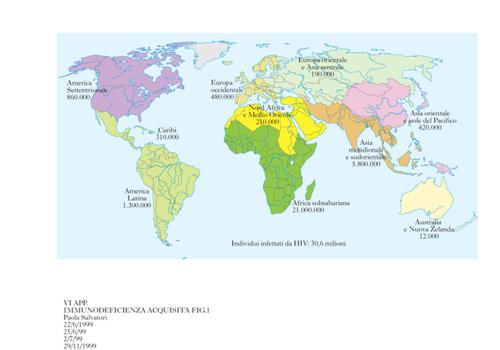
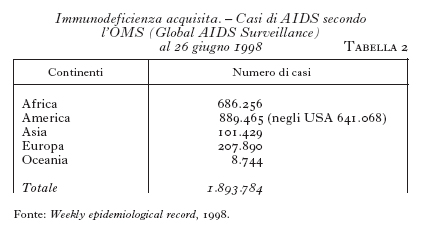
Il sistema di sorveglianza mondiale (Global AIDS Surveillance) fornisce periodicamente i dati sulla diffusione dei casi di AIDS nei vari paesi, consentendo l'elaborazione di un quadro sufficientemente realistico del numero dei pazienti colpiti e della loro distribuzione geografica. Nel Weekly epidemiological record del 26 giugno 1998 la situazione della pandemia viene così riassunta al giugno 1998 (fig. 1): 30,6 milioni di individui in vita con HIV/AIDS, di cui 5,8 milioni infettati ex novo nel 1997 (tra i quali 590.000 bambini). Il calcolo consente una stima di circa 16.000 nuove infezioni al giorno. Dal momento che i sistemi nazionali di sorveglianza per l'infezione da HIV variano da nazione a nazione in rapporto al livello dell'organizzazione sanitaria, della disponibilità economica e della capacità di un'adeguata elaborazione dei dati, mentre si ritiene che gli Stati economicamente avanzati siano in grado di fornire il numero dei casi di AIDS in forma conclamata, per altre aree geografiche esiste verosimilmente una forte sottostima dei valori inviati al sistema di Global AIDS Surveillance dell'Organizzazione mondiale della sanità. Nella tab. 2 sono riportate le cifre fornite per continente.
Alcune caratteristiche regionali sono indicative dell'importanza della diffusione del virus in rapporto alla difficoltà del controllo dell'infezione e alla modesta disponibilità delle risorse necessarie a fronteggiare il grave problema. Per es., viene stimato che nell'Africa subsahariana vivano i due terzi degli individui con HIV/AIDS (con una prevalenza del 7,4% negli individui compresi fra i 15 e i 49 anni). La via di contagio più importante è quella eterosessuale. In Asia (Sud e Sud-Est) si stima una distribuzione di circa 6 milioni di soggetti con HIV/AIDS. Per quanto concerne l'America Latina, è di particolare interesse la forte crescita di casi in Brasile, soprattutto per via eterosessuale. In Europa occidentale si assiste a una relativa stabilità dei casi trasmessi per via omosessuale, o legati all'uso di droga con scambio di siringhe, mentre il fenomeno della diffusione del virus tra i tossicodipendenti con uso endovenoso di stupefacenti sembra in crescita nei paesi dell'Europa dell'Est. Negli Stati Uniti l'AIDS ha ucciso oltre 350.000 individui ed è la principale causa di morte nella fascia di età compresa tra i 24 e i 44 anni. L'introduzione di nuovi farmaci antivirali (oltre alla AZT) ha modificato, negli Stati economicamente avanzati dove è possibile l'impegno finanziario per una loro larga diffusione, la storia naturale della malattia da HIV e viene pertanto segnalato, a partire dal 1995, un minor numero di nuovi casi di AIDS quale conseguenza del ritardo della progressione del danno biologico in soggetti sieropositivi, che restano più a lungo asintomatici e comunque non acquisiscono clinicamente i caratteri della definizione di caso. In Italia esiste un sistema di sorveglianza nazionale dell'infezione da HIV che fa capo all'Istituto superiore di sanità. Periodicamente vengono effettuati i rilievi epidemiologici sull'andamento della malattia e sulla sua diffusione. I dati relativi al 1997 evidenziano un discreto rallentamento nell'epidemia, confermando gli indici di flessione già segnalati negli ultimi mesi del 1995. Anche per l'Italia, come per gli Stati Uniti, la Gran Bretagna e la Francia, il fenomeno si può interpretare in rapporto a un più esteso e razionale uso dei farmaci antivirali. I casi di AIDS segnalati al secondo trimestre 1998 in Italia sono 42.122 (circa il 70% degli individui è deceduto). Di notevole interesse è l'osservazione relativa al maggior incremento della casistica dei pazienti di sesso femminile, che superano il 20% delle segnalazioni. La via di trasmissione eterosessuale è in fase di crescita, con importanti implicazioni epidemiologiche per il rischio di trasmissione del virus alla prole in corso di gravidanza.
Struttura e replicazione del virus
Sono noti due virus HIV tra loro correlati, entrambi responsabili dell'AIDS (HIV-1 e HIV-2). HIV-2 differisce di poco da HIV-1 (per alcune sue caratteristiche, come il Vpx, e per essere meno aggressivo sotto il profilo patogenetico); per comodità espositiva in questo testo si usa l'acronimo HIV, se non altrimenti precisato (la maggior parte degli studi ha riguardato l'HIV-1; l'HIV-2 ha una particolare diffusione nell'Africa occidentale). Il genoma del virus HIV è stato mappato e include geni strutturali e di regolazione. Caratteristicamente l'HIV è un retrovirus (v. App. V), perché dotato di un enzima (transcrittasi inversa) in grado di trascrivere RNA virale in DNA. Nel genoma del virus si riconoscono alle estremità due sequenze definite LTR (Long Terminal Repeat); esse svolgono un'azione di promoter ed esercitano il ruolo di siti di combinazione verso la cellula ospite. Nell'ambito LTR si trova una componente (elemento TAR) che svolge un ruolo importante perché si lega con il prodotto del gene tat, capace di attivare i processi di trascrizione. I geni strutturali sono siglati come gag (codificano per le proteine del nucleocapside), pol (codificano per trascrittasi inversa, integrasi e proteasi) ed env (struttura del rivestimento virale con espressione delle molecole gp120 e gp41 necessarie alla fusione dell'HIV con la membrana della cellula bersaglio linfocita T CD4+). L'HIV presenta una struttura icosaedrica caratterizzata da 72 estroflessioni esterne che rappresentano le due maggiori glicoproteine virali (gp120 e gp41). Nella membrana esterna del virus sono anche presenti alcune proteine (antigeni di istocompatibilità) che la particella acquisisce durante la fase di gemmazione attraverso la struttura membranosa della cellula infettata. Il ciclo cellulare del virus ha inizio con l'adesione delle particelle virali al recettore specifico rappresentato dalla molecola nota come CD4, propria dei linfociti T ad azione adiuvante (T helper). La struttura dell'HIV che si combina con il recettore è la molecola gp120, il cui processo di fusione è completato dall'ausilio della gp41. Sono conosciuti vari sottotipi dell'HIV-1: ciascuno di essi è stato isolato da individui provenienti da ben definite regioni geografiche, evidenziando come la diffusione per un determinato genotipo sia caratteristica per ciascun focolaio noto dell'epidemia. L'HIV-1 è coltivato facilmente utilizzando colture di tessuti, e la maggior parte dei ceppi isolati risulta patogena per l'uomo. Tuttavia, la particolare aggressività di un ceppo non è correlata, in generale, con la supposta origine geografica. L'infezione della cellula bersaglio implica due possibili evoluzioni: a) integrazione genomica; b) produzione di nuove particelle virali.
Interazione tra HIV e sistema immunitario
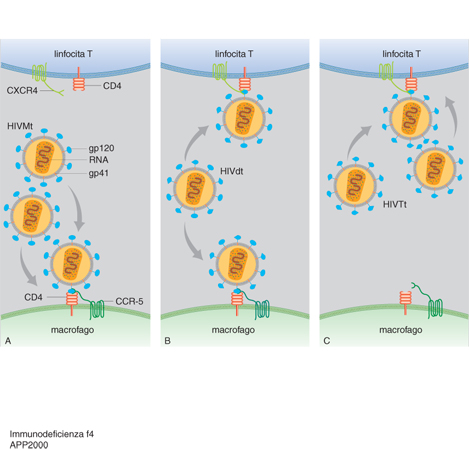
Il virus HIV, a differenza di quanto riscontrato per altri retrovirus in animali e nell'uomo, non possiede una specifica funzione trasformante, ma esplica la sua patogenicità svolgendo un ruolo citopatico orientato verso le cellule che esprimono il recettore CD4 (T helper, fig. 2). Tuttavia, si deve ricordare come altre cellule del sistema monocito-macrofagico e del sistema nervoso centrale possano essere infettate dal virus. Nel corso degli anni Novanta, grazie ai progressi della biologia molecolare e a nuove acquisizioni sul significato di molecole regolatrici della risposta immunitaria (citochine), si è osservato che esistono altri recettori (co-recettori) che rendono possibile l'ingresso del virus all'interno della cellula bersaglio. In particolare, sono state studiate alcune proteine di membrana che appartengono alla famiglia dei recettori per le chemochine. Per es., si ricordano le ricerche che hanno dimostrato come, in certe condizioni di indagine, alcune molecole possano svolgere un ruolo inibitore sulla crescita del virus. Esperimenti sui macrofagi hanno messo in evidenza come chemochi-ne note in sigla come RANTES (Regulated on Activation Normal T Expressed and Secreted), MIP-1α e MIP-1β (MIP, Macrophage Inflammatory Protein) siano effettivamente in grado di limitare o bloccare la replicazione del virus; d'altro canto, osservazioni clinico-epidemiologiche hanno descritto un fenomeno apparentemente non spiegabile: l'esistenza di individui che, se esposti ripetutamente al virus, non si infettano (quasi avessero una protezione naturale). L'interpretazione di questo dato può collegarsi a un difetto o alterazione genetica, per cui alcuni soggetti non costruiscono in modo biologicamente adeguato proprio quei co-recettori del virus necessari all'ingresso dell'HIV dentro la cellula. Una di queste proteine (CCR-5) è il recettore per RANTES, MIP-1α e MIP-1β, ma anche il co-fattore facilitante l'ingresso del virus. In sostanza, potrebbe verificarsi la condizione per cui la CCR-5 alterata (o addirittura assente) non consente al virus di penetrare la cellula attraverso il citoplasma, anche se la particella è combinata con l'altro recettore chiave conosciuto come CD4. Il problema ha importanti risvolti pratici, e la sua corretta interpretazione giustifica sia l'esistenza di una qualche forma di refrattarietà all'HIV, sia l'andamento clinico di individui che hanno, dopo il contagio, una diversa storia naturale dell'infezione (slow progressors e rapid progressors). Il gene che codifica per il recettore CCR-5 determina, in sostanza, la resistenza al virus HIV o la permissività alla penetrazione intracitoplasmatica. Analisi di popolazione e studi su materiale genetico hanno dimostrato che i soggetti con alleli normali per CCR-5 collocano la molecola correttamente sulla membrana dei macrofagi, per cui il virus si fissa sia al CD4 (anch'esso dislocato sulla membrana) sia al CCR-5 (fig. 3). Se il gene per CCR-5 subisce una mutazione (la cosiddetta variante corta) viene meno il secondo punto di ancoraggio della particella che, nella maggior parte dei casi, non riesce così a penetrare all'interno del macrofago. D'altro canto, sui linfociti T è stato isolato un altro recettore per chemochine (in sigla CXCR4) che ha diversa specificità rispetto alle molecole di RANTES, MIP-1α e MIP-1β e che rappresenta una struttura di ancoraggio per particolari ceppi di virus HIV-1. Questi, alla luce dei fenomeni descritti, possono pertanto essere distinti in M-tropici (preferenzialmente invasori dei macrofagi), che legano la gp120 sia al CD4 che al CCR-5, e in T-tropici, che aggrediscono con più facilità i linfociti T (legame a CD4 e CXCR4).
In pratica, nel corso dell'interazione tra sistema immunitario e virus si osserva una prima fase dell'infezione, nella quale il virus è preferenzialmente M-tropico e aggredisce il monocita-macrofago. A questo tempo iniziale segue una fase nella quale l'HIV-1 tende a esprimere gp120 modificate, che si legano ai recettori CD4 e CCR-5 sul macrofago, ma possono anche combinarsi con il recettore CXCR4 espresso sul linfocita T. In un terzo tempo, che può essere definito come fase tardiva, il virus M-tropico si è del tutto trasformato, acquisendo sulle gp120 caratteristiche di legame che si esprimono con affinità completa per il CXCR4 (HIV T-tropico puro), perdendo la possibile capacità di combinazione con il macrofago (fig. 4 A, B, C). In questo periodo della storia naturale dell'infezione si osserva una maggiore aggressività virale, con forte compromissione della risposta immunitaria e danno progressivo verso il deficit completo. L'osservazione che la protezione genetica poteva esercitarsi non solo nel prevenire il contagio (presenza di due geni mutanti del CCR-5), ma anche nel ritardare la progressione del danno cellulare (nei soggetti dotati di una sola copia mutante), ha dato origine a numerose linee di ricerca basate sull'ipotesi di un intervento biologico naturale, con impiego di chemochine, in grado di bloccare potenzialmente l'infettività del virus. Il problema non è però di facile soluzione: esistono infatti dati per cui anche soggetti omozigoti per il CCR-5 (variante corta del recettore) possono essere contagiati. Non è possibile escludere, pertanto, che esistano ceppi di virus che riescono, in qualche modo, a superare la barriera del recettore anomalo e/o che subiscono un salto biologico naturale M→T, aggredendo i linfociti senza il previsto periodo di evoluzione correlato alla presenza dell'HIV-1 nel macrofago. D'altro canto, esistono studi su pazienti emofilici, che dimostrano come, in alcuni di questi individui, una produzione elevata di chemochine sia in grado di impedire all'HIV-1 di agganciarsi alla superficie della cellula bersaglio, di penetrarla e quindi di scatenare l'infezione.
Il danno esercitato dall'HIV-1 sui vari bersagli dipende dunque dalle modalità con le quali si svolge l'interazione tra la particella virale e il bersaglio stesso 'selezionato'. Per es., la serie cellulare monocito-macrofagica, come abbiamo visto, non subisce una lesione citopatica molto marcata, rispetto a quanto si osserva per i linfociti T helper; tuttavia i macrofagi rappresentano una vera e propria riserva naturale del virus, che consente allo stesso di spostarsi in diversi distretti anatomici (penetrando, per es., anche all'interno del sistema nervoso centrale). Tra l'altro esistono dati che dimostrano come un altro recettore per chemochine, noto come CCR-3, possa facilitare l'ingresso dell' HIV-1 nelle cellule microgliali del cervello.
Altri aspetti importanti riguardano le cellule note come APC (Antigen Presenting Cell). Infatti, se l'infezione è acquisita, per es., a livello delle mucose, alcune particolari cellule, definite dendritiche (caratterizzate da numerosi processi citoplasmatici), possono dislocarsi in varie sedi (milza, linfonodi) ed esporre l'antigene virale in stretto contatto (fisico e funzionale) con le cellule T. In tal modo si facilita l'infezione di bersagli biologicamente selezionati. Un aspetto fondamentale nella patogenesi del danno immunitario deriva dall'incapacità dell'organismo di liberarsi definitivamente della particella infettante dopo l'ingresso del virus nel citoplasma e la sua integrazione genomica: questo status può esplicarsi variamente in termini biologici e clinici (infezione latente, evoluzione lenta, evoluzione rapida, riattivazione, disregolazione immunitaria), e non sono ancora del tutto chiariti i momenti critici che rendono possibile una determinata evoluzione del danno biologico in rapporto a condizioni (o all'esistenza di co-fattori) che assumono un significato scatenante in senso clinico. Senza dubbio, una delle caratteristiche favorevoli al virus è la sua variabilità antigenica: il sistema immunitario non può adeguarsi con efficacia a tale variabilità e, pertanto, la sua risposta finisce con il non essere mai realmente efficiente (per es., gli anticorpi anti-HIV sono prodotti dall'organismo sin dalle prime fasi del contagio, ma essi non sembrano esercitare un convincente ruolo protettivo durante l'infezione stessa). Analisi dei vari ceppi virali hanno messo in luce come esista una certa correlazione tra particelle meno virulente (fenotipo che si replica lentamente e tende a non formare sincizi tra cellule: slow-low) e una buona stabilità clinica del decorso, e come, al contrario, ceppi più aggressivi, talora derivati per mutazione dagli stessi ceppi slow-low, siano dotati di una maggiore forza patogenetica nell'indurre il danno cellulare (rapid-high). Sebbene siano stati proposti vari modelli in vitro e le osservazioni cliniche siano continuamente oggetto di costante attenzione, non sono ancora del tutto acquisiti i meccanismi patogenetici che inducono la perdita dei linfociti CD4. Un'ipotesi riguarda la possibile infezione di cellule midollari che fungono da precursori dei linfociti T CD4+, con forte limitazione dei processi rigenerativi. A questo meccanismo si affianca il ruolo di cellule T a funzione citotossica, in grado di colpire il virus dislocato sui CD4. Meno evidente, ma da non escludersi, un processo di attivazione anomala delle cellule infettate, che pertanto possono andare incontro alla lisi per meccanismi di apoptosi.
Diagnostica molecolare e monitoraggio del carico virale
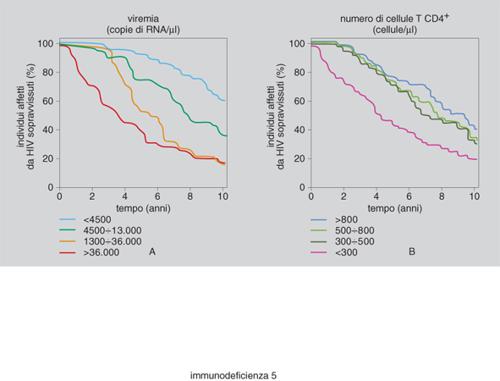
La diagnostica dell'infezione si basa sulla dimostrazione nel paziente contagiato di anticorpi antivirus (evidenziabili con metodiche immunoenzimatiche e con la tecnica del western blot, metodica biochimica di separazione per le proteine). Tuttavia i progressi della biotecnologia consentono di dimostrare il contagio delle cellule valutando anche l'integrazione del genoma virale nel patrimonio genetico della cellula infettata. Per questa indagine si applica la tecnica della PCR (Polymerase Chain Reaction) di tipo qualitativo. Nel corso degli anni Novanta, ulteriori progressi sono stati fatti grazie alla disponibilità di tecniche di laboratorio riproducibili che permettono di calcolare il numero delle copie di virus circolanti nel sangue (viral load). Essere in grado di valutare il danno cellulare (decremento dei linfociti T CD4+/μl) e di calcolare le particelle virali presenti nel sangue (carico virale) sono le condizioni che hanno fornito nuove e sostanziali possibilità di monitoraggio della malattia da HIV (fig. 5 A, B).
Un individuo infettato dal virus è in grado di produrre circa 10 miliardi di particelle ogni giorno, ed è stato calcolato come la metà delle stesse particelle virali venga sostituita in poche ore nell'arco della giornata. Miliardi di particelle virali vengono pertanto distrutte e riprodotte in un arco di tempo relativamente breve (ore), e questo implica un imponente impegno delle sottopopolazioni linfocitarie T CD4+. Pertanto l'uso di un test quantitativo che misuri HIV-RNA (acido nucleico del virus nel plasma) è diventato uno strumento essenziale, perché si possa inquadrare correttamente il paziente sieropositivo e si possa attuare un controllo della risposta individuale ai farmaci antivirali introdotti nei vari protocolli terapeutici, attuati per limitare l'azione citolesiva del virus. In tal senso l'approccio all'infezione da HIV nella seconda metà degli anni Novanta si è modificato sia per la disponibilità di nuove molecole farmacologicamente efficaci, sia per il controllo più diretto della risposta alla terapia che può attuarsi nel corso del trattamento. Questo dev'essere iniziato prima che il sistema immunitario vada incontro a un grave deterioramento e quando sono stati valutati con cognizione di causa (aspetti clinici e di laboratorio) i rischi della progressione al momento della diagnosi. L'entità della viremia plasmatica ha una buona correlazione con la fase replicativa del virus e ha assunto un vero significato prognostico. È possibile infatti, utilizzando opportuni modelli matematici, calcolare l'HIV-RNA in un dato momento della storia naturale dell'infezione e predire il margine di tempo necessario perché un individuo sieropositivo si ammali di AIDS in forma conclamata. I due parametri base di controllo, pertanto, sono il numero dei linfociti T CD4+ circolanti nel sangue periferico e il carico virale. Oltre ai linfociti T CD4+ un ruolo significativo è costituito dalla sottopopolazione dei T CD8+. I linfociti T CD8+ (citotossici/soppressori) aumentano nelle prime fasi dell'infezione e tendono a incrementarsi con la progressione della malattia. Lo stato di attivazione cellulare dei linfociti T CD8+ si può evidenziare utilizzando un altro anticorpo monoclonale (rispetto al CD8), in grado di riconoscere sulle cellule una molecola nota come CD38. Pertanto, un linfocita T CD8+CD38+ può fornire indicazioni sulla risposta immunitaria e, in particolare, l'aumento di questa frazione cellulare in soggetti non ancora sintomatici sembra avere un significato prognostico non favorevole.
Approccio terapeutico
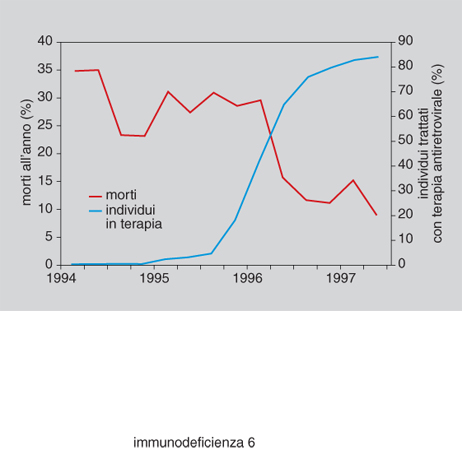
I progressi compiuti nel controllo della malattia da HIV sono stati numerosi e concettualmente rilevanti. In sintesi essi riguardano la messa a punto di una valida strategia antivirale e la migliore gestione farmacologica delle infezioni conseguenti allo stato di depressione immunitaria provocato dal virus. In particolare, dopo il 1995, grazie alla disponibilità di varie molecole antivirali in grado di agire su diverse fasi del ciclo di replicazione virale, e grazie alla disponibilità di metodiche di laboratorio con le quali è possibile seguire la risposta alla terapia (v. sopra), si è assistito a un sostanziale mutamento della prognosi (fig. 6). I farmaci antivirali dei quali si dispone sono distinti in: a) inibitori nucleosidici (NRTI, Nucleoside Reverse Transcriptase Inhibitor: zidovudina, didanosina, zalcitabina, stavudina, lamivudina); b) inibitori non-nucleosidici (NNRTI, Non Nucleoside Reverse Transcriptase Inhibitor: nevirapina, delavirdina, DMP-266); c) inibitori delle proteasi (PI, Protease Inhibitor: indinavir, ritonavir, nelfinavir, saquinavir). Mentre la disponibilità di un solo farmaco (AZT: zidovudina, esempio di NRTI), a partire dalla seconda metà degli anni Ottanta, aveva limiti oggettivi e non permetteva una strategia radicale contro il virus, la possibilità di integrare l'azione di due o più antivirali ha consentito di agire con maggiore efficacia sulla replicazione dell'HIV. Poiché le lesioni a carico del sistema linfatico sono legate alla costante replicazione del virus, è di fondamentale importanza un intervento idoneo a sopprimere nel modo più efficace possibile la moltiplicazione dell'HIV, rallentando l'andamento clinico conseguente al danno biologico e salvaguardando la capacità residua della risposta immunitaria. Pertanto, si è reso necessario un più accurato inquadramento della fase acuta dell'infezione (conseguente al contagio iniziale) e sono stati elaborati criteri di riferimento adeguati a stabilire il tempo di inizio del trattamento e le modalità del monitoraggio. I punti cardine sono: 1) valutazione del carico virale circolante nel sangue periferico (inteso come HIV-RNA); 2) calcolo del numero dei linfociti T CD4+ per unità di volume (μl); 3) stato clinico del paziente.
Per rendere omogenee le linee di una corretta procedura terapeutica, varie commissioni di esperti hanno elaborato modelli-guida, allo scopo di ottimizzare i tempi e i modi di somministrazione dei farmaci antivirali disponibili. Prendendo in considerazione i vari metodi di laboratorio, la 'viremia' plasmatica critica per l'inizio della somministrazione dei farmaci è di circa 5000÷10.000 copie/ml. Con valori più alti l'obbligo della terapia si impone anche se il paziente è in buone condizioni cliniche e i valori dei linfociti T CD4+ non risultano gravemente compromessi. Se il criterio di riferimento riguarda prevalentemente i linfociti T CD4+, i farmaci vanno somministrati quando la quota di cellule circolanti scende al di sotto dei 500/μl, con indicazione obbligatoria se il valore è minore di 300÷350/μl.
Poiché i farmaci antivirali non sono esenti da effetti indesiderati di varia natura (per es., calcolosi renale, tossicità per il fegato, disturbi gastroenterici) e la loro somministrazione richiede un costante rapporto tra medico e paziente, è necessario che il momento iniziale della terapia sia scelto con cognizione di causa, per es. ripetendo i controlli di laboratorio a breve distanza di tempo dalla prima valutazione, secondo i protocolli terapeutici che sono internazionalmente adottati. In generale, quando un paziente viene incluso in terapia per la prima volta, è opportuno utilizzare una triplice associazione di farmaci (per es., un inibitore della proteasi con due farmaci NRTI). È possibile anche l'associazione tra due farmaci NRTI e uno NNRTI, sebbene esista una minore esperienza clinica acquisita. D'altro canto, l'uso di un solo farmaco non è più assolutamente ammesso, per la facilità con la quale possono insorgere resistenze virali, e anche l'impiego di due soli antivirali dev'essere limitato a particolari condizioni di risposta individuale al trattamento.
Più complesso appare il problema quando si tratta di decidere il comportamento terapeutico in individui che hanno fatto già uso di antivirali. In tal caso dovrebbero essere sostituiti almeno due prodotti, e sarebbe opportuno individuare la caratteristica mutazionale del virus che si è accompagnata all'insorgere della resistenza. La rivoluzione del trattamento antivirale si è verificata tra la fine del 1995 e l'inizio del 1996. I risultati sono stati senza dubbio incoraggianti e si sono consolidati nel corso del 1997 e 1998. Restano aperti i problemi sulla durata della terapia e sulla necessità di utilizzare (e quindi progettare) nuove molecole, in grado di sostituire quelle già disponibili per il momento di comparsa della resistenza al trattamento originalmente impostato, a causa delle mutazioni del virus. Poiché la terapia antivirale ha lo scopo di sopprimere il virus prima che si abbia un'irreversibilità del danno immunitario, l'adozione del trattamento (vera e propria polichemioterapia) viene classificata come HAART (Highly Active Antiretroviral Therapy). Esistono alcuni problemi sulla valutazione della HAART: quando considerare realmente significativo il decremento delle copie virali? Si ammette che un decremento attorno alle 200÷300 copie sia accettabile; tuttavia un accordo generale non è ancora definito. D'altro canto, quando si è stabilita una terapia antiretrovirale efficace, si può osservare una ripresa del numero dei linfociti T CD4+. In particolare, nella prima fase della ripresa crescono i CD45RO+ (cosiddetti linfociti-memoria), probabilmente perché vengono liberati dal complesso dei tessuti linfatici nei quali si annidavano; in un secondo tempo aumentano i linfociti CD4+, classificati come funzionalmente naïfs. È probabile che proprio la terapia antivirale eserciti un ruolo nella dinamica della ricostituzione del patrimonio immunologico del paziente in trattamento, rendendo necessaria l'adozione di un approccio immunoterapico che abbia lo scopo di integrare la stessa terapia antiretrovirale. Recentemente alcuni ricercatori hanno dimostrato che dopo l'HAART è possibile una ricostituzione immunologica, anche se parziale, verso antigeni di richiamo. È sicuramente prematuro definire i concetti di una terapia modulante della risposta immunitaria in corso di malattia da HIV, tuttavia sono state proposte alcune interleuchine (IL-2, IL-10, IL-12), con lo scopo di agire su vari momenti della risposta immunitaria, che risultano potenzialmente in grado di recuperare la funzione corretta del sistema. Per es., l'adozione di protocolli con IL-2 (molecola in grado di stimolare le funzioni dei linfociti T CD4+) sembra dimostrare come la risposta dipenda da un valore soglia, al di sotto del quale esisterebbe un punto di non ritorno per il ripristino della normalità.
Gli studi condotti sui vaccini anti-HIV, con finalità sia profilattiche sia terapeutiche (in soggetti che erano stati già infettati dal virus), non sembravano dare risultati soddisfacenti, almeno con il tipo di metodologia messo in atto in animali e nell'uomo. Tuttavia, nel corso del 1999, l'idea di un approccio vaccinale ha ripreso forza, grazie ad alcuni protocolli che hanno fornito interessanti risultati preliminari. Alcuni vaccini, infatti, che impiegano la proteina Tat sembrano avere efficacia protettiva in alcune scimmie.
bibliografia
Centers for Diseases Control and Prevention, 1993 revisited classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults, in Morbidity and mortality weekly report, 1993, pp. 1-19;
G. Pantaleo, C. Graziosi, A.S. Fauci, New concepts in the immunopathogenesis of human immunodeficiency virus infection, in New England journal of medicine, 1993, 328, pp. 327-35;
D.D. Ho, A.U. Neumann, A.S. Perelson et al., Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection, in Nature, 1995, 373, pp. 123-26;
T.C. Quinn, Global burden of HIV pandemic, in Lancet, 1996, 348, pp. 99-106;
G.M. Shearer, M. Clerici, Protective immunity against HIV infection: has nature done the experiment for us?, in Immunology today, 1996, pp. 21-24;
C.C.J. Carpenter, M.A. Fischl, S.M. Hammer et al., Antiretroviral therapy for HIV infection in 1997 updated recommendations of the International AIDS society, in The journal of the American medical association, 1997, 227, pp. 1962-69;
E. Essex, Origin of acquired immunodeficiency syndrome, in V.T. De Vita, S. Hellman, S.A. Rosenberg, AIDS: etiology, diagnosis, treatment and prevention, Philadelphia 1997, pp. 3-14;
First international meeting of the Italian study on acute HIV infection (Primary HIV infection from pathogenesis to treatment), in Journal of biological regulators and homeostatic agents, 1997, 11 (nr. monografico);
S.J. O' Brien, M. Dean, In cerca dei geni della resistenza all'AIDS, in Le Scienze (ed. it. di Scientific American), 1997, 351, pp. 38-47;
T.C. Quinn, Acute primary HIV infection, in The journal of the American medical association, 1997, 278, pp 58-62; AIDS research 1998 (Special report), in Science, 1998, 280, pp. 1855-97;
ANLAIDS, Atti dell'XI Convegno nazionale AIDS e sindromi correlate, Pisa 13-15 nov. 1997, in Notiziario dell'Istituto superiore di sanità, 1998, pp. 1-8;
Global AIDS Surveillance (OMS), Weekly epidemiological record, 1997, 48, pp. 357-64;
Global AIDS Surveillance (OMS), Weekly epidemiological record, 1998, 26, pp. 193-96;
Speciale AIDS, in Le Scienze (ed. it. di Scientific American), 1998, 361, pp. 76-109.