INGEGNERIA BIOMEDICA
Ingegneria biomedica
Con i. b. si intende quel settore dell'ingegneria che utilizza le metodiche e le tecnologie proprie dell'ingegneria per la cura del paziente e per il controllo delle malattie; rientrano pertanto nel campo d'applicazione dell'i. b. gli strumenti diagnostici, le protesi, gli organi artificiali, e, in senso lato, tutte le apparecchiature d'interesse medico per il supporto alla vita. Più in generale, le attività dell'i. b. sono strettamente connesse con la medicina e comportano una stretta collaborazione fra ingegneri e medici.
L'applicazione dell'ingegneria alla medicina inizia alla fine della Seconda guerra mondiale grazie ai progressi conseguiti nell'ambito della tecnologia bellica; la strumentazione utilizzata viene progettata da ingegneri e acquisisce la specificità di strumentazione biomedica per diagnosi e terapia, e l'indagine sui processi biologici viene effettuata con l'aiuto della tecnologia. Nasce in questo periodo la bioingegneria il cui campo di applicazione si estende, nel corso del tempo, dalla realizzazione di protesi e di organi artificiali allo studio dei biomateriali con particolare attenzione ai problemi di biocompatibilità, dall'elaborazione dei segnali biomedici (cardiologia, elettroencefalografia, potenziali evocati) all'elaborazione delle immagini della radiologia, dell'ecografia, della medicina nucleare (bioimmagini), alle applicazioni dell'informatica, alla diagnostica, alla telemedicina, e, da ultimo, all'introduzione della robotica in campo chirurgico (v. anche fisica medica, in questa Appendice).
A partire dagli anni Settanta, comincia a manifestarsi il problema della razionale utilizzazione delle apparecchiature biomediche, inteso come problema di manutenzione, di gestione all'interno dell'ospedale, di economia, e, soprattutto, di sicurezza. Il numero e la complessità delle apparecchiature utilizzate diventa tale da implicare il rischio di malfunzionamenti e con esso la possibilità di arrecare danni gravi e irreparabili ai pazienti; nasce quindi una nuova figura professionale, quella di un ingegnere, con ampie conoscenze tecnologiche, che opera all'interno dell'ospedale per affrontare le responsabilità correlate alla sicurezza, al training, alla valutazione dei costi. Si assiste pertanto allo sviluppo dell'ingegneria clinica (v. oltre), che si occupa della gestione delle apparecchiature biomediche in ambiente clinico, cioè a contatto con il paziente, allo scopo di garantirne la sicurezza e l'efficienza.
I temi di interesse dell'i. b. sono molteplici e sono stati trattati in diverse voci dell'Enciclopedia Italiana e delle successive Appendici. Si ricordano di seguito le voci ritenute più significative al riguardo. Nella voce bioingegneria (App. IV, i, p. 286; V, i, p. 375), vengono definiti i campi di interesse più tradizionali della disciplina (elaborazione di segnali, protesi, organi artificiali ecc.), e si accenna alla gestione delle apparecchiature biomediche entrando sia pur brevemente nel campo dell'ingegneria clinica. Campi più innovativi della disciplina sono specificamente trattati nell'App. V alle voci informatica medica (ii, p. 709), che verte sulla diagnosi assistita e sull'elaborazione dei segnali biologici, e telemedicina (v, p. 425), sull'assistenza medica a distanza. Per quanto riguarda la strumentazione biomedica per diagnosi, terapia, riabilitazione, si può fare anzitutto riferimento a voci specifiche, ma anche a voci di carattere medico. I principi dell'elettrocardiografia sono già presenti nel vol. XIII (p. 721) e nell'App. II (i, p. 834). L'elettroencefalografia viene introdotta nell'App. II (i, p. 837), e ampiamente ripresa nell'App. V (ii, p. 69). Sempre nell'App. V (iii, p. 285) viene introdotta la magnetoencefalografia. Nella voce raggi X e raggi γ (XXVIII, p. 746) viene presentata la radiologia medica sia per gli aspetti diagnostici, sia per quelli terapeutici; l'argomento è ripreso nell'App. II (ii, p. 662) e in radiologia medica nelle App. III (ii, p. 566), IV (iii, p. 139) e V (iv, p. 392); è così possibile seguire l'evoluzione di questo settore, dalla risonanza magnetica nucleare (RMN) fino alle più innovative realizzazioni digitali, come la tomografia computerizzata (TAC). Sempre nel campo della diagnostica per immagini, i principi dell'ecografia, sia per quanto riguarda la visualizzazione interna di organi, sia per quanto riguarda le applicazioni dinamiche mediante effetto Doppler, sono presentati nella voce ultrasuoni: Applicazioni tecnologiche degli ultrasuoni (App. IV, iii, p. 713); gli ulteriori sviluppi sono illustrati nella voce ecografia dell'App. V (ii, p. 6). Di una diversa tecnica diagnostica e terapeutica, l'endoscopia, si parla già nel vol. XIII (p. 961), ma, come dimostra l'aggiornamento alla stessa voce nell'App. V (ii, p. 109), è solo con l'introduzione dell'endoscopio flessibile (fibroscopio) e della videoendoscopia che tale tecnica rivela tutte le sue potenzialità.
Per quanto riguarda particolari apparecchiature, come, per es., la macchina cuore-polmone per circolazione extra-corporea e il rene artificiale, si rinvia alle voci di carattere medico nell'App. IV e V. Nella voce terapia intensiva e rianimazione (App. V, v, p. 456), infine, vengono trattati gli aspetti del monitoraggio (controlli cardiografici, dell'attività respiratoria ecc.) e della terapia (respirazione assistita, defibrillazione ecc.). *
Bioingegneria
di Serenella Salinari
Informatica medica
Lo sviluppo dell'informatica, sia grazie alla possibilità di utilizzare mezzi di calcolo sempre più potenti e di basso costo, sia grazie allo sviluppo di nuove metodologie, per es. nell'ambito dell'intelligenza artificiale, ha avuto notevoli ricadute nel settore dell'ingegneria biomedica. La prima utilizzazione dei mezzi informatici si è avuta in applicazioni gestionali e organizzative, che possono riguardare sia l'intero sistema sanitario nazionale sia il singolo ospedale, o ancora, reparti specifici in ambito ospedaliero, quali tipicamente il laboratorio di analisi cliniche e le unità di terapia intensiva. Nell'ambito delle applicazioni diagnostiche, speciale rilievo hanno avuto l'utilizzazione di metodi automatici per l'identificazione di particolari caratteristiche in immagini biomediche (per es. in immagini radiografiche) e l'impiego delle metodiche e tecniche di intelligenza artificiale nello sviluppo di sistemi automatici di ausilio alla diagnosi.
I sistemi di gestione sanitaria vengono utilizzati, ai vari livelli, per immettere, memorizzare, elaborare e restituire informazioni in modo automatico. I principali vantaggi di un tale sistema risiedono nella velocità con cui l'informazione può essere immessa e successivamente restituita.
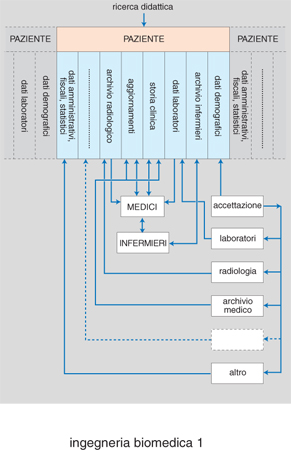
Per es., una grande istituzione, come un organismo nazionale di controllo e gestione della sanità o un ospedale, può conservare centralmente alcune informazioni, in modo che si possa accedere a esse da parte di più di un utilizzatore, evitando ridondanza e possibili inconsistenze. Contemporaneamente file dedicati, di interesse di un solo utente, possono essere conservati localmente in specifiche aree di memoria. Come esempio (fig. 1), una tipica base di dati in un contesto ospedaliero può includere informazioni personali e/o demografiche, informazioni provenienti da vari reparti ospedalieri (come laboratori clinici e radiologici, servizi centrali, servizi amministrativi ecc.). Tutte queste informazioni debbono poter essere immesse, registrate, richiamate ed eventualmente cancellate dall'utilizzatore. Il sistema deve quindi essere in grado di rilevare in modo automatico l'eventuale ripetizione di qualche dato, segnalare e/o correggere errori nell'immissione dei dati ed errori logici, identificare correttamente le successive modifiche alla base di dati e dedurre automaticamente ulteriori informazioni ricavabili da quelle disponibili. Inoltre, la base di dati non deve essere influenzata dal tipo di programma applicativo utilizzatore, dal numero degli utenti e dalle metodologie e dai dispositivi di accesso. Un sistema di questo tipo può garantire l'integrità dei dati, la consistenza e la sicurezza molto più dei tradizionali sistemi manuali.
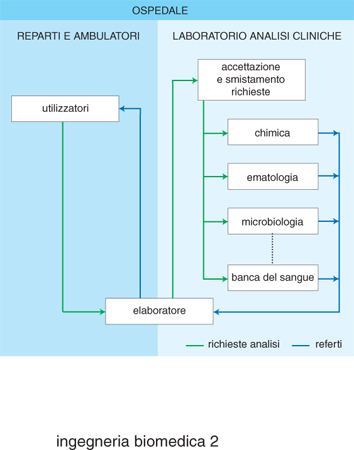
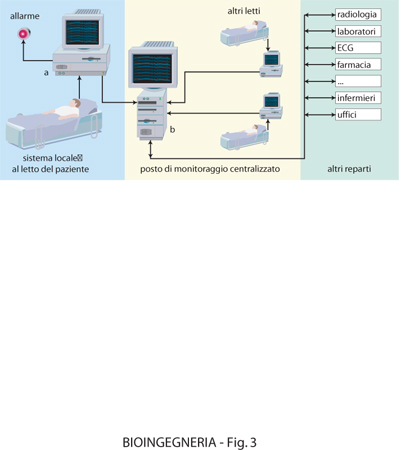
A livello dell'automazione di singole unità operative all'interno dell'ospedale, i reparti che per primi hanno utilizzato strumenti e metodologie informatiche, con conseguente elevato livello di automazione, sono i laboratori di analisi cliniche e i reparti di terapia intensiva. In entrambi i casi il sistema di automazione consta di una parte relativa alla gestione e al controllo di apparecchiature di misura e di una parte relativa allo scambio di informazioni con altri reparti ospedalieri. Nel caso del laboratorio di analisi cliniche, un elaboratore locale, oltre a effettuare le procedure di controllo di qualità, relative alla strumentazione presente in tali laboratori, può provvedere alla generazione automatica e all'aggiornamento di una base di dati contenente le descrizioni dei vari test, i valori e gli intervalli di normalità, le unità di misura, gli aggiustamenti in funzione dell'età, del sesso ecc., nonché provvedere a elaborazioni statistiche su base giornaliera, mensile o annuale, per sezione del laboratorio e tipo di paziente. L'elaboratore locale può essere interfacciato con un elaboratore centralizzato, in modo da ricevere le richieste degli esami clinici dagli altri reparti, elaborare la relativa lista di attesa, gestire le urgenze e provvedere all'invio dei risultati degli esami stessi, una volta effettuati (fig. 2). I sistemi di monitoraggio ospedaliero consistono, a loro volta, di un insieme di strumenti di misura (informazioni rilevate in un'unità di terapia intensiva possono essere elettrocardiogramma e frequenza cardiaca, forma d'onda pressoria e pressione sistolica, diastolica e media, gittata cardiaca, temperatura corporea, presenza di aritmie per pazienti cardiopatici ecc.). L'insieme di tali misure è gestito da un'unità posta accanto al letto del paziente (microelaboratore). Ogni unità è connessa a un elaboratore o controllore centrale (fig. 3) che tipicamente supervisiona da sei a otto unità contemporaneamente; tale controllore interroga l'unità posta al letto del paziente a opportuni intervalli di tempo e trasmette le informazioni a un posto centrale di sorveglianza e anche a una o più unità dello stesso reparto, in maniera che un'infermiera che si trovi al letto di un paziente possa ricevere informazioni anche dagli altri letti e un'infermiera all'unità centrale possa monitorare tutte le unità. Nel caso in cui si richieda il monitoraggio di particolari caratteristiche, come, per es., della presenza di aritmie, questo può essere effettuato centralmente per un certo numero di pazienti, l'elettrocardiogramma dei quali viene rilevato in modo continuo e analizzato tramite algoritmi di riconoscimento e classificazione. Le uscite del sistema consistono in un certo numero di allarmi e in sistemi di restituzione di tipo video e grafico.
Una prima applicazione di metodi automatici alla diagnostica ha riguardato la localizzazione e l'identificazione automatica di caratteristiche anomale in immagini, in modo da evidenziare e discriminare fra differenti patologie. I principali passi implicati in tale processo consistono generalmente nella digitalizzazione dell'immagine, qualora questa non sia già disponibile in questa forma, e nella pre-elaborazione dei dati, consistente in processi di normalizzazione e filtraggio. A questi passi preliminari fanno seguito l'estrazione delle caratteristiche, cioè la misura di proprietà locali dell'immagine, la segmentazione, che riguarda la suddivisione dell'immagine in sottoregioni significative di proprietà omogenee, e infine la classificazione, cioè l'assegnazione dell'immagine alla più probabile interpretazione. Questa sequenza può ovviamente essere modificata omettendo o ripetendo alcuni dei passi. Per es., una semplice caratteristica come il valore medio locale di grigio può dare luogo a una prima segmentazione dell'immagine in due regioni: lo sfondo e il soggetto. Un insieme più definito di caratteristiche può successivamente essere applicato per suddividere ulteriormente le due regioni e così via.
Un secondo settore di applicazione dell'informatica alla diagnostica riguarda l'implementazione di sistemi esperti (cioè sistemi capaci di funzionare come un individuo esperto nella soluzione di problemi complessi), per applicazioni biomediche. Infatti la natura del procedimento diagnostico e della pianificazione della terapia, che implica la combinazione di un gran numero di aspetti non tutti completamente evidenti, rende l'area biomedica una scelta naturale per l'applicazione di tali sistemi.
Lo sviluppo di un sistema esperto si articola in un certo numero di passi successivi consistenti in: a) la definizione del dominio, cioè la definizione del problema da risolvere e dei limiti entro i quali deve essere risolto; b) la strutturazione del sistema, comprendente la strutturazione degli ingressi (per es. la riduzione dei dati di ingresso), la strutturazione della base di conoscenza (fig. 4), cioè la scelta del modo di rappresentare la conoscenza relativamente al problema diagnostico che viene affrontato (questa può realizzarsi per 'regole di produzione', ovvero per accertamento e verifica successiva di ipotesi, oppure, come nel caso di fig. 4, per frame, ovvero per settori di conoscenza comprendenti contemporaneamente ipotesi e regole di valutazione), la scelta del motore inferenziale, cioè del programma di controllo responsabile dell'applicazione della base di conoscenza e della soluzione dei conflitti, e infine la strutturazione del sistema di uscita in modo tale che la presentazione dell'informazione all'utilizzatore sia effettuata in modo analogo a quello che si verificherebbe se il problema fosse stato analizzato da un individuo esperto; c) la validazione della base di conoscenza e i test sul sistema.
L'applicazione di sistemi esperti in medicina si è rivelata importante non solo come ausilio alla diagnosi, ma anche nell'importante settore dell'educazione, in cui il sistema esperto può costituire un utile strumento di esercitazione per allievi medici e chirurghi.
Telemedicina
Tale tecnica, nata alla fine degli anni Sessanta negli Stati Uniti, riguarda le particolari applicazioni della telematica - cioè l'utilizzazione di sistemi integrati di reti di comunicazione (telefoniche, radio o via satellite) ed elaboratori - alla medicina, e ha raggiunto rapidamente una notevole efficienza e affidabilità, grazie all'impulso ricevuto durante il periodo delle ricerche spaziali. Attualmente i servizi offerti dalla telemedicina riguardano, oltre alle tradizionali applicazioni in campo spaziale, l'assistenza a distanza, il telemonitoraggio ospedaliero, domiciliare e ambientale, le applicazioni per la terapia a distanza (per es. la teledialisi), i servizi per aree isolate a bassa densità di popolazione, quali isole e/o comunità montane, i servizi mobili per aree di intervento periodico od occasionale, quali stadi, aree turistiche, posti di lavoro ecc., nonché per la medicina delle emergenze e dei disastri. Un ulteriore settore di applicazione delle tecniche della telemedicina è la telechirurgia. In questo caso il chirurgo, con l'ausilio di un monitor che gli permette l'osservazione continua del campo operatorio, esegue le varie manovre dell'intervento che, trasmesse a distanza, possono essere ripetute sul paziente con l'ausilio di strumenti controllati anch'essi a distanza. Tuttavia, la sperimentazione clinica di tale tecnica è, allo stato attuale, praticamente inesistente anche se promettenti prospettive si possono aprire con lo sviluppo delle tecnologie della robotica chirurgica e della realtà virtuale. Comunque, anche quando tutti i problemi tecnici fossero risolti, la telechirurgia appare limitata a particolari settori di intervento, quali quello militare e spaziale.
La telemedicina riguarda anche l'integrazione di servizi e organizzazione, come, per es., il sistema informativo sanitario, i laboratori di analisi, il registro tumori, i servizi bibliografici e didattici. Un notevole impulso in tal senso può essere fornito dall'utilizzazione delle grandi reti telematiche internazionali che possono rendere accessibili dati disponibili presso organizzazioni pubbliche, quali Ministeri della Sanità, OMS, ONU, università ecc.
All'impiego clinico di tale tecnica si è ultimamente affiancato anche un 'impiego didattico' sia con riferimento all'educazione di base di medici e chirurghi, sia per programmi di aggiornamento e di specializzazione. Per es., in Gran Bretagna il progetto INSURRECT (Interactive Surgical at Remote Centres Teaching), nato nel 1993 da una collaborazione fra sei università, è destinato all'addestramento in chirurgia per gli studenti del corso di laurea in medicina. Tale progetto prevede l'utilizzazione di avanzate tecnologie di telecomunicazione per l'insegnamento e l'apprendimento attraverso l'utilizzazione di sistemi di televisione interattiva, dal momento che la chirurgia è un'area in cui l'informazione visiva è fondamentale nel processo di apprendimento. Interessanti esperienze si sono avute sempre in Gran Bretagna nell'addestramento di personale infermieristico operante in zone rurali attraverso sistemi di videoconferenza. Programmi di tele-educazione per personale medico già laureato sono attualmente disponibili, come l'EuroTransMed in Europa e quello sviluppato presso la Mayo Clinic negli Stati Uniti (Minnesota). Tali programmi erano originariamente diffusi attraverso satellite ma, attualmente, la Mayo Clinic ha spostato la trasmissione della rete satellitare a quella terrestre per motivi di costo. In tale ambito, oltre ai progetti illustrati che utilizzano strumenti comuni ad altre discipline, lo sviluppo contemporaneo delle tecniche di realtà virtuale ha fatto sì che sia possibile realizzare una ricostruzione tridimensionale virtuale del corpo umano, su cui gli studenti di medicina possano, per es., apprendere l'anatomia o effettuare interventi chirurgici virtuali, verificandone i risultati in tempo reale. Tecniche di telemedicina possono permettere l'uso a distanza, e da parte di più utenti, di tali ausili che, allo stato attuale, hanno ancora costi di sviluppo molto elevati e non possono quindi essere direttamente disponibili in modo diffuso.
Le diverse applicazioni illustrate sono accomunate dall'utilizzazione di una linea di comunicazione, anche se differenze pur rilevanti si possono verificare fra un'applicazione e l'altra: differenze di tipo medico (tipo di esperienza medica richiesta), relative al tipo di informazione (per es. immagini, suoni ecc.) e, infine, di carattere tecnico (per es. grado di compressione che può essere tollerata senza perdita di informazione clinica). La base fondamentale della telemedicina risiede comunque nel sistema di trasmissione dell'informazione clinica da un luogo a un altro. Per es., il teleconsulto richiede sistemi di teleconferenza installati nel sito locale e remoto; la teleradiologia richiede un sistema che acquisisca immagini digitali e le trasmetta in un luogo diverso in cui possano essere visualizzate; la telepatologia necessita di un sistema che acquisisca immagini da un microscopio: in tutti i casi il sistema deve avere un'adeguata risoluzione e restituzione dei colori per trasmettere un'immagine soddisfacente.
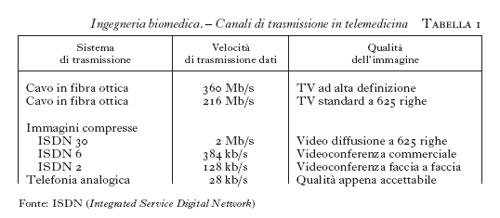
Poche tecniche standard sono state definite per la telemedicina: in teleradiologia l'ACR (American College of Radiology) ha fornito alcune indicazioni riguardanti la discretizzazione spaziale e la digitalizzazione dell'immagine, mentre è ammessa una minore qualità nel caso di teleconsulto. Questo tipo di specifiche, che variano a seconda del tipo di applicazione, unitamente alle esigenze di sicurezza e riservatezza dei dati, particolarmente importanti quando si tratti di diagnosi o terapie, hanno portato all'utilizzazione di differenti tipi di periferiche e di canali di trasmissioni (tab. 1). Così per la visualizzazione di immagini si va da sistemi digitali ad alta risoluzione, a video standard a 625 righe, fino a sistemi commerciali per videoconferenze. Analogamente la trasmissione dell'informazione può avvenire attraverso la normale rete telefonica fino all'utilizzazione di trasmissione in fibra ottica. In ogni caso la scelta del mezzo di trasmissione rappresenta sempre un compromesso fra i costi, la disponibilità del servizio e le esigenze di larghezza di banda e di affidabilità della trasmissione. In tale ottica si colloca l'utilizzazione della rete Internet che, per il suo basso costo e la sua diffusione, sarebbe un mezzo potenzialmente utilizzabile in telemedicina. Tuttavia, la lentezza nella trasmissione, dovuta alla ristretta banda a disposizione dell'utilizzatore, e la scarsa sicurezza limitano l'uso di tale mezzo prevalentemente ad applicazioni nell'ambito della ricerca.
La telemedicina e la teleassistenza possono senz'altro migliorare il servizio sanitario attraverso l'aumento degli accessi a servizi specializzati (per es. la teleradiologia può essere utilizzata per fornire un servizio di radiologia a ospedali periferici che non possono averne uno locale), l'incremento di rapidità dei referti, l'aumento della comunicazione fra i livelli di assistenza primaria e secondaria, il miglioramento e la diffusione dell'educazione e la riduzione dei costi. Rimane tuttavia ancora un problema aperto, quello della validazione di questa nuova tecnica, che risulta di una certa difficoltà a causa delle non semplici interazioni fra gli aspetti tecnici ed economici, dell'ancora esiguo numero di applicazioni e delle rapide variazioni della tecnologia.
Robotica chirurgica
La robotica chirurgica, che è un altro settore di recente sviluppo della bioingegneria, riguarda l'applicazione delle metodiche e delle tecniche della robotica alla chirurgia, con lo sviluppo di apparati di ausilio e/o di parziale sostituzione dell'opera del chirurgo. I primi campi di applicazione della robotica in chirurgia sono stati la microchirurgia, la chirurgia cerebrale, la radiochirurgia e la chirurgia ortopedica. È stata utilizzata inoltre per parti di intervento a elevata precisione, come in chirurgia stereotassica e, in particolare, in associazione al bisturi laser o per l'apposizione di chiodi, punti metallici ecc.
Il sistema utilizzato è costituito in generale dal robot propriamente detto, che viene guidato dal chirurgo, e non preventivamente programmato, come, per es., nelle catene di montaggio; in tali applicazioni, esso deve pertanto soddisfare specifiche particolarmente stringenti anche dal punto di vista della stessa costruzione meccanica. Il robot deve infatti presentare caratteristiche di maneggevolezza e leggerezza associate a un numero di gradi di libertà adeguato a rendere possibili movimenti di una certa complessità. Le grandezze che definiscono la posizione e l'orientamento dell'organo effettore del robot vanno definite con grande precisione; il robot deve infatti essere manovrato dal chirurgo in modo da ottenere un posizionamento il più accurato possibile di tale organo effettore, che può consistere in un dispositivo portautensile, specializzato a seconda dell'intervento che si deve effettuare (trapano, raggio laser ecc.). Al robot viene in generale associato un sistema di ricostruzione che permetta di mettere in relazione misure relative alla geometria della zona su cui deve essere effettuato l'intervento e immagini della zona stessa. In tal modo è possibile, tramite una rappresentazione tridimensionale della zona di operazione, simulare la posizione e la direzione di avanzamento dell'utensile così da definire esattamente la posizione in cui il robot deve portare il suo organo effettore e programmarne opportunamente i movimenti.
Un caso di particolare interesse è dato dalla radiochirurgia stereotassica, in cui un fascio di radiazioni viene utilizzato per distruggere una zona tumorale e il cui percorso è vincolato dalla necessità di non attraversare particolari strutture, quali il cervelletto, i nervi ottici ecc. In tal caso le misure relative alla posizione di un casco stereotassico posto sul cranio del paziente insieme a immagini tridimensionali quali lastre a risonanza magnetica, tomografie ecc. permettono di definire esattamente la posizione della zona tumorale e di pianificare i percorsi del fascio di radiazioni e, di conseguenza, i movimenti del robot che controlla la posizione della sorgente di radiazioni. Un'ulteriore, interessante evoluzione della robotica chirurgica è legata allo sviluppo delle tecniche di realtà virtuale e di telemedicina. In questo caso il chirurgo, indossando casco, guanti o altri dispositivi per realtà virtuale, potrà 'entrare' nella sala operatoria posta a distanza, ricevere stimoli sensoriali e operare tramite strumenti telecomandati agendo in modo naturale, come se operasse effettivamente. Medico e robot sono in tal caso dotati di sensori ed effettori che permettono di riprodurre fedelmente a distanza e in tempo reale sia stimoli sensoriali sia azioni: il chirurgo riceve dal robot informazioni reali (suoni, stimoli propriocettivi, immagini stereoscopiche tridimensionali) e quindi comanda direttamente a distanza il robot. Sistemi analoghi, utilizzati già da alcuni anni in Giappone, Stati Uniti e, recentemente, anche in Italia, che permettono una rappresentazione automatica della posizione degli strumenti chirurgici sul piano operatorio, possono essere utilizzati per la pianificazione di un intervento chirurgico: in pratica, si opera 'virtualmente' verificando traiettorie, posizioni dei vasi ecc. prima di effettuare interventi reali. A livello di ricerca, si è preconizzato il 'medico virtuale' che può essere consultato a distanza e compiere procedure chirurgiche su pazienti lontani tramite robot. Alcuni gruppi di ricerca lavorano inoltre su microrobot operatori, che possono essere controllati a distanza e raggiungere il campo d'azione attraverso i vasi sanguigni.
Biomateriali
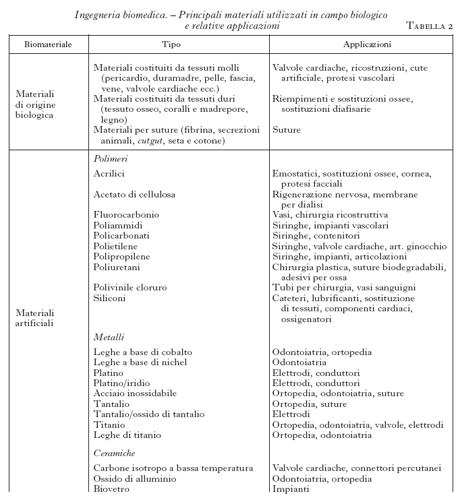
Il termine biomateriale (v. anche bioingegneria: Biomateriali, App. V) designa correntemente ogni sostanza o combinazione di sostanze, diversa da un farmaco, naturale o artificiale, che possa essere impiegata per un qualunque periodo di tempo, sola o come parte di un sistema che tratta, migliora o sostituisce un qualunque tessuto, organo o funzione del corpo. La scienza dei biomateriali riguarda quindi la produzione di nuovi materiali e la loro caratterizzazione fisico-chimica e meccanica. Per tale caratterizzazione è possibile, in generale, l'utilizzazione di metodiche e tecniche tradizionali. È necessaria anche una caratterizzazione biologica, da effettuarsi in vitro e in vivo, in modo da verificare se un dato materiale, già dotato di tutte le proprietà chimico-fisiche e meccaniche considerate, possa essere impiegato senza pericolo in applicazioni biomediche (v. anche fisica medica, in questa Appendice). Tale proprietà, definita come biocompatibilità, è la principale e peculiare caratteristica che devono presentare i biomateriali, in modo da poter sostituire in parte o in tutto un tessuto vivente senza che l'organismo in cui è inserito 'si accorga' della loro presenza. Lo sviluppo dei biomateriali ha seguito sostanzialmente quattro vie, spesso collegate fra loro: a) materiali di origine biologica, tipicamente di origine animale, che possono essere utilizzati, se provenienti da viventi, per trapianti di tessuti e organi, altrimenti, se opportunamente trattati, come materiali per protesi; b) materiali artificiali, sia sviluppati per altre applicazioni, sia appositamente progettati in modo da renderli più adatti alle condizioni in cui si troveranno a operare; c) materiali sintetici 'identici' a quelli naturali; d) rigenerazione per 'via naturale', su supporto sintetico o meno del tessuto danneggiato. Se il biomateriale di supporto si rivela biodegradabile, il risultato finale è quello di avere una parte perfettamente ricostruita senza nessuna traccia del materiale utilizzato. Nella tab. 2 sono elencati i principali materiali utilizzati in applicazioni biologiche.
Riguardo ai materiali di origine biologica, attualmente si sta sviluppando, accanto ai trapianti, l'utilizzazione di materiali di origine sia animale che umana, in strutture già organizzate o allo stadio molecolare. Questa utilizzazione si inserisce nell'ambito di una sempre maggiore ricerca di materiali di alta sofisticazione e biocompatibilità. I materiali biologici, in generale, non necessitano inoltre di tecnologie di ottenimento e fornitura particolarmente complesse e costose, per cui essi sono anche alla portata della piccola industria o del piccolo gruppo di ricerca. I materiali di questo tipo possono essere suddivisi in materiali costituiti da tessuti molli, da tessuti duri e materiali per suture. Per i primi l'utilizzazione principale si è avuta nel settore cardiovascolare per protesi valvolari e di vasi sanguigni. Naturalmente, prima dell'utilizzazione, debbono essere sottoposti a una serie di trattamenti che, distruggendo la componente deteriorabile del materiale, lo rendano immune all'attacco dei batteri.
I materiali costituiti da tessuti duri sono stati utilizzati prevalentemente in ortopedia, per riempimenti nel caso di difetti ossei o di asportazione di tumori. I principali requisiti richiesti riguardano le caratteristiche meccaniche, che debbono essere simili a quelle dell'osso e possedere un'alta compatibilità con l'osso stesso. Il primo materiale utilizzato è stato l'osso umano, prelevato da cadaveri, che, ovviamente, presenta caratteristiche ottimali dal punto di vista della biocompatibilità. Successivamente sono state utilizzate ossa provenienti da animali opportunamente trattate e, più recentemente, materiali diversi come frammenti di corallo e madrepore. Un altro campo in cui i materiali di origine biologica sembrano affermarsi è quello dei bioadesivi, data la non ottima biocompatibilità dei collanti artificiali. Fra questi il più interessante è la colla di fibrina, ottenuta per miscelazione del fibrinogeno umano con diversi reagenti (trombina, cloruro di calcio ecc.). Attraverso una reazione analoga a quella dell'organismo umano, si ha una produzione di fibrina che può essere utilizzata come un normale adesivo sintetico. Va tuttavia ricordato che l'utilizzazione di materiali di origine biologica, nonostante la non complessa tecnologia di ottenimento, rimane comunque confinata in un ambito relativamente ristretto di applicazioni, sia per i limiti intrinseci di tali materiali sia, nella maggioranza dei casi, per le difficoltà di approvvigionamento.
Un differente approccio è quello di utilizzare, per applicazioni biologiche, materiali artificiali che sono stati sviluppati per altri tipi di applicazioni, dopo averne verificate le caratteristiche di biocompatibilità. Fino a qualche anno fa, la scelta di un materiale per un organo artificiale veniva effettuata caratterizzando il materiale biologico dal punto di vista delle sue principali proprietà e utilizzazioni e, successivamente, scegliendo un materiale con proprietà simili o migliori. In tale contesto è stata identificata una serie di materiali che presentavano elevata biocompatibilità e proprietà meccaniche a volte addirittura superiori a quelle dei materiali biologici che dovevano sostituire. Attualmente i più comuni materiali artificiali sono costituiti da polimeri, materiali metallici e materiali ceramici.
I polimeri, che costituiscono un'importante e diversificata classe di biomateriali, sono sostanze macromolecolari le cui caratteristiche specifiche (resistenza, reattività chimica, degradabilità e biocompatibilità) possono essere modificate in dipendenza di un numero molto elevato di variabili fisico-chimiche, dando così origine a un numero praticamente infinito di materiali e a un'ampia varietà di applicazioni. Di particolare rilievo risultano le utilizzazioni di polimeri in oftalmologia, per la fabbricazione di lenti a contatto e di cornee artificiali e nella chirurgia del distacco della retina, e in ortopedia, per la realizzazione di cementi ossei e di protesi di tendini e legamenti. Più complessa è risultata l'utilizzazione di tali materiali nella realizzazione di protesi cardiovascolari o, in generale, di apparati che vengano a contatto con il sangue, in cui particolare attenzione va dedicata all'interfaccia polimero-sangue per evitare che si producano trombi dovuti a effetti anomali di coagulazione del sangue stesso. Altri importanti settori di applicazione dei polimeri si hanno nella realizzazione di membrane artificiali per ossigenatori e per dialisi e, in farmacologia, nella realizzazione di sistemi macromolecolari per il rilascio controllato di farmaci (materiali per capsule di rivestimento dei farmaci). Tale tipo di somministrazione ha costituito un importante progresso per la possibilità di mantenere concentrazioni ottimali di farmaco nel plasma senza apprezzabili fluttuazioni e di ridurre la necessità di somministrazioni ripetute. Naturalmente il materiale polimerico deve rispondere a requisiti di non tossicità, non cancerogenicità, incapacità di scatenare reazioni immunologiche, assenza di contaminanti. Nel caso di sistemi biodegradabili, i prodotti di degradazione debbono essere metabolizzati senza dar luogo a fenomeni tossici e ad accumulo di materiali esogeni in tessuti e organi. I materiali metallici sono fra quelli di più antica utilizzazione, legata alle prestazioni tipiche di tali materiali in ingegneria: essi forniscono infatti un soddisfacente compromesso fra caratteristiche meccaniche, lavorabilità e resistenza all'ambiente rispetto ai costi. Nell'applicazione più tipica, che è quella ortopedica, il materiale ha il compito di sostituire o integrare in modo permanente o temporaneo le funzioni di una struttura ossea. Deve quindi essere modellato nella forma prevista e posto nella posizione di lavoro, in cui si troverà a interagire sia dal punto di vista meccanico sia biologico con i tessuti circostanti. Sono quindi richieste buone caratteristiche meccaniche, facilità di lavorazione e biocompatibilità. Negli anni passati si è fatto ricorso a materiali tradizionali già sviluppati industrialmente, rispondenti ai primi due requisiti e resistenti alla corrosione, come gli acciai inossidabili, leghe a base di cobalto e titanio. Successivamente, il progredire delle ricerche ha favorito la progettazione di nuove leghe e il perfezionamento di quelle già esistenti, focalizzando l'interesse su quelle al titanio, su quelle a memoria di forma (leghe che riassumono la configurazione su cui sono state modellate), e sulle tecnologie di trattamento superficiale. Infine i materiali ceramici includono un vasto gruppo di materiali solidi non metallici con caratteristiche di alta resistenza alla compressione e relativa inerzia chimica. Fra questi, di particolare interesse risultano essere i carboni, che vengono usati nella costruzione di valvole cardiache e connettori percutanei per le loro proprietà antitrombogeniche, l'ossido di alluminio, utilizzato nelle protesi dentarie, i biovetri, che sono ceramiche attive, capaci di formare legami chimici diretti con i tessuti circostanti, e i vari fosfati di calcio ampiamente utilizzati in ortopedia per riempimenti di difetti ossei.
Per quanto riguarda i materiali di sintesi che siano identici a quelli naturali, va notato che allo stato attuale esistono materiali in grado di sostituire egregiamente i materiali naturali, a meno che non sia a essi richiesto di svolgere una qualche funzione biologica o di non modificare equilibri naturali. Ciò risulta particolarmente evidente quando si tratti di realizzare materiali che vengano a contatto con il sangue; infatti, mentre allo stato attuale è possibile realizzare arterie e vene artificiali che eguaglino o superino quelle naturali quanto a proprietà elastiche e di contenimento, è molto più difficile riprodurre le funzioni espletate dall'endotelio nel suo contatto con il sangue.
Un altro interessante esempio si ha per la cute artificiale. Infatti, mentre le caratteristiche passive della cute sono state adeguatamente riprodotte, per altre funzioni, come la capacità di rilevare variazioni di pressione o di temperatura, si è ancora lontani dalle caratteristiche naturali. In tale ambito, recentemente, sono stati condotti studi relativi all'impiego di polimeri piezo- e piroelettrici per realizzare sensori tattili distribuiti capaci di simulare macroscopicamente alcune caratteristiche della cute umana, così come si è studiata la possibilità di impiegare polielettroliti reticolati per la creazione di muscoli artificiali. Tali sostanze presentano infatti la caratteristica di contrarsi sviluppando forze qualora vengano stimolate elettricamente.
Infine, una possibile soluzione alla ricostruzione di parti od organi del corpo è quella della rigenerazione, consistente nell'utilizzare un supporto sul quale l'organismo stesso sia in grado di ricostruire la parte mancante. Come si è detto, se il biomateriale è biodegradabile, è possibile ottenere, dopo un certo periodo, la parte ricostruita identica all'originale senza più alcuna traccia del biomateriale stesso; in questo ambito esiste una vasta gamma di polimeri bioriassorbibili che hanno già trovato numerose applicazioni, come nei fili di sutura e nel rilascio graduale di farmaci.
Altre applicazioni, ancora in fase sperimentale, riguardano l'impiego di materiali di supporto biodegradabili e bioriassorbibili per la ricostruzione dell'intima di vasi sanguigni e, in ortopedia, di materiali che vengono riassorbiti nel tempo di consolidamento di una frattura. In neurologia sono stati utilizzati canali sintetici per guidare la ricrescita di nervi danneggiati. Un interessante esempio di ricostruzione è la cute artificiale sviluppata al Massachusetts Institute of Technology di Cambridge, costituita da una membrana suturabile formata da uno strato superiore di elastomero siliconico e uno inferiore biodegradabile consistente in un reticolo di collagene-glicosoamminoglicani (GAG) reticolati. Durante l'applicazione, lo strato di collagene-GAG viene riassorbito e sostituito da tessuto neodermico, mentre quello di silicone viene espulso con la formazione della nuova epidermide.
Si fa infine presente che in tab. 2 non compaiono indicazioni relative ai materiali di sintesi e a quelli ricostruiti tramite il meccanismo della rigenerazione, in quanto si tratta di materiali ancora soggetti allo studio e alla ricerca.
Organi artificiali
Per organo artificiale (v. anche bioingegneria: Organi artificiali, App. V) si intende ogni dispositivo, macchina o altro materiale che è usato per sostituire, parzialmente o totalmente, le funzioni di un organo danneggiato o perduto, o altre parti dell'organismo umano (quali apparecchiature di dialisi, ossigenatori a membrana, vari tipi di protesi ecc.). Particolare interesse è stato rivolto negli ultimi anni ai dispositivi che potessero sostituire, in modo permanente, o temporaneo, le funzioni cardiache, cioè verso il cuore artificiale.
I primi esperimenti relativi a un'apparecchiatura di questo tipo datano alla fine degli anni Sessanta, mentre i primi impianti su pazienti risalgono ai primi anni Ottanta (R.K. Jarvik; D.A. Cooley; W.C. De Vries). In particolare, il cuore artificiale Jarvik-7, impiantato su paziente per la prima volta nel 1981, consisteva in due ventricoli in poliuretano ed era azionato in modo pneumatico; non era richiesta ossigenazione, in quanto i polmoni del paziente non venivano bypassati. Il primo paziente sopravvisse 112 giorni e morì in conseguenza delle numerose complicazioni dovute all'impianto; la stessa sorte subirono i pazienti cui fu successivamente impiantato lo stesso dispositivo. Ciò portò alla deduzione che la tecnologia dell'epoca non fosse sufficientemente evoluta per consentire la realizzazione di un dispositivo affidabile e che potesse essere applicato per lunghi periodi. Per tali motivi il cuore artificiale è stato, in pratica, fino a tempi recenti, prevalentemente utilizzato quale mezzo di mantenimento in vita di pazienti in attesa di subire un intervento chirurgico e, quindi, sostanzialmente in ambito ospedaliero. Protesi cardiache totalmente impiantabili ad azionamento elettrico (cuore artificiale di seconda generazione) sono attualmente in fase di studio e sperimentazione in molti laboratori di ricerca. A titolo di esemplificazione, il cuore artificiale totalmente impiantabile, realizzato a Houston (Texas) presso il dipartimento di Chirurgia dall'équipe di M.E. De Bakey nel 1992, ha forma, dimensioni (diametro 97 mm, spessore 82 mm e un volume totale di 510 cm³) e massa (620 g), tali da consentire un buon adattamento anatomico. Il sistema di controllo, anch'esso impiantabile, è realizzato utilizzando la tecnologia VLSI (Very Large Scale Integration). L'energia è fornita per via transcutanea, attraverso due bobine, da batterie portatili con un'autonomia di 7÷8 ore e ricaricabili. Una batteria interna permette un'autonomia di 30÷40 minuti e può rimpiazzare la sorgente di energia esterna nel caso questa debba essere rimossa.
Negli ultimi anni, accanto alla ricerca relativa alla realizzazione di un cuore artificiale totalmente impiantabile, una seconda via di sperimentazione molto seguita è stata quella relativa alla realizzazione di dispositivi di assistenza, come il ventricolo artificiale, che trovano utilizzazione in patologie che investono un numero molto elevato di pazienti, quali l'infarto miocardico. Tali apparecchiature, che nella maggior parte dei casi sono esterne all'organismo, realizzano sostanzialmente un bypass parziale o totale del ventricolo sinistro, prelevando il sangue a livello atriale e reimmettendolo, successivamente, direttamente in aorta. La teoria alla base dell'utilizzazione di tali dispositivi è che essi permettono, nell'ambito di un'applicazione di alcuni giorni, un recupero del miocardio dal punto di vista della ricostituzione delle riserve energetiche perdute durante l'ischemia.
bibliografia
A. Rosenfeld, A.C. Kak, Digital picture processing, New York 1976, 1982².
J.B. Park, R.S. Lakes, Biomaterials. An introduction, London-New York 1979, 1992².
A.F. Krieg, Contempo '81. Computers in clinical laboratory. New problems and new solutions, in Journal of the American medical association, 1981, 245, pp. 2242-44.
A. Macovski, Medical imaging systems, Englewood Cliffs 1983.
A.R. Piergeorge, F.L. Cesarano, D.M. Casanova, Designing the critical care unit: a multidisciplinary approach, in Critical care medicine, 1983, pp. 541-45.
Biomateriali: dalla ricerca di base alla applicazione clinica, a cura di R. Fumero, P. Giusti, Bologna 1985.
Handbook of biomedical engineering, ed. J. Kline, New York 1988.
M. Stefanelli, Sistemi esperti in medicina: le metodologie, i progetti di ricerca e/o i prodotti commerciali, Roma 1988.
La strutturazione del sapere biomedico, a cura di C. Cobelli, M. Stefanelli, V. Tagliasco, Bologna 1988.
L.A. Geddes, L.E. Baker, Principles of applied biomedical instrumentation, New York 1989.
The artificial heart. Prototypes, policies and patients, ed. J.R. Hogness, M. Van Antwerp, Washington 1991.
F.H. Silver, Biomaterials, medical devices and tissue engineering: an integrate approach, London 1994.
Biomaterial science: an introduction to materials in medicine, ed. B.D. Ratner, A.S. Hoffman et al., San Diego 1996.
Medicine meets virtual reality, health care and informatic age, ed. S.J. Weghorst, H.B. Sieburg, K.S. Morgan, Amsterdam 1996.
R. Pietrabissa, Biomateriali per organi artificiali, Bologna 1996.
I sistemi informativi sanitari, a cura di P. Cristiani, F. Pinciroli, M. Stefanelli, Bologna 1996.
E. Biondi, Introduzione all'ingegneria biomedica, Bologna 1997.
Electroassembly of smart polymer structures (role of polyelectrolytes). Proceedings of the SPIE - The International Society for Optical Engineering, ed. G.G. Wallace, S.B. Adeloju, S.J. Shaw, San Diego 1997.
H. Lamaster, J. Maylor, F. Maylor, Internet technologies and requirements for telemedicine, in Minimally invasive therapy & allied technologies, 1997, pp. 436-43.
R. Wootton, Telemedicine: the current state of art, in Minimally invasive therapy & allied technologies, 1997, pp. 393-403.
Ingegneria clinica
di Francesco Paolo Branca
La figura dell'ingegnere clinico
L'ingegnere clinico svolge la sua attività professionale, prevalentemente nel settore dei servizi, in una clinica, in un ospedale, in un centro medico o in altra istituzione dove vengano forniti ricovero e cura al paziente. A partire dalla scelta delle tecnologie disponibili, egli si occupa principalmente della strumentazione biomedica per effettuare una data diagnosi o terapia; l'ingegnere clinico è infatti responsabile della pianificazione e gestione della manutenzione, nonché della sicurezza di esercizio e dell'affidabilità nel tempo della strumentazione in oggetto. Fanno anche parte della sua attività l'informazione, la formazione e l'aggiornamento necessari agli operatori medici e tecnici per il corretto e sicuro impiego della strumentazione biomedica. Questa figura professionale svolge quindi la sua attività in settori che sono strettamente connessi con il paziente, nei confronti del quale egli, per il tramite dell'apparecchiatura e del medico che la utilizza, si trova ad assumere responsabilità professionali diverse da quelle per le quali tradizionalmente l'ingegnere è preparato. Il ruolo importante che l'ingegnere clinico assume operando insieme con il medico vicino al paziente è quello di raccogliere esperienze dirette per realizzare il collegamento tra l'ambiente medico, in ambito clinico, e quello della ricerca, in ambito industriale. Egli, di norma, svolge la sua attività in un nuovo tipo di servizio ospedaliero, il Servizio di ingegneria clinica, di solito composto da uno o più ingegneri clinici e da un certo numero di tecnici biomedici, che sono gli operatori destinati all'attuazione di tutte le attività operative del servizio.
Il numero dei Servizi di ingegneria clinica in Italia è attualmente limitato a circa 30, sebbene alcuni di questi servizi prestino funzione a più presidi ospedalieri. In questo ambito operano circa 60 ingegneri clinici; il loro numero è tuttavia in rapido incremento da quando alcune università italiane hanno istituito sia corsi di laurea sia corsi di diploma che forniscono le competenze necessarie per operare in questa nuova professione.
La strumentazione biomedica
Scopo dell'ingegnere clinico, nella fase di ricerca applicativa, è quello di rendere utile e finalizzato al paziente (direttamente o indirettamente) il prodotto della ricerca stessa. Tale prodotto consiste in genere in procedure relative all'elaborazione di segnali e/o immagini ottenuti dal paziente sia direttamente sia in risposta a uno stimolo esterno (raggi, ultrasuoni ecc.), nonché in procedure relative alla somministrazione controllata di farmaci. Queste azioni costituiscono un procedimento utile alla diagnosi o alla terapia e si traducono in apparecchiature o strumenti appositamente realizzati per erogare le prestazioni necessarie: tali apparecchiature definiscono nel loro insieme la strumentazione biomedica, la quale include anche apparecchiature destinate a sorvegliare lo stato fisiologico dell'individuo, nonché a consentire al medico la diagnosi della malattia del paziente e a effettuare il trattamento terapeutico.
Un criterio che consente una prima classificazione delle apparecchiature biomediche è quello che trae origine dalle attività fondamentali della professione medica, e cioè la diagnosi e la terapia. In generale, uno strumento biomedico viene utilizzato in una di tali attività: in esse tuttavia la distinzione della finalità dello strumento non è sempre netta. Così, per es., uno strumento biomedico usato principalmente per ricavare elementi utili alla diagnosi può essere utilizzato anche per attività di controllo nel corso di azioni terapeutiche (monitoraggio) e, similmente, un'apparecchiatura prevista per attività terapeutiche, come per es. un pacemaker, può riuscire utile per fornire indicazioni di carattere diagnostico.
Vengono compresi nella categoria relativa alla diagnosi: gli strumenti destinati al prelievo e alla presentazione di potenziali elettrici prodotti nel corpo umano (elettroencefalografi, elettrocardiografi, elettromiografi ecc.); gli strumenti per la misurazione diretta o indiretta di parametri fisiologici (quali, per es., pressione del sangue, flussi di gas nel corso della respirazione), come ossimetri, termometri ecc.; gli strumenti per l'analisi di campioni del corpo umano (analisi cliniche, ematologiche, batteriologiche ecc.); le apparecchiature che forniscono immagini delle parti interne del corpo umano, quali apparecchi radiologici in generale, tomografi (TAC e RMN), ecotomografi (ultrasuoni) ecc.
Vengono considerate nella categoria relativa alla terapia: le apparecchiature che applicano energia raggiante o meccanica (di natura acustica) al corpo umano (raggi X, microonde, ultrasuoni ecc.); le apparecchiature per rianimazione (ventilatori polmonari, defibrillatori cardiaci, pacemaker ecc.); le apparecchiature per la terapia fisica (stimolazione dei muscoli e/o nervi); le apparecchiature che servono di supporto alla chirurgia (apparecchi per anestesia, elettrobisturi, pompe parenterali, ossigenatori ecc.).
Vengono, poi, incluse nella categoria relativa al monitoraggio quelle apparecchiature la cui finalità diagnostica o di controllo si manifesta attraverso la misurazione continua di parametri fisiologici (elettrocardiogramma che registra pressione sistolica, diastolica e media, frequenza cardiaca e respiratoria, pressione parziale dell'ossigeno e dell'anidride carbonica nel sangue ecc.).
Appartengono infine alla categoria riabilitazione e protesi sia le apparecchiature destinate alla riabilitazione in generale motoria e in particolare nel campo ortopedico, neurologico ecc., sia altre apparecchiature che, pur avendo il carattere di protesi (sostituzione permanente di organi funzionali anatomici), hanno necessità, per il loro funzionamento, di apporto di energia dall'esterno (protesi elettriche impiantabili come pacemaker, defibrillatore impiantabile, dispositivi di assistenza al ventricolo sinistro ecc.).
Il carattere fondamentale che distingue la strumentazione biomedica da tutte le altre apparecchiature presenti in ospedale, o in un ambiente medico in generale, è che questa è stata progettata per l'utilizzazione specificamente rivolta al paziente e che normalmente la sua progettazione e realizzazione ha richiesto un elevato livello di tecnologia. Un secondo carattere specifico è quello che attiene al controllo, nel corso della vita utile degli strumenti, della costanza delle prestazioni erogate e della sicurezza di esercizio. Per quanto concerne la costanza delle prestazioni nel tempo, questa è strettamente connessa alla qualità della progettazione e della realizzazione dell'apparecchiatura, che deve essere garantita dal fabbricante dei vari dispositivi che la compongono. Questa garanzia è di solito associata all'esperienza che il fabbricante ha nello specifico settore, che determina spesso la qualità di un'apparecchiatura. Per quanto attiene alla sicurezza, vi è da osservare che il fabbricante è obbligato a seguire nella progettazione delle proprie apparecchiature una specifica normativa e, in particolare, le norme dell'IEC (International Electrotechnical Commission) 601-1, corrispondenti alle norme italiane CEI-CNR 62-5 aventi per titolo Norme generali per la sicurezza degli apparecchi elettromedicali.
Grande importanza riveste il problema della manutenzione della strumentazione biomedica, ossia degli interventi che è necessario fare sull'apparecchiatura, per sostituire gli elementi guasti, per le calibrazioni, le pulizie ecc., affinché essa fornisca prestazioni costanti nel tempo e pari a quelle erogate in sede di collaudo dell'apparecchiatura nuova. Per ottenere questo risultato, spesso occorre sostituire alcuni componenti, anche se, apparentemente, la macchina risponde, agli occhi del medico, in modo pienamente soddisfacente. L'ingegnere clinico, avendo tra i suoi compiti anche quello della manutenzione e della sicurezza di esercizio della strumentazione biomedica, è una figura fondamentale per l'eliminazione dei guasti e dei rischi connessi all'impiego di tali apparecchiature. D'altronde, per la gestione di una struttura ospedaliera stanno assumendo un'importanza sempre maggiore sia la presenza diffusa della tecnologia sia la manutenzione, non solo sotto il profilo economico e di immagine, in quanto alla tecnologia è in generale connessa l'attività specialistica che caratterizza il livello dell'ospedale stesso, ma, soprattutto, sotto l'aspetto della sicurezza di esercizio nei confronti del paziente.
Un altro problema nella progettazione e nell'impiego della strumentazione biomedica in ospedale riguarda l'interfaccia medico-macchina. In generale, uno strumento biomedico presenta un certo numero di comandi, a ciascuno dei quali è associata la possibilità di regolare o impostare un parametro dal cui valore dipendono il tipo e la qualità della prestazione ottenibile, o la modifica di un'immagine, o il risultato di un'operazione di calcolo. Quando il numero di questi comandi si approssima al centinaio, vi è il problema di conoscere l'azione che compete a ciascuno di essi e quindi la prestazione attesa.
Tutte le informazioni relative a queste azioni sono in generale descritte in un 'manuale per l'operatore' che spesso è di qualche decina di pagine per le apparecchiature più semplici (per es. elettrobisturi, monitor monocanale, elettrocardiografo a 3 canali ecc.), ma può raggiungere qualche centinaio di pagine per macchine più complesse (TAC, ecografo bidimensionale Doppler a colori, emodinamica ecc.). Di norma il medico, all'atto dell'acquisizione dell'apparecchiatura, apprende dallo specialista della casa costruttrice dell'apparecchiatura l'azione dei comandi fondamentali che sono quelli, salvo rara eccezione, che adopererà per il resto della vita utile dell'apparecchio. Ne risulta una sotto-utilizzazione della strumentazione relativa che tuttavia ha avuto un costo proporzionale al numero delle potenziali prestazioni da erogare. In queste circostanze è essenziale che l'ingegnere clinico apprenda i principi di funzionamento e le modalità di erogazione delle prestazioni della macchina, lasciando quindi il medico libero di concentrarsi sul compito principale che gli è proprio, e cioè la diagnosi. Molte apparecchiature sono realizzate in modo da facilitare il medico nelle scelte da operare mediante l'uso di opportuni microprocessori: la macchina impedisce che si compiano manovre dannose per l'integrità delle sue componenti o pericolose per il paziente (per es., nell'impostazione dei dati per effettuare un radiogramma) e, in generale, fornisce i dati di impostazione e/o diagnosi stampati su una striscia di carta, sulla quale compare anche il nome del paziente.
Nella progettazione della strumentazione biomedica va pertanto tenuto presente il fattore sicurezza. Il medico deve ricevere dalla macchina l'aiuto necessario per essere, per quanto possibile, liberato dal timore delle conseguenze di una decisione errata. Per raggiungere questo risultato, nell'ultimo decennio la strumentazione biomedica si è specializzata nel fornire apparecchiature di monitoraggio che mostrano in tempo reale l'andamento dei parametri fisiologici e che indicano, in particolare, se essi sono entro i limiti di sicurezza o tendono verso limiti di allarme. Così, per es., nel caso di un intervento chirurgico oggi vengono correntemente tenuti sotto controllo: i parametri caratteristici relativi al sistema cardiopolmonare (frequenza cardiaca, elettrocardiogramma, frequenza respiratoria, pressione arteriosa venosa e media); quelli di emogasanalisi (pressione parziale dell'ossigeno e dell'anidride carbonica nel sangue), le percentuali dei gas anestetici inspirati ed espirati dal paziente, la sua temperatura corporea e altri ancora. Recentemente è stato anche introdotto il controllo on-line non invasivo del consumo di ossigeno nel cervello e, negli interventi sulla colonna vertebrale, il controllo, tramite i potenziali evocati, dell'integrità della trasmissione nervosa agli arti inferiori. A queste apparecchiature spesso si aggiungono quelle che consentono il controllo di organi interni a mezzo di immagini ottenute con raggi X o per via ecografica, come, per es., negli esami attinenti al settore dell'emodinamica (cateterismo cardiaco), condotti anche con l'ausilio di sonde ecografiche endoesofagee, oppure nel settore dell'ortopedia, quando si opera la riduzione delle fratture con visione diretta sul monitor dell'intensificatore elettroottico di immagini, comunemente noto come amplificatore o intensificatore di brillanza (IB).
Apparecchiature per diagnosi e monitoraggio
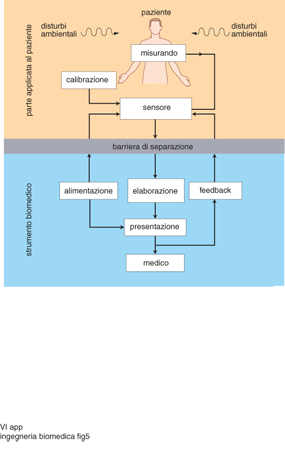
Queste apparecchiature sono sostanzialmente strumenti di misura, in quanto nel loro funzionamento rilevano, mediante appositi sensori, il segnale di interesse (cardiografico, encefalografico, miografico ecc.), che può essere una qualsiasi grandezza rappresentativa dello stato fisiologico o patologico di un apparato (circolatorio, nervoso, muscolare ecc.); in questo caso il corpo umano si presenta rispetto all'apparecchiatura come un generatore, per cui il flusso di energia va nel senso paziente-strumento. L'apparecchiatura elabora il segnale catturato e lo presenta sotto forma di dato numerico assoluto (in un determinato momento) o diacronico (variazione delle grandezze nel tempo). Gli apparecchi diagnostici, per svolgere la loro funzione, utilizzano talvolta energia esterna; in altre parole, il corpo umano non si comporta più come sorgente di segnali bioelettrici, ma piuttosto come un elemento passivo che modifica o subisce l'azione di una radiazione generata all'esterno e inviata al suo interno. Tale radiazione, se è fortemente penetrante (come, per es., la radiazione X, per la quale v. radiologia medica, App. V), fuoriesce dalla parte opposta a quella di ingresso, modificata da ciò che ha incontrato al suo interno. In tale 'modifica' risiede il contenuto diagnostico che viene registrato, per es., su una pellicola fotografica impressionata dai raggi X. In altri casi, come per es. per le onde ultrasonore, si verifica che queste vengano riflesse modificate dagli organi interni che hanno incontrato nel loro cammino, e che, rilevate dallo stesso trasduttore che le ha emesse, trasferiscano l'informazione nell'apparecchiatura; quest'ultima, dopo apposita elaborazione, presenta l'informazione su uno schermo televisivo (ecotomografo). A parte la pericolosità intrinseca nell'utilizzazione delle radiazioni X, γ, o, in altri casi, radiazioni laser, nel caso delle apparecchiature di diagnosi e monitoraggio le tecniche che si utilizzano sono, nella grande maggioranza dei casi, non invasive, nel senso che la cute del paziente rimane integra; di contro, sono generalmente invasive le apparecchiature progettate per la terapia.
Lo schema generale di principio delle apparecchiature di monitoraggio e diagnosi viene presentato in fig. 5: la grandezza fisica, associata alla proprietà o condizione che viene osservata, può essere diversamente accessibile e può essere interna al corpo (per es., nella misura invasiva della pressione sanguigna), o rilevabile sulla superficie (per es., potenziali elettrocardiografici); può essere una radiazione prodotta dal corpo (per es., radiazione infrarossa) e, infine, può derivare da campioni biologici estratti dal corpo (per es., esame bioptico, esami del sangue). Le più importanti misurazioni che si compiono sul corpo umano si possono raggruppare nelle seguenti categorie: biopotenziali e impedenza elettrica, pressione, flusso (portata), dimensioni (immagini), spostamento, velocità, accelerazione e forze, temperature e concentrazioni di miscugli di gas.
Apparecchiature per la terapia
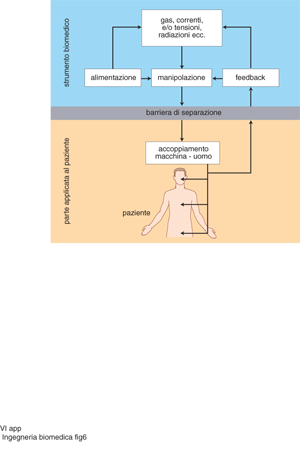
Poiché l'attuazione della terapia richiede sempre l'interazione tra l'ambiente esterno e il corpo umano (così, per es., con l'assunzione di farmaci, si ha la terapia farmacologica; per la correzione chirurgica di un'ernia si ha la terapia chirurgica ecc.), lo schema generale di principio di un'apparecchiatura biomedica per la terapia ha la medesima impostazione dell'apparecchiatura per la diagnosi, ma è invertito il senso del flusso dell'energia che in questo caso viene, in generale, prelevata dall'esterno (dalla rete elettrica per le apparecchiature elettromedicali, dalla rete di gas medicali per le applicazioni di anestesia e la ventilazione polmonare ecc.); tale flusso viene poi opportunamente manipolato nell'apparecchiatura per assumere le caratteristiche idonee a erogare la prestazione voluta e, quindi, inviato al paziente. Si ha così, per es., per il bisturi elettrico, una forma d'onda sinusoidale o pacchetti di onde sinusoidali; per le apparecchiature per elettrostimolazioni, forme d'onda impulsive di idonea ampiezza e durata; per il ventilatore polmonare, pacchetti di gas (aria) di idonea massa, portata e pressione che vengono erogati con l'opportuna frequenza per simulare il regime fluidodinamico del respiro ecc. (fig. 6).
La sicurezza del paziente
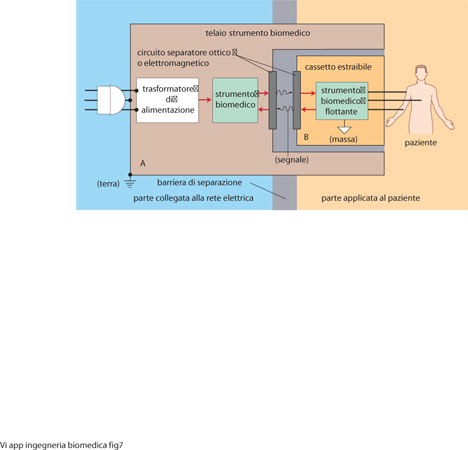
Una caratteristica comune alle apparecchiature elettromedicali con una parte applicata al corpo umano, siano esse diagnostiche o terapeutiche, è quella consistente nell'isolamento elettrico (barriera di separazione, figg. 5 e 6) che deve esistere tra la parte applicata al paziente e il resto dell'apparecchiatura, connessa invece alla rete elettrica di alimentazione. Di norma, l'elevato valore della resistenza elettrica che deve manifestarsi tra le due parti viene ottenuto con la separazione fisica tra le parti stesse (che, però, durante il funzionamento, sono contigue), in modo che possano essere scambiati i segnali utili e l'alimentazione elettrica per la parte isolata. La parte separabile e collegabile al paziente viene chiamata cassetto, in quanto estraibile dal corpo principale dell'apparecchiatura (come se fosse il cassetto di una scrivania).
Le modalità con le quali il segnale utile viene trasferito attraverso la barriera fisica costituita dai contenitori - dei quali uno contiene i circuiti interni al cassetto e l'altro è la parte ospitante il cassetto - sono realizzate con separatori ottici o elettromagnetici, il che significa che il segnale utile viene trasferito tra i due blocchi a mezzo delle modulazioni di un flusso magnetico (nel nucleo di un trasformatore) od ottico (tra un fotodiodo e un fototransistore). Nella fig. 7 viene riportato lo schema di principio di un'apparecchiatura con parte applicata al paziente fisicamente separata dal resto dell'apparecchiatura, detta flottante. In caso di guasto della parte alimentata dalla rete elettrica (per perdita di isolamento o per rottura di un conduttore che si trova alla tensione di rete), la parte isolata dell'apparecchiatura non risente di alcun effetto e la corrente massima che può per qualsiasi strada (capacitiva, resistiva o induttiva) pervenire sulla parte flottante, e quindi interessare il paziente, non supera il valore massimo di 10 μA efficaci, come prefissato dalla normativa vigente per le applicazioni di cardiochirurgia e/o terapia intensiva cardiochirurgica. I sistemi flottanti hanno una grande capacità di isolamento tra i due riferimenti elettrici (massa, verso il paziente, appartenente al cassetto estraibile; terra, verso l'alimentazione elettrica da rete, appartenente alla parte dell'apparecchio collegata alla rete elettrica); tale isolamento nei migliori apparecchi offre protezione fino a tensioni di 10 kV.
La normativa europea IEC 601-1 (o l'equivalente CEI-CNR 62-5) classifica le apparecchiature elettromedicali dal punto di vista della sicurezza elettrica con riferimento all'entità delle correnti che esse possono 'disperdere' nel paziente, in modo da limitarne l'uso a seconda della specialità medica nella quale esse vengono impiegate. A tale fine, le apparecchiature sono suddivise in 4 classi: tipo H, apparecchiature elettromedicali di sicurezza equivalente agli usuali apparecchi di tipo domestico; tipo B, apparecchiature elettromedicali aventi correnti di dispersione ridotte e costruite con particolari riguardi alla sicurezza del paziente: sono adatte per applicazioni dirette sul paziente (per es., cardiomonitor, misuratore non invasivo della pressione ecc.); tipo BF, apparecchiature elettromedicali aventi la parte applicata al paziente isolata da terra (flottante; le stesse apparecchiature del caso precedente, ma idonee a essere impiegate, per es., in terapia intensiva cardiochirurgica): queste apparecchiature presentano margini di sicurezza maggiori rispetto a quella del tipo B; tipo CF, apparecchiature elettromedicali che presentano elevate garanzie di sicurezza con correnti di dispersione della parte applicata al paziente particolarmente basse (≤10 μA efficaci) e pertanto idonee per applicazione diretta al cuore del paziente.
Nella normativa relativa alla sicurezza elettrica delle apparecchiature elettromedicali vengono definite tre correnti di dispersione: verso terra, sull'involucro e nel paziente. La corrente di dispersione verso terra è la corrente che fluisce nel conduttore di protezione (in certe specifiche condizioni); la corrente di dispersione sull'involucro è la corrente che attraversa il paziente in contatto con l'involucro dell'apparecchiatura e la terra o con due distinte parti dell'involucro; se, infine, l'apparecchiatura ha una parte applicata, intesa come insieme di parti (fili, elettrodi, sonde ecc.) che viene messa intenzionalmente a contatto con il paziente, da questa, tramite il paziente stesso, può fluire una corrente verso terra, che viene chiamata corrente di dispersione nel paziente. Le tre correnti citate possono assumere valori diversi in condizioni normali e in condizioni specificate (dette di primo guasto). Le norme riportano i valori massimi che tali correnti possono assumere nelle diverse modalità di funzionamento e di guasto: quanto più questi valori sono bassi tanto migliore è la classe dell'apparecchiatura e il suo livello tecnologico.
Le condizioni di sicurezza elettrica nei confronti del paziente non dipendono solamente dalle condizioni di sicurezza intrinseche delle apparecchiature, ma anche dall'ambiente nel quale esse sono disposte per il loro funzionamento. Esempi tipici sono quelli delle sale operatorie in generale e di quelle di cardiochirurgia e delle terapie intensive cardiochirurgiche in particolare. La condizione essenziale di sicurezza da doversi garantire è che in nessuna circostanza in cui più apparecchiature funzionano contemporaneamente (più di una decina nel corso di un intervento di cardiochirurgia), deve essere consentito che una differenza di potenziale (d.d.p.) esistente tra due diverse apparecchiature sia superiore al valore di 10 mV. Questa condizione di pericolo viene eliminata rendendo equipotenziale tutto l'ambiente intorno al paziente.
Prelevamento dei segnali bioelettrici
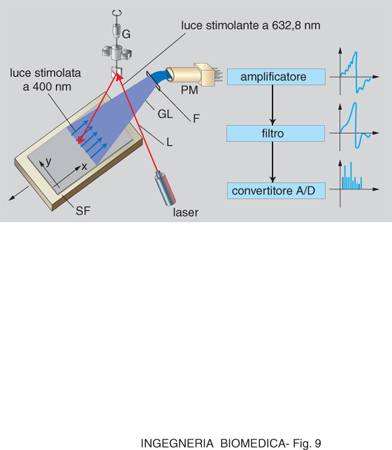
Tra i problemi di carattere tecnologico che occorre risolvere per la progettazione e l'impiego della strumentazione elettromedicale relativa alla diagnosi, e quindi dell'eventuale monitoraggio, ve ne è uno comune a ogni apparecchiatura destinata al prelievo e all'amplificazione di segnali bioelettrici. Questi infatti hanno ampiezza dell'ordine della decina di μV (potenziali evocati, potenziali elettromiografici, potenziali cerebrali) o di qualche mV nel caso di potenziali cardiaci. I campi elettrici e magnetici certamente presenti nel luogo dove viene eseguito l'esame diagnostico o l'intervento terapeutico (dovuti alla rete di distribuzione dell'energia elettrica, ai reattori delle lampade fluorescenti, ai motori elettrici degli ascensori ecc.) inducono, in genere per accoppiamento capacitivo (ma spesso anche per via induttiva, se si costituisce una spira tra i diversi conduttori che realizzano il cosiddetto cavo-paziente), un disturbo che si presenta assieme al segnale utile all'ingresso dello stadio manipolatore del segnale. La d.d.p. relativa al disturbo ha un valore che può essere parecchie centinaia di volte maggiore di quello della d.d.p. del segnale utile da misurare. Si suole dire che vi è una tensione indotta comune ai due ingressi dell'amplificatore e che si presenta assieme al segnale bioelettrico utile. Tale tensione, rappresentante il disturbo, è chiamata tensione di modo comune e, affinché si possa eseguire la misura, essa deve essere quanto più possibile attenuata. Tale risultato può essere ottenuto con alcuni artifici circuitali che prevedono l'impiego di un amplificatore differenziale, il quale amplifica solo la differenza tra due segnali presenti al suo ingresso: ciò comporta l'eliminazione di segnali che si presentano con pari ampiezze (tensione di modo comune). Il problema viene completamente risolto utilizzando una serie di amplificatori differenziali che consentono un efficace rigetto della tensione di modo comune, mantenendo elevata l'impedenza di ingresso nei confronti del segnale utile. Il parametro che fornisce la misura dell'efficacia dell'attenuazione si chiama CMRR (Common Mode Rejection Ratio) e viene indicato in decibel (dB). Un buon apparecchio elettromedicale con parte applicata al paziente flottante ha un CMRR pari a circa 100 dB.
Esempi di diagnostica per mezzo di immagini
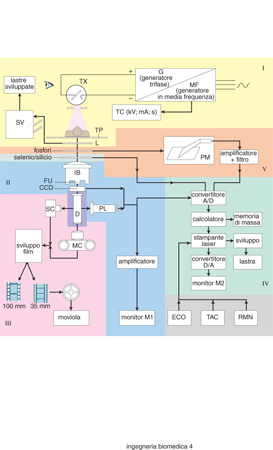
Mediamente gli investimenti per l'acquisizione di apparecchiature biomediche per un nuovo ospedale sono circa il 16% del costo totale, e di tale costo circa la metà è assorbita dalle apparecchiature destinate alla diagnostica per immagini, principalmente ecografia (ultrasuoni), raggi X e risonanza magnetica nucleare. Tra queste apparecchiature, quelle da più tempo utilizzate e anche le più diffuse sono quelle a raggi X (v. radiologia medica: Radiologia diagnostica, App. V) che richiedono per il loro impiego personale medico specializzato e un controllo, appositamente previsto dalla vigente legislazione, eseguito da esperto qualificato. Il problema principale associato alla progettazione e all'impiego delle apparecchiature a raggi X, e quindi la direzione degli sforzi e dei progressi tecnologici in questo settore, sono connessi alla capacità di un'apparecchiatura di fornire la migliore qualità dell'immagine (radiogramma, nel linguaggio corrente chiamato lastra) con la minima dose diretta assorbita dal paziente. Queste prestazioni sono state ottenute di recente mediante il ricorso alla tecnica della 'media frequenza' per l'alimentazione in alta tensione dei tubi radiogeni, mediante l'amplificatore di brillanza per le analisi di relativa lunga durata (fluoroscopia), mediante la digitalizzazione delle immagini provenienti dall'amplificatore di brillanza e, infine, utilizzando la recente tecnologia di nuovi sensori di raggi X (v. oltre). Nella fig. 8 è riportato un quadro sintetico suddiviso in settori, ciascuno dei quali rappresenta lo sviluppo tecnologico della radiologia negli ultimi trent'anni circa. Essa si compone di cinque sezioni ciascuna delle quali, oltre a rappresentare i principali componenti delle apparecchiature, indica sia le loro diverse possibili utilizzazioni (radiogramma, fluoroscopia ecc.), sia il recente sviluppo tecnologico delle tecniche radiografiche.
Radiologia tradizionale. - Nella sezione I è rappresentato il dispositivo fondamentale di ogni apparecchio che utilizzi i raggi X come mezzo per ottenere informazioni dall'interno del corpo umano. Esso si compone del tubo generatore di raggi X (tubo TX) che viene alimentato con tensione di elevato valore (da 35 a 150 kV, a seconda della tecnica diagnostica prescelta e delle caratteristiche morfologiche del paziente) e con correnti che variano nel campo da qualche mA (per uso in scopia) a 800÷1000 mA (per uso in grafia).
Poiché l'energia della radiazione X dipende dall'intensità del campo elettrico che accelera l'elettrone che produce la radiazione stessa, e quindi dalla tensione applicata al tubo, se questa varia, come accade nelle tensioni raddrizzate, dando luogo a ondulazione o ripple, negli istanti in cui la tensione è lontana dal valore massimo vengono emessi fotoni la cui energia può non essere sufficiente ad attraversare il corpo umano (radiazioni molli); questi fotoni pertanto rimangono nel suo interno producendo ionizzazioni nella materia, per cui a essi è associato un danno biologico, mentre non vi è alcun contributo alla formazione dell'immagine sulla lastra. La situazione ideale è quella di produrre una radiazione con fotoni X tutti di pari energia: ciò si verifica se la tensione applicata al tubo non oscilla e cioè se essa è continua. L'impostazione dei parametri fondamentali (tensione, intensità di corrente, tempo), che devono essere scelti dal radiologo a seconda delle dimensioni del paziente e del 'distretto' anatomico oggetto dell'indagine, viene attuata su apposita console chiamata tavolo di comando (TC). Occorre pertanto costruire un alimentatore del tubo TX, normalmente chiamato generatore (G) nel linguaggio radiologico, idoneo a fornire tensioni continue associate a elevata potenza (dell'ordine che va dalla decina di kW fino a più di 100 kW): ciò comporta la realizzazione di trasformatori di grande ingombro e massa (200÷400 kg). Poiché è molto oneroso ottenere tensioni continue di tale potenza a partire dalla tensione di alimentazione della rete, di solito si accetta di ottenere tensioni quasi continue con un certo contenuto di alternata (ripple) che va dal 2 al 15% (quest'ultimo valore essendo ammesso in condizioni di erogazione della potenza massima), utilizzando trasformatori in alta tensione trifase con uno o due secondari. Un sensibile miglioramento si è ottenuto incrementando artificialmente la frequenza di rete (da 50Hz a più di 25 kHz), a mezzo di appositi apparati raddrizzatori trifase con associato un inverter (MF); questi strumenti consentono di ottenere tensioni di elevato valore quasi continue con un contenuto residuo di alternata, talvolta inferiore rispetto al caso precedente, ma con un risparmio di circa l'85% dello spazio e del volume, di circa il 75% della massa, di circa il 25% del calore prodotto e di circa il 30% del costo.
Nella sezione è inoltre presente il tavolo portapaziente (TP), eventualmente fornito di meccanismi che possano consentire spostamenti secondo direzioni ortogonali nel piano e anche inclinazioni rispetto al piano orizzontale fino alle posizioni estreme di ±90°. Vi è inoltre un luogo dove viene sviluppata la lastra fotografica (L), che è solitamente posta dentro una 'cassetta', interposta tra uno o due schermi fluorescenti che, emettendo luce sotto l'azione dei raggi X, impressionano la pellicola molto più di quanto non sia possibile impressionarla con i soli raggi X. Ne risulta una forte riduzione della dose erogata al paziente a parità di annerimento della pellicola fotografica. Completa la sezione una macchina sviluppatrice (SV) della pellicola fotografica impressionata dopo l'esposizione ai raggi X, che compie le operazioni di sviluppo, fissaggio, lavaggio ed essiccazione entro un tempo di circa 120 s, in modo completamente automatico.
Fluoroscopia. - Nella sezione II sono rappresentati i componenti della catena televisiva per l'osservazione in scopia (o fluoroscopia) di parti interne del corpo umano, in condizioni statiche o dinamiche, su un monitor televisivo. Il primo elemento è costituito dall'amplificatore di brillanza (IB) che riceve la radiazione X e, al suo interno, la trasforma attraverso uno strato scintillatore (ioduro di cesio) e uno fotoelettrico (sali di cesio) in elettroni; questi, accelerati da una d.d.p. tra anodo e catodo di circa 25 kV, vengono focalizzati nella finestra di uscita (FU), dove trasformano la loro energia cinetica in energia luminosa su uno strato di fosfori (di solito solfuro di cadmio e di zinco). La brillanza della finestra di uscita è 15.000÷20.000 volte maggiore di quella dello strato fotoscintillatore di ingresso, ed elevato è anche il potere risolutivo (100 coppie di linee per millimetro). La dose di radiazione X in ingresso è circa 10 volte inferiore a quella occorrente per impressionare la pellicola fotografica e per tale motivo l'amplificatore di brillanza consente di utilizzare bassi valori della corrente al tubo TX (1÷4 mA) e di osservare sul monitor (M1) in tempo reale l'immagine del corpo, che nel corso dell'indagine può muoversi. A bassi valori della corrente nel tubo corrispondono bassi valori di dose di radiazioni X per il paziente, per cui è possibile incrementare il tempo di osservazione senza che la dose accumulata nel corpo del paziente raggiunga valori pericolosi: la durata media di un'osservazione fluoroscopica è di 5÷6 minuti. L'immagine uscente dall'amplificatore di brillanza perviene a un distributore ottico (D) e quindi viene catturata direttamente, o per il tramite di una fibra ottica, da un tubo da ripresa televisiva (vidicon e, più di recente, plumbicon - PL - o saticon) che trasferisce il segnale elettrico alla sua uscita (segnale video) a un amplificatore, e quindi al monitor (M1), il cui standard televisivo può essere di 625 linee (europeo) o 1249 linee (alta definizione). Il plumbicon è stato da qualche tempo sostituito in alcune apparecchiature da un sensore a stato solido CCD (Charge-Coupled Device), il quale possiede, rispetto al plumbicon, un campo dinamico più ampio e un comportamento lineare (tensione di uscita proporzionale all'intensità luminosa in ingresso).
Vi sono tuttavia alcuni svantaggi, quali quello del difficile controllo del rumore con l'incremento della temperatura, nonché della fluttuazione dovuta all'emissione quantica dei raggi X a bassa dose, fenomeno che limita il contrasto dell'immagine. Oltre a ciò vi è anche l'intrinseca complicazione dovuta al fatto che il CCD cattura l'immagine dalla finestra di uscita dell'amplificatore di brillanza, che è di forma circolare, mentre la sua superficie sensibile ha rapporto base/altezza 4:3. Un sistema di lenti anamorfiche è necessario per comprimere l'immagine nella direzione verticale. Comunque il sistema di riproduzione con catena televisiva, fondato sull'accoppiamento plumbicon-monitor, consente di ottenere un'eccellente qualità dell'immagine, che costituisce a tutt'oggi lo standard di riferimento.
Angiografia. - Nella sezione III sono rappresentati i componenti che consentono di realizzare la tecnica angiografica, e cioè lo studio di organi (liquidi) in movimento e, in particolare, della rappresentazione dei vasi sanguigni a mezzo dell'introduzione nel sistema circolatorio di liquidi radioopachi (composti dello iodio). Essa si compone del distributore ottico (D), che a mezzo di un sistema di specchi semitrasparenti distribuisce l'immagine in uscita dall'amplificatore di brillanza, oltre che al plumbicon, a una macchina cinematografica (MC) con pellicola con passo di 35 mm che può scorrere fino a 200 fotogrammi al secondo. È così possibile confrontare eventi dinamici a distanza temporale di 1/200 di secondo. Ciò è essenziale in esami emodinamici di neonati, le cui funzioni cardiache raggiungono in caso di patologia frequenze di 150÷180 battiti al minuto. Infine l'immagine dell'amplificatore di brillanza può essere inviata a una spot camera (SC) che permette sequenze fino a 12 immagini al secondo, registrate su pellicola con passo di 70, 100 o 105 mm.
Il vantaggio dell'impiego della spot camera consiste nel grande risparmio di dose da somministrare al paziente, che si riduce a un quinto di quella che sarebbe necessaria se si utilizzassero cassette con pellicole di formato ordinario. La spot camera si differenzia dalle normali macchine fotografiche motorizzate sia per l'obiettivo, che ha fuoco fisso e grande apertura angolare, sia per l'assenza dell'otturatore. Questo viene sostituito dal generatore di raggi X, che interrompe la sua emissione nell'intervallo di tempo necessario alla macchina per passare da un fotogramma al successivo. La sezione iii è completata da una moviola, necessaria per visionare il film girato dalla macchina a ripresa veloce e da una sviluppatrice per la pellicola di 35 mm. I caricatori della macchina hanno, di solito, bobine che contengono spezzoni di pellicola lunghi 90 metri.
Radiologia digitale. - Nella sezione IV sono riportati i blocchi relativi al processo di digitalizzazione dell'immagine, che ha rappresentato il grande progresso della tecnica radiologica dagli anni Ottanta a oggi. Il procedimento di digitalizzazione avviene sul segnale video in uscita dal plumbicon o dagli altri sensori della radiazione X diversi dall'amplificatore di brillanza, quali il sensore piatto al selenio e il sensore piatto al silicio (v. oltre), i quali compiono, al pari dell'amplificatore di brillanza, la trasduzione della radiazione X nella corrispondente immagine con componenti a stato solido. Essi forniscono alla loro uscita un segnale analogico (segnale video), che viene successivamente digitalizzato.
Il processo di digitalizzazione consiste nel campionare, in forma numerica, a intervalli di tempo discreti, l'intensità del segnale analogico; i campioni così ottenuti rappresentano il livello di grigio (numero minimo di livelli: 256, corrispondenti a 8 bit) da attribuire a una matrice di elementi (pixel) nei quali è stata discretizzata l'immagine. L'operazione di discretizzazione dell'immagine è compiuta dal convertitore analogico digitale (A/D) che rende quindi il segnale elaborabile da un calcolatore. I dati digitalizzati sono memorizzati dal calcolatore (memoria di massa) che applica su di essi gli appositi algoritmi di elaborazione. Parametri tipici per il processo di digitalizzazione delle immagini, in campo biomedico, sono i seguenti: da 9 a oltre 16 milioni di pixel su lastra formato 35×43 cm² e cioè con una dimensione per pixel che va da 116 a 90 μm; da 10 a 12 bit per pixel e cioè da 1024 a 4096 livelli di grigio; rapporto tra segnale utile e rumore >100 dB. L'immagine, dopo esser stata processata dal calcolatore, viene inviata a una stampante laser, nella quale l'immagine analogica è riottenuta per mezzo di convertitore digitale analogico (D/A). Il segnale all'uscita del D/A può essere inviato per l'osservazione anche sul monitor M2. Poiché altre macchine diagnostiche come TAC, RMN ed ECO producono immagini già digitalizzate, è facile inviare il corrispondente segnale numerico direttamente alla stampante laser.
La digitalizzazione dell'immagine presenta, rispetto al corrispondente procedimento analogico, il vantaggio di consentire: a) un aiuto alla diagnosi a mezzo del trattamento dell'immagine (post-processing) e del miglioramento della resa dei toni di grigio; b) una sostanziale riduzione di dose globale trasferita al paziente, poiché possono essere recuperate a mezzo del post-processing immagini sovra- o sottoesposte; c) una gestione computerizzata delle immagini e quindi possibilità di archiviazione, trasmissione, produzione di copie multiple ecc.; d) un migliore utilizzo della pellicola fotografica.
Radiologia digitale con sensore di immagine a stato solido (computed radiology). - Nella sezione V è riportato lo schema a blocchi della radiologia digitale, realizzata a mezzo di un particolare sensore dove la radiazione X emergente, dopo aver attraversato il corpo umano, impressiona non una pellicola fotografica, bensì una speciale lastra sul cui supporto è depositato, in luogo dell'emulsione fotografica, uno strato di fosfori (fluoruro di bario e altri alogeni attivati all'europio BaFX: Eu₂ con X=Cl,Br,I), dello spessore di circa 150 μm. Il fenomeno fisico utilizzato è quello della luminescenza fotostimolata, che non è né fluorescenza né fosforescenza ed è fondata sulla proprietà delle citate sostanze di emettere luce, sotto l'azione di una stimolazione di radiazione elettromagnetica nel campo del visibile e la cui lunghezza d'onda è molto maggiore di quella della radiazione elettromagnetica che ha stimolato la sostanza una prima volta. Se, quindi, queste sostanze sono state attivate da una radiazione X, esse, successivamente stimolate da una radiazione visibile, emettono a loro volta una radiazione, anch'essa visibile, che può essere raccolta, per es., da un fotomoltiplicatore. Il sensore ai fosfori - così come viene oggi definito - una volta impressionato viene quindi 'letto' da un dispositivo come quello indicato nella fig. 9: un raggio laser (L) di modesta potenza (≃20 mW) viene deflesso dallo specchio di un galvanometro (G) che oscillando fa percorrere al raggio riflesso la larghezza del sensore ai fosfori (SF) nella direzione y, mentre questo avanza con velocità costante nella direzione x. Una guida di luce (GL, costituita da una serie di fibre ottiche) in prossimità dello strato sensibile raccoglie la luce emessa per effetto della luce laser e la convoglia all'ingresso del fotomoltiplicatore (PM), alla cui uscita si ha un segnale analogico la cui intensità, punto per punto, è proporzionale all'intensità di radiazione X che ha impressionato i fosfori nei medesimi punti. All'ingresso del fotomoltiplicatore è posto un filtro (F) che blocca la componente stimolante (lunghezza d'onda 632,8 nm) e fa passare il segnale utile (luce stimolata nella banda dei 400 nm). Il segnale in uscita, amplificato e filtrato, viene digitalizzato e inviato al calcolatore, dove avviene l'elaborazione del segnale; è quindi possibile procedere alla fase di stampa. La radiologia digitale con sensori a fosfori, commercialmente designata come computed radiology, in base alla conformazione del nuovo tipo di sensore che viene inserito nella cassetta sostituendo la pellicola fotografica, ha il grande vantaggio di non richiedere alcuna modifica dell'impianto di base (di cui alla sezione I), né delle altre apparecchiature che comunque 'vedono' sempre una cassetta portalastre. Per quanto attiene alle prestazioni generali offerte dalla computed radiology, rispetto alla radiologia tradizionale, con cassetta film e schermi di rinforzo, si osserva che: il sensore delle immagini è riutilizzabile e ha caratteristiche di dinamica di esposizione 1:40.000 contro la dinamica 1:30 della pellicola fotografica; è consentita una riduzione di dose al paziente, in quanto è possibile, per mezzo dell'elaborazione effettuata dal computer, recuperare senza difficoltà l'immagine che altrimenti avrebbe dovuto essere ripetuta perché sotto o sovraesposta; l'efficienza quantica può essere superiore a quella del sistema pellicola-schermo di rinforzo. Per quanto concerne, infine, la qualità dell'immagine, di fatto la computed radiology ha una risoluzione che in ogni caso non è superiore a quella del sistema tradizionale schermo-pellicola, anche se tale deficienza può, almeno in parte, essere recuperata con l'elaborazione dell'immagine.
Lo sviluppo della radiologia digitale. - Lo sviluppo della radiologia digitale è ora rivolto alla sostituzione dell'amplificatore di brillanza con un sensore a stato solido che possa funzionare in condizioni sia statiche sia dinamiche. Il primo sensore sviluppato, e attualmente in uso per le radiografie toraciche, è costituito da uno strato di selenio amorfo, di spessore pari a 0,5 mm, disteso su un substrato di alluminio, in modo da formare un doppio strato. Il selenio è un fotoconduttore che si comporta da isolante, se non interessato da radiazioni; esso diviene però conduttivo se esposto alla radiazione: ciascun elemento di area dello strato diviene più o meno conduttivo in proporzione all'intensità della radiazione che lo ha colpito. In un primo momento il doppio strato viene 'caricato' elettrostaticamente, per cui sulla superficie libera dello strato di selenio vi sono solo le cariche positive, mentre le negative sono allocate nel supporto di alluminio. L'esposizione ai raggi X rende conduttore lo strato di selenio e la distribuzione delle cariche positive superficiali ricopia la distribuzione dell'intensità della radiazione X, in quanto le cariche positive liberate vengono neutralizzate dallo strato di Al negativo. Successivamente la superficie dello strato di selenio viene sottoposta a una scansione a mezzo di una piccola sonda di un elettrometro, a una distanza di circa 0,1 mm dalla superficie del selenio. L'elettrometro fornisce alla sua uscita una d.d.p. proporzionale alla densità di carica superficiale e quindi, in definitiva, all'intensità della radiazione X che ha colpito lo strato. Il selenio ha l'importante proprietà di possedere la più elevata efficienza quantica rispetto a tutti gli altri sensori e pertanto grande è la capacità di assorbire la massima parte di fotoni X incidenti. A ciò è connesso un migliore rapporto segnale-disturbo, cui corrisponde una migliore capacità di catturare piccoli dettagli dell'immagine e quindi tale sistema, rispetto agli altri, consente di ottenere una migliore qualità dell'immagine e una diminuzione di dose per il paziente.
Infine, vi è un altro sensore a stato solido, destinato probabilmente a sostituire in un prossimo futuro l'amplificatore di brillanza, che è (fig. 10) costituito da un supporto sul quale è disteso un sottile strato di silicio amorfo depositato con un processo di vaporizzazione sotto vuoto e che è strutturato in schiere di sensori (fotodiodi) utilizzando i metodi fotolitografici. Ciascun sensore è un quadratino il cui lato è pari a circa 140 μm e rappresenta pertanto la dimensione del pixel. In un sensore di dimensione 43×43 cm² (per radiografia toracica) vi sono 3000×3000 pixel. La matrice è percorsa da una doppia griglia di conduttori che circonda i pixel, in modo che ciascuna riga composta da 3000 sensori (fotodiodi) possa essere letta sequenzialmente una dopo l'altra, percorrendo così l'intera immagine, mentre nell'ambito di ciascuna riga può essere prelevato il segnale di ciascun fotodiodo che, istante per istante, è proporzionale alla radiazione che ha colpito il sovrastante strato scintillatore. Il segnale elettrico analogico fornito dal contributo di ciascun pixel, prelevato sequenzialmente riga per riga, rappresenta il segnale video della riga medesima. Esso è l'analogo del segnale video in uscita dal plumbicon, dove il pennello elettronico, pilotato magneticamente, percorrendo sequenzialmente in 625 righe ogni quadro dell'immagine disponibile sullo strato fotosensibile, nello scaricare i microcondensatori costituenti i pixel dello strato sensibile, fornisce alla sua uscita il segnale video analogico relativo all'immagine in 1/50 di secondo. Il sensore al silicio amorfo sostituisce l'amplificatore di brillanza per immagini statiche e consente di utilizzare le tecniche della radiologia digitale; poiché esso ha un'efficienza quantica che risulta circa doppia rispetto alla tecnica tradizionale schermo-pellicola, ne deriva una significativa riduzione della dose di radiazioni al paziente senza alcuna perdita di qualità dell'immagine. I primi dispositivi radiologici con sensori a stato solido sono stati commercializzati nel 1999. Vedi tav. f.t.
bibliografia
The practice of clinical engineering, ed. C.A. Caceres, New York 1977.
Clinical engineering: principles and practices, ed. J.G. Webster, A.M. Cook, Englewood Cliffs (N.J.) 1979.
Medical engineering, cap. 14, ed. C.D. Ray, Chicago 1980.
H.E. Johns, J.R. Cunninghan, The physics of radiology, Springfield (Ill.) 1983, 1993⁴.
P. Saha, S. Saha, Ethical responsibilities of the clinical engineer, in Journal of clinical engineer, 1986, 1.
CNR, Progetto finalizzato tecnologie biomediche e sanitarie. Sottoprogetto n. 19 AC.MA.GEST., Roma 1987.
Medical instrumentation: application and design, ed. J.G. Webster, Boston 1992, 1995².
A.B. Wolbarst, Physics of radiology, Norwalk (Conn.) 1993.
T.M. Boguchi, D.P. Tranernicht, T.E. Kocher, Characteristics of a storage phosphor system for medical imagining, New York 1995.
Introduction to biomedical engineering, ed. J. Enderle, S.M. Blanchard, J.D. Bronzino, San Diego 1999.