iperalgesia
iperalgesia
Aumentata sensibilità ad avvertire uno stimolo dolorifico. L’i. è causata da alterazioni sia periferiche sia centrali.
Alterazioni periferiche
Questo tipo di alterazioni include la sensibilizzazione dei nocicettori, che si innesca a seguito di un danno tissutale e l’avvio di un processo infiammatorio. Il danno e l’infiammazione portano al rilascio di una serie di mediatori chimici che eccitano direttamente i nocicettori, oppure causano una riduzione della soglia per la loro attivazione. A livello di un tessuto leso, infatti, si ha rilascio massiccio di ioni potassio, di bradichinina e di serotonina, che agiscono sulle terminazioni nocicettive; la bradichinina, in partic., oltre ad attivare direttamente le fibre Aδ e C, è in grado di stimolare la via delle cicloossigenasi, inducendo la sintesi e il rilascio di prostaglandine dalle cellule adiacenti alla lesione. Le prostaglandine rilasciate hanno un effetto molto potente di sensibilizzazione delle terminazioni dolorifiche. L’aspirina e altri farmaci antinfiammatori non steroidei sono efficaci nel controllo del dolore (➔) proprio grazie alla loro attività di inibizione delle cicloossigenasi. Al processo di sensibilizzazione possono contribuire le stesse terminazioni nocicettive; queste rilasciano, in seguito a depolarizzazione, alcuni neuropeptidi (➔) (quali la sostanza P e il peptide associato al gene per la calcitonina, ossia CGRP, Calcitonin Gene-Related Peptide). Tali neuropeptidi causano vasodilatazione e un ulteriore aumento della risposta infiammatoria. In partic., la sostanza P induce la degranulazione dei mastociti con conseguente rilascio di istamina, che agisce attivando e sensibilizzando le terminazioni nocicettive.
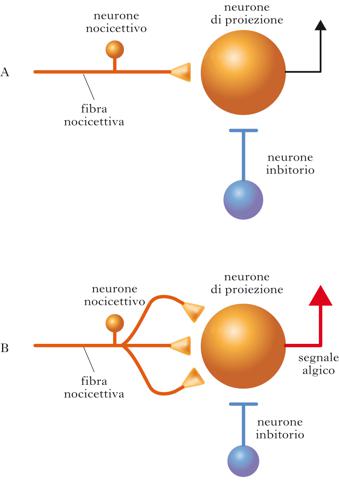
Alterazioni centrali
L’i. può essere conseguenza anche di alterazioni a livello di sistema nervoso centrale, in partic. di un aumento della risposta dei neuroni delle corna dorsali del midollo spinale (sensibilizzazione centrale) che ricevono ingresso dai nocicettori, con conseguente amplificazione del segnale algico. È stato osservato, per es., che a seguito di un danno tissutale persistente, le fibre C possono scaricare potenziali d’azione in maniera sostenuta e ripetuta. Questa scarica ad alta frequenza induce massiccio rilascio di glutammato e una depolarizzazione sostenuta a livello dei neuroni bersaglio nella corna dorsali del midollo spinale. In queste condizioni si verifica, a livello postsinaptico, l’apertura di canali ionici del tipo N-metil-aspartato (NMDA, N-Methyl-D-Aspartate), che fanno entrare calcio; questo innesca una serie di modifiche strutturali e funzionali persistenti, che aumentano l’efficacia della trasmissione sinaptica e sono chiamate potenziamento a lungo termine (➔), o LTP (Long Term Potentiation), consistente in cambiamenti sia presinaptici sia postsinaptici. Tra le modifiche presinaptiche si possono menzionare un’aumentata probabilità di rilascio del neurotrasmettitore glutammato e la formazione di nuove collaterali assonali da parte dei terminali nocicettivi afferenti (fenomeno dello sprouting). Le modifiche postsinaptiche (a livello del neurone delle corna dorsali) comprendono un aumento del numero di recettori per il glutammato e un abbassamento della soglia per la genesi di potenziali d’azione. È noto che l’attivazione del recettore NMDA è un evento critico nell’induzione dell’LTP. Inoltre, un ruolo importante è svolto da un fattore neurotrofico, il BDNF (Brain-Derived Neurotrophic Factor), che viene prodotto dai neuroni nocicettivi, trasportato in senso anterogrado nella loro branca assonale centrale, e rilasciato quando le fibre nocicettive scaricano ad alta frequenza. Il rilascio del BDNF induce varie modificazioni plastiche nei neuroni delle corna dorsali, che incrementano la loro risposta a stimoli afferenti. In queste condizioni uno stimolo algico afferente può essere potentemente amplificato, causando una patologica accentuazione della sensibilità dolorifica. Sono stati individuati altri meccanismi che possono modificare l’eccitabilità dei neuroni delle corna dorsali. In partic., sono state osservate, in modelli di i.: riduzione dell’inibizione locale (GABAergica e glicinergica) sui neuroni delle corna dorsali, diminuzione del numero di sinapsi inibitorie, minore probabilità di rilascio dei trasmettitori inibitori e riduzione di densità di recettori postsinaptici per i trasmettitori inibitori. Questi ridotti livelli di inibizione possono facilitare l’attivazione dei neuroni delle corna dorsali da parte dei nocicettori. Alcuni dati suggeriscono che anche alterazioni nella fisiologia delle cellule gliali (in partic., astrociti e microglia) e delle loro interazioni con i neuroni delle corna dorsali possano mediare l’aumentata sensibilità dolorifica in modelli di iperalgesia.