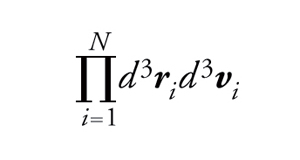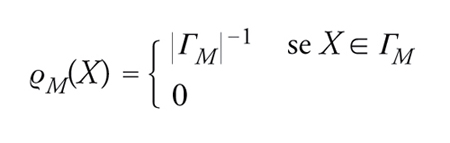Irreversibilità
Irreversibilità
Se si considera il successo dei metodi statistici introdotti da James Maxwell e William Thomson (che divenne più tardi lord Kelvin) e resi quantitativi da Ludwig Boltzmann ‒ metodi che condussero alla spiegazione e alla predizione del comportamento dei sistemi macroscopici sulla base della dinamica microscopica reversibile ‒ si resta sorpresi che ancor oggi regni tanta confusione sul problema dell'irreversibilità. A mio parere questa situazione deriva dal fatto che l'originalità di questi metodi ha reso davvero difficile una loro comprensione profonda. La rilevanza che questi assunsero nella forma precisa ed elegante che Boltzmann diede loro con la sua famosa equazione cinetica e con il 'teorema H' li rese facili bersagli di molti attacchi. La confusione creata da queste incomprensioni e dalle controversie che ne seguirono fra Boltzmann e alcuni dei suoi contemporanei, in particolare Ernst Zermelo, è stata perpetuata da vari autori i quali non compresero, o non spiegarono adeguatamente, le risposte del tutto soddisfacenti che Boltzmann aveva dato a questi problemi nelle sue repliche a coloro che lo attaccavano e anche negli scritti successivi. Questa incomprensione, vista la chiarezza di tali scritti, non ha alcuna scusante. Per usare le parole di Erwin Schrödinger, "le idee di Boltzmann conducono realmente a comprendere" le origini del comportamento macroscopico dei corpi materiali. Tutte le affermazioni sulla incompatibilità fra leggi microscopiche e comportamento macroscopico (almeno tutte quelle di cui sono a conoscenza) sono a mio avviso errate e non si vede alcuna necessità di cercare spiegazioni alternative, almeno per quanto riguarda il livello classico non relativistico.
La teoria statistica di Boltzmann sul comportamento fuori dall'equilibrio (asimmetrico rispetto al tempo e irreversibile) associa a ciascuno stato microscopico di un sistema macroscopico, sia esso un gas, un liquido o un solido, un numero SB chiamato entropia di Boltzmann di tale stato. Questa entropia coincide (a meno di termini trascurabili rispetto alle dimensioni del sistema) con l'entropia termodinamica macroscopica di Clausius se il sistema è in equilibrio e in questo caso coincide anche con l'entropia di Gibbs SG, che è definita non per i microstati individuali ma per gli ensemble statistici o distribuzioni di probabilità. Questo è vero anche per sistemi in equilibrio locale. Tuttavia, a differenza di SG ‒ che non cambia nel tempo anche per insiemi che descrivono sistemi (isolati) non in equilibrio, per esempio fluidi che si evolvono secondo le equazioni dell'idrodinamica ‒ SB cresce generalmente in una maniera che spiega e descrive qualitativamente l'evoluzione verso l'equilibrio dei sistemi macroscopici.
Questo comportamento di SB è dovuto alla separazione fra le scale microscopiche e macroscopiche, cioè al numero molto grande di gradi di libertà che intervengono nella specificazione delle proprietà macroscopiche. È proprio tale separazione fra le scale che permette di fare previsioni precise sull'evoluzione di una realizzazione individuale tipica di un sistema macroscopico, il cui comportamento, in realtà, è irreversibile. Come è stato detto succintamente da James C. Maxwell nella sua importante opera del 1872 Theory of heat, "la seconda legge della termodinamica deriva dalla nostra esperienza che si fonda sul comportamento di corpi formati da un numero immenso di molecole; tuttavia, essa è continuamente violata [...] quando si tratti di un gruppo sufficientemente piccolo di molecole [...]. Quando tale numero [...] aumenta [...] la probabilità di una variazione misurabile [...] può considerarsi praticamente come impossibile".
I vari ensemble usati comunemente in meccanica statistica devono essere considerati soltanto come strumenti matematici per descrivere un comportamento che è praticamente identico per 'quasi tutti' i singoli sistemi macroscopici nell'insieme. Per quanto questi strumenti siano estremamente utili e alcuni dei teoremi che li coinvolgono siano molto eleganti, essi non vanno confusi con ciò che realmente avviene in un singolo sistema, il che equivarrebbe a confondere le immagini con la realtà. Inoltre, il comportamento asimmetrico nel tempo che si manifesta nella singola evoluzione tipica di un sistema macroscopico distingue l'irreversibilità macroscopica da quel tipo di evoluzione mescolante degli insiemi che si manifesta anche nel comportamento caotico di sistemi che hanno solo un piccolo numero di gradi di libertà, come per esempio due sfere rigide in una scatola. Chiamare irreversibile questo tipo di dinamica è pertanto fonte di confusione.
Il problema dell'irreversibilità macroscopica
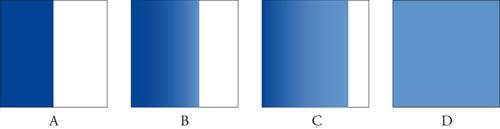
Consideriamo un sistema macroscopico che si evolva nel tempo come quello rappresentato schematicamente nella fig. 1 dalle immagini di un sistema binario, e composto da due inchiostri di diverso colore. Le quattro immagini della figura rappresentano le concentrazioni locali dei due componenti a tempi diversi. Supponiamo di sapere che il sistema è stato isolato durante tutto il tempo in cui sono state riprese le immagini e poniamo che ci si chieda di identificare l'ordine temporale in cui le immagini sono state riprese. La risposta ovvia, basata sull'esperienza, è che il tempo aumenta andando dalla fig. 1A alla fig. 1D. Ci piacerebbe poter dimostrare che questa risposta discende direttamente dalle leggi microscopiche della natura ma non è così, perché secondo le leggi microscopiche che conosciamo se è permessa la sequenza che va da A verso D lo è anche quella che va da D verso A.
Ciò si vede facilmente nella meccanica classica, dove lo stato microscopico di un sistema isolato classico di N particelle è rappresentato da un punto X=(r1,v1,r2,v2,…,rN,vN) nello spazio delle fasi Γ, dove ri e vi sono la posizione e la velocità della i-esima particella. Chiaramente, le immagini della fig. 1 non specificano in maniera completa il microstato X del sistema; ciascuna figura fornisce una descrizione grossolana di X che denoteremo con M(X) e chiameremo macrostato corrispondente a X. Per esempio, se supponiamo che ciascuna immagine della fig. 1 rappresenti un litro di liquido, ognuna potrebbe essere suddivisa in un miliardo di piccoli cubi, e allora il macrostato M specificherebbe semplicemente (entro un certo margine di errore) la frazione di particelle di ciascun tipo in ogni cubo j, j=1,…,109. A ciascun macrostato M corrisponde un gran numero di microstati contenuti in una regione ΓM nello spazio delle fasi Γ. Per specificare adeguatamente la regione ΓM occorre conoscere anche l'energia totale E, nonché ogni altra costante del moto macroscopicamente rilevante, per esempio additiva (anch'essa entro un certo margine di errore). Benché una tale specificazione dello stato macroscopico contenga evidentemente elementi di una certa arbitrarietà, questo per ora non ci deve preoccupare. Tutte le affermazioni qualitative che faremo sull'evoluzione nel tempo dei macrostati M sono sostanzialmente indipendenti dalla loro definizione precisa, purché le scale macroscopiche e microscopiche siano ampiamente separate.
Consideriamo ora l'evoluzione temporale dei microstati corrispondente a quella dei macrostati M(X); l'evoluzione dei microstati è governata dalla dinamica hamiltoniana che connette un microstato X(t0) al tempo t0 a un microstato X(t) al tempo t. Chiamiamo X(t0) e X(t0+τ), τ>0, questi due microstati; invertendo (fisicamente o matematicamente) tutte le velocità al tempo t0+τ otteniamo un nuovo microstato. Se ora seguiamo l'evoluzione durante un nuovo intervallo τ, arriviamo a un microstato al tempo t0+2τ che è esattamente lo stato X(t0) con tutte le velocità invertite. Indicheremo con RX il microstato ottenuto da X invertendo tutte le velocità, RX=(r1,−v1,r2,−v2,…,rN,−vN). Ritornando ora alle immagini della fig. 1, è chiaro che esse rimarrebbero immutate se invertissimo le velocità di tutte le particelle; perciò, se X appartiene a ΓM anche RX appartiene a ΓM. Appare ora chiaramente quale sia la difficoltà di assegnare un ordinamento temporale definito alle immagini della figura: dire che un macrostato M1 al tempo t1 si evolve verso un altro macrostato M2 al tempo t2=t1+τ, τ>0 significa che vi è un microstato X in ΓM1 che dà origine a un microstato Y a t2 con Y in ΓM2. Ma allora RY è anch'esso in ΓM2 e seguendo l'evoluzione di RY per un tempo τ si otterrebbe lo stato RX che sarebbe allora in ΓM1. Perciò, dal punto di vista delle leggi della meccanica (che qui supponiamo siano le leggi della natura), la serie di immagini che rappresentano MA, MB, MC e MD nella fig. 1 potrebbero corrispondere a sequenze temporali che vanno in ambedue le direzioni. È perciò chiaro che la nostra assegnazione dell'ordine temporale alle immagini della fig. 1 non è basata soltanto sulle leggi dinamiche dell'evoluzione, che sono compatibili con entrambi gli ordinamenti temporali, ma è piuttosto basata sull'esperienza: una direzione è quella usuale che facilmente s'indovina, mentre l'altra non la si vede mai. Si pone quindi il problema di spiegare la ragione di ciò.
La risposta di Boltzmann
Questa domanda fu posta per la prima volta dai fisici teorici, che ne diedero anche la risposta, nella seconda metà del XIX sec., quando gli esperimenti di James P. Joule e di altri avevano già dimostrato l'applicabilità delle leggi della meccanica ai fenomeni termici. Gli scienziati che maggiormente contribuirono a questo problema furono Maxwell, Thomson e Boltzmann. Un'esauriente risposta qualitativa al problema venne fornita da Thomson nel bellissimo articolo del 1875; per quanto mi risulta, né Boltzmann né altri autori citano mai questo articolo, che avrebbe potuto o dovuto chiarire molte incomprensioni. Tale risposta può venir riassunta con una citazione di J. Willard Gibbs (1876) apparsa sul risvolto di copertina del secondo volume delle lezioni di Boltzmann sulla teoria cinetica dei gas: "In altre parole, l'impossibilità di una diminuzione non compensata di entropia sembra ridursi all'improbabilità". Il significato di questa teoria statistica può essere meglio compreso associando a ogni macrostato M, e perciò a ogni punto nello spazio delle fasi che dà origine a M, una entropia di Boltzmann definita da:
[1] SB(M) = klog∣ΓM∣
dove k è la costante di Boltzmann e ∣ΓM∣ è il volume dello spazio delle fasi associato al macrostato M, cioè ∣ΓM∣ è l'integrale dell'elemento di volume di Liouville invariante nel tempo
[2] formula
esteso a ΓM (SB è definita a meno di costanti additive).
La geniale intuizione di Boltzmann consistette nel connettere direttamente questa funzione SB(M(X)), definita microscopicamente, con l'entropia termodinamica di Clausius, Seq, che è una proprietà estensiva dei sistemi macroscopici in equilibrio definita macroscopicamente e operativamente misurabile (a meno di costanti additive). Per un sistema in equilibrio con una data energia E (definita con un certo margine di errore), un volume V e un numero di particelle N, Boltzmann dimostrò che
Seq(E,V,N) = Nseq(e,n) ≅ SB(Meq)
[3]
con e = E/N, n = N/V
dove Meq(E,V,N) è il macrostato all'equilibrio (corrispondente a MD nella fig. 1). Con il simbolo ≅ intendiamo che per grandi N, cioè tali che il sistema sia realmente macroscopico, l'uguaglianza valga a meno di termini trascurabili quando si dividano i due membri dell'equazione [3] per N e si sia fissata opportunamente la costante additiva. È importante che le celle usate per definire Meq contengano molte particelle, cioè che la scala macroscopica sia molto grande rispetto a quella microscopica.
Se si accetta questa identificazione, si può usare l'equazione [1] anche per definire l'entropia (macroscopica) per sistemi non interamente all'equilibrio e identificare così gli aumenti di tale entropia con gli aumenti del volume della regione dello spazio delle fasi ΓM(X). Questa identificazione spiega in maniera naturale l'osservazione contenuta nella seconda legge della termodinamica, secondo la quale quando si rimuove un vincolo da un sistema macroscopico isolato, esso si evolve verso uno stato con entropia maggiore. Più precisamente: supponiamo che inizialmente vi sia una parete che divide i riquadri della fig. 1 e che questa venga rimossa al tempo tA. Il volume dello spazio delle fasi che il sistema ha a disposizione quando si rimuove la parete è enormemente aumentato: per esempio, se il sistema nella fig. 1 contiene una mole di fluido in un contenitore da un litro, il rapporto fra il volume della regione senza vincoli e quello della regione vincolata è dell'ordine di 2N, ossia 101020, approssimativamente uguale al rapporto ∣ΓMD∣/∣ΓMA∣.
Possiamo perciò prevedere che, quando si rimuove la parete, il moto del punto X dello spazio delle fasi avverrà con altissima probabilità verso regioni dello spazio delle fasi divenute in tal modo accessibili, per le quali ∣ΓM∣ è grande. Ci si può dunque attendere che questo moto continui fino a che X(t) raggiunga ΓMeq, corrispondente al fatto che il sistema si trova ora nello stato di equilibrio senza vincoli. Dopo tale istante possiamo attenderci di vedere soltanto piccole fluttuazioni attorno all'equilibrio macroscopico, la cui ampiezza è tipicamente dell'ordine della radice quadrata del numero delle particelle interessate. Va sottolineato che un elemento importante di questa analisi è la costanza nel tempo del volume di Liouville degli insiemi nello spazio delle fasi Γ. Senza tale invarianza la connessione tra volume dello spazio delle fasi e probabilità diverrebbe impossibile o almeno molto problematica.
Naturalmente, se il nostro sistema rimane isolato per sempre, in base al teorema della ricorrenza di Poincaré il punto dello spazio delle fasi X(t) dovrebbe ritornare molto vicino al suo valore iniziale X(tA) e anzi ci ritornerebbe un numero infinito di volte. Tuttavia, i tempi di ricorrenza di Poincaré sono talmente grandi (più o meno dell'ordine del rapporto ∣ΓMD∣/∣ΓMA∣) che quando Zermelo avanzò questa obiezione alla spiegazione di Boltzmann della seconda legge, quest'ultimo rispose nelle Vorlesungen über Gastheorie: "Il teorema di Poincaré, che Zermelo spiega all'inizio del suo articolo, è certamente corretto, ma non la sua applicazione alla teoria del calore [...]. Perciò quando [...] Zermelo, dal fatto teorico che gli stati iniziali in un gas devono essere ricorrenti ‒ senza aver calcolato il tempo necessario perché ciò avvenga ‒ conclude che le ipotesi della teoria dei gas debbano essere scartate o per lo meno cambiate in maniera fondamentale, si comporta come un giocatore di dadi che, avendo calcolato che la probabilità di una sequenza di mille uno non è uguale a zero, concludesse che il suo dado deve essere truccato perché non ha ancora osservato una tale sequenza!".
Va notato che nello stesso articolo Boltzmann ha scritto anche: "Analogamente si osserva che le particelle molto piccole in un gas compiono dei moti che derivano dal fatto che la pressione sulla superficie delle particelle può fluttuare". Ciò mostra che Boltzmann aveva compreso perfettamente la causa del moto browniano dieci anni prima del famoso articolo di Albert Einstein sull'argomento. È sorprendente che egli non abbia mai menzionato questo fenomeno nelle sue discussioni con Friedrich W. Ostwald e Ernst Mach sulla reale esistenza degli atomi. Perciò non soltanto le profonde intuizioni di Boltzmann danno un'interpretazione microscopica della misteriosa entropia termodinamica di Clausius, ma esse forniscono anche una generalizzazione naturale dell'entropia agli stati macroscopici di non equilibrio M e perciò una spiegazione della seconda legge della termodinamica, cioè l'espressione formale dell'evoluzione asimmetrica nel tempo degli stati microscopici che si verifica in natura.
L'uso della probabilità
Le idee di Boltzmann, come dice David Ruelle, sono al tempo stesso semplici e molto acute: esse introducono nelle leggi della natura la nozione di probabilità, che almeno a quell'epoca era del tutto estranea al pensiero scientifico. Infatti, fino a quel momento si supponeva che le leggi scientifiche valessero senza alcuna eccezione e non soltanto quasi sempre: invero non si conoscevano (né si conoscono tuttora) eccezioni alla seconda legge e neppure ci aspettiamo di vederne nel prossimo "milione di anni", come dice Richard P. Feynman molto prudentemente. La ragione di questo, come avevano compreso Maxwell, Thomson e Boltzmann, sta nel fatto che per un sistema macroscopico la frazione di microstati la cui evoluzione conduce a macrostati con un'entropia SB maggiore è talmente vicina a uno (in termini del loro volume di Liouville), che tale comportamento è esattamente quello che ci appare debba avvenire sempre. Per usare le parole di Boltzmann (1896-1898): "La legge di Maxwell della distribuzione delle velocità fra le molecole di un gas non è in alcun modo un teorema della meccanica usuale che possa essere dimostrato soltanto a partire dalle equazioni del moto; al contrario, si può soltanto dimostrare che è altamente probabile e che per un gran numero di molecole tutti gli altri stati hanno in confronto una probabilità talmente piccola da poter venir trascurata a tutti i fini pratici". Usando il linguaggio matematico moderno, diremmo che tale comportamento è tipico, intendendo così che l'insieme dei microstati X in ΓMA in cui si riscontra tale comportamento occupa una frazione di volume che tende a uno al crescere di N. Perciò nella fig. 1 la sequenza che va da A verso D è tipica per un punto dello spazio delle fasi in ΓMA, mentre quella che va da D verso A ha una probabilità che tende a zero rispetto a una distribuzione uniforme in ΓMD quando N tende all'infinito.
Si noti che l'argomento di Boltzmann non richiede effettivamente l'ipotesi che il sistema macroscopico debba trovarsi su lunghi periodi di tempo in regioni diverse ΓM, cioè in stati macroscopici diversi M per frazioni di tempo esattamente uguali al rapporto fra ∣ΓM∣ e il volume totale dello spazio delle fasi corrispondente alla sua energia. Tale comportamento, che può essere considerato come una forma debole dell'ipotesi ergodica di Boltzmann ‒ debole perché applicata soltanto a quelle regioni dello spazio delle fasi che rappresentano macrostati ΓM ‒ sembra del tutto plausibile quando non vi siano costanti del moto che scompongono la superficie dell'energia in regioni con stati macroscopici diversi. Esso appare ancora più plausibile se si tiene conto del fatto che in pratica l'isolamento perfetto non esiste. Le piccole fluttuazioni dall'equilibrio che ne conseguono sono certamente compatibili con le osservazioni (anche la forma forte dell'ipotesi ergodica sembra essere un'ipotesi naturale per sistemi macroscopici e permette di derivare in maniera semplice molte delle loro proprietà di equilibrio).
Condizioni iniziali
Una volta accettata la spiegazione statistica del perché un sistema macroscopico evolva in maniera tale che SB cresca col tempo, resta ancora lo spinoso problema (del quale Boltzmann era ben consapevole) di che cosa si intenda con l'espressione "col tempo". Poiché le leggi della dinamica microscopica sono simmetriche, le due direzioni della variabile temporale sono a priori equivalenti e tali devono rimanere anche a posteriori. In particolare, se un sistema con un profilo di densità macroscopico non uniforme, per esempio MB al tempo tB nella fig. 1, avesseun microstato che è tipico per ΓMB, allora quasi sicuramente il suo macrostato sarebbe del tipo di MC sia al tempo tB+τ sia al tempo tB−τ. Ciò è inevitabile: poiché la regione nello spazio delle fasi ΓMB, corrispondente a MB a un dato tempo tB, è invariante sotto la trasformazione X→RX, si deve prevedere lo stesso sia per tB−τ che per tB+τ. Tuttavia, l'esperienza dimostra che l'ipotesi di tipicità al tempo tB conduce al comportamento corretto soltanto per tempi t>tB e non per tempi t〈tB. In particolare, dati soltanto MB e MC, non abbiamo alcuna esitazione a situare MB prima di MC.
Se ragioniamo più a fondo su come stabiliamo l'ordine di MB e MC, ci accorgiamo che esso sembra derivare dalla nostra ipotesi che MB sia esso stesso così improbabile che deve essersi evoluto da uno stato iniziale di entropia ancora minore, come MA. Da un microstato iniziale tipico del macrostato MA, che può facilmente essere creato sperimentalmente, otteniamo il comportamento monotono di SB con l'ordinamento temporale MA, MB, MC e MD. Se invece il sistema nella fig. 1 fosse stato completamente isolato per un tempo molto lungo rispetto al suo tempo di rilassamento idrodinamico, allora ci aspetteremmo di trovarlo sempre nel suo stato di equilibrio MD (eventualmente con alcune piccole fluttuazioni intorno a esso). Messi di fronte alle quattro figure, in questo caso (estremamente improbabile) non avremmo invece alcuna base per assegnare loro un ordine; la reversibilità microscopica ci assicura che le fluttuazioni attorno all'equilibrio sono tipicamente simmetriche negli intorni degli istanti in cui vi è un minimo locale di SB. In assenza di qualsiasi conoscenza sulla storia del sistema prima e dopo la sequenza di immagini della fig. 1, usiamo la nostra esperienza per concludere che lo stato di bassa entropia MA doveva essere uno stato iniziale preparato. Come dice Roger Penrose in The Emperor's new mind (1989): "La asimmetria temporale deriva soltanto dal fatto che il sistema è partito in uno stato molto particolare (cioè di bassa entropia) e, avendo fatto partire il sistema da questo stato, abbiamo osservato la sua evoluzione nella direzione futura".
La questione è che un microstato corrispondente a MB (al tempo tB) che deriva da MA (al tempo tA) deve esserein qualche modo atipico per i punti in ΓMAB. Ciò avviene perché, in virtù del teorema di Liouville, l'insieme ΓMAB di tutti questi punti nello spazio delle fasi ha un volume ∣ΓMAB∣≤∣ΓMA∣ che è di gran lunga minore di ∣ΓMB∣. Tuttavia ciò non impedisce alla stragrande maggioranza dei punti in ΓAB (rispetto alla misura di Liouville su ΓAB, che è la stessa della misura di Liouville su ΓMA) di avere macrostati futuri come quelli tipici di ΓMB, nonostante che questi ultimi siano molto particolari e non rappresentativi di ΓB per quanto riguarda i loro macrostati passati. Questo comportamento è stato esplicitamente dimostrato da Oscar E. Lanford nella sua deduzione dell'equazione di Boltzmann ed è implicito in tutte le deduzioni delle equazioni idrodinamiche. Per renderci conto intuitivamente della sua origine, osserviamo che, per sistemi con interazioni realistiche, il dominio ΓMAB risulterà così convoluto da essere essenzialmente denso in ΓMB, sicché ogni suo minimo ispessimento copre tutto ΓMB. Non è perciò irragionevole attendersi che il loro comportamento futuro, per quanto riguarda i macrostati, risulterà sostanzialmente inalterato dalla loro storia passata. Ciò può essere dimostrato completamente per un modello di sistema macroscopico in cui ognuno degli N (N molto grande) atomi non interagenti sia specificato non da (r,v) ma da σ=(…,σ−2,σ−1;σ0,σ1,…), cioè da una sequenza bilatera infinita di 0 e 1 (in modo equivalente a un punto in un quadrato unitario). La loro dinamica con tempo discreto è quella di una traslazione a sinistra (Tσ)i=σi+1 (detta talvolta la trasformazione del fornaio). Se definiamo l'inversione delle velocità con (Rσ)i=σ−i−1 e il macrostato M(σ) con k valori M(σ)=(σ0+σ−1,σ1+σ−2,σ2+σ−3,…,σk−1+σ−k), si può facilmente dimostrare che il comportamento futuro dei punti tipici in ΓMAB è in effetti quello descritto più sopra.
Irreversibilità e stabilità macroscopica
Naturalmente la meccanica non impedisce l'esistenza di un microstato X per il quale SB (M(Xt)) decresce al crescere di t. Uno sperimentatore potrebbe, in linea di principio, invertire tutte le velocità del sistema nella fig. 1B e osservare poi il sistema che si separa. Sembra tuttavia impossibile farlo in pratica: anche se si riuscisse a invertire perfettamente le velocità, come avviene in maniera imperfetta negli esperimenti di eco di spin, non dovremmo attenderci di vedere il sistema della fig. 1 passare da MB a MA, cosa per la quale sarebbe necessario che sia l'inversione delle velocità sia l'isolamento del sistema siano assolutamente perfetti. La ragione per cui una tale perfezione è necessaria in questa situazione e non nella precedente consiste nel fatto che il comportamento macroscopico di un sistema, con un microstato Y nello stato MB che proviene da un microstato X tipico per ΓMA, è stabile rispetto alle perturbazioni per quanto riguarda il suo futuro, mentre è molto instabile rispetto al suo passato (e perciò in relazione al futuro di RY, figg. 2 e 3).
L'analisi precedente è basata sull'ipotesi del tutto ragionevole che quasi ogni perturbazione del microstato Y tenda a renderlo più tipico nel suo macrostato M(Y ), che in questo caso è uguale a MB; la perturbazione perciò non interferisce con il comportamento tipico di ΓMB. D'altra parte, l'evoluzione in avanti dello stato imperturbato RY è, per costruzione, diretta verso volumi più piccoli dello spazio delle fasi ed è perciò atipica per ΓMB. Ciò significa che si richiede in questo caso una mira perfetta e perciò più facilmente deviata da perturbazioni anche assai piccole nell'inversione e/o da minime influenze esterne. Dopo un tempo molto breve, durante il quale SB decresce, le imperfezioni nell'inversione e le perturbazioni esterne, come quelle che provengono da un'esplosione solare, un terremoto stellare in una galassia distante (avvenuto molto tempo fa) o dal battere delle ali di una farfalla, la faranno crescere di nuovo. Ciò è in un certo senso simile a un flipper, in cui il giocatore deve mandare una biglia in una zona particolarmente piccola: per riuscire a mandarvi la biglia bisogna agire con grande precisione, ma basta pochissimo perché vada in zone più ampie. Per i sistemi macroscopici che stiamo considerando, la differenza fra le dimensioni relative delle regioni analoghe nello spazio delle fasi è incredibilmente più grande. A meno che vi sia una 'grande cospirazione', è possibile prevedere con sicurezza che il comportamento sarà in accordo con la seconda legge (a parte forse per tempi molto brevi).
Confronto fra le entropiedi Boltzmann e di Gibbs
Il punto di vista boltzmanniano, che si concentra sull'evoluzione di un sistema macroscopico particolare, è concettualmente diverso da quello gibbsiano, che prende in considerazione gli ensemble statistici. Questa differenza si manifesta in modo evidente quando si paragona l'entropia di Boltzmann ‒ definita nella [1] per un microstato X di un sistema macroscopico ‒ con l'entropia SG di Gibbs, più comunemente usata, definita per una densità di insieme ϱ(X) dalla relazione
[4] SG({ϱ}) = − k∫ϱ(X)[logϱ(X)]dX
dove ϱ(X) è la probabilità che lo stato microscopico del sistema si trovi nel volume dello spazio delle fasi dX e l'integrale è esteso a tutto lo spazio delle fasi Γ. Se ϱ(X) è l'ensemble microcanonico generalizzato associato al macrostato Me, cioè
[5] formula 0
altrimenti
allora si ha naturalmente
[6] SG({ϱM}) = klog∣ΓM∣ = SB(M).
Gli ensemble microcanonici generalizzati del tipo di ϱM(X), o la loro versione canonica, sono comunemente impiegati per descrivere sistemi in cui la densità delle particelle, la densità di energia e la densità di quantità di moto variano lentamente su scala microscopica e il sistema è, in ciascuna piccola regione macroscopica, in equilibrio alle densità locali prescritte, cioè quando si ha equilibrio locale. In questi casi SG({ϱM}) e SB(M) coincidono fra di loro e con l'entropia idrodinamica macroscopica. Si noti tuttavia che, a meno che il sistema sia in equilibrio completo e che non vi siano ulteriori cambiamenti sistematici in M o ϱ, l'evoluzione temporale di SG e SB è molto diversa. Com'è ben noto, dal fatto che il volume delle regioni dello spazio delle fasi rimane invariato nell'evoluzione temporale hamiltoniana (ancorché le loro forme cambino grandemente) segue che SG({ϱ}) non muta nel tempo fintantoché l'evoluzione di X è hamiltoniana, cioè se ϱ si evolve secondo l'equazione di Liouville; SB(M), invece, cambia grandemente. Perciò se consideriamo l'evoluzione dell'ensemble microcanonico corrispondente al macrostato MA nella fig. 1A, dopo che si è rimosso il vincolo, SG sarà inizialmente uguale a SB, ma successivamente SB crescerà mentre SG resterà costante. Pertanto, SG non può dare alcuna indicazione che il sistema stia evolvendo verso l'equilibrio.
Bibliografia
Boltzmann 1896: Boltzmann, Ludwig, Entgegnung auf die wärmetheoretischen Betrachtungen des Hrn. E. Zermelo, ‟Annalen der Physik und Chemie", 57, 1896, pp. 772-784.
Boltzmann 1896-1898: Boltzmann, Ludwig, Vorlesungen über Gastheorie, Leipzig, Barth, 1896-1898, 2 v. (trad. ingl.: Lectures on gas theory, Berkeley, University Press of California, 1964).
Broda 1955: Broda, Engelbert, Ludwig Boltzmann. Mensch, Physiker und Philosoph, Berlin-Wien, Deuticke, 1955 (trad. ingl.: Ludwig Boltzmann, man physicist philosopher, Woodbridge CT, Ox-Bow Press, 1983).
Brush 1965: Brush, Stephen G., Kinetic theory, Oxford, Pergamon, 1966.
Brush 1976: Brush, Stephen G., The kind of motion we call heat: a history of the kinetic theory of gases in the 19th century, Amsterdam, North-Holland, 1976.
Cohen, Tirring 1973: The Boltzmann equation: theory and applications, edited by Ezechiel G.D. Cohen and Walter E. Tirring, Wien, Springer, 1973.
De Masi, Presutti 1991: De Masi, Anna - Presutti, Errico, Mathematical methods for hydrodynamic limits, New York-Berlin, Springer, 1991.
Feynman 1965: Feynman, Richard P., The character of physical law, Cambridge-London, British Broadcasting Corporation, 1965 (trad. it.: La legge fisica, Torino, Bollati Boringhieri, 1971).
Feynman 1963-1965: Feynman, Richard P. - Leighton, Robert B. - Sands, Matthew, The Feynman lectures on physics, Reading (Mass.), Addison-Wesley, 1963-1965, 3 v. (trad. it.: La fisica di Feynman, Milano, Masson Italia, 1985, 3 v.).
Gallavotti 1995: Gallavotti, Giovanni, Ergodicity, ensembles, irreversibility in Boltzmann and beyond, "Journal of statistical physics", 78, 1995, pp. 1571-1789.
Gibbs 1876: Gibbs, J. Willard, On the equilibrium of heterogeneous substances, "Connecticut Academy transactions", 3, 1876, pp. 108-248 (ora in: The scientific papers of Willard Gibbs, New York, Dover, 1961, 2 v.; v. I, pp. 55-195).
Hahn 1950: Hahn, Erwin L., Spin echoes, "Physical review", 80, 1950, pp. 580-594.
Lanford 1981: Lanford, Oscar E., The hard sphere gas in the Boltzmann-Grad limit, "Physica A", 106, 1981, pp. 70-76.
Lebowitz 1988: Lebowitz, Joel L. - Presutti, Errico - Spohn, Herbert, Macroscopic models of hydrodynamic behavior, "Journal of statistical physics", 51, 1988, pp. 841-862.
Lebowitz 1993: Lebowitz, Joel L., Macroscopic laws, microscopic dynamics, time's arrow and Boltzmann entropy, "Physica A", 196, 1993, pp. 1-27.
Lebowitz, Spohn 1983: Lebowitz, Joel L. - Spohn, Herbert, On the time evolution of macroscopic systems, "Communications on pure and applied mathematics", 36, 1983, pp. 595-613.
Levesque, Verlet 1993: Levesque, Daniel - Verlet, Loup, Molecular dynamics and time reversibility, "Journal of statistical physics", 72, 1993, pp. 519-537.
Maxwell 1872: Maxwell, James C., Theory of heat, 3. ed., London, Logmans, 1872 (1. ed.: 1871).
Nadiga 1989: Nadiga, Balu T. - Broadwell, James E. - Sturtevant, Bradford, Study of a multispeed cellular automaton, in: Rarefied gas dynamics: theoretical and computational techniques, edited by Eric P. Muntz, David P. Weaverand, David H. Campbell, Washington D.C., American Institute of Aeronautics and Astronautics, 1989, pp. 155-170.
Penrose 1969: Penrose, Oliver, Foundations of statistical mechanics, Oxford-New York, Pergamon, 1969.
Penrose 1989: Penrose, Roger, The Emperor's new mind, Oxford-New York, 1989 (trad. it.: La mente nuova dell'Imperatore, Milano, Rizzoli, 1992).
Ruelle 1991: Ruelle, David, Hasard et chaos, Paris, Odile Jacob, 1991 (trad. it.: Caos e caso, Torino, Bollati Boringhieri, 1992).
Schrödinger 1944: Schrödinger, Erwin, What is life?, Cambridge, Cambridge University Press, 1944 (trad. it.: Che cos'è la vita?, Firenze, Sansoni, 1944).
Spohn 1991: Spohn, Herbert, Large scale dynamics of interacting particles, Berlin-London, Springer, 1991.
Thomson (Lord Kelvin) 1875: Thomson, William, The kinetic theory of the dissipation of energy, "Proceedings of the Royal Society of Edinburgh", 8, 1875, pp. 325-345.
Zhang 1992: Zhang, Shanmin - Maier, Beat H. - Ernst, Richard R., Polarization echoes in NMR, "Physical review letters", 59, 1992, pp. 2149-2151.