L'Ottocento: chimica. Analisi chimica
L'Ottocento: chimica. Analisi chimica
Analisi chimica
Il laboratorio chimico, così come lo si conosce oggi, è nato nel XIX sec., quando furono costruite le strutture dedicate alle operazioni chimiche e furono apportate modifiche agli edifici in funzione delle attività specifiche che vi venivano svolte, quali l'insegnamento, l'analisi, la ricerca avanzata e quella industriale. Anche le altre scienze, inoltre, si adeguarono al modello fornito dal laboratorio chimico che divenne il progenitore dei moderni laboratori fisici, biologici e di quelli dedicati alla ricerca e allo sviluppo industriale. Quando si esamina l'evoluzione del laboratorio chimico nell'Ottocento, si assiste alla creazione del luogo dove si pratica la moderna attività scientifica.
Se è vero che i laboratori e gli edifici a essi destinati si diffusero enormemente nel corso del secolo, anche le pratiche di laboratorio subirono un processo di modificazione diventando più complesse e specializzate. Mentre il chimico del XVIII sec. non aveva ancora piena coscienza di sé, i chimici del tardo Ottocento erano solitamente specializzati, per esempio nelle analisi, e magari focalizzati, in modo ancor più ristretto, nell'analisi dell'acqua o del cibo. Benché lo sviluppo della pratica di laboratorio di questo periodo sia parallelo a quello della chimica moderna, esso è stato quasi completamente trascurato dagli storici della chimica.
Il laboratorio chimico ottocentesco
Intorno al 1825 è possibile parlare di un laboratorio 'tipico' per gli scopi generali della chimica. Esso era costituito da una stanza rettangolare con un alto soffitto, ampie finestre disposte su una delle pareti più lunghe e, sul lato opposto, forni permanenti dotati di tubi interni che permettevano varie condizioni di riscaldamento, forni portatili, il bagno a sabbia riscaldato in maniera continua e l'apparecchiatura più antica, il bagno ad acqua o 'bagnomaria'. Una delle pareti più corte era occupata da scaffali per bottiglie e vasi contenenti le varie sostanze chimiche; l'altra da canali pneumatici ‒ uno dei quali probabilmente riempito con mercurio ‒ e altri apparecchi tra cui quello di Nooth per produrre e manipolare gas. Sotto la finestra si trovavano tavoli con cassetti nei quali erano riposti tappi di sughero, spaghi, carta gommata per le etichette e piccoli tubi di vetro. Il lavoro chimico di tipo generale veniva eseguito al tavolo mentre in una stanza adiacente erano conservate bilance e altri strumenti.
L'apparecchiatura corrente comprendeva una gran varietà di beute e palloni (tra cui la cucurbita e il matraccio); storte di vetro, terracotta e metallo, con e senza imboccatura tubolare; bottiglie di Woulfe con due e tre colli; mortai di diverse dimensioni, di pietra, di ceramica lucidata, di acciaio, di ottone, oppure di bronzo. I mortai di agata erano utilizzati per ridurre i solidi in polvere molto fine; quelli più grandi avevano il pestello sospeso per mezzo di una molla. Capsule e vetrini erano disponibili in varie dimensioni. Su un tavolo centrale oppure in una stanza vicina c'era una batteria e una macchina elettrostatica.
Questa disposizione generale venne modificata per effetto di diverse cause tra cui, una delle più importanti, fu determinata dalle esigenze introdotte dall'insegnamento della chimica. A metà del XIX sec., un laboratorio dedicato a tale scopo aveva banchi corti disposti ad angolo retto rispetto alle pareti più lunghe, un lungo corridoio centrale e forse due laterali per permettere i movimenti. Ogni banco era occupato da due o tre studenti per lato, a ciascuno dei quali erano forniti acqua e gas, mentre le apparecchiature concesse in prestito venivano riposte in armadietti collocati sotto i banchi; in una fila centrale di scaffali erano contenute le bottiglie dei reagenti.
Altre stanze di minori dimensioni erano utilizzate come magazzino delle sostanze chimiche ed eventualmente per ospitare una piccola biblioteca. Robert Bunsen (1811-1899), a Heidelberg, introdusse l'uso di una finestrella posta in alto nella parete di fondo del suo ufficio per controllare gli studenti che fu copiata da Henry E. Roscoe (1833-1915) a Manchester e da Peter P. Bedson (1853-1943) a Newcastle. Liebig utilizzò un paio di finestrelle di questo tipo a Giessen.
Imprese commerciali di analisi chimica fiorirono in tutte le più importanti città industriali della Gran Bretagna durante il XIX secolo. Spesso esse avevano obiettivi ristretti e talvolta si occupavano solamente di un unico tipo di campioni, come per esempio i minerali di manganese o il carbon fossile. Su alcune di queste, Alder Wright (1844-1894), un chimico che aveva acquisito una lunga esperienza in campo industriale, accademico e medico, in un articolo pubblicato nelle "Chemical News" del 1876 sentenziò in maniera molto critica: "Metodi accurati che richiedono tempo, manodopera e abilità vengono scartati a favore di test grossolani e rapidi; il lavoro viene portato a termine a una velocità pari a quella dei cavalli da corsa e senza la dovuta cura e attenzione; si presume che talvolta non venga eseguita alcuna prova e che i risultati siano semplicemente il frutto dell'immaginazione di colui che esegue le analisi" (p. 27).
Anche l'industria esercitò la propria influenza sul laboratorio. Le prime attività sugli alcali richiedevano una semplice stanza per eseguire i test, ma l'avvento dell'industria dei coloranti sintetici introdusse esigenze molto più sofisticate. Prodotti rivali dovettero essere esaminati e identificati e fu necessario provare nuove sintesi. Nacque così il laboratorio di ricerca industriale. Nel frattempo sia leggi e sia tasse resero necessario aprire laboratori specializzati per scopi legati alla riscossione di dazi doganali, imposte di consumo nonché a esami forensi.
Le tecniche fondamentali
Pesature accurate, distillazioni efficaci e chiusure ermetiche furono condizioni essenziali per lo sviluppo della pratica di laboratorio e dell'analisi chimica. Ciononostante il loro sviluppo fu relativamente lento e si protrasse per tutto l'Ottocento. L'appello di Antoine-Laurent Lavoisier (1743-1794) per giunti di vetro smerigliato non trovò risposta fino agli anni Trenta del Novecento; nel frattempo i chimici pratici provavano più passione per un buon tappo di sughero di quanto non ne sentissero per una teoria della valenza e ciò sembra correggere la nozione corrente secondo cui la teoria è quello che conta in chimica. La storia delle chiusure potrebbe essere usata come base per una storia evolutiva della disciplina.
Chiusure e connessioni
Sebbene i Romani fossero a conoscenza della possibilità di utilizzare sughero ricoperto da pece, il modo più comune di chiudere una beuta era rappresentato da un tappo di legno soffice ricoperto con una resina. I tappi di sughero divennero comuni nel Settecento, ma campioni di buona qualità erano sempre scarsi.
Prima che Carl Friedrich Mohr (1806-1879) inventasse uno strumento adatto, si utilizzavano due metodi per far passare un tubo di vetro attraverso il sughero. Il primo, utilizzato da Peter Woulfe (1727?-1803) nel suo apparecchio per la distillazione del 1767, prevedeva di limare un intaglio semicircolare o a 'V' in corrispondenza di un lato del sughero e sigillare l'intero giunto con una sostanza di consistenza simile a quella dello stucco chiamata luto. Il secondo metodo, descritto da Lavoisier e Michael Faraday (1791-1867), consisteva nel perforare il sughero con una bacchetta di acciaio incandescente, o con la punta aguzza di una lima, e nel rifinire il foro con una lima tonda. Gli attrezzi inventati da Mohr consentirono di risparmiare molto tempo in laboratorio, ma furono adottati molto lentamente e per decenni i cataloghi scientifici continuarono a pubblicizzare assortimenti di lime tonde per forare il sughero.
I tappi di gomma che furono realizzati dopo il brevetto, nel 1843, della vulcanizzazione della gomma da parte di Thomas Hancock (1786-1865) non meritano una particolare menzione. Lunghi tappi conici potevano essere acquistati ed essere tagliati in laboratorio in funzione delle diverse esigenze e necessità individuali.
Complesse serie di apparecchiature come gli impianti di distillazione di Woulfe o di Lavoisier-Hassenfratz presentavano il problema di unire le varie parti evitando le rotture dovute all'assenza di connessioni flessibili che impartissero mobilità ai diversi componenti della serie. A parte la possibilità di unire i giunti con un luto, c'erano due materiali che servivano per le connessioni e che erano particolarmente popolari: la carta gommata e le vescicole umidificate il cui ruolo è stato ben descritto da Faraday nella Chemical manipulation (1827).
Nel 1839 Charles Goodyear aveva realizzato i tubi vulcanizzati che furono largamente disponibili in commercio in Europa nel decennio successivo. Alcuni, tuttavia, trovavano che i tubi di gomma commerciale facessero meno presa sul vetro rispetto ai materiali più vecchi.
Per chiudere il giunto tra la storta e il serbatoio si impiegava il luto e poiché questo veniva in contatto con i prodotti di reazione, furono ricercati luti specializzati la cui preparazione divenne, tra la fine del XVIII e l'inizio del XIX sec., una parte fondamentale della pratica di laboratorio. Tra gli ingredienti preferiti dai chimici a questo scopo c'erano l'argilla di Storbridge, il formaggio, la terra argillosa, la farina, il crine di cavallo e l'olio di semi di lino. Jöns Jacob Berzelius (1779-1848) fornì la formula per dodici luti, tra cui due miscele a presa dura costituite da limatura d'acciaio miscelata con argilla, gesso, colla e latte, che però creavano problemi quando l'apparecchiatura doveva essere smontata. All'interno di questa tradizione tecnica, Faraday descrisse la preparazione del suo famoso cemento isolante: "Può essere costituito da 5 parti in peso di resina, una parte di cera gialla d'api, e una parte di ocra rossa oppure di rosso veneziano in polvere fine. La sostanza terrosa dovrebbe essere ben asciugata in una bacinella per l'evaporazione di Wedgewood oppure in un bagno a sabbia a una temperatura superiore ai 212 °F. La cera e la resina dovrebbero essere fuse assieme, e la polvere aggiunta e mescolata a poco a poco" (Faraday 1827 [1830, p. 473]).
Che non tutti fossero soddisfatti di questi metodi estremamente lunghi è indicato dalle parole di Lavoisier sulla necessità di giunti intercambiabili contenute nel suo Traité élémentaire de chimie: "Sarebbe di utilità infinita poter permettere ai chimici, specialmente quelli che si occupano di processi pneumatici, di poter evitare l'uso dei luti, o almeno diminuire il numero necessario in strumenti complicati. Una volta pensai di farmi costruire l'apparecchiatura in modo tale che tutte le sue parti fossero unite mediante guarnizioni di smeriglio, allo stesso modo delle bottiglie con i tappi di cristallo, ma l'esecuzione di un progetto di questo tipo si rivelò estremamente complicata" (Lavoisier 1789 [1965, pp. 411-412]).
Il primo sistema di giunti intercambiabili di vetro smerigliato per le vetrerie da laboratorio chimico fu realizzato, tuttavia, solo nel 1926, da Fritz Friedrichs (1885-1958), della Greiner & Friedrichs di Stützerbach in Turingia. Pochi anni dopo la maggior parte dei fornitori di apparecchiature scientifiche offrivano tipi limitati di vetrerie con giunti intercambiabili di vetro smerigliato e James A. Jobling di Sunderland fondò la Quickfit & Quartz Ltd. per sfruttare questo nuovo campo nel 1934. Passarono, comunque, altri due decenni prima che sistemi completamente intercambiabili di vetreria (che utilizzavano vetro Pyrex resistente al calore) fossero largamente disponibili e solamente negli anni Sessanta essi divennero di uso generale.
Bilance
All'inizio dell'Ottocento, la maggior parte dei chimici ancora utilizzava le semplici bilance a piatti degli orefici e dei negozianti medievali e questo conservatorismo sopravvisse in parte fino agli anni Settanta del XX secolo. Il XIX sec. fu comunque un periodo cruciale per lo sviluppo della bilancia chimica la cui precisione aumentò moltissimo nonostante le difficoltà presentate dalla lunghezza del giogo, che se indubbiamente rendeva più sensibile la bilancia, per la sua maggiore pesantezza era soggetto, prima di poter raggiungere l'equilibrio e determinare il peso, a lenti moti di dondolamento. Per migliorare il funzionamento del fulcro sul quale gira il cardine del giogo e i punti di contatto tra il fulcro e i piatti della bilancia, nel Settecento si incominciarono a usare lastrine e coltelli di acciaio temperato per il perno centrale; dopo il 1770 essi rimpiazzarono i ganci a 'collo di cigno' che fino a quel momento erano stati utilizzati per collegare il giogo e i piatti. Prima del 1800 diversi costruttori di strumenti, su istruzione dei loro clienti, tentarono di realizzare bilance molto precise in cui potessero trovar posto grandi pezzi di apparecchiatura; particolarmente importanti furono le bilance costruite nel 1788 da Jean-Nicholas Fortin (1750-1831) per Lavoisier e da Jesse Ramsden (1735-1800) per la Royal Society di Londra un anno più tardi.
Alla Royal Society era stato chiesto, da parte del governo, di determinare accuratamente il peso specifico delle bevande alcoliche in base al loro contenuto di alcol. Il suo segretario Charles Blagden (1748-1820) chiese a Ramsden ‒ già noto come costruttore di strumenti ‒ una bilancia che combinasse precisione e capacità di sostenere grossi pesi. A questo scopo Ramsden usò coni vuoti collegati alla base, che univano solidità e leggerezza, e introdusse l'agata come materiale per i piani, che fino ad allora erano di acciaio temperato. Lavoisier considerò questa la bilancia più accurata mai costruita e Blagden affermò che: "era così superiore in accuratezza a qualunque cosa potesse essere desiderata in questi esperimenti, al punto che la possibilità di errori nell'eseguire la pesata doveva essere considerata assolutamente fuori questione" (Blagden 1790, p. 340). Contrariamente alle altre, la bilancia di Ramsden era sistemata in una teca di mogano con i lati di vetro allo scopo di proteggerla da polvere, fumi chimici e correnti d'aria; l'utilizzazione della teca fu subito adottata per tutte le bilance chimiche.
Un'alternativa per rendere leggero il giogo fu trovata per la bilancia costruita da Jacob Bernhard Haas (1753-1828) e Johann Heinrich Hurter (1734-1799) per Martin van Marum (1750-1837) nel 1793. Essi rimossero tutti i materiali che non erano necessari a mantenerla rigida ottenendo il giogo reticolare, che aveva la forma di un diamante perforato.
Una bilancia molto simile fu utilizzata a Giessen più di quarant'anni dopo da Liebig, il quale la celebrò come: "quello strumento impareggiabile, che dà permanenza a ogni osservazione, elimina ogni ambiguità, stabilisce la verità, trova l'errore e ci mostra che ci troviamo sulla retta via" (Liebig 1851, lettera IX).
Il primo costruttore di strumenti a dedicarsi alla produzione di bilance di precisione fu il londinese Thomas C. Robinson (1792-1841) che, come Haas e Hurter, utilizzò un giogo reticolare, ma migliorò il progetto di base accorciando il giogo, che era estremamente delicato e aggiungendo un'intelaiatura di arresto che agiva da supporto. Egli inserì anche un puntatore centrale verticale e viti a ciascun capo del giogo che permettessero l'esecuzione di aggiustamenti minimi. Nel 1820 Robinson costruì una bilancia di questo tipo per William H. Wollaston (1766-1828), con coltelli di acciaio e un piano di agata, che venne copiata da altri costruttori per tutto il corso del XIX secolo.
Andrew Ure (1778-1857), professore di chimica al Mechanics Institute di Glasgow e chimico ufficiale dell'ufficio delle dogane e delle imposte del Regno Unito, utilizzò una bilancia simile a quella di Robinson, ma realizzata dai costruttori tedeschi di strumentazioni F.W. Breithaupt & Sohn. Essa era dotata di tre coltelli di acciaio temperato e di un piano di agata centrale.
Una caratteristica fondamentale delle prime bilance realizzate da Ludwig Oertling (1818-1893), un costruttore di strumenti tedesco emigrato a Londra nel 1841, fu l'uso dell'agata per i coltelli oltre che per i piani; tuttavia, essendo l'agata costosa, Oertling continuò ad avere bilance con lame di acciaio nei suoi cataloghi, anche se esaltava il valore di sistemi con coltelli-piani di agata, più resistenti all'azione degli agenti chimici e dell'umidità.
Oertling rese popolare anche il 'sistema a cavaliere' ‒ una staffa o un ago che scorre sulla parte superiore del giogo ‒ per sostituire i pesi molto piccoli difficili da usare e facilmente danneggiati o persi. Alla Great Exhibition del 1851 Oertling espose tre bilance e portò i più recenti progressi nella tecnologia di questo settore all'attenzione di un pubblico più ampio, che includeva anche molti chimici. Per i risultati conseguiti, specialmente per l''apparato scorrevole', gli fu assegnata la Council Medal dalla giuria.
Nel 1867 Paul Bunge (1839-1888), un ingegnere progettista di ponti, realizzò una bilancia innovativa con un giogo corto, che eliminava le oscillazioni associate ai gioghi lunghi. La sua idea fu ripresa da Florenz Sartorius (1846-1925), che, per costruire il giogo, utilizzò l'alluminio, molto leggero ma estremamente costoso. Una bilancia Sartorius costruita nel 1876 aveva un giogo di 5,5 pollici (14 cm ca.), coltelli di acciaio e piatti di agata e una risoluzione di 2 parti su 1 milione.
Un altro progresso rilevante fu rappresentato dalle bilance meccaniche a variazione di peso, introdotte dal viennese Albert Rueprecht (1833-1913) intorno al 1885. Sebbene non fossero ampiamente utilizzate, esse precorrevano le bilance ad anello che furono commercializzate all'inizio del XX sec. e usate nei laboratori chimici tra gli anni Trenta e Settanta del Novecento.
Distillazione e condensazione
La distillazione di liquidi volatili (e dei solidi da cui si ricavano liquidi) e la condensazione dei vapori che ne derivano è una delle operazioni più frequenti e importanti della chimica e se in questo contesto l'alambicco è considerato lo strumento simbolo dell'alchimia, quello che erroneamente viene chiamato 'condensatore di Liebig' riveste lo stesso ruolo per la moderna chimica organica. Poiché gli alambicchi erano costosi e delicati, veniva spesso utilizzata la storta, più semplice e particolarmente utile per la distillazione distruttiva (pirolisi) dei solidi. Di solito i vapori che uscivano dall'alambicco e dalla storta venivano condensati raffreddando il beccuccio di questi apparecchi all'aria oppure facendolo passare in un recipiente contenente acqua fredda. Un condensatore a spirale, detto 'serpentino' ‒ spesso di rame ‒ che poteva essere raffreddato ad aria o mediante un bagno in acqua divenne d'uso comune a partire dal Medioevo, specialmente per la produzione di acqua distillata.
L'idea di raffreddare un tubo condensatore con l'acqua fu avanzata per primo da Christian Weigel (1748-1831) nel 1771. L'acqua era convogliata in un tubo esterno di metallo che veniva sigillato con il gesso nella parte inferiore mentre quella superiore era lasciata aperta e il flusso dell'acqua aveva direzione opposta a quella del vapore condensante secondo il principio del flusso controcorrente dei condensatori moderni; prima dell'introduzione della rete idrica nei laboratori, a metà del XIX sec., l'acqua doveva essere versata da una cisterna in un imbuto. Nel 1836 Mohr sigillò le porzioni terminali dei tubi esterni con tappi di sughero mentre Liebig rese popolare quello che dal 1852 è appunto noto come 'condensatore di Liebig'. Fino ad allora, il condensatore era semplicemente un adattatore per storta raffreddato ad acqua. Nel catalogo del 1866 del fornitore di apparecchiature John J. Griffin (1802-1877) compare la manica esterna di vetro temperato e, nell'edizione del 1877, palloni a fondo rotondo sono congiunti per mezzo di un braccio laterale ai condensatori di Liebig per distillazione. Il condensatore sigillato tutto di vetro fu introdotto attorno al 1885.
L'era della 'piccola chimica': 1780-1830
Tra il 1780 e il 1830 i chimici si concentrarono sullo sviluppo di tecniche piccole, semplici e facilmente trasportabili, soprattutto analisi al cannello ferruminatorio e test alla fiamma, visto il diffondersi dell'interesse per la mineralogia, che era sostanzialmente analisi chimica sul campo. Nel periodo compreso tra i laboratori alchemici da un lato e il moderno laboratorio chimico dall'altro, nacque dunque l'esigenza di laboratori portatili che fossero relativamente economici e potessero essere utilizzati ovunque. Lo sviluppo di queste tecniche e dei laboratori portatili influenzò anche l'evoluzione dell'attrezzatura.
Accum e Londra
La carriera di Friedrich Christian Accum (1769-1838) sintetizza molte importanti caratteristiche dello sviluppo del laboratorio chimico. Queste includono il laboratorio privato utilizzato per l'insegnamento, le consulenze di tipo analitico su base commerciale e infine gli armadietti chimici frequentemente denominati, con qualche distorsione di linguaggio, 'laboratori portatili'.
Accum nacque vicino a Hannover, dove suo padre aveva un saponificio; ciò gli permise di crescere nell'ambiente della chimica tecnica. Nel 1793 si trasferì a Londra; in questa città entrò in contatto con Sir Anthony Carlisle (1768-1840), chirurgo di fama e pioniere dell'elettrolisi insieme a William Nicholson (1753-1815), e con Rudolph Ackerman (1764-1834), un progettista tedesco di carrozze diventato un commerciante d'arte di successo.
Nel 1800 Accum aprì un laboratorio a Soho, dove teneva lezioni di chimica, mineralogia e farmaceutica pratica, scrisse molti libri, condusse l'attività di consulente e di commerciante di materie e apparecchiature chimiche. Il corso di chimica da lui tenuto attrasse personalità di particolare rilievo. Accum raggiunse un uditorio più ampio quando gli fu assegnato un corso di chimica alla Surrey Institution. L'anfiteatro in cui si tenevano le lezioni, costituito da un piano terra, due gallerie e uno spazio con posti in piedi situato al di sotto della cupola di vetro attraverso la quale la stanza veniva illuminata, poteva contenere cinquecento ascoltatori, il che rendeva le sue dimensioni (ma non il suo status) confrontabile con quello della Royal Institution dove insegnava Humphry Davy (1778-1829). Accanto all'anfiteatro c'era un laboratorio, che serviva anche come stanza per preparare le lezioni.
Nel periodo del suo incarico alla Surrey Institution, Accum continuò ad amministrare la sua azienda di Soho e realizzò una serie di esperimenti sul cibo adulterato, raccolti nel Treatise on adulterations of food, and culinary poisons (1820). Interessato soprattutto agli adulteranti inorganici, Accum analizzò acqua, vini, birra, brandy, rum, gin, pane, tè, caffè, formaggio, pepe, aceto, panna, dolci, crema, salse, olio d'oliva, senape, funghi e sottaceti impiegando due dozzine di reagenti e denunciò chi commerciava cibi avariati, pubblicando i nomi e gli indirizzi dei negozi presso i quali erano stati acquistati i campioni; ciò contribuì probabilmente alla sua partenza frettolosa all'inizio del 1821 per Berlino dove divenne professore di chimica presso la Technische Schule, rinominata Gewerbe-Institut nel 1827.
Oltre all'analisi commerciale e investigativa, nel laboratorio di Accum si svolgeva attività di ricerca i cui risultati furono pubblicati nel "Nicholson's Journal". I suoi studi sulla produzione e l'uso del gas di carbone per illuminazione furono riassunti nel Practical treatise on gas lighting (1815), che per molto tempo fu il lavoro più importante su questo argomento e gli valse la nomina a 'chimico pratico' e poi a direttore della Gas Light and Coke Company.
L'azienda di Accum produceva 350 reagenti chimici e vendeva 300 pezzi di apparecchiatura di laboratorio, spesso sotto forma di armadietti chimici. In particolar modo riforniva i professori che tenevano dimostrazioni di storte, serbatoi per i distillati, recipienti per gas, pompe ad aria e pile voltaiche, oltre a un'ampia varietà di apparecchiature da bancone. Riceveva ordini da Yale, Harvard e dall'India. Accum si definiva 'chimico sperimentale', ma questo titolo non definisce a sufficienza l'acceso difensore dei cibi non adulterati, il tecnologo del gas di carbone, l'insegnante di successo, lo scrittore prolifico e l'uomo d'affari la cui capacità organizzativa era unica a quel tempo.
Il cannello ferruminatorio
Il cannello ferruminatorio per usi chimici ha una storia rispettabilmente antica come strumento artigianale di gioiellieri, smaltatori e orafi. Nel Settecento cominciò a essere usato nell'indagine sistematica dei minerali; la sua funzione era quella di concentrare e dirigere la fiamma attraverso uno sbuffo d'aria, e grazie a esso, nel 1751 Axel Frederik Cronstedt (1722-1765) riuscì a scoprire il nickel e, nel 1774, Johan Gottlieb Gahn (1745-1818) fu in grado di isolare il manganese.
All'inizio del XIX sec., i cercatori e i saggiatori di minerali sul campo, così come i chimici nel laboratorio, avevano a disposizione uno strumento affidabile e semplice grazie al quale erano in grado di esaminare i materiali inorganici. I fornitori di apparecchiature scientifiche cominciarono ben presto a offrire serie complete di accessori, ciascuna delle quali costituiva un vero e proprio laboratorio portatile. Lo strumento subì diverse modificazioni di forma, soprattutto finalizzate a bloccare l'umidità del fiato e adattarsi alla vista del ricercatore. Poiché la massima efficienza si otteneva mantenendo una corrente d'aria costante il ricercatore doveva imparare a respirare attraverso il naso e soffiare contemporaneamente dalla bocca. Quest'arte poteva essere imparata soltanto attraverso un insegnante poiché era quasi impossibile da descrivere per iscritto. Per affrontare questo problema furono messi sul mercato diversi attrezzi meccanici. Jean-Henri Hassenfratz (1755-1827) utilizzò un soffietto a piede, ma esso era troppo poco sensibile alle correzioni minime. Altri progetti prevedevano un serbatoio d'aria posto sul cannello oppure una sacca sistemata tra la bocca e il cannello, da tenere tra le ginocchia, che doveva essere schiacciata più o meno forte a seconda dell'intensità della corrente d'aria richiesta. Berzelius considerava con un certo disprezzo questi attrezzi, osservando come la loro stessa esistenza era la prova che coloro che li avevano inventati non avevano mai veramente imparato a usare il cannello.
Il campione da esaminare era solitamente collocato su un pezzo di carbonella nel quale veniva praticata una piccola depressione. Invece della carbonella, Torbern Olof Bergman (1735-1784) aveva usato un cucchiaio d'argento che si dimostrò troppo facilmente fusibile. Dopo che nel 1805 Wollaston aveva scoperto come preparare il platino in forma malleabile, il foglio di platino divenne un tipo di sostegno molto diffuso, sebbene potesse essere facilmente distrutto da arsenico, stagno o piombo eventualmente presenti nel campione. Gahn usò un filo di platino che Griffin suggerì di sigillare in un tubo da termometro di vetro, ottenendo in questo modo un arnese da laboratorio di utilità generale. Poiché la domanda di buona carbonella cominciava a superare l'offerta, Griffin preparò un blocco modellato ‒ utilizzando carbonella in polvere, carbonato di sodio, borace, frumento di riso e acqua, che entrò nell'uso comune via via che l'insegnamento della chimica era ammesso nelle scuole.
Con il cannello ferruminatorio era possibile ridurre un minerale a metallo, inoltre potevano essere preparati gli ossidi annotando il loro colore e, infine, ioni colorati potevano venire incapsulati in grani di borace, soda o fosfato. La prerogativa principale di questo strumento consisteva nel fatto che esso poteva essere utilizzato su un campione completamente ignoto senza alcuna classificazione preliminare; nessun altro metodo di investigazione ha fornito tante informazioni con così poca spesa.
Verso la 'microanalisi'
Sebbene Johann Joachim Becher (1635-1682), fondatore della teoria del flogisto, abbia dedicato le prime pagine del Tripus Hermeticus (1680) alla descrizione del laboratorium portatile, il vero laboratorio portatile entrò nell'uso alla fine del XVIII secolo. Si trattava sostanzialmente di un prodotto della chimica 'economica' di quel periodo. I primi chimici e i loro predecessori avevano usato reagenti in quantità generose e fornaci, storte e alambicchi di grandi dimensioni; quelli del periodo illuminista e immediatamente successivi preferirono lavorare su una scala più piccola e servirsi di utensili casalinghi come lampade ad alcol, bicchieri di vetro, piattini, scodelle, caraffe. Il laboratorio portatile era uno sviluppo di questa tendenza.
L'impiego crescente del laboratorio portatile nelle scuole e nelle università riflette la progressiva istituzionalizzazione della chimica e dell'educazione scientifica a metà del XIX sec.; al tempo stesso, il modus operandi fu anche influenzato dall'insegnamento della chimica pratica in laboratori permanenti. All'Università di Edimburgo, negli anni Trenta dell'Ottocento, David Boswell Reid (1805-1863) cercò di rendere più economico l'insegnamento della chimica riducendo la scala sulla quale venivano eseguiti gli esperimenti: introdusse l'uso degli spot tests su piastrine di vetro e banconi di laboratorio con bruciatori a gas greggio che l'insegnante controllava dal fondo. Gli armadietti chimici utilizzati nei corsi universitari promuovevano, oltre a riflettere, un cambiamento decisivo nella pratica chimica: si cominciava a lavorare impiegando modeste quantità di reagenti in apparecchiature di piccola scala. Questa tendenza a preferire la microanalisi e la chimica micropreparativa accelerò con l'appropinquarsi del XX sec., assistita dall'esperienza crescente dei costruttori di strumentazioni.
L'introduzione dei laboratori scolastici, incoraggiati dalla Devonshire Commission del 1870, e il fatto che la chimica fu resa professionale in laboratori universitari appositamente costruiti fecero sì che, dopo il 1870, i corredi chimici divenissero meno elaborati e più economici.
Test alla fiamma
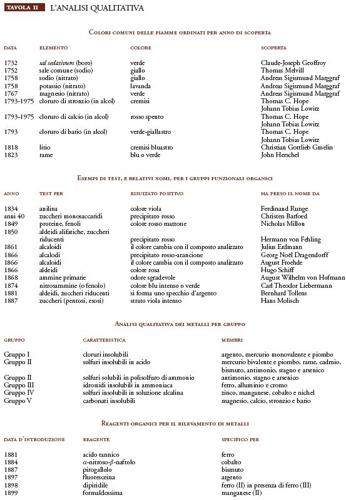
Se il sale di un metallo, come il cloruro di litio, viene portato su una fiamma sufficientemente calda, questa assume un colore cremisi bluastro. Non tutti i metalli hanno un colore proprio alla fiamma, tuttavia, un numero significativo di essi mostra questa proprietà, soprattutto gli alcali e i metalli alcalino terrosi; il più noto, e certamente il più diffuso, è il colore giallo vivo del sodio. Thomas Melvill (1726-1753) nel 1752 notò che il sale comune in alcol produceva questa fiamma gialla monocromatica, si accorse però che moltissimi materiali danno tale colore (probabilmente per contaminazione con piccole quantità di sali di sodio). Poiché Melvill era alla ricerca di una sorgente di luce monocromatica, non collegò il colore con il metallo. Sei anni più tardi, Andreas Sigismund Marggraf utilizzò la fiamma di color giallo e quella più delicata color lavanda del potassio per distinguere i nitrati dei due metalli. La fiamma verde del boro, in forma di soluzione alcolica di sal sedativum (acido borico), era stata registrata già nel 1732 da Claude-Joseph Geoffroy il giovane.
Nel 1823 John Herschel (1792-1871) ipotizzò che questi colori fossero provocati dai sali vaporizzati e che le fiamme assumessero la colorazione gialla quando erano molto calde ma anche lui, come Melvill, stava cercando sorgenti di luce monocromatica. William H.F. Talbot (1800-1877), noto soprattutto per essere un pioniere della fotografia, fu il primo a suggerire di aggiungere l'analisi dei colori della fiamma alle analisi chimiche qualitative e, nel 1834, a osservare la fiamma attraverso un prisma: fu in questo modo in grado di distinguere in base ai loro spettri il litio dallo stronzio (che hanno colori alla fiamma simili).
Entro il 1820 i colori della fiamma più comuni erano stati ormai tutti rilevati, ma l'uso di questo tipo di analisi si affermò lentamente, sebbene John G. Children (1777-1852) la menzionasse nella sua traduzione inglese di un capitolo del Traité de chimie élémentaire théorique et pratique (1817-1818) di Louis-Jacques Thenard dal titolo Essay on chemical analysis (1819). Ciò è motivato dal fatto che i test alla fiamma erano appropriati solamente per un piccolo gruppo di metalli mentre al contrario i metodi di precipitazione sviluppati nel terzo e nel quarto decennio dell'Ottocento potevano essere applicati a quasi tutti i metalli e i metalloidi. Nel periodo precedente lo sviluppo del bruciatore Bunsen erano facilmente disponibili soltanto fiamme relativamente fredde e, come scoperto da Herschel, la contaminazione con tracce di sodio era un evento comune. L'uso oggi ben noto di un filtro in vetro blu di cobalto per rilevare il potassio in presenza di tracce di sodio fu introdotto relativamente tardi da Rowlandson Cartmell nel 1858.
Analisi volumetrica
Il medico scozzese Francis Home (1720-1813) adottò nel 1856 una procedura volumetrica per determinare la quantità di potassa nelle ceneri di legno utilizzate nella manifattura del vetro e in agricoltura. Il punto finale della reazione corrispondeva alla cessazione dell'effervescenza e Home contò il numero di cucchiaini da tè di acido solforico diluito necessari a ottenerla.
Nel 1785 il farmacista Henri Descroizilles (1751-1825) misurò la forza delle soluzioni di cloro per il candeggio ‒ che all'epoca erano state appena introdotte ‒ notando il volume di indaco, o di soluzione di colorante alla coccinella, che il candeggiante era in grado di decolorare; la sua apparecchiatura era costituita da una bottiglia con una scala graduata di carta. Infine, nel 1806, stabilì alcuni metodi per le titolazioni acido-base, usando sciroppo di violette come indicatore colorimetrico.
Solitamente si ritiene che l'analisi titrimetrica nel suo aspetto moderno abbia avuto inizio con Joseph-Louis Gay-Lussac (1778-1850), il quale intraprese questa attività per conto di una commissione del governo francese che si occupava di polvere da sparo e per la Zecca. Gay-Lussac saggiò l'argento dissolvendolo in acido nitrico e mettendolo in una soluzione standard di cloruro di sodio fino alla cessazione della precipitazione del cloruro d'argento. Per effettuare questa e altre determinazioni titrimetriche Gay-Lussac progettò una buretta, caratterizzata da un tubo capillare estremamente fragile che richiedeva caute manipolazioni. Una buretta più robusta, adatta alle condizioni ambientali che si potevano trovare nell'industria degli alcali, all'epoca in pieno sviluppo, fu progettata da Christopher Binks, un costruttore di apparecchiature chimiche del Sunderland. Entrambe le burette venivano utilizzate chiudendo il foro che permette al liquido di uscire goccia a goccia, ma era necessario riportarle in posizione verticale per leggere il volume e tale operazione spesso provocava la formazione di una goccia che scendeva all'esterno.
La buretta moderna, utilizzata e letta in posizione verticale, fu inventata nel 1855 da Carl Friedrich Mohr (1806-1879). Egli dapprima utilizzò un tubo diritto chiuso da un rubinetto di vetro, che però veniva attaccato dalle soluzioni alcaline; sostituì allora il tappo con un tubo di gomma unito a uno di vetro e, per aprire e chiudere il flusso di liquido, adottò un morsetto a pizzico di filo d'ottone, al posto del quale Bunsen usò poi un morsetto a vite. La buretta di Mohr, pur presentando molti vantaggi, non prese immediatamente il posto di quelle di Gay-Lussac e Binks, tanto che trent'anni più tardi tutte e tre si potevano ancora trovare nel catalogo di apparecchiature chimiche di Griffin.
Gli anni intorno alla metà del XIX sec. furono fruttuosi per la titrimetria. Nel 1846 Frédéric Margueritte introdusse l'uso del permanganato di potassio per la titolazione del ferro (II). Se il ferro si fosse già trovato nello stato ossidato, esso si sarebbe dovuto ridurre; al fine di prevenire la riossidazione Bunsen inventò una valvola che serviva a evitare l'ingresso dell'aria.
Nel 1850 Frederick Penny (1816-1869) introdusse l'uso del dicromato di potassio per la titolazione del ferro e nel 1853 Bunsen cominciò a usare soluzioni di iodio. Nessuna di queste procedure richiedeva un nuovo tipo di apparecchiatura ma, in ogni caso, esse mutarono l'aspetto del laboratorio chimico, dove grosse bottiglie nelle quali veniva conservato il permanganato viola, il dicromato arancione e lo iodio marrone abbellivano gli scaffali.
La 'Gründerzeit' dell'analisi chimica
L'espressione tedesca Gründerzeit (lett. periodo dei fondatori), che si riferisce al decollo dell'economia tedesca nel periodo compreso tra il 1850 e il 1870, sembra appropriata per descrivere questa fase di sviluppo della pratica chimica. L'organizzazione dei primi laboratori effettivamente moderni, l'introduzione della ricerca avanzata e la prima applicazione di metodi analitici che avrebbero dominato la chimica per oltre un secolo sono eventi che si verificarono nel corso di questi tre decenni. Fecero la loro prima apparizione la rastrelliera per bottiglie e i banchi da laboratorio dotati di lavandini; l'analisi volumetrica e quella dei gruppi inorganici divennero di uso generale e il test di Marsh per l'arsenico stabilì le basi della tossicologia moderna. Prendendo qui come esempio il laboratorio di Liebig a Giessen non si intende certo perpetuare il mito che questo laboratorio rappresentasse un'improvvisa frattura con il passato o che fosse in qualche modo diverso dagli altri laboratori per l'insegnamento sorti nel medesimo periodo, né si vuole affermare che Liebig da solo abbia introdotto un modo radicalmente nuovo di svolgere la ricerca chimica e l'analisi organica. Ciononostante la sua struttura esercitò una grande influenza in tutta Europa e i metodi che Liebig sviluppò per l'analisi dei composti organici sono in uso ancora oggi.
Liebig e Giessen
Dopo aver ricevuto una formazione da farmacista, Justus von Liebig (1803-1873) studiò chimica alle Università di Bonn ed Erlangen; trascorsi due anni di studio e ricerca a Parigi, nel 1825 divenne professore all'Università di Giessen, nello stato di Assia-Darmstadt in cui era nato. A causa dell'opposizione di Wilhelm Zimmermann (1780-1825), un professore più anziano, Liebig non poté utilizzare il piccolo laboratorio esistente nell'università ma riuscì ad allestirne uno, sia pure modesto, al piano terra del corpo di guardia in disuso che gli era stato assegnato. Una stanza per le bilance e un piccolo laboratorio privato vennero aggiunti nel 1834. Cinque anni dopo, nel 1839, in una nuova ala, furono costruiti un laboratorio ampio (dotato di pionieristiche cappe per i fumi) e uno più piccolo 'per gli studenti di livello meno avanzato'.
L'interno del laboratorio più grande è raffigurato in una litografia di Wilhelm Trautschold e Hugo von Ringen pubblicata nel 1842, tre anni dopo l'apertura; in essa sono visibili le fornaci utilizzate per le operazioni di riscaldamento (con le cappe per i fumi) e i banconi, così descritti da Bergemann: "sono equipaggiati con compartimenti e caselle di varie dimensioni in cui gli operatori ripongono gli oggetti utilizzati nelle loro indagini, e sugli stessi vi sono scaffali di reagenti di cui c'è una scorta talmente abbondante che possono essere condivisi da due studenti nei loro esperimenti. Sotto i banconi si possono trovare alcune nicchie e, all'interno di queste, contenitori dai quali l'acqua può essere attinta e scolata attraverso un tubo" (in Brock 1997, p. 335). Al centro vi sono quattro tavoli, utilizzati soprattutto per operazioni ingombranti come la distillazione; i due più bassi erano destinati agli operatori di statura inferiore e, forse, alle apparecchiature di altezza maggiore. Una stufa di ferro di notevoli dimensioni riscaldava il laboratorio in inverno e un grande forno per l'essicazione "è costruito in modo tale che un grande bagno a sabbia possa essere portato ad alta temperatura e, da questo, il calore possa essere trasmesso mediante diverse condotte e tubi in singole stanze, all'interno delle quali si può regolare per diversi scopi. L'intero forno ricoperto di ferro è ugualmente dotato di finestrelle scorrevoli, in modo tale che gli oggetti che devono essere asciugati siano protetti dalla polvere e dalla contaminazione" (ibidem).
Il nuovo laboratorio di Liebig rappresentava un ponte tra il tavolone al centro di un salotto usato da Joseph Priestley (1733-1804) o da Lavoisier e i laboratori dominati dai banconi e dagli scaffali per i reagenti, tipici del XIX secolo.
L'analisi organica
I composti organici contengono carbonio e in gran parte sono derivati dalle piante, dagli animali e dagli organismi marini. Al contrario di quelli inorganici, essi presentano spesso strutture molto complesse, che possono essere anche particolarmente grandi. Sebbene Lavoisier avesse utilizzato la combustione in un vaso per determinare la composizione elementare dell'etanolo e gli agenti ossidanti per analizzare altri composti organici, il suo lavoro in questo campo non era molto conosciuto. Se un chimico voleva studiare un composto organico, lo scaldava o lo trattava con agenti chimici potenti nella speranza di ottenere frammenti riconoscibili. In questo modo, per esempio, nel 1749 Marggraf produsse l'acido formico mediante la distillazione delle formiche rosse.
All'inizio dell'Ottocento, l'analisi organica era convenzionalmente divisa in qualitativa e quantitativa, similmente a quanto avveniva in chimica inorganica, o, in alternativa, si parlava di: "Analisi elementare o fondamentale e analisi approssimata, a seconda che l'obiettivo dell'indagine sia quello di determinare gli elementi fondamentali, carbonio, idrogeno, ecc., oppure i principî prossimi, tipo lo zucchero, l'amido, la fibrina, ecc., in cui quegli stessi elementi sono raggruppati" (Watts 1863-72, I, p. 225).
Lo sviluppo dell'analisi elementare sino al punto di renderla una tecnica affidabile, ancorché lenta, si deve in gran parte all'impegno di Liebig e dei suoi studenti a Giessen. Alla fine degli anni Venti dell'Ottocento, in seguito alla scoperta di nuovi prodotti naturali, comparvero rapidamente composti organici prima sconosciuti, inoltre gli alcaloidi ‒ che erano appena stati scoperti ‒ contenevano molto più carbonio che non idrogeno o azoto. Per questo motivo per ciascun elemento erano necessarie analisi separate, che rallentavano una procedura già di per sé lenta. Liebig si trovò di fronte a un problema simile nel 1829, quando provò a condurre l'analisi dell'acido ippurico.
Il primo metodo efficace per determinare con una procedura routinaria le proporzioni relative di carbonio, idrogeno e azoto fu sviluppato a Parigi nel 1811 da Gay-Lussac e Thenard. Essi scaldarono il composto con l'agente ossidante clorato di potassio e raccolsero i gas in un recipiente a forma di campana. In questo modo furono in grado di mostrare che lo zucchero comune era un 'carbo-idrato', in cui ciascun atomo di carbonio era combinato con acqua (Cn[H2O]n). Poco dopo, Berzelius perfezionò questo metodo analitico, adottando una configurazione orizzontale dove la miscela clorato/composto era racchiusa in una lamiera di ferro. Egli migliorò anche l'accuratezza dell'analisi, determinando l'acqua e il diossido di carbonio emesso mediante assorbimento e pesata invece che attraverso la misurazione del volume. Nel 1815 Gay-Lussac apportò un'ulteriore modifica sostituendo il clorato di potassio con l'ossido di rame; questa era la versione del metodo di Gay-Lussac e Thenard utilizzata da Liebig quando studiò chimica a Parigi con i suoi inventori. Dovendo affrontare analisi sempre più difficili, Liebig conseguì miglioramenti sostanziali: adoperò ossido di zinco, sostituì il piccolo e insoddisfacente bulbo di cloruro di calcio impiegato da Berzelius per assorbire l'acqua con un lungo tubo sottile dell'agente essiccante e, soprattutto, sviluppò un'ingegnosa coppia di bulbi per tenere la soluzione di idrossido di potassio che assorbiva il diossido di carbonio. In questo modo fu in grado di incrementare la velocità alla quale venivano condotte le analisi, in parte usando metodi gravimetrici (come Berzelius) e in parte aumentando la quantità del composto da esaminare. Il metodo di Liebig fu pubblicato nel 1837 nel suo Handwörterbuch der reinen und angewandten Chemie (Piccolo dizionario di chimica pura e applicata). Nel 1840 Carl Ettling, il soffiatore di vetro che lavorava per Liebig, durante il congresso della British Association for the Advancement of Science a Glasgow mostrò come si facevano i bulbi di Liebig a un collega scozzese.
Al pari dei suoi predecessori, anche Liebig usava la carbonella o una lampada ad alcol per riscaldare la miscela ma, ben presto, si impegnò per trovare un metodo migliore. Franz Leopold Sonnenschein (1817-1879) introdusse nel 1852 il primo forno di combustione alimentato a gas di carbone che fu un predecessore del bruciatore Bunsen. Durante gli anni Cinquanta dell'Ottocento l'ex allievo di Liebig, August Wilhelm von Hofmann (1818-1892) sviluppò un bruciatore a gas che utilizzava tubi di ceramica rimovibili dotati di minuscoli fori. Nel 1866 Griffin offriva versioni commerciali di queste due fornaci di combustione e circa trent'anni dopo, nel 1890, la ditta di W.G. Heraeus di Jena introdusse il forno a combustione elettrica dotato di un elemento riscaldante di platino.
Il contenuto di azoto del composto fu ottenuto raccogliendo i gas d'azoto che si erano sviluppati (in un secondo esperimento) liberi dagli altri gas formati nel corso della combustione. Jean-Baptiste-André Dumas (1800-1884), un ex assistente di Thenard, ideò nel 1831 un metodo affidabile che consisteva nel forzare i gas fuori dal tubo di combustione aggiungendo carbonato di piombo (per generare diossido di carbonio extra), per poi ridurre tutti gli ossidi di azoto presenti passandoli su rame attivato, raccogliendo l'azoto in una soluzione alcalina e assorbendo in questo modo diossido di carbonio. Il suo metodo fu migliorato dall'adozione del nitrometro, un particolare pezzo di vetreria che consentiva di raccogliere l'azoto, introdotto nel 1868 da Hugo Schiff (1834-1915). Un approccio diverso adottarono, nel 1841, due studenti di Liebig, Heinrich Will (1812-1890) e Franz Varrentrapp (1815-1877), i quali estrassero l'azoto presente nel composto organico riscaldandolo con calce sodata, stimando l'ammoniaca che si era sviluppata per via gravimetrica con il cloruro di platino (IV). Questo metodo fu più tardi sostituito dalla digestione con acido solforico, sviluppata per la prima volta nel 1883 da Johan Gustav Kjeldahl (1849-1900), il quale per la determinazione dell'azoto ideò appositamente un pallone speciale tuttora in uso.
Nel 1860 Georg Ludwig Carius (1829-1875) propose un nuovo metodo per la determinazione dello zolfo, del fosforo e del contenuto di alogeni nei composti chimici. Nella sua forma finale, pubblicata nel 1870, il metodo consisteva nello scaldare una miscela del composto con acido nitrico e dicromato di potassio in un tubo sigillato. Il residuo era trattato con cloruro di bario per produrre solfato di bario, che quindi veniva pesato per stimare la quantità di zolfo presente nel composto originario. Il metodo usato per determinare gli alogeni era simile ma utilizzava nitrato d'argento al posto del dicromato di potassio e consentiva di determinare immediatamente il contenuto di alogeno pesando l'alogenuro d'argento formato nel tubo.
Prima di condurre un'analisi elementare completa, era uso comune scoprire quali elementi fossero presenti nel composto. L'idrogeno e il carbonio erano rivelati dalla formazione di acqua e diossido di carbonio quando il campione veniva riscaldato con ossido di rame; la presenza di azoto era indicata dallo sviluppo di ammoniaca quando il composto da esaminare veniva riscaldato con idrossido di potassio (o calce sodata) e, analogamente, il cloro era identificato riscaldando il campione con calce viva e rivelando il calcio cloruro che si formava in questo modo mediante una soluzione di nitrato d'argento, la quale dava un precipitato bianco di cloruro d'argento.
L'analisi organica qualitativa venne enormemente migliorata da Jean-Louis Lassaigne (1800-1859) nel 1843. Egli fuse la sostanza da saggiare con potassio metallico (più tardi sostituito con sodio) e rivelò la presenza di cianuro di potassio attraverso la formazione di blu di Prussia con solfato di ferro (II; parzialmente ossidato). Questo test di fusione di Lassaigne fu più tardi esteso agli alogeni, utilizzando nitrato d'argento per rivelare gli alogenuri formati. Nel 1849 Lyon Playfair (1818-1898) introdusse il test con nitroprussiato di sodio per lo zolfo, che è rivelato dalla comparsa di un brillante colore viola nella reazione tra il nitroprussiato di sodio e il solfuro formato nella fusione di Lassaigne. Nel 1872 Konrad Friedrich Beilstein (1838-1906) pubblicò un nuovo test per i composti contenenti alogeni: immergendo un filo di platino ricoperto di ossido di rame (o un filo di rame bruciato) nel composto da analizzare e riscaldandolo successivamente con la fiamma di un bruciatore Bunsen, esso provocava un cambiamento del colore della fiamma in blu o verde.
Il test con nitroprussiato di sodio e quello di Beilstein erano soltanto due delle numerose analisi alla tocca utilizzate a metà del XIX sec., che stanno gradualmente cadendo in disuso ma che rivestirono un ruolo importante in chimica organica, clinica e forense prima dell'introduzione delle strumentazioni fisiche nel laboratorio chimico, avvenuta negli anni Sessanta del XX secolo. La maggior parte di questi test coinvolgeva una variazione di colore o di una proprietà caratteristica, la più sgradevole delle quali era il nauseabondo odore degli isocianuri prodotto dal test di Hofmann per le ammine. Non dovrebbe forse sorprendere che questo tipo di analisi fosse particolarmente diffuso nella chimica dei carboidrati e degli alcaloidi, che erano i campi fondamentali nella chimica dell'Ottocento, e in tossicologia.
Sebbene sia l'analisi quantitativa sia quella qualitativa abbiano compiuto grandi progressi nel XIX sec., per quanto riguarda le sostanze naturali l'analisi prossima rimase un passaggio chiave.
La conoscenza degli elementi fondamentali da cui un corpo organico è composto non è sufficiente a dare un'idea completa della sua costituzione, a meno che la sostanza sotto esame sia un composto chimico ben definito, come uno zucchero[…] quando si deve esaminare un organo complesso, come una foglia o una radice, o un vegetale o fluidi animali come la linfa o il latte o il sangue, è necessario, prima di procedere all'analisi elementare, separare i numerosi composti definiti o elementi prossimi di cui è costituita la sostanza complessa. (Watts 1863-72, I, p. 249)
L'analisi prossima era a sua volta divisa in organica e inorganica. La prima consisteva nell'essiccazione e incenerimento della sostanza, seguiti da un'analisi organica standard. L'analisi organica approssimata solitamente coinvolgeva un trattamento del materiale, accuratamente essiccato, con una sequenza di etere, alcol e acqua introdotta da Charles Frédéric Gerhardt (1816-1856), ma erano utilizzati anche altri solventi, inclusi il benzene, il cloroformio e il disolfuro di carbonio. I costituenti di base venivano estratti mediante acido solforico o acido cloridrico diluiti e gli acidi organici con ammoniaca diluita o idrossido di potassio. Come precipitante era spesso utilizzato l'acetato di piombo e procedure speciali si seguivano per gruppi specifici di composti (come gli alcaloidi) che utilizzavano miscele complesse. Uno schema specifico, detto 'analisi zoochimica', fu sviluppato per lo studio delle sostanze animali.
La determinazione del peso molecolare
L'analisi organica elementare permette di conoscere soltanto le proporzioni relative di ciascun elemento in un composto. Se i pesi atomici degli elementi sono noti è anche possibile derivare una formula empirica.
Tuttavia composti completamente diversi come l'acetilene e il benzene possono avere la medesima formula empirica (in questo caso CH) e quindi per scoprire il vero numero di atomi di ciascun elemento di un composto, cioè la formula molecolare, è necessario conoscere il loro peso molecolare.
Nel 1826 Dumas inventò un metodo per determinare il peso molecolare dei composti volatili misurandone la densità allo stato di vapore: poiché volumi uguali di gas contengono un numero uguale di molecole (alla stessa pressione e temperatura) se si assume la densità dell'idrogeno (che ha un peso molecolare pari a 2) uguale a 1, la densità relativa di un altro gas (o vapore) sarà pari a metà del suo peso molecolare. Dopo aver collocato una piccola quantità del composto in esame in un grosso bulbo dalle pareti sottili, Dumas riscaldava l'apparecchio in acqua bollente fino al punto in cui il composto era completamente vaporizzato e aveva sostituito tutta l'aria contenuta nel bulbo, che veniva immediatamente sigillato. Il bulbo veniva pesato sia vuoto sia dopo essere stato sigillato e il suo volume si calcolava sulla base della quantità di liquido che vi penetrava quando il sigillo veniva rotto sott'acqua alla fine della determinazione. Un metodo che migliorava questo procedimento fu introdotto da Victor Meyer (1848-1897) nel 1878. Esso consisteva nell'usare due palloni di vetro, uno esterno e l'altro interno; si faceva bollire acqua nel primo e si poneva una piccola fiala tappata contenente il composto da analizzare nel pallone interno che veniva rapidamente chiuso con un tappo di sughero. Quando la fiala toccava il fondo riscaldato del pallone, il campione cominciava rapidamente a bollire espellendo il tappo e un volume equivalente d'aria attraverso il braccio laterale del pallone interno collegato a un tubo di misurazione; per ottenere risultati utili era necessaria una notevole abilità.
I pesi molecolari possono essere determinati dalla diminuzione del punto di congelamento di una soluzione rispetto al solvente puro, oppure dall'aumento del punto di ebollizione di una soluzione. La diminuzione del punto di congelamento era già stata notata da Richard Watson nel 1770 e da Charles Blagden nel 1788, ma a questo fenomeno fu dato un fondamento scientifico nel 1882 a opera di François-Marie Raoult, con gli studi sul contenuto alcolico dei vini. Poiché la diminuzione è molto piccola, sono necessari termometri estremamente sensibili per poterla studiare in modo accurato. Ernst Beckmann (1853-1923) realizzò nel 1888 un termometro di questo tipo caratterizzato da una scala di soli cinque o sei centesimi di grado, che poteva essere sistemata alla temperatura desiderata trasferendo mercurio tra il bulbo e un serbatoio sistemato in alto. La regolazione del termometro di Beckmann era un'operazione che richiedeva abilità poiché bisognava ripetutamente riscaldare, spillare e agitare, inoltre molto spesso il costoso termometro si rompeva durante tale procedimento. Il termometro e l'agitatore, passando attraverso un pezzo di sughero, erano sistemati in un pallone dotato di un braccio laterale ad angolo; il pallone a sua volta si trovava in un tubo più ampio mentre tutta l'apparecchiatura era incastrata in una miscela in condizioni di congelamento. Determinato il punto di congelamento del solvente puro, veniva aggiunto attraverso il braccio laterale un campione pesato del composto da analizzare disciolto nel solvente e si registrava il punto di congelamento diminuito. Il peso molecolare così stabilito risulta solo approssimativamente esatto ma, poiché deve essere un multiplo del peso empirico, un ampio margine d'errore è comunque accettabile. Nel 1889 Beckmann utilizzò il suo termometro per determinare l'aumento corrispondente del punto di evaporazione: il solvente puro veniva immesso nel pallone interno e poi riscaldato, facendo bollire lo stesso liquido nel pallone esterno e determinando il punto di ebollizione. Il composto veniva poi dissolto nel solvente e nel medesimo modo si misurava il punto di ebollizione aumentato. Il pallone interno conteneva palline di vetro o tetraedri di platino per assicurare un riscaldamento omogeneo e un pezzetto di filo di platino veniva saldato alla base. Un'apparecchiatura alternativa per determinare il punto di ebollizione fu introdotta nel 1898 da Landsberger ed entrambe vennero migliorate nel 1919 da James Walker.
L'analisi dei gruppi
L'aumento progressivo del numero di metalli noti rendeva sempre più evidente l'inadeguatezza dell'approccio empirico alla loro individuazione. Divenne quindi necessario classificare i metalli in gruppi, ciascuno dei quali era identificato mediante un particolare reagente, e applicare test specifici soltanto a quei gruppi per i quali era stata ottenuta una reazione positiva. L'analisi di gruppo, nata in questo modo, era destinata a diventare il punto di forza nell'insegnamento pratico della chimica inorganica per più di un secolo.
Le basi di questo tipo di indagine erano state poste da pionieri dell'analisi minerale come Torbern Olof Bergman a Uppsala, Martin Heinrich Klaproth (1743-1817) a Berlino e Nicolas-Louis Vauquelin (1763-1829) a Parigi, sebbene i loro schemi comprendessero solo pochi metalli. Il sistema che avrebbe impegnato generazioni di studenti di chimica fu proposto da Heinrich Rose in Handbuch der analytischen Chemie (Manuale di chimica analitica, 1831) ed esteso da Carl Remigius Fresenius in Anleitung zur chemischen Analyse (Introduzione all'analisi chimica, 1841). Lo schema utilizzava i cinque gruppi mostrati nella Tav. II.
Come strumento didattico, lo schema era economico e richiedeva soltanto l'apparecchiatura più semplice: una rastrelliera di provette, un imbuto con filtro, un bruciatore Bunsen, alcuni beker piccoli e palloni conici erano sufficienti allo studente per tutta la durata del corso. Ciononostante lo schema era basato in misura assai ampia sul solfuro di idrogeno gassoso, che richiedeva parecchie parti di apparato sperimentale per essere gestito.
Rose e Fresenius nelle prefazioni dei loro libri e nei loro corsi di insegnamento spingevano gli studenti a considerare ciascuna analisi come una parte della ricerca, usando il sistema dei gruppi solo come una struttura generale entro cui lavorare. Un riflesso di questo atteggiamento può essere notato anche in A manual of qualitative analysis, pubblicato da Robert Galloway (1822-1896) nel 1850, che include numerosi dettagli pratici e un'ampia trattazione della chimica inorganica descrittiva. Ben presto però le cose sarebbero cambiate.
La pressione a insegnare a classi affollate e con studenti di diversa abilità, specialmente in Inghilterra, generò un approccio più meccanico. I testi più vecchi furono sostituiti da brevi sinossi dalle quali era stato rimosso tutto, eccetto brevi dettagli. Uno di questi libretti, utilizzato in una scuola per apprendisti, liquidava l'intero argomento in dodici pagine.
Usando testi di questo tipo lo studente non era stimolato a sviluppare se non il minimo di considerazioni originali e non acquisiva alcuna vera educazione chimica. A causa di questa situazione molti pedagogisti consideravano con disprezzo l'insegnamento di laboratorio, definendolo un 'pasticcio con provette', adatto soltanto per gli studenti meno validi. La rispettabilità della materia fu recuperata quando le teorie sulle soluzioni diluite cominciarono a emergere negli anni Ottanta grazie a Jacobus Henricus van't Hoff (1852-1911) e Svante August Arrhenius (1859-1927). L'uscita nel 1894 del volume Wissenschaftliche Grundlage der analytischen Chemie (I fondamenti scientifici della chimica analitica) di Friedrich Wilhelm Ostwald (1853-1932) offrì una base ragionata per l'analisi inorganica qualitativa.
Nel frattempo due progressi tecnici cominciarono a cambiare l'aspetto del laboratorio di analisi. Questi erano rappresentati, rispettivamente, dalla riduzione dei processi analitici, grazie alla quale erano sufficienti pochi milligrammi di campione organico, e dall'introduzione di reagenti organici specifici per certi metalli. Il test di Marsh per l'arsenico (1836) e il test di Nessler per l'ammoniaca nell'acqua (1856) avevano aperto la strada al rilevamento di sostanze in piccole quantità. Ampi schemi per la microanalisi inorganica furono sviluppati nel 1890 a Graz da Friedrich Emich (1860-1940), il quale, insieme al suo allievo Anton Benedetti-Pichler, progettò apparecchiature per l'analisi su piccola scala e per le operazioni chimiche in generale.
La produzione di reagenti organici per metalli è diventata significativa nell'industria chimica solo dopo il 1930, ma molti reagenti e le loro reazioni erano già noti nel XIX sec. (Tav. II). Questi e altri reagenti scoperti più tardi, assieme all'apparecchio di Emich, permisero ai chimici di condurre analisi complete in una vaschetta: un ritorno al laboratorio portatile in forma specializzata.
La stagione d'oro della chimica inorganica: 1850-1870
Il periodo compreso tra il 1850 e il 1870 rappresentò una fase di intermezzo nell'evoluzione della pratica chimica. Le tecniche sviluppate nel corso dei decenni precedenti si diffusero dai laboratori ai chimici, che svolgevano attività di consulenza, e alle industrie. I coloranti sintetici, nati nel 1850 con l'acido picrico e qualche anno dopo con la muresside, rimasero privi di applicazione fino alla metà degli anni Sessanta, mentre gli effetti della rivoluzione che la scoperta del color malva nel 1856 provocò nella chimica organica applicata non furono avvertiti per quasi un altro decennio. Furono costruiti nuovi laboratori, esemplati però in gran parte su quelli risalenti agli anni Quaranta e anche precedenti. Non sussistevano grandi differenze tra l'ampliamento del laboratorio di Liebig del 1840 e i nuovi laboratori di Bunsen realizzati una quindicina di anni dopo a Heidelberg. Durante questo periodo di consolidamento, tuttavia, si verificarono alcuni cambiamenti molto importanti. Al di là di un'apparente, relativa semplicità la spettroscopia atomica rappresentò, infatti, un passo in avanti estremamente rilevante per l'analisi chimica in quanto rese possibile la misurazione, fino ad allora inimmaginabile, di quantità piccolissime di elementi, persino a livello di parti su un milione, in modo non distruttivo. Si compiva così il primo, piccolo passo nella transizione paradigmatica dalle tecniche chimiche alla strumentazione fisica, che ha raggiunto l'apogeo nel corso degli anni Sessanta del Novecento. Mentre Bunsen ‒ un fermo oppositore della ricerca in chimica organica ‒ promuoveva l'avanzamento della chimica inorganica e la scoperta di nuovi elementi, alcuni chimici organici a Londra, Parigi, Gand e Marburgo ponevano le basi di una rivoluzione nella teoria della struttura delle molecole e nella sintesi organica che avrebbe assicurato in seguito al loro settore una supremazia indiscutibile.
Bunsen e Heidelberg
Robert Bunsen (1811-1899) studiò fisica, matematica, mineralogia e chimica (come allievo di Friedrich Stromeyer) all'Università di Gottinga e nel 1831 conseguì il dottorato con una dissertazione sui diversi tipi di igrometro. Dopo aver visitato vari paesi europei, ritornò all'Università di Gottinga nel 1834 come libero docente, assumendo in rapida successione una serie di cariche accademiche alla Technische Hochschule di Cassel (1836-1839) e all'Università di Marburgo, dove rimase fino al 1851. Dopo un breve incarico all'Università di Breslavia, succedendo a Leopold Gmelin (1788-1853), divenne professore di chimica a Heidelberg, dove rimase fino al 1889, anno in cui si ritirò dall'attività accademica.
Quando Bunsen arrivò a Heidelberg nell'ottobre del 1852 i laboratori chimici erano sistemati in un antico convento domenicano ma, fortunatamente, nell'estate del 1853 ebbe inizio la costruzione di un nuovo istituto di chimica, che fu inaugurato due anni più tardi. Come notò Henry Roscoe, nella sua Bunsen memorial lecture (1900), la fama di Bunsen attirava studenti da tutto il mondo, tanto che "la nuova costruzione divenne fastidiosamente affollata e molte richieste [da parte di studenti] per poter ottenere banconi da lavoro dovettero essere rifiutate" (Roscoe 1900, p. 547).
Oltre a una stanza per le preparazioni e a una che custodiva le bilance, l'edificio che ospitava l'istituto ne prevedeva anche alcune particolari per l'analisi dei gas e per le attività di tipo elettrochimico. Due grandi laboratori, con 28 e 22 postazioni di lavoro, venivano presumibilmente utilizzati per l'insegnamento; il direttore disponeva di un suo laboratorio privato e ne esisteva anche uno più piccolo, che non era utilizzato, come si potrebbe pensare, per la ricerca ma "per condurre le operazioni che sarebbero state inammissibili nei laboratori grandi". Accanto alle stanze in cui si svolgeva il lavoro scientifico erano situati un'auletta senza pretese e l'appartamento, relativamente modesto, del direttore. I laboratori erano provvisti di acqua corrente e di gas ma, come a Giessen, i lavandini scaricavano in recipienti conici di legno. I reagenti venivano tenuti in credenze, le cui parti frontali erano di vetro; quelle più piccole venivano sistemate sopra i banconi, le più grandi contro la parete; le credenze per i fumi erano addossate alle pareti interne e gli elementi più voluminosi delle apparecchiature erano collocati su lunghi banconi posti sotto le finestre. Una fotografia del laboratorio di Heidelberg mostra i comuni banconi da laboratorio in fondo ai quali erano sistemati gli scaffali per le bottiglie dei reagenti e i lavandini di ceramica bianca, ma è chiaro che questi ultimi costituirono un'innovazione introdotta in seguito.
Bunsen aveva fondato la propria reputazione sullo studio scrupoloso (ed estremamente pericoloso) del radicale cacodile, di tipo organoarsenicale, e sui miglioramenti da lui apportati all'altoforno. Egli fornì anche diversi contributi alla chimica di laboratorio: particolarmente importanti furono il suo lavoro concernente l'uso dello iodio nell'analisi volumetrica (iodometria) e la cella Bunsen, che precorse la moderna 'batteria'; nel 1850 sviluppò il bagno ad acqua calda 'a livello costante', in cui l'acqua persa per evaporazione veniva continuamente sostituita.
L'analisi dei gas
Due dei grandi risultati conseguiti dalla chimica del XVIII sec. furono la determinazione della composizione dell'acqua e quella dell'aria. Per entrambi, la misurazione dei volumi di gas era un aspetto fondamentale. Nel 1776 Alessandro Volta inventò un eudiometro calibrato in cui una miscela di un gas infiammabile e ossigeno poteva essere fatta esplodere mediante una scintilla elettrica, consentendo in tal modo di misurare la variazione di volume.
L'analisi sistematica dei gas si deve però alla chimica tecnica. Tra i fattori che ne stimolarono lo sviluppo è possibile citare l'avvento dell'illuminazione a gas, la preoccupazione per le esplosioni nelle miniere, l'inquinamento dell'atmosfera causato dalle ciminiere delle fabbriche e il bisogno di controllare le reazioni chimiche in fase gassosa.
L'interesse dimostrato da Bunsen per l'altoforno lo spinse a sviluppare alcuni metodi per l'analisi dei gas che dipendevano dalla rimozione, in fasi successive, dei costituenti di una miscela per contatto con reagenti solidi quali l'idrossido di potassio e il cloruro di calcio. Tali metodi, pubblicati nel 1857, erano accurati ma lenti. Procedimenti più veloci, ma meno precisi, furono introdotti da Walther Mathias Hempel (1851-1916), il quale negli anni Settanta inventò la sua pipetta per gas in cui la miscela gassosa subiva l'azione di reagenti liquidi. Nel 1878 Georg Lunge (1839-1923) inventò il suo nitrometro con un tubo di livello, cui seguirono diversi progetti di burette e pipette a gas associate ai nomi di Louis Hengist Orsat, Hans Hugo Christian Bunte e Lunge stesso.
Il bruciatore Bunsen o 'becco' Bunsen
Gli altri risultati conseguiti da Bunsen, per quanto utili, non sono confrontabili con il riconoscimento universale accordato al bruciatore o 'becco' Bunsen. All'inizio del XIX sec. esistevano soltanto due tipi di strumenti da laboratorio in grado di riscaldare: le lampade con lo stoppino, alimentate ad alcol, e il forno. Un importante passo in avanti fu rappresentato dall'introduzione di un nuovo tipo di lampada a olio da parte di Ami Argand nel 1782. La lampada di Argand utilizzava uno stoppino circolare di tipo innovativo, che permetteva all'aria di fluire da entrambe le parti della fiamma aumentando il grado di combustione e, di conseguenza, la temperatura della fiamma stessa. Questo principio venne applicato nel 1797 alla lampada ad alcol di Guyton de Morveau che, resa popolare da Berzelius, divenne nota (non correttamente) come lampada di Berzelius.
L'introduzione, dopo il 1812, del gas da illuminazione ottenuto mediante la distillazione distruttiva del carbone consentì la costruzione di un nuovo tipo di apparecchio da riscaldamento. Michael Faraday descrisse un primo bruciatore a gas nell'opera Chemical manipulation (1827), in cui un getto di gas si miscelava con aria e bruciava sopra un imbuto rovesciato e senza stelo. Un bruciatore a gas piuttosto diffuso era basato sul sistema della lampada a olio di Argand; esso era dotato di un anello circolare di piccoli getti di gas ‒ si trattava in effetti di una versione in miniatura del vecchio fornello a gas ‒ attraverso il centro del quale passava l'aria.
Bunsen creò un bruciatore a gas affidabile, basato su questi prototipi, nel 1855, quando Heidelberg venne rifornita per la prima volta con gas di carbone. Egli lavorava con il suo tecnico Peter Desaga e Roscoe, il quale anni dopo raccontò:
Di ritorno dalle mie vacanze pasquali a Londra, avevo portato con me un bruciatore Argand dotato di un fumaiolo di rame e di un coperchio in reticella di rame, che era la forma abitualmente utilizzata nei laboratori inglesi a quel tempo per riuscire a lavorare con una fiamma che non desse fumo. Questo tipo di congegno non piacque a Bunsen […] la fiamma era tremolante, era troppo grande, e il gas era talmente diluito con aria che la temperatura della fiamma risultava enormemente diminuita. Bunsen avrebbe costruito un bruciatore in cui la miscela di gas e aria sarebbe bruciata in cima al tubo senza nessuna reticella di alcun tipo, dando una fiamma stabile, piccola e calda, in modo tale che sarebbe bruciata senza piegarsi verso il basso, non solo quando l'erogazione del gas fosse stata messa al massimo ma anche quando l'erogazione fosse stata diminuita fino al punto in cui rimaneva soltanto una piccolissima fiamma. Questo rappresentava un problema difficile da risolvere ma, dopo molti tentativi infruttuosi e tediosi, Bunsen arrivò al suo scopo. (Roscoe 1900, p. 547)
Nel bruciatore originale di Bunsen le proporzioni di aria e gas venivano controllate chiudendo mediante l'impiego di piccoli tappi i buchi per l'aria presenti nella base. Il comune manicotto rotante venne introdotto da Griffin pochi anni dopo.
La spettroscopia atomica
La spettroscopia chimica può essere definita come lo studio dell'assorbimento o dell'emissione di radiazione elettromagnetica da parte di composti chimici. Il benzene, per esempio, assorbe luce ultravioletta a lunghezze d'onda specifiche e i composti di sodio, quando vengono riscaldati, emettono luce gialla a due lunghezze d'onda precise. Questa importante tecnica per la rilevazione, e addirittura la scoperta, degli elementi fu il risultato dell'incontro, nel 1851 all'Università di Breslavia, tra il nuovo professore di chimica Bunsen e il giovane professore di fisica Gustav Robert Kirchhoff (1824-1887). La loro collaborazione a Heidelberg, dal 1854 in poi, e gli sviluppi del bruciatore Bunsen dotato di fiamma calda, tra il 1860 e il 1875, condussero direttamente alla scoperta di cinque elementi.
Tale scoperta servì da sostegno tanto per la tavola periodica di Dmitrij Ivanovič Mendeleev quanto per l'identificazione dei gas nobili nel corso degli anni Novanta. Nel XX sec. la spettroscopia ha rivoluzionato la determinazione della struttura dei composti chimici e, al contempo, ha stimolato l'evoluzione dell'astrofisica.
Il prisma usato da Talbot nel 1834 per distinguere i colori simili alla fiamma del litio e dello stronzio aveva rappresentato un progresso che, tuttavia, non trovò sviluppi per molti anni. Il fisico Anders Jonas Ångström (1814-1874), in un lungo studio concernente gli spettri di molte sostanze pubblicato nel 1852, giunse alla conclusione che gli elementi e i loro composti avevano lo stesso spettro. Due anni più tardi, David Alter (1807-1881) sostenne che lo spettro di un elemento era unico e che poteva essere usato per identificare gli elementi nell'aurora boreale o perfino nelle stelle. Nel 1856 William Swan (1818-1894) fu in grado di dimostrare che la linea gialla 'D' dello spettro poteva essere utilizzata per rilevare la presenza di sodio fino a concentrazioni inferiori a una parte per milione, un livello di sensibilità fino ad allora inimmaginabile nell'analisi chimica.
In ogni caso la collaborazione sperimentale tra Kirchhoff e Bunsen permise di porre le fondamenta della tecnica della spettroscopia atomica nel 1859. Seguendo l'esempio di Cartmell, Bunsen stava già analizzando i materiali sulla base dei loro colori distintivi nelle fiamme dei bruciatori, utilizzando vari filtri di vetri colorati allo scopo di distinguere le fiamme di colori simili. Il bruciatore Bunsen era uno strumento di enorme importanza per questo tipo di ricerca, poiché era in grado di fornire una temperatura elevata di bassa luminosità. Kirchhoff ipotizzò che le fiamme colorate potessero essere analizzate meglio utilizzando uno spettroscopio, piuttosto che usando filtri come Talbot aveva già proposto venticinque anni prima. Bunsen e Kirchhoff però superarono i predecessori per l'accuratezza delle loro preparazioni; essi, infatti, ricristallizzavano le sostanze analizzate prima di esaminare i loro spettri e sperimentavano diversi combustibili e miscele di combustibili per la fiamma.
Inoltre Kirchhoff riuscì a dimostrare che lo spettro di emissione di un certo elemento era semplicemente lo spettro di assorbimento rovesciato, fenomeno, questo, che era stato notato per la prima volta (ma non capito) nel 1814 da Joseph von Fraunhofer (1787-1826) nelle linee scure dello spettro solare. Come scrisse ancora Roscoe:
Kirchhoff ha fatto la scoperta più bella e più inattesa: ha trovato la causa delle linee scure dello spettro solare ed è stato in grado sia di rafforzare queste linee artificialmente nello spettro solare sia di provocare la loro comparsa nello spettro continuo di una fiamma, e la loro posizione è identica a quella delle linee di Fraunhofer. In questo modo si mostra la strada mediante la quale è possibile stabilire la composizione materiale del Sole e delle stelle fisse con lo stesso grado di certezza con cui possiamo stabilire per mezzo dei nostri reagenti la presenza di SO3 e di Cl. Mediante questo metodo, inoltre, è possibile stabilire anche la composizione della materia di cui è fatta la Terra, e le diverse componenti possono essere distinte con altrettanta facilità e finezza come nel caso della materia che compone il Sole; infatti io sono riuscito a determinare la presenza di litio in 20 grammi di acqua di mare. (ibidem, p. 531)
L'apparecchiatura originale era molto semplice. Il chimico osservava lo spettro di un campione riscaldato nella fiamma di un bruciatore Bunsen. Lo spettro veniva prodotto riducendo la luce emessa dalla fiamma del bruciatore a una striscia stretta mediante un tubo collimatore; tale fascio di luce era fatto passare attraverso un prisma di vetro flint, formando in questo modo lo spettro, che poi veniva messo a fuoco in un piccolo telescopio. I tubi e il prisma erano fissati in cima a un sostegno pesante (la soluzione utilizzata nei primi esperimenti fu ben presto abbandonata a favore di una sistemazione su un sostegno di ghisa). Un terzo tubo illuminato da una candela fu poco dopo aggiunto all'apparecchiatura di base; esso proiettava sull'immagine dello spettro una scala graduata che permetteva di leggere le lunghezze d'onda. Da allora l'apparecchiatura ha subito soltanto alcune piccole modifiche; una sola, tuttavia, è di maggiore importanza e consiste nell'introduzione di uno spettroscopio a visione diretta che ha incorporato il prisma nel telescopio, consentendo in questo modo l'osservazione diretta dello spettro, a costo, però, di una minore accuratezza.
Utilizzando sali altamente purificati come standard, Bunsen e Kirchhoff furono in grado di identificare lo spettro a righe di diversi elementi. Cominciarono poi a esaminare acque termali e minerali, cercando righe che non potessero essere attribuite a elementi noti. Nella primavera del 1860 Bunsen e Kirchhoff studiarono alcuni campioni provenienti dalle terme di Bad Dürkheim: dapprima riuscirono a osservare soltanto le righe di alcali noti e di metalli alcalino-terrosi ma, quando i metalli alcalino-terrosi e la maggior parte del litio furono rimossi, essi videro per la prima volta due importanti righe blu adiacenti. Bunsen chiamò questo nuovo elemento cesio, da caesius (la parola latina per indicare il colore degli occhi blu-grigi).
Non molto tempo dopo, all'inizio del 1861, Bunsen e Kirchhoff esaminarono la lepidolite, un minerale a base di fluorosilicati reperibile in Sassonia; dopo aver rimosso il potassio presente nel minerale, essi osservarono nello spettro due righe viola, che riconobbero come un nuovo elemento. Bunsen lo chiamò rubidio, poiché nel suo spettro osservò due belle righe rosso cupo (rubidus in latino significa rosso, e a sua volta deriva da rubia, robbia). Indagini successive mostrarono che il rubidio era in effetti piuttosto diffuso ma soltanto in basse concentrazioni. Bunsen preparò del rubidio metallico già nel 1863, mentre il cesio venne isolato solamente nel 1882.
Il lavoro di Bunsen e Kirchhoff portò ben presto alla scoperta di altri elementi; il primo fu il tallio, identificato da William Crookes (1832-1919) nel marzo del 1861. Dopo aver compiuto studi superiori irregolari, nel 1848 Crookes entrò al Royal College of Chemistry, dove fu assistente di Hofmann tra il 1850 e il 1854. Dopo due brevi incarichi accademici si stabilì a Londra, dove per il resto delle sua vita lavorò come consulente e giornalista free lance, fondando la rivista "Chemical News" nel 1859. Mentre Crookes si trovava al Royal College of Chemistry, Hofmann gli diede alcuni residui provenienti da un impianto per la produzione di acido solforico a Tilkerode, vicino a Quedlinburg (oggi in Sassonia-Anhalt), che riteneva fossero una possibile fonte di selenio. Crookes utilizzò il selenio estratto da questo materiale per preparare i cianuri di selenio‒ che furono l'oggetto del suo primo articolo nel 1851 ‒ e tenne un po' di selenio impuro con l'idea di estrarne il tellurio. In seguito egli decise di analizzare il campione utilizzando lo spettroscopio: dopo aver rimosso il selenio, esaminò lo spettro del residuo e osservò una riga verde brillante. Il 5 marzo del 1861 scrisse a Greville Williams, che allora lavorava per le "Chemical News": "Hai mai notato una riga verde dello spettro, lontana come quella del Naα, su un lato così come il Liα è sull'altro? Se la risposta è no, ho trovato un nuovo elemento" (Fournier D'Albe 1923, p. 59). Crookes annunciò il suo nuovo elemento nell'edizione del 30 marzo della sua rivista e più tardi lo chiamò tallio, dal nome greco classico che indicava il germoglio verde, thallós, e ne isolò una piccola quantità nel gennaio del 1862. Pochi mesi più tardi, Claude-Auguste Lamy (1820-1878), professore di fisica a Lilla, preparò una barretta di tallio usando la melma che aveva trovato sul fondo delle camere di piombo utilizzate nella manifattura dell'acido solforico.
In seguito l'analisi spettroscopica fu utilizzata per scoprire molti altri elementi alcuni dei quali furono rinvenuti nei minerali. Nel 1863, infatti, Ferdinand Reich (1799-1882), professore di fisica all'Accademia Mineraria di Freiberg in Sassonia, e il suo assistente Hieronymous Richter (1824-1898) scoprirono l'indio in un campione di blenda locale. Il gallio fu scoperto nel 1875, grazie alla sua coppia di righe viola, da Paul-Émile (François) Lecoq de Boisbaudran (1838-1912) in campioni di blenda dei Pirenei.
Nel 1868, invece, Pierre-Jules-César Janssen (1824-1907) notò, durante un'eclisse totale, una riga gialla vivace nello spettro della cromosfera solare, che si trovava in una posizione completamente diversa rispetto a quella gialla del sodio. Joseph N. Lockyer (1836-1920) decise che apparteneva a un elemento non reperibile sulla Terra e propose il nome di elio (dal nome greco classico che indicava il sole, helios). Ciononostante la sua esistenza rimase in dubbio per un lungo periodo di tempo, tanto da essere quasi incluso tra gli elementi inesistenti come, per esempio, il coronio e il victorio. L'intuizione di Lockyer fu alla fine confermata dalla scoperta dell'elio sulla Terra nel 1895 da parte di William Ramsay e, in maniera indipendente, da Per Teodor Cleve (1840-1905) e dal suo allievo Nils Langlet (1868-1936). Ramsay mandò a Crookes un campione del gas emesso dal minerale uranifero cleveite (che aveva preso il suo nome da Cleve) perché non aveva a disposizione uno spettroscopio accurato, come lo stesso Crookes riportò nell'edizione del 1895 di "Chemical News".
Grazie alla gentilezza del professor Ramsay ho avuto la possibilità di esaminare per via spettroscopica due tubi di Plücker riempiti con un po' di gas ottenuto dal minerale raro cleveite […] Osservando lo spettro, si notava che la riga di gran lunga più prominente era quella di color giallo brillante, che in apparenza occupava la posizione delle righe del sodio. Eseguendo alcune analisi utilizzando un'elevata potenza osservai che la riga si manteneva inequivocabilmente singola, mentre le righe del sodio sono nettamente separate. Inviando la luce del sodio dentro lo spettroscopio contemporaneamente a quella del nuovo gas […] si vedeva che lo spettro di quest'ultimo consisteva quasi interamente di una riga gialla vivace [...] separata [dalle righe del sodio] da uno spazio leggermente più ampio del doppio di quello che separa le due componenti del sodio l'una dall'altra. (p. 58)
Il lavoro di Ramsay sui gas inerti derivò dall'osservazione, risalente al 1892, di John W. Strutt (lord Rayleigh, 1842-1919) secondo cui la densità dell'azoto ottenuto dall'aria era più alta rispetto a quella dell'azoto estratto per via chimica. La differenza era minima, ma effettiva. Henry Cavendish (1731-1810) nel 1785 aveva scoperto che rimaneva una bolla di gas inerte dopo che tutto l'ossigeno e l'azoto erano stati rimossi dall'aria. Lord Rayleigh utilizzò il metodo di Cavendish, ma Ramsay arrivò al risultato di Cavendish con mezzi diversi; egli rimosse l'ossigeno presente nell'aria usando rame spugnoso e l'azoto utilizzando magnesio. Rayleigh e Ramsay annunziarono la scoperta dell'argon nell'agosto del 1894 e, nel 1898, Ramsey estrasse dall'aria anche il cripton, il neon e lo xenon.
La spettroscopia giocò un ruolo di primo piano nella scoperta di tutti questi elementi e, per capirne l'importanza, si deve tornare indietro negli anni, ovvero al lavoro di Julius Plücker (1801-1868), professore di matematica e fisica a Bonn, e del suo vetraio Heinrich Geissler (1815-1879). Nel 1858 Plücker trovò un modo per studiare gli spettri dei gas. Il gas, sotto bassissima pressione, veniva inserito in un tubo di vetro chiuso e sigillato all'interno del quale erano fusi elettrodi di platino. Una scarica elettrica attraverso il tubo provocava la luminescenza del gas, permettendo in questo modo di osservarne lo spettro. Se non ci fosse stata la contemporanea ricerca di Bunsen e Kirchhoff, Plücker sarebbe oggi considerato il vero fondatore della spettroscopia atomica. Questi tubi di Geissler divennero vere e proprie opere d'arte, perché venivano piegati e forgiati in forme bizzarre, usando il vetro di uranio per creare effetti belli e inusuali. Il tubo corto più semplice (spesso chiamato 'tubo di Plücker') mantenne, comunque, la sua importanza come mezzo per rendere un gas luminoso.
Ramsay utilizzò semplici tubi di Plücker insieme a un piccolo spettroscopio a visione diretta da tenere con la mano per identificare i gas nobili in base ai loro spettri. Nel numero del 24 agosto 1894 di "Chemical News" Crookes dichiarava di aver avuto l'opportunità di fotografare ed esaminare lo spettro del gas [argon] e di confrontarlo con quello dell'idrogeno in circostanze simili. "Lo spettro è molto definito e caratteristico e le linee hanno posizioni diverse rispetto a quelle dell'azoto". Affermava inoltre che il suo aspetto somigliava di più a quello di uno spettro metallico. Questi gas producevano colori vivaci, che attualmente sono a tutti familiari nella forma del moderno 'neon'.
La comparsa della 'grande chimica': 1865-1900
All'inizio degli anni Sessanta dell'Ottocento la chimica era una scienza che si praticava sostanzialmente su piccola scala. Secondo la colorita frase di Crookes, "una cantina o qualunque buco possono fungere da laboratorio"; spesso un corridoio inutilizzato o un seminterrato erano considerati sufficienti e perfino nel nuovo edificio che ospitava il laboratorio di Bunsen c'erano poche stanze, relativamente piccole. Al di fuori dell'ambiente accademico, anche il laboratorio della Inland Revenue a Londra era stretto in poche stanzette malsane presso la Somerset House. Gli sforzi operati dal governo prussiano per indurre Hofmann a tornare in Germania accelerarono la costruzione di ben tre grandi edifici per l'insegnamento e la ricerca: questi nuovi palazzi dedicati alla chimica stabilirono lo stile e offrirono il modello per gli altri istituti chimici, non solo in Germania ma anche altrove in Europa e negli Stati Uniti. All'inizio degli anni Novanta dell'Ottocento diverse aziende in Germania e in Inghilterra avevano eretto grandi laboratori per la ricerca industriale e perfino il British Treasury, notoriamente parsimonioso, si sentì obbligato a fornire all'appena nominato Government Chemist un edificio in linea con i più recenti modelli accademici. Se non fosse per le descrizioni del rivoluzionario edificio di Kolbe a Lipsia e per un articolo esaustivo sul nuovo Government Laboratory di Londra scritto da un giornalista oggi non saremmo a conoscenza di tali eventi. Nel medesimo periodo si distinguevano due tendenze nell'attività chimica: l'esame degli alimenti, dell'acqua e dei fertilizzanti nel settore dell'analisi, e la sintesi organica, la quale divenne la colossale impresa intellettuale che è ancora oggi, sostenuta dai suoi legami con la nuova industria chimica organica che allora stava iniziando a svilupparsi.
Kolbe e Lipsia
Come Bunsen, Adolf Wilhelm Hermann Kolbe (1818-1884) era nato a Hannover, durante il lungo regno di Giorgio III. Dopo aver frequentato il liceo a Gottinga, studiò fisica, matematica, mineralogia, metafisica e chimica (sotto Friedrich Wöhler) all'università della stessa città. Nel 1843 Kolbe conseguì il dottorato grazie a una dissertazione riguardante la reazione tra il disolfuro di carbonio e il cloro. Un anno più tardi, mentre stava lavorando come suo assistente, Kolbe salvò Bunsen da morte quasi certa per avvelenamento da monossido di carbonio. Egli divenne poi assistente di Playfair al Museum of Economic Geology di Londra, che era appena stato fondato, dove strinse amicizia con Edward Frankland e, tra il 1847 e il 1851, lavorò come autore e redattore presso la ben nota casa editrice Vieweg Verlag a Brunswick. In seguito Kolbe successe a Bunsen all'Università di Marburgo, dove riceveva uno stipendio esiguo ed era poco conosciuto dalla maggior parte dei suoi colleghi, e nel 1865 divenne professore di chimica all'Università di Lipsia, dove rimase fino alla morte.
Una sequenza di eventi verificatisi tra il 1863 e il 1867, collegati alla figura di Hofmann, portarono alla costruzione di tre laboratori moderni di ottimo livello in Germania. Nel 1863 Karl Gustav Christoph Bischof (1792-1870), professore di chimica a Bonn, andò in pensione e la sua cattedra fu offerta dal governo prussiano a Hofmann. Oltre a uno stipendio elevato, egli richiese che venisse costruito il più costoso e moderno laboratorio tedesco. Nel frattempo Eilhard Mitscherlich (1794-1863) aveva appena abbandonato la sua cattedra berlinese e, quando nel gennaio 1864 morì l'altro professore di chimica a Berlino, Rose, questa città divenne un'attrazione irresistibile per Hofmann. Egli non solo negoziò un laboratorio ancora più grande, come parte dell'accordo per accettare la cattedra berlinese, ma estorse anche la promessa da parte del governo prussiano di costruire in ogni caso il laboratorio di Bonn, mantenendo la sua opzione per la cattedra di Bonn nel caso non gli fosse piaciuta Berlino (e forse per essere sicuro che il governo mantenesse la promessa). Alla fine, nel 1867 Friedrich August Kekulé (1829-1896) ottenne la nomina per la cattedra di Bonn, dove lo splendido nuovo laboratorio era sul punto di essere completato; chiaramente un laboratorio altrettanto grandioso avrebbe dovuto essere assegnato a Kolbe per attirarlo a Lipsia ma egli, da parte sua, non sollevò la questione.
Kolbe successe a Otto Kühn (1800-1863), professore di chimica generale dal 1830, e gli fu assegnato il laboratorio ubicato nel castello medievale di Pleissenburg in Königsplatz. Costruito originariamente nel 1804 per il predecessore di Kühn, Christian Gottlob Eschenbach (1753-1831), era stato in qualche modo migliorato nel 1830 ma al suo arrivo Kolbe non riuscì a trovare una singola storta, un condensatore, un sostegno per filtri e neanche un singolo pezzo di vetreria utilizzabile. Richiese, e rapidamente ottenne, un ampliamento del laboratorio a fini didattici, ma questa era chiaramente soltanto una soluzione temporanea. Dopo vari ritardi, tra cui quello dovuto alla guerra del 1866, la Ständesversammlung nel gennaio del 1867 approvò un preventivo di 80.000 talleri (circa 8000 sterline in valuta del 1867, ovvero 337.000 sterline in termini odierni). Kolbe visitò diversi laboratori in Germania e Svizzera nella primavera del 1867 e a Londra nel marzo del 1868. La costruzione cominciò nell'agosto del 1867 e l'edificio fu completato quattordici mesi più tardi. Sebbene avesse avuto un costo inferiore rispetto ai laboratori di Bonn e di Berlino, poteva ospitare 130 studenti praticanti, tanti quanti ne potevano contenere i due laboratori prussiani messi assieme, e pertanto si meritò l'appellativo di laboratorio più grande di tutta la Germania.
Particolare attenzione fu dedicata alla ventilazione e all'illuminazione, ricorrendo all'uso di soffitti notevolmente elevati.
L'edificio fu costruito a forma di 'E', sfruttando al massimo l'illuminazione naturale. Il piano terra era dominato da una grande aula per le lezioni, che costituiva il palco sul quale il colto maestro poteva dimostrare la propria abilità ed esporre le sue conoscenze di chimica. Progettata a imitazione dell'aula per le lezioni di Liebig a Monaco, costruita nel 1855, l'aula di Lipsia era dotata di file diritte di posti per gli studenti di fronte al bancone per le dimostrazioni e poteva ospitare 160 studenti. Di fianco all'aula c'era una stanza per le preparazioni nella quale venivano organizzate le dimostrazioni che rendevano vivaci e illuminanti i discorsi del direttore. C'erano anche due laboratori per i principianti: la stanza per il solfuro d'idrogeno che si trovava in mezzo a questi due, indicava che la separazione dei gruppi inorganici era una caratteristica fondamentale degli esercizi pratici elementari. Sebbene il primo piano fosse dotato di due grandi laboratori per gli studenti più avanzati, ne conteneva anche di più piccoli e specializzati che divennero un aspetto tipico degli istituti della fine del XIX sec., così come la camera oscura per l'analisi spettrale, la stanza per le bilance, una stanza per l'analisi elementare (che presumibilmente conteneva i forni di combustione) e una per l'analisi dei gas. Su entrambi i piani c'erano stanze spaziose per gli esperimenti all'aria aperta, pratica allora piuttosto comune: in effetti operazioni rischiose o potenzialmente esplosive, come la nitrazione di composti aromatici, venivano talvolta condotte su un tetto piano. Sembra, tuttavia, che il nuovo istituto di Kolbe non contenesse un laboratorio specifico, separato dagli altri, in cui potessero essere condotte ricerche originali. Inoltre la biblioteca era sorprendentemente piccola, ma probabilmente sufficiente per un'epoca in cui erano state scritte appena poche migliaia di libri di chimica e in cui venivano pubblicate una manciata di riviste di questa disciplina.
Nel seminterrato c'erano il forno e le cantine per il carbone, oltre alla lavanderia, il bagno e la dispensa che formavano una parte degli appartamenti del direttore. Costituito da quattordici ampie stanze, l'appartamento dominava la via principale, ed era aperto alla luce su tre lati. Al primo piano era situato un corridoio che portava dallo studio del suo appartamento al suo laboratorio privato oltre a una stanza accanto al laboratorio in cui il direttore poteva condurre le proprie attività pubbliche.
I laboratori erano riscaldati, fino a raggiungere una temperatura minima di 17 °C nel freddo inverno sassone, ed erano dotati di acqua corrente e alimentazioni per il gas. L'area di lavoro più importante era il bancone (Arbeitstisch), con credenze e scaffali sottostanti, lavandini di porcellana alla fine, file di bottiglie di reagenti sugli scaffali, mentre le apparecchiature più voluminose, come i sostegni per le storte, gli essiccatori, i copricampioni e i bagni ad acqua venivano sistemati in alto. Le cappe per i fumi, piuttosto strette, e non dissimili da quelle che si trovavano a Giessen circa venticinque anni prima, venivano collocate presso le pareti che davano verso l'esterno, tra le finestre.
Sebbene Lipsia fosse stato il primo laboratorio a essere aperto, Bonn fu progettato all'inizio del 1864 e Berlino alla fine del medesimo anno, ben prima che venissero disegnati i progetti per Lipsia, che risalgono alla metà del 1867, e quindi è possibile che fosse Lipsia a subire l'influenza di Bonn e di Berlino, e non viceversa. In realtà Kolbe non rimase molto impressionato dai nuovi laboratori prussiani, preferendo loro quelli zurighesi di Georg Staedeler (1821-1871).
Oltre alle aule per le lezioni, Hofmann diede anche grande importanza ai musei chimici e mineralogici, forse per effetto della sua familiarità con il Museum of Economic Geology e con il South Kensington Museum di Londra. A Bonn c'erano due stanze separate per i minerali e per i materiali chimici, ma a Berlino erano riuniti nel grande museo per le collezioni scientifiche dell'istituto. Hofmann commentò che si trattava di "una sala grandiosa, lunga 19 metri larga quasi 8, il cui tetto ad arco era sostenuto da colonne d'acciaio" (Hofmann 1866, p. 58). Nel numero del 6 novembre 1868 delle "Chemical News", Crookes fece alcune annotazioni sul nuovo edificio di Hofmann a Berlino. Egli affermava che era stata completamente distrutta l'idea secondo la quale una cantina o un buco qualunque avrebbe potuto essere utilizzato come laboratorio. "Questo è un edificio nobile ‒ direi quasi un palazzo. È stata demolita l'idea secondo cui tanto più umile è l'attività eseguita da uno studente, quanto più grande è il suo successo". Affermava inoltre che agli studenti era offerto ogni tipo d'aiuto, e che gli rimanevano da fare soltanto le cose che persone meno istruite "non sarebbero in grado di fare […] ci si chiede se quei grandiosi saloni e lussuosi corridoi e quelle scale riusciranno a vedere scoperte comparabili a quelle che a loro tempo videro quei piccoli buchi in cui i loro direttori conseguirono la loro prima fama". Continuando egli ribadiva che ripensandoci questo sembrava un miserevole residuo del pregiudizio risalente agli alchimisti che condannava un chimico a lavorare in edifici di gran lunga meno belli rispetto a quelli che venivano assegnati ai letterati nelle università e nelle biblioteche, sui quali le capacità degli architetti erano state adoperate in maniera così prodiga.
Queste tre strutture, progettate e costruite tra il 1864 e il 1869, costituirono un vero e proprio modello in Europa e in America. Il famoso laboratorio di analisi a Wiesbaden in seguito alla sua espansione, opera di Carl Remigius Fresenius nel 1875, assunse la medesima forma a 'E' del laboratorio di Lipsia. Anche l'edificio originale all'Università dell'Illinois, a Urbana, eretto nel 1903 aveva la stessa forma a 'E', ma, nel 1916, fu espanso e rimodellato in modo tale da formare un quadrato dove l'aula per le lezioni si trovava al centro, come per esempio a Bonn e a Berlino. Al contrario, l'edificio fatto costruire a Manchester dall'allievo di Bunsen, Roscoe, nel 1882 era più simile all'edificio di Heidelberg che a quelli di Lipsia o Berlino. Il progetto di Roscoe venne a sua volta copiato da Bedson, responsabile per la costruzione dei laboratori chimici di Newcastle nel 1885, che aveva lasciato Manchester immediatamente dopo il completamento dell'edificio di Roscoe.
La sintesi organica
La sintesi organica consiste essenzialmente nella preparazione di un composto organico da molecole più semplici: per esempio, la sintesi dell'acido propanoico dallo ioduro di etile e dal cianuro di potassio, in cui il propanonitrile (cianuro d'etile), specie intermedia, viene idrolizzato per ottenere l'acido desiderato. Essa costituisce oggi uno dei settori principali delle attività delle facoltà di chimica, in cui gruppi di ricerca sintetizzano molecole complesse come, per esempio, la vitamina B12 e il brevetoxin B. Queste molecole contengono rispettivamente 63 e 50 atomi di carbonio: una lunga strada dalla sintesi realizzata da Kolbe nel 1844 dell'acido acetico che contiene soltanto due atomi di carbonio.
Il concetto fondamentale può sembrare semplice, ma le origini della sintesi organica sono meno lineari. Il termine sintesi può essere ristretto alla preparazione di prodotti naturali a partire da precursori inorganici, più nota come 'sintesi totale'. Dietro quest'ultima nozione era presente un programma ideologico che fu portato avanti da Marcellin Berthelot (1827-1907) ed esposto ampiamente nel suo trattato La chimie organique fondée sur la sinthèse pubblicato nel 1860. Essendo materialista e ateo, Berthelot era determinato a eliminare ogni traccia di vitalismo dalla chimica organica. A tal fine si concentrò sulla sintesi di composti organici relativamente semplici, come l'acido formico, a partire esclusivamente da materie inorganiche e dai quali, almeno in teoria, potevano venir preparati tutti gli altri composti organici. Una forma di sintesi completamente diversa e ideologicamente libera era la manifattura del colorante artificiale malveina realizzata dal pastore evangelico William H. Perkin nel 1856 e l'intera industria di chimica organica che si sviluppò in seguito alla sua ossidazione dell'anilina non pura. Sebbene Berthelot avesse sintetizzato il benzene a partire dall'acetilene e Carl James Peter Graebe (1841-1927) e Carl Theodor Liebermann (1842-1914) il colorante naturale alizarina nel 1868, nessuna di queste due sintesi precorsero la moderna sintesi organica accademica.
Attualmente, i chimici accademici non sintetizzano i composti organici per costruire una catena da semplici composti inorganici, e le loro sintesi, d'altra parte, non sostituiscono i prodotti naturali, rispetto ai quali sono più cari, perlomeno di un ordine di grandezza. Essi sintetizzano composti organici soprattutto per offrire evidenze convincenti sulla struttura chimica del prodotto naturale. Prima che questo aspetto della sintesi organica potesse emergere, però, fu necessario sviluppare un concetto chiaro della struttura dei composti organici, che divenne possibile soltanto in seguito alle ricerche di Archibald S. Couper (1831-1892), Frankland e Kekulé durante gli anni Cinquanta e Sessanta del XIX secolo. Una volta elaborata una teoria della struttura, questa permise ai chimici di determinare i prodotti delle reazioni, consentendo in questo modo di predire l'effetto strutturale di un singolo stadio della sintesi. Infine, fu necessario approntare un arsenale di reagenti di particolare importanza in sintesi organica. Tutti questi prerequisiti per la sintesi organica moderna furono finalmente disponibili verso la metà del XIX secolo.
Nonostante il suo odio per la teoria strutturale, Kolbe diede un contributo fondamentale alla costituzione della sintesi organica. Nel biennio 1843-1844, egli sintetizzò l'acido acetico dal disolfuro di carbonio clorandolo a tetracloruro di carbonio, che poi a sua volta veniva trasformato in tetracloroetilene. Mediante l'azione del cloro e dell'acqua, il tetracloroetilene veniva convertito in acido tricloroacetico. Dal momento che il disolfuro di carbonio veniva preparato mediante l'azione del carbonio sul solfuro di ferro e poiché l'acido tricloroacetico era stato da poco ridotto ad acido acetico, il lavoro di Kolbe costituiva una sintesi totale di un prodotto naturale. Parlando in termini pratici, però, questa sintesi non aveva alcun valore e l'acido acetico sintetico non divenne commercialmente disponibile fino alla Prima guerra mondiale. Questo lavoro, inoltre, non contribuì al progresso della sintesi organica nel laboratorio accademico. Ancora più significativa, sotto questo aspetto, fu l'elettrolisi di Kolbe dei sali dell'acido carbossilico a idrocarburi ottenuta nel 1849 e la sintesi che, nel 1873, egli stesso fu in grado di ottenere dell'acido salicilico. Quest'ultima reazione fu migliorata da Rudolf Schmitt nel 1885 ed è ora nota come reazione di Kolbe-Schmitt. Essa non solo rese possibile la commercializzazione dell'aspirina, ma è tuttora ampiamente utilizzata, così come pure l'elettrolisi di Kolbe, sia pure in maniera meno diffusa.
I reagenti chiave per la sintesi organica, però, erano i composti in grado di scambiare rapidamente un legame carbonio-idrogeno con un legame carbonio-carbonio, permettendo in questo modo la costruzione di molecole piuttosto grosse da un certo numero di precursori più piccoli. Questa reazione, che costituisce un processo noto come condensazione, ebbe il suo pioniere in Alexander Borodin (1833-1887) nel corso degli anni Sessanta. Il primo dei composti 'a idrogeno attivo' di tipo standard, che è ancora impiegato nelle sintesi, è stato l'etilacetoacetato, che fu preparato in situ da Frankland e Baldwin Francis Duppa nel 1865 e da loro utilizzato nella preparazione dei chetoni. Il composto simile etilmalonato fu utilizzato per la prima volta nel 1880 per preparare acidi carbossilici sostituiti da parte di Max Conrad (1848-1920). Soltanto tre anni più tardi, William H. Perkin jr utilizzò l'etilmalonato per sintetizzare l'acido ciclobutancarbossilico dall'1,3-dibromopropano. Nella Geschichte der Chemie (Storia della chimica, 1889), Ernst von Meyer (1847-1916) commentò come l'entusiasmo con cui queste sintesi venivano condotte aumentasse soprattutto dopo che si era notato che i processi che si svolgevano negli organismi delle piante erano basati sulla condensazione.
Un'altra scoperta rivoluzionaria fu realizzata nel 1877 da Charles Friedel (1832-1899) e James M. Crafts (1839-1917) e consisteva nell'alchilazione del benzene utilizzando cloruro di alluminio come catalizzatore. Inizialmente prepararono pentilbenzene dal cloruro di amile, ma ben presto scoprirono che la reazione funzionava meglio con gli alogenuri acilici e quindi prepararono il chetone benzofenone. Tuttavia la sintesi multistadio, oggi ben nota, fu lenta a svilupparsi. Il problema delle rese decrescenti con l'aumentare del numero degli stadi rappresentava probabilmente un fattore chiave, specialmente in un periodo in cui erano richieste quantità relativamente grandi per poter eseguire un'analisi quantitativa. Scrivendo nel 1888, Meyer lodava la sintesi della coniina a partire dalla α-picolina, eseguita da Albert Ladenburg (1842-1911) appena due anni prima come 'ingegnosa', sebbene fosse costituita da due stadi soltanto. Una delle prime sintesi a multistadio fu la sintesi a sei stadi dell'α-terpineolo eseguita da Perkin jr nel 1904, utilizzando gli ioduri di alchilmagnesio introdotti da François-Auguste-Victor Grignard nel 1900.
L'apparecchiatura utilizzata per questo lavoro era relativamente semplice e non cambiò molto nel corso della maggior parte del XX secolo. Quando alla fine degli anni Sessanta del Novecento Robert B. Woodward (1917-1979) sviluppò la sintesi della vitamina B12 utilizzò la cromatografia per separare i composti intermedi e la spettroscopia di massa per identificarli, ma l'apparecchiatura che usò per eseguire le sintesi era grosso modo la stessa che Kolbe aveva usato un secolo prima. La vetreria consisteva in una serie di palloni a fondo rotondo, in palloni più piccoli per la ricristallizzazione e in condensatori, raffreddati ad acqua e ad aria. Il riscaldamento veniva ottenuto con bruciatori Bunsen e con bagni ad acqua (particolarmente utili per le ricristallizzazioni); con bagni a sabbia e bagni a olio quando erano richieste temperature più elevate; l'abilità dell'operatore era più importante di apparecchiature sofisticate o costose.
Esistevano parecchi testi di chimica organica pratica, quali l'Anleitung zur Darstellung organischer Präparate (Introduzione all'elaborazione del preparato organico) di Emil Hermann Fischer, l'Owens College course of practical organic chemistry di Julius Cohen, entrambi del 1887 e il rinomato Praxis des organischen Chemikers (Pratica dei chimici organici) di Ludwig Gattermann, del 1894, pubblicati e tradotti in diverse edizioni e sui quali si formarono chimici come il giovane Woodward. In ogni caso, si trattava di compendi di ricette per la preparazione di una serie canonica di composti organici standard; in effetti il libro di testo di Gattermann fu rinominato Gattermanns Kochbuch (Ricettario da cucina). I primi libri dedicati alle sintesi furono con molta probabilità il Lehrbuch der synthetischen Methoden der organischen Chemie (Trattato dei metodi sintetici della chimica organica, 1903) di Theodor Posner e la Chemical synthesis of vital products di Raphael Meldola del 1904.
Bibliografia
Brand 1995: Brand, John C.D., Lines of light. The sources of dispersive spectroscopy, 1800-1930, Luxembourg, Gordon & Breach, 1995.
Brock 1997: Brock, William H., Justus von Liebig. The chemical gatekeeper, Cambridge-New York, Cambridge University Press, 1997.
Bud 1998: Instruments of science. An historical encyclopedia, edited by Robert Bud and Deborah J. Warner, New York, Garland, 1998.
Child 1940: Child, Ernest, The tools of the chemist. Their ancestry and American evolution, New York, Reinhold, 1940.
Cole 1951: Cole, R.J., Friedrich Accum (1769-1838). A biographical study, "Annals of science", 7, 1951, pp. 128-143.
Dronsfield 1999: Dronsfield, Alan - Brown, Trevor - Morris, Peter - Parker, James, Bunsen. A centennial tribute, "Education in chemistry", 36, 1999, pp. 127-129.
Fournier D'Albe 1923: Fournier D'Albe, Edmund E., The life of Sir William Crookes, London, Unwin, 1923.
Gee 1989: Gee, Brian, Amusement chests and portable laboratories. Practical alternatives to the regular laboratory, in: The development of the laboratory. Essays on the place of experiment in industrial civilisation, edited and introduced by Frank A.J.L. James, Basingstoke, Macmillan, 1989, pp. 37-59.
‒ 1991: Gee, Brian - Brock, William H., The case of Joseph Griffin. From artisan-chemist and author-instructor to business-leader, "Ambix", 38, 1991, pp. 29-62.
Hammond 1992: Hammond, Peter William - Egan, Harold, Weighed in the balance. A history of the laboratory of the government chemist, London, Her Majesty's Stationary Office, 1992.
Holmes 1989: Holmes, Frederic L., The complementarity of teaching and research in Liebig's laboratory, in: Science in Germany. The intersection of institutional and intellectual issues, edited by Kathryn M. Olesko, "Osiris", Special issue, s. 2, 5, 1989, pp. 121-164.
‒ 2000: Instruments and experimentation in the history of chemistry, edited by Frederic L. Holmes and Trevor H. Levere, Cambridge (Mass.)-London, MIT Press, 2000.
Homburg 1999: Homburg, Ernst, The rise of analytical chemistry and its consequences for the development of the German chemical profession (1780-1860), "Ambix", 46, 1999, pp. 1-32.
‒ 2001: Homburg, Ernst, The story behind the name 4. Kipp's apparatus, "Royal Society of Chemistry. Historical group. Newsletter", febbraio, 2001, pp. 14-18.
Jenemann 1997: Jenemann, Hans R., Die Waage des Chemikers. The chemist's balance, Frankfurt a.M., Dechema, 1997.
Laidler 1993: Laidler, Keith J., The world of physical chemistry, Oxford-New York, Oxford University Press, 1993.
Lockemann 1949: Lockemann, Georg, Robert Wilhelm Bunsen, Lebensbild eines deutschen Naturforschers, Stuttgart, Wissenschaftliche Verlagsgesellschaft, 1949.
‒ 1956: Lockemann, Georg, The centenary of the Bunsen Burner, "Journal of chemical education", 33, gennaio, 1956, pp. 20-22.
Morris 2002: From classical to modern chemistry. The instrumental revolution, edited by Peter J.T. Morris, Cambridge, Royal Society of Chemistry, 2002.
Rocke 1993: Rocke, Alan J., The quiet revolution. Hermann Kolbe and the science of organic chemistry, Berkeley, University of California Press, 1993.
Russell 1987: Russell, Colin A., The changing role of synthesis in organic chemistry, "Ambix", 34, 1987, pp. 169-180.
Schelenz 1964: Schelenz, Hermann, Zur Geschichte der pharmazeutisch-chemischen Destilliergeräte, Hildesheim, Georg Olms, 1964 (1. ed.: Militz bei Leipzig, Schimmel & Co., 1911).
Smeaton 1966: Smeaton, William A., The portable chemical laboratories of Guyton de Morveau, Cronstedt and Göttling, "Ambix", 13, 1966, pp. 84-91.
Stock 1969: Stock, John T., Development of the chemical balance, London, Her Majesty's Stationary Office, 1969.
Szabadváry 1966: Szabadváry, Ferenc, History of analytical chemistry, translated from Hungarian by Gyula Svehla, Oxford-New York, Pergamon, 1966 (rist.: Yverdon-Langhore (Pa.), Gordon and Breach Science, 1992; tit. orig.: Az analitikai kémia módszereinek kialakulása).
Weeks 1968: Weeks, M. Elvira - Leicester, Henry M., Discovery of the elements, 7. ed., Easton (Pa.), Journal of Chemical Education, 1968 (1. ed.: Easton (Pa.), Mack Printing Co., 1933).