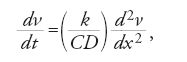L'Ottocento: fisica. La fisica dei fenomeni termici
L'Ottocento: fisica. La fisica dei fenomeni termici
La fisica dei fenomeni termici
Lo studio del calore cominciò a svilupparsi alla fine del XVIII sec., in particolare nelle comunità dei chimici della Scozia e della Francia. L'attività teorica e sperimentale proseguì intensamente nella prima metà dell'Ottocento, soprattutto nell'ambito della tradizione delle teorie caloriciste, basate sull'ipotesi che il calore fosse un fluido diffuso in tutto lo spazio, imponderabile ed elastico o, almeno, che fosse rappresentabile come tale. In particolare, nei primi tre decenni del XIX sec. la trattazione teorica dei fenomeni termici subì enormi progressi, diventando più quantitativa e sistematica, e le conoscenze sperimentali aumentarono fino a raggiungere un importante traguardo nel lavoro di ricerca di Henri-Victor Regnault (1810-1878). Un altro cambiamento di rilievo fu il 'passaggio', attraverso un processo favorito almeno in parte dal crescente interesse per le macchine termiche, dello studio del calore dalla chimica alla fisica, che si completò, intorno alla metà del secolo, con lo sviluppo della termodinamica classica.
Si passeranno in rassegna alcune tematiche più significative nello sviluppo della fisica dei fenomeni termici fino al sorgere della termodinamica. Molte acquisizioni di questo periodo andarono perdute allorché si rinunciò all'ipotesi dell'esistenza e della conservazione del fluido calorico in favore del principio di conservazione dell'energia nella sua forma termodinamica; tuttavia molti elementi della vecchia teoria continuarono a sopravvivere in forme talora interessanti.
Calori specifici e calori latenti
All'inizio dell'Ottocento, l'attenzione per le misurazioni dei calori specifici e dei calori latenti fu fortemente stimolata da alcune controversie teoriche delle quali uno dei nodi centrali era l'oscura relazione tra temperatura e calore. Era evidente l'esistenza di una correlazione positiva tra la somministrazione di calorico a un corpo e la sua temperatura; erano però anche ben noti i casi in cui un corpo riceveva o cedeva calore senza subire alcun cambiamento di temperatura o, viceversa, subiva una variazione di temperatura senza ricevere o cedere calore. Fenomeni come i passaggi di stato, il riscaldamento e il raffreddamento dei gas per compressione ed espansione, il riscaldamento dei solidi per percussione o strofinamento, già osservati alla fine del Settecento, continuarono a essere il principale oggetto di ricerca da parte dei caloricisti nella prima metà del XIX secolo. Al centro del dibattito vi era il concetto di 'calore latente'; ci si domandava che cosa avvenisse esattamente al calorico quando esso diventava 'latente', ossia quando era assorbito da un corpo senza aumentarne la temperatura; o perché esso cessava di essere rilevato dai termometri; e ancora, come faceva il calorico latente a tornare talvolta al suo stato sensibile.
La scoperta del calore latente è stata attribuita al medico e chimico scozzese Joseph Black (1728-1799), anche se si è ampiamente riconosciuto il contributo indipendente dello svedese Johan Carl Wilcke (1732-1796). L'idea di Black era che il calorico, apparentemente consumato nel fondere il ghiaccio, non si distruggesse ma semplicemente passasse in un altro stato che, per definizione, non aveva il potere di influenzare il termometro. Sebbene lo stesso Black mantenesse una posizione agnostica circa l'essenza materiale del calore, la sua nozione di calore latente si accordava felicemente con l'idea generale condivisa dai chimici che il calorico dovesse essere considerato una sostanza suscettibile di combinarsi chimicamente con la materia ordinaria. Questo punto di vista era stato proposto, per esempio, da Antoine-Laurent Lavoisier (1743-1794), il quale, nel suo autorevole trattato sulla nuova chimica, Traité élémentaire de chimie (1789), arrivò a includere il calorico (così come la luce) nella tavola degli elementi chimici.
Secondo questa concezione chimica del calore ‒ molto diffusa tanto in Gran Bretagna quanto in Francia ‒ il calorico latente, entrando in combinazione con le particelle della materia ordinaria, era la causa dell'aumento di fluidità quando i solidi passavano allo stato liquido e i liquidi allo stato gassoso; lo stesso calorico latente sarebbe tornato a essere sensibile nei processi inversi di condensazione e solidificazione. L'assorbimento e l'emissione di calore nelle reazioni chimiche ordinarie erano spiegati allo stesso modo. L'idea della combinazione chimica del calorico con la materia ebbe riflessi anche nel linguaggio: accanto alla terminologia fenomenologica, 'calorico latente' e 'calorico sensibile', si cominciarono a usare locuzioni come 'calorico combinato' e 'calorico libero'.
Un oppositore della teoria chimica del calore fu William Irvine (1743-1787), allievo e collaboratore di Black a Glasgow, che si rifiutò di attribuire al calorico due stati diversi. Dal momento che egli non pubblicò mai le sue teorie, queste divennero note soltanto attraverso le lezioni e i contatti personali; alcuni dei suoi saggi furono pubblicati postumi dal figlio, che aveva lo stesso nome William, solamente nel 1805 con il titolo Essays chiefly on chemical subjects. Quella che d'ora in avanti sarà chiamata 'ipotesi della capacità termica di Irvine' asseriva l'esistenza di una sola specie di calorico e assumeva che la quantità di calorico contenuta in un corpo era il prodotto tra la sua 'capacità per il calorico' e la sua temperatura assoluta (che sarebbe stata di zero gradi nello stato di totale assenza di calorico). Secondo Irvine la fenomenologia del calore latente era quindi da ricondursi a variazioni della capacità dei corpi per il calorico. Il passaggio di stato dal ghiaccio all'acqua, per esempio, produceva un aumento della capacità termica, il che significava che occorreva assorbire calore anche per mantenere il sistema alla stessa temperatura. Il processo poteva essere compreso mediante l'analogia con un secchio che si allarga improvvisamente: il livello di acqua al suo interno scenderebbe se non si aggiungesse altra acqua per mantenerlo costante. Allo stesso modo, gli effetti termici delle reazioni chimiche erano spiegati attribuendoli a presunte differenze tra le capacità termiche dei reagenti e dei prodotti della reazione.
Irvine si servì di alcune misurazioni per avvalorare il suo schema interpretativo: egli dimostrò, per esempio, che l'acqua ha in effetti una capacità termica superiore a quella del ghiaccio. Tuttavia, le sue idee non furono mai pienamente accettate, anche se vennero adottate ed elaborate da alcuni pensatori influenti, specialmente in Gran Bretagna. Il principale sostenitore delle idee di Irvine fu forse il medico e chimico irlandese Adair Crawford (1748-1795) che, attivo a Londra nell'ultimo periodo della sua vita, ne aveva seguito le lezioni quando era studente a Glasgow. Crawford si servì delle teorie di Irvine per cercare una nuova soluzione all'antica questione del calore animale e il suo importante trattato, Experiments and observations on animal heat, and the inflammation of combustible bodies (1779), facilitò la diffusione delle concezioni del suo maestro a studiosi lontani da Glasgow, ivi compreso John Dalton (1766-1844), colui che diede avvio alla teoria atomica in chimica. Altri importanti seguaci di Irvine furono Sir John Leslie, professore di matematica e poi di filosofia naturale a Edimburgo, e il chimico scozzese John Murray, i cui libri di testo furono molto influenti all'inizio dell'Ottocento.
Anche se l'adesione alle idee di Irvine diminuì dopo il primo decennio del XIX sec., la sua eredità continuò ad avere una notevole rilevanza nei dibattiti successivi e gran parte della ricerca sui fenomeni termici della prima metà del secolo fu diretta a colmare le lacune causate dall'abbandono della sua teoria. Molte teorie del calore elaborate inizialmente erano piuttosto vaghe: le assunzioni basilari non erano abbastanza specifiche da consentire predizioni quantitative. Da questo punto di vista, l'ipotesi della capacità termica di Irvine costituiva un grande passo avanti, prevedendo una relazione precisa tra la capacità termica, la temperatura e il calore totale. L'ipotesi divenne ampiamente verificabile in seguito all'identificazione della grandezza 'calore specifico', che si poteva misurare in laboratorio, con il concetto più teorico di 'capacità termica'. Soltanto allora parecchie predizioni effettuate sulla base della teoria di Irvine si rivelarono errate. Il conseguente rifiuto di tale ipotesi lasciò, però, un vuoto teorico che occorreva riempire se si voleva ripristinare una certa chiarezza nella trattazione teorica di numerosi problemi di importanza cruciale, come la relazione tra calore specifico e calore latente, la determinazione dello zero assoluto e della quantità totale di calore contenuta nei corpi, il contenuto di calore del vuoto, il raffreddamento e riscaldamento adiabatico dei corpi, la definizione della temperatura e così via.
Metodi di misurazione
Malgrado la controversia teorica che circondava l'ipotesi di Irvine sulla capacità termica, le nozioni più fenomenologiche di calore latente e calore specifico erano condivise da quasi tutti i ricercatori. Un grande impegno fu dedicato alla loro determinazione sperimentale, anche al fine di sottoporre a verifica le teorie rivali confrontandole con i dati ottenuti. Tuttavia dovette passare molto tempo prima che le indagini sperimentali raggiungessero un livello tale da produrre misure abbastanza precise da consentire il raggiungimento di gran parte degli obiettivi teorici. Le difficoltà non erano soltanto di carattere tecnico, ma riguardavano anche l'interpretazione teorica dei dati stessi.
Per determinare i calori specifici e i calori latenti occorreva misurare le seguenti grandezze fondamentali: il peso o il volume del corpo, la sua temperatura e la quantità di calore da esso assorbita. La determinazione del volume era abbastanza facile; più problematica era la misurazione del peso, in particolare per i gas, ma la cosa non presentava difficoltà concettuali. I principî su cui si basava la misurazione della temperatura erano invece più sottili e complicati; tuttavia, dopo ricerche come quelle effettuate da Daniel Gabriel Fahrenheit (1686-1736) e da Anders Celsius (1701-1744), esistevano ormai termometri abbastanza affidabili. I problemi principali erano invece legati alla determinazione della quantità di calore poiché non esisteva alcun metodo diretto per misurare il calore che si trasferiva da un corpo a un altro e per definire la quantità totale di calore contenuta in un dato corpo. L'unico modo per stimare quanto calore veniva assorbito o emesso da un corpo era quello di osservarne l'intensità degli effetti; gli unici noti in quel periodo e utilizzabili a tal fine erano il passaggio di stato e la variazione di temperatura, ma la procedura che consentiva di derivare da essi l'intensità della loro causa (ossia la quantità di calore) implicava a sua volta i concetti di calore latente e calore specifico, con un'evidente circolarità concettuale.
La calorimetria basata sui passaggi di stato fu sviluppata da Lavoisier e da Pierre-Simon de Laplace (1749-1827) con l'invenzione del calorimetro a ghiaccio e fu applicata con molta efficacia nelle indagini che costituirono la base del loro famoso Mémoire sur la chaleur (1783). Nello strumento, il recipiente metallico in cui era contenuto il corpo riscaldato era circondato da ghiaccio triturato; dopo aver fatto raffreddare il corpo fino alla temperatura del ghiaccio fondente, si misurava la quantità di ghiaccio che era passata allo stato liquido raccogliendo e pesando l'acqua prodotta. Con il calorimetro a ghiaccio Lavoisier e Laplace studiarono vari fenomeni, dai calori specifici dei corpi solidi al calore prodotto dagli animali. La principale assunzione teorica di questa tecnica era, in primo luogo, che il calore era soggetto a un principio di conservazione e, in secondo luogo, che il calore latente richiesto per fondere una massa unitaria di ghiaccio al suo punto di fusione era sempre la stessa. Anche se tali assunti erano difficilmente verificabili in pratica, non c'era alcun motivo particolare per dubitarne e contestarne la validità. Purtroppo, però, il calorimetro a ghiaccio di Lavoisier e Laplace presentava difetti pratici: in particolare, non si poteva raccogliere e pesare tutta l'acqua prodotta dalla fusione del ghiaccio, poiché il liquido restava in parte intrappolato nei piccoli interstizi tra i pezzi di ghiaccio.
Sebbene in quel periodo il calorimetro a ghiaccio di Lavoisier e Laplace costituisse l'unica possibilità di usare i passaggi di stato per le misurazioni di quantità di calore, la sua inadeguatezza sul piano pratico costrinse gli scienziati a basarsi piuttosto sulle variazioni di temperatura. Il solo metodo plausibile era l'abituale tecnica delle mescolanze. La procedura tipica consisteva nell'immergere un corpo a temperatura più elevata a in un corpo di riferimento (comunemente acqua) a temperatura più bassa b. Il calore specifico c del primo corpo era ricavato dalla temperatura finale m della mescolanza in base alla formula (a−m)c=(m−b)c0, dove c0 era il calore specifico del corpo di riferimento, normalmente preso uguale a 1 per l'unità di massa di acqua. Questa tecnica, tuttavia, non era esente da gravi limiti concettuali, in quanto si presumeva non soltanto che il calore si conservasse ma anche che i calori specifici in questione (c e c0) si mantenessero costanti in tutto l'intervallo di temperatura utilizzato nell'esperimento. Come si vedrà, quest'ultima assunzione si prestava a facili e frequenti obiezioni, ma doveva essere mantenuta come approssimazione accettabile se si volevano effettuare misurazioni calorimetriche; altrimenti la tecnica delle mescolanze non soltanto sarebbe stata poco precisa ma anche priva di senso. La difficoltà poteva essere minimizzata operando con piccole differenze di temperatura, ma questa soluzione creava altri inconvenienti pratici e incideva sull'accuratezza dei risultati, che dipendeva sensibilmente da quella delle misure di temperatura.
A parte queste complicazioni di fondo nelle misurazioni di quantità di calore, altri problemi peculiari rendevano ancor più delicata la determinazione dei calori specifici dei gas. A prescindere dalle questioni di carattere più teorico, di cui si tratterà più avanti, la principale difficoltà tecnica nasceva dal fatto che i calori specifici dei gas erano molto piccoli rispetto a quello del corpo di riferimento e del recipiente che doveva essere utilizzato per contenere il gas stesso. Il primo tentativo di misurazione dei calori specifici dei gas di cui si ha notizia fu effettuato da Crawford negli anni Ottanta del Settecento, allo scopo di cercare una spiegazione del calore animale basata sull'ipotesi di Irvine. Egli attribuiva l'origine del calore alla respirazione, ragion per cui diventava importante misurare le capacità termiche dei gas che venivano inalati ed esalati dagli animali. Crawford riempì una vescica con gas ad alta temperatura, la immerse in una tinozza piena d'acqua fredda e ne misurò l'aumento di temperatura; i suoi risultati non erano però attendibili, dal momento che i cambiamenti di temperatura dell'acqua erano molto piccoli e le misurazioni poco accurate. I miglioramenti introdotti da altri ricercatori negli anni successivi non produssero esiti significativi. Per questo, l'esigenza di accrescere la precisione delle misure di calore specifico costituì uno dei principali obiettivi del premio messo in palio dalla prima classe (Scienze matematiche e fisiche) dell'Institut de France, che dal 1795 aveva sostituito l'Académie Royale des Sciences di Parigi.
La competizione del 1812 fu vinta da François Delaroche e Jacques-Étienne Bérard (1789-1869), il cui studio, Mémoire sur la détermination de la chaleur spécifique des différents gaz, fu pubblicato nel 1813. Essi, modificando una tecnica precedentemente adottata da Lavoisier, utilizzarono un metodo che si basava sul passaggio di un gas riscaldato a pressione costante attraverso un tubo di rame a spirale immerso in un calorimetro ad acqua. In base alla quantità di calore ceduta all'acqua nell'unità di tempo e alla velocità del flusso di gas, Delaroche e Bérard furono in grado di ricavare i calori specifici (per unità di volume) di diversi gas a pressione costante e di conseguenza, conoscendo la densità dei gas, di desumere i calori specifici per unità di massa. Lo studio di Delaroche e Bérard fu molto apprezzato per l'ingegnosità del metodo, nonché per la grande attenzione con cui erano state eliminate le possibili perdite di calore: per alcuni decenni i loro dati sui calori specifici di diversi gas furono considerati come le migliori stime disponibili. Grazie alle loro ricerche si ebbe la certezza che i calori specifici dei diversi gas variano in maniera sensibile: a partire dal valore 0,903 per il calore specifico volumetrico dell'idrogeno fino al valore 1,258 per quello dell'anidride carbonica (avendo posto questa volta uguale a 1 il calore specifico volumetrico dell'aria). Il lavoro dell'altra coppia di contendenti, Nicolas Clément (1788-1841) e Charles-Bernard Desormes (1777-1862), entrambi chimici industriali, era basato su nozioni meno condivise e non ricevette altrettanta attenzione. L'esito della competizione del 1812 avrebbe comunque avuto implicazioni teoriche complesse e significative.
Le principali difficoltà concettuali nella misurazione dei calori specifici e dei calori latenti rimasero senza soluzione, ma le tecniche di laboratorio subirono continui miglioramenti. Alcuni progressi importanti, compreso l'uso della legge di raffreddamento, furono compiuti da Pierre-Louis Dulong e Alexis-Thérèse Petit e le ricerche da loro effettuate sul raffreddamento, la termometria e i calori specifici negli anni intorno al 1820 finirono per essere considerate da molti come modello di precisione nella sperimentazione. In seguito la ricerca sperimentale sui calori specifici e latenti fu portata quasi alla perfezione da Regnault; il suo laboratorio presso il Collège de France era finanziato dal governo, che aveva l'esigenza di raccogliere dati per lo sviluppo della macchina a vapore e richiedeva misure precise di diversi parametri, tra i quali i calori specifici di molti gas e il calore latente del vapore. Regnault rinnovò, criticò e migliorò tutte le tecniche rilevanti usate dai suoi predecessori. I risultati, assieme alla descrizione minuziosa delle procedure sperimentali, riempirono tre interi volumi dei "Mémoires de l'Académie des Sciences", pubblicati a Parigi nel 1847, nel 1862 e nel triennio 1868-1870.
La dipendenza dei calori specifici dalla temperatura
Come si è detto, un problema cruciale delle misurazioni termiche era l'eventuale dipendenza del calore specifico di una determinata sostanza dalla sua temperatura. Tutti concordavano sul fatto che il calore specifico subiva una variazione se la sostanza era sottoposta a un passaggio di stato, tuttavia vi era un notevole dissenso sulla possibilità che esso cambiasse anche a causa della semplice variazione di temperatura della sostanza. Questa problematica esemplifica efficacemente i numerosi punti di disaccordo che dividevano i caloricisti su importanti questioni di dettaglio.
Secondo Dalton, per esempio, un cambiamento di volume avrebbe causato un cambiamento del calore specifico, poiché un corpo che subiva un'espansione in seguito a riscaldamento avrebbe dovuto incrementare la propria capacità termica, dato che l'aumento di volume creava più 'spazio' per il calorico assorbito. Tale ipotesi era molto diffusa tra la fine del XVIII e l'inizio del XIX secolo. Tra gli altri, il geologo, meteorologo e alpinista ginevrino Jean-André Deluc (1727-1817), nelle Idées sur la météorologie (1786-1787), aveva suddiviso la capacità dei corpi per il 'fuoco' in una capacità 'geometrica' e in una capacità 'fisica'; la prima era legata al numero di 'pori' presenti nel corpo in cui il calore poteva inserirsi, la seconda era legata alla natura di questi pori, dalla quale dipendeva la quantità di fuoco che poteva essere assorbita in una data estensione di spazio geometrico. Per una data sostanza in un dato stato la capacità fisica sarebbe stata costante, mentre la capacità geometrica avrebbe subito un aumento proporzionale a quello del volume. Questo tipo di considerazioni creava gravi problemi per la misurazione dei calori specifici con il metodo delle mescolanze, basato sull'ipotesi che il calore specifico fosse indipendente dalla temperatura.
Per quanto riguarda la dipendenza del calore specifico dalla temperatura, coloro che non seguivano l'ipotesi di Irvine facevano considerazioni di altro tipo destinate a giocare un ruolo decisivo nelle indagini successive. Gli oppositori di Irvine, postulando che il calorico potesse assumere uno stato latente, non registrabile dal termometro, erano comunque costretti a rispondere alla domanda se il calorico fornito a un corpo dall'esterno restasse interamente sensibile. Su questo problema Lavoisier e Laplace avevano espresso chiaramente la loro opinione: essi pensavano che una parte del calorico assorbito continuasse a rimanere libero e quindi producesse un aumento della temperatura; la parte restante del calorico sarebbe diventata invece latente e avrebbe prodotto l'espansione del corpo. Questa concezione, anche se suscitò alcune obiezioni (per es., da Deluc), era generalmente condivisa nell'ambiente francese. Si poneva quindi il problema della proporzione di calore assorbito che diventava latente e della sua eventuale dipendenza dalla temperatura. Se ciò fosse stato vero, infatti, la dipendenza del calore specifico dalla temperatura avrebbe trovato una giustificazione.
Nel corso del primo decennio del XIX sec. l'idea che il calore specifico dovesse diminuire al crescere della temperatura era sempre più condivisa nell'ambito della tradizione inaugurata da Lavoisier e Laplace. Questo punto di vista fu proposto con chiarezza dal mineralogista e teologo René-Just Haüy (1743-1822) nella seconda edizione (1806) del Traité élémentaire de physique, un manuale commissionato personalmente da Napoleone Bonaparte per essere adottato nei licei da poco istituiti. Haüy argomentava che a temperature più basse le molecole della materia erano più vicine tra loro, quindi le forze attrattive intermolecolari di affinità erano più intense e pertanto l'espansione avrebbe richiesto l'assorbimento di una quantità maggiore di calorico, con la conseguente diminuzione del calorico disponibile per aumentare la temperatura. In altri termini, più alta era la temperatura, minore era la parte di calorico assorbito che diventava latente e quindi maggiore era la quantità di calorico disponibile per far crescere la temperatura di un intervallo unitario. Tale conclusione era esattamente opposta a quella di Dalton, tuttavia le conoscenze acquisite non permettevano di dirimere la questione. Il problema fondamentale era, ancora una volta, quello della circolarità: per raggiungere una conclusione sperimentale sulla dipendenza del calore specifico dalla temperatura occorreva un termometro preciso, ma non era possibile controllare la correttezza del termometro se non conoscendo la dipendenza del calore specifico dalla temperatura.
Lo zero assoluto
All'inizio del XIX sec., uno degli argomenti più significativi del dibattito relativo ai concetti di calore specifico e calore latente era la determinazione del punto di zero assoluto della temperatura. Anche se tutti i caloricisti avessero condiviso l'idea che lo zero assoluto potesse essere raggiunto privando totalmente il corpo del calorico in esso contenuto, soltanto l'ipotesi di Irvine rendeva possibile il tentativo di determinare tale valore. Questo perché, secondo tale ipotesi, il contenuto totale di calore sarebbe risultato dal prodotto della temperatura assoluta per la capacità termica, e quindi, conoscendo la capacità termica e il calore totale, sarebbe stato possibile ricavare la temperatura assoluta; una volta determinata la temperatura assoluta di un punto di riferimento scelto opportunamente, sarebbe poi stato facile esprimere il valore dello zero assoluto in una qualsiasi delle scale termometriche convenzionali. Il calore totale di un corpo non poteva essere misurato nemmeno dai seguaci di Irvine; per lo scopo suddetto era sufficiente misurare la 'variazione' di calore totale in due stati successivi dello stesso corpo. Nella fusione di una data quantità di ghiaccio, per esempio, la variazione di calore totale (assumendo valida la conservazione del calore) sarebbe stata espressa dall'equazione cgx+L=cax, dove cg è la capacità termica del ghiaccio, ca la capacità termica dell'acqua, L il calore latente di fusione e x la temperatura assoluta del ghiaccio nel punto di fusione. Dato che x è 0° nella scala centigrada, lo zero assoluto di temperatura si sarebbe collocato a x gradi sotto lo zero di questa scala. Equazioni simili potevano essere formulate per qualsiasi cambiamento di stato, o per ogni reazione chimica in cui si verifica un assorbimento o un'emissione di calore. In ciascuno di questi casi la temperatura assoluta poteva essere dedotta dai valori misurati del calore latente (assorbito o emesso) e delle capacità termiche delle sostanze utilizzate. Alcune misurazioni volte a tal fine effettuate da Irvine e Crawford furono citate e integrate da alcuni seguaci di Irvine, tra cui Dalton e Murray.
Per gli oppositori dell'ipotesi di Irvine il fondamento stesso di questi calcoli era sospetto, poiché il loro concetto di calore specifico non giustificava l'equazione usata da Irvine per il calore totale. Esprimere il calore totale come semplice prodotto della capacità termica per la temperatura assoluta implicava, infatti, l'aver assunto che il calore specifico dovesse essere lo stesso per tutte le temperature. Come si è visto, quest'ipotesi era ritenuta ingiustificata o, almeno, non verificata. Tuttavia per i seguaci di Irvine l'espressione per il calore totale era valida per ogni data temperatura, anche se la capacità termica fosse variata con la temperatura, e quindi essi erano autorizzati a considerare la possibilità di determinare la temperatura assoluta come uno dei vantaggi della loro teoria.
Dato che le argomentazioni teoriche non erano conclusive, il dibattito si concentrò su una questione empirica, cioè se i valori dello zero assoluto ottenuti da diverse reazioni fossero o meno tra loro compatibili. La maggior parte dei seguaci di Irvine riteneva di aver ricavato risultati compatibili e questo accresceva la loro fiducia nella validità della teoria. I loro oppositori, a partire da Lavoisier e Laplace, la pensavano diversamente. A questi i primi replicavano attribuendo le apparenti discrepanze all'inaffidabilità delle misure di capacità termica. Con un'argomentazione accettata anche da Lavoisier e Laplace, essi si basavano sul fatto che il valore calcolato dello zero assoluto dipendeva sensibilmente dai valori della capacità termica: la controversia non era risolvibile con un verdetto sperimentale finché l'accuratezza delle misure di calore specifico non fosse diventata molto più elevata. Soltanto misurazioni più precise, come quelle effettuate da Delaroche e Bérard nel 1813, sembrarono confutare l'ipotesi di Irvine contribuendo al suo progressivo accantonamento. Tuttavia, i caloricisti che dissentivano da Irvine non trovarono mai un metodo per determinare lo zero assoluto, sicché questo argomento sparì gradualmente dall'insieme dei problemi ritenuti degni d'attenzione.
Conduzione, convezione e irraggiamento
La prima metà del XIX sec. fu contrassegnata da grandi progressi nello studio della trasmissione del calore. Anche se i tre processi distinti di trasmissione del calore oggi noti (ossia conduzione, convezione e irraggiamento) erano stati identificati già dal 1800, erano ancora vive alcune divergenze significative sulla natura di ciascun processo nonché sulla sua relazione con gli altri.
Sir Benjamin Thompson (1753-1814), meglio noto come conte di Rumford, aveva effettuato ricerche prestigiose su tutti gli aspetti della scienza del calore, tra le quali destarono immediato consenso da parte dei suoi contemporanei quelle svolte sulla trasmissione del calore. Nell'ultimo decennio del Settecento egli si era adoperato per chiarire la distinzione tra conduzione e convezione, definendo la prima come trasferimento diretto di calore da una molecola all'altra di un corpo e la seconda come trasferimento di calore prodotto dallo spostamento delle molecole all'interno di un fluido. Anche se il termine 'convezione' fu coniato soltanto nel 1834 da William Prout nel Bridgewater treatise, la distinzione concettuale tra convezione e conduzione fu sin dall'inizio universalmente riconosciuta come valida e illuminante. Da questa chiarificazione seguirono anche alcune conseguenze pratiche, come per esempio l'ineccepibile spiegazione del fatto che materiali come il piumino d'oca fossero buoni isolanti (e quindi utili per l'abbigliamento invernale) perché le piume ostacolavano il movimento delle molecole d'aria e quindi ritardavano la propagazione convettiva del calore.
Un'altra affermazione di Rumford, invece, creò parecchie controversie all'inizio del XIX secolo. I risultati dei suoi esperimenti mostravano, a suo parere, che l'acqua, l'aria e, con ogni probabilità, tutti i liquidi e i gas erano perfetti non conduttori del calore, essendo la trasmissione del calore al loro interno interamente dovuta alla convezione. Rumford, per esempio, provò a riscaldare una tinozza d'acqua dalla sua superficie superiore e mostrò che non si osservava alcun aumento di temperatura, neanche a piccole distanze dalla superficie stessa. Numerosi colleghi, compreso Leslie, respinsero con forza questa affermazione. Lo scioglimento della controversia dipendeva in gran parte dalla sensibilità dell'apparato sperimentale. Sebbene Rumford fosse in genere molto attento alla precisione e da questo punto di vista gli esperimenti da lui condotti fossero spesso migliori di quelli dei suoi contraddittori (per es., nelle ricerche per verificare se il calore avesse o meno un peso), ulteriori miglioramenti delle tecniche sperimentali finirono per rivelare che, almeno nei liquidi, avveniva una conduzione molto lenta.
Può sembrare che questi dibattiti non fossero gravati da grandi questioni teoriche, al contrario essi costituivano un aspetto importante dell'attacco generalizzato di Rumford verso le teorie del calorico. La sua idea era che il calore consistesse nella vibrazione delle molecole e che la conduzione del calore fosse prodotta dalla trasmissione delle vibrazioni armoniche da una molecola all'altra. I fluidi non potevano mantenere i movimenti oscillatori, data la mobilità delle loro molecole, e quindi al loro interno non poteva avvenire la conduzione. Queste argomentazioni non valevano per i caloricisti come Leslie, secondo i quali la conduzione non era altro che un flusso di calorico tra le molecole e non c'era ragione per escludere che tale flusso avesse luogo anche nei liquidi. Quindi, se Rumford avesse ammesso la conduzione nei fluidi sarebbe stato costretto ad ammettere che esisteva qualcosa di analogo al calorico che si propagava all'interno della materia ponderabile. Questa necessità teorica lo portò allora a sostenere che la piccola conduzione osservata nei fluidi fosse in realtà dovuta all'irraggiamento.
Un argomento che provocò discussioni ancora più animate fu quello relativo appunto alla trasmissione del calore per 'irraggiamento', termine con il quale ci si riferiva alla trasmissione di calore su distanze macroscopiche e che si pensava avvenisse istantaneamente e non attraverso un mezzo materiale. L'irraggiamento del calore era stato osservato già da lungo tempo in fenomeni dell'esperienza ordinaria, come, per esempio, la sensazione intensa e diretta di calore prodotta dal fuoco o da metalli roventi. Lper il calore radiante fu probabilmente accentuato dalla scoperta che esso poteva essere riflesso da superfici lucide, anche quando non era accompagnato da luce visibile. Testimonianze di simili osservazioni risultano già nel XVII sec. nelle opere dell'Accademia del Cimento di Firenze.
Probabilmente lo scienziato che riuscì ad attirare l'attenzione dei fisici sul calore radiante fu il ginevrino Marc-Auguste Pictet (1752-1825). I suoi esperimenti sulla riflessione del calore radiante potevano forse essere considerati come una ripetizione di quelli compiuti nel XVII sec. o di quelli effettuati successivamente dal naturalista e meteorologo ginevrino Horace-Bénédict de Saussure e dal poliedrico scienziato tedesco Johann Heinrich Lambert; tuttavia il lavoro di Pictet destò un interesse maggiore per diversi motivi. In primo luogo, conseguì risultati eclatanti: con una serie di ricerche egli mostrò che il calore si propagava per irraggiamento dal fuoco di uno specchio concavo di stagno al fuoco di un altro specchio distante dal primo più di 12 piedi (3,66 m ca.).
Gli esperimenti di Pictet erano anche relativamente precisi e sistematici; egli, per di più, inserì i suoi risultati in una teoria del calore notevolmente elaborata, assai simile a quella di Lavoisier e pubblicata all'incirca negli stessi anni nell'Essai sur le feu (1790). Inoltre Pictet era uno degli esponenti di spicco della fiorente comunità dei filosofi naturali di Ginevra, nella quale non solo si discutevano approfonditamente i lavori di ciascuno dei componenti, ma si era anche in comunicazione costante con gli studiosi degli altri principali centri di ricerca. Gli studi avviati da Pictet furono seguiti da un ricco e utile lavoro sperimentale realizzato da Rumford e Leslie sulla rapidità di emissione di calore per irraggiamento da parte di diversi tipi di superficie.
Dai sorprendenti esperimenti condotti da Pictet per dimostrare la possibile riflessione e concentrazione del 'freddo' radiante (ossia, del freddo emesso per irraggiamento) nacque una controversia interessante. Egli dispose nel fuoco del suo specchio concavo oggetti freddi (per es., un cubetto di ghiaccio) trovando che il termometro posto nel fuoco dello specchio opposto si abbassava immediatamente. Questi esperimenti colpirono a tal punto il collega ginevrino Pierre Prévost (1751-1839) da indurlo a costruire, per comprendere lo scambio di calore tra i corpi, uno schema interpretativo del tutto nuovo, che egli elaborò nel corso di molti anni a partire dal lavoro del 1791 intitolato Sur l'équilibre du feu. Pictet aveva spiegato il fenomeno di apparente trasmissione di 'freddo' radiante in termini di semplice conseguenza dell'irraggiamento di calore dal termometro verso l'oggetto freddo; era normale che si verificasse sempre un irraggiamento di calore da un oggetto caldo a un oggetto più freddo. Prévost generalizzò ulteriormente questa rappresentazione postulando che ogni oggetto irraggiasse calorico con una rapidità dipendente dalla propria temperatura. L'equilibrio termico sarebbe stato raggiunto quando la quantità di calorico emessa da un corpo in base alla sua temperatura fosse stata bilanciata dalla quantità di calorico ricevuta dall'ambiente circostante. In altri termini: c'è sempre un irraggiamento di calore che entra ed esce da ogni corpo e, quando sembra che non vi sia alcuna trasmissione, questo significa solo che è stato raggiunto un equilibrio dinamico. Uno dei vantaggi della teoria di Prévost consisteva nella possibilità di fare a meno di supporre che il corpo caldo 'sapesse' in qualche modo che ve ne era uno freddo nelle vicinanze pronto a ricevere la sua radiazione.
Le spiegazioni di Pictet e Prévost sulla radiazione del 'freddo' erano convincenti per la maggior parte degli scienziati a eccezione di Rumford, la cui visione del calore radiante divergeva sensibilmente dalle opinioni correnti. La concezione del calore radiante come emissione di particelle di calorico non era infatti compatibile con la sua idea del calore come effetto delle vibrazioni molecolari. Seguendo questa visione generale, Rumford concepiva il calore radiante come un fenomeno ondulatorio, ossia come propagazione di onde attraverso un etere onnipervasivo. Ciascun corpo avrebbe emesso raggi di una 'frequenza' caratteristica determinata dalla sua temperatura, ed essi avrebbero avuto il potere di portare la temperatura del corpo ricevente sempre più vicino a quella della loro sorgente. Gli stessi raggi avrebbero agito quindi esattamente come raggi 'calorifici' se ricevuti da un corpo più freddo della loro sorgente e come raggi 'frigorifici' se ricevuti da un corpo più caldo. Rumford, peraltro, propose esplicitamente un'analogia tra la radiazione calorifica-frigorifica e la propagazione e la risonanza dei suoni. Nel 1800, avendo ripetuto con successo l'esperimento di Pictet, Rumford scrisse a quest'ultimo che le vibrazioni più lente del ghiaccio contenuto in una bottiglia fanno sì che il termometro suoni una nota più bassa. Basandosi sulla precedente esperienza nello studio del potere radiativo e riflettente di superfici diverse, Rumford effettuò alcuni esperimenti per corroborare la sua ipotesi che l'irraggiamento del freddo fosse un fenomeno del tutto analogo all'irraggiamento del caldo e che la distinzione tra calore e freddo fosse solo relativa. Tuttavia, sembra che i suoi sforzi in questa direzione non bastassero a ribaltare il consenso a favore dell'ipotesi di Prévost.
Il fatto che il calore radiante fosse soggetto a riflessione suggerì immediatamente un parallelismo con la luce e tale parallelismo non poteva risultare che rafforzato quando si scoprì che il calore radiante era anche soggetto a rifrazione e addirittura a polarizzazione. Queste scoperte si ricollegavano all'antica congettura che la luce e il calore (e talvolta anche l'elettricità) fossero semplicemente manifestazioni diverse di una medesima entità ultima, un'ipotesi proposta per esempio da James Hutton (1726-1797), il geologo scozzese intimo amico di Black. Lo studio del calore radiante offrì dunque un terreno concreto sul quale le speculazioni sulla relazione tra calore e luce potevano essere elaborate.
Una ripresa dei dibattiti sulla relazione tra luce e calore si verificò quando, nel 1800, William Herschel, già scopritore di Urano, rese pubbliche le sue osservazioni sugli effetti di riscaldamento al di là del limite rosso dello spettro solare. Herschel s'imbatté nei raggi infrarossi nel corso di ricerche sul potere calorifico dei diversi colori dello spettro solare. Dapprima egli pensò che l'effetto termico osservato nello spazio oscuro al di là del rosso indicasse l'esistenza di una 'luce invisibile'. Questa sembrava una conclusione obbligata, poiché i raggi infrarossi provenienti dal Sole (e anche da sorgenti terrestri) mostravano di seguire le stesse leggi di riflessione e rifrazione della luce. Ulteriori esperimenti, tuttavia, spinsero Herschel a credere che ciò che egli stava osservando nella regione infrarossa non fosse luce invisibile (il che era per lui una contraddizione in termini) ma raggi calorici separati dalla luce dalla sola azione del prisma. Lo convertirono a questa opinione alcuni esperimenti sulla trasmissione della radiazione nei quali appariva evidente che alcune sostanze lasciavano passare la luce e non il calore e viceversa. Herschel vide tutto questo come una 'separazione' tra luce e calore; la sua autorevole opinione fu condivisa da molti, per esempio negli influenti manuali di John Murray (m. 1820) e Thomas Thomson (1773-1852), e talvolta il riscaldamento infrarosso fu considerato come la prova sperimentale più convincente della reale esistenza del calorico.
Le ricerche di Herschel diedero nuova vita alla questione dell'identità tra luce e calore. La conclusione di Herschel era che, almeno dal punto di vista empirico, luce e calore si manifestavano come due enti separati e che quindi l'onere della prova ricadeva su coloro che credevano nella suddetta identità. In realtà, prima che si potesse raggiungere una conclusione definitiva, dovevano ancora essere risolti alcuni vecchi problemi ontologici. Il caso di Leslie illustra bene la questione: egli fu il primo critico autorevole di Herschel nei dibattiti sulla natura dei raggi infrarossi. Sconcertando molti osservatori Leslie finì addirittura per negare l'esistenza stessa di tale forma di radiazione e con l'attribuire gli effetti termici osservati a carenze nelle tecniche sperimentali usate da Herschel. L'obiezione di Leslie nasceva dalla sua visione generale della relazione tra luce e calore, in cui il calore era considerato l'effetto della combinazione della luce con la materia ordinaria. Per questo Leslie pensava che la trasmissione di calore attraverso il vuoto potesse avvenire solo come effetto collaterale del passaggio della luce e concludeva asserendo che la radiazione termica non mediata dalla luce era dovuta a una pulsazione ondulatoria che si propagava attraverso l'aria. Anche se Leslie non ebbe molti sostenitori, la sua posizione fu più volte citata nella letteratura grazie alla grande stima che i colleghi avevano del suo lavoro sperimentale.
Le critiche più dannose e durature al punto di vista di Herschel vennero invece da coloro i quali accettavano i suoi risultati sperimentali ma ne mettevano in discussione l'interpretazione. Questa visione contraria emerse lentamente, dato che richiedeva un completo distacco dalle opinioni comunemente accettate circa la natura della luce e del calore; le vecchie idee sulla loro identità erano basate su una concezione materialista di entrambi questi agenti fisici; ma su tale base non c'era molto da obiettare all'interpretazione di Herschel. La spinta decisiva per la riaffermazione dell'identità venne invece dalla teoria ondulatoria della luce, a sostegno della quale potevano essere annoverati i fenomeni di interferenza e polarizzazione. Coloro che inseguivano il parallelismo tra luce e calore radiante cercarono allora di dimostrare che anche il calore radiante manifestava le medesime proprietà. Fu Jacques-étienne Bérard nel 1813 il primo ad affermare di aver osservato la polarizzazione del calore radiante, ma per una verifica convincente di tale asserzione si dovettero aspettare le ricerche del 1834 di James D. Forbes, geologo scozzese, allievo e successore di Leslie a Edimburgo. La visione del calore radiante come vibrazione eterea non era certo nuova, come si è visto discutendo le opinioni di Rumford, e fu ripresa senza difficoltà. Sembrava divenuto plausibile trattare sia la luce sia il calore radiante come aspetti di un solo fenomeno ondulatorio, che interagiva in varie maniere con le sostanze e gli organi di senso in funzione della sua lunghezza d. Il grosso del lavoro teorico e sperimentale che portò al consolidamento di questa nuova concezione fu effettuato dal fisico italiano Macedonio Melloni, che inizialmente condivideva le opinioni di Herschel.
La teoria caloricista dei gas
Nel XIX sec. la netta maggioranza dei caloricisti riteneva che la natura del calorico si manifestasse molto più chiaramente nel comportamento dei gas, piuttosto che in quello dei liquidi e dei solidi. Questo punto di vista era stato anticipato da Lambert e, ancora prima, dal fisico francese Guillaume Amontons (1663-1705), che aveva ottenuto alcuni importanti risultati sperimentali sul comportamento dei gas. Tuttavia, l'interesse verso essi cominciò ad avere grande diffusione solo nell'ambito delle teorie caloriciste. In tale ambito una delle difficoltà più note era l'impossibilità di isolare il calorico in forma di sostanza pura, un fatto normalmente attribuito alla sua alta affinità con la materia ponderabile. Tuttavia i gas (inclusi i vapori) potevano essere considerati come una buona approssimazione del calorico 'puro'. In particolare, coloro che avevano adottato l'immagine 'newtoniana', in base alla quale il comportamento macroscopico della materia doveva essere spiegato in termini di attrazioni e repulsioni tra particelle microscopiche, potevano essere quasi certi del fatto che il comportamento dei gas dipendesse pressoché esclusivamente dall'azione del calorico, dato che nei gas le particelle di materia ordinaria erano talmente distanti l'una dall'altra che le forze di affinità tra di esse risultavano trascurabili. Tale ipotesi dello status speciale dei gas, combinata con la credenza nella semplicità della Natura, fu la nota dominante di molte ricerche sui fenomeni termici nella prima metà dell'Ottocento.
La spinta principale in questa direzione si ebbe quando le ricerche quasi simultanee ma indipendenti di Joseph-Louis Gay-Lussac (Recherches sur la dilatation des gaz et des vapeurs) e di Dalton (On the expansion of elastic fluids by heat) mostrarono nel 1802 che tutti i gas si espandevano nella stessa proporzione se riscaldati per un intervallo fissato di temperatura. Sebbene a posteriori tale risultato sembri quasi ovvio, gli esperimenti richiesero un considerevole miglioramento nelle tecniche, per esempio nell'eliminazione dell'umidità dai campioni di gas. Unita alla molto più antica legge di Mariotte (o di Boyle), la scoperta di Dalton e Gay-Lussac fu la principale responsabile del diffondersi della convinzione che i gas seguissero leggi molto semplici. Essa spinse numerosi scienziati a ritenere che l'espansione termica di ciascun gas dovesse essere lineare o uniforme, con la conseguenza che i termometri a gas potevano essere considerati veri e propri termometri naturali e potevano sostituire il mercurio quale sostanza termometrica privilegiata. Come affermarono chiaramente sia Dalton sia Gay-Lussac, questa ipotesi aggiuntiva circa l'uniformità dell'espansione era priva di giustificazione logica e non verificabile sperimentalmente in assenza di uno standard termometrico convalidato indipendentemente; tuttavia fu considerata altamente plausibile nel clima dell'epoca. Tale punto di vista fu adottato da molti scienziati influenti, compresi Dulong e Petit, anche se le loro ricerche sperimentali degli anni Dieci dell'Ottocento avevano di fatto messo in luce differenze tra gli andamenti dell'espansione termica del mercurio e quella dell'aria.
L'ipotesi di semplicità non fu però l'unica ragione principale dell'attenzione verso i gas all'inizio del secolo. Parte di questo interesse derivava dalle maggiori sfide sperimentali e teoriche presentate dallo studio dei gas rispetto a quello dei solidi e dei liquidi, in particolare a causa della loro grande elasticità e compressibilità. Un intero terreno d'indagine si apriva ai ricercatori allorché ci si accorse che l'espansione termica dei gas poteva essere influenzata dalla variazione della pressione esterna e dal fatto che la compressione e la decompressione prodotte artificialmente determinavano cambiamenti di temperatura. Questo significava che, in aggiunta alle altre variabili che entravano in gioco nella fisica dei fenomeni termici per gli altri corpi (volume, densità, temperatura e calore totale), la pressione era per i gas una variabile cruciale. Da tali considerazioni, quindi, sarebbero derivate importantissime acquisizioni non soltanto riguardo al comportamento dei gas ma anche per la teoria generale del calore.
La spiegazione dei fenomeni adiabatici
Un argomento di intenso dibattito nell'ambito delle teorie caloriciste riguardava il raffreddamento e il riscaldamento adiabatico, ossia le variazioni di temperatura che si producono in un corpo senza che avvengano scambi di calore con l'esterno. Assumendo valida l'ipotesi della conservazione del calore, l'unico modo per trovare una spiegazione naturale di questi fenomeni doveva fare riferimento al calore latente; e quindi le spiegazioni proposte dipendevano in maniera decisiva dalle concezioni sulla natura del calore latente. Per questo i fenomeni adiabatici fornirono un importante terreno sul quale le teorie del calore latente allora in competizione potevano essere confrontate e verificate. In questo periodo non poteva certo essere messa in gioco la concezione moderna che i fenomeni adiabatici siano un chiaro esempio di conversione di calore in lavoro meccanico e viceversa, dato che le diverse teorie caloriciste non incontravano particolari difficoltà nello spiegare tali fenomeni.
A partire dall'Ottocento i fenomeni adiabatici divennero generalmente ben conosciuti, anche se in Francia, nel secolo precedente, non avevano suscitato particolare attenzione. Le prime osservazioni relative alle variazioni adiabatiche di temperatura furono effettuate nella sperimentazione di pompe ad aria e risalgono a Robert Boyle. Il riscaldamento del gas per compressione meccanica e il suo raffreddamento in seguito a espansione era un'osservazione comune, così come il riscaldamento che si verificava quando l'aria veniva fatta irrompere nel vuoto, ossia nel recipiente evacuato della pompa ad aria. Tra i commentatori del XVIII sec. di tali fenomeni vi erano Lambert, Pictet, de Saussure, William Cullen, insegnante e predecessore di Black, ed Erasmus Darwin, il nonno di Charles Darwin.
Le prime discussioni sui fenomeni adiabatici derivarono dagli studi meteorologici. In Francia, invece, furono le ricerche sulla velocità del suono condotte da Laplace a costituire il nucleo del nuovo interesse sulla questione. Alla fine del secolo Laplace era giunto all'idea che la ben nota discrepanza tra il valore osservato della velocità del suono nell'aria e il valore teorico previsto da Newton nei Principia poteva essere rimossa se si prendevano in considerazione le variazioni adiabatiche di temperatura che si verificano nell'aria quando la propagazione delle onde sonore ne comprime e decomprime piccole parti. Il compito di tradurre quest'idea in una dimostrazione rigorosa fu assegnato a Jean-Baptiste Biot e fu da questi eseguito in maniera abbastanza soddisfacente in un articolo pubblicato nel 1802 (Sur la théorie du son). Seguì poi, nel 1808, lo studio di Siméon-Denis Poisson (Mémoire sur la théorie du son), un altro seguace di Laplace; sia Poisson sia Biot di fatto non furono in grado di calcolare il fattore correttivo ma se la cavarono nel modo migliore deducendo che, se tale fattore doveva essere quello che eliminava la discrepanza tra i valori teorici e quelli osservati della velocità del suono, la variazione di temperatura nella compressione o espansione adiabatica avrebbe dovuto essere di 1 °C per un cambiamento di volume pari a 1/116 del volume originale. Questo numero costituì il valore di riferimento per un buon periodo di tempo.
A partire dal primo decennio del XIX sec., l'importanza dei fenomeni adiabatici era dunque ampiamente riconosciuta in tutti i maggiori centri di ricerca sul calore. Tuttavia non si può certo dire che vi fosse un pieno accordo sulla loro spiegazione. Le interpretazioni allora proposte possono essere distinte grosso modo in due classi: quelle che si rifacevano alle concezioni di Irvine e quelle che erano loro contrarie. All'inizio le prime sembravano più vantaggiose: basandosi sull'assunzione che la capacità termica di un corpo diminuiva assieme al volume era facile spiegare, mediante l'ipotesi di Irvine, perché la compressione producesse temperature più elevate. Una spiegazione del genere fu proposta, per esempio, da Dalton nell'articolo del 1802, Experiments and observations on the heat and cold produced by the mechanical condensation and rarefaction of air. Il caso del riscaldamento dell'aria che irrompe nel vuoto era un po' più impegnativo, ma non in maniera sostanziale. Dalton lo affrontò servendosi di un'altra assunzione comunemente accettata e cioè che la capacità termica di un volume dato di spazio vuoto fosse maggiore della capacità termica dello stesso volume pieno d'aria. La nozione di capacità termica del vuoto può sembrare strana e in effetti essa è priva di senso qualora ci si riferisca al calore specifico per unità di massa. Tuttavia il problema non si presenta se la capacità termica si riferisce al volume e il concetto acquista pieno significato se si suppone che il vuoto contenga sempre un certo ammontare di calorico. Quest'ultima era un'ipotesi piuttosto diffusa in quel periodo, almeno a partire da Lambert. Il riempimento di uno spazio precedentemente evacuato poteva essere pensato come diminuzione della sua capacità termica, il che avrebbe prodotto un aumento di temperatura nel momento in cui il calore non poteva uscire dal recipiente (dove peraltro la quantità totale di calorico aumentava, poiché insieme all'aria veniva immesso anche calorico). Altri seguaci di Irvine, tra i quali per esempio Murray, diedero spiegazioni analoghe dei fenomeni adiabatici. Leslie, invece, ne propose una descrizione leggermente diversa, in base alla sua convinzione che non fosse possibile ottenere il vuoto perfetto; egli immaginò il fenomeno come l'effetto della compressione dell'aria residua presente nel recipiente 'evacuato', riconducendo di fatto anche questo caso a quello più familiare di un normale riscaldamento per compressione.
Le concezioni di Irvine, come negli altri settori, non furono tuttavia prive di contestazioni. La loro critica fu guidata da Gay-Lussac il quale, in un articolo del 1807, Premier essai pour déterminer les variations de température qu'éprouvent les gaz en changeant de densité, et considérations sur leur capacité pour le calorique, propose un'obiezione sperimentale all'ipotesi che il vuoto contenesse calorico. Egli inserì un termometro in un vuoto torricelliano e fece variare il volume di tale spazio senza osservare alcun cambiamento di temperatura. Delaroche e Bérard, nella memoria sui calori specifici del 1813 già citata, proseguirono in questa critica, che ne era del resto una conseguenza naturale, considerato che il premio era stato messo in palio con lo scopo esplicito di produrre dati per decidere a favore o contro le teorie basate sull'ipotesi di Irvine. I diversi valori per i calori specifici ottenuti da Delaroche e Bérard erano in disaccordo con le predizioni della teoria di Irvine. Infatti, il calore specifico del vapore risultò pari a 0,8470 (avendo attribuito a quello dell'acqua un valore unitario), mentre la spiegazione di Irvine del calore latente di evaporazione richiedeva evidentemente che la capacità termica del vapore fosse più grande di quella dell'acqua. Analogamente, i valori ottenuti per i calori specifici dei gas erano in contrasto con le previsioni di Irvine sul calore assorbito o ceduto nelle reazioni chimiche. La formazione di acqua, per esempio, era sempre accompagnata dalla produzione di una notevole quantità di calore: in base alle sue concezioni ciò implicava che la capacità termica dell'acqua dovesse essere più piccola della media pesata del calore specifico delle due sostanze reagenti, ossigeno e idrogeno; i dati di Delaroche e Bérard indicavano invece proprio il contrario. Tali risultati furono considerati, almeno in Francia, come una confutazione decisiva delle concezioni di Irvine.
Tuttavia, per chi si opponeva all'ipotesi di Irvine, la confutazione dell'ipotesi stessa non era sufficiente: occorreva fornire spiegazioni alternative dei fenomeni adiabatici. Queste spiegazioni furono trovate con facilità anche se, come fu notato, risultò che era molto più difficile formularle in termini quantitativi. L'immagine intuitiva a cui entrambe le parti facevano ricorso si basava sull'analogia che vedeva le molecole di gas come spugne imbevute di calorico che veniva 'spremuto via' allorché si applicava una pressione esterna e il volume del gas veniva ridotto. Se per i seguaci di Irvine era possibile interpretare il processo come effetto della diminuzione della capacità termica delle molecole del gas, gli antagonisti erano costretti invece a supporre che il calore spremuto dalle molecole fosse presente allo stato latente prima della compressione. Questa concezione aveva il pregio di essere in perfetto accordo con l'idea, discussa in precedenza, che l'espansione termica fosse dovuta al calorico combinato o latente. Invertendo l'espansione in maniera forzata, il calorico prima divenuto latente sarebbe dovuto tornare allo stato sensibile.
L'esperimento dell'immissione di gas in un recipiente precedentemente evacuato continuava però a presentare alcune difficoltà teoriche. La dimostrazione sperimentale di Gay-Lussac che il vuoto non conteneva calore aveva minato le basi della spiegazione di Irvine ma certamente non favoriva la spiegazione alternativa. Da questo punto di vista non sorprende il fatto che Clément e Desormes, nella loro memoria sottoposta all'Institut de France nel 1812 (che sarà pubblicata in versione più ampia nel 1819 sul "Journal de physique" con il titolo Détermination expérimentale du zéro absolu de la chaleur et du calorique spécifique des gaz), scegliessero di aderire all'idea secondo la quale il vuoto conteneva calorico.
Clément e Desormes compirono notevoli progressi nell'analisi dei fenomeni adiabatici aderendo al punto di vista dei seguaci di Irvine, ossia considerando il vuoto come un'entità che possedeva una capacità termica fissata e che poteva mescolarsi ai gas. Ne derivava che la compressione di un gas poteva essere vista in termini di distruzione di una certa quantità di vuoto e quindi di assorbimento, da parte dell'aria, del calore precedentemente contenuto in quel vuoto. Nel caso dell'esperimento di immissione di gas in un recipiente evacuato, tutto il vuoto veniva distrutto e rilasciava il suo calore all'aria immessa dall'esterno. Questa concezione, combinata con il principio di Irvine sulla capacità termica, permise a Clément e Desormes di determinare in modo sperimentale molte grandezze importanti, mescolando varie quantità d'aria e di vuoto a diverse temperature iniziali, registrando poi le temperature risultanti e misurando la capacità termica dell'aria a varie temperature.
I risultati di Clément e Desormes erano molto interessanti. Molte misurazioni basate sul loro principio concordavano nell'indicare il valore 0,4 per il rapporto tra le capacità termiche (volumetriche) del vuoto e dell'aria e quindi, a differenza di quanto sostenuto da Dalton, le loro spiegazioni non richiedevano che il vuoto dovesse avere una capacità termica maggiore di quella dell'aria. L'accordo tra varie misure aumentò la loro fiducia nella correttezza del risultato. Essi fecero anche una stima della quantità totale di calorico contenuta in un vuoto a temperatura ambiente (12,5 °C): tale quantità avrebbe fatto aumentare la temperatura di un ugual volume d'aria a pressione atmosferica di 114 °C. Da ciò conseguiva che, comprimendo adiabaticamente l'aria per 1/114 del suo volume originale (il che equivaleva a distruggere 1/114 del vuoto originale), si produceva un aumento di temperatura pari a 1 °C, a patto di trascurare le piccole differenze che sarebbero state prodotte dal cambiamento della capacità termica dell'aria stessa soggetta a compressione. Clément e Desormes notarono che questo valore era molto vicino a quello calcolato da Poisson, ossia 1/116. Inoltre essi ricavarono un valore per lo zero assoluto pari a −267,5 °C, che era molto diverso dalle prime stime effettuate dai seguaci di Irvine ma straordinariamente vicino ai −266,6 °C, ossia al valore che essi avevano ottenuto seguendo l'idea di Amontons di estrapolare la curva di espansione termica (assunta in questo caso come una retta) fino al punto in cui il volume del gas si sarebbe annullato.
La fiducia che Clément e Desormes riponevano nella qualità della loro ricerca è del resto perfettamente comprensibile, anche se si è portati ad attribuire i brillanti risultati a coincidenze fortunate e forse a una selezione non obiettiva dei dati. La commissione dell'Institut comunque non favorì il lavoro dei due scienziati (anche se fu loro concessa una menzione onorevole), sicché la loro sconfitta ufficiale nella competizione finì per rafforzare in Francia la già forte opposizione contro le tesi di Irvine. Soltanto la pubblicazione nel 1819 della memoria di Clément e Desormes risvegliò un certo interesse verso la capacità termica del vuoto e in generale verso le idee di Irvine.
I due calori specifici
Dopo che l'attenzione teorica si fu concentrata sui gas e le procedure di misurazione dei loro calori specifici furono migliorate, la differenza tra i due tipi di calore specifico emerse sempre più chiaramente. Mentre il calore specifico a pressione costante (normalmente indicato con cp) era definito come la quantità di calore necessaria per riscaldare il gas di un grado lasciandolo espandere a pressione costante, il calore specifico a volume costante (cv) era definito come la quantità di calore necessaria per riscaldare di un grado un gas racchiuso all'interno di un volume fissato. La diversità tra le due grandezze era stata già osservata nelle misure di Crawford, peraltro senza che questi le attribuisse importanza, in quanto la differenza numerica rilevata era molto piccola. Anche Dalton nel New system of chemical philosophy (1808-1827) aveva affermato che cp era più grande di cv, ma non aveva discusso a lungo la questione.
Probabilmente fu Haüy, nella seconda edizione (1806) del Traité élémentaire de physique, il primo a dimostrare teoricamente che doveva esserci una differenza tra i due calori specifici se si ammetteva la validità dell'ipotesi di Lavoisier e Laplace: quando un corpo viene riscaldato, la parte di calorico che produce l'espansione deve essere tenuta distinta da quella che produce l'aumento di temperatura. Da tale ipotesi, infatti, segue che occorre fornire calore anche per far espandere un gas a temperatura costante. Quindi, se il processo di riscaldamento a pressione costante viene immaginato come separato in due fasi, ossia prima avviene un riscaldamento a volume costante e poi un'espansione a temperatura costante, è chiaro che cp deve essere più grande di cv, essendo cp=cv+ct, dove ct è la quantità di calore richiesta per l'espansione a temperatura costante, ovvero il 'calore latente di espansione'. Questo tipo di ragionamento sarebbe stato comunemente adottato dai caloricisti francesi, come si vedrà in seguito.
L'effettiva misurazione della differenza tra i due calori specifici presentava molte difficoltà, in particolare per quanto riguarda cv (il metodo del flusso costante di Delaroche e Bérard consentiva di misurare solo cp). La prima stima credibile del rapporto cp/cv (normalmente simbolizzato con la lettera greca γ) derivò non da una misurazione diretta ma dalla discussione teorica riguardante la velocità del suono. In base ai lavori di Biot e Poisson analizzati in precedenza, Laplace stesso si occupò della questione in un lavoro pubblicato nel 1816, nel quale asseriva che il fattore correttivo della velocità del suono di Newton era appunto la radice quadrata di γ e che il valore di γ era pari a 1,5; in effetti il valore richiesto per avere un accordo esatto tra teoria ed esperimento era 1,43, un valore non lontano dalla stima eseguita da Laplace. Quando finalmente Gay-Lussac e Jean-Joseph Welter (1763-1852) effettuarono una determinazione sperimentale ragionevole della grandezza, il valore ottenuto 1,3748, era abbastanza vicino a quello stimato da Laplace da creare una notevole fiducia nella validità dell'intero schema argomentativo.
La microfisica del calorico di Laplace
Con la graduale decadenza delle ipotesi di Irvine, il riferimento teorico per la comprensione del comportamento dei gas divenne quello della tradizione di Lavoisier e Laplace. Subito dopo l'esecuzione capitale di Lavoisier nel maggio del 1794, Laplace divenne in Francia la guida indiscussa nell'ambito della fisica del calore nonché in molti altri settori scientifici. Insieme al chimico Claude-Louis Berthollet (1748-1822), anch'egli in precedenza collaboratore di Lavoisier, Laplace dominò a lungo la scena delle scienze fisiche. Entrambi avevano un punto di vista genericamente newtoniano, in base al quale tutti i fenomeni dovevano essere spiegati in termini di forze centrali agenti tra particelle puntiformi. L'aspirazione di fondo della 'fisica laplaciana' era quella di condurre la fisica dei corpi terrestri allo stesso livello di perfezione al quale la scoperta della legge di gravitazione universale aveva portato la fisica dei corpi celesti. Nel primo decennio del XIX sec. Laplace cominciò a lavorare concretamente in questa direzione, formulando teorie della rifrazione ottica e dell'azione capillare basate su forze a breve raggio d'azione (trascurabili a distanze macroscopiche). Non riuscendo però a specificare ulteriormente la forma di tali leggi di forza, egli cercò di dimostrare che la loro esatta formulazione non aveva in fondo alcuna importanza.
Nella fisica del calore la strategia di Laplace era dello stesso tipo. Secondo Lavoisier il calorico era autorepulsivo (mentre calorico e materia ordinaria si attraevano reciprocamente); nella tradizione newtoniana, invece, queste azioni potevano essere concepite solamente in termini di forze a distanza agenti tra particelle, quindi anche il calorico doveva avere una natura corpuscolare (ossia essere un fluido 'discreto') e tra le particelle di calorico doveva esserci una forza repulsiva universale che era funzione della sola distanza tra di esse. Ancora una volta non sussistevano indizi per stabilire quale forma dovesse avere tale funzione; sicché negli studi di Laplace essa era sempre riportata come funzione incognita, a eccezione del fatto che essa doveva essere trascurabile a distanze macroscopiche. Il ruolo di tale funzione, quindi, non poteva spingersi molto al di là di quello di fornire altri simboli, i quali rappresentavano i suoi vari integrali che andavano presentati all'occorrenza come una costante incognita introducendo un integrale definito.
Per questo Laplace fu costretto a effettuare la sua analisi del calore studiando le forze tra le molecole piuttosto che le forze tra le stesse particelle di calorico. La visione matura di Laplace della teoria del calorico fu sviluppata in diversi articoli pubblicati all'inizio degli anni Venti dell'Ottocento e riassunti nel quinto e ultimo volume del Traité de mécanique céleste (1825), pubblicato due anni prima della morte. La sua visione si basava sulla costituzione molecolare della materia e su un equilibrio dinamico nello scambio di calorico per irraggiamento tra le particelle. L'idea di un equilibrio radiativo era stata probabilmente tratta dal lavoro di Prévost, ma Laplace non si diede pace finché non riuscì a fornire una spiegazione microscopica dell'emissione radiativa del calorico legato a una molecola. Alla fine egli attribuì tale processo alla forza repulsiva esercitata dal calorico presente nelle molecole vicine. Tuttavia, essendo però difficile capire come il calorico latente (o 'combinato') potesse staccarsi tanto facilmente dalle molecole, Laplace compì l'audace passo di supporre che all'interno delle molecole vi fosse anche calorico 'libero'. Egli postulò che il calorico latente non esercitasse forze repulsive e quindi non gli attribuì alcun ruolo nella sua visione dell'equilibrio radiativo; il calorico libero, invece, pur essendo trattenuto dalle molecole, manteneva la propria forza repulsiva, sicché il calorico emesso negli spazi intermolecolari era chiamato 'calorico libero spaziale', in modo da distinguerlo dal calorico libero nelle molecole. In questo Laplace finì per abbandonare la concezione del calore latente proposta da Lavoisier.
Laplace adottò gli assunti ontologici così stabiliti come punti di partenza. Una sua ipotesi cruciale e molto utile fu che la forza repulsiva tra due molecole adiacenti avrebbe dovuto essere proporzionale al prodotto delle quantità di calorico in esse contenuto. In questo modo l'equazione fondamentale della forza finiva per somigliare alla legge di gravitazione newtoniana, anche se la dipendenza dalla distanza era ancora rappresentata da una funzione incognita. Un altro vincolo era fissato dall'assunzione che tutte le molecole di una data quantità di gas in condizioni di equilibrio interno contenessero lo stesso ammontare, c, di calorico libero e che la forza repulsiva tra due molecole fosse proporzionale a c2. Laplace riuscì a dedurre da queste ipotesi la legge dei gas, oltre a risultati che rafforzavano la sua vecchia convinzione che il termometro ad aria fornisse la vera misura della temperatura. Tuttavia sembra che queste deduzioni non ottenessero molta considerazione; l'influenza di Laplace era già in fase di declino nel periodo in cui egli sviluppava i dettagli della sua teoria matura del calorico. Tenendo conto di tale contesto, non sorprende che le deduzioni di Laplace, basate su vaghe ipotesi speculative piuttosto che su una specificazione della funzione che esprimeva la forza tra le particelle di calorico, non riuscissero a riscuotere fiducia e infatti anche i suoi seguaci più fedeli decisero di astenersi dal proseguire ulteriormente su questa linea di ricerca.
Fourier e l'equazione della diffusione
Mentre teorici del calorico erano impegnati nella ricerca di spiegazioni fisiche e metafisiche delle azioni del calore, nei primi decenni del XIX sec. si andava formando una diversa tradizione di ricerca con indagini di carattere più fenomenologico. Il pioniere riconosciuto di questa tradizione fu Jean-Baptiste-Joseph Fourier (1768-1830). Quando, intorno al 1805, cominciò a lavorare sulla teoria del calore, Fourier risiedeva a Grenoble con la funzione di prefetto del Dipartimento di Isère, dopo aver accompagnato Napoleone Bonaparte nella spedizione in Egitto. Nel 1807 egli presentò all'Institut de France una memoria che conteneva alcuni risultati importanti, compresa una prima versione della famosa equazione della diffusione. Non avendo ottenuto reazioni significative al suo studio, Fourier riuscì a convincere Laplace a proporre nel 1811 un premio dell'Institut sul tema della conduzione del calore, premio che egli vinse facilmente con una versione riveduta della memoria del 1807. Tuttavia la commissione del premio, rilevando che la ricerca presentava ancora alcuni problemi irrisolti, non ne consentì la pubblicazione nei "Mémoires de l'Institut"; per questo motivo i principali risultati di Fourier furono pubblicati nel 1822 in una monografia a parte intitolata Théorie analytique de la chaleur. Malgrado una difficile accoglienza iniziale, il lavoro cominciò ben presto a suscitare un grande interesse e finì per esercitare una profonda influenza sullo sviluppo sia della fisica del calore, sia della matematica.
Il valore dell'analisi di Fourier risiedeva non soltanto nella matematizzazione completa e innovativa dell'argomento, ma anche e soprattutto in una consapevole ed esplicita messa a fuoco di un problema particolare. Questa restrizione era così radicale che gli studi di Fourier toccavano appena i problemi tradizionali delle teorie del calore. Non si trattava soltanto di mantenere una completa neutralità rispetto alla natura ultima del calore, atteggiamento che avevano condiviso a vari gradi anche Black, Lavoisier e altri teorici. In realtà Fourier non prese in considerazione gli effetti del riscaldamento dei corpi e accennò appena alle cause che possono essere di natura chimica o di natura meccanica. Il punto di partenza della sua analisi era soltanto l'ammissione di una qualche distribuzione iniziale del calore e di condizioni al contorno definite per la temperatura del corpo considerato, senza preoccuparsi del meccanismo che aveva prodotto e mantenuto la situazione di partenza. Fourier fece alcune riflessioni sui motivi che lo avevano spinto a non considerare gli effetti del calore (a parte la temperatura). La sua idea era, semplicemente, che una teoria del calore in senso proprio avrebbe dovuto trattare soltanto ciò che non si poteva ricondurre alle leggi della meccanica, escludendo perciò dalla trattazione teorica tutto quello che avrebbe potuto essere affrontato con considerazioni relative a forze tra particelle di materia e di calorico: Fourier era lieto di lasciare questi problemi meccanici alle ricerche corpuscolari di Laplace e della sua scuola. La conseguenza più significativa di tale impostazione era che, tra le altre cose, gli effetti espansivi del calore restavano fuori dal suo campo di interesse. L'unica classe di fenomeni che vi rientrava era, invece, quella riguardante il 'movimento' del calore. Non è chiaro se Fourier fosse convinto dell'impossibilità di ricondurre il flusso di calore ad azioni meccaniche tra particelle del calorico; ciò che invece appare evidente nel lavoro del 1822 è che egli considerava difficilmente effettuabile, alla luce delle conoscenze allora disponibili, la riduzione dei fenomeni di flusso di calore alla meccanica.
In sintesi, Fourier riuscì a individuare una classe specifica di problemi che si propose di risolvere per via matematica. Il punto di partenza di uno di questi problemi era la perturbazione della situazione di equilibrio nella distribuzione del calore, tale da produrre un flusso di calore dalle zone di temperatura più elevata a quelle di temperatura più bassa. In alcuni problemi si ammette che si ripristini una situazione di equilibrio (dopo un intervallo di tempo tendente all'infinito); in altri il risultato è uno stato stazionario in cui la temperatura si mantiene costante in ogni punto e si ha un flusso continuo di calore tra una sorgente e un pozzo. In ogni caso si ha una dissipazione di calore e la risoluzione del problema consiste nel rappresentare la distribuzione di temperatura come funzione del tempo e descrivere la velocità (e la direzione) con la quale il calore fluisce in ogni punto del corpo. Non sono invece presi in considerazione gli altri effetti della trasmissione del calore (per es., la dilatazione dei corpi), trattati addirittura come fattori disturbanti da trascurare per non complicare troppo l'analisi. Da questo nasce il commento ironico secondo il quale Fourier avrebbe affrontato solamente un caso di "dissipazione senza lavoro".
Non c'è dubbio che l'opera di Fourier ebbe conseguenze durevoli, ottenendo riconoscimenti significativi da parte sia dei contemporanei sia dei commentatori successivi. La sua notorietà ha molte cause e una di esse è di carattere filosofico. Il suo stretto rapporto con la filosofia positivista può essere colto nell'approvazione di Ernst Mach (1838-1916) nei suoi Die Prinzipien der Wärmelehre (I principî della termologia): "La teoria della conduzione del calore di Fourier può essere considerata come una teoria fisica ideale […]. L'intera teoria di Fourier consiste in realtà in una concezione dei fatti relativi alla conduzione del calore che appare coerente, astratta e quantitativamente corretta ‒ si tratta di un inventario dei fatti semplice, sintetico e ordinato in maniera sistematica" (Mach 1896 [1986, p. 113]).
La compatibilità con il pensiero positivista era riconosciuta anche dai contemporanei. Nel 1829 Fourier seguì le lezioni sul positivismo di Auguste Comte (1798-1857), il quale ammirava a tal punto la sua opera da dedicargli, insieme all'anatomista e zoologo Henri-Marie Ducrotay de Blainville, i suoi Cours de philosophie positive. Di fatto Fourier è spesso considerato il leader intellettuale della nuova generazione dei fisici francesi, ossia di coloro che stavano preparando verso la fisica laplaciana una ribellione silenziosa, in gran parte caratterizzata da un'indifferenza od ostilità di tipo positivistico contro le ipotesi circa forze e strutture microscopiche.
L'equazione della diffusione e la sua soluzione
Nonostante le sue dichiarazioni e inclinazioni positivistiche, Fourier fornì un quadro metafisico della conduzione del calore. Egli condivideva l'idea, all'epoca abbastanza diffusa e proposta tra gli altri da Laplace, che la conduzione in ultima analisi consistesse in un trasferimento di calore per irraggiamento tra le molecole. Tuttavia, la concezione di Fourier era basata sulla nozione alquanto inconsueta che i raggi di calore radiante possedessero una temperatura, essendo più caldi o più freddi; si trattava di una concezione che riprendeva in parte le idee di Rumford e divergeva dall'ipotesi caloricista dominante, secondo la quale il calore radiante era costituito da particelle di calorico dotate di un movimento aereo, in maggiore o minore quantità, ma senza avere esse stesse una temperatura. In ogni caso, le considerazioni sul meccanismo di radiazione non influenzarono le analisi matematiche di Fourier, ragion per cui si possono lasciare da parte le questioni ontologiche per concentrare l'attenzione sulle altre ipotesi fisiche che stanno alla base della sua trattazione.
Dato che le due variabili fondamentali alle quali ricorreva la teoria di Fourier erano la temperatura e la quantità di calore, risultava certamente necessario disporre di una concezione definita della relazione tra esse. Questa era molto semplice e si basava sull'assunto che il calore specifico di una data sostanza non dipendesse della temperatura. Non è chiaro fino a che punto Fourier fosse a conoscenza delle deduzioni teoriche e sperimentali a favore della dipendenza dalla temperatura del calore specifico. Né sembra che egli si preoccupasse di stabilire se parte del calore che scorreva nel conduttore potesse assumere uno stato latente per qualche motivo. Senza dubbio, la semplificazione introdotta da queste assunzioni fisiche fece sì che le equazioni di Fourier risultassero di più facile trattazione di quanto altrimenti sarebbero state.
Fu Mach a sostenere che "nella meccanica e nella teoria della conduzione basta in realtà individuare, per ciascun settore, un solo grande fatto" (Mach 1896 [1986, pp. 113-114]). Per la meccanica egli aveva in mente la gravitazione universale; qual era allora il fatto che aveva un'importanza analoga nella teoria della conduzione del calore? Per rispondere a questa domanda occorre risalire allo studio di Newton del raffreddamento in aria dei corpi riscaldati. La legge che ne derivò stabiliva che la velocità di raffreddamento doveva essere proporzionale alla differenza di temperatura tra il corpo caldo e l'aria circostante. Questa legge esercitava un forte fascino per la sua plausibilità intuitiva, ma le ricerche di Biot, Dalton, Dulong, Petit e altri dimostrarono che essa valeva solo in maniera approssimata. Lo stesso Fourier ammetteva che tale legge potesse con ogni probabilità non essere sempre rigorosamente valida ma, ipotizzando che potesse valere per piccole differenze di temperatura, la adottò come punto di partenza per lo sviluppo della sua analisi della dissipazione del calore. Nel procedere in tal senso egli stava comunque seguendo le indicazioni che Biot aveva dato nel 1804 in uno studio del problema di un'asta conduttrice riscaldata a un'estremità per mantenere una temperatura costante, questione che era stata trattata in modo simile ma con minor successo da Amontons nel 1703 e da Lambert nel 1779. In realtà, né Biot né Fourier adottarono esattamente la legge di Newton; in particolare, la legge andava generalizzata a tutti i tipi di trasmissione del calore e non riguardava più soltanto il caso del raffreddamento dei corpi macroscopici in aria. Questa è appunto la generalizzazione che Mach considerò l'unico fatto importante: "La rapidità con cui si annullano piccole differenze di temperatura è proporzionale a tali differenze". Fourier, inoltre, aveva bisogno di elaborare una versione di questo principio che fosse adeguata a trattare mezzi continui. Proprio questo adattamento lo condusse alla sua equazione della diffusione.
In ogni punto (o regione infinitesima) dell'interno di un corpo continuo la velocità di flusso del calore è, per ipotesi, proporzionale a quanto la temperatura nel punto diverge dalla media delle temperature dei punti circostanti. Nel caso unidimensionale quest'ultima differenza è espressa dalla derivata parziale del second'ordine della funzione temperatura rispetto alla coordinata spaziale. Intuitivamente, si può immaginare tale derivata seconda come indice della curvatura in ogni punto della curva che lega la temperatura alla posizione; a una curvatura positiva corrisponde una situazione in cui nell'intorno del punto si ha, in media, una temperatura più elevata che nel punto stesso. La rapidità della trasmissione del calore è anche proporzionale alla conducibilità termica interna del materiale. Il cambiamento di temperatura, quindi, risulta dal rapporto tra la quantità di calore trasmesso e il calore specifico della sostanza moltiplicato per la densità. Con tale procedimento, Fourier ottenne l'equazione seguente:
dove t e x erano rispettivamente la coordinata temporale e spaziale, ν la temperatura, C il calore specifico, k la conducibilità interna della sostanza e D la sua densità (in questa formula non si ricorre alla notazione moderna di derivata parziale). Questa equazione fondamentale fu modificata in vario modo a seconda delle diverse forme dei corpi presi in considerazione da Fourier. Per i casi in cui la conduzione avveniva in corpi di dimensione infinita occorreva aggiungere un altro termine per rappresentare la diffusione del calore dalla superficie del corpo verso l'esterno.
La prevedibile reazione di Laplace non si fece attendere: questi, infatti, era interessato al lavoro di Fourier ma lo considerava quanto meno incompleto, poiché il modo in cui era stata ottenuta l'equazione della diffusione non faceva alcun riferimento al meccanismo microscopico con il quale avveniva la trasmissione del calore. Già nel 1810 Laplace stesso si era messo all'opera per superare questo difetto, postulando un processo di trasmissione del calore per irraggiamento tra le molecole di un corpo continuo basato sull'ipotesi di Prévost. Attenendosi a queste considerazioni egli riuscì a ricavare l'equazione della diffusione di Fourier, considerando il proprio procedimento come quello che dava al risultato di Fourier il suo reale fondamento fisico.
A parte la discussione sulle basi fisiche dell'equazione della diffusione, la difficoltà di risolverla diede luogo a vivaci dibattiti e comportò importanti sviluppi nell'analisi matematica. Fourier stesso trovò un percorso innovativo per giungere alla soluzione, basandosi sui precedenti lavori di Brook Taylor, Daniel Bernoulli, Leonhard Euler e Jean Le Rond d'Alembert relativi allo studio delle corde vibranti. Questi studi avevano prodotto soluzioni della forma di onde sinusoidali stazionarie e Fourier si accorse che si sarebbe potuta risolvere l'equazione della diffusione in termini di serie infinite di funzioni sinusoidali. Lo sviluppo di tale metodo avrebbe in seguito portato a ciò che oggi si chiama analisi di Fourier, una procedura ricca di preziose applicazioni in vari settori della fisica e dell'ingegneria.
La ricerca di Fourier sulla conduzione del calore è dunque di grande importanza non soltanto per la funzione svolta nello sviluppo della teoria del calore, ma anche per il ruolo ricoperto nella storia della matematica e della fisica matematica. Fourier restituì perfezionato ciò che aveva preso in prestito dalla ricerca matematica precedente. L'elaborazione di tecniche per risolvere un dato tipo di equazioni senza far riferimento alle loro applicazioni fisiche fu un passo decisivo nello sviluppo della fisica matematica moderna. Con queste procedure, infatti, si potevano risolvere equazioni utilizzabili in situazioni fisiche riferite a sistemi materialmente anche molto diversi tra loro, ma che presentavano somiglianze dal punto di vista strutturale. Fourier era interessato proprio a queste analogie, in modo da poter applicare le stesse tecniche matematiche allo studio di fenomeni fisici diversi: anche il lavoro sul calore era da lui considerato come un contributo generale all'analisi matematica. Questo sarebbe emerso con grande efficacia, al di là degli studi di Fourier, allorché, per esempio, l'equazione della diffusione sarebbe stata più tardi adattata allo studio della propagazione di onde elettriche nell'ambito della telegrafia.
Il calore come funzione di stato
L'approccio relativamente microscopico seguito da Laplace nel derivare le note leggi che regolano il comportamento dei gas ebbe apparentemente un successo enorme; ciononostante, i dubbi sulla sua utilità interpretativa erano molto forti. La microfisica laplaciana risultava inefficace soprattutto nella trattazione dei fenomeni adiabatici. è in questo campo che è possibile collocare i primi approcci che adottavano quella peculiare trattazione macroscopica e fenomenologica che avrebbe caratterizzato le ricerche tanto di Sadi Carnot quanto della successiva termodinamica classica. Si prenderà ora in esame l'assunto centrale di questo tipo di analisi macroscopica, ossia l'ipotesi che il calore fosse una funzione di stato.
L'asserzione che il calore è una funzione di stato può essere in qualche modo confusa o quanto meno risultare ambigua, dato che nel periodo che si sta considerando questa terminologia non era stata ancora adottata. In taluni casi essa era solo un modo di ribadire l'ipotesi della conservazione del calore, anche se con un significato più specifico. La formulazione più accurata ed esplicita è forse quella data da Siméon-Denis Poisson nella memoria Sur la chaleur des gaz et des vapeurs:
Anche se non sarebbe possibile calcolare la quantità totale di calore contenuta in una data massa di gas [...], si potrebbe però valutare l'eccesso di quantità di calore che il gas contiene rispetto a quella che conterrebbe in determinate condizioni di pressione e temperatura scelte a piacere. Tale quantità in eccesso, denotata da q, sarà una funzione di p [la pressione], ϱ [la densità] e θ [la temperatura], o anche semplicemente di p e di ϱ, dato che le tre variabili sono collegate tra loro da [p=aϱ(1+αθ); con a e α costanti]; quindi abbiamo che q=f(p,ϱ), dove f è una funzione la cui forma è ancora da determinare. (Poisson 1823c, p. 337)
Alcuni aspetti di questa formulazione sono degni di nota; in primo luogo si ammette con chiarezza che non si può misurare e nemmeno calcolare la quantità totale di calore contenuta in un corpo. Ora, anche se in tutte le teorie materiali del calore il concetto di quantità totale di calorico contenuto in un corpo aveva un senso definito, solo i seguaci di Irvine disponevano di un metodo per misurare effettivamente tale quantità. Tuttavia, i 'cambiamenti' di tale quantità erano in linea di principio misurabili; per questo, secondo Poisson, la grandezza q poteva essere posta uguale a zero in uno stato arbitrario per poi calcolarne la sola variazione. Eppure anche le variazioni di q erano misurabili soltanto in situazioni attentamente controllate. L'unico modo per rendere operativo questo concetto era quindi quello di definirlo come completamente individuato da altre variabili più facilmente determinabili con misure dirette. La definizione di Poisson raggiungeva questo obiettivo, anche se egli non ne dava alcuna giustificazione. Dunque, per motivi che appaiono essenzialmente di convenienza, fu introdotta l'ipotesi addizionale che q potesse essere espressa come funzione di tre sole ‒ ma in definitiva due ‒ variabili, per altro facilmente controllabili.
Inoltre, dato che q era una variabile praticamente non misurabile, è lecito chiedersi perché fosse considerata così importante, soprattutto quando la tendenza che si andava affermando nella fisica dei fenomeni termici era di tipo positivistico e fenomenologico. Sembra, infatti, che il ruolo di q fosse eminentemente teorico. In particolare, l'assunzione che q fosse una funzione di stato introduceva proprio quell'utile vincolo teorico che caratterizzava la vecchia teoria di Irvine sulla capacità termica. Questa, infatti, forniva una relazione definita tra il calore totale, la temperatura assoluta e la capacità termica; quindi, anche se il calore totale non era di per sé misurabile, l'ipotesi di Irvine stabiliva una connessione teorica che rendeva possibile effettuare svariate previsioni controllabili. Per questo il suo abbandono finì per privare la teoria del calorico di gran parte del suo contenuto empirico e con l'assunzione che il calore totale dovesse avere una relazione funzionale definita con grandezze osservabili, come la pressione, la temperatura e la densità, si cercava di rimediare proprio a questa situazione.
Poisson seppe sfruttare bene la sua ipotesi. Nella memoria Sur la vitesse du son, anche questa pubblicata nel 1823 e destinata a portare avanti il lavoro di Laplace sulla velocità del suono, egli ricavò quella che oggi è nota come legge delle espansioni adiabatiche dei gas,
[2] PVγ = cost .
Poisson suppose che una certa quantità di gas fosse riscaldata a pressione costante (quindi soggetta a espansione) assorbendo una certa quantità di calore Q. Di conseguenza immaginò che lo stesso gas fosse riscaldato ulteriormente con una compressione adiabatica tale da portarlo al volume iniziale. Infine, il gas veniva raffreddato a volume costante fino alla temperatura iniziale assorbendo da esso la quantità di calore Q′. Essendo il calore una funzione di stato, il gas, nello stato finale, contiene esattamente la stessa quantità di calore che aveva all'inizio. Ne consegue che Q=Q′, dato che la seconda trasformazione nel processo sopra descritto è una compressione adiabatica, ossia avviene senza scambio di calore. Visto che le variazioni di temperatura che si erano verificate nel primo e nel terzo processo erano diverse tra loro, se ne poteva dedurre che Q era una grandezza proporzionale a cp (secondo la definizione data in precedenza) e Q′ era proporzionale a cv. Questo esempio mostra quanto poteva essere feconda l'ipotesi che il calore fosse una funzione di stato.
Carnot e la potenza motrice del fuoco
L'ipotesi che il calore fosse una funzione di stato trovò la sua applicazione più rilevante nelle Réflexions sur la puissance motrice du feu, la monografia pubblicata nel 1824 da Sadi Carnot (1796-1832), ingegnere e ufficiale dell'esercito francese. Carnot aveva raggiunto la sua maturità intellettuale nel periodo in cui in Francia si era sviluppato un grande interesse per le macchine a vapore, stimolato dal riconoscimento del carattere più avanzato dei progetti inglesi dopo la fine delle guerre napoleoniche. Questo interesse fu condiviso anche dal governo che commissionò a Regnault una serie di ricerche sperimentali rilevanti per il perfezionamento della macchina a vapore. Erano stati inoltre avviati diversi studi volti a raggiungere una migliore comprensione teorica del funzionamento delle macchine termiche, per esempio da parte di Biot nel 1816, di Petit nel 1818, del matematico Jean-Nicolas-Pierre Hachette negli anni 1818-1819 e, infine, di Clément e Desormes nel 1819.
Nei manuali di fisica e in gran parte della letteratura storiografica Carnot è considerato il principale precursore della termodinamica, anche se sfortunatamente il suo lavoro pionieristico fu preso in considerazione solo dopo la sua morte. Il fatto che Carnot ottenesse risultati notevolmente originali in completo isolamento rispetto alla comunità scientifica ufficiale ha dato luogo a numerose discussioni tra gli storici riguardo le fonti delle sue teorie. Si potrebbe sostenere che l'originalità di Carnot consiste nella sua capacità di sintetizzare spunti e suggerimenti provenienti da campi diversi; alcuni di questi meritano di essere richiamati in dettaglio.
Non c'è dubbio che l'opera di Carnot fosse essenzialmente incentrata sull'ingegneria delle macchine e non sulla fisica teorica. Il problema fondamentale che egli affrontò era centrale per la ricerca tecnica: come poter migliorare il rendimento delle macchine a vapore riducendone i costi. Normalmente il rendimento era definito come la quantità di effetto meccanico utile che poteva essere ottenuta, con una macchina termica, da una data quantità di combustibile (ossia da una data quantità di calore). Quindi, anche se Carnot ragionava in maniera molto astratta, i suoi obiettivi erano rivolti al problema pratico del rendimento delle macchine, un problema di livello diverso rispetto a quelli affrontati nelle ricerche fisiche e chimiche a lui contemporanee. Tuttavia ciò non significa che le ricerche di Carnot fossero di natura più applicativa di quelle effettuate normalmente dai fisici. Ancora non esistevano le basi teoriche per fornire una risposta al suo problema, sicché egli dovette riflettere su questioni fondamentali con il risultato di produrre idee la cui portata superava di gran lunga la soluzione del problema iniziale.
Tra gli spunti specifici che Carnot trasse dalla tecnologia delle macchine, i due più importanti sono riconducibili alle scoperte fatte da James Watt nel corso della sua opera di perfezionamento della macchina a vapore. L'installazione da parte di quest'ultimo del condensatore separato risaliva al 1765, ma la lezione che Carnot ne trasse era pur sempre relativamente originale: il lavoro non era prodotto dalla sola presenza di calore, bensì dal 'flusso' di calore da un luogo caldo a uno freddo. La seconda innovazione gli fu suggerita dall'introduzione da parte di Watt del cosiddetto 'principio espansivo': il vapore bollente poteva continuare a effettuare da solo ulteriore lavoro grazie alla sua tendenza a proseguire a espandersi nel cilindro; ciò significava che poteva essere ottenuto un sovrappiù di effetto meccanico anche dopo che l'afflusso del vapore nel cilindro era stato interrotto. Questa fase 'espansiva' trovò la sua espressione formale, nella teoria di Carnot, nel processo di espansione adiabatica che egli introdusse nel suo ciclo. Si può anche sostenere che le fonti di ispirazione tecnologica per le scoperte di Carnot non fossero ristrette al campo delle macchine a vapore. Egli introdusse un'analogia esplicita con le macchine idrauliche: una macchina termica era vista come un congegno in cui il calorico produceva lavoro meccanico 'cadendo' da una 'quota' a temperatura più elevata a un'altra a temperatura più bassa.
Dal punto di vista teorico, Carnot subì l'influenza maggiore dal collega Clément (che nel 1819 aveva finalmente ottenuto una cattedra presso il Conservatoire des Arts et MÉtiers) piuttosto che dai luminari dell'École Polytechnique. Egli riprese la ricerca sulla macchina a vapore di Clément e Desormes del 1819, ma interpretò la fase espansiva dopo l'interruzione dell'afflusso di vapore come un processo di espansione adiabatica (con conseguente raffreddamento del vapore) invece che come un processo di espansione isoterma (ossia a temperatura costante) per il quale sarebbe valsa la legge di Boyle. Inoltre Carnot adottò la 'legge di Clément e Desormes', in base alla quale una data massa di vapore a una data temperatura conteneva la stessa quantità di calore, indipendentemente dalla pressione (o temperatura) alla quale era stata generata. Questa legge, già anticipata da Watt, era ampiamente accettata nel periodo in cui Carnot stava scrivendo il suo saggio, anche se era stata criticata da Laplace e sarebbe poi stata generalmente confutata.
La trattazione della vita e dell'opera di Carnot non sarebbe completa se non si facesse menzione dell'influenza esercitata dal padre. Lazare Carnot (1753-1823), uno dei più importanti personaggi politici e militari della Francia rivoluzionaria e napoleonica, fu anche, difatti, un acuto fisico matematico. Nel trattato Essai sur les machines en général (1783) egli formulò una descrizione astratta delle macchine e si occupò del problema delle condizioni che avrebbero consentito di massimizzarne il rendimento. Il suo saggio discuteva soltanto di macchine 'meccaniche', ma non è azzardato supporre che il figlio stesse appunto cercando di estendere le conclusioni del padre anche alle macchine termiche. Ci sono anche alcune corrispondenze tra le loro concezioni; per esempio, l'insistenza di Lazare sul fatto che tra le parti delle macchine non dovesse verificarsi alcun tipo di urto (in altri termini, sul fatto che la comunicazione del moto dovesse avvenire solo tra parti che avevano la stessa velocità) si riflette nell'intuizione di Carnot secondo la quale, ogni volta che il calore viene trasmesso direttamente tra corpi che hanno tra loro una differenza di temperatura finita, si verifica uno spreco del potere di generare lavoro meccanico.
Alla luce di quanto discusso nei paragrafi precedenti, l'approccio di Sadi Carnot può essere anche considerato una felice mediazione tra quello di Fourier e quello di Laplace. Come Fourier, Carnot si rifiutò di effettuare ipotesi speculative sulla natura del calore e sui meccanismi microscopici dei fenomeni termici. D'altra parte egli seguì Laplace nell'indagare sugli effetti meccanici dell'alterazione dei corpi materiali prodotta dal calore. La sintesi di Carnot si tradusse nel principio basilare che la produzione di effetto meccanico in una macchina termica era sempre dovuta a un flusso di calore, ovvero al ripristino di una condizione di equilibrio termico, che prima era stata alterata. Il flusso di calore era sempre potenzialmente capace di produrre lavoro meccanico. Il compito degli ingegneri era quindi quello di far sì che gli sprechi di questa capacità potenziale fossero ridotti al minimo.
La macchina termica ideale di Carnot
Com'è stato accennato, si ritiene che l'originalità del lavoro di Carnot derivi in gran parte dal fatto che egli si occupò di un problema essenzialmente pratico, trattandolo però volutamente in una forma astratta e idealizzata. Dal momento che intendeva creare una teoria di tutte le macchine termiche e non solo delle macchine a vapore, egli fu costretto a formulare il problema in termini astratti, senza fare riferimento a particolari sostanze o meccanismi; secondo Carnot, il vapore serviva semplicemente come mezzo per trasportare il calorico, funzione che poteva essere espletata da qualsiasi altro corpo. A questo livello di astrazione, il funzionamento di una macchina termica poteva essere suddiviso in due fasi: la sostanza agente assorbe il calore da un corpo caldo; il calore assorbito viene ceduto a un corpo freddo. Era naturale immaginare che l'effetto meccanico desiderato sarebbe stato prodotto nella fase di assorbimento, dato che quasi tutti i corpi, quando assorbono calore, subiscono una dilatazione.
A questo punto, dunque, cominciavano a essere prese in considerazione le condizioni ideali del processo, ossia le condizioni che rendevano possibile ottenere il massimo rendimento. Com'è noto, l'ipotesi fondamentale di Carnot era che la produzione di effetto meccanico fosse dovuta al flusso di calore da un corpo caldo a uno freddo, ma egli mise subito in evidenza il fatto che il flusso di calore non produce effetto meccanico in qualsiasi circostanza: si verificano infatti i casi di 'dissipazione senza lavoro', come quelli che avevano dato origine alla maggior parte dei problemi affrontati da Fourier. Carnot sottolineò il fatto che un qualsiasi cambiamento di temperatura di un corpo al quale non fosse associato un cambiamento di volume (trascurando per il momento il calore chimico) implicava un inutile flusso di calore. Si dovevano quindi evitare, per eliminare queste situazioni di 'spreco', flussi di calore tra corpi a temperature diverse, e ammettere solo flussi tra corpi aventi la stessa temperatura.
Se questo criterio di massimo rendimento doveva essere rispettato nel delineare le caratteristiche di una macchina ideale, allora bisognava immaginare che questa avesse una struttura relativamente più complessa. Occorreva che, nella fase in cui la macchina assorbiva calore, la sua temperatura fosse uguale o tutt'al più minore per una quantità infinitesima, rispetto a quella (supposta costante) della sorgente di calore. La stessa condizione doveva valere quando la macchina cedeva calore: la sostanza avrebbe dovuto avere una temperatura uguale, o maggiore per una quantità infinitesima, rispetto alla sorgente fredda. L'unico processo non chimico capace di produrre nella sostanza una variazione di temperatura senza utilizzare un flusso di calore è appunto l'espansione adiabatica e questo si accordava bene con il principio espansivo di Watt, che suggeriva di lasciar espandere il vapore da solo anche dopo averne interrotto l'immissione nel cilindro.
Per completare il ciclo di Carnot, a questo punto, bastava soltanto un'ulteriore innovazione. Al fine di poter considerare il solo effetto meccanico dovuto al passaggio del calore attraverso la macchina, occorreva prendere in esame una situazione in cui la sostanza agente cedesse alla fine del processo esattamente la stessa quantità di calore che aveva precedentemente assorbito. Ciò poteva essere ottenuto, in base all'ipotesi che il contenuto di calore sia una funzione di stato, imponendo che la sostanza ritornasse esattamente allo stato iniziale. Per questo la macchina ideale di Carnot opera ciclicamente, il che costituisce uno degli aspetti che differenziano la sua ricerca dai lavori della maggior parte dei teorici della macchina a vapore a lui contemporanei, i quali prendevano in considerazione solamente l'effetto meccanico che veniva prodotto quando il vapore spostava il pistone e trascuravano il lavoro che occorreva fornire al fine di far tornare la sostanza al suo stato originale.
La descrizione che Carnot dà del suo ciclo ideale è piuttosto complicata e oscura, se considerata dal punto di vista attuale; la versione basata su quattro fasi, simile a quella presentata nei manuali moderni, fu data più tardi da Clapeyron. La descrizione di Carnot contiene tuttavia tutti gli elementi essenziali. La trasmissione di calorico alla e dalla sostanza agente doveva avvenire in maniera isoterma. Tutte le variazioni di temperatura della sostanza dovevano essere prodotte da espansioni e compressioni adiabatiche. L'effetto meccanico era in parte prodotto dall'espansione della sostanza e in parte speso nella sua compressione. Tuttavia si aveva un guadagno netto di effetto meccanico, dato che l'espansione avveniva a temperature più alte (e quindi a pressioni più elevate) rispetto a quelle della compressione. In alcuni casi Carnot usava una versione semplificata del ciclo, nella quale la differenza di temperatura tra la fornace e il corpo refrigerante era così piccola che l'effetto delle fasi adiabatiche poteva essere trascurato.
Una delle tesi più importanti che Carnot propose fin dall'inizio del suo trattato era che la macchina termica ideale avrebbe avuto lo stesso rendimento indipendentemente dalla natura della sostanza agente: questa conclusione derivava dal semplice assunto che il suo ciclo era di fatto 'reversibile'. L'idea che una macchina potesse funzionare all'inverso non era inconsueta tra gli ingegneri dell'epoca; pensando in particolare alle macchine idrauliche era facile immaginare che potessero funzionare in senso opposto, sollevando una certa quantità d'acqua a spese di una certa quantità di lavoro meccanico. L'analogia di Carnot con la 'caduta' di calorico rese più facile estendere questa idea anche alle macchine termiche e, su queste basi, gli fu possibile dare un'efficace dimostrazione della sua tesi.
Carnot prese in considerazione l'effetto complessivo di due macchine termiche 'accoppiate', ipotizzando il seguente processo: prendendo una macchina termica ideale reversibile in grado di produrre l'effetto meccanico L grazie alla 'caduta' del calorico Q tra due temperature fissate, è facile dimostrare che, se esistesse un'altra macchina termica con un rendimento maggiore della precedente (capace cioè di produrre un lavoro L′>L con lo stesso calorico Q), si potrebbe creare effetto meccanico dal nulla. Infatti, con la macchina più efficiente sarebbe possibile produrre un lavoro L′ lasciando cadere il calorico Q dalla temperatura più alta a quella più bassa e si potrebbe poi utilizzare solo una parte L di questo lavoro per riportare, facendo agire la prima macchina in senso inverso, la stessa quantità di calorico Q alla temperatura più elevata. In questo modo avremmo creato dal nulla una quantità di effetto meccanico pari a L′−L, il che è impossibile in linea di principio.
Avendo così stabilito che vi è un solo rendimento ideale per la caduta di una certa quantità di calorico tra due temperature fissate, Carnot si accinse a stimare l'entità di tale rendimento. Egli si pose il problema di confrontare tra loro le quantità di calore necessarie per produrre la stessa quantità di potenza motrice in due macchine termiche ideali operanti a diversi livelli della scala delle temperature. Dato che la macchina che avesse richiesto meno calore sarebbe stata la più efficiente, il problema si riduceva a quello di stimare la quantità di calore assorbita in un'espansione isoterma che si effettua a diverse temperature. Carnot immaginò quindi di riscaldare un campione di aria da 1°C a 100°C a pressione costante (quindi producendo un'espansione). Il risultato finale di un simile processo poteva essere raggiunto anche in due altri modi: (1) facendo aumentare la temperatura a 100°C a volume costante e quindi effettuando un'espansione isoterma; (2) effettuando un'espansione isoterma a 1°C e quindi facendo aumentare la temperatura a volume costante. Il calore totale utilizzato in entrambi i processi sarebbe stato lo stesso, dato che sia gli stati iniziali sia gli stati finali del gas coincidono (e qui entrava in gioco l'ipotesi che il calore fosse una funzione di stato); a questo punto Carnot sostenne che la fase di aumento della temperatura richiede più calorico nel processo (2) rispetto al processo (1), dato che il calore specifico cresce all'aumentare del volume (o al diminuire della densità), ipotesi che Carnot derivò dai risultati sperimentali di Delaroche e Bérard del 1813. Infine, dato che il calore totale assorbito dal gas nei processi (1) e (2) è lo stesso, ne segue che l'espansione isoterma in (1) deve richiedere più calore rispetto alla stessa fase in (2). Il che equivale a dire che il calore assorbito in un'espansione isoterma è tanto maggiore quanto più alta è la temperatura, per cui il rendimento di una macchina è minore a temperature più elevate.
Nelle Réflexions sur la puissance motrice du feu l'ipotesi che il calore sia una funzione di stato ha un ruolo fondamentale in questa e in molte altre dimostrazioni. Carnot la formulò in una nota a piè di pagina, peraltro in maniera molto simile alla versione generale datane da Poisson, definendo lo stato di un corpo in termini di densità, temperatura e stato di aggregazione. Per gli estimatori moderni di Carnot, un'ipotesi come questa, associata com'era all'assunzione della conservazione e della materialità del calore, costituisce l'aspetto più sfortunato della sua opera. Per questo molti hanno insistito sul fatto che la fiducia di Carnot riguardo l'idea del calorico e della sua conservazione fosse sempre stata incerta, per essere infine ripudiata decisamente nei manoscritti inediti scritti negli ultimi anni di vita e pubblicati dal fratello Hippolyte solo nel 1878. In ogni caso, la nostra discussione continuerà a riferirsi alle idee di Carnot nella forma in cui vennero formulate nelle Réflexions, dato che sono queste le idee che altri scienziati poterono conoscere intorno alla metà del XIX sec. e che contribuirono allo sviluppo della fisica.
Le principali conclusioni di Carnot sul rendimento delle macchine termiche non furono di grande aiuto per gli ingegneri, dato che esse ribadivano ciò che era già stato sperimentato nella pratica (per es., il fatto che a pressioni più elevate si ottenevano rendimenti maggiori, soprattutto se si adottava il 'principio espansivo'), ovvero prevedevano effetti di piccola entità (il rendimento è maggiore a temperature più basse). Eppure la sua opera conteneva, anche se quasi come digressione, alcune deduzioni interessanti e significative per la fisica dei gas ideali. Tra queste c'erano le dimostrazioni del fatto che la quantità di calore assorbita nel corso di un'espansione isoterma era indipendente dalla natura del gas e inoltre che la differenza (non il rapporto) tra i due calori specifici cp e cv era la stessa per tutti i gas e per tutte le densità di un dato gas (egli fece anche una stima numerica di questa differenza in base ad alcuni dati disponibili per il caso dell'aria). Infine Carnot derivò le relazioni tra calore assorbito e aumento di volume in un'espansione isoterma e tra il calore specifico e il volume. Questi risultati furono ottenuti in base all'ipotesi che il calore fosse una funzione di stato e che il rendimento delle macchine ideali fosse indipendente dal loro particolare meccanismo di funzionamento.
La riabilitazione di Carnot
In conclusione non è poi così sorprendente che l'opera di Carnot fosse ignorata dalla maggior parte degli ingegneri, dato che i suggerimenti pratici contenuti nella sua trattazione erano già abbastanza noti e ampiamente adottati. Meno chiaro è il motivo per cui Carnot non venisse preso in considerazione dai fisici accademici, dal momento che il suo lavoro conteneva molti aspetti rilevanti per la teoria calorica dei gas, anche se questi erano trattati in una prospettiva del tutto inconsueta. Sembra comunque certo che Carnot non si diede molto da fare per pubblicare le sue ricerche sulle riviste accademiche; questo fatto, unito all'assenza di legami formali con il mondo universitario, forse fu sufficiente a far sì che la monografia del 1824 sparisse senza lasciare praticamente alcuna traccia. La ripresa dell'opera di Carnot fu inizialmente dovuta a Émile Clapeyron (1799-1864), ingegnere civile laureato presso l'École Polytechnique e specialista nella progettazione e costruzione di locomotive a vapore.
Nel 1834 Clapeyron pubblicò nel "Journal de l'École Polytechnique" un Mémoire sur la puissance motrice de la chaleur, che altro non era che una riformulazione della teoria di Carnot. Essa tuttavia era più rigorosa dal punto di vista della trattazione matematica e più accessibile dal punto di vista intuitivo, grazie all'uso sistematico del diagramma indicatore di Watt, ossia di quella rappresentazione grafica in cui lo stato della sostanza agente viene riportato in un piano le cui coordinate sono la pressione e il volume (che è poi la rappresentazione del ciclo di Carnot adottata nella stragrande maggioranza dei moderni libri di testo).
Pur non alterando le idee fondamentali di Carnot, l'esposizione chiarificatrice di Clapeyron fu molto utile. In primo luogo egli riformulò la descrizione del ciclo nel modo seguente: lo stato iniziale della sostanza è definito da determinati valori del volume, della pressione e della temperatura (T1); dapprima la sostanza si espande con una trasformazione isoterma, assorbendo la quantità di calore Q da una sorgente a temperatura T1 e producendo la quantità di effetto meccanico L1; dopo di che essa continua a espandersi in maniera adiabatica fino a raggiungere la temperatura T2 della sorgente fredda e producendo l'effetto meccanico L2; la terza fase consiste in una compressione isoterma che restituisce alla sorgente fredda la stessa quantità di calore assorbita nella prima espansione e che richiede la spesa di una certa quantità di effetto meccanico L3; infine la sostanza viene compressa in maniera adiabatica, spendendo la quantità di effetto meccanico L4, fino a ritornare ai valori iniziali del volume, della pressione e della temperatura e quindi al contenuto totale di calore che aveva all'inizio; alla fine del ciclo, la caduta del calorico Q dalla temperatura T1 alla temperatura T2 ha prodotto l'effetto meccanico netto L=L1+L2−L3−L4.
Da questa esposizione del ciclo di Carnot si può notare come Clapeyron non solo mantenesse l'idea del calorico e della sua conservazione, ma assegnasse all'ipotesi che il calore fosse una funzione di stato un ruolo ancora più esplicito e importante di quello che essa aveva nella formulazione originale di Carnot. Dal punto di vista di Clapeyron, se lo stato del gas era individuato dal suo volume V, dalla sua pressione P, dalla sua temperatura T e dalla sua quantità di calore Q, allora la conoscenza dei valori di due di queste grandezze avrebbe permesso di determinare i valori delle altre. Ciò perché le relazioni tra di esse erano due: la prima era quella che oggi si riconosce come equazione di stato del gas ideale e che Clapeyron scrisse come
[3] PV=R(267+T);
la seconda era la relazione, ancora sconosciuta, che avrebbe dovuto esprimere Q in funzione delle altre variabili.
Uno dei principali obiettivi del lavoro di Clapeyron era appunto quello di dedurre e applicare questa seconda relazione. L'ipotesi che Q fosse una funzione di stato imponeva che tale grandezza, a una data T, dipendesse solo da P e da V; inoltre, secondo la legge dei gas ideali, il prodotto PV doveva essere una funzione lineare di T. In base a queste considerazioni Clapeyron ottenne il seguente risultato:
[4] Q=R(B−ClogP),
dove R era una costante e C e B erano rispettivamente due funzioni della temperatura.
La stessa equazione era già stata sostanzialmente ricavata da Carnot, tuttavia Clapeyron non solo la ottenne in modo più diretto, ma la usò anche in maniera più efficace. In particolare, nella sua trattazione, assumeva un'importanza centrale la variabile C, in seguito nota come 'funzione di Carnot', dato che Clapeyron riuscì a dimostrare che 1/C era proporzionale al rendimento della macchina ideale di Carnot. Partendo dalla sua equazione per il calore totale, Clapeyron ottenne una nuova derivazione dei risultati di Carnot riguardanti la quantità di calore ceduta nel corso della compressione adiabatica e la relazione tra i calori specifici dei gas.
Clapeyron aggiunse quindi qualcosa di sostanziale a quanto Carnot aveva già sviluppato e non si limitò a una semplice chiarificazione. Una di queste integrazioni fu quella di estendere il metodo di Carnot al caso di un sistema costituito da acqua e vapore in equilibrio. Questa analisi lo portò a stabilire un'importante relazione riguardante la variazione della pressione del vapore in funzione della temperatura, oggi nota come equazione di Clausius-Clapeyron. Inoltre Clapeyron utilizzò i dati disponibili per effettuare nuovi calcoli che confermavano quanto concludeva Carnot e cioè che la caduta del calorico per una differenza fissata di temperatura produceva un maggiore effetto meccanico a temperature più basse. In ogni caso il suo contributo più importante fu quello di far da tramite alle idee di Carnot presso gli scienziati della generazione successiva.
William Thomson (lord Kelvin) venne a conoscenza dell'opera di Carnot nel 1845 attraverso l'articolo di Clapeyron, mentre completava la propria formazione presso il laboratorio di Regnault. Le ricerche di Thomson sulla termodinamica cominciarono appunto con il tentativo di comprendere ed estendere le teorie di Carnot, a partire dalla sua definizione del concetto di temperatura assoluta del 1848. La teoria di Thomson conservò molti aspetti di quella di Carnot del 1824, anche dopo che egli fu convinto da James P. Joule ad abbandonare la concezione del calore basata sull'idea di calorico e sulla sua conservazione.
Il declino delle teorie caloriciste
Come si è visto, all'inizio del XIX sec. le ricerche sul calore erano nettamente dominate dai caloricisti, molti dei quali erano chimici. Durante il primo quarto del secolo, la teoria del calorico visse un periodo di grande favore e di intensa elaborazione, seguito però da una fase di declino. Non è semplice spiegare le cause di tale fenomeno. Nel periodo che va dal 1825 al 1845, infatti, non emersero nuove anomalie di difficile soluzione. Molti indizi, inoltre, inducono a credere, in modo ancora più sorprendente, che la disaffezione verso la teoria del calorico cominciò a manifestarsi molto prima dell'esistenza di soluzioni teoriche più efficaci. Sulle cause del declino delle teorie caloriciste si possono avanzare solamente alcune ipotesi.
è difficile valutare l'impatto degli attacchi alla teoria del calorico lanciati da una minoranza chiassosa di scienziati che comprendeva Rumford, Humphry Davy, Thomas Young, André-Marie Ampère e il meno conosciuto John Herapath. Come è oggi ampiamente noto, la teoria del calorico aveva risorse sufficienti per integrare quei fatti sperimentali (per es., quelli ottenuti da Rumford) che potevano esserle considerati contrari. è vero però che successivamente gli oppositori usarono in modo più incisivo gli stessi argomenti che erano stati sollevati dai primi avversari.
è possibile che, particolarmente in Gran Bretagna, la confutazione sperimentale della teoria di Irvine fosse stata considerata come una contestazione complessiva delle teorie del calorico, anche perché tale teoria aveva il vantaggio di essere più semplice e intuitiva delle versioni rivali. Il declino della teoria del calorico in Francia, invece, potrebbe essere messo in relazione con l'eccessiva complessità delle ipotesi adottate da Laplace, in un contesto in cui era in fase di regressione l'intero programma di ricerca della scuola laplaciana. è significativo il fatto che il personaggio più importante della fisica francese della metà del secolo sarebbe stato Regnault, il quale era totalmente contrario alla ricerca puramente teorica e sperava di riuscire a fondare la fisica solo sulle regolarità e sui fatti empirici. Può anche darsi che la reazione contro Laplace abbia fatto da sfondo allo spostamento verso una fisica dei fenomeni termici più fenomenologica e macroscopica, come nel caso delle ricerche di Fourier, Carnot e Clapeyron. Del resto, fu questa la tendenza che si affermò con forza anche nella nuova termodinamica, almeno fino alla rinascita della teoria cinetica. In un clima di questo tipo, non ci si deve sorprendere se le speculazioni sulle proprietà dei fluidi calorici o delle loro particelle diventassero sempre più irrilevanti.
Bibliografia
Brown 1967: Brown, Sanborn C., Benjamin Thompson, Count Rumford. Count Rumford on the nature of heat, Oxford, Pergamon, 1967.
Cardwell 1968: John Dalton and the progress of science, edited by Donald S.L. Cardwell, Manchester, Manchester University Press; New York, Barnes and Noble, 1968.
‒ 1971: Cardwell, Donald S.L., From Watt to Clausius. The rise of thermodynamics in the early industrial age, Ithaca (N.Y.), Cornell University Press, 1971 (rist.: Ames, Iowa State University Press, 1989).
Crosland 1967: Crosland, Maurice P., The Society of Arcueil. A view of French science at the time of Napoleon I, London, Heinemann, 1967.
Fox 1971: Fox, Robert, The caloric theory of gases. From Lavoisier to Regnault, Oxford, Clarendon, 1971.
‒ 1974: Fox, Robert, The rise and fall of Laplacian physics, "Historical studies in the physical sciences", 4, 1974, pp. 89-135.
Gillispie 1997: Gillispie, Charles Coulston, Pierre-Simon Laplace 1749-1827. A life in exact science, with the collaboration of Robert Fox and Ivor Grattan-Guinness, Princeton, Princeton University Press, 1997.
Grattan-Guinness 1990: Grattan-Guinness, Ivor, Convolutions in French mathematics, 1800-1840, Basel, Birkhäuser, 1990, 3 v.; v. II: The turns.
McKie 1935: McKie, Douglas - Heathcote, Niels H. de V., The discovery of specific and latent heats, with a foreword by Edward N. da C. Andrade, London, Arnold & Co., 1935.
Truesdell 1980: Truesdell, Clifford A., The tragicomical history of thermodynamics. 1822-1854, New York-Berlin, Springer, 1980.