La grande scienza. Immunologia
La grande scienza. Immunologia
Immunologia
La sopravvivenza dell'individuo e della specie in un ambiente microbiologico potenzialmente ostile dipende dall'esistenza di un sistema immunitario efficiente, in grado di fronteggiare virus, batteri, protozoi ed elminti, eliminandoli o contenendoli. La capacità stessa dei microorganismi di trasmettere malattia (patogenicità) è funzione della loro interazione con il sistema immunitario. Infatti nei soggetti con sistema immune alterato diventano patogeni microorganismi con cui abbiamo altrimenti una convivenza pacifica.
Il sistema immunitario costituisce un insieme di cellule e molecole che è stato paragonato per la sua complessità al sistema nervoso centrale. Il suo funzionamento si fonda su due funzioni fondamentali; ovvero riconoscere e comunicare. La funzione di riconoscimento consente di attivare i sistemi immunitari di difesa in presenza di una reale minaccia patogena e non contro l'organismo stesso, mentre la funzione di comunicazione risulta fondamentale per la regolazione di questo sistema altamente complesso, per il suo funzionamento ordinato, per la sua capacità di mantenere l'omeostasi, nonché per la sua corretta attivazione nel contesto spaziale e temporale.
Riconoscere è dunque una parola chiave fondamentale dell'immunologia. La percezione dell'identità di specie e di individuo costituisce uno degli elementi caratteristici del modo di funzionare del sistema immunitario. Così, per esempio, tutti sappiamo che i trapianti d'organo fra individui geneticamente scorrelati vengono rigettati, se non si interviene farmacologicamente. Ancora, il rigetto è particolarmente drammatico se si trapiantano organi di specie diverse come, per fare un esempio, quelli di maiale nell'uomo. Il sistema immune riconosce dunque l'identità dell'individuo e, in un certo senso, quella della specie. Quando le armi del sistema immune si rivolgono contro elementi propri dell'individuo stesso, si hanno malattie autoimmuni, quali il diabete giovanile o il lupus eritematoso sistemico.
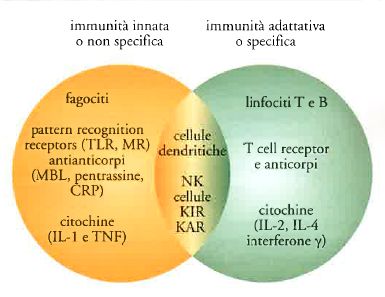
Il sistema immunitario è costituito da due universi che per lungo tempo sono stati visti come sostanzialmente separati (fig. 1). L'immunità innata o non specifica è quella primigenia nella scala evolutiva; le cellule responsabili dell'immunità innata sono spesso dotate di capacità fagocitica e sono presenti in organismi estremamente primitivi come la stella marina. Un fossile vivente quale il Limulus polyphemus, da cui ci separano circa 500 milioni di anni di evoluzione, è sopravvissuto così a lungo sul pianeta grazie a questo tipo di sistema di difesa, presente ed efficace anche nell'uomo. Fino a tempi relativamente recenti, lo studio dell'immunità innata ha costituito un argomento abbastanza marginale nella comunità degli immunologi.
Il secondo universo è costituito dall'immunità adattativa o specifica. I meccanismi dell'immunità adattativa sono comparsi nell'evoluzione in organismi relativamente complessi e sono caratterizzati dall'estrema specificità. Sono questi i meccanismi che vengono attivati dalle vaccinazioni, un tipo di intervento medico che ha avuto un impatto rilevante e a basso costo, sulla salute umana, debellando flagelli quali il vaiolo. I vaccini dimostrano la raffinata specificità dell'immunità adattativa: il vaccino contro il virus dell'epatite B protegge contro il virus B ma non contro A e viceversa.
In questo contributo verranno discussi i principî generali sui quali è fondato il funzionamento dell'immunità innata e dell'immunità adattativa, utilizzando come coordinate le parole chiave 'riconoscimento' e 'comunicazione' e sottolineando la differenza fra le strategie utilizzate.
Immunità innata
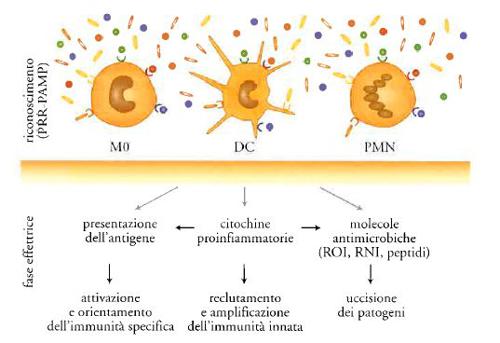
L'universo dei sistemi di difesa dell'immunità innata è costituito da una componente cellulare e da una umorale (fig. 1). La prima comprende i leucociti polimorfonucleati e i macrofagi, ossia le cellule dotate di attività fagocitica (fig. 2). Il riconoscimento dei patogeni da parte di queste cellule attiva sistemi di uccisione rapida, costituiti da intermedi reattivi dell'ossigeno e dell'azoto e da peptidi antimicrobici. Inoltre, il riconoscimento dei patogeni induce la produzione di citochine infiammatorie (IL-1, TNF, chemochine) che reclutano globuli bianchi e aumentano la risposta infiammatoria, amplificando così i meccanismi di resistenza innata. Infine, il riconoscimento dei patogeni attiva e orienta l'immunità specifica.
La componente umorale dell'immunità innata è costituita da molecole presenti nel sangue oppure nei liquidi biologici (per es., alveoli polmonari), quali la lettina che lega il mannosio (MBL), il surfattante A e D (SP-A, SP-D), le pentrassine corte e lunghe quali la proteina C reattiva (CRP) e PTX3. Queste molecole precedono nell'evoluzione gli anticorpi, ne svolgono le funzioni fondamentali e vengono perciò spesso chiamate 'antianticorpi'. Una volta legati al patogeno, gli antianticorpi attivano il sistema del complemento e favoriscono il riconoscimento da parte dei fagociti (opsonizzazione) analogamente a quanto fanno gli anticorpi.
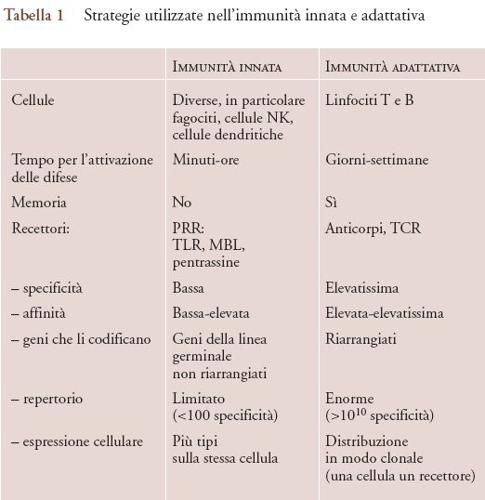
I sistemi dell'immunità innata riconoscono i patogeni attraverso pattern recognition receptor (PRR) presenti sulla membrana cellulare o solubili (gli antianticorpi). La strategia di riconoscimento utilizzata dai recettori dell'immunità innata è profondamente diversa da quella usata da anticorpi e dal 'T cell receptor' (recettore della cellula T, o TCR). La tab. 1 riassume e mette a confronto le caratteristiche fondamentali delle strategie di riconoscimento impiegate dall'immunità innata e dall'immunità specifica. I PRR riconoscono forme presentate da strutture molecolari diverse; in altri termini, lo stesso recettore può riconoscere strutture glucidiche, lipidiche o proteiche. La specificità e l'affinità sono perciò di regola relativamente basse se confrontate con quelle degli anticorpi. Le strutture riconosciute sono spesso essenziali per la vita del microorganismo; è questo il caso del lipopolisaccaride, componente principale della parete cellulare esterna dei batteri gram-negativi riconosciuto da TLR4.
Ancora, la stessa cellula di regola esprime più tipi di recettori, mentre linfociti B e T hanno un solo recettore, eccezionalmente due. Infine, i geni che codificano per i PRR non vanno incontro a modificazioni strutturali durante l'ontogenesi, mentre i geni dei recettori dei linfociti B e T vengono 'riarrangiati' durante la differenziazione di queste cellule. La strategia sottesa ai PRR ubbidisce dunque a un criterio di semplicità e versatilità.
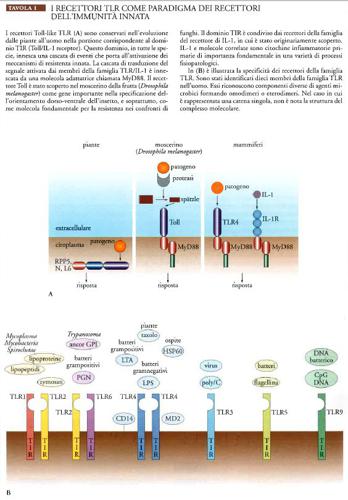
I recettori appartenenti alla famiglia Toll-like (TLR) costituiscono il paradigma dei recettori dell'immunità innata (Tav. I). Nell'uomo sono stati identificati dieci membri della famiglia TLR, i quali riconoscono componenti diversi di agenti microbici; l'azione di tale riconoscimento induce la produzione di citochine infiammatorie, che costituiscono un sistema di comunicazione dell'immunità innata.
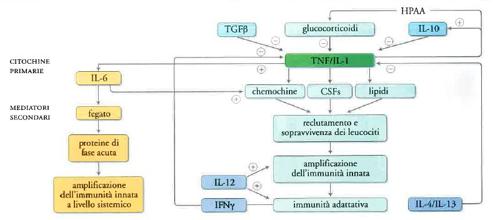
Infatti, le citochine sono mediatori centrali dell'infiammazione e dell'immunità innata (fig. 3). È utile distinguere le citochine infiammatorie in primarie e secondarie. Le primarie mettono in moto un'intera cascata della risposta infiammatoria; molecole prototipo di questa famiglia sono l'interleuchina-1 (IL-1) e il fattore di necrosi tumorale (TNF). Queste molecole, a livello sistemico, attraverso IL-6, agiscono sul fegato inducendo la produzione di proteine di fase acuta. La proteina di fase acuta in uso clinico come diagnostico è la CRP. Il significato generale della risposta di fase acuta a livello sistemico è quello di amplificare i meccanismi dell'immunità innata a tale livello. A livello locale, le citochine infiammatorie primarie agiscono inducendo la produzione di mediatori secondari (chemochine, fattori di crescita, molecole adesive, mediatori lipidici quali prostaglandine e NO) che amplificano il reclutamento dei leucociti dal torrente ematico ai tessuti. Il significato generale di questi mediatori è quello di amplificare a livello locale i meccanismi dell'immunità innata, i quali preparano il terreno per l'attivazione e l'orientamento dell'immunità adattativa. Questa cascata dei mediatori dell'infiammazione è sotto il controllo di circuiti inibitori estrinseci e intrinseci. Per esempio, l'asse ipotalamo-ipofisi-surrene attivato da IL-1 e TNF induce la produzione di glucocorticoidi che tendono a spegnere la cascata delle citochine. Ancora, cellule fondamentali dell'infiammazione, quali i macrofagi, in una fase tardiva della risposta producono citochine antiinfiammatorie, come IL-10 che spegne la cascata.
Immunità adattativa
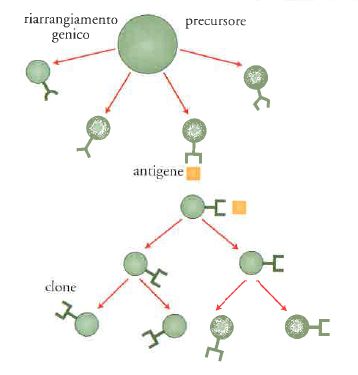
L'immunità adattativa o specifica è fondata sulla generazione di recettori altamente specifici, costituiti dagli anticorpi per i linfociti B e dal TCR per i linfociti T. Questi vengono rigenerati mediante il rimescolamento casuale di segmenti di DNA. Ogni cellula porta un unico recettore ed è l'incontro con 'l'altro da sé' (l'antigene) che seleziona in modo darwiniano la cellula più adatta, in grado di dare una risposta efficace (fig. 4).
Nel sistema immune i linfociti T costituiscono l'elemento centrale che orchestra e dirige l'attività degli altri elementi. Il fondamento della discriminazione fra self e nonself da parte del sistema immunitario è in larga parte dipendente dal fatto che durante la generazione dei linfociti T e B vengono eliminati o resi anergici i linfociti dotati di recettori che 'vedono' componenti del self. Tuttavia permangono nel sistema immune cellule autoreattive, che non esprimono la loro potenzialità distruttiva.
Come abbiamo ricordato sopra, i linfociti T, volendo utilizzare un'espressione abusata, costituiscono 'i direttori dell'orchestra' immunologica. Sono infatti i linfociti T che con il riconoscimento dell'antigene fanno partire la risposta immune specifica e la orientano a utilizzare le armi più efficaci al fine di contrastare l'agente esterno. Essi, per esempio, 'aiutano' le cellule B nella produzione di anticorpi e aumentano la capacità delle cellule dell'immunità innata di distruggere i microorganismi. La discriminazione fra self e nonself da parte dei linfociti T è dunque cruciale per attivare una risposta immune specifica nei confronti dei microorganismi e non dei costituenti normali dell'organismo. Tuttavia, la percezione del mondo esterno da parte dei linfociti T passa attraverso il riconoscimento del self.
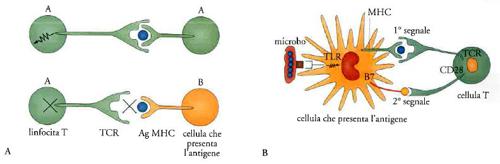
Infatti, il recettore dei linfociti T (TCR) vede il mondo esterno (l'antigene) non in quanto tale ma solo se presentato nel contesto di proteine del complesso maggiore di istocompatibilità (MHC). L'MHC costituisce una sorta di carta di identità immunologica dell'individuo. La funzione degli elementi che costituiscono l'MHC è di legare e presentare in modo appropriato frammenti di antigene al TCR dei linfociti T (fig. 5). I linfociti T riconoscono l'antigene (Ag) solo se presentato all'interno della carta d'identità molecolare dell'individuo costituita dall'MHC dell'individuo stesso. Per la scoperta di questo fenomeno, detto 'restrizione', nel 1996 è stato assegnato il premio Nobel a Peter Doherty e Rolf Zinkernagel. Dunque il riconoscimento del mondo esterno (nonself) da parte dei linfociti T passa attraverso il senso di identità immunologica costituito da MHC (fig. 5A).
Se è vero che 'l'altro da sé' viene visto dai linfociti T come frammento associato alla carta di identità immunologica dell'individuo costituita da MHC, è logico chiedersi quali cellule abbiano MHC e svolgano la funzione di presentare MHC. Esso è presente su tutte le cellule dell'organismo, con poche eccezioni, ma per l'attivazione di una risposta immunitaria è cruciale che il primo incontro del linfocita T con l'antigene avvenga grazie a cellule che sono specializzate nel presentarlo in modo adeguato. Infatti, il riconoscimento di un frammento di antigene adeguatamente presentato nel contesto di MHC non è sufficiente ad attivare i linfociti T e quindi a far partire una risposta immune (fig. 5B). Riconoscere non basta. Per attivare i linfociti T è necessario un secondo segnale, costituito da molecole costimolatorie. Esse vengono espresse a tempo e luogo da cellule specializzate dette dendritiche. Le cellule dendritiche sono sentinelle del sistema immunitario che pattugliano l'organismo, catturano gli antigeni e li presentano ai linfociti T fornendo anche il secondo segnale di costimolazione.
Le cellule dendritiche appartengono all'universo dell'immunità innata e non hanno recettori specifici. Esse hanno i PRR scarsamente specifici, tipici delle cellule dell'immunità innata. Tuttavia sono queste cellule 'non specifiche' che decidono, presentando il segnale di costimolazione, se far partire la risposta immunitaria specifica guidata dai linfociti T.
Abbiamo dunque visto come l'attivazione di una risposta immune specifica dipende non solo e non tanto dal riconoscimento dell''altro da sé' (nonself) da parte dei linfociti T, quanto dalla presenza di un segnale costimolatorio fornito dalle cellule dell'immunità innata. In altri termini, in modo un po' paradossale, sono gli elementi dell'immunità innata che decidono se far partire una risposta immunitaria adattativa.
Le risposte immunitarie adattative sono regolate e sostenute da citochine, come già discusso sopra per l'immunità innata. Le citochine sostengono la proliferazione e la differenziazione dei linfociti T e B. Per esempio, IL-2 è il più importante fattore di crescita per i linfociti T. Oltre a stimolare la crescita dei linfociti T, alcune citochine ne polarizzano la funzione (Tav. II).
Infatti le cellule T si possono specializzare ad attivare sistemi di difesa diversi: affrontare un batterio intracellulare, quale il Mycobacterium tuberculosis, richiede strategie di difesa diverse da quelle sollecitate da un grande parassita, per esempio un verme localizzato nell'intestino. Questa specializzazione o polarizzazione funzionale è riassunta nel paradigma Th1/Th2. Citochine tipiche delle risposte Th1 (virus e batteri intracellulari, difese macrofago-mediate) sono IL-12 e gli interferoni, mentre centrali per le risposte Th2 (parassiti, difese mediate da eosinofili e basofili) sono IL-4 e IL-5.
Cellule NK e cellule T: strategie complementari
Gli anni Novanta del secolo scorso hanno visto una svolta radicale nei paradigmi che si riferiscono a come il sistema immunitario discrimina ciò che appartiene o meno all'individuo (self verso nonself). Le cellule NK (natural killer) sono linfociti scoperti intorno alla metà degli anni Settanta del XX secolo. Queste cellule, di cui esistevano descrizioni di tipo morfologico, sono state individuate per la loro capacità di uccidere spontaneamente alcune linee tumorali, da cui il nome 'assassini naturali'. Per lungo tempo a un'analisi fenomenologica estesa e a tentativi, non riusciti, di utilizzarle in terapia antitumorale non ha corrisposto una reale comprensione del loro significato all'interno del sistema immunitario.
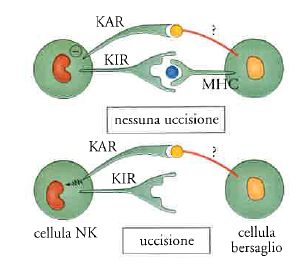
La svolta nello studio delle cellule NK e nei paradigmi che si riferiscono alla discriminazione self-nonself si è fondata su un intreccio fra teorizzazione e analisi sperimentale. Klaus Kärre aveva per primo osservato che le cellule NK uccidevano in modo efficace le cellule che avevano perso MHC e su questa base aveva formulato l'ipotesi che tali cellule avessero recettori del tutto peculiari, capaci di inibirne la funzione quando interagiscono con MHC normale. Lorenzo Moretta ha per primo dimostrato l'esistenza di questi recettori e ne ha definito la funzione (fig. 6).
Le cellule NK riconoscono dunque un missing self, ovvero la perdita di identità immunologica. Qual è il senso di questa strategia di difesa e come si integra con i sistemi mediati dai linfociti T discussi sopra? Una volta attivati, una parte specializzata dei linfociti T pattuglia l'organismo e uccide le cellule che presentano antigeni associati a MHC. Questo sistema di difesa è particolarmente importante nei confronti dei virus, che si riproducono obbligatoriamente all'interno delle cellule. Uccidere la cellula infettata è in questo caso la strategia più efficace per interrompere un'infezione virale.
I virus si sono evoluti con il sistema immunitario e, paradossalmente, lo conoscono molto meglio degli stessi immunologi. Si tratta, ovviamente, di una conoscenza darwiniana, basata sulla selezione delle varianti virali che meglio si adattano a sfuggire all'attacco del sistema immunitario. Per eludere il sistema immunitario i virus utilizzano diverse strategie. Una delle principali è costituita dal blocco dell'espressione o della funzione di MHC. Infatti, una cellula che abbia perso MHC è invisibile ai linfociti T. Si tratta di un vero e proprio bombardiere biologico invisibile che può produrre virus indisturbato.
Le cellule NK ovviano a questa intrinseca limitazione della strategia di riconoscimento dell''altro da sé' dei linfociti T. Le cellule NK nascono assassine, sono cioè costitutivamente capaci di uccidere. Esse sono però dotate di recettori inibitori, detti KIR (killer inhibitory receptors), che vedono MHC normale e frenano il loro potenziale distruttivo. Le cellule NK pattugliano l'organismo e controllano con i loro recettori le MHC. Chi ha perso o alterato la carta di identità viene ucciso (fig. 6). Non solo, ma in queste condizioni aiutano le cellule dendritiche a far partire una risposta immune. La strategia di riconoscimento delle cellule NK dell'identità perduta è dunque complementare a quella usata dai linfociti T.
Prospettive di sviluppo nell'epoca postgenomica
Negli ultimi decenni l'immunologia ha costituito uno dei settori più innovativi delle scienze biomediche. Essa ha fornito paradigmi generali che hanno avuto un impatto profondo sulla nostra comprensione dei meccanismi fisiopatologici. Queste conoscenze di base hanno avuto un impatto trasversale, influenzando profondamente la visione delle malattie sia di tipo strettamente immunologico sia di quelle apparentemente non relate all'immunologia.
Le tecnologie di tipo immunologico hanno modificato in modo drastico e rilevante la ricerca biomedica e la diagnostica clinica. Basti pensare alla tecnologia degli anticorpi monoclonali e allo sviluppo di sistemi immunometrici basati su dosaggi immunoenzimatici (ELISA). Questi contributi di tipo strettamente tecnologico hanno costituito una sorta di rivoluzione invisibile, nel senso che non è direttamente percepibile dagli utilizzatori finali. Ancora, lo sviluppo di nuovi vaccini, di farmaci immunosoppressivi più selettivi, di strategie di trapianto innovative, di terapie basate sull'utilizzazione di citochine o anti citochine, hanno avuto un impatto profondo sulla terapia di numerose malattie. L'immunologia è stata insomma uno degli elementi fondamentali della rivoluzione biotecnologica che ha caratterizzato gli ultimi decenni del XX sec. e che caratterizzerà ancora a lungo lo sviluppo delle scienze biomediche.
È ragionevole ritenere che ancor di più nell'era della genomica e della cosiddetta postgenomica, l'immunologia continuerà a costituire una delle branche più innovative dello sviluppo in biomedicina.
La ricerca immunologica è sempre stata contraddistinta da un approccio basato sulla formulazione di una ipotesi interpretativa cui segue la messa a punto di modelli sperimentali per la validazione dell'ipotesi di partenza. I nuovi strumenti di analisi della genomica e della proteomica, caratterizzati dalla capacità di studiare un numero molto elevato di molecole in parallelo, sono viceversa particolarmente adatti a un approccio sperimentale non vincolato da alcuna ipotesi di partenza. Questo cambio di prospettiva è potenzialmente in grado di porre in evidenza il ruolo inatteso di varie molecole in differenti processi biologici, portando alla formulazione di nuove ipotesi interpretative.
Esistono vari ambiti di ricerca dell'immunologia moderna cui questa dinamica può essere applicata. La definizione del profilo di espressione caratteristico di diversi tipi leucocitari porterà a una caratterizzazione su base molecolare del fenotipo cellulare, fornendo informazioni su nuovi marcatori cellulari potenzialmente utili anche in ambito diagnostico.
L'identificazione di geni responsabili di patologie a trasmissione ereditaria è oggi una realtà per un numero rilevante di patologie sostenute da alterazioni monogeniche. Tuttavia molte patologie, tra cui le autoimmuni, riconoscono una patogenesi poligenica che complessivamente si esprime con un incremento del rischio su base familiare. L'approccio metodologico tipicamente impiegato per l'identificazione dei geni coinvolti in questo tipo di patologie, rappresentato da studi di linkage genetico volti a mappare varianti alleliche di suscettibilità, può essere in vario modo integrato da metodologie di genomica funzionale. Alcuni studi basati sull'uso di DNA array hanno posto in evidenza alterazioni quantitative nei livelli di espressione di geni precedentemente associati in virtù di funzione e localizzazione cromosomica allo sviluppo di malattia, mentre in altri studi la stessa metodica è stata utilizzata per l'identificazione di varianti alleliche di geni selezionati associate a sviluppo di malattia. In entrambi i tipi di studio la necessità di analizzare un ampio pannello di molecole in contemporanea è adeguatamente corrisposta solo da tecniche di genomica funzionale.
Come in altri ambiti, anche in campo immunologico infine l'uso di tecniche di proteomica e genomica funzionale sarà rilevante per lo sviluppo di nuovi farmaci. La caratterizzazione degli effetti sul profilo genico espresso durante attivazione linfocitaria consentirà, per esempio, di definire gli effetti complessivi di potenziali agenti immunosoppressivi, di interpretarne meglio i meccanismi d'azione, di prevederne gli effetti collaterali, di sviluppare derivati dotati di maggiore specificità di azione.
Bibliografia
Garlanda 2002: Garlanda, Cecilia e altri, Non-redundant role of the long pentraxin PTX3 in anti-fungal innate immune response, "Nature", 420, 2002, pp. 182-186.
Mantovani 2000: Mantovani, Alberto - Dinarello, Charles A. - Ghezzi, Pietro, Pharmacology of cytokines, Oxford-New York, Oxford University Press, 2000.
Mantovani 2001: Mantovani, Alberto - Garlanda, Cecilia - Bottazzi, Barbara, PTX3/TSG14, in: Cytokine reference, edited by Joost J. Oppenheim and Marc Feldmann, New York, Academic Press, I, 2001, pp. 135-145.
Medzhitov 2001: Medzhitov, Ruslan, Toll-like receptors and innate immunity, "National review of immunology", 1, 2001, pp. 135-145.
Muzio, Mantovani 2001: Muzio, Marta - Mantovani, Alberto, The toll receptor family, "Allergy", 56, 2001, pp. 103-108.
Sallusto, Lanzavecchia 2001: Sallusto, Federica - Lanzavecchia, Antonio, Le cellule dendritiche, Genova, Forum service, 2001.
Santoni 2001: Santoni, Angela, Le cellule natural killer, Genova, Forum service, 2001.
Szalai 1997: Szalai, Alexander J. - Agrawal, Alok - Greenhough, Trevor J. - Volanakis, John E., C-reactive protein: structural biology, gene expression, and host defense function, "Immunologic research", 16, 1997, pp. 127-136.