La sconfitta di Big Pharma
La sconfitta di Big Pharma
Due colossi farmaceutici hanno venduto per anni un medicinale costosissimo per la cura di una grave malattia degli occhi. Finalmente ora l’Antitrust ne accerta l’accordo illecito per ostacolare la diffusione del più economico Avastin e li punisce con oltre 180 milioni di euro di multa.
«La Commissione tecnico scientifica dell’AIFA, nel corso nella seduta del 9 e 10 giugno, si è espressa a favore dell’inserimento di bevacizumab (Avastin) nell’elenco dei farmaci erogabili a totale carico del Servizio sanitario nazionale»: poche righe, rese note dall’Agenzia italiana del farmaco (AIFA), chiudono il caso dell’anno. Era esploso sui media il 5 marzo 2014, quando l’Autorità garante della concorrenza (l’Antitrust) ha annunciato una multa da 180 milioni di euro nei confronti delle industrie farmaceutiche Roche e Novartis colpevoli, secondo l’Authority, di essersi «accordate illecitamente per ostacolare la diffusione di un farmaco molto economico, chiamato Avastin, nella cura della più diffusa patologia della vista tra gli anziani e di altre gravi malattie oculistiche, a vantaggio di un prodotto molto più costoso, il Lucentis, differenziando artificiosamente i due prodotti». Per capire cosa è accaduto in questi mesi di bagarre mediatica bisogna seguire 3 piste: quella medica che indaga i farmaci e la loro eventuale equivalenza, quella industriale e quella normativa, in carico all’AIFA e al Ministero.
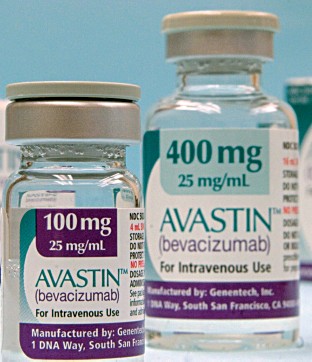
Cominciamo dalla prima. Siamo di fronte a 2 farmaci, entrambi efficaci per la cura della degenerazione maculare e di altre patologie oftalmiche (DMLE) legate all’età: l’Avastin (bevacizumab) di Roche e il Lucentis (ranibizumab) di Novartis, entrambi scoperti e brevettati dalla californiana Genentech. Oltre 30 studi scientifici dimostrano che per quanto riguarda certe malattie degli occhi fanno lo stesso mestiere.
Oggi, però. Perché nel lontano 2004 per curare la degenerazione non c’erano medicine efficaci. In oncologia era stato, invece, testato e approvato un antiangiogenetico (capace cioè di bloccare i vasi sanguigni che portano linfa al tumore), l’Avastin, che, tra i suoi effetti possibili, se opportunamente dosato e iniettato direttamente nell’occhio poteva trattare la DMLE. Ottima notizia dunque, e l’AIFA ne autorizzò l’uso con la modalità off label (fuori da quelli contemplati nella scheda di registrazione). A scompaginare le carte arrivò però Lucentis, registrato da Novartis – che ne ha rilevato la licenza da Genentech – proprio per la cura della DMLE: disponibile a pagamento dal giugno del 2007 e rimborsato dal Servizio sanitario nazionale (SSN) a partire dal gennaio del 2009. In presenza di un farmaco specifico la prassi vuole che non si utilizzi un off label, a meno che l’azienda non ne chieda la registrazione ad hoc. E Roche (che nel frattempo ha acquisito Genentech e ne detiene i diritti) non lo ha fatto. Così nel 2007 l’AIFA si trova di fronte a un farmaco abbastanza economico, l’Avastin, e a uno nuovo, il Lucentis, che costa 50 volte di più, e conferma la possibilità di usare il prodotto Roche: lo inserisce nella lista della 648 (in riferimento alla legge 648/96), l’elenco di quei medicinali che possono essere prescritti dai medici sotto la loro responsabilità personale per curare malattie per le quali non sono esplicitamente registrati. Da allora è polemica tra la Società oftalmologica italiana, che assicura che i prodotti sono assolutamente equivalenti, e Novartis, che sostiene il suo prodotto affermando che è stato testato specificamente per uso oftalmico con studi che hanno dimostrato un migliore profilo di sicurezza. Una motivazione che convince l’AIFA: nel 2012, l’agenzia rimuove Avastin dalla lista della 648 e obbliga i medici a prescrivere quello più costoso, a carico del SSN.
Oggi, nonostante l’azione dell’AIFA del 2012, il Consiglio superiore di sanità, incaricato dalla ministra Beatrice Lorenzin di stabilire il vero, sancisce: «I due farmaci non presentano differenze statisticamente significative dal punto di vista dell’efficacia e della sicurezza nella terapia della degenerazione maculare senile».
Ci chiediamo allora: perché Roche non vuole venderlo agli oculisti? E perché l’AIFA lo ha rimosso dalla lista 648 nel 2012? E torniamo al 2009, quando Roche acquisisce Genentech e i diritti di bevacizumab e ranibizumab, questi ultimi poi ceduti subito a Novartis.
L’intreccio tra le società è tutto scritto nei rilievi fatti dall’Antitrust, che ha condotto un’inchiesta e deliberato l’esistenza di un cartello tra i 2 colossi per spingere il prodotto più costoso: Lucentis costa circa 800 euro e Avastin 16 (i prezzi sono molto variabili ma la differenza resta). Roche, sostiene l’Antitrust, aveva interesse ad aumentare le vendite di Lucentis perché attraverso la sua controllata Genentech ottiene su di esse le royalties da Novartis. E quest’ultima, oltre a guadagnare dall’incremento delle vendite di Lucentis, detiene una rilevante partecipazione in Roche, superiore al 30%. L’Antitrust stima che solo nel 2012 l’intesa sia costata al SSN 45 milioni di euro oltre il necessario.
Perché le autorità sanitarie glielo hanno permesso? Abbiamo già detto che l’inserimento dell’Avastin nella lista degli off label consentiti dava agli oculisti la possibilità di prescriverlo in scienza e coscienza. A garantire una volta per tutte questa possibilità ci voleva pensare l’allora ministro Renato Balduzzi, che aveva inserito in una prima stesura del ‘decretone’ che porta il suo nome (poi diventato legge nel novembre del 2012) uno specifico articolo 11, comma 3 relativo proprio all’«Impiego intravitreale di bevacizumab» per assicurare che esso fosse somministrato nelle specifiche strutture del SSN per uso oculistico. Ma, dopo molte e furiose proteste di Farmindustria, un emendamento al decreto proposto in Commissione Affari sociali da Laura Ravetto e Giancarlo Abelli (PDL) fu approvato coi voti di PDL, Lega e UDC e cancellò questa norma.
La scelta del Parlamento è più o meno contestuale a un’altra scelta che oggi sembra davvero sbagliata, quella della commissione tecnico-scientifica dell’AIFA che nelle sedute del 26 e 27 settembre 2012 ha disposto la rimozione dell’indicazione dell’uso intravitreale di Avastin dalla lista della 648/1996. Così la partita si chiude mentre cala l’inverno del 2012: ha vinto Novartis. Fino a che, qualche mese fa, l’Antitrust non rende note le sue indagini e il procuratore torinese Raffaele Guariniello non apre un’inchiesta per disastro colposo a carico dei manager di queste multinazionali.