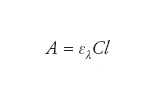legge di Lambert e Beer
legge di Lambert e Beer
Sviluppata sulla base delle ricerche di Johann Heinrich Lambert e perfezionata in seguito da August Beer, è sicuramente una delle relazioni empiriche più utilizzate nella chimica analitica. La legge correla la quantità di luce assorbita da una sostanza con la sua concentrazione, con la sua natura chimica e con lo spessore del mezzo attraversato. In termini pratici una luce (poli- o monocromatica) che colpisce una soluzione contenente una certa quantità di una sostanza chimica, perde parte della sua energia in modo direttamente proporzionale alla concentrazione della sostanza nella soluzione stessa e alla dimensione dello spessore di soluzione che deve attraversare, il tutto corretto per un parametro costante per ogni sostanza detto coefficiente di estinzione molare:
dove A è l’assorbanza ed esprime la quantità di luce assorbita, C è la concentrazione della specie in esame espressa generalmente in moli/l, l il cammino della luce attraverso la soluzione generalmente espresso in centimetri ed ελ è un coefficiente caratteristico detto di estinzione molare, o assorbività molare, espresso in moli−1 cm−1. La relazione precedente è una relazione lineare fra l’assorbanza e la concentrazione della specie di cui si vuole misurare la concentrazione, purché sia noto il coefficiente di estinzione molare. Il valore di ελ viene assunto costante per una data sostanza a una data lunghezza d’onda, anche se può subire piccole variazioni con la temperatura. Ovviamente questa situazione risulta applicabile solo all’interno di un dato intervallo di concentrazioni, al di sopra delle quali la linearità tra assorbanza e concentrazione può essere inficiata da fenomeni chimico-fisici.