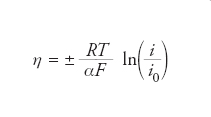legge di Tafel
legge di Tafel
La circolazione di corrente nei sistemi elettrochimici è determinata da un campo elettrico imposto ed è associata a delle cadute di potenziale, che possono essere essenzialmente di tre tipologie: ohmiche, di polarizzazione e dovute a sovratensione di elettrodo. Quest’ultima rappresenta la tensione che è necessario fornire al di sopra di quella termodinamica per far avvenire la reazione elettrodica, vale a dire quel processo in cui vi è trasferimento di carica fra ioni dispersi in soluzione ed elettrodo. La legge di Tafel, formulata dall’elettrochimico tedesco Julius Tafel nel 1905, correla la sovratensione di elettrodo η alla densità di corrente circolante i e può essere espressa, in forma generale, come:
dove l’espressione ha valore positivo o negativo a seconda che la reazione sia anodica o catodica, R è la costante dei gas perfetti (8,314 Jmol−1K−1), T la temperatura espressa in Kelvin, α una costante, nota come coefficiente di trasferimento, legata alla particolare reazione elettrochimica considerata e avente valore compreso tra 0 e 1, F è la costante di Faraday e rappresenta la carica associata a una mole di elettroni (96.500 C), e infine i0 è la corrente di scambio e rappresenta, per una particolare reazione anodica o catodica, il flusso di corrente associato alla reazione elettrodica in condizioni di equilibrio, vale a dire quando non vi sia un flusso netto di corrente circolante in cella. La legge di Tafel ha avuto ampi riscontri sperimentali per densità di corrente circolante elevata, mentre per bassa densità di corrente la legge logaritmica perde di precisione per via dell’incremento di importanza della reazione inversa, nel qual caso il processo elettrodico è più correttamente descritto dall’equazione di Butler-Volmer. La sovratensione di elettrodo rappresenta, per ogni particolare processo elettrodico, una ‘resistenza’ alla reazione elettrochimica dovuta alla necessità di superare una barriera di energia potenziale per far procedere la reazione alla velocità desiderata.