LIQUIDI IONICI
LIQUIDI IONICI.
– Definizione e generalità. Classificazione e struttura chimica. Proprietà chimico-fisiche. Applicazioni. Bibliografia
Definizione e generalità. – In termini generali, l’espressione liquidi ionici indica una sostanza chimica che, in determinate condizioni di temperatura e pressione, si presenta allo stato liquido ed è costituita esclusivamente (o in modo largamente prevalente) da ioni, cioè da atomi o aggregati di atomi dotati di carica elettrica netta. In senso più stretto, e nell’accezione comunemente intesa nella chimica fisica moderna (Freemantle 2010), i l. i. sono composti chimici organici costituiti da ioni e aventi temperatura di fusione inferiore a 100 °C, cosicché si presentano allo stato liquido a temperature modeste o, in senso ancora più stretto, già alla temperatura ambiente (RTIL, Room Temperature Ionic Liquids). Questa definizione esclude dalla famiglia i classici sali fusi inorganici. Per es., è ben noto che il cloruro di sodio (NaCl) è un sale che allo stato cristallino contiene un retico lo formato da ioni positivi Na+ e ioni negativi Cl-disposti ordinatamente. A temperature superiori a quella di fusione (circa 800 °C a 1 bar di pressione), il sale si presenta in forma liquida e risulta ancora costituito da ioni che, seppure non organizzati in una struttura ordinata, conservano un certo grado di coordinazione dovuto alle forti interazioni coulombiane tra specie cariche. Tuttavia, in virtù dell’elevata temperatura di fusione, il cloruro di sodio e i sali fusi inorganici evidentemente non rientrano nella categoria dei liquidi ionici propriamente detti.
I l. i. sono dunque composti organici che in fase liquida, a differenza delle comuni sostanze organiche (liquidi molecolari), sono costituiti non da molecole neutre – le quali, pur potendo presentare maggiore o minore polarità elettrica, sono prive di carica netta – ma appunto da entità cariche: uno ione negativo (anione) che può essere di natura inorganica o organica e uno ione positivo (catione), generalmente di natura organica. La formula generale di un l. i. può dunque essere scritta come C+A- o semplicemente CA, dove C è il catione e A l’anione. Dal punto di vista chimico e strutturale, i l. i. sono estremamente vari e si valuta che in linea di principio possano esistere in almeno 1010 varianti (decine di miliardi), a cui vanno aggiunte tutte le possibili miscele che se ne possono formare (Niedermeyer, Hallett, Villar-Garcia 2012).
I l. i. rappresentano uno dei settori della chimica e della chimica fisica sui quali si è indirizzata la maggiore attenzione della ricerca a partire circa dall’inizio del 21° sec., dopo la sintesi dei primi l. i. stabili da parte di John S. Wilkes e Michael J. Zaworotko (1992). L’interesse creatosi per questa classe di composti deriva in buona parte da alcune proprietà chimico-fisiche che, in conseguenza della loro struttura ionica, risultano nettamente diverse da quelle dei composti organici tradizionali e ne hanno quindi fatto prevedere molteplici applicazioni innovative. In particolare, la bassa volatilità e la bassa infiammabilità hanno posto all’attenzione i l. i. come possibili sostituti ecocompatibili dei comuni solventi organici usati nell’industria chimica, la maggior parte dei quali appartiene alla famiglia dei cosiddetti VOC (Volatile Organic Compounds).
Classificazione e struttura chimica. – Come ogni famiglia ampia di composti chimici, i l. i. possono essere classificati in base a criteri diversi. Una prima grande suddivisione è quella tra l. i. aprotici e l. i. protici. Questi ultimi, a differenza dei primi, contengono nella porzione cationica un protone acido e si formano per reazione tra un acido e una base di Brønsted:
AH + B = [BH+][A−]
dove [BH+][A-] rappresenta appunto il liquido ionico. Un esempio di l. i. protico è il nitrato di etilammonio, CH3CH2NH3+NO3-, il primo l. i. riportato nella letteratura scientifica, preparato da Paul Walden nel 1914.
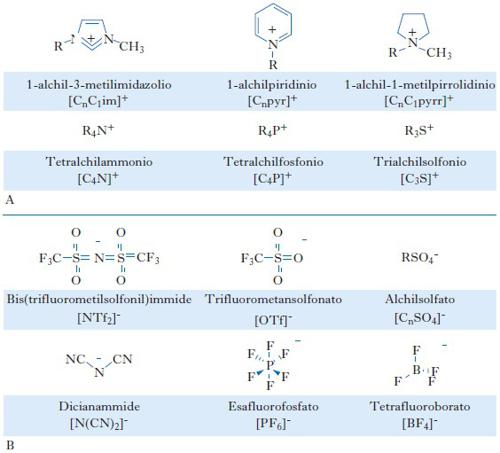
Per quanto riguarda i l. i. aprotici, che sono quelli maggiormente studiati, il catione è spesso un composto organico azotato a struttura ciclica. Le prime sostanze di questo tipo, per quanto instabili verso l’acqua e verso l’aria, furono sintetizzate da Frank H. Hurley a partire da ioduri di alchilpiridinio e tricoloruro di alluminio all’inizio degli anni Cinquanta del 20° secolo. Tra i più comuni l. i. aprotici si possono citare quelli contenenti cicli imidazolici, pirrolidinici, piridinici (fig. A). Possibili cationi non azotati sono quelli basati su ioni tetralchilfosfonio e trialchilsolfonio. Molto varia può essere la natura chimica degli anioni: alcuni tra i più comuni sono esafluorofosfato, tetrafluoroborato, trifluorometansolfonato, bis(trifluorometilsolfonil)immide, dicianammide (fig. B).
Una classe di l. i. di sviluppo più recente è quella dei composti dicationici, contenenti uno ione positivo doppiamente carico e due anioni mononegativi. Tra questi, particolare interesse hanno suscitato quelli contenenti cationi geminali, costituiti da due cationi a singola carica del tipo di quelli presenti nei monocationici, legati da una catena metilenica o di altro tipo. Questi composti sembrano possedere una stabilità termica superiore a quella dei corrispondenti monocationici.
Talvolta vengono inclusi nella famiglia dei l. i. anche i cosiddetti DES (Deep Eutectic Solvents), miscele costituite da un alogenuro imidazolico o d’ammonio quaternario (il cloruro di colina è il più comune) e un sale metallico (per es., cloruri di stagno, zinco, alluminio) o un donatore di legame idrogeno. Proposti per la prima volta nel 2001, sono di preparazione più semplice ed economica dei l. i. convenzionali e, avendo composizione vicina a quella eutettica, si presentano allo stato liquido a temperature molto inferiori alle temperature di fusione dei singoli componenti (Smith, Abbott, Ryder 2014).
Proprietà chimico-fisiche. – Tra le proprietà chimico-fisiche che maggiormente caratterizzano i l. i. differenziandoli dai comuni solventi organici, le principali sono la bassa volatilità, la bassa infiammabilità, la relativamente alta stabilità termica e chimica, l’ampiezza dell’intervallo di temperature in cui si presentano allo stato liquido. Queste caratteristiche hanno portato alla ribalta i l. i. come possibili green solvents (solventi compatibili con la tutela dell’ambiente), da usare in sostituzione dei comuni solventi organici molecolari, che sono spesso all’origine di problemi ambientali (si pensi, per es., ai solventi alogenati quali cloroformio, tetracloruro di carbonio ecc.), e, più in generale, come candidati a una moltitudine di applicazioni tecnologiche a temperature superiori a quella ambiente (v. oltre). Inoltre, per la loro natura ionica, i l. i. sono dotati di conducibilità elettrica (tipicamente, 5-10 mS/cm a temperatura ambiente) e quindi possono trovare impiego in applicazioni di tipo elettrochimico. La conducibilità, limitata dalla elevata viscosità, aumenta all’aumentare della temperatura e può essere accresciuta miscelando opportunamente l. i. diversi. Infine, la grande varietà e la possibilità di modulare le proprietà del composto con opportune modificazioni della composizione e della struttura chimica forniscono uno strumento utile alla progettazione di l. i. dotati di proprietà specifiche; per questo motivo, con riferimento ai l. i. adatti all’uso come solventi si è diffusa l’espressione di designer solvents.
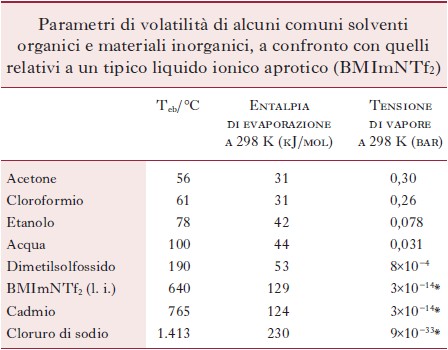
La bassa volatilità è probabilmente la singola caratteristica chimico-fisica più pregiata e peculiare dei l. i. (Esperança, Canongia Lopes, Tariq et al. 2010). A titolo di esempio, si riportano in tabella i dati relativi alla volatilità di alcuni comuni solventi organici e materiali inorganici, messi a confronto con quelli relativi a un tipico l. i. aprotico, l’1-butil-3-metilimidazolio bis(trifluorometilsolfonil)immide (BMImNTf2). Come si può notare, l’entalpia di vaporizzazione del l. i. e la sua tensione di vapore sono simili a quelle di un tipico metallo volatile come il cadmio. La tensione di vapore dei comuni solventi (acqua, etanolo, acetone, cloroformio) alla temperatura ambiente è pari a qualche centesimo o qualche decimo di bar, mentre quella del BMImNTf2 è di oltre dieci ordini di grandezza inferiore. Di conseguenza, le temperature di ebollizione dei l. i. sono in genere di centinaia di gradi superiori a quelle dei solventi ordinari e in realtà non sono neppure misurabili perché a temperature di molto inferiori (in genere intorno ai 300 °C) i composti subiscono processi di degradazione termica che liberano prodotti volatili di tipo molecolare (Marton, De Vos, Stevens 2013).
Applicazioni. – Numerose sono le applicazioni tecnologiche e industriali dei l. i. che sono state proposte negli ultimi 10-15 anni (Freemantle 2010). Sebbene sia prevedibile che non tutte si rivelino effettivamente praticabili o vantaggiose economicamente tanto da imporsi su larga scala, alcune di queste sono già realizzate e molte altre sembrano realmente promettenti. Un primo gruppo di applicazioni riguarda l’impiego dei l. i. o di loro miscele come solventi o come catalizzatori in processi chimici industriali (Hallett, Welton 2011). Si tratta delle primissime applicazioni pensate per questo tipo di composti. Il primo brevetto risale al 1998 ed è relativo al processo noto come DifasolTM (IFP, Institut Français du Pétrole) per la produzione di isootteni a partire da buteni. In questo processo, un l. i. è usato come solvente per il catalizzatore (un sale di nichel). Nel 2002 è stata la volta della BASF con il processo BASIL (Biphasic Acid Scavenging by Ionic Liquids) per la produzione di alcossifenilfosfine, composti utilizzati nella sintesi di fotoiniziatori per la produzione di inchiostri da stampa. In questo processo, condotto a 90 °C, viene utilizzato l’1-metilimidazolo come scavenger per l’acido prodotto, con formazione del l. i. cloruro di 1-metilimidazolio. Particolarmente promettente sembra l’impiego di alcuni l. i. per la dissoluzione della cellulosa (Pinkert, Marsh, Pang et al. 2009), che consente la successiva modificazione chimica del polimero. Questa prospettiva riveste un certo interesse in considerazione del fatto che la cellulosa, il polimero naturale più abbondante in natura, viene oggi rivalutata per il packaging ecocompatibile.
Altra ampia categoria di applicazioni si ha nel campo dei dispositivi elettrochimici. Per es., alcuni l. i. trovano applicazione come elettroliti nei sistemi di conversione dell’energia solare noti come celle di Grätzel o DSSC (Dye Sensitized Solar Cells) e nelle celle a combustibile.
I l. i. sono stati anche sperimentati con successo come assorbenti per la cattura di gas tossici, per la sequestrazione del biossido di carbonio e come solventi per processi di separazione ed estrazione (per es., nel trattamento delle scorie nucleari). Alcuni l. i. sono già usati su scala commerciale come fasi stazionarie per applicazioni cromatografiche. Per la loro scarsa infiammabilità, possono inoltre essere usati come lubrificanti ad alta temperatura. Sebbene molte delle prime applicazioni suggerite per i l. i. traggano forza dalla loro scarsa infiammabilità, negli ultimi anni il settore si è evoluto. Grazie alla possibilità di sintetizzarne nuovi tipi con caratteristiche progettate ad hoc, sono stati prodotti l. i. con proprietà diverse da quelli classici, tanto che alcuni di essi sono considerati con interesse nel settore degli esplosivi e dei combustibili (Zhang, Shreeve 2014). Per quanto riguarda infine i DES, sono allo studio molte interessanti applicazioni in campo elettrometallurgico (Smith, Abbott, Ryder 2014), in sostituzione delle soluzioni acquose impiegate nelle tecnologie tradizionali.
Bibliografia: A. Pinkert, K.N. Marsh, S. Pang et al., Ionic liquids and their interaction with cellulose, «Chemical reviews», 2009, 109, pp. 6712-28; J.M.S.S. Esperança, J.N. Canongia Lopes, M. Tariq et al., Volatility of aprotic ionic liquids. A review, «Journal of chemical & engineering data», 2010, 55, pp. 3-12; M. Freemantle, An introduction to ionic liquids, Cambridge 2010; J.P. Hallett, T. Welton, Room-temperature ionic liquids: solvents for synthesis and catalysis 2, «Chemical reviews» 2011, 111, pp. 3508-76; H. Niedermeyer, J.P. Hallett, I.J. Villar-Garcia et al., Mixtures of ionic liquids, «Chemical society reviews», 2012, 41, pp. 7780-82; C. Marton, N. De Vos, C.V. Stevens, Ionic liquid thermal stabilities: decomposition mechanisms and analysis tools, «Chemical society reviews», 2013, 42, pp. 5963-77; E.L. Smith, A.P. Abbott, K.S. Ryder, Deep eutectic solvents (DESs) and their applications, «Chemical reviews», 2014, 114, pp. 11060-82; Q. Zhang, J.M. Shreeve, Energetic ionic liquids as explosives and propellant fuels: a new journey of ionic liquid chemistry, «Chemical reviews», 2014, 114, pp. 10527-74.