Metabolismo
Metabolismo
Il metabolismo (dal greco μεταβολή, «mutazione») può essere definito come il complesso di processi biochimici che assicurano le attività vitali dell’organismo e dei singoli tessuti. Il concetto si applica prevalentemente all’insieme degli scambi energetici (oggetto di questa trattazione), ma anche ai processi che, a prescindere dalle variazioni di energia, garantiscono la vitalità e il buon funzionamento di strutture organiche (per es., metabolismo osseo, glucidico, lipidico, proteico ecc.). Sostanzialmente, il termine metabolismo può essere considerato sinonimo di ricambio. Quando si prendano in esame le trasformazioni di energia e di materia che avvengono nelle cellule dei vari organismi viventi, vanno comprese diverse funzioni, quali i processi di biosintesi con relative reazioni enzimatiche, la modificazione, trasformazione e degradazione di sostanze biologiche, le interazioni fra le diverse sostanze biologiche. Queste funzioni in sostanza mirano a ottenere, accumulare e rendere disponibile l’energia; esse sono regolate da fattori genetici e sono strettamente interconnesse. Il sistema endocrino e quello nervoso coordinano il complesso di queste attività adattandole ai cambiamenti dell’ambiente interno ed esterno.
1. Metabolismo energetico
di Domenico Andreani, Nicola Locuratolo
La conoscenza della quantità d’energia ottenuta con l’assorbimento e la digestione degli alimenti, e della spesa energetica relativa a tutti i processi vitali di un organismo, è essenziale per una corretta valutazione dei fabbisogni corporei. Il contenuto energetico degli alimenti è espresso in chilocalorie (kcal) o in joule (J) ed è valutato con la calorimetria diretta, procedura che misura la quantità di calore prodotta dagli alimenti ossidati totalmente a CO2 (anidride carbonica) e H2O (acqua) in una camera calorimetrica (1 kcal rappresenta la quantità di calore necessaria a innalzare la temperatura di 1 kg di acqua di 1 °C).
Il contenuto energetico dei principali macronutrienti ottenuto con tale metodica è, mediamente, il seguente: carboidrati 4,1 kcal/g; proteine 5,3 kcal/g; grassi 9,3 kcal/g; etanolo 7,1 kcal/g. Nell’uomo, valori di questa entità sono ottenuti, in condizioni normali, per i carboidrati e per i grassi; l’ossidazione delle proteine è invece incompleta dal momento che fra i prodotti finali vi sono composti azotati che hanno ancora contenuto energetico (in aggiunta ad acqua e anidride carbonica) e pertanto il valore calorico delle proteine è ridotto a 4,1 kcal/g. Sebbene anche le proteine possano essere catabolizzate per ottenere energia e per tale motivo sono incluse nel computo delle calorie, la maggior parte dell’energia stessa è ricavata da carboidrati e grassi. Infatti, la funzione delle proteine è in realtà molto diversa, in quanto esse rappresentano la fonte di aminoacidi (suddivisi in essenziali e non essenziali), i quali fungono da precursori nella sintesi proteica endogena e, quindi, delle impalcature cellulari e intercellulari. Si definiscono essenziali quegli aminoacidi che non possono essere sintetizzati all’interno dell’organismo e debbono provenire dall’alimentazione; non essenziali sono gli aminoacidi che possono provenire dal metabolismo endogeno. Quando l’energia contenuta negli alimenti è tale da consentire il mantenimento di un peso corporeo costante, si può affermare che l’individuo si trova in uno stato d’equilibrio energetico. Il fabbisogno calorico medio, per un soggetto adulto, in condizioni di sanità in ambiente temperato, a riposo, si aggira su 25-30 kcal/kg di peso corporeo. Nella tab. 1 è riportato il dispendio energetico per diverse attività fisiche. La spesa energetica complessiva dipende da tre fattori: metabolismo basale, attività fisica, effetto termico del cibo.
a) Metabolismo basale. Viene definito come la quantità di calore liberata dall’organismo a riposo, in assenza di stress fisico e psichico, dopo 12 ore di digiuno in ambiente termoneutro (18-26 °C). Rappresenta l’energia minima necessaria per mantenere i processi vitali ed è soggetto a varie influenze: aumenta con altezza e peso in proporzione alla superficie corporea; è correlato con la massa corporea magra (più rappresentata nel maschio che nella femmina, cosicché il metabolismo basale è maggiormente elevato nel sesso maschile; tale differenza, abbastanza marcata verso la pubertà, si riduce dopo i 20 anni); è maggiore nel bambino e declina con gli anni (percentuale differente di tessuto metabolicamente attivo ed energia spesa per processi di accrescimento); cresce dopo ingestione di cibo, mentre durante il digiuno protratto può scendere fino al 50%; è incrementato da ansia e tensione ed è invece ridotto dalla depressione; è sensibile alla temperatura dell’ambiente (quando la temperatura esterna è inferiore a quella corporea si attivano i meccanismi di produzione di calore, per es. con i brividi, cosicché il metabolismo aumenta; un’accelerazione generale del metabolismo si ha anche quando la temperatura esterna è tale da far innalzare quella interna con un incremento di circa il 13% per ogni aumento di grado centigrado di temperatura corporea); è influenzato da vari ormoni, quali gli ormoni tiroidei, l’ormone della crescita e le catecolamine. Rappresenta circa il 70% della spesa energetica giornaliera dell’uomo medio normale.
Diverse condizioni, sia fisiologiche sia patologiche, determinano una variazione del dispendio energetico: tra le prime segnaliamo la gravidanza e l’allattamento, tra le seconde la febbre, la malnutrizione, traumi, obesità, malattie endocrine, neoplasie e ustioni (queste ultime possono dar luogo a un aumento anche del 100%). Fegato, cervello, cuore e reni utilizzano circa il 70% del metabolismo basale a riposo a fronte del 18% impiegato dalla muscolatura scheletrica.
b) Attività fisica. In ordine d’importanza, è il secondo fattore, dopo il metabolismo basale, a condizionare il bilancio energetico; può incidere sulla spesa energetica in modo molto variabile, secondo il tipo, la durata dell’esercizio e in base al peso del soggetto. In mancanza d’attività fisica e di una programmazione alimentare adeguata, l’incremento di peso riflette uno sbilanciamento a favore della massa grassa (metabolicamente poco attiva) rispetto a quella magra (metabolicamente più attiva). L’attività fisica di un soggetto che conduce una vita sedentaria corrisponde a circa il 20% del dispendio energetico nelle 24 ore.
c) Effetto termico del cibo. Dopo l’assunzione di un pasto, si osserva un aumento della spesa energetica che varia a seconda dei differenti substrati nutritivi (azione dinamica specifica degli alimenti): è ciò che si definisce anche come effetto termico del cibo. Si distinguono una parte obbligatoria e una parte facoltativa. La termogenesi obbligatoria è legata all’aumento della produzione di calore durante la fase di assorbimento dopo l’ingestione degli alimenti ed è dovuta alla spesa energetica necessaria per l’assorbimento stesso, la digestione e la metabolizzazione, prevalentemente epatica. La termogenesi facoltativa è in rapporto all’aumento dell’attività metabolica che si ha dopo il pasto allo scopo di dissipare, sotto forma di calore, l’eccesso di chilocalorie introdotte (attivazione simpatica). Di media, con l’effetto termico del cibo si determina una perdita di poco meno del 10% delle calorie potenziali di un pasto misto. La produzione di calore in seguito all’ingestione di un alimento è connessa con la natura e la composizione del pasto; per es., un pasto con un elevato rapporto carboidrati/grassi è altamente termogenico, come pure un pasto ricco in proteine.
In conclusione, il consumo energetico complessivo di un individuo deriva dalla termogenesi globale che, anche in questo caso, è in parte obbligatoria (metabolismo basale), in parte facoltativa (esercizio fisico, effetto termico del cibo, nonché temperatura ambientale). La prima è definita obbligatoria perché non può essere modificata dall’esterno, mentre la seconda è suscettibile alle variazioni d’elementi esterni. La sede principale della termogenesi facoltativa è rappresentata dal muscolo scheletrico (circa il 50%).
2. Misurazione della spesa energetica
di di Domenico Andreani, Nicola Locuratolo
Esistono due metodi sperimentali per la misurazione del metabolismo negli esseri viventi: la calorimetria diretta e quella indiretta (v. anche energia, Aspetti biochimici). Il metodo della calorimetria diretta prevede che una persona sia introdotta all’interno di una camera isolata, all’interno della quale è possibile valutare il dispendio energetico a partire dalla misurazione della dispersione di calore del soggetto stesso. Più semplice ed economica appare l’utilizzazione della calorimetria indiretta, nella quale la spesa energetica viene determinata dalla misurazione della variazione di concentrazione d’ossigeno e di anidride carbonica nei gas respiratori; quest’ultima metodica consente anche la valutazione dell’ossidazione dei singoli substrati (glucidi, lipidi e protidi).
Gli specifici contributi dei tre substrati citati sono calcolati mediante equazioni che usano il quoziente respiratorio dei carboidrati, dei grassi e delle proteine. Il quoziente respiratorio (QR) è il rapporto tra CO2 prodotta e O2 consumato nell’unità di tempo; la CO2 prodotta e l’O2 consumato in un organo sono calcolati moltiplicando il flusso ematico per unità di tempo per la differenza arterovenosa di O2 e CO2. Il QR può essere valutato con buona approssimazione per l’organismo intero con metodi spirometrici. Esso si aggira sull’unità quando si bruciano carboidrati ed è inferiore quando si bruciano grassi e proteine; questi ultimi, infatti, sono più poveri di ossigeno. Il consumo energetico può essere calcolato anche mediante una stima del metabolismo basale, dell’effetto termico del cibo e dell’attività fisica.
Il metabolismo basale delle 24 ore, inteso come spesa energetica basale, è computato sulla base del sesso, del peso, dell’altezza e dell’età di un individuo. Una stima in un individuo normale può essere ottenuta con la formula di Harris-Benedict:
Uomo: MB (kcal/h/kg) = 66 + (13,7 · P) + (5 · A) - (6,8 · E)
Donna: MB (kcal/h/kg) = 65,5 + (9,5 · P) + (1,8 · A) - (4,7 · E)
dove: MB = metabolismo basale; P = peso corporeo in kg; A = altezza in centimetri; E = età in anni. L’energia spesa in differenti attività fisiche è stimata sulla base di valori tabulati.
In alternativa alla calorimetria indiretta si può usare la metodica dell’acqua con doppio isotopo che permette la valutazione energetica in condizioni fisiologiche e non restrittive durante normale attività fisica; non consente, però, di distinguere le varie componenti relative al dispendio energetico.
3. Regolazione dell’equilibrio energetico
di Domenico Andreani, Nicola Locuratolo
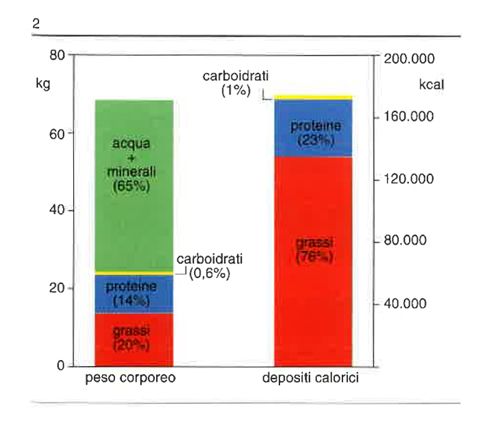
Il deposito principale di riserva energetica dell’organismo è il tessuto adiposo (in prevalenza trigliceridi). In fig. 2 è illustrata la percentuale di grassi nei depositi calorici. L’elevata concentrazione calorica e la natura idrofobica dei trigliceridi consentono la creazione di riserve energetiche ideali senza effetti osmotici avversi. In accordo con la prima legge della termodinamica (essa postula che l’energia può essere convertita da una forma in un’altra, ma che non può essere né creata né distrutta; la quantità d’energia immagazzinata è pari alla differenza tra energia introdotta e quella eliminata), la quantità di trigliceridi nel tessuto adiposo è in rapporto con la differenza tra quantità d’energia introdotta (alimenti) e spesa energetica (principalmente metabolismo a riposo e lavoro fisico). Sebbene esistano meccanismi molto efficienti per mantenere questa differenza assai vicina a zero, piccoli squilibri, che si attuino per lunghi periodi, possono condurre a effetti cumulativi importanti.
Numerosi meccanismi sono necessari affinché possa esserci un’integrazione armoniosa tra i componenti a breve termine (acidi grassi, glicemia, glicogeno epatico) e le riserve d’energia a lungo termine (massa grassa). L’equilibrio energetico è il risultato dell’attività di un sistema molto complesso che va dalla corteccia cerebrale all’adipocita: nessuna parte della struttura può funzionare da sola. Un gran numero di segnali afferisce dalla periferia ai centri specializzati del sistema nervoso centrale, che a sua volta si fa mediatore degli impulsi attraverso vie efferenti per regolare l’assunzione di cibo (abitudini alimentari) e il consumo calorico (regolato in larga misura dal sistema simpatico e parasimpatico, dagli ormoni tiroidei).
Vie nervose centrali effettrici anaboliche e cataboliche controllano il bilancio energetico; le prime promuovono l’alimentazione e sopprimono il dispendio energetico favorendo la deposizione di grasso, le seconde hanno effetto contrario. Il bilancio finale di queste due parti determina nel tempo l’entità dei depositi di grasso. Questi, a loro volta, influenzano le concentrazioni plasmatiche di insulina e leptina, chiudendo in tal modo il circuito a livello centrale con effetto inibitorio.
Una fondamentale alterazione del ricambio energetico si può avere quando vengono meno i meccanismi di controllo che regolano il consumo calorico e lo stimolo alimentare. L’obesità è causata dall’eccessivo accumulo di riserve, cui non corrisponde un adeguato consumo. La magrezza insorge quando si abbia una persistente prevalenza del consumo sugli introiti. Ambedue i fenomeni raggiungono livelli patologici ove si riscontri l’implicazione di alterazioni dei centri nervosi e dei sistemi endocrini regolatori.
4. Metabolismo intermedio
di Domenico Andreani, Nicola Locuratolo
Le reazioni chimiche sono strutturate in sequenze o vie metaboliche nelle quali il prodotto di una reazione rappresenta il substrato di quella successiva. Ogni componente di una via metabolica prende il nome di metabolita. Esistono tre tipi di vie metaboliche: catabolica, anabolica, amfibolica.
a) Via catabolica. Trasforma molecole grandi e complesse in composti più piccoli, scindendo legami chimici. Riguarda processi ossidativi con liberazione d’energia che è conservata come adenosintrifosfato (ATP) e forme ridotte d’energia (nicotinamideadenindinucleotide fosfato-ridotto, NADPH, e nicotinamideadenindinucleotide ridotto, NADH). La glicolisi e l’ossidazione degli acidi grassi sono alcuni esempi.
b) Via anabolica. Sintetizza molecole grandi e complesse da sostanze più semplici, formando nuovi legami chimici. Queste vie sono rappresentate dai processi riduttivi che richiedono energia sotto forma di ATP, NADPH e NADH. Ne sono esempi la gluconeogenesi e la sintesi di grassi.
c) Via amfibolica. È una via metabolica che funziona in maniera sia catabolica sia anabolica. Un esempio è fornito dal ciclo degli acidi tricarbossilici dove l’acetilcoenzima A è ossidato a CO2 e H2O e contemporaneamente include diverse sostanze intermedie che fungono da substrati di vie sintetiche.
Ogni componente alimentare ha una forma di deposito, una forma di trasporto e dei metaboliti tessutali a basso peso molecolare che convergono principalmente verso l’acetilcoenzima A. Le forme di deposito e quelle di trasporto sono largamente interconvertibili: glucosio, acidi grassi e aminoacidi rappresentano forme di trasporto di combustibili metabolici che vengono immagazzinati rispettivamente come glicogeno, trigliceridi e proteine. Le interconversioni metaboliche sono di due tipi: permesse (da carboidrati a grassi, da proteine a grassi, da proteine a carboidrati) e non permesse (da grassi a proteine, da carboidrati a proteine, da grassi a carboidrati). Le proteine non sono sintetizzabili direttamente dai carboidrati e dai grassi perché hanno bisogno della supplementazione dietetica di aminoacidi essenziali; i grassi non possono diventare carboidrati perché la reazione che trasforma il piruvato (composto a 3 atomi di carbonio) in acetilcoenzima A (composto a 2 atomi di carbonio) può avvenire in una sola direzione, non esistendo nei tessuti umani un enzima in grado di catalizzare il passaggio inverso da acetilcoenzima A a piruvato (fig. 3).
5. Metabolismo minerale e osseo
di Domenico Andreani, Nicola Locuratolo
Il calcio, il fosforo e il magnesio sono tre dei principali elementi chimici dell’organismo. Il calcio, in fase cristallina, contribuisce a formare la struttura ossea, mentre in soluzione regola l’eccitabilità delle membrane plasmatiche, le attività enzimatiche e la deposizione di altri minerali sulla matrice extracellulare dell’osso. Il fosfato è il principale anione intracellulare con funzioni di tampone, di trasportatore d’energia (per es. ATP) e di modulatore di processi molecolari attraverso fosforilazioni e defosforilazioni. Il magnesio è il principale catione citoplasmatico, in quanto funge da cofattore in molte reazioni chimiche.
I valori di calcio totale nel sangue oscillano entro un intervallo molto stretto di circa il 5% del valore medio; quest’elemento si trova legato a proteine (principalmente albumina) oppure in forma ionizzata. La misurazione di quest’ultima frazione è un indice accurato dell’omeostasi calcica, che è regolata principalmente dall’ormone paratiroideo, dalla calcitonina, dalla vitamina D. Il fosforo e il magnesio circolano nel sangue in forma libera con variazioni plasmatiche molto ampie. Soltanto lo 0,1% del calcio totale corporeo è rinvenuto nel sangue e nei liquidi extracellulari. Tale quota di calcio è in rapido equilibrio con quella più grande regolata da osso, intestino e rene. La quantità dei flussi giornalieri è tale che una malattia di uno di questi organi può determinare valori patologici di calcemia. Il tessuto osseo funge da serbatoio per il calcio, i fosfati e il magnesio. A livello intestinale non esiste una regolazione fine dell’assorbimento del magnesio e dei fosfati, al contrario del calcio. Quest’ultimo viene assorbito principalmente nel piccolo intestino dove circa il 10% del quantitativo ingerito con la dieta è assorbito passivamente; il rimanente è regolato dai metaboliti attivi della vitamina D, soprattutto 1,25-(OH)2-D (originariamente indicata come una vitamina liposolubile, attualmente considerata un ormone steroideo). Con un regime dietetico normale è assorbito il 30% di calcio; con una dieta a basso contenuto di questo elemento l’assorbimento può giungere fino al 90%.
A livello renale le frazioni di calcio, magnesio e fosfati non legate a proteine sono filtrate dai glomeruli. La porzione distale del nefrone può riassorbire dal liquido che fluisce nei tubuli più del 99% di questi minerali. Il riassorbimento del calcio tubulare è stimolato principalmente dall’ormone paratiroideo. Il riassorbimento di fosfati è influenzato negativamente dal paratormone. La tab. 2 elenca gli ormoni implicati nella regolazione del metabolismo fosfocalcico e le loro azioni.
6. Malattie ereditarie del metabolismo
(Red.)
La trasformazione dei differenti macronutrienti in energia utilizzabile o in molecole necessarie per l’anabolismo percorre vie metaboliche proprie per ciascuna tipologia (carboidrati, lipidi, mucopolisaccaridi ecc.). Le vie sono contraddistinte dalla presenza di enzimi (molecole proteiche prodotte dall’organismo stesso a partire da aminoacidi sotto la direzione di un codice che risiede nei geni) specifici per ciascuna via e per ciascuna tappa, con il compito di far procedere la cascata di reazioni fino all’ottenimento dei prodotti finali. Qualsiasi alterazione a carico di uno o più di questi enzimi comporta un difetto nella catena metabolica, difetto che si estrinsecherà in maniera diversa, determinando sintomi più meno gravi, più o meno precoci o rimanendo inapparente. Modificazioni a livello della sequenza di DNA di un determinato gene (mutazioni) sono in grado di causare alterazioni nella produzione di enzimi che, di conseguenza, possono: non essere prodotti; essere prodotti in quantità insufficiente o in forma alterata. Ciascuna di queste possibilità a sua volta implicherà conseguenze per l’organismo, il cui impatto e la cui gravità saranno variabili a seconda dei casi.
Le malattie ereditarie del metabolismo (tab. 3) comprendono un vasto numero di condizioni morbose caratterizzate da un ‘errore’ in una delle tappe metaboliche normali, cui consegue l’accumulo nell’organismo di un metabolita che è la causa dei danni riscontrabili. Nel testo di riferimento per questo argomento (The metabolic and molecular bases of inherited disease 1995) vengono menzionate oltre 400 patologie. Per la maggior parte di esse la frequenza è intorno a 1/100.000 individui; alcune si riscontrano con frequenza inferiore, altre superiore (la fenilchetonuria, per es., è presente in 1/12.000 bambini nati negli Stati Uniti); talune, inoltre, sono più diffuse in determinati gruppi etnici. Pertanto, malgrado ciascuna di esse di fatto sia rara, se considerate come gruppo di malattie, la loro frequenza è relativamente elevata.
Per capire il meccanismo alla base di questi disordini metabolici, può essere utile esaminare una simulazione (fig. 4), nella quale un enzima è deputato a convertire una sostanza X in una sostanza Y per giungere a un prodotto finale Z. Se l’enzima non opera tale trasformazione, come conseguenza si avrà un accumulo di sostanza X che, quando in eccesso, potrà attivare un enzima normalmente non funzionante, il quale modificherà la sostanza X in sostanza W, normalmente non presente; Y e Z pertanto non saranno prodotti del tutto o lo saranno in misura notevolmente ridotta. Le conseguenze possono essere diverse: la sostanza X può essere di per sé tossica (per es., le sostanze azotate che si accumulano nelle patologie caratterizzate da alterazioni del ciclo dell’urea), o determinare la produzione di sostanze tossiche (per es., i glicolipidi che si accumulano nelle malattie lisosomiali possono causare una degenerazione delle cellule accumulandosi al loro interno), o interferire con altre vie metaboliche, legarsi a enzimi che quindi non potranno essere attivi laddove dovrebbero (l’acido propionico che si accumula nell’acidemia propionica simula l’acido acetico, un metabolita intermedio che si lega al coenzima A e interferisce con numerose reazioni nelle quali l’acido acetico è implicato), infine, accumularsi senza provocare danni (gli individui affetti da pentosuria presentano, come unico sintomo, l’eliminazione di enormi quantità di zuccheri a 5 atomi di carbonio). La sostanza Z può essere una molecola importante, la cui mancanza di per sé determina sintomi (per es., nelle alterazioni della sintesi di cortisolo); infine la sostanza W, ossia quella prodotta per eccesso di X, può essere tossica o interferire con altre vie metaboliche. Spesso la coesistenza dei meccanismi sopra elencati può rappresentare la base patogenetica della malattia. La diagnosi di queste malattie si può effettuare basandosi sulla misurazione dei metaboliti (aminoacidi, per es. nella fenilchetonuria, nella omocistinuria, nella malattia delle urine dall’odore di sciroppo di acero ecc.; substrati organici o specifici: acido lattico, glicosaminoglicani, glicogeno, vitamine ecc.), su test sugli enzimi presenti nel sangue, nei fibroblasti cutanei, nel fegato, nei muscoli o nel cervello; oppure valutando i difetti genetici con l’analisi del DNA, sapendo a priori quale mutazione ricercare. Questo metodo è indubbiamente quello che fornirà, quando la tecnologia sarà così avanzata da permetterne un impiego efficiente ed efficace, i migliori risultati. Infine, poiché per talune malattie, come la fenilchetonuria, è possibile prevenire l’accumulo del metabolita alternativo e tossico (fenilchetoni), è importante praticare screening sui neonati per identificare l’eventuale presenza di queste malattie metaboliche e consentire un trattamento che, se avviato precocemente, può ridurne gli effetti devastanti. In Italia leggi regionali regolano la pratica di questi screening che, peraltro, si possono effettuare solo per pochi quadri morbosi (per es., fenilchetonuria, galattosemia).
bibliografia
K.J. Achenson, E. Ravussin, J. Wahren, Thermic effect of glucose in man, «Journal of Clinical Investigation», 1984, 74, 5, pp. 1572-80.
C.J. Coffee, Metabolism, Madison (CT), Fence Creek, 1998.
A. Fabris, P. Bernich, A. D’angelo, Alterazioni del metabolismo idro-elettrolitico, Padova, Liviana, 1993.
K.N. Frayan, Metabolic regulation, London, Portland, 1996.
N.K. Fukagawa, L.G. Bandini, J.B. Young, Effect of age on body composition and resting metabolic rate, «American Journal of Physiology», 1990, 259, pp. 233-38.
The metabolic and molecular bases of inherited disease, ed. C.R. Scriver et al., New York, McGraw-Hill, 19957.
A. Pinchera et al., Endocrinologia e metabolismo, Milano, Ambrosiana, 1991.
Primer on metabolic bone diseases and disorders of mineral metabolism, ed. M.J. Favus, Philadelphia, Lippincott, Williams and Wilkins, 19994.
E. Ravussin, S. Lilliojoia, Determinants of 24-hour energy expenditure in man, «Journal of Clinical Investigation», 1986, 78, 12, pp. 1568-78.
C.M. Rotella, V. Ricca, E. Mannucci, L’obesità. Manuale per la diagnosi e la terapia, Firenze, SEE, 1997.
P. Tessari, The role of substrates in the regulation of protein metabolism, «Baillière’s Clinical Endocrinology and Metabolism», 1996, 10, 4, pp. 511-32.