neurofarmacologia
neurofarmacologia
Da sempre l’uomo cerca di influenzare l’attività del cervello sia attraverso i farmaci, sia attraverso l’attività intellettuale ed emotiva. I progressi della ricerca hanno consentito l’identificazione delle molecole responsabili della comunicazione tra cellule nervose, e dei meccanismi attraverso i quali le cellule vivono, si assemblano, si differenziano e muoiono, aprendo la strada all’impiego di sostanze in grado di intervenire in questi processi. Farmaci di questo tipo possono agire su diversi aspetti della struttura e funzione del sistema nervoso, in particolare sulla comunicazione tra cellule neuronali (per es., sulla sintesi, sul degrado e sul trasporto nei neurotrasmettori), sul controllo della sopravvivenza e morte dei neuroni, sulla plasticità delle cellule nervose. La neurofarmacologia deve anche affrontare i problemi, di complessa soluzione, legati al superamento della barriera ematoencefalica da parte dei farmaci e al raggiungimento selettivo del bersaglio prefissato [➔ endocannabinoidi; neurodegenerazione; neuropatie, Neuropatie da farmaci; plasticità neurale; sinapsi]
La n. studia la struttura chimica, i meccanismi d’azione e gli effetti delle sostanze in grado di influenzare i meccanismi di funzionamento del cervello, compresi le funzioni mentali superiori e il comportamento. Le prime indicazioni sull’uso di sostanze attive sul sistema nervoso centrale (SNC) risalgono a più di 5.000 anni fa in Cina e in America Meridionale; spesso i farmaci erano utilizzati in situazioni di forte emotività sociale, come i riti sciamanici o i banchetti. L’utilità di associare farmaci e terapie comportamentali per intervenire sull’attività cerebrale è stata dimostrata dai risultati ottenuti con la tecnica fMRI (functional Magnetic Resonance Imaging), che ha evidenziato come le terapie farmacologiche e quelle comportamentali antidepressive attivino zone cerebrali diverse, suggerendo una possibile sinergia attraverso vie e circuiti nervosi differenti.
Sviluppo delle conoscenze sul cervello come base per la neurofarmacologia
La base del funzionamento dell’SNC sta nella comunicazione tra le cellule nervose (neuroni e glia). La comunicazione tra cellule avviene attraverso le sinapsi per mezzo dei neurotrasmettitori chimici; si calcola vi siano 1011 neuroni, 16x1011 cellule gliali e 1014 sinapsi. Le cellule gliali, la cui funzione si supponeva limitata a quella di supporto metabolico e strutturale ai neuroni, hanno ora assunto maggiore rilevanza perché si è dimostrato che possono influenzare attivamente anche la comunicazione tra neuroni. Le cellule nervose sono assemblate in circuiti nervosi che si formano durante lo sviluppo e sono geneticamente stabiliti. Queste informazioni genetiche sono però fortemente influenzabili e modificabili da situazioni esterne e contingenti (epigenetiche), che da un lato riescono a modificare le sinapsi (fenomeno della plasticità cerebrale), dall’altro sono in grado di interferire con il funzionamento dell’attività cerebrale per la presenza di sostanze esterne (farmaci o agenti tossici). Partiti da una conoscenza approfondita, ma statica, dell’anatomia e istologia dell’SNC, siamo giunti a una conoscenza che unisce gli aspetti anatomici a quelli funzionali; la biologia ha contribuito all’identificazione delle molecole responsabili della comunicazione tra cellule nervose, e dei meccanismi attraverso i quali esse vivono, si assemblano, si differenziano e muoiono. L’uso di metodologie di imaging non invasive e della psicologia sperimentale ha infine permesso ulteriori e decisivi passi nello studio del comportamento del cervello permettendo una integrazione funzionale di tutti gli approcci molecolari. In questo contesto di ricerca si è inserita la farmacologia, che ha contribuito allo sviluppo delle neuroscienze con farmaci selettivi, attivi su bersagli molto specifici e con successi terapeutici insperati fino a poco tempo fa. I farmaci possono agire su diversi aspetti della struttura e funzione dell’SNC e tra questi i più importanti sono: la comunicazione tra cellule neuronali; il controllo della sopravvivenza e morte dei neuroni; la plasticità delle cellule nervose.
Comunicazione neuronale
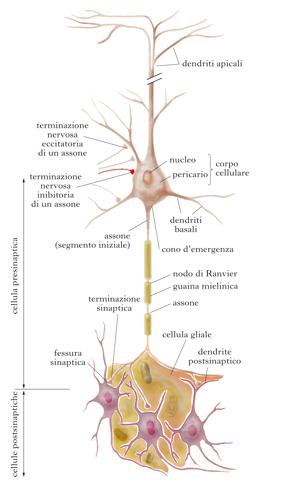
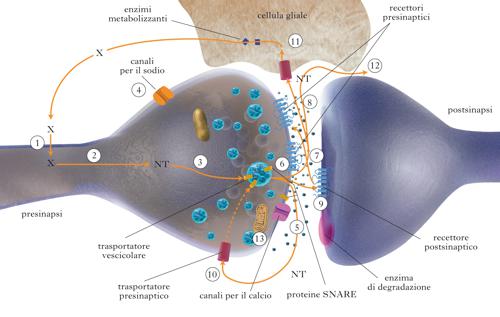
La comunicazione tra neuroni per mezzo delle sinapsi (➔) è la base dei circuiti nervosi, che sono ben definiti e funzionalmente modulabili attraverso la trasmissione di un segnale, specifico, localizzato, modulato in intensità, e unidirezionale. La sinapsi è costituita dalla parte terminale dell’assone di un neurone (parte presinaptica), e da quella che prende contatto con il corpo cellulare o con i dendriti (parte postsinaptica). La presinapsi contiene i componenti biochimici strutturali per sintetizzare, immagazzinare e liberare i neurotrasmettitori, mentre la postsinapsi contiene i recettori deputati a riconoscere i neurotrasmettitori e a trasmettere il segnale all’interno del neurone.
Sostanze in grado di intervenire nella presinapsi. La propagazione dello stimolo lungo la fibra nervosa può essere influenzata da farmaci che bloccano i canali voltaggio dipendenti: quelli per il sodio (per es., anestetici locali e tetrodotossina), quelli per il calcio responsabili dell’inizio della fusione delle vescicole sinaptiche (per es., le omega-conotossine che diminuiscono la liberazione di neurotrasmettitori e sono perciò utilizzate come analgesici centrali). Il trasporto delle vescicole sinaptiche dal corpo cellulare alla periferia dipende da motori molecolari e microtubuli che possono essere bersaglio di molte sostanze farmacologicamente attive ma tossiche, quali i taxoli e la vinblastina. Le tossine tetaniche e botuliniche bloccano la fusione delle vescicole sinaptiche e la liberazione dei neurotrasmettitori; l’alfa latrotossina (presente nel veleno della vedova nera) si lega a proteine che regolano il riciclo delle vescicole sinaptiche (➔ neurotossicosi).
Sostanze in grado di interferire con i neurotrasmettitori. Il modo più efficace per ottenere un effetto terapeutico interagendo con l’attività sinaptica è quello di intervenire a livello dei neurotrasmettitori, e questo può essere fatto in tre modi: agendo sugli enzimi per la sintesi o la degradazione dei neurotrasmettitori, oppure sul trasporto dei neurotrasmettitori, o sui recettori. Per quanto riguarda la prima possibilità, si può intervenire sugli enzimi deputati alla sintesi o alla degradazione dei neurotrasmettitori bloccandoli o stimolandoli. Gli esempi più classici sono i farmaci che bloccano la catena sintetica della serotonina o delle catecolammine, come la alfa-metildopa, che si usa come antipertensivo (ma che può dare depressione centrale, diminuendo l’efficienza del sistema catecolamminergico e serotoninergico) e la tranilcipromina, utilizzata sperimentalmente per inibire le vie serotoninergiche. Il blocco degli enzimi degradativi ha portato a individuare classi di farmaci interessanti: gli inibitori della acetilcolinesterasi potenziano le vie colinergiche permettendo che l’acetilcolina venga degradata più lentamente e rimanga più a lungo nella sinapsi; essi sono utilizzati per stimolare il sistema nervoso periferico, ma anche nelle fasi non terminali della malattia di Alzheimer, rappresentando per ora l’unico presidio disponibile per migliorarne i deficit cognitivi o per rallentarne il peggioramento. Il blocco degli enzimi monoamminossidasi (MAO), che distruggono le catecolammine e la serotonina, porta i farmaci anti-MAO al potenziamento di queste vie nervose centrali con un’intensa attività antidepressiva e antiparkinsoniana. Per quanto riguarda il trasporto dei neurotrasmettitori, che avviene all’interno delle vescicole sinaptiche, provocandone il blocco si impedisce il rifornimento dei neurotrasmettitori e quindi si provoca un loro depauperamento. Il rifornimento dei neurotrasmettitori avviene attraverso la membrana vescicolare per mezzo di alcune pompe o trasportatori abbastanza specifici per i neurotrasmettitori. Tra i farmaci in grado di intervenire sul trasporto dei neurotrasmettitori è particolarmente rilevante la reserpina, che blocca il trasporto vescicolare della serotonina e delle catecolammine e che (insieme alla cloropromazina) è stata studiata fin dagli anni Cinquanta del 20° sec. come farmaco attivo sui sintomi schizofrenici e psicotici. Il farmaco deprime in modo massiccio la trasmissione amminergica provocando notevoli effetti sedativi, antipsicotici e neurolettici; purtroppo la sua azione sui trasportatori è troppo aspecifica e coinvolge anche molti altri bersagli, provocando effetti collaterali che ne proscrivono l’uso antipsicotico. Il vesamicolo è invece un farmaco che ha funzioni di blocco sul trasportatore della colina; risulta molto utile a livello sperimentale, ma non viene usato in clinica. Un altro modo di intervenire sul trasporto dei neurotrasmettitori è aumentandone la liberazione dalle vescicole attraverso l’uso di sostanze come le anfetamine: in questo caso la maggiore liberazione di catecolammine e serotonina può determinare un’attivazione sinaptica, soprattutto nelle vie amminergiche, e notevoli effetti stimolanti sull’SNC. I trasportatori dei neurotrasmettitori presenti sulla membrana presinaptica sono responsabili del recupero della serotonina e delle catecolammine dalla fessura sinaptica, quindi la loro inibizione porta a un’attivazione del sistema serotoninergico e catecolamminergico: ciò si traduce clinicamente in un effetto antidepressivo intenso ed efficace. Esistono farmaci attivi contemporaneamente sui trasportatori per la serotonina e le catecolammine (per es., gli antidepressivi triciclici e, fra i più recenti, la venlafaxina) e quelli attivi solamente sul trasportatore della serotonina, come gli SSRI (inibitori selettivi della ricaptazione della serotonina), con capostipite la fluoxetina, che hanno anche un effetto ansiolitico e minori effetti collaterali. Infine, la terza possibilità per interferire con i neurotrasmettitori è agendo sui loro recettori. I recettori pre- e postsinaptici sono utilizzati dai farmacologi sfruttando la possibilità di stimolare o inibire un solo tipo molecolare con farmaci specifici. Si possono citare: i farmaci che intervengono sul sistema dopamminergico (inibitori del recettore D2 come i neurolettici, e stimolatori come la DOPA e la bromocriptina, utilizzati nella patologia del Parkinson); le benzodiazepine, ansiolitici, stimolatori di alcuni recettori GABAergici; gli antagonisti dei recettori betadrenergici, utili nel tremore essenziale, nell’ansia e nel controllo centrale dell’ipertensione; la nicotina e i farmaci nicotinici, attivi nell’aumentare l’attenzione e altri comportamenti centrali attraverso la stimolazione dei recettori colinergici nicotinici presinaptici; la morfina e gli oppioidi, che hanno proprietà analgesiche (➔ analgesia) e influenzano anche il comportamento attraverso la stimolazione di recettori oppiacei μ, δ, σ.
Controllo della sopravvivenza e morte neuronale
I neuroni sopravvivono per lungo tempo, ma con l’avanzare dell’età o a causa di effetti tossici (stress, prodotti della degradazione proteica, virus e altri agenti patogeni) possono andare incontro a sofferenza e morte (➔ neurodegenerazione). La sopravvivenza neuronale è in genere sotto il controllo di vari fattori neurotropici (NGF, BDNF, GDNF, neurotropine, ecc.); essi, attivando recettori specifici che portano alla formazione di secondi messaggeri e a modificazioni postrasduzionali di proteine, influenzano vari circuiti metabolici intracellulari, stimolano o deprimono l’espressione di geni specifici e mantengono quindi vitale la cellula e attive le risposte riparative agli insulti. La ricerca sta cercando di utilizzare queste molecole, o loro sostituti con simili meccanismi d’azione, per cercare di ritardare la senescenza e la morte neuronale, allo scopo di rallentare o di prevenire le malattie neurodegenerative. Si possono inquadrare in questo contesto anche le ricerche con cellule staminali neuronali, che avrebbero lo scopo di rimpiazzare i neuroni morti nei circuiti nervosi con cellule nuove, o di localizzare nelle aree sofferenti cellule vitali di origine nervosa, in grado di fornire in loco i fattori di crescita che si stanno esaurendo.
Intervento sulla plasticità neuronale
l concetto di plasticità neurale (➔) è relativamente recente: oggi sappiamo che il sistema nervoso è un sistema plastico che può modificarsi a seconda degli stimoli ricevuti. La privazione di stimoli sensoriali, durante lo sviluppo (ma anche nell’adulto), riduce il numero delle sinapsi nelle aree interessate mentre l’esposizione a un ambiente ricco di stimoli sensoriali e cognitivi ne aumenta il numero e l’efficienza. Negli ultimi tempi si sta facendo luce sulla base molecolare e cellulare di questo processo nel breve e nel lungo periodo. L’aumento dell’attività sinaptica in un neurone aumenta la ricettività delle fibre innervanti, facilita la formazione di nuove sinapsi, aumenta l’efficienza con l’inserimento di nuovi recettori attivi e modifica la matrice extracellulare della membrana sinaptica per rendere queste modifiche stabili nel tempo. Molti farmaci stimolanti l’SNC (anfetamine, nicotina, stimolatori dei recettori glutammatergici e catecolamminergici) hanno anche questo effetto, che tuttavia è associato a effetti collaterali poco tollerabili. Il problema delicato è se si possa ‘drogare il cervello’ con farmaci per ottenere prestazioni migliori, soprattutto in persone giovani nel periodo di formazione e sviluppo dell’SNC.
Problemi farmacocinetici
Non tutti i farmaci riescono a raggiungere il cervello, protetto da una barriera ematoencefalica che fa passare dal sangue al tessuto nervoso solo i farmaci lipofili: per es., i peptidi molto difficilmente raggiungono il cervello in quantità opportune, mentre passano assai facilmente la nicotina, l’eroina, ecc. Oltre che dalla sua biodisponibilità, l’effetto di un farmaco attivo sull’SNC dipende anche dalla frequenza di somministrazione, dalla storia di precedenti assunzioni, dalla competizione o dal sinergismo con altri farmaci, dalle caratteristiche metaboliche individuali (esistono soggetti ‘rapidi metabolizzatori’ che possono apparire poco sensibili a un farmaco, mentre i ‘lenti’ hanno risposte più intense con maggiori probabilità di effetti tossici). Non è inoltre possibile, per il momento, indirizzare i farmaci specificamente nelle aree interessate del cervello e avere quindi effetti selettivi (per es., i neurolettici bloccano i recettori dopamminergici in tutte le aree e non solo in quelle limbiche, dove esplicano gli effetti ritenuti utili nelle psicosi). In questo settore (detto drug delivery) si sta lavorando con l’utilizzo delle nano- e biotecnologie per riuscire a utilizzare molecole efficaci che arrivino al bersaglio giusto. Francesco Clementi
Le interazioni tra farmaci
Se somministrate in associazione, le sostanze farmacologicamente attive sul sistema nervoso centrale possono dare luogo a interazioni farmacologiche, che si manifestano con maggior frequenza e importanza clinica rispetto ad altri distretti e sistemi.
Cause a monte dell’azione sul sistema nervoso
Le interazioni, prima ancora che i farmaci arrivino sul bersaglio terapeutico, sono molteplici, e vanno dall’assorbimento del farmaco (diversi livelli e tempi di assorbimento), al legame con le proteine plasmatiche e con altri siti di deposito, alla lipo- o idrosolubilità. La competizione tra farmaci a livello dei siti di deposito (albumina, muscoli, tessuto adiposo) può provocare l’insorgenza ritardata dell’azione del farmaco che si lega prima, e uno sbilanciamento dell’azione terapeutica combinata: un legame più forte significa meno farmaco libero e meno azione; al contrario, se il legame è debole il farmaco libero ha un’azione maggiore a va ridotto di dosaggio rispetto all’altro.
Interazioni tra farmaci con il medesimo meccanismo d’azione sull’SNC
I meccanismi d’azione che caratterizzano le varie classi di farmaci attivi sul cervello sono: intervento a livello della sinapsi, dei neurotrasmettitori (sia sui sistemi enzimatici sia sul loro trasporto), dei recettori extra- o intracellulari. Molto frequentemente, spec. nei casi di patologie croniche complesse, si somministra un secondo (o un terzo) farmaco, sia contemporaneamente, sia nell’intervallo di tempo in cui il primo farmaco è ancora circolante (o comunque ancora attivo sul suo bersaglio); se queste altre molecole hanno il medesimo meccanismo d’azione delle prime, si possono verificare competizioni tra i due farmaci a livello enzimatico o recettoriale, o a livello del neurotrasmettitore specifico: non sempre è prevedibile quale molecola sia più attiva sul bersaglio neuronale o sinaptico, e il paziente può subire l’azione prevalente dell’una o dell’altra, come se il dosaggio fosse maggiore di quello somministrato. Per questo è solitamente sconsigliata l’associazione tra due farmaci che abbiano il medesimo scopo terapeutico e lo stesso meccanismo d’azione, come gli antidepressivi inibitori della ricaptazione della serotonina (SSRI) e quelli inibitori delle monoamminossidasi (anti-MAO).
Interazioni tra farmaci con meccanismo d’azione differente sull’SNC
Le indicazioni terapeutiche per una determinata patologia utilizzano, spesso volutamente, più farmaci con differente meccanismo d’azione, sia perché ciò è garanzia di copertura per un paziente particolarmente difficile, sia perché patologie complesse richiedono approccio terapeutico su più fronti (e il caso, per es., dell’epilessia o delle psicosi). Le interazioni in questi casi riguardano la prevalenza, spesso imprevedibile, dell’effetto farmacologico di una sostanza rispetto all’altra (o alle altre); nell’ambito della patologia esiste un certo equilibrio fisiopatologico nascosto che si rompe nel corso della terapia: ne sono un esempio le tendenze suicide dei pazienti psicotici che, accanto a un antipsicotico, assumono, per un’impronta depressiva della loro patologia, antidepressivi. Un altro esempio è il potenziamento dell’azione sedativa sui centri respiratori dovuto alla contemporanea somministrazione di ipnotici-sedativi di diverse classi, come benzodiazepine e barbiturici. Al contrario, l’associazione di anfetamine con antidepressivi provoca crisi di agitazione psicomotoria con allucinazioni per potenziamento dell’effetto serotoninergico (le anfetamine hanno affinità per i recettori 5HT, gli antidepressivi SSRI inibiscono la ricaptazione sinaptica della serotonina). Anche due farmaci che agiscono l’uno con agonismo l’altro con antagonismo (o con antagonismo parziale) sullo stesso recettore non devono essere somministrati insieme: per es., la somministrazione di fentanyl (oppiaceo sintetico) o naloxone insieme alla morfina diminuisce la potenza di quest’ultima che, di conseguenza, necessiterà di dosaggi maggiori; e inoltre differente la curva doserisposta della morfina a seconda che sia stato aggiunto un antagonista competitivo o non competitivo.
Cause legate al metabolismo dei farmaci
Farmaci somministrati contemporaneamente, sia per la medesima patologia, sia per altre patologie non neurologiche, possono entrare fra loro in competizione oppure produrre un’azione sinergica attraverso interferenze nel reciproco metabolismo; a livello dei sistemi epatici preposti alla loro conversione metabolica (attivazione, inattivazione, escrezione) l’uno o l’altro ‘entrano prima’ nel sistema di trasporto dentro l’epatocita o in quello di trasformazione, oppure riescono a rendere più efficaci tali sistemi. Tipico esempio di facilitazione è quello da barbiturici, che attivano sistemi enzimatici microsomiali sia per essi stessi sia per altri farmaci, eliminandoli più velocemente, con conseguente minore efficacia terapeutica e aumento dei dosaggi (fenomeno dell’induzione enzimatica). Analogo comportamento hanno gli antiepilettici fenitoina e carbamazepina. Un’eventualità spesso misconosciuta è l’induzione enzimatica dell’acido folico nei confronti degli anticonvulsivanti. L’acido folico è una vitamina che viene spesso somministrata per compensare la carenza di folati indotta dagli anticonvulsivanti stessi; sono state descritte riduzioni dal 16 al 50% nei livelli plasmatici dell’anticonvulsivante fenitoina dopo l’assunzione in dose terapeutica di acido folico: lo stato mentale dei pazienti migliora, ma aumentano il numero e la gravità degli attacchi epilettici. Anche il fumo di tabacco è un induttore: agisce sulla trasformazione metabolica dell’antipsicotico aloperidolo, riducendone gli effetti. Esempi di inibizione enzimatica, con conseguente rallentamento nell’eliminazione e quindi effetti maggiori (fino alla tossicosi), sono invece l’inibizione del metabolismo della fenitoina da parte dei chemioterapici cloramfenicolo o isoniazide, e quella che esercita il disulfiram (una volta usato per la disassuefazione dall’alcolismo) sul metabolismo dell’alcol, con effetti devastanti.