neuropeptidi
neuropeptidi
I neuropeptidi sono piccole molecole di natura proteica che, liberate dalle cellule nervose in risposta a uno stimolo, mediano o modulano la comunicazione neuronale legandosi a specifici recettori di superficie. Una volta rilasciati nella giunzione sinaptica, i peptidi attivi possono comportarsi da veri neurotrasmettitori, in maniera sia autocrina sia paracrina, oppure agire da neuromodulatori, condizionando la neurotrasmissione attraverso la liberazione di trasmettitori di tipo rapido. Dopo essersi legati ai propri recettori specifici, i neuropeptidi danno inizio alla cascata di eventi biochimici che porta alla stimolazione o all’inibizione cellulare. Attualmente si ritiene che il genoma umano contenga circa 90 geni che codificano precursori di neuropeptidi e si conoscono circa 100 diversi neuropeptidi che vengono rilasciati da differenti popolazioni di neuroni nelle aree cerebrali di mammifero, ma il loro numero è destinato ad aumentare. Il dosaggio radioimmunologico e l’immunoistochimica hanno permesso di disegnare esatte mappe di distribuzione dei singoli neuropeptidi e dei loro recettori nel sistema nervoso centrale e periferico. [➔ codice di comunicazione neuronale; dolore; endorfine; neuromodulazione; neurotrasmettitori; sinapsi]
Uno straordinario arricchimento nelle conoscenze sulla neurotrasmissione (➔) si è avuto con le ricerche eseguite su un folto gruppo, destinato a crescere, di molecole peptidiche, in parte note come componenti del sistema endocrino e neuroendocrino. I primi n. di mammifero sono stati isolati a partire da enormi quantità di intestino o di cervello o utilizzando centinaia di ipotalami e, parallelamente, analoghi n. sono stati estratti da altre fonti, come la pelle di anfibio, da parte del grande farmacologo italiano Vittorio Erspamer.
Formazione e natura dei neuropeptidi
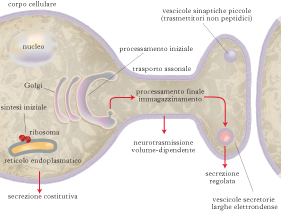
In generale, i n. si originano nel corpo della cellula nervosa come precursori a elevato peso molecolare, detti pre-propeptidi, dal cui processamento derivano uno o più n. dotati di attività biologica. La frammentazione enzimatica del precursore porta alla liberazione delle sequenze attive che spesso rivelano uno spiccato polimorfismo, presentandosi in forme di grandezza molecolare diversa. Nell’apparato del Golgi del soma neuronale i n. sono concentrati in granuli che, con appropriato meccanismo di trasporto, migrano lungo l’assone per poi depositarsi nelle terminazioni nervose in vescicole di norma più grandi e più dense di quelle di deposito dei trasmettitori non peptidici, in attesa dei segnali di secrezione. Quando la membrana plasmatica del sito secretorio viene depolarizzata, i granuli a essa più vicini si fondono con la membrana e versano all’esterno il loro contenuto peptidico, evento indicato come secrezione regolata. Una piccola quantità del precursore può però essere liberata come tale da parte del corpo del neurone, meccanismo noto come secrezione costitutiva, svolgendo generalmente funzione di fattore di crescita neuronale. I n. maturi sono costituiti da catene di 3÷100 amminoacidi e sono fino a 50 volte più grandi dei classici neurotrasmettitori, ma più piccoli delle normali proteine e con una struttura tridimensionale meno complessa. Rispetto alle molecole dei classici neurotrasmettitori, questi contengono più informazioni chimiche e hanno più siti di riconoscimento per i recettori e, conseguentemente, presentano una maggiore affinità di legame; pertanto la concentrazione fisiologica di n. è molto più bassa di quella di altri neurotrasmettitori cerebrali.
Funzioni dei neuropeptidi
Una volta immessi nello spazio sinaptico, i peptidi attivi interagiscono con specifici recettori accoppiati a proteine G posti nella membrana postsinaptica che, analogamente ai recettori metabotropici dei classici neurotrasmettitori, sono una famiglia numerosa e farmacologicamente distinguibile in sottotipi recettoriali. Queste stesse molecole possono comportarsi da veri neurotrasmettitori, oppure possono controllare a distanza più neuroni, sia nel sistema nervoso centrale sia in quello periferico, agendo come veri e propri ormoni (neurosecrezione), o ancora possono condizionare la neurotrasmissione modulando la liberazione di trasmettitori di tipo rapido (neuromodulazione). In ciascuna di queste modalità la stessa sostanza opera effetti funzio;nali diversi, ancorché il suo meccanismo di base sia sempre lo stesso, servito dallo stesso processo di trasduzione del segnale recettoriale; questo però realizza modificazioni funzionali in accordo alla specificità della cellula bersaglio. In partic., i n. con funzione di neuromodulatori, quando vengono rilasciati dalle vescicole sinaptiche in seguito alla depolarizzazione e all’ingresso di calcio nella terminazione nervosa, diffondono nell’ambiente circostante, coprendo anche lunghe distanze, e interagiscono con i rispettivi recettori con latenza talora di decine di secondi. Raramente i neuromodulatori fungono da trasmettitori, piuttosto agiscono da sensibilizzatori al trasmettitore corilasciato o al trasmettitore di neuroni vicini, oppure esercitano un’azione progressivamente inibitrice della neurotrasmissione, attivando recettori presinaptici. In generale, si attribuisce ai peptidi il ruolo di modulatori lenti più che di trasmettitori rapidi, ma questa distinzione non è priva di eccezioni: esperienze in vivo e in vitro dimostrano infatti che certi n. agiscono in modo sorprendentemente rapido e selettivo. Nei neuroni quasi tutti i n. sono presenti insieme a uno o più neurotrasmettitori, permettendo al neurone la combinazione di una comunicazione sinaptica sia veloce (2÷5 ms) sia lenta (100÷500 ms).
Differenze con gli altri neurotrasmettitori
Vi sono alcune differenze fondamentali tra i peptidi e altre molecole messaggere, rispetto sia alla sintesi sia all’immagazzinamento e alla trasduzione del segnale. Per es., il rilascio di peptidi richiede frequenze di eccitazione maggiori e, una volta rilasciati, i peptidi possono raggiungere recettori posti a notevole distanza dal sito di rilascio. Si tratta di una speciale forma di trasmissione endocrina a cui è stato dato il nome di neurotrasmissione volume-dipendente o neurotrasmissione extrasinaptica. Questa modalità espande il classico concetto di trasmissione sinaptica basata su una comunicazione per punto ed enfatizza la capacità delle molecole di trasmettitore, soprattutto peptidiche, di influenzare ampie aree bersaglio. Una volta tradotto il segnale, i n. rilasciati dal neurone non sono ricaptati dai terminali sinaptici come le ammine biogene, e non vengono neppure così rapidamente distrutti come l’acetilcolina. La scomparsa del peptide dal sito di azione è lenta e principalmente affidata alla proteolisi enzimatica a opera di varie peptidasi, più o meno specifiche, che portano alla inattivazione del peptide, oppure è indotta dalla caduta della concentrazione peptidica dovuta a diluizione. In molti casi la diluizione induce interruzione del segnale in quanto diminuisce il numero di legami peptide-recettore.
Principali neuropeptidi attivi nel sistema nervoso centrale
I n. intervengono in molteplici funzioni biologiche, a livello sia centrale sia periferico, in quanto spesso queste molecole sono prodotte, oltre che da cellule neuronali o gliali del sistema nervoso centrale, anche perifericamente da cellule endocrine o nervose, dove agiscono come neurormoni. L’azione complessiva che ne risulta è pertanto un processo integrato che regola, a vari livelli, diverse funzioni dell’organismo.
È possibile effettuare una classificazione in base al loro principale apporto a livello centrale di sistemi di regolazione di funzioni fisiologiche:
• n. modulatori del dolore e nella nocicezione (per es., peptidi oppioidi e tachichinine);
• peptidi coinvolti nel controllo metabolico e nell’assunzione di cibo (per es., NPY, colecistochinina, gastrina, grelina, bombesina);
• fattori ipotalamici di controllo della secrezione degli ormoni ipofisari (per es., TRH, somatostatina);
• peptidi coinvolti nel controllo cardiovascolare e idrico-salino (per es., peptidi natriuretici, endoteline, vasopressina);
• peptidi appartenenti alla famiglia delle granine, proteine che danno origine a numerosi frammenti peptidici bioattivi (cromogranine e secretogranine, pancrestatina).
Nel seguito vengono approfonditi soltanto alcuni n. che hanno particolare rilievo in fisiologia e nelle patologie del sistema nervoso centrale.
Tachichinine. Oltre ai peptidi oppioidi (➔), tra i modulatori del dolore e della nocicezione sono di particolare rilievo le tachichinine. Questa vastissima famiglia, presente in tutti i vertebrati e in numerose specie di invertebrati, è rappresentata, nei mammiferi, principalmente dalla sostanza P e dalle due neurochinine A e B. Si tratta di n. ampiamente distribuiti sia nel sistema nervoso centrale sia in quello periferico, dotati della capacità di regolare una grande varietà di risposte biologiche nei diversi organi e tessuti e di agire da neurotrasmettitori, neuromodulatori e fattori neurotrofici. Sono presenti in grandi quantità nelle aree coinvolte nel controllo di molte funzioni autonome ed endocrine, nelle aree che regolano le risposte affettive ed emozionali e sono spesso colocalizzate con altri neurotrasmettitori come dopammina, serotonina ed endomorfine. Le tachichinine vengono catalogate in due sottofamiglie codificate da altrettanti distinti geni: PPT-A (preprotachichinina A) che codifica, oltre alla sostanza P e alla neurochinina A, anche i n. κ e γ, e PPT-B (preprotachichinina B), che codifica la neurochinina B. Nel 2000 è stato evidenziato un terzo gene, indicato come TAC4, che codifica i peptidi emochinina 1 e le endochinine. Le principali sedi di localizzazione delle tachichinine nel sistema nervoso di mammifero sono rappresentate dal sistema motorio extrapiramidale (substantia nigra, corpo striato), dal midollo spinale e, in periferia, da plessi intramurali di organi periferici. Le tachichinine interagiscono con tre distinti recettori accoppiati a proteine G, denominati NK1, NK2 e NK3, i cui agonisti sono, rispettivamente, la sostanza P, la neurochinina A e la neurochinina B. Una caratteristica peculiare del sistema tachichininergico è rappresentata dal fatto che vi è spesso discrepanza tra la distribuzione di questi peptidi e dei rispettivi recettori, inducendo a pensare che la trasmissione da tachichinine nel sistema nervoso sia prevalentemente una trasmissione volume-dipendente o neurotrasmissione extrasinaptica. A livello centrale, le tachichinine esplicano una potente azione antidipsogena (inibizione della sete) e sono coinvolte nell’attivazione di vari riflessi, come il vomito e la minzione, e soprattutto nella nocicezione, attraverso un intervento sulla trasmissione del dolore a livello del midollo spinale. Questo ultimo effetto sembra essere dipendente da un potenziamento della neurotrasmissione da amminoacidi eccitatori. In periferia, le tachichinine intervengono nel controllo dell’attività motoria del tratto gastrointestinale con un effetto contratturante, nella coagulazione del sangue e nella risposta infiammatoria della pelle e di altri tessuti, dove stimolano il rilascio di istamina, aumentando la permeabilità vasale e favorendo la formazione di edemi infiammatori. Oltre che in numerosi neuroni del sistema nervoso autonomo, la sostanza P è presente anche nelle cellule enterocromaffini.
Colecistochinina (CCK, CholeCystoKinin). È un ormone intestinale attivo sia in periferia sia nel sistema nervoso centrale (corteccia e altre aree); funge da neurotrasmettitore e neuromodulatore, regolando gli effetti di altri trasmettitori come dopammina, serotonina, oppioidi endogeni, GABA e amminoacidi eccitatori. Esistono due tipi di recettori per la colecistochinina, denominati CCKA e CCKB. I primi sono localizzati prevalentemente a livello periferico, mentre i secondi sono ampiamente distribuiti nel cervello. In risposta all’attivazione dei recettori CCKB, la colecistochinina, iniettata nel cervello di diverse specie animali, induce attacchi di panico e ansia che si associano a comportamenti di difesa. Inoltre essa esplica un’azione depressiva sull’appetito, nonché una cospicua azione anticonvulsivante, sedativa e analgesica, in parte tramite la liberazione di catecolammine e di encefaline.
Peptide intestinale vasoattivo (VIP, Vasoactive Intestinal Peptide). È ampiamente distribuito in numerosi nervi autonomi periferici e in vaste aree del sistema nervoso centrale importanti per la funzione cognitiva (corteccia, ippocampo). In periferia, ha un’accentuata azione vasodilatatrice e rilassante sulla muscolatura liscia gastrointestinale, compresa quella delle vie biliari. A livello centrale, sembra svolgere un’azione protettiva verso svariate sostanze neurotossiche e si ritiene ricopra un importante ruolo nell’apprendimento e nella memoria, forse attraverso un’esaltazione della funzione colinergica.
Bombesina (GRF, Gastrin-Releasing Factor). Appartiene a una famiglia di peptidi che agiscono in periferia come potenti liberatori di gastrina, e quindi stimolatori della secrezione acida gastrica, e come potenti liberatori di colecistochinina e di somatostatina, ossia inibitori della motilità intestinale. Nel sistema nervoso centrale essi sono coinvolti nella termoregolazione e nella glicoregolazione, nel controllo della sete e della secrezione di prolattina e dell’ormone della crescita. Inoltre, inibiscono la secrezione gastrica e l’assunzione del cibo. Nel sistema neurovegetativo il neuropeptide Y (NPY) è spesso liberato insieme alla noradrenalina e all’ATP dalle terminazioni simpatiche dei vasi e di numerosi organi a muscolatura liscia. La sua funzione principale è quella di modulare l’azione del trasmettitore principale. Nel sistema nervoso centrale, dove agisce da potente vasocostrittore, è in genere largamente diffuso nei neuroni non adrenergici.
Neurotensina. Isolata inizialmente dall’ipotalamo come un fattore stimolante la secrezione salivare, è largamente presente in varie aree cerebrali e in nervi periferici, soprattutto gastrointestinali. In periferia, il peptide sembra inibire la secrezione di gastrina e la motilità gastrica e interferire nella regolazione della pressione del sangue, provocando ipotensione. A livello del sistema nervoso centrale, la neurotensina sembra essere un importante modulatore della nocicezione, della temperatura, del comportamento alimentare e dello stress.
Fattori ipotalamici che controllano la secrezione ormonale. Tra i fattori di controllo della secrezione degli ormoni ipofisari, il TRH (Thyrotropin-Releasing Hormone) è stato il primo a essere completamente caratterizzato. Il TRH è un tripeptide che, oltre alla sua funzione di rilascio neuroendocrino dell’ormone ipofisario TSH che stimola la tiroide, ha funzioni di neurotrasmettitore e di neuromodulatore sia nel sistema nervoso centrale sia in quello periferico. Questo neuropeptide ha la capacità di inibire nei neuroni l’espressione dell’enzima glicogenosintasichinasi-3β (GSK-3β), responsabile della formazione degli aggregati neurofibrillari associati alla demenza della malattia di Alzheimer. È stata prospettata la possibilità che il TRH possa essere utilizzato nella malattia di Alzheimer e in altre patologie neurodegenerative. Un altro fattore ipotalamico è rappresentato dalla somatostatina, originariamente caratterizzata come neurormone ipotalamico responsabile dell’inibizione della secrezione dell’ormone della crescita ipofisario. Oltre al ruolo neuroendocrino, la somatostatina agisce come neuromodulatore nel sistema nervoso centrale, influenzando l’attività motoria, il sonno e le funzioni cognitive, e gioca un ruolo in patologie cerebrali come i disordini affettivi, l’epilessia e la malattia di Alzheimer.
Cosintesi e cosecrezione neuronale di monoammine e peptidi
L’ipotesi di Henry H. Dale, secondo il quale tutti i neuroni liberano un unico e ben definito trasmettitore, è stata largamente superata dalle ricerche di Tomas Hökfelt, il quale ha dimostrato che molti neuroni sintetizzano e depositano nelle vescicole sinaptiche più sostanze biologicamente attive, che possono essere liberate simultaneamente. Si possono infatti verificare la cosintesi e la cosecrezione di più ammine, di ammine e polipeptidi o di più polipeptidi. Nel sistema nervoso periferico si può osservare la coesistenza di noradrenalina con il neuropeptide Y, l’ATP, la somatostatina e le encefaline, di acetilcolina e del VIP e, nella midollare del surrene, di adrenalina e di vari peptidi oppioidi. Nel sistema nervoso centrale possono coesistere, per es., la serotonina e la sostanza P, la colecistochinina e l’acetilcolina. È probabile che la cosintesi e la cosecrezione di diversi neurotrasmettitori e neuromodulatori rappresentino, se non la regola, un’evenienza frequente. Non è ancora chiaro il significato di questa simultanea molteplicità di segnali chimici, ma è evidente che essa eleva la potenzialità e la perfezione del messaggio trasmesso alla cellula bersaglio. Nell’interpretazione degli interventi terapeutici diretti a indurre modificazioni quantitative di un singolo trasmettitore è necessario considerare se esso è in realtà cosecreto con altri trasmettitori o modulatori che non vengono modificati, ma piuttosto sregolati, dall’intervento terapeutico. Questo fenomeno potrebbe spiegare la parzialità e la temporaneità del successo terapeutico e la comparsa di effetti collaterali. Cinzia Severini
Neuropeptidi e patologie nervose