Neurosecrezione
Neurosecrezione
di Giovanni Berlucchi
SOMMARIO: 1. Introduzione. □ 2. Evoluzione del concetto di neurosecrezione: a) origine del concetto di neurosecrezione; b) distinzione tra neurotrasmettitori e neurormoni; c) neuromodulatori e secrezione paracrina; d) il liquor cerebrospinale come mezzo di diffusione di principî con azioni neurotrope; e) definizione di neurosecrezione; f) classificazione dei sistemi neurosecretori. □ 3. Caratteristiche citologiche e fisiologiche generali dei neuroni secretori: a) caratteristiche morfologiche e formazione dei granuli; b) liberazione all'esterno della cellula del materiale neurosecretorio; c) destino del materiale neurosecretorio liberato. □ 4. Anatomia e fisiologia speciali dei sistemi neurosecretori endocrini ipotalamo-ipofisari: a) il sistema magnocellulare neurosecretore; b) il sistema parvocellulare neurosecretore dell'ipotalamo. □ 5. Peptidi neurogeni e organizzazione dell'attività nervosa: a) peptidi neurogeni e comportamento; b) vasopressina, ossitocina e memoria; c) comportamento sessuale e peptidi del sistema parvocellulare ipotalamico; d) angiotensina e sete; e) peptidi neurogeni e dolore; f) altri peptidi come possibili neuromodulatori; g) sostanze non peptidiche, neurosecrezione e comportamento. □ 6. Conclusioni. □ Bibliografia.
1. Introduzione.
Nella sua ormai famosa teoria sull'evoluzione della scienza Kuhn (v., 1962) ha sostenuto che tale evoluzione non consiste affatto in un processo di continua e graduale modificazione delle idee e delle cognizioni in base alle nuove esperienze, ma è invece il risultato di avvenimenti episodici eccezionali - le rivoluzioni scientifiche - che portano a una revisione radicale, e quindi alla sostituzione, anziché al perfezionamento, dei paradigmi di pensiero e di prassi adottati fino a quel momento dalla comunità scientifica. L'attività scientifica normale, che Kuhn equipara a mere esercitazioni enigmistiche, consisterebbe soltanto nell'affinamento e nella precisazione di dettagli in accordo con i paradigmi scientifici vigenti al momento, e produrrebbe risultati destinati a perdere il loro valore scientifico in tutto o in parte al momento in cui la successiva rivoluzione scientifica genererà un nuovo paradigma. Swazey e Worden (v., 1975) hanno recentemente analizzato la storia di vari campi delle neuroscienze in base alla concezione epistemologica di Kuhn, riscontrando numerosi esempi di sviluppi ad andamento kuhniano. Un caso da essi ritenuto tipico è quello della neurosecrezione, concetto che fu considerato decisamente eretico al tempo della sua origine nei primi decenni del secolo e fu pertanto avversato dall'establishment neuroscientifico per la sua incompatibilità con il paradigma dell'epoca. Il concetto tuttavia fu universalmente accettato, negli anni cinquanta, nel contesto di un nuovo paradigma che esso stesso aveva contribuito a generare. Tale paradigma riconosceva al sistema nervoso funzioni endocrine in aggiunta alle tradizionali funzioni motorie, sensoriali e vegetative.
Per quanto suggestiva e ben formulata, questa analisi non deve indurci a pensare che l'attività scientifica attuale nel campo della neurosecrezione sia normale in senso kuhniano, e che un'esposizione storiografica o addirittura cr0- nachistica di una serie di concetti e di esperimenti basti a descrivere esaurientemente l'argomento. Da una parte non si può negare che non esiste attualmente una definizione totalmente soddisfacente di neurosecrezione, e d'altra parte è possibile prevedere che risultati ottenuti recentemente in quest'area di ricerca potrebbero indurci a rivedere completamente alcune delle concezioni sull'organizzazione del sistema nervoso che fino a poco fa parevano del tutto inattaccabili.
È certamente vero che l'accettazione del concetto di neurosecrezione ha rivoluzionato le scienze del sistema nervoso, ma è altrettanto vero che con tale accettazione non si è esaurita la potenzialità rivoluzionaria, sempre in senso kuhniano, della ricerca sui fenomeni della secrezione neuronica e sul significato di questa nei confronti dell'attività nervosa ed endocrina in generale.
2. Evoluzione del concetto di neurosecrezione.
a) Origine del concetto di neurosecrezione.
L'evoluzione del concetto di neurosecrezione può essere seguita nei rendiconti di sette simposi internazionali (v. Scharrer e altri, 1954; v. Bargmann e altri, 1958; v. Heller e Clark, 1962; v. Stutinsky, 1967; v. Bargmann e Scharrer, 1970; v. Knowles e Vollrath, 1974; v. Bargmann e altri, 1978) e in articoli di carattere storiografico (v. Knowles, 1974; v. Scharrer, 1975; v. Guillemin, 1978).
Il concetto derivò originariamente dall'osservazione di particolari caratteristiche morfologiche in neuroni spinali o ipotalamici di Vertebrati o in neuroni di vari centri del sistema nervoso di Invertebrati (v. Gabe, 1967; v. ormoni negli invertebrati), quali la presenza di vacuoli e granuli nel pericario e nei prolungamenti cellulari, e la colorabilità di questi organelli intracellulari con tecniche già utilizzate per la dimostrazione di materiale secretorio in cellule endocrine non nervose (v. Scharrer, 1928; v. Bargmann, 1949). A queste caratteristiche citologiche si ricollegava inizialmente l'ipotesi di una differenza fondamentale fra neuroni comuni privi di capacità secretrici, che si pensava funzionassero esclusivamente in base a meccanismi di conduzione e trasmissione elettrica, e neuroni secretori, la cui attività fisiologica era attribuita al passaggio dei neurosecreti presumibilmente contenuti nei granuli all'esterno della membrana cellulare. L'accertamento della natura chimica della trasmissione sinaptica centrale e periferica (v. sinapsi: Fisiologia della sinapsi centrale e Fisiologia della sinapsi periferica) portò successivamente a una modificazione sostanziale di quest'ipotesi, visto che l'elaborazione intracellulare di sostanze specifiche e la loro liberazione extracellulare venivano identificate come processi comuni a tutti i neuroni, e non solo ai neuroni caratterizzati da segni morfologici indicativi di attività secretrice. Per la definizione di neurosecrezione divennero allora essenziali il concetto di ‛organo neuroemale' e l'associazione dell'attività neurosecretrice con le funzioni endocrine.
b) Distinzione fra neurotrasmettitori e neurormoni.
Le sostanze che mediano la trasmissione sinaptica fra neurone e neurone o fra neurone ed effettore periferico vengono liberate dal terminale del neurite presinaptico direttamente a ridosso della cellula postsinaptica, sulla quale agiscono unendosi a recettori specifici localizzati in un'area circoscritta della membrana cellulare. La loro azione è pertanto limitata nello spazio, come è limitata nel tempo per la presenza di agenti inattivanti, di meccanismi di riassorbimento da parte del terminale presinaptico, di semplici fenomeni di dispersione per diffusione. Da questi ‛neurotrasmettitori' si differenziano le sostanze prodotte da molti (non da tutti) neuroni secretori. Anche per questi neuroni il processo di liberazione della sostanza elaborata intracellularmente avviene al terminale del neurite, ma dato che questo è situato in stretto contatto con la lamina basale di capillari sanguigni in organi detti neuroemali, il risultato è l'immissione della sostanza liberata nel torrente circolatorio anziché la sua interazione con una cellula postsinaptica. Una volta entrate in circolo, le sostanze prodotte dai neuroni secretori sono in condizione di esercitare azioni fisiologiche su organi e tessuti situati anche a grande distanza dal punto di secrezione. Per questo fatto, e anche per la durata delle loro azioni fisiologiche che è assai più lunga in genere di quella dei neurotrasmettitori, le sostanze secrete dai neuroni nel sangue si qualificano come ‛neurormoni'. Un'ulteriore distinzione fra neurotrasmettitori e neurormoni, sia pure non assoluta, è operabile in base alla loro diversa natura chimica: i neurotrasmettitori identificati sono in genere piccole molecole (ammine biogene, amminoacidi), mentre i neurormoni sono in genere molecole peptidiche di dimensioni assai più grandi.
c) Neuromodulatori e secrezione paracrina.
La distinzione fra neurotrasmettitori e neurormoni permette a prima vista una chiara differenziazione fra neuroni secretori e neuroni non secretori; tuttavia, la situazione certamente non è così semplice. Già la nozione classica che la noradrenalina può funzionare sia come neurormone secreto dai medullociti surrenali di origine neuroblastica, sia come neurotrasmettitore sinaptico centrale e periferico (v. sistema nervoso autonomo) contraddiceva l'ipotesi di una distinzione assoluta fra neurotrasmettitori e neurormoni. Gli sviluppi recenti della neurochimica cerebrale suggeriscono che molte altre sostanze di origine nervosa, in aggiunta alla noradrenalina, possono esercitare da un lato azioni tipicamente endocrine, e dall'altro influenze sull'attività nervosa assai simili a quelle dei neurotrasmettitori. Come verrà descritto dettagliatamente più avanti, sostanze peptidiche simili o identiche ai neurormoni liberati nel sangue dai neuroni secretori vengono anche immesse, dagli stessi o da altri neuroni, nel liquido extracellulare del tessuto nervoso e nel liquor cefalorachidiano. Esse possono così influenzare l'attività nervosa con un'azione in parte simile a quella dei neurotrasmettitori sinaptici per l'intervento di legami chimici con recettori membranari delle cellule influenzate, in parte nettamente diversa per la sua maggior durata e la sua ampia diffusione spaziale. A queste sostanze è stato dato il nome di neuromodulatori (v. Iversen, 1978) o cibernine (v. Guillemin, 1978) e per definire la loro modalità di azione per diffusione, indipendente dalla circolazione sanguigna, è stato riesumato l'antico termine di secrezione paracrina (v. Guillemin, 1978). La possibilità concreta che uno stesso neurone utilizzi una stessa sostanza come neurormone trasportato dal sangue, come neurotrasmettitore a livello di contatti sinaptici con altri neuroni, e come neuromodulatore attivo per via extraematica è ovviamente in netto contrasto con l'ipotesi di una categorizzazione assoluta dei neuroni in secretori e non secretori.
d) Il liquor cerebrospinale come mezzo di diffusione di principî con azioni neurotrope.
La sperimentazione neurofarmacologica e neurochimica, come del resto alcune metodiche di terapia delle malattie neurologiche, hanno dimostrato che l'immissione di sostanze nel liquor cerebrospinale, sia nei ventricoli sia negli spazi subaracnoidei, può influenzare profondamente l'attività del sistema nervoso. Varie considerazioni fanno pensare che una comunicazione umorale che si effettua per il tramite del liquor abbia una parte non trascurabile nell'organizzazione ‛normale' dell'attività nervosa. Rodriguez (v., 1976) ha recentemente pubblicato una rassegna dei dati e delle teorie sul ruolo del liquor nell'integrazione dei meccanismi neuroendocrini; molti di questi dati e di queste teorie possono riguardare tuttavia anche l'integrazione delle attività nervose in generale, senza la necessità di collegamenti con le regolazioni endocrine. I dati di fatto principali sono i seguenti.
1. Numerosi terminali di neuriti si insinuano fra le cellule ependimali e terminano in contatto con lo spazio endoventricolare. Parte di questi neuriti provengono da neuroni con caratteri morfologici secretori, mentre altri appartengono a neuroni comuni. In entrambi i casi sembra ovvio che se vi è la normale liberazione di sostanze da parte di questi terminali neuritici, tali sostanze devono riversarsi nel liquor cerebrospinale.
2. Soprattutto nei Vertebrati non mammiferi, le arbo- rizzazioni dendritiche di cellule nervose prendono rapporto diretto con le cavità ventricolari. Inoltre, cellule nervose ciliate, dotate pertanto di una caratteristica morfologica ritenuta indicativa di funzione sensoriale, si notano in posizione direttamente subependimale, a breve distanza dalle cavità ventricolari.
3. Esami chimici e biologici della composizione del liquor, eseguiti con metodi ad alta sensibilità, hanno dimostrato la presenza di numerosi principi attivi, che possono essere di origine neurogena o non neurogena. Molti di questi principi, in genere di natura peptidica o amminica, possono anche essere presenti nel plasma: quando lo sono, la loro concentrazione plasmatica è di parecchie volte superiore a quella liquorale. Le concentrazioni liquorali sono tuttavia sufficienti, almeno per alcuni principi, a esercitare influenze chiare sull'attività nervosa.
4. L'ependima, che costituisce il rivestimento monostratificato delle cavità ventricolari, è costituito in varie regioni del sistema dei ventricoli da cellule sempre di natura gliale, ma diverse dai comuni ependimociti. Queste cellule differenziate hanno in generale una forma molto allungata, per cui sono denominate ‛taniciti' (da τανυ-); esse possono stabilire rapporti fra le cavità ventricolari e i vasi capillari, oppure fra le cavità ventricolari e i corpi di neuroni che si trovino in posizione subependimale. Sui corpi di questi taniciti si osservano inoltre contatti sinaptoidi formati da terminali neuritici. Le caratteristiche funzionali attribuite, in maniera ancora in gran parte ipotetica, a questi taniciti sono: a) la capacità di trasportare attivamente sostanze nei due sensi fra sangue capillare e liquor, oppure fra liquor e neuroni; b) la capacità di modificare i propri rapporti reciproci spaziali là dove costituiscono la parete della cavità ventricolare, regolando così la diffusione di sostanze fra liquor e liquido interstiziale del tessuto nervoso. Illustrazioni schematiche dei taniciti e delle loro possibili funzioni si trovano nelle figg. 5, 15 e 16.
Tutti questi dati e queste osservazioni suggeriscono che la presenza e la concentrazione di principi biologicamente attivi nel liquor vengano determinate sia da processi di secrezione da parte dei neuroni che proiettano con i loro neuriti direttamente nelle cavità ventricolari, sia per passaggio di questi principi dal sangue al liquor o per diffusione in punti di maggiore permeabilità della barriera emato-encefalica e della barriera encefalo-liquorale, o per trasporto attivo mediato dai taniciti. D'altra parte, un trasporto in senso inverso da parte dei taniciti potrebbe far sì che sostanze inizialmente immesse nel liquor passino nel sangue. La presenza di principî attivi nel liquor potrebbe essere avvertita dal sistema nervoso sia tramite i neuroni i cui dendriti terminano nelle cavità ventricolari, sia per trasmissione fra taniciti e neuroni, sia infine per diffusione di sostanze dal liquor al liquido interstiziale, possibilmente sotto il controllo dei taniciti ‛regolabili' (v. fig. 15).
e) Definizione di neurosecrezione.
Le considerazioni precedenti consentono un tentativo di definizione di neurosecrezione. Nel presente articolo considereremo neurosecretori tutti i processi relativi all'elaborazione, al trasporto intracellulare, alla liberazione, alla propagazione e alle attività fisiologiche sia dei neurormoni, sia dei neuromodulatori di origine neurogena con modalità di secrezione endocrina o paracrina. Questa definizione ha il difetto di essere essenzialmente una definizione per esclusione, in quanto identifica come neurosecreti tutte le sostanze neurogene che non siano neurotrasmettitori sinaptici, e pertanto la sua validità dipende dalla precisione della definizione di neurotrasmettitore. D'altra parte, questa definizione si adegua al dato di fatto che materiali secreti dai neuroni possono esercitare attività fisiologiche che certamente non intervengono direttamente nella trasmissione sinaptica nè nei processi endocrini. Con essa si rifiuta anche la pratica diffusa di usare i termini neurosecrezione e neuroendocrinologia come sinonimi.
La neuroendocrinologia si occupa dei rapporti reciproci fra sistema nervoso e ghiandole endocrine (v. neuroendocrininologia) e pertanto prende in considerazione anche quei fenomeni, come il controllo sinaptico di ghiandole endocrine (per es. midollare surrenale, pancreas) e l'azione di ormoni non neurogeni (per es. steroidi sessuali) sul sistema nervoso, che non rientrano nel campo della neurosecrezione. A sua volta la neurosecrezione, come è stata qui definita, include fenomeni come la secrezione paracrina di neuromodulatori neurogeni che non riguardano direttamente la sfera delle regolazioni neuroendocrine.
f) Classificazione dei sistemi neurosecretori.
Sulla base della precedente definizione di neurosecrezione, si possono distinguere vari sistemi neurosecretori. Una prima classe di sistemi neurosecretori è costituita dai gruppi di neuroni che elaborano neurormoni, e svolgono quindi funzioni endocrine. Nei Vertebrati questi sistemi sono localizzati nel complesso ipotalamo-ipofisario e nella midollare surrenale. Le attività neurosecretrici endocrine di questi sistemi possono a loro volta essere distinte in attività dirette o di primo grado e attività regolatrici o di secondo grado (v. Knowles, 1974). Le attività neurosecretrici endocrine dirette sono proprie del sistema magnocellulare dei nuclei sopraottico e paraventricolare dell'ipotalamo e della midollare surrenale. Il complesso magnocellulare ipotalamico immette nella circolazione generale, a livello del lobo posteriore dell'ipofisi, i due ormoni peptidici vasopressina (o adiuretina o ADH) e ossitocina, che agiscono su molteplici organi bersaglio: rene e muscolatura liscia dei vasi per la vasopressina, mammella, utero, vescicole seminali per l'ossitocina (v. neuroendocrinologia). La midollare surrenale, costituita di cellule di origine neuroblastica simpatica, riversa in circolo gli ormoni adrenalina e noradrenalina (v. sistema nervoso autonomo). I sistemi neurosecretori con attività endocrina regolatrice o di secondo grado sono rappresentati dal complesso neuronico parvocellulare dell'ipotalamo che secerne gli ormoni destinati al controllo della produzione degli ormoni del lobo anteriore e del lobo intermedio dell'ipofisi. Questi fattori ipotalamici che controllano l'attività endocrina dell'ipofisi sono veri neurormoni in quanto vengono immessi nel torrente circolatorio nel plesso capillare primario formato dalle arterie ipofisarie superiore e inferiore. La loro permanenza nel sangue è limitata tuttavia al breve tragitto lungo il sistema portale ipofisario, e le loro cellule bersaglio sono esclusivamente le cellule endocrine ipofisarie. Ciò differenzia questi neurormoni regolatori dai neurormoni prodotti dai sistemi neurosecretori con attività endocrina diretta, che, come abbiamo visto, percorrono la circolazione generale ed esercitano azioni su tessuti e organi molto diversi. Convincenti, anche se non definitive, indicazioni dell'esistenza di altri sistemi neurosecretori a carattere non endocrino sono fornite dai seguenti dati.
1. Neuroni dei sistemi ipotalamici neurosecretori magnocellulare e parvocellulare proiettano a regioni nervose ipotalamiche ed extraipotalamiche dove non esistono contatti neuroemali (v. Reichlin e altri, 1978). Parte di queste proiezioni terminano in organi circumventricolari, come l'organo vascolare della lamina terminale, o direttamente a contatto con l'ependima dei ventricoli cerebrali, suggerendo la possibilità che i neurosecreti diffondano nel liquor cerebrospinale passando quindi in varie aree del tessuto nervoso. Sono note collaterali ricorrenti delle fibre del sistema magnocellulare, che costituiscono il fascio ipotalamo-ipofisario, e del sistema parvocellulare, che costituiscono il fascio tubero-infundibolare. Se si accetta il principio di Dale (v., 1935) secondo il quale ogni neurone libera la stessa sostanza a livello di tutti i suoi terminali neuritici, queste collaterali ricorrenti devono liberare, rispettivamente, vasopressina od ossitocina e i fattori ipofisiotropi. Tali sostanze quando sono liberate dalle collaterali ricorrenti nel tessuto nervoso, anziché nel sangue, funzionano con ogni probabilità da trasmettitori sinaptici o da neuromodulatori anziché da neurormoni. La stessa considerazione si applica alle proiezioni di quei neuroni secretori dei sistemi magnocellulare e parvocellulare ipotalamici che non prendono contatto con capillari sanguigni ma terminano in regioni ipotalamiche o extraipotalamiche del tessuto nervoso.
2. Con le moderne tecniche immunoistochimiche e immunocitologiche è stato possibile dimostrare nelle più svariate regioni del sistema nervoso centrale - dalla neocorteccia al midollo spinale - la presenza di neuroni ‛peptidergici' che producono: a) peptidi identici ai peptidi dei sistemi neuroendocrini ipotalamici; oppure b) peptidi identici o simili a ormoni non neurogeni come gli ormoni gastrointestinali, la renina e l'angiotensina II; oppure ancora c) peptidi diversi dai precedenti, ma aventi presumibilmente azioni della stessa natura sul sistema nervoso (v. Gainer, 1977). Tutti questi peptidi esercitano potenti influenze sull'attività dei neuroni quando sono applicati direttamente al tessuto nervoso. Tali influenze sono state dimostrate con metodi comportamentali ed elettrofisiologici nell'animale integro, e anche con lo studio di neuroni coltivati in vitro. Le azioni di questi peptidi hanno in genere le caratteristiche attribuite ai neuromodulatori - lunga durata e azione su vaste aree del sistema nervoso - ma la possibilità che essi funzionino anche come neurotrasmettitori sinaptici non può essere esclusa. In ogni caso le azioni di questi peptidi si esercitano direttamente sul sistema nervoso e sono indipendenti dai meccanismi endocrini, anche se possono coinvolgerli.
3. Neuropeptidi identici a neurormoni ipofisiotropi dei Mammiferi si trovano in animali che non hanno l'ipofisi: ad esempio, l'ormone ipotalamico che controlla l'ormone ipofisario tireotropo è presente nei gangli circumesofagei della lumaca, animale privo di ipofisi. Ciò suggerisce che queste molecole peptidiche siano state adattate nel corso della filogenesi a svolgere ruoli diversi nel sistema nervoso (v. Jackson, 1978).
4. È possibile che alcuni dei sistemi neuronici amminergici dell'encefalo utilizzino le ammine da essi prodotte non come trasmettitori sinaptici ma come regolatori della crescita e della differenziazione dei neuroni (v. Lewis, 1978) e come modulatori della plasticità dei circuiti nervosi (v. Pettigrew, 1978). Queste azioni neuroumorali differenziabili dalla trasmissione sinaptica rientrerebbero a buon diritto nel capitolo della neurosecrezione.
3. Caratteristiche citologiche e fisiologiche generali dei neuroni secretori.
a) Caratteristiche morfologiche e formazione dei granuli.
Una rassegna approfondita sull'argomento è stata pubblicata di recente da Mason e Bern (v., 1977). La varietà e l'eterogeneità dei neuroni classificati come secretori secondo la definizione qui adottata non preclude che essi abbiano in comune molte caratteristiche citologiche e fisiologiche generali. Tali caratteristiche comuni si osservano anche in specie molto diverse, dagli Invertebrati all'uomo. La fig. 1 mostra le principali differenze citologiche fra un neurone secretore e un neurone comune negli Invertebrati; in genere, queste differenze valgono anche per i Vertebrati. I neuroni secretori sono neuroni a tutti gli effetti, e mostrano pertanto le proprietà morfologiche tipiche del neurone: pericario con prolungamenti dendritici e prolungamento neuritico con relative ramificazioni, sistemi neurofibrillari, associazione con cellule gliali, organelli citoplasmatici. La maggior parte dei neuroni secretori sono peptidergici e si differenziano dai neuroni comuni per la presenza di granuli da 90 a 300 nm di diametro, limitati da una membrana e opachi agli elettroni del microscopio elettronico. Questi granuli si trovano sia nel pericario che nei prolungamenti, e possono essere concentrati in ampie dilatazioni del prolungamento neuritico, dette corpi di Herring (v. fig. 2). Si ritiene che questi granuli che contengono il materiale neurosecretorio siano formati nel pericario tramite i seguenti processi: una istruzione specifica viene inviata dal nucleo ai ribosomi attaccati al reticolo endoplasmatico dove si forma un precursore del materiale neurosecretorio terminale, presumibilmente una molecola proteica di grandi dimensioni. Questa molecola viene successivamente trasportata all'apparato del Golgi che provvede sia a formare la membrana dei granuli, sia a immettervi, presumibilmente dopo un processo di frazionamento molecolare, il materiale neurosecretorio. I granuli vengono successivamente trasportati lungo i prolungamenti, in particolare lungo il neurite, con un meccanismo di flusso assonico molto rapido, dell'ordine di qualche millimetro l'ora. Tale meccanismo non è noto in dettaglio: l'ipotesi più probabile è che i granuli si muovano con modalità simili a quelle dimostrate per il trasporto di vescicole o altre componenti particolate lungo il neurite. In breve la struttura necessaria per il movimento sarebbe il complesso dei microtubuli, lungo i quali il materiale trasportato può scorrere unendosi con legami specifici a subunità microtubulari che si sposterebbero grazie all'energia liberata dal trifosfato di guanosina in presenza di un catione divalente. Altri meccanismi, come la diffusione, i movimenti peristaltici del neurite e un flusso dovuto a differenze di pressione idrostatica, sono considerati meno probabili. È accertato, comunque, che qualunque sia il meccanismo di trasporto dei granuli, questi vanno incontro durante il trasporto stesso a un processo di maturazione che porta alla formazione del materiale neurosecretorio finale. La liberazione del materiale neurosecretorio al di fuori della cellula avviene con ogni probabilità per un processo di esocitosi che consiste nella fusione della membrana del granulo con la membrana del terminale neuritico e nell'apertura del granulo stesso verso lo spazio extracellulare. Questo processo di esocitosi ha luogo certamente nel terminale neuritico, ma potrebbe in qualche caso avvenire anche nelle dilatazioni di Herring. L'ipotesi più probabile, tuttavia, è che arrivati al terminale neuritico i granuli, qualora non vengano secreti per esocitosi, risalgano lungo il neurite in senso retrogrado e si accumulino nei corpi di Herring per costituire un deposito utilizzabile in condizioni di aumentata neurosecrezione; in tal caso i granuli depositati nei corpi di Herring sarebbero ritrasportati al terminale neuritico. Una parte di vecchi granuli potrebbe tuttavia essere distrutta a opera dei lisosomi e sia il loro contenuto che la loro membrana potrebbero servire alla formazione di nuovi granuli. La fig. 3 riassume schematicamente questo processo.
b) Liberazione all'esterno della cellula del materiale neurosecretorio.
Il processo di liberazione all'esterno della cellula del materiale neurosecretorio per esocitosi è assai simile, se non identico, al processo di liberazione di neurotrasmettitori contenuti in vescicole, come l'acetilcolina (v. sinapsi: Fisiologia della sinapsi periferica). Come è noto, il processo di liberazione di acetilcolina nelle sinapsi neuromuscolari, come d'altra parte anche il processo di liberazione di mediatori sinaptici nelle sinapsi centrali, ha un livello basale minimo che è indipendente dallo stato elettrico della membrana del terminale neuritico, e un livello di attività assai superiore che è causato dall'arrivo del potenziale d'azione al terminale neuritico e dal conseguente ingresso in questo di ioni calcio. La liberazione del materiale granulare da parte dei neuroni secretori è in gran parte analoga. Non è certo che esista una liberazione di materiale secretorio allo stato basale, cioè in assenza di attività elettrica, ma è sicuro che il meccanismo dell'esocitosi segue all'arrivo del potenziale d'azione al terminale neuritico. Anche qui, come nelle sinapsi dei neuroni comuni, l'ingresso degli ioni calcio nel terminale neuritico ha un'importanza causale per la liberazione del materiale neurosecretorio, dato che questa non avviene in assenza di calcio nel mezzo extracellulare, ed è invece aumentata dall'applicazione di ionofori che facilitano l'entrata del calcio nelle cellule. Come nei neuroni comuni, anche nei neuroni neurosecretori il segnale elettrico adeguato per il movimento intracellulare degli ioni calcio è la depolarizzazione parziale della membrana del terminale neuritico; infatti, in condizioni sperimentali, si ha liberazione di materiale neurosecretorio quando si depolarizza la membrana del terminale neuritico dei neuroni secretori innalzando la concentrazione extracellulare di potassio, anche se si impedisce la formazione di potenziali d'azione per mezzo di tetrodotossina. In condizioni fisiologiche, tuttavia, la depolarizzazione del terminale neuritico neurosecretore avviene quando il potenziale d'azione arriva al terminale stesso. Non vi sono differenze fondamentali fra neuroni secretori e neuroni comuni in termini di caratteristiche elettrofisiologiche. I neuroni secretori hanno un potenziale di membrana di riposo interno-negativo paragonabile a quello degli altri neuroni, e anche i meccanismi di genesi e di propagazione del potenziale d'azione non presentano differenze di rilievo nelle due classi di neuroni, se si esclude la possibile partecipazione degli ioni calcio al potenziale d'azione nel terminale neuritico dei neuroni secretori (v. Cooke, 1977). La durata del potenziale d'azione sarebbe infatti assai più lunga nel terminale neuritico che nel resto del neurite. Un modello in parte ipotetico della liberazione di materiale neurosecretorio, che include i fatti principali accertati, è illustrato nella fig. 4.
c) Destino del materiale neurosecretorio liberato.
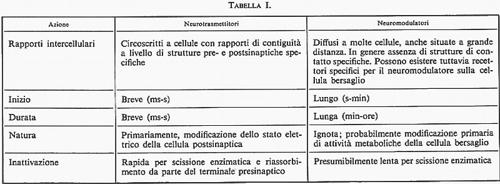
Il destino del materiale liberato dalle cellule neurosecretrici può essere, come abbiamo visto, diverso a seconda della sede in cui avviene l'uscita dalla membrana cellulare: a) se la liberazione avviene a contatto con la parete capillare in un organo neuroemale, allora si avrà l'entrata in circolo del neurosecreto, che si qualifica pertanto come un neurormone. L'entrata in circolo può anche avvenire per una via più complessa, quando il neurosecreto viene liberato nel liquor cerebrospinale, tramite le speciali cellule ependimali, i taniciti, che si presume colleghino i ventricoli con i vasi sanguigni (v. fig. 5); b) la liberazione del materiale neurosecretorio nel tessuto nervoso per via diretta o per via indiretta, dopo diffusione negli spazi ventricolari e passaggio attraverso gli organi circumventricolari o spazi ependimali specializzati, dà luogo, come si è già detto, alla possibilità di azioni di tipo neurotrasmettitore o di tipo neuromodulatore. Solo il secondo tipo di azione viene qui considerato come un aspetto della neurosecrezione. La distinzione fra azioni di neurotrasmettitori e azioni di neuromodulatori non è assoluta ed è comunque difficile; essa è giustificata, tuttavia, dai dati neurocitologici e neurofisiologici in nostro possesso. La tab. I indica le principali differenze fra i due tipi di azione.
4. Anatomia e fisiologia speciali dei sistemi neurosecretori endocrini ipotalamo-ipofisari.
I sistemi neurosecretori più studiati sono i sistemi con attività neuroendocrina di primo e secondo grado. Esamineremo in questa sede le più importanti proprietà anatomiche e fisiologiche di due di questi sistemi nei Vertebrati: il sistema magnocellulare e il sistema parvocellulare del complesso ipotalamo-ipofisario (v. fig. 6). L'esposizione che segue è basata in gran parte sulle recenti rassegne di Hayward (v., 1977), Cross e Wakerley (v., 1977), Richard e altri (v., 1978) e Renaud (v., 1978), che vanno consultate per i riferimenti bibliografici ai lavori originali. (Per la descrizione dei sistemi neurosecretori neuroendocrini degli Insetti e del sistema neuroendocrino della midollare surrenale nei Vertebrati v. ormoni negli invertbrati; v. sistema nervoso autonomo).
a) Il sistema magnocellulare neurosecretore.
Questo sistema, dotato di attività neuroendocrina di primo grado, è costituito nei Vertebrati da neuroni dei nuclei sopraottico e paraventricolare dell'ipotalamo che proiettano all'organo neuroemale costituito dal lobo posteriore dell'ipofisi (v. fig. 7). Questi neuroni elaborano due ormoni nonapeptidici, l'òssitocina e la vasopressina (o adiuretina o ADH), ciascuno dei quali è associato nei granuli neurosecretori con una proteina specifica del peso molecolare di circa 10.000: rispettivamente, la neurofisina I e la neurofisina Il. Il sistema è detto magnocellulare, perché i neuroni che lo compongono hanno grandi dimensioni (diametro del pericario, circa 40 μ) rispetto agli altri neuroni ipotalamici (diametro del pericario, inferiore a 10 μ). I neuriti di questi neuroni, amielinici, costituiscono il fascio ipotalamo-ipofisario e prendono contatti multipli con la lamina basale dei capillari postipofisari (v. fig. 2). Il sistema magno-cellulare possiede tutte le proprietà citologiche descritte più sopra per i neuroni secretori in generale. In particolare, il flusso dei granuli secretori lungo il neurite è stato dimostrato originariamente in neuroni di questo sistema mediante l'osservazione di accumulo dei granuli a monte, e scomparsa a valle, di una sezione neuritica. Inoltre in neuroni di questo sistema sono state riscontrate correlazioni fra il numero di granuli nei neuroni e il contenuto ormonale specifico del sistema ipotalamo-ipofisario.
Nell'analisi dell'organizzazione del sistema magnocellulare si sono esaminate tre possibilità: a) entrambi gli ormoni e le relative proteine sono secrete dagli stessi neuroni; b) esistono due popolazioni separate di neuroni, ciascuna preposta all'elaborazione di uno dei due ormoni, con i neuroni vasopressinergici situati nel nucleo sopraottico e quelli ossitocinergici nel nucleo paraventricolare; c) esistono neuroni vasopressinergici e neuroni ossitocinergici, che tuttavia sono distribuiti in entrambi i nuclei del sistema magnocellulare. La terza ipotesi è stata suffragata dalle ricerche più recenti, basate sull'utilizzazione di metodi elettrofisiologici, immunoistochimici e immuno-citochimici. Soprattutto questi ultimi metodi hanno permesso di identificare, sia nel nucleo sopraottico che in quello paraventricolare, neuroni immunoreagenti specificamente per l'uno o per l'altro dei due ormoni, o per le rispettive proteine associate. In alcune specie i neuroni ossitocinergici prevalgono per numero su quelli vasopressinergici nel nucleo paraventricolare, mentre il contrario avviene nel nucleo sopraottico, ma in tutte le specie esaminate entrambi i nuclei contengono neuroni di entrambi i tipi. Il concetto della dicotomia funzionale fra le popolazioni dei neuroni destinati alla produzione dei due ormoni, e della presenza di entrambi i tipi di neuroni in entrambi i nuclei ipotalamici, è anche in accordo con la recente scoperta di un ceppo di ratti (ceppo Brattleboro) il cui sistema magnocellulare è incapace di elaborare vasopressina ma produce normali quantità di ossitocina. Nei nuclei sopraottico e paraventricolare di questi animali è presente un gruppo di neuroni magnocellulari che non hanno le caratteristiche citologiche della neurosecrezione, anche se i loro neuriti terminano nel lobo posteriore dell'ipofisi. Accanto a questi neuroni agranulari, che si presume corrispondano ai neuroni vasopressinergici dei ratti normali e non svolgano tale funzione per uno specifico difetto genetico, sono presenti neuroni secretori di normale aspetto citologico che secernono normalmente ossitocina.
L'analisi elettrofisiologica dei neuroni del sistema magnocellulare è facilitata dal fatto che la registrazione dai corpi cellulari di questi neuroni può avvenire anche in animali non anestetizzati e liberi di muoversi, dopo identificazione del neurone in esame come effettivamente appartenente al sistema neurosecretore magnocellulare in base alla sua attivazione antidromica per stimolazione elettrica del fascio ipotalamo-ipofisario (v. fig. 8). La conoscenza degli effetti fisiologici dei due ormoni del sistema magnocellulare (v. neuroendocrinologia) permette di studiare l'attività dei neuroni di questo sistema in condizioni funzionali collegate oggettivamente a tali effetti. Il ruolo fisiologico più importante dell'ossitocina è quello di stimolare le contrazioni delle cellule mioepiteliali dei dotti galattofori della mammella, con conseguente eiezione del latte. Questo ruolo ha un'importanza vitale per la prole, che in assenza di ossitocina nella madre non può ottenere latte succhiando la mammella e muore per denutrizione. Gli stimoli che producono liberazione di ossitocina durante l'allattamento e la mungitura sono stimoli meccanici e termici del capezzolo, che presumibilmente vengono trasmessi al sistema magno-cellulare dell'ipotalamo tramite vie spino-reticolari e reticolo-ipotalamiche. La liberazione di ossitocina in risposta a questi stimoli può essere analizzata sia dosando l'ossitocina nel sangue periferico, sia misurando la pressione intramammaria, che aumenta quando le cellule mioepiteliali dei dotti galattofori si contraggono. In varie specie di mammiferi studiate durante l'allattamento (inclusa la specie umana), si è osservato che la liberazione di ossitocina avviene tipicamente per immissioni periodiche, anziché per continua infusione, di ormone nel sangue, anche se lo stimolo mammario è continuo. Nella donna durante 15 minuti di allattamento si hanno tre ondate di aumento della pressione intramammaria, che corrispondono all'immissione nel sangue di tre dosi di ossitocina dell'ordine di 30, 20 e 20 mU. Nella femmina di ratto, il cui periodo di allattamento ha una durata maggiore (30-40 min), le scariche di ossitocina durante ogni periodo di allattamento sono 6-8: la registrazione dell'attività di neuroni del sistema magnocellulare durante l'allattamento dimostra un corrispettivo elettrofisiologico di questa modalità di liberazione di ossitocina. Alcuni neuroni, la cui attività ‛spontanea' è nulla o assai bassa al di fuori dell'allattamento, mostrano alcuni minuti dopo l'inizio dell'allattamento delle salve di potenziali d'azione della durata di 1-4 secondi, e con una frequenza nella salve da 20 a 80 potenziali al secondo. Questa attivazione avviene presumibilmente in maniera sincrona per tutti i neuroni ossitocinergici, ed è seguita dopo 10-20 s da un aumento della pressione intramammaria; tale latenza è in buon accordo con la latenza della risposta della pressione intramammaria alla stimolazione elettrica del fascio ipotalamo-ipofisario e con i dati sulla comparsa delle ondate di ossitocina nel sangue periferico durante l'allattamento. In un periodo di allattamento vi sono 6-8 salve di attività neuronica, separate da periodi di inattività completa, ognuna delle quali precede l'ondata di immissione di ossitocina nel sangue e la conseguente risposta della pressione intramammaria. Queste cellule ritenute ossitocinergiche possono anche rispondere, ma con una scarica continuata, alla diminuzione del volume sanguigno (v. fig. 9), in analogia con le cellule vasopressinergiche e in accordo con la nozione di una risposta biormonale a questo tipo di stimolo. È possibile calcolare la quantità di ossitocina liberata per ogni potenziale d'azione in condizioni di assenza di stimolo e durante l'allattamento (v. fig. 10). Durante la stimolazione la quantità di ormone liberato da ogni potenziale d'azione è circa 100 volte maggiore rispetto alle condizioni di riposo. Questo dato si spiegherebbe con la facilitazione del processo dell'esocitosi al terminale neuritico quando aumenta la frequenza dei potenziali d'azione, in analogia a quanto avviene per la liberazione di trasmettitori sinaptici da parte di neuroni non secretori (v. anche sinapsi: Fisiologia della sinapsi periferica).
Un altro ruolo fisiologico dell'ossitocina è quello di favorire le contrazioni uterine durante lo stadio espulsivo del parto. La stimolazione elettrica del fascio ipotalamo-ipofisario per brevi periodi causa il parto nelle femmine di ratto e di coniglio gravide, ed è noto che il cosiddetto ‛parto pilotato' nella donna si basa sull'infusione endovenosa di ossitocina. Tuttavia si può avere il parto anche in assenza di ossitocina, e le immissioni periodiche di ossitocina nel sangue che si osservano nella donna in travaglio non hanno relazione temporanea con le contrazioni uterine, anche se aumentano notevolmente di numero durante il periodo espulsivo. La modalità di secrezione ossitocinica a ondate suggerisce che anche durante il parto vi sia un'attività dei neuroni ossitocinergici simile a quella osservata durante l'allattamento, ma i pochi dati sperimentali a disposizione fanno pensare invece a un aumento tonico dell'attività di questi neuroni. Lo stimolo per la secrezione di ossitocina durante il parto sarebbe la dilatazione della cervice uterina e della vagina; analogamente, la dilatazione della vagina durante il coito produrrebbe una secrezione di ossitocina utile alla fecondazione per aumentata motilità uterina e conseguente facilitazione del progresso degli spermatozoi verso la sede della fecondazione (riflesso di Ferguson). Nell'ipotalamo di varie specie sono presenti cellule che rispondono alla distensione vaginale, ma la loro relazione con la secrezione di ossitocina non è nota. D'altra parte questa secrezione si può avere durante l'estro anche per stimoli molteplici (visivi, olfattivi, acustici, ecc.), diversi dalla distensione vaginale, e la sua importanza per la fecondazione è in genere modesta o, in alcune specie come quella umana, addirittura pressoché nulla. Una secrezione di ossitocina durante il coito è stata osservata nei maschi di alcune specie, ed è stata accertata un'azione dell'ormone sulla contrattilità delle vescicole seminali, del deferente e dell'epididimo, ma sia l'importanza funzionale che i correlati nervosi di queste azioni ossitociniche nel maschio sono ignoti.
In analogia agli esperimenti sui meccanismi secretori dell'ossitocina, i neuroni vasopressinergici possono essere studiati in relazione alle attività fisiologiche della vasopressina: attività che riguardano la regolazione idrico-salina e la regolazione della pressione arteriosa (v. neuroendocrinologia). La sindrome del diabete insipido, classicamente attribuita da Verney (v., 1947) a lesioni ipotalamo-ipofisarie e alla mancanza della vasopressina, si osserva in tutti i suoi aspetti nel ceppo di ratti Brattleboro che, pur avendo un normale numero di neuroni nel sistema magnocellulare, sono incapaci di produrre vasopressina, presumibilmente per un'alterazione metabolica innata dei neuroni deputati a tale secrezione. Nell'animale normalmente idratato si ha una secrezione basale minima di vasopressina, che tuttavia ha una notevole influenza limitativa sulla diuresi. Tale secrezione può aumentare fino a 20 volte dopo una deprivazione d'acqua per tre giorni; aumenti simili si possono osservare a breve termine aumentando bruscamente l'osmolalità del plasma con iniezioni endovascolari o intraperitoneali di soluzioni ipertoniche di cloruro di sodio. La secrezione di vasopressina è quantitativamente correlata all'osmolalità del plasma, giustificando il concetto classico del ‛controllo osmometrico' della secrezione di questo ormone. I dati ottenuti nel ratto, che valgono in generale anche per l'uomo, dimostrano che la normale osmolalità del plasma (circa 294 mosm/kg) costituisce uno stimolo minimo per la secrezione di vasopressina, che cessa quando l'osmolalità plasmatica scende a 290-293 mosm/kg. Aumenti dell'osmolalità plasmatica al di sopra del valore normale producono aumenti strettamente proporzionali di secrezione di vasopressina, e la sensibilità del sistema è tale che anche una variazione pari all'10/0 dell'osmolalità del plasma è seguita da una modificazione significativa della concentrazione plasmatica di vasopressina nello stesso senso. Registrazioni dell'attività di neuroni identificati come sorgente di fibre del fascio ipotalamo-ipofisario dimostrano un aumento generale di attività in rapporto con l'aumento dell'osmolalità del plasma, ed è probabile che questi neuroni siano deputati alla secrezione di vasopressina. In condizioni normali di idratazione il 20-30% dei neuroni che proiettano al lobo posteriore dell'ipofisi mostrano un'attività fasica con salve di bassa frequenza. La deprivazione d'acqua o la somministrazione di soluzioni saline ipertoniche fanno aumentare questa attività sia rendendola continua, sia aumentando il numero delle salve e la frequenza entro la singola salve. L'azione dell'osmolalità del plasma su questi neuroni, presumibilmente vasopressinergici, è stata attribuita a osmocettori situati nel fegato, a osmocettori neuronici situati nella zona internucleare di Oreving posta fra i nuclei sopraottico e paraventricolare, a recettori intraventricolari per il sodio situati al di fuori della barriera emato-encefalica, e infine a un'influenza diretta sugli stessi neuroni secretori. Nessuna di queste ipotesi è accertata, ma la localizzazione encefalica del meccanismo di controllo sembra più probabile rispetto a quella extraencefalica per il fatto che l'iniezione di soluzioni ipertoniche nella carotide interna o nei ventricoli ha potenti effetti facilitanti sulla secrezione dell'ormone.
È noto che la vasopressina viene secreta anche in risposta a una riduzione del volume sanguigno e della pressione arteriosa; tale risposta è omeostatica, perché da una parte tende a controllare le perdite d'acqua con la riduzione della diuresi, e dall'altra ad aumentare la pressione arteriosa per incremento delle resistenze circolatorie periferiche. Questo ultimo effetto dipende dall'azione della vasopressina sui muscoli costrittori dei vasi a parete muscolare, e può essere coadiuvato da una simultanea secrezione di ossitocina. Il controllo volumetrico della secrezione vasopressinica è tuttavia assai meno fine di quello osmometrico. Un aumento significativo di secrezione di vasopressina si osserva solo dopo una riduzione del 10-15% del volume sanguigno e una forte caduta della pressione arteriosa. I recettori che inducono queste risposte sono i volumocettori situati nell'atrio sinistro del cuore e i barocettori arteriosi ‛classici'. L'occlusione delle carotidi comuni è uno stimolo potente per la secrezione di vasopressina. Possibili correlati neuronici della secrezione di vasopressina in risposta a stimoli volumetrici sono illustrati nella fig. 11. Neuroni identificati come appartenenti al nucleo sopraottico per attivazione antidromica da stimolazione del fascio ipotalamo-ipofisario, e la cui attività non è correlata con l'allattamento, mostrano un aumento dapprima tonico e poi fasico, con salve ad alta frequenza, in risposta a una diminuzione del volume sanguigno. L'attività a salve ad alta frequenza sarebbe caratteristica dei neuroni vasopressinergici, e una immissione continuata di ormone si avrebbe per desincronizzazione delle salve di neuroni diversi. Tuttavia, durante stimoli intensi, come la chiusura delle carotidi comuni, si potrebbe avere una sincronizzazione delle salve e quindi una liberazione per ‛ondate' della vasopressina, a somiglianza della secrezione di ossitocina.
Modificazioni dell'attività dei neuroni presumibilmente preposti alla secrezione di vasopressina si osservano anche in seguito a stimoli provenienti da recettori gustativi: l'acqua pura inibisce, e il cloruro di sodio aumenta, la scarica di questi neuroni, fornendo così un esempio di ‛anticipazione' della regolazione omeostatica. Aumenti di secrezione di vasopressina si verificano anche a seguito di stimoli algogeni, e si osservano anche fluttuazioni circadiane della secrezione di vasopressina, correlate con il ciclo sonno-veglia. Il significato fisiologico di questi effetti non è chiaro e la loro importanza per la neurosecrezione consiste principalmente nel fatto che essi dimostrano, al pari degli stimoli di molteplice natura che possono causare secrezione di ossitocina, un'ampia convergenza di influssi nervosi diversi sul sistema magnocellulare neurosecretore. Questa convergenza ha un corrispettivo anatomico nell'afflusso di connessioni da diverse parti dell'encefalo - sistema limbico, talamo, mesencefalo - ai nuclei sopraottico e paraventricolare. Come precedentemente ricordato, i neuroni secretori sono neuroni a tutti gli effetti, e quindi sono anche sottoposti a controllo sinaptico da parte di altri neuroni. Esperimenti di microionoforesi hanno indicato che la membrana delle cellule del sistema magnocellulare ha recettori sinaptici eccitatori (di tipo nicotinico) e inibitori (di tipo muscarinico) per l'acetilcolina, e recettori inibitori beta-adrenergici. La presenza di effetti di inibizione e facilitazione ricorrente a seguito della stimolazione antidromica del fascio ipotalamo-ipofisario (v. fig. 8) ha fatto pensare alla possibilità che in base al principio di Dale l'ossitocina e la vasopressina possano funzionare da trasmettitori sinaptici in questi circuiti ricorrenti (v. cap. 2, È f). Effetti eccitatori e inibitori possono essere osservati in neuroni del sistema magnocellulare a seguito dell'applicazione microionoforetica dei due ormoni; tuttavia questi effetti, al pari di quello eccitatorio per l'angiotensina Il, hanno in genere le caratteristiche attribuite agli effetti dei neuromodulatori (v. cap. 2, È c). Essi potrebbero comunque intervenire nel determinare le caratteristiche periodiche di risposta del sistema. Un'altra possibilità è che i neuroni del sistema magnocellulare producano, in aggiunta agli ormoni specifici, mediatori sinaptici come l'acetilcolina. Ciò è suggerito dalla presenza di vescicole ‛pallide' accanto ai granuli neurosecretori. In violazione al principio di Dale, questi neuroni potrebbero liberare ormoni al terminale neuritico a contatto con i capillari sanguigni e un mediatore sinaptico a livello delle collaterali ricorrenti. Un'altra possibilità che non infirmerebbe il principio di Dale, ma ne richiederebbe la modificazione, è la liberazione di più di una sostanza a livello di tutte le terminazioni principali e collaterali del neurite. Queste possibilità sono state esaminate da Burnstock (v., 1976) in relazione alla fisiologia generale dei neuroni; la loro applicazione allo studio dei neuroni secretori richiede ulteriori e specifiche conferme sperimentali. D'altra parte l'esistenza di proiezioni di neuroni ossitocinergici e vasopressinergici al di fuori del lobo posteriore dell'ipofisi, in altre zone del sistema nervoso centrale, unitamente alla dimostrazione della presenza dei due ormoni nel tessuto nervoso e nel liquor, indica che il destino di queste sostanze non è solo il torrente circolatorio. Il possibile significato funzionale di queste proiezioni verrà discusso più avanti.
b) Il sistema parvocellulare neurosecretore dell'ipotalamo.
Questo sistema è formato da un gran numero di neuroni di piccola taglia (diametro del pericario uguale o inferiore a 10 μ situati in una vasta area ipotalamica detta ipofisiotropica, che mandano i loro neuriti amielinici a terminare a contatto con i capillari del plesso primario formato nell'eminenza mediana dalle arterie ipofisarie superiore e inferiore. Da questo plesso nascono le vene portali ipofisarie lunghe e corte che si ricapillarizzano nel lobo anteriore e nel lobo intermedio dell'ipofisi (v. fig. 12). L'area ipofisiotropica è costituita da vari nuclei che si estendono anche al di fuori dei confini classicamente assegnati all'ipotalamo. Essa include il nucleo soprachiasmatico, l'area preottica, l'area periventricolare, il nucleo ventromediale e il nucleo arcuato (v. fig. 13). Come mostra la fig. 13, l'identificazione dei neuroni del sistema parvocellulare può avvenire, in analogia con gli esperimenti sul sistema magnocellulare, per attivazione antidromica da stimolazione elettrica dei neuriti che terminano nell'organo neuroemale costituito dell'eminenza mediana e che formano il fascio tubero-infundibolare. Tuttavia questa identificazione non è facile, perché vi è la possibilità di costimolare i neuriti del fascio ipotalamo-ipofisario del sistema magnocellulare. Il sistema parvocellulare secerne un numero non precisato di neurormoni dotati di attività endocrina di secondo grado, in quanto destinati al controllo della produzione di ormoni da parte dell'ipofisi anteriore e intermedia (v. neuroendocrinologia). L'identificazione chimica di tre di questi neurormoni, l'ormone che potenzia la secrezione delle gonadotropine ipofisarie (LHRH), l'ormone che potenzia la secrezione di tirotropina (TRH), e l'ormone che inibisce la secrezione dell'ormone della crescita (somatostatina) (v. Schally, 1978; v. Guillemin, 1978), ha permesso tentativi immunocitochimici di localizzazione dei neuroni che li producono. In tutti e tre i casi si tratta di ormoni oligopeptidici. La fig. 14 mostra la localizzazione dei neuroni che producono LHRH nella zona ipofisiotropica dell'ipotalamo dell'uomo. Anche altri ormoni del sistema parvocellulare, non tutti ben identificati chimicamente ma la cui esistenza è desunta da esperimenti fisiologici (v. neuroendocrinologia), sono di natura peptidica e possono includere la vasopressina, presente in neuroni parvocellulari del nucleo soprachiasmatico. Un neurormone del sistema parvocellulare di natura non peptidica potrebbe tuttavia essere la dopammina, che si ritiene possa funzionare come fattore inibente la secrezione di prolattina. I rapporti complessi, e ancora in gran parte ipotetici, fra neuroni peptidergici e dopamminergici del sistema parvocellulare nell'eminenza mediana sono illustrati nelle figg. 15 e 16, che mostrano anche il possibile ruolo di cellule ependimali nel funzionamento di questo organo neuroemale.
La incompleta conoscenza della localizzazione anatomica dei neuroni del sistema parvocellulare, la difficoltà di identificazione elettrofisiologica con la stimolazione elettrica dell'eminenza mediana, e la mancanza di strette relazioni temporali con eventi fisiologici o comportamentali specifici sono tutti fattori che hanno contribuito a rendere lo studio del sistema parvocellulare molto più arduo di quello del sistema magnocellulare. I fatti accertati sono: a) l'attività basale generalmente assai bassa o assente del sistema parvocellulare (l'80% dei neuroni identificati con la stimolazione antidromica possono non mostrare attività spontanea); b) la reattività di neuroni del sistema parvocellulare all'applicazione topica di neurormoni del sistema stesso, di ormoni adenoipofisari e di ormoni di ghiandole endocrine bersaglio dell'adenoipofisi (corteccia surrenale, tiroide, gonadi). Questi effetti potrebbero spiegare le azioni fisiologicamente riconosciute di feedback ultrabreve, breve e lungo; c) la possibilità da parte di stimoli periferici di varia natura di influenzare i neuroni del sistema parvocellulare tramite le proiezioni che da molte regioni del sistema nervoso centrale, soprattutto dal sistema limbico, e dall'amigdala in particolare, si portano all'area ipofisiotropica. Bisogna tuttavia precisare che sia la reattività agli ormoni applicati localmente, sia la reattività a diversi stimoli periferici non sono affatto specifiche dei neuroni del sistema parvocellulare, ma interessano un'ampia regione del sistema limbico e del tronco dell'encefalo. Il significato fisiologico di questi effetti non può quindi essere limitato al controllo diretto del sistema parvocellulare.
Proiezioni dal sistema parvocellulare si portano a varie aree del sistema nervoso (v. fig. 17), e pertanto i neurosecreti di questo sistema devono svolgere azioni sul sistema nervoso indipendenti dal controllo ipofisario. Queste azioni verranno descritte più avanti. Anche per il fascio tuberoinfundibolare si conosce l'esistenza di collaterali ricorrenti, la cui importanza funzionale è probabilmente analoga a quella del fascio ipotalamo-ipofisario.
5. Peptidi neurogeni e organizzazione dell'attività nervosa.
Negli ultimi decenni ha avuto grande importanza, sia per la medicina che per la biologia, la constatazione dell'esistenza di una relazione reciproca fra il sistema nervoso e le ghiandole endocrine. Alla scoperta delle attività endocrine di primo e di secondo grado del sistema nervoso ha fatto riscontro la dimostrazione di molteplici influenze esercitate da ormoni di ghiandole endocrine, quali le gonadi, la tiroide, la corteccia surrenale, sullo sviluppo, la maturazione e l'organizzazione generale del sistema nervoso (v. neuroendocrinologia). Più recentemente è stato osservato che anche ormoni dell'ipofisi anteriore e dell'ipofisi intermedia (o loro derivati) possono agire sul sistema nervoso centrale con un meccanismo che è totalmente indipendente dalle azioni di questi ormoni sulle ghiandole endocrine periferiche. Infatti queste azioni neurotrope di principi ghiandolari ipofisari sono presenti anche dopo estirpazione delle ghiandole endocrine bersaglio dell'ipofisi, non sono riprodotte dalla somministrazione degli ormoni di queste ghiandole, e sono invece riprodotte dalla somministrazione di frammenti molecolari di ormoni ipofisari anteriori e intermedi privi delle attività endocrine periferiche dell'intera molecola. Quasi certamente le sostanze prodotte nell'ipofisi ghiandolare svolgono le loro influenze neurotrope raggiungendo i neuroni bersaglio per vie diverse da quella ematica, e pertanto è giustificato definirle, in queste funzioni, come neuromodulatori anziché come ormoni. Meccanismi e azioni di questa natura riguardano la neurosecrezione, secondo la nostra definizione, quando le sostanze attive sono prodotte non dalle ghiandole endocrine ma da neuroni: in altre parole quando i neuromodulatori sono di origine neurogena.
a) Peptidi neurogeni e comportamento.
Abbiamo già visto come le sostanze prodotte dai sistemi secretori magnocellulare e parvocellulare dell'ipotalamo possano essere liberate nel liquor cerebrospinale e nel tessuto nervoso anziché nel sangue. Abbiamo visto anche come l'applicazione locale di queste sostanze al tessuto nervoso modifichi l'attività elettrica di neuroni in aree ipotalamiche ed extraipotalamiche. Inoltre, la reattività del sistema nervoso a farmaci o a trasmettitori sinaptici può essere modificata dalla simultanea somministrazione di sostanze prodotte dal sistema secretore magnocellulare o da quello parvocellulare (v. Vale e altri, 1977). Tutti questi effetti indicano che l'attività neuronica può essere influenzata da queste sostanze prodotte da neuroni secretori; essi suggeriscono anche modalità d'azione che sono diverse da quelle dei trasmettitori sinaptici e sono simili, invece, per lentezza d'insorgenza e lunga durata, a quelle degli ormoni neurotropi non neurogeni. Le informazioni più interessanti sull'azione neuromodulatrice di neurosecreti liberati nel tessuto nervoso stesso provengono tuttavia non dallo studio diretto dell'attività dei neuroni, ma dall'esame delle modificazioni del comportamento che conseguono alla mancanza o alla somministrazione esogena di queste sostanze. Alcune osservazioni comportamentali suggeriscono che l'organizzazione dell'attività nervosa includa, in aggiunta ai ben stabiliti principi di connessione sinaptica fra i neuroni e di relazioni reciproche fra sistema nervoso e ghiandole endocrine, anche un'autoregolazione umorale neurosecretoria del tessuto nervoso stesso.
b) Vasopressina, ossitocina e memoria.
De Wied e collaboratori (v. De Wied e Bohus, 1978) hanno dimostrato la comparsa di disturbi dell'apprendimento e della memoria in ratti sottoposti a ipofisectomia totale. I disturbi non dipendono da conseguenze endocrine e generali somatiche dell'operazione, ma sono invece riconducibili alla mancanza di un'azione neurotropa diretta di sostanze secrete dall'ipofisi anteriore (ACTH) e intermedia (MSH, ormone stimolante i melanociti) e della vasopressina, o di loro derivati.
È stato dimostrato che ratti del ceppo Brattleboro, che mancano della capacità di sintetizzare la vasopressina, hanno difetti di apprendimento e di memoria, e che questi difetti possono in parte essere corretti con la somministrazione di vasopressina, o anche di molecole simili alla vasopressina, che tuttavia non ne posseggono gli effetti endocrini antidiuretici. L'asportazione totale dell'ipofisi in ratti normali ha, come abbiamo visto, conseguenze negative per la capacità di apprendere e ricordare. La somministrazione di vasopressina migliora le capacità di questi animali soprattutto per quanto riguarda la resistenza all'estinzione di risposte apprese di evitazione attiva o passiva (v. memoria: studi sperimentali). La somministrazione intraventricolare di siero antivasopressina in ratti normali ne deteriora specificamente le capacità mnemoniche, soprattutto in compiti nei quali queste capacità vengono misurate in termini di resistenza all'estinzione. La vasopressina ‛protegge' anche il cervello del ratto dagli effetti amnesici dell'elettroshock o di altre tecniche che aboliscono temporaneamente l'attività normale cerebrale. Infatti, i fenomeni amnesici da elettroshock in ratti pretrattati con vasopressina sono minori di quelli di ratti controllo non trattati con vasopressina. Gli effetti favorevoli della vasopressina sulla memoria durano anche per ore dopo la somministrazione della sostanza, e hanno quindi le caratteristiche di azioni prodotte da un neuromodulatore. Risultati ancora preliminari fanno pensare a un'azione antagonista dell'ossitocina rispetto alla vasopressina sulla memoria. In conclusione, è probabile che i principi del sistema magnocellulare dell'ipotalamo con attività endocrina intervengano anche direttamente, o in quanto precursori di molecole attive, in organizzazioni complesse del sistema nervoso necessarie per l'acquisizione e il mantenimento di comportamenti appresi. Queste azioni neuromodulatrici complesse della vasopressina e dell'ossitocina, diverse e indipendenti dai loro effetti endocrini, hanno presumibilmente il loro luogo di azione nel sistema limbico e possono attuarsi tramite l'interazione con altri sistemi di neurotrasmettitori e neuromodulatori. Le informazioni su questi aspetti del meccanismo di azione dei secreti del sistema magnocellulare sono peraltro ancora del tutto insufficienti per un'analisi neuroanatomica e neurofisiologica. Tuttavia, la presenza normale di vasopressina e di ossitocina nel liquor cerebrospinale, e la capacità di tali sostanze di influenzare il comportamento e l'attività dei neuroni quando sono iniettate nei ventricoli cerebrali, sono importanti indicazioni di una loro attività paracrina.
c) Comportamento sessuale e peptidi del sistema parvocellulare ipotalamico.
I peptidi del sistema parvocellulare ipotalamico con funzione endocrina, regolatrice dell'ipofisi anteriore e intermedia, esercitano influenze dirette sull'attività nervosa. Ciò è dimostrato da esperimenti elettrofisiologici nei quali queste sostanze vengono iniettate a contatto con neuroni di cui si registra l'attività, e da studi di risposte fisiologiche e comportamentali all'azione di farmaci somministrati da soli o in combinazione con i peptidi del sistema parvocellulare. Anche se è accertato che tutti questi peptidi possono influenzare l'attività nervosa direttamente e indipendentemente dai loro effetti endocrini sull'ipofisi e su altre ghiandole, solo per il neurormone del sistema parvocellulare che potenzia la secrezione di gonadotropine ipofisarie (LHRH) è nota un'attività neuromodulatrice complessa sul comportamento. Questa sostanza può indurre comportamenti sessuali (lordosi, accoppiamento) nella femmina di ratto ipofisectomizzata e ovariectomizzata, pretrattata con estrogeni. L'azione dell'LHRH sul comportamento non dipende quindi da effetti gonadotropici ipofisari sull'ovaio, né richiede la presenza della corteccia surrenale, perché avviene anche dopo surrenectomia. Queste osservazioni sono importanti, perché è noto che gli ormoni steroidi gonadici e corticosurrenalici possono agire sull'encefalo inducendo comportamenti sessuali analoghi. L'LHRH influenza quindi il comportamento sessuale indipendentemente dall'azione degli ormoni steroidi, e con un'azione diretta sul tessuto nervoso, come dimostrato dalla presenza di effetti sul comportamento sessuale quando la sostanza viene iniettata direttamente a contatto con le aree sensitive dell'ipotalamo (area preottica mediale e nucleo arcuato). Questi effetti hanno una lunga latenza (1 ora dall'iniezione ipotalamica), in accordo con l'ipotesi di un'azione neuromodulatrice. In condizioni fisiologiche, la secrezione di LHRH da parte del sistema parvocellulare sarebbe quindi caratterizzata da effetti convergenti della componente neuroendocrina, che influenza il comportamento sessuale tramite le gonadotropine e gli ormoni sessuali, e della componente neuromodulatrice, che agisce direttamente sui substrati nervosi dello stesso comportamento. Questa convergenza è resa possibile dalla simultanea secrezione endocrina (nei vasi portali ipofisari) e paracrina (nel liquor o nel liquido extracellulare del tessuto nervoso) dell'LHRH da parte del sistema parvocellulare (v. Barker, 1977).
d) Angiotensina e sete.
L'angiotensina II è un ormone octapeptidico di grande importanza fisiologica per la regolazione del bilancio idricosalino e della pressione arteriosa (v. acqua e vita; v. endocrinologia; v. ormoni nei vertebrati; v. ipertensione arteriosa). Questo ormone si forma nel sangue per azione dell'ormone renale renina su una globulina circolante, l'angiotensinogeno. Da questa si distacca un decapeptide, l'angiotensina I, che viene successivamente trasformato in angiotensina II da un enzima convertente concentrato nel piccolo circolo. Le principali attività fisiologiche esercitate dall'angiotensina II sono: a) aumento della pressione arteriosa dovuto sia a una potente vasocostrizione, sia ad un'attivazione della midollare surrenale; b) aumento di ritenzione idrica e sodica da parte del rene, dovuto a stimolazione della secrezione degli ormoni aldosterone e vasopressina; c) aumento dell'assorbimento idrico intestinale. A queste attività fisiologiche ‛pure' si aggiunge un effetto comportamentale dell'angiotensina Il che le coadiuva. L'angiotensina II è il più potente agente dipsogeno (generatore di sete) che si conosca, e aumenta inoltre l'appetito specifico per sostanze contenenti sodio. Sotto l'azione dell'angiotensina II, l'organismo animale tende a bere di più e a introdurre più sali di sodio con gli alimenti. Tutte queste attività fisiologiche e comportamentali dell'angiotensina II hanno come conseguenza un aumento del volume sanguigno, ed è infatti l'ipovolemia, quale si ha ad esempio dopo un'emorragia, ad aumentare la renina circolante e quindi la produzione di angiotensina II, con conseguenti effetti omeostatici. L'aumento della produzione di vasopressina, la sete e l'appetito specifico per i sali di sodio dipendono da un'azione diretta dell'angiotensina II sul sistema nervoso centrale.
L'iniezione di quantità minime (picomoli) di angiotensina II nell'ipotalamo anteriore, nella regione preottica e nel setto spinge ratti normalmente idratati a bere. Dosi un po' maggiori sono richieste per l'azione sulla vasopressina e sull'aumento della fame specifica per il sodio; inoltre, mentre l'insorgenza della sete si manifesta un minuto o poco più dopo l'iniezione, l'insorgenza dell'appetito per il sodio richiede circa mezz'ora. Nel ratto l'infusione prolungata intracerebrale di angiotensina durante vari giorni provoca un aumento stabile dell'ingestione di acqua e di sodio. Gli animali così stimolati bevono anche una soluzione di cloruro di sodio al 2,7%, che è disgustosa per il ratto non trattato. Anche nella capra l'iniezione intraventricolare di angiotensina II produce tendenza a bere, ma questa tendenza non si manifesta se l'animale è preidratato; in questo caso la sete compare solo se si associa all'infusione di angiotensina II una soluzione ipertonica di cloruro di sodio. L'azione dipsogena dell'angiotensina II è stata osservata in molte altre specie di Mammiferi e anche negli Uccelli. Gli effetti sulla sete e sulla secrezione di vasopressina possono essere prodotti anche dalla somministrazione endovenosa o endoarteriosa di angiotensina II. Dato che è improbabile che l'angiotensina II superi la barriera ematoencefalica, si ritiene che gli effetti dell'ormone circolante sul sistema nervoso avvengano tramite neuroni situati al di fuori della barriera. Gli organi circumventricolari (v. fig. 18) rispondono a questo requisito, ed è perciò assai importante la dimostrazione che l'angiotensina II è fortemente dipsogena quando è iniettata nell'organo vascolare della lamina terminale o nell'organo subfornicale.
Tutti gli effetti dell'angiotensina II fin qui descritti fanno parte del capitolo della neuroendocrinologia. Essi riguardano tuttavia anche la neurosecrezione quando si considera che il sistema nervoso centrale possiede per intero il sistema enzimatico e i substrati che portano alla formazione di angiotensina II. Le prove dell'esistenza di un sistema renina-angiotensina encefalico, in aggiunta a quello renale-plasmatico, sono: a) la dimostrazione immunoistochimica della presenza di angiotensina II nel tessuto nervoso, che non è modificata dalla nefrectomia bilaterale; b) l'osservazione che l'iniezione intracerebrale di renina produce gli stessi effetti dell'iniezione di angiotensina Il, ma con una latenza riconducibile ai tempi della produzione enzimatica della seconda sostanza da parte della prima; questa produzione per necessità deve avvenire a opera di enzimi presenti nel tessuto nervoso; c) la constatazione che il tessuto cerebrale stesso produce renina. I due sistemi renina-angiotensina II, il renale-plasmatico e l'encefalico, potrebbero essere attivati dagli stessi stimoli, cioè dalla disidratazione e dalla conseguente ipovolemia; tuttavia, mentre conosciamo i meccanismi dell'azione di questo stimolo a livello renale, mancano dati sull'azione cerebrale. È però possibile postulare che l'angiotensina II, sia essa di origine cerebrale o di origine renale-plasmatica, eserciti le sue azioni neurotrope sia entro che fuori la barriera ematoencefalica. Gli organi circumventricolari sarebbero responsabili dell'azione al di fuori della barriera, mentre l'eminenza mediana e l'area ipotalamica anteriore medierebbero l'azione entro la barriera. L'ipotesi che l'angiotensina II circolante (ormone) causi le influenze extrabarriera e quella neurogena (neuromodulatore) causi le influenze intrabarriera è suggestiva, ma è possibile anche una sovrapposizione di azioni, data l'osservazione di angiotensina II nei taniciti dell'ependima degli organi circumventricolari. Questi taniciti potrebbero trasportare l'angiotensina II plasmatica entro la barriera ematoencefalica, e l'angiotensina II neurogena al sangue dei capillari. In ogni caso, è chiaro che l'encefalo possiede un suo sistema neurosecretore per il controllo endocrino, tramite la vasopressina, e comportamentale, tramite la regolazione del comportamento di ingestione alimentare, del bilancio idrico-salino. L'angiotensina II cerebrale sarebbe la sostanza neuromodulatrice responsabile sia dell'attivazione del sistema magnocellulare vasopressinergico, sia dell'innesco dei complessi meccanismi neuronici preposti a comportamenti alimentari per l'assunzione di acqua e di sodio. L'applicazione diretta di angiotensina II ai neuroni vasopressinergici ne produce l'attivazione con modalità di tipo neuromodulatorio. È tuttavia importante ricordare che ricerche immunocitologiche hanno permesso di dimostrare la presenza di angiotensina II anche nel midollo spinale (sostanza gelatinosa) e nel sistema nervoso periferico (catena laterale del simpatico). Ciò può suggerire la partecipazione di questa sostanza ad altre attività nervose, possibilmente anche come neurotrasmettitore sinaptico (v. Barker, 1977; v. Fitzsimons, 1978).
e) Peptidi neurogeni e dolore.
L'undecapeptide Sostanza P, prodotto da varie cellule nel sistema nervoso periferico e centrale, è stato considerato sia come una delle possibili sostanze algogene periferiche, sia come un neurotrasmettitore nelle vie centrali del dolore (v. somatoestesia). Ricerche recenti, descritte in dettaglio da Barker (v., 1977), fanno pensare a una funzione molto più estesa della Sostanza P, che si potrebbe considerare un neuromodulatore che agisce sia a livello delle afferenze primarie di senso al midollo spinale, sia a livello della membrana di interneuroni o motoneuroni spinali. La possibile associazione della Sostanza P con i sistemi nocicettivi resta tuttavia un'ipotesi assai suggestiva, anche sulla base della recente osservazione di un'ampia coincidenza fra le regioni del sistema nervoso nelle quali è presente la Sostanza P e quelle in cui si ritrovano recettori membranari per gli oppiacei. Come è noto, i recettori membranari che legano specificamente i farmaci antidolore oppiacei sono presumibilmente deputati, nel funzionamento fisiologico del sistema nervoso centrale, a interagire con le cosiddette ‛morfine naturali' del cervello, cioè con le endorfine e le encefaline (v. neuroendocrinologia; v. somatoestesia). Questi peptidi sembrano derivare tutti da una proteina presente nell'ipofisi anteriore e intermedia, la β-lipotropina, che si considera un precursore degli ormoni ACTH ed MSH. Questa sostanza è stata ritrovata di recente anche in cellule dell'ipotalamo (v. Miller, 1978). Le endorfine e le encefaline, legandosi ai recettori per gli oppiacei, potrebbero esercitare un controllo naturale sulle vie del dolore, particolarmente a livello della sostanza grigia periventricolare e della sostanza gelatinosa spinale. In questa funzione di controllo si potrebbero avere interazioni o interferenze con le azioni della Sostanza P. È probabile comunque che anche le endorfine abbiano funzioni al di fuori della sfera del dolore, e che possano influenzare l'intera reattività dell'organismo al mondo esterno (v. Guillemin, 1978). La lenta insorgenza e la lunga durata delle azioni sia della Sostanza P che delle ‛morfine naturali' fa comunque pensare che questi agenti siano da classificare come neuromodulatori piuttosto che come trasmettitori sinaptici, giustificando così la loro inclusione fra i materiali neurosecretori.
f) Altri peptidi come possibili neuromodulatori.
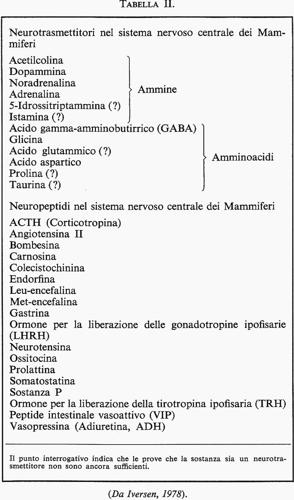
La tab. II elenca vari peptidi la cui presenza nel tessuto nervoso e la cui origine neurogena sono state documentate con metodi immunoistochimici e immunocitologici. Per alcuni di questi peptidi sono state ricordate più sopra possibili attività fisiologiche e comportamentali, mentre per altri le azioni neurotrope sono del tutto sconosciute. È interessante notare che alcuni di questi peptidi sono identici chimicamente a ormoni che regolano la motilità e le secrezioni nell'apparato gastrointestinale (gastrina, colecistochinina, peptide intestinale vasoattivo). D'altra parte la Sostanza P, le encefaline, la somatostatina, che abbiamo visto far parte dei neuropeptidi prodotti dall'encefalo, possono essere isolate anche dall'intestino. È possibile che questi peptidi, così come gli ormoni gastrointestinali, siano prodotti nell'apparato digerente da cellule nervose appartenenti ai plessi nervosi intramurali del canale alimentare, oppure da cellule endocrine di origine neuroblastica. Pearse e Takor (v., 1976) hanno suggerito l'ipotesi che tutte le cellule secernenti peptidi abbiano in realtà una derivazione neuroectodermica, incluse le cellule dell'adenoipofisi che non proverrebbe, come si sostiene generalmente, dallo stomodeo, ma avrebbe un'origine in comune con l'ipotalamo (v. anche Guillemin, 1978). Secondo questa concezione i neuropeptidi sarebbero pertanto sostanze utilizzate dal sistema nervoso per scopi diversi a seconda della localizzazione: ad esempio, la somatostatina inibisce la secrezione endocrina pancreatica e la secrezione di gastrina quando è liberata a livello del canale alimentare, mentre inibisce la secrezione ipofisaria dell'ormone della crescita quando è liberata a livello ipotalamico. Questa ipotesi è attraente sia perché spiega la presenza degli stessi peptidi in organi così diversi come il cervello e i visceri addominali, sia perché è in accordo con la cosiddetta legge dell'economia della natura; essa tuttavia deve ancora essere confermata. Se si dimostrasse al di là di ogni dubbio che tutte le cellule peptidergiche hanno origine neuroblastica, si potrebbe riscontrare un'analogia fra cellule endocrine peptidiche e neuroni peptidergici da una parte, e cellule endocrine nella midollare surrenale e neuroni adrenergici o noradrenergici dall'altra. In entrambi i casi le stesse sostanze neurogene - peptidi in un caso, catecolammine nell'altro - possono funzionare sia come ormoni, sia come trasmettitori sinaptici, sia come neuromodulatori, nel sistema nervoso centrale, nel sistema nervoso periferico e in organi non nervosi. Altre possibili azioni peptidergiche di natura neurosecretoria interessano la fisiologia del sonno e dell'apprendimento. Pappenheimer (v., 1976) ha descritto l'insorgenza di sonno fisiologico in animali per iniezione endoventricolare di peptidi isolati dal liquor di altri animali deprivati di sonno. Ungar (v., 1973), fra altri autori, ha sostenuto che informazioni acquisite con l'apprendimento possono essere codificate in forma di peptidi specifici, la cui iniezione in altri animali provoca il trasferimento del comportamento appreso. Queste esperienze hanno destato molto interesse ma anche molto scetticismo, e al momento attuale è giustificato esprimere varie riserve sul loro significato. Qualora esse dovessero essere confermate, l'importanza della neurosecrezione nell'organizzazione cerebrale assumerebbe ancora maggior rilievo.
g) Sostanze non peptidiche, neurosecrezione e comporta- mento.
In accordo con la definizione qui adottata, tutti i processi nervosi basati su azioni neuromodulatrici da parte di sostanze neurogene rientrano nella neurosecrezione. Abbiamo avuto modo di vedere nella tab. I che è possibile tentare una distinzione fra azioni di neuromodulatori e neurormoni da una parte, e neurotrasmettitori dall'altra. Sostanze che hanno certamente una funzione neurotrasmettitrice a livello di alcune sinapsi centrali e periferiche potrebbero essere attive come neuromodulatori nelle stesse o in altre aree del tessuto nervoso. Alcune teorie moderne della motivazione e della regolazione dell'umore sono basate sul concetto dell'azione diffusa, neuromodulatrice, di ammine biogene sulla corteccia cerebrale e sul sistema limbico, e a squilibri in questa regolazione vengono attribuiti i sintomi di stati patologici mentali come la schizofrenia, la mania o le sindromi depressive (v. Kety, 1970). Anche i processi di crescita, migrazione e differenziazione dei neuroni che avvengono durante l'ontogenesi del sistema nervoso possono essere sottoposti a controlli ‛trofici' da parte di ammine biogene che certamente non sono riconducibili ad azioni di trasmissione sinaptica (v. Lewis, 1978). È noto d'altra parte che, anche quando agiscono come trasmettitori sinaptici, l'adrenalina e la noradrenalina esercitano influenze sul metabolismo della cellula postsinaptica che sono diverse dagli effetti tipicamente sinaptici sulla permeabilità della membrana agli ioni, e si svolgono durante periodi di tempo assai più lunghi dei fenomeni puramente sinaptici (v. Nathanson e Greengard, 1977). Le azioni sul comportamento generale delle ammine biogene sono basate su meccanismi in gran parte sconosciuti, e gli effetti metabolici dei trasmettitori sinaptici amminergici sulle cellule postsinaptiche non hanno ancora un posto preciso nel quadro dell'attività nervosa. La conoscenza di questi dati ci permette tuttavia di riconoscere che la distinzione fra neurotrasmettitori e neuromodulatori non è assoluta, e potrebbe non essere più giustificata a mano a mano che si chiariscono le modalità di azione delle sostanze neurotrope.
6. Conclusioni.
Da tutta l'esposizione precedente risulta come il funzionamento del sistema nervoso includa processi basati sulla liberazione di sostanze secrete da neuroni che non si comportano come i trasmettitori sinaptici classici. In alcuni casi queste sostanze sono classificabili a tutti gli effetti come ormoni, e la loro azione può essere neurotropa o avere come bersaglio tessuti non nervosi. In altri casi, tuttavia, l'attività di queste sostanze si esplica senza passaggio nel circolo sanguigno, ma l'interazione con le cellule bersaglio può avvenire ugualmente in maniera assai diffusa e anche a distanza dal luogo di secrezione. L'azione diffusa di sostanze umorali non neurogene sul tessuto nervoso - si consideri ad esempio l'importanza del cosiddetto Nerve Growth Factor (v. Levi-Montalcini, 1975; v. neurogenesi) per lo sviluppo del sistema simpatico, degli ormoni tiroidei per la maturazione del sistema nervoso centrale, degli ormoni gonadici per il comportamento sessuale - era da tempo riconosciuta. La teoria prevalente dell'organizzazione nervosa è tuttavia ancor'oggi quella connessionistica, solidamente basata su una massa impressionante di dati anatomici e fisiologici che dimostrano un piano ordinato di relazioni sinaptiche specifiche fra neuroni di uno stesso centro o di centri diversi. Dai tempi di Ramón y Cajal e Sherrington a oggi, questa teoria è stata il fondamento di spiegazioni straordinariamente efficaci di fatti della fisiologia del sistema nervoso e del comportamento, e non c'è dubbio che essa è ancora paradigmatica per la stragrande maggioranza di coloro che lavorano nei vari campi delle neuroscienze. Tuttavia, il riconoscimento dell'esistenza di processi di neurosecrezione che portano ad azioni umorali neurotrope diffuse ci obbliga a considerare la possibilità che l'elaborazione dell'informazione nel sistema nervoso non avvenga solamente grazie alle relazioni sinaptiche ordinatamente distribuite nella trama dei circuiti neuronici. Spetta agli studi futuri sulla neurosecrezione e sulla neurochimica cerebrale la valutazione dell'importanza di altri meccanismi di funzionamento nervoso rispetto all'organizzazione dei neuroni in circuiti ‛classici'. È in questo senso che la ricerca sulla neurosecrezione può essere, come si è detto nel cap. 1, veramente rivoluzionaria.
Bibliografia.
Adiyodi, K. G., Bern, H. A., Neuronal appearance of neurosecretory cells in the pars intercerebralis of Periplaneta americana, in ‟General and comparative endocrinology", 1968, XI, pp. 88-91.
Bargmann, W., Übe die neurosekretorische Verknüpfung von Hypothalamus und Neurohypophyse, in ‟Zeitschrift für Zellforschung und mikroskopische Anatomie", 1949, XXXIV, pp. 610-634.
Bargmann, W., Hänstrom, B., scharre, B., Scharrer, E. (a cura di), Zeites Internationales Symposium über Neurosekretion, Berlin 1958.
Bargmann, W., Oksche, A., Polenov, A., Scharre, b. (a cura di), Neurosecretion and neuroendocrine activity, Berlin 1978.
Bargmann, W., Scharre, B. (a cura di), Aspects of neuroendocrinology, Berlin 1970.
Barker, J. L., Physiological roles of peptides in the nervous system, in Peptides in neurobiolgy (a cura di H. Gaine), New York 1977, pp. 295-343.
Burnstock, G., Do some nerve cells release more than one transmitter?, in ‟Neuroscience", 1976, I, pp. 239-248.
Cooke, I. M., Electrical activity of neurosecretory terminals and control of peptide hormone release, in Peptides in neurobiology (a cura di H. Gainer), New Yok 1977, pp. 345-374.
Cross, B. A., Dybell, R.E.J., Dyer, R.G., Jones, C. W., Lincoln, D. W., Morris, J. F., Pickering, B. T., Endocrine neurons, in Recent progress in hormone research (a cura di G. Pincus), vol. XXXI, New York 1975, pp. 234-286.
Cross, B. A., Wakerley, J. B., The neurohypophysis, in International review of physiology (a cura di S. M. McCann), vol. XVI, Baltimore 1977, pp. 1-34.
Dale, H.A., Pharmacology and nerve endings, in ‟Proceedings of the Royal Society for Medicine", 1935, XXVIII, pp. 319-332.
De Wied, D., Bohus, B., The modulation of memory pocesses by vasotocin, the evolutionarily oldest neurosecretory principle, in Progress in brain research (a cura di M. A. Corner, R.E. Baker, N.E. Van de Poll, D. F., Swaab e H.B.M. Uylings), vol. XLVIII, Amsterdam 1978, pp. 327-334.
Fitzismons, J. T., Angiotensin and thirst, in ‟Trends in neurosciences", 1978, I, pp. 70-72.
Gabe, M., Neurosecrétion, Paris 1967.
Gainer, H. (a cura di), Peptides in neurobiology, New York 1977.
Gainer, H., Peng Loh, Y., Sarne Y., Biosynthesis of neuronal peptides, in Peptides in neurobiology (a cura di H. Gainer), New York 1977, pp. 183-219.
Guillemin, R., Biochemical and physiological correlates of hypothalamic peptides. The new endocrinology of the neuon, in The hypothalamus (a cura di S. Reichlin, R. J. Baldessarini e J. B. Martin), New York 1978, pp. 155-194.
Hayward, J. N., Functional and morphological aspects of hypothalamic neurons, in ‟Physiological reviews", 1977, LVII, pp. 574-658.
Heller, H., Clark, R. B. (a cura di), Neurosecretion, London 1962.
Hökfelt, T., Elde, R., Fuxe, K., Johansson, O., Ljungdahl, A., Goldstein, M., Luft, R., Efendic, S., Nilsson, G., Terenius, L., Ganten, D., Jeffcoate, S. L., Rehfeld, J., Said, S., Perez de la Mora, M., Possani, L., Tapia, R., Teran, L., Palacios, R., Aminergic and peptidergic pathways in the nervous system with special reference to the hypothalamus, in The hypothalamus (a cura di S. Reichlin, R. J. Baldessarini e J. B. Martin), New York 1978, pp. 69-135.
Iversen, L.L., Chemical messengers in the brain, in ‟Trends in neurosciences", 1978, I, pp. 15-16.
Jackson, I. M. D., Extrahypothalamic and phylogenetic distribution of hypothalamic peptides, in The hypothalamus (a cura di S. Reichlin, R. J. Baldessrini e J. B. Martin), New York 1978, pp. 217-231.
Kety, S. S., The biogenic amines in the central nervous system: their possible roles in emotion, arousal and learning, in The neurosciences: second study program (a cura di F. O. Schmitt, G. C. Quarton, T. Melnechuk e G. Adelman), New York 1970, pp. 324-336.
Knowles, F., Endocrine activity in the central nervous system, in Essays on the nervous system. A Festschrift for Professor J.Z. Young (a cura di R. Bellairs e E. G. Gray), Oxfod 1974, pp. 431-450.
Knowles, F., Vollrath, L. (a cura di), Neuosecretion. The final neuroendocrine pathway, Berlin 1974.
Kuhn, T. S., The structure of scientific revolutions, Chicago 1962 (tr. it.: La struttura delle rivoluzioni scientifiche, Torino 1969).
Levi-Montalcini, R., NGF: an uncharted route, in The neurosciences. Paths of discovey (a cura di F. G. Worden, J. P. Swazey e G. Adelman), Cambridge, Mass., 1975, pp. 245-265.
Lewis, P.D., Neurohumoal influences on cell proliferation in brain development, in ‟Tends in neurosciences", 1978, I, pp. 158-159.
Lincoln, D. W., Dynamics of oxytocin secretion, in Neurosecretion. The final neuroendocrine pathway (a cura di F. Knowles e L. Vollrath), Berlin 1974, pp. 129-133.
McKelvy, J. F., Epelbaum, J., Biosynthesis, packaging, transport and release of brain peptides, in The hypothalamus (a cura di S. Reichlin, R. J. Baldessarini e J. B. Martin), New York 1978, pp. 195-211.
Mason, C. A., Bern, H. A., Cellular biology of the neurosecretory neuron, in Handbook of physiology. Section I: Neurophysiology (a cura di J. M. Brookhart e V. B. Mountcastle), vol. I, Bethesda 1977, pp. 651-689.
Miller, R. J., Enkefalin: a peptide with morphine-like properties, in ‟Trends in neurosciences", 1978, I, pp. 29-31.
Nathanson, J. A., Greengard, P., ‛Second messengers' in the brain, in ‟Scientific American", 1977, CCXXXVII, 2, pp. 108-119.
Oksche, A., Oehmke, H. J., Hortwig, H. G., A concept of neuroendocrine cell complexes, in Neurosecretion. The final neuroendocrine pathway (a cura di F. Knowles e L. Vollrath), Berlin 1974, pp. 154-164.
Pappenheimer, J. R., The sleep factor, in ‟Scientific American", 1976, CCXXXV, 2, pp. 24-29.
Pearse, A. G. E., Takor, T., Neuroendocrine embryology and the apud concept, in ‟Clinical endocrinology", 1976, V, suppl., pp. 229-244.
Pettigrew, J. D., The locus coeruleus and cortical plasticity, in ‟Trends in neurosciences", 1978, I, pp. 73-74.
Reichlin, S., Introduction, in The hypothalamus (a cura di S. Reichlin, R. J. Baldessarini e J. B. Martin), New York 1978, pp. 1-14.
Reichlin, S., Baldessarini, R. J., Martin, J. B. (a cura di), The hypothalamus, New York 1978.
Renaud, L. P., Neurophysiological organization of the endocrine hypothalamus, in The hypothalamus (a cura di S. Reichlin, R. J. Baldessarini e J. B. Martin), New York 1978, pp. 269-301.
Richard, Ph., Freund-Mercier, M. J., Moos, F., Les neurones hypothalamiques ayant une fonction endocrine. Identification, localisation, caractéristiques électrophysiologiques et contrôle hormonal, in ‟Journal de physiologie", 1978, LXXIV, pp. 61-112.
Rodriguez, E.M., The cerebrospinal fluid as a pathway in neuroendocrine integration, in ‟Journal of endocrinology", 1976, LXXI, pp. 407-443.
Schally, A. V., Aspects of hypothalamic regulation of the pituitary gland, in ‟Science", 1978, CCII, pp. 18-28.
Scharrer, B., The concept of neurosecretion and its place in neurobiology, in The neurosciences. Paths of discovery (a cura di F. G. Woden, J. P. Swazey e G. Adelman), Cambridge, Mass., 1975, pp. 231-243.
Scharrer, E., Die Lichtempfindlichkeit blinder Elritzen (Untersuchungen über das Zwischenhirn der Fische). I., in ‟Zeitschrift für vergleichende Physiologie", 1928, VII, pp. 1-38.
Scharrer, E. e altri, Convegno sulla neurosecrezione. Riassunti, in ‟Pubblicazioni della Stazione Zoologica di Napoli", 1954, XXIV, suppl., pp. 1-98.
Stutinsky, F. (a cura di), Neurosecretion, Berlin 1967.
Swazey, J. P., Worden, F. G., On the nature of research in neuroscience, in The neurosciences. Paths of discovery a cura di F. G. Worden, J. P. Swazey e G. Adelman), Cambridge, Mass., 1975, pp. 569-587.
Ungar, G., The problem of molecular coding of neural information, in ‟Naturwissenschaften", 1973, LX, pp. 307---312.
Vale, W., Rivier, C., Brown, M., Regulatory peptides of the hypothalamus, in ‟Annual review of physiology", 1977, XXXIX, pp. 473-527.
Verney, E. B., The antidiuretic hormone and the factors which determine its release, in ‟Proceedings of the Royal Society" (Series B), 1947, CXXXV, pp. 25-106.
Weindl, A., Neuroendocrine aspects of circumventricular organs, in Frontiers in neuroendocrinology (a cura di W. F. Ganong e L. Martini), New York 1973, pp. 3-32.