ORIGINI DELLA VITA
Origini della vita
Le origini della vita non sono note. Le più recenti scoperte della chimica organica, della biologia molecolare e, soprattutto, i dati forniti dall’esplorazione dello spazio extraterrestre delineano gli scenari plausibili e i possibili percorsi dell’evoluzione dei processi iniziali.
Il problema centrale delle origini, a tutt’oggi aperto, è la definizione stessa di vita. Anche se di soluzione apparentemente intuitiva, il fatto che esista qualcosa che risponde a ciò che istintivamente siamo portati a definire vita è difficilmente riconducibile all’interno di una definizione formale e univoca. Le definizioni che prevedono una breve serie di attribuzioni di proprietà (del tipo un essere vivente nasce, si accresce, può riprodursi, muore) sono invariabilmente passibili di contraddizione. Per qualsiasi definizione proposta esistono una o più eccezioni che ne aboliscono il valore definitorio. Né offre soluzione l’introduzione, tra ciò che è categorizzabile come vivente, di cristalli, argille o virus, né l’estensione a macrosistemi, formulando domande del tipo: sono considerabili viventi i pianeti, e la Terra in particolare? Sono viventi le galassie?
La definizione di vita accettata correntemente è quella proposta in un convegno organizzato dalla NASA (National Aeronautics and Space Administration): un sistema chimico autosostenibile e autoreplicante, in grado di sottostare alle teorie evolutive di Charles Darwin (J. Joyce, introduzione a Origins of life. The central concepts, ed. D.W. Deamer, G.R. Fleischaker, 1994). È interessante che vita ed evoluzione siano due concetti legati tra loro in termini identificativi. Vivere ed evolversi sono in questa definizione due aspetti della stessa proprietà. Il terzo aspetto fondante del sistema è l’autosostenibilità: la vita è tale solo se è in grado di provvedere a sé stessa. Per poter svolgere la propria funzione e per potersi replicare, una struttura vivente deve interagire, essere in equilibrio dinamico con l’ambiente nel quale è immersa ed evolversi con esso. Se l’ambiente cambia, sopravvive solo chi ne segue i cambiamenti. La capacità di evolversi è il mezzo e il fine delle strutture viventi; l’uomo, la cui evoluzione è ancora in atto, non fa eccezione.
Anche se è corretto affermare che le origini della vita non sono note, è oggi possibile, da un lato, proporre soluzioni parziali suffragate da evidenze sperimentali solide, dall’altro tracciare un quadro di insieme plausibile. L’analisi delle soluzioni parziali e degli scenari più ampi richiede che vengano chiariti alcuni aspetti della struttura del vivente: il primo e centrale è la distinzione tra genotipo e fenotipo; il secondo è la distinzione tra i componenti essenziali della struttura vivente (proteine, acidi nucleici, strutture lipidiche); il terzo è il problema delle loro origini distinte e il rapporto di interazione funzionale che tra loro deve essersi necessariamente instaurato nei momenti iniziali e critici di quel processo evolutivo che ha portato alla sfera del vivente, così come la conosciamo oggi.
Genotipo e fenotipo
Il genotipo è l’insieme di informazioni genetiche che determinano le caratteristiche fisiche di ogni organismo. L’informazione è data dai nucleotidi che compongono il genoma e dal loro ordinarsi in sequenze. Il genoma può essere costituito da una o più unità separate, i cromosomi, ed essere fatto di DNA (DeoxyriboNucleic Acid), nella maggior parte dei casi, o di RNA (RiboNucleic Acid), come in molti virus che infettano batteri, animali e, soprattutto, piante. Nonostante prevalga l’idea del DNA come materiale genetico, l’ipotesi che le strutture genetiche iniziali siano state di RNA è suffragata dalla descrizione delle sue proprietà.
Anche se di natura induttiva, tali osservazioni riducono il ruolo del DNA a quello di deposito di informazione e relegano il suo sviluppo a momenti successivi a quelli del processo replicativo iniziale. Il DNA sarebbe stato favorito dalle sue doti di maggiore stabilità molecolare. L’RNA, invece, è dotato di maggiore reattività, di capacità etero- e autocatalitiche, a scapito della capacità di perdurare a lungo nell’ambiente.
Gli eventi iniziali sarebbero stati, in questa logica, a carico del più attivo ma instabile RNA, mentre la resistenza strutturale necessaria per permettere l’accumulo e il tramandarsi dell’informazione selezionata sarebbe stata assicurata dal DNA.
Perché il DNA evolvesse, presumibilmente, è stato però necessario che prima si sviluppassero strutture complesse e processi biosintetici elaborati. In altre parole, l’RNA è in grado di autogenerarsi, mentre il DNA è un prodotto di evoluzione avanzata, una presumibile invenzione cellulare. È importante precisare che l’informazione genetica è al tempo stesso un’entità astratta e un oggetto materiale definito. Astratta perché, in quanto sequenza di nucleotidi, può essere determinata, trascritta su carta o in un file di computer e conservata all’infinito; materiale perché nella realtà fisica essa consiste di strutture polimeriche precise, organizzate in quell’ordine che di per sé costituisce informazione ma che è comunque ottenuto a partire da strutture chimiche, i monomeri nucleotidici. Il materiale genetico è allo stesso tempo informazione (genotipo) e materiale chimico (fenotipo). Il termine fenotipo (dal greco pháinomai «apparire») indica ciò che si manifesta, la materia costituente e la forma che questa assume, la sua organizzazione. Nel rapporto tra genotipo e fenotipo il ruolo di genotipo è rivestito esclusivamente da RNA e DNA, mentre il fenotipo è fatto di proteine, lipidi e tutte le altre strutture chimiche, RNA e DNA inclusi, che caratterizzano e compongono nella loro enorme varietà gli esseri viventi.
Nell’ambito delle ipotesi e degli scenari all’interno dei quali vanno considerate le sintesi dei precursori prebiotici, dei componenti primi, le ricerche più recenti in chimica organica e in biologia molecolare forniscono una serie di verità parziali sull’origine degli amminoacidi costituenti le proteine, su quella delle basi nucleiche costituenti il DNA e l’RNA e sull’origine di quelle membrane senza le quali non esisterebbero un dentro e un fuori, un sé e un non sé.
Le sintesi molecolari
Amminoacidi
Nove dei venti amminoacidi presenti nelle proteine di origine biologica si formano spontaneamente in reazioni sintetiche simili a quelle descritte nel pionieristico esperimento di Stanley L. Miller (A production of amino acids under possible primitive Earth conditions, «Science», 1953, 117, 3046, pp. 528-29). Nella pubblicazione originale viene descritta la sintesi di amminoacidi ottenuta a partire da una miscela gassosa riducente a seguito di scariche elettriche. Si pensava che l’atmosfera usata fosse rappresentativa di quella della Terra primitiva. L’esperimento dimostrò, in primo luogo, che alcune tra le molecole fondamentali per la vita potevano essere sintetizzate a partire da molecole semplici e in condizioni compatibili con quelle presumibili per l’ambiente prebiotico. In secondo luogo, dimostrò come la warm little pond, ossia la piccola pozza calda che Darwin immaginava come culla della vita, fosse uno scenario plausibile e potenzialmente fertile. Il fatto ancora più importante fu che questo tipo di esperimenti mostrò chiaramente come lo studio delle nostre origini fosse riconducibile a verifica sperimentale.
Il lavoro sperimentale originale è stato poi ripetuto e ampliato; i risultati di decenni di studi hanno rivelato quali sono gli amminoacidi che possono sintetizzarsi spontaneamente (vale a dire: materializzarsi dall’atmosfera) e in quali condizioni ambientali questo può avvenire. Gli altri amminoacidi, invece, non possono che essere prodotti da organismi viventi. Per i venti amminoacidi la cui combinazione forma le proteine che costituiscono gli organismi attuali, e che sono oggi tutti comunque codificati dal sistema genetico, siamo dunque in presenza di alcuni composti oggettivamente in grado di autogenerarsi, possibile prodotto di gas atmosferici e di scariche elettriche (o di altre fonti di energia di comparabile intensità), mentre altri componenti amminoacidici richiedono, per essere sintetizzati, l’esistenza di strutture biologiche evolutesi in precedenza.
Questa dicotomia lascia intravedere il percorso delle origini della vita: sintesi spontanee di composti semplici, seguite dall’interazione dei prodotti ottenuti a formare strutture via via più elaborate lungo un processo evolutivo basato sulla progressiva acquisizione di complessità. Siamo allora in presenza di due tipi distinti di amminoacidi: prebiotici e metabolici. L’insieme degli studi che li vede protagonisti, i rapporti tra i due tipi di amminoacidi e il loro ruolo nell’evoluzione del codice genetico sono uno degli argomenti di più intenso sviluppo nelle ricerche odierne sulle origini della vita.
Un secondo tipo di esperimento di sintesi di amminoacidi era stato condotto da Miller ancora negli anni Cinquanta e mai pubblicato. Un gruppo di suoi allievi, usando materiali e protocolli originali, lo ha recentemente ripetuto. Il sistema, semplice anch’esso come gli esperimenti originali, simula scariche elettriche prodotte in un ambiente gassoso simile a quello presente durante le eruzioni vulcaniche. I risultati hanno dimostrato la produzione di 22 amminoacidi e di 5 ammine, alcune delle quali non osservate in precedenza. Lo scenario risultante delinea un ambiente nel quale gas ridotti e fulmini associati a eruzioni vulcaniche potrebbero avere stimolato, in luoghi sufficientemente caldi, efficienti reazioni di sintesi. Altre sintesi potrebbero avere avuto luogo nelle nubi vulcaniche: sintesi di acido cianidrico (HCN), di aldeidi e di chetoni di varia natura. Questi composti, dopo essere precipitati ed essersi raccolti in zone tidali, avrebbero potuto dare luogo a processi di polimerizzazione. La formazione di peptidi a partire da amminoacidi e solfuri è infatti un processo ben descritto.
Le prime scoperte sulle sintesi spontanee di brevi sequenze di amminoacidi risalgono agli studi di Noam Lahav che, negli anni Sessanta del 20° sec., osservò in presenza di argille la formazione di poliglicina a partire da glicine isolate. Gli studi proseguirono con l’ampliamento dello spettro dei catalizzatori possibili e degli amminoacidi in grado di legarsi l’un l’altro senza l’intervento dei ribosomi.
Gli amminoacidi formano le proteine, e gli enzimi proteici sono alla base di tutte le reazioni metaboliche. Ma le proteine, il costituente essenziale del fenotipo, non sono in grado di riprodursi, di tramandare sé stesse e la propria informazione, in modo tale da perpetuare così direttamente le proprie funzioni. Per riprodurre il fenotipo la vita ha bisogno di un genotipo, di un sistema di codificazione in grado di replicare sé stesso e di produrre di nuovo il macchinario che lo ha sintetizzato.
Acidi nucleici
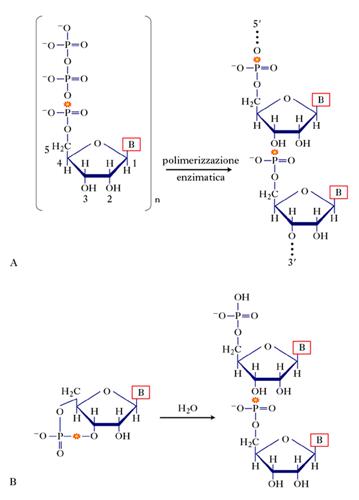
L’RNA e il DNA sono costituiti, in maniera tra loro molto simile, da strutture polimeriche composte dall’unione di monomeri formati da tre componenti: una base nucleotidica, uno zucchero pentoso, un gruppo fosfato. Come mostrato nella figura (A) un nucleotide trifosfato, composto da uno zucchero pentoso, una base nucleotidica e una serie di tre gruppi fosfato, viene polimerizzato producendo RNA (nella figura è riportata la numerazione dei 5 atomi di carbonio ed è indicato con una scintilla il legame la cui rottura provoca transfosforilazione e polimerizzazione). La polimerizzazione del DNA è simile. Le basi nucleotidiche, indicate genericamente con la lettera B, possono essere purine (adenina, guanina) o pirimidine (uracile, citosina, timina). In tutti i sistemi viventi contemporanei, i nucleotidi precursori sono trifosfati e la reazione procede per rimozione del difosfato terminale a opera dell’RNA polimerasi o DNA polimerasi. È plausibile che il processo di polimerizzazione prebiotica, necessariamente avvenuto in assenza di enzimi, abbia fatto uso di nucleotidi ciclici (fig. B). Le differenze tra i due tipi di polimero sono dovute alla presenza nell’RNA di un gruppo ossidrilico nella posizione 2′ del pentoso e alla sostituzione di una delle due basi pirimidiniche (la timina per il DNA, l’uracile per l’RNA), comunque molto simili. Al di là di queste differenze in apparenza minori, ma comunque in grado di determinare diversità nella stabilità e reattività, entrambi i polimeri prendono origine dalla formazione di legami fosfodiesterici tra i componenti pentosi. In seguito alla polimerizzazione due filamenti di DNA si uniscono a formare una struttura chimicamente antiparallela, la doppia elica, mantenuta unita dai legami idrogeno che si formano tra le basi: due legami per la coppia adenina-timina, tre, invece, per la coppia guanina-citosina.
In termini di origine del materiale genetico, da un lato è importante capire come si siano potuti formare i vari componenti dei monomeri, come questi abbiano raggiunto uno stato di reattività sufficiente a polimerizzare, in che condizioni queste reazioni siano potute avvenire. Ma è anche fondamentale capire come, una volta che si sono formati, i polimeri (necessariamente, almeno all’inizio, di brevi dimensioni) abbiano potuto raggiungere e mantenere lunghezze e complessità sufficienti ad assumere valenza informazionale; come, in altre parole, brevi oligonucleotidi siano riusciti a diventare genotipi in grado di determinare specifici fenotipi, dando così inizio alla serie di cicli riproduttivi e ai processi di evoluzione.
È importante, a questo punto, fare chiarezza sui termini con i quali ci si riferisce a questi fenomeni: il termine abiotico, in genere, è usato come attributo caratterizzante un processo non enzimatico e non necessariamente correlato a possibili sviluppi biogenici. Il termine prebiotico si riferisce, invece, al sottoinsieme di processi abiotici suscettibili di contribuire all’organizzazione e all’evoluzione di strutture viventi. In quest’ambito è naturalmente importante precisare in che termini viene inteso il concetto di ‘vivente’. Ovvero, a che punto del processo evolutivo, passando dal chimicamente semplice al biologicamente complesso, non siamo più in presenza di reazioni incontrollate e non coordinate; e a che punto invece ci veniamo a trovare in presenza di processi che definiamo viventi? Qual è il punto di passaggio tra l’inanimato e il vivente? Poiché questo quesito rappresenta un’irrisolvibile aporia, la conseguenza logica è che la vita non è definibile.
Viene inoltre definito neodarwiniano il processo di selezione che agisce sui geni (o su sequenze di RNA o di DNA), in opposizione a darwiniano. Quest’ultimo aggettivo definisce più strettamente i processi di selezione/evoluzione di organismi. È in uso chiamare neodarwiniane le strutture nelle quali fenotipo e genotipo non sono entità distinte (per es., una molecola di RNA), mentre con darwiniano si indica l’esistenza di un fenotipo complesso e codificato, così come definito in modo classico (per es., una giraffa).
Origine dell’RNA
L’RNA è una molecola reattiva ed è molto probabile che l’ipotesi che la ritiene la molecola iniziale sia quella corretta. Le ragioni sono essenzialmente collegate alla capacità dell’RNA di reagire secondo proprietà intrinseche.
Quello che viene detto RNA catalitico è una molecola dotata di grande reattività; la sua stessa struttura la rende capace di rompere i propri legami e, allo stesso tempo, di riformarli. Questo significa che, a seconda delle condizioni, i legami possono scambiarsi, ricombinare e dare luogo sia a molecole più corte sia, soprattutto, a molecole più lunghe e più complesse. In particolare, due molecole possono unirsi e scambiare legami, portando a eventi di ricombinazione delle sequenze circostanti, o possono scambiare legami al proprio interno. La reattività dell’RNA dipende dalla fragilità del legame fosfato in posizione 3′, legame che può essere facilmente scisso, anche per semplice esposizione ad ambiente acquoso, attraverso un meccanismo ormai chiarito nei dettagli. Durante l’idrolisi si produce un legame fosfato in forma ciclica che è, anche se per un tempo breve, particolarmente reattivo. Poiché quindi l’estremità ciclica prodotta è in grado di far proseguire le reazioni, la sua esposizione momentanea può costituire il punto di crescita per l’unione di altre molecole, siano esse monomeri o altri polimeri. La molecola dell’RNA ha, in altre parole, la capacità endogena di allungarsi, accorciarsi, legarsi ad altre molecole sue simili ed è in grado di espandere la propria informazione di sequenza senza ricorrere ad altre molecole: è dunque genotipo e fenotipo di sé stessa.
Come è stata possibile l’evoluzione di una molecola così complessa e, allo stesso tempo, tanto semplice da permettere la propria generazione spontanea? Ovviamente, per comprendere le basi di questa evoluzione, è necessario in primo luogo capire le origini dei monomeri a partire dai quali può crearsi RNA. La scoperta fondante è dovuta a Juan Oró (Mechanism of synthesis of adenine from hydrogen cyanide under possible primitive Earth conditions, «Nature», 1961, 191, pp. 1193-94) che descrisse la sintesi di adenina da HCN, un componente molto abbondante dello spazio interstellare e, in particolare, il più diffuso composto a tre atomi contenente carbonio. Sulla Terra si forma da condensazione in ambiente gassoso vulcanico ed è il precursore molecolare delle basi nucleiche. Anche se nei decenni successivi la chimica dell’HCN è stata esplorata in dettaglio e nonostante la grande intensità di studi diretti all’analisi delle basi nucleiche a partire da HCN e dai suoi derivati, il progresso del campo è stato limitato.
Una possibile soluzione del problema della formazione delle molecole necessarie per la sintesi spontanea dell’RNA è fornita dall’ovvia considerazione che, appunto, HCN è il composto organico a tre atomi più abbondante nel mezzo circum- e interstellare. H2O è d’altro canto il composto inorganico più abbondante. La combinazione di HCN e H2O (reazione favorita sia dall’abbondanza sia dalla reattività dei due composti) produce formammide, NH2COH. Questo composto è stabile in forma liquida tra i 4 e i 210 °C, è in grado di reagire con decine di catalizzatori diversi per produrre, in condizioni ambientali moderate, tutti i precursori necessari per le sintesi degli acidi nucleici, comprese forme nucleosidiche (base azotata più pentoso) in grado di permettere la polimerizzazione, fino alla stimolazione della loro fosforilazione e alla protezione delle forme autopolimerizzate (Saladino, Crestini, Ciciriello et al. 2007).
Il problema dell’origine dei polimeri informazionali non è più dunque ormai quello di scoprire il loro quadro chimico di riferimento, semplicemente formato dagli atomi più abbondanti dell’universo (H, C, N e O) e dalle loro frequenti e ulteriormente reattive combinazioni (HCN e H2O combinate in NH2COH). Gli interrogativi irrisolti riguardano le condizioni chimico-fisiche e gli ambienti nei quali sono venuti a trovarsi i primi piccoli polimeri in grado di autogenerarsi. Contro quali forze questi accumuli di informazione chimica hanno dovuto lottare per sopravvivere, quali barriere termodinamiche hanno dovuto superare per raggiungere dimensioni tali da poter essere ragionevolmente considerate (pre)genetiche?
Il problema chimico-fisico principale è quello costituito dal fatto che le reazioni di unione di due monomeri sono estremamente sfavorite in acqua in quanto essi richiedono l’eliminazione di una molecola di H2O, per la formazione del legame di unione. La soluzione di questo problema termodinamico adottata dagli organismi attuali consiste nell’evoluzione di meccanismi di preattivazione dei monomeri (oggi usati in forma trifosfata). Altre soluzioni in ambito prebiotico sono possibili; è stata, in effetti, scoperta recentemente una reazione di unione non enzimatica di polimeri preformati che sfrutta come sorgente di attivazione l’interazione longitudinale tra le molecole (Pino, Ciciriello, Costanzo, Di Mauro 2008).
È quindi ragionevole concludere che le reazioni di sintesi dei precursori degli acidi nucleici non costituiscono oggi un mistero e che la chimica dell’acido cianidrico e quella della formammide forniscono un plausibile quadro di riferimento e una soluzione generale soddisfacente. Allo stesso modo non sono più un mistero le reazioni di polimerizzazione di questi monomeri in condizioni prebiotiche e in assenza di enzimi.
La difficoltà attuale è quella di capire le interazioni tra gli acidi nucleici formatisi spontaneamente e i pe-ptidi, frammenti delle proteine a venire, nucleatisi altrettanto spontaneamente. Le interazioni iniziali non possono che essere state casuali e non guidate da rapporti di codificazione reciproca. Ma il fatto che oggi gli acidi nucleici determinino le proteine attraverso un codice genetico unico e universale, e il fatto che senza proteine il materiale genetico non può sopravvivere né replicarsi indicano che i rapporti tra acidi nucleici e proteine devono aver assunto una valenza di causalità deterministica in tempi evolutivamente molto precoci. È di conseguenza corretto ipotizzare che l’evoluzione ha potuto prendere la direzione che conosciamo quando i rapporti tra acidi nucleici e proteine hanno assunto una dimensione di reciprocità e cooperazione.
Genetica e metabolismo
Delle due maggiori categorie metodologiche in cui lo studio delle origini risulta oggi diviso, sinteticamente denominate prima il metabolismo e prima la genetica, quest’ultima appare più rilevante. Senza un sistema robusto (facile ed efficiente) in grado di codificare, perpetuandola, la selezione delle reazioni e dei meccanismi chimico-fisici che producono organizzazione di materia e di energia (o meglio, che le trasformano e le rendono disponibili a trasformazioni ulteriori, dato che nulla si crea e nulla si distrugge veramente), l’alternarsi e il coordinarsi di reazioni anaboliche e cataboliche darebbero luogo a una serie inutile di eventi futili, diretti senza freni allo stato entropico finale. Senza un apparato di codificazione le attività di tipo metabolico non sarebbero state in grado di giungere a quell’originario sistema di reazioni capace di evoluzione darwiniana, sistema il cui abbozzo è stato necessariamente il passo iniziale dell’evoluzione.
Questo non significa affermare che metabolismo e genetica non siano presto giunti a una sovrapposizione, a una profonda integrazione iniziale. Se la reazione codificata ed eseguita non serve a nulla, e materia e/o energia si disperdono, non c’è vita. Di qui deriva la necessità dell’integrazione tra metabolismo e genetica.
Una reazione che rilascia energia, per es. un’ossidazione, può però avvenire senza programmazione, dall’incontro casuale di due molecole nell’ambiente adatto. Il metabolismo può essere iniziato spontaneamente, e risultare più o meno intenso e coerente nel proprio insieme, anche breve, di reazioni.
Tra le ipotesi che hanno recentemente riscosso maggior successo nel tentativo di individuare le possibili fonti di energia e le possibili reazioni implicate nello sviluppo di protometabolismi da segnalare quella che va sotto il nome del proponente Günter Wächtershäuser (n. 1938). Lo scenario delineato prevede nell’origine chemioautotrofa del metabolismo secondario la funzione centrale di minerali a base di ferro e zolfo, quali la pirite (FeS2) e la pirrotina (Fe1−xS). Lo schema delle reazioni è basato sulla formazione di metilmercaptano (CH3SH) da ossidi di carbonio, in una sorta di primitiva via di fissazione del carbonio in presenza di FeS e H2S. Il metilmercaptano può essere trasformato in acido tioacetico, plausibile precursore dell’acetilcoenzima A. Il particolare successo di questa ipotesi è basato anche sul fatto che reazioni di questo tipo possono essere avvenute e, in effetti, avvenire ancora nelle profondità marine in vicinanza di sorgenti di gas solforati (i black smokers), a temperature molto alte.
La codificazione è invece fenomeno ben più complesso che richiede, per poter avere inizio, la presenza contemporanea di tutti i componenti della macromolecola informazionale che dovrà formarsi. Rimanendo nello scenario più probabile, quello che vede l’RNA come prima molecola informazionale, dovevano essere presenti basi nucleiche (la cui sequenza è l’informazione), zuccheri pentosi (a connettere le basi con la matrice della quale essi stessi sono parte) e gruppi fosfato (a legare tra loro gli zuccheri e stabilizzare la catena informazionale). In assenza anche di uno solo di questi tre componenti, e senza un insieme ricco ed eterogeneo di basi nucleiche, non ci sarebbe stato modo di sviluppare l’informazione chimica dirigendola verso quella genetica. È comunque chiaro che in assenza di una conoscenza solida – tuttora mancante – di entrambe le categorie di eventi, protometabolismo e protogenetica, l’analisi astratta dei loro possibili piani di integrazione iniziale è esercizio inutile.
Per la comprensione dei successivi passaggi verso lo sviluppo dei protorganismi, sarebbe necessario raggiungere una conoscenza maggiore degli eventi iniziali evolutisi a permettere lo sviluppo di riproducibili processi protometabolici.
Membrane
Un sistema di codificazione richiede un sé e un non sé, un dentro e un fuori, e un apporto energetico locale e dedicato. Il materiale genetico richiede a priori l’identificazione di un ambiente interno, isolato dal resto del mondo, separato fisicamente e, se possibile, termodinamicamente. In assenza di una definizione di luogo separato dal resto, non è concepibile quella evoluzione che richiede scelte all’interno di un insieme. L’ambiente presente sulla Terra dei primordi ha fornito la soluzione, un modo di definire uno scenario nel quale fosse possibile esplorare lo spazio evolutivo (il tramandarsi cioè di un’informazione nel tempo, conservandola e allo stesso tempo modificandola) e quello strutturale, cioè uno spazio nel quale fosse possibile sviluppare strutture capaci di coesistere in modo armonico, in accordo tra loro funzionale.
Studi recenti condotti dal gruppo di David Deamer hanno dimostrato come sia possibile ottenere la sintesi spontanea di RNA in ambiente lipidico. Gli esperimenti dimostrano come microambienti lipidici siano capaci di organizzare mononucleotidi all’interno di una matrice, quando vescicole di fosfolipidi vengono mescolate con mononucleotidi in ambiente acquoso e poi asciugate. In queste condizioni lunghi filamenti di molecole simili a RNA vengono sintetizzati in una reazione di condensazione solo quando i reagenti vengono esposti a uno o più cicli di deidratazione. Il potenziale chimico che conduce le reazioni è presumibilmente fornito dalle condizioni anidre, mentre il calore fornisce l’energia di attivazione. Alla fine della reazione i polimeri rimangono incapsulati nelle vescicole formate dai lipidi in reidratazione.
Cicli
Studi come quelli di Deamer pongono l’accento sulla rilevanza degli eventi ciclici. Il principio di fondo è semplice: un ambiente stabile fornisce un insieme definito di condizioni, nel quale possono avvenire o non avvenire alcune definite reazioni. Queste reazioni sono, in un ambiente stabile, sempre le stesse; le possibilità di movimento e spostamento sono limitate e, ben presto, i reagenti vanno in esaurimento. In ambienti sottoposti a oscillazioni cicliche si instaurano, al contrario, condizioni tra loro molto diverse, separate inoltre da fasi intermedie che di norma hanno dinamiche speculari. Un esempio semplice è l’alternanza di notte e giorno, caratterizzata da assenza e presenza di tutta una gamma di radiazioni, quella termica inclusa. Spesso questi cicli di radiazioni sono sfalsati tra loro (le ore più fredde sono quelle intorno all’alba), sono opposti nei loro effetti (passare dal buio alla luce non è per un sistema recettivo come passare dalla luce al buio) e creano cicli di effetti secondari. È stato, per es., scoperto recentemente come la superficie dell’acqua sia più acida delle zone interne del liquido. L’autoionizzazione dell’acqua che avviene secondo la reazione 2H2O ♦ H3O+ + OH− è un processo di grande importanza e induce, nell’acqua pura, un pH=7. Ciononostante è stato osservato come il pH della superficie dell’acqua pura sia significativamente più basso (pH < 4,8) a causa della stabilizzazione protonica alla superficie. La ragione è semplicemente dovuta alla preferenza di H3O+ ma non di OH− per le superfici. La maggiore acidità della superficie di uno strato di acqua ha un significativo impatto sulle sue proprietà chimiche e influenza quelle dell’atmosfera. Modellizzando gli effetti della variazione di temperatura sulla mobilità e sul conseguente cambiamento di distribuzione degli ioni nell’acqua si vede come sia possibile considerare un piccolo stagno primigenio un reattore variabile e accordato sui cicli di variazione dell’ambiente.
Poiché le polimerizzazioni di RNA, di proteine, di lipidi sono grandemente e squisitamente sensibili alle variazioni di pH dell’ambiente, il collegamento tra le variazioni cicliche ambientali e la possibilità di influenzare le polimerizzazioni, ovvero la creazione di informazione chimica complessa, risulta ineludibile.
Altri cicli rilevanti in questo scenario sono soprattutto quelli di idratazione-deidratazione e i cicli tidali collegati ai cicli lunari. Le variazioni di acidità e di condizioni termiche in ambienti a intenso vulcanismo, non cicliche ma comunque frequenti, possono anch’esse avere svolto un ruolo importante.
Essendo a ragione considerato più che plausibile che ambienti fluttuanti fossero comuni sulla Terra prebiotica, reazioni del tipo di quelle appena descritte, originate da lipidi e nucleotidi, avrebbero facilmente prodotto compartimenti membranosi e geneticamente fertili in questi ambienti. All’interno di questi compartimenti si sarebbero potute accumulare molecole RNA-simili che, una volta incapsulate e separate dall’ambiente esterno, avrebbero potuto evolversi ulteriormente verso le prime forme di vita cellulare primitiva.
È quindi particolarmente rilevante cercare di ricostruire i passaggi di evoluzione delle membrane. Le odierne membrane cellulari sono basate su fosfolipidi e risultano essere barriere formidabili nei riguardi di molecole polari e cariche, dagli ioni metallici ai nutrienti complessi. Lo sviluppo della moderna vita cellulare ha necessariamente richiesto l’evoluzione di meccanismi sofisticati basati su canali proteici e pompe selettive, allo scopo di mediare gli scambi molecolari tra l’ambiente esterno e quello interno. Si pensa che i candidati molecolari più probabili per lo sviluppo iniziale di queste complesse strutture siano gli acidi grassi e i loro corrispondenti alcoli e monoesteri glicerolici. Come componenti delle membrane protocellulari questi composti risultano particolarmente adatti e plausibili in termini prebiotici sia per la loro semplicità strutturale sia per il loro carattere anfifilo. Queste caratteristiche, da un lato, permettono la formazione di vescicole membranose a doppio strato in grado di trattenere gli oligonucleotidi eventualmente incapsulati, dall’altro, ne favoriscono la crescita e la successiva divisione.
La soluzione di fondo usata dalla natura per creare ambienti definiti diventa, in questa prospettiva, solida e verosimile. Gli acidi grassi tendono naturalmente a separarsi dall’acqua e a formare micelle. E quanto più questi acidi sono semplici e comuni – per es., l’acido oleico – tanto meglio funzionano.
Le proprietà di permeabilità di membrane di questo tipo suggeriscono che le primitive protocellule possono aver acquisito nutrienti dall’ambiente in assenza di un macchinario di trasporto molecolare. In altre parole, suggeriscono che le protocellule primitive erano eterotrofe e assumevano, concentrandolo, cibo e materiale (proto)genetico dall’ambiente circostante.
Lo studio della formazione e della duplicazione di micelle lipidiche sta ormai uscendo dal periodo pionieristico iniziato con le intuizioni di Aleksandr I. Oparin (1894-1980) e sta rapidamente assumendo i contorni di una disciplina matura orientata, oltre che alla comprensione delle origini della vita, verso la biotecnologia e la biologia sintetica.
Abbiamo ricordato come le sintesi di amminoacidi, di basi nucleiche attivate poi a nucleotidi, e infine di acidi grassi siano possibili in modo spontaneo e chimicamente non elaborato. Allo stesso modo è possibile la loro polimerizzazione. Quest’ultimo processo è termodinamicamente sfavorito in acqua ma potrebbe essere avvenuto in ambienti ciclicamente anidri, oppure essere stato favorito dall’interazione con superfici minerali particolarmente catalitiche (quali quelle di alcune argille), oppure aver sfruttato, soprattutto per la creazione di molecole protogenetiche come nel caso dell’RNA, caratteristiche intrinseche delle molecole stesse in grado di produrre appaiamenti macromolecolari ordinati. Anche se i procedimenti precisi non sono noti, le varie possibilità chimico-fisiche alternative sono ormai state identificate.
Il concetto di polimerizzazione è in questa argomentazione di importanza centrale. Poiché i polimeri possono sussistere in quanto tali solo se più stabili dei monomeri che li compongono, si sono necessariamente selezionate le molecole dotate di questa caratteristica differenza di stabilità. Ne consegue che il criterio di selezione darwiniana applicato alle molecole primigenie è soprattutto basato sulla capacità di creazione di informazione chimica complessa, di polimerizzazione appunto. Le molecole che sono state in grado di interagire aumentando la stabilità del sistema macromolecolare hanno avuto, in quest’ottica, un ulteriore vantaggio. Il fatto che il materiale genetico odierno sia in forma di cromatina (complessi di acidi nucleici e proteine) è probabilmente una diretta derivazione di questo tipo di vantaggio evolutivo.
Bibliografia
J.W. Szostak, D.P. Bartel, P.L. Luisi, Synthesizing life, «Nature», 2001, 409, 6818, pp. 387-90.
R. Saladino, C. Crestini, F. Ciciriello et al., Formamide chemistry and the origin of informational polymers, «Chemistry & biodiversity», 2007, 4, 4, pp. 694-720.
S. Pino, F. Ciciriello, G. Costanzo, E. Di Mauro, Nonenzymatic RNA ligation in water, «The journal of biological chemistry», 2008, 283, 52, pp. 36.494-503.