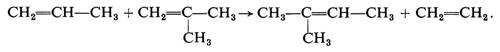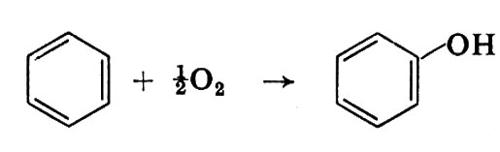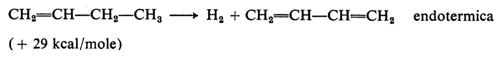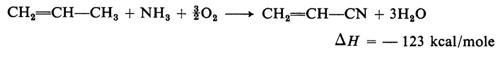Petrolchimica
Petrolchimica
di Alberto Girelli
Petrolchimica
sommario: 1. Premessa. 2. La chimica della petrolchimica. a) Radicali liberi e ioni di carbonio. b) II cracking. c) Polimerizzazione. d) Disproporzionamento. e) Alchilazione. f) Isomerizzazione. g) Deidrogenazione. h) L'ossidazione degli idrocarburi. i) Altri processi petrolchimici. 3. Alimentazioni petrolchimiche. 4. L'industria petrolchimica. 5. Il futuro della petrolchimica. □ Bibliografia.
1. Premessa
La petrolchimica è quella parte della chimica industriale che riguarda la trasformazione di idrocarburi naturali in composti destinati a ulteriori elaborazioni chimiche o comunque a usi diversi da quelli cui sono prevalentemente destinati gli idrocarburi del petrolio.
Questa definizione, però, è puramente negativa, in quanto definisce che cosa ‛non è' la petrolchimica più di che cosa essa ‛è'.
D'altra parte, una volta avvenuta la trasformazione prima degli idrocarburi naturali (gas naturale, petrolio grezzo o suoi distillati), tutte le reazioni e i processi ai quali si sottopongono i prodotti primari vengono definiti ‛petrolchimici', in quanto realizzati spesso dalla stessa industria e nello stesso stabilimento che ha realizzato la trasformazione prima. Tuttavia, a un esame più attento, risulta che i processi ‛a valle' sono comuni processi della chimica industriale, dato che l'individualità chimica dei composti in gioco ovviamente prescinde dalla materia prima dalla quale sono stati ottenuti.
Questa considerazione consente di circoscrivere il campo della petrolchimica e di distinguerlo da quello della chimica industriale organica, che riguarda la trasformazione degli intermedi petrolchimici in derivati diversi, tipici dell'industria chimica cosiddetta ‛secondaria'. Consente inoltre di distinguerlo da quello della raffinazione del petrolio, processo attraverso il quale si elabora il petrolio grezzo soprattutto per trasformarlo in combustibili adatti ai diversi impieghi (nei forni, nei bruciatori, nei motori a scoppio e Diesel), in lubrificanti, solventi, bitumi.
Le distinzioni tra questi tre grandi settori di attività industriale (la ‛chimica' tout court, la petrolchimica e la tecnologia del petrolio) rimangono tuttavia sfumate e non mancano le sovrapposizioni.
Le raffinerie di petrolio possono svolgere alcune attività tipicamente chimiche (per es. la produzione di zolfo o di acido solforico dal solfuro di idrogeno ottenuto da processi per produrre combustibili di pregio); l'industria petrolchimica da parte sua produce componenti di combustibili (per es. la benzina di pirolisi, sottoprodotto del cracking con vapor d'acqua per ottenere olefine leggere, può essere utilizzata quale componente di carburanti).
Vi sono inoltre processi che possono condurre sia a combustibili di pregio sia a prodotti chimici. È questo il caso dell'hydroforming (procedimento in uso negli anni quaranta) e dei diversi tipi di reforming catalitico, adottati in un primo tempo dalle raffinerie di petrolio soltanto per ottenere benzina ad alto numero di ottano, ma successivamente anche come primo stadio della produzione di singoli idrocarburi aromatici: benzene, toluene e altri alchilbenzeni.
L'identificazione della petrolchimica in base a considerazioni di tipo soltanto chimico è praticamente impossibile. Si tratta di un'attività industriale i cui confini sfumano da una parte nella tecnologia della raffinazione del petrolio e dall'altra nella chimica industriale: non solo nella chimica industriale organica, che pure rappresenta la parte più cospicua delle ulteriori elaborazioni degli intermedi petrolchimici, ma anche in quella inorganica. Infatti, essendo gli idrocarburi naturali la maggior fonte industriale dell'idrogeno, a essi va ricondotta la sintesi dell'ammoniaca, e, attraverso questa, la produzione - quantitativamente colossale e qualitativamente ramificata - dei fertilizzanti azotati, misti e complessi.
Gran parte delle reazioni e dei processi industriali sui quali si basa la petrolchimica di oggi erano noti assai prima che l'abbondante disponibilità e il basso costo degli idrocarburi naturali suggerissero di impiegarli come materia prima chimica. Ciò vale in particolar modo per i processi di pirolisi, mutuati, sia pure con profonde modificazioni, dal cracking termico adottato dalle raffinerie nel primo trentennio del secolo per aumentare la resa in benzina dal petrolio grezzo; per i processi di idrogenazione, chiaramente riconducibili agli anni d'oro della carbochimica (1920-1945); per quelli di estrazione con solvente degli idrocarburi aromatici e di separazione mediante distillazione azeotropica o estrattiva di idrocarburi difficilmente separabili.
La tab. I elenca alcune delle più importanti tappe della petrolchimica, segnate dall'inizio della produzione industriale di derivati della prima e della seconda generazione (derivati diretti della materia prima naturale e alcuni loro importanti prodotti). Non sono inclusi i processi e i prodotti di polimerizzazione a macromolecole (plastomeri ed elastomeri). Le date riportate nella tabella sono sempre posteriori alla data della scoperta della reazione o del processo: l'innovazione ha richiesto un più o meno lungo lavoro di sviluppo.
2. La chimica della petrolchimica
Lo sviluppo dell'industria petrolchimica si è realizzato sia attraverso l'adozione di tecnologie originate da sperimentazioni alquanto empiriche, sia attraverso l'applicazione dei risultati di ricerche di base condotte secondo i criteri scientifici più ortodossi.
Il cracking termico - il primo processo ‛chimico' operato sul petrolio - sarebbe stato realizzato per la prima volta per la negligenza di un addetto alla distillazione discontinua. Il reforming catalitico su platino - forse la maggiore realizzazione della chimica del petrolio del secondo dopoguerra - era già in nuce nei lavori di N. Zelinski sull'aromatizzazione del cicloesano, negli anni venti. Ancora nel 1934 un chimico illustre come C. Ellis affermava nel suo fondamentale trattato Chemistry of petroleum derivatives l'impossibilità di produrre derivati alchilati per condensazione delle olefine con le paraffine.
A parte questi esempi, tanto caratteristici quanto non comuni, la petrolchimica si è potuta giovare, nel corso degli ultimi decenni, dei progressi della chimica riguardanti le principali reazioni degli idrocarburi. È impossibile qui anche soltanto fare un elenco di tali reazioni. Si preferisce citarne più diffusamente alcune, scelte fra quelle riguardanti le trasformazioni di idrocarburi in altri idrocarburi.
a) Radicali liberi e ioni di carbonio
L'affermazione, prima, e la dimostrazione, poi, che nelle reazioni degli idrocarburi intervengono intermedi instabili molto reattivi è stata certamente una delle più importanti acquisizioni della chimica degli idrocarburi. O. Rice dimostrò già nel 1931 che la rottura di legami C−C e C−H negli idrocarburi alifatici, causata dal cracking termico, poteva venire spiegata in modo soddisfacente con un meccanismo di radicali liberi. Poco dopo F.C. Whitmore affermò il concetto che le trasposizioni intramolecolari possono essere spiegate con l'intervento di ioni carbonio, e che tali ioni fungono anche da intermedi della polimerizzazione delle olefine in catalisi acida. Con questi concetti fu possibile interpretare altre reazioni degli idrocarburi.
Le reazioni termiche e quelle indotte da perossidi furono spiegate ammettendo che i radicali liberi subiscano l'uno o l'altro dei seguenti mutamenti, prima di portare ai prodotti finali della reazione: 1) addizione a una molecola insatura, per formare un radicale libero di peso molecolare maggiore; 2) decomposizione in un idrocarburo insaturo e in un radicale libero (o in un atomo di idrogeno). Questi radicali liberi si trasformano nei prodotti finali della reazione o attraverso reazioni di eliminazione o per estrazione di un atomo d'idrogeno da un reagente o per ‛disproporzionamento' di due radicali liberi con formazione di un composto insaturo e di un composto saturo.
Le reazioni degli idrocarburi catalizzate da acidi furono spiegate in termini di ioni carbonio, le cui trasformazioni successive fino ai prodotti finali sono alquanto simili a quelle - ora accennate dei radicali liberi. Una trasformazione che gli ioni carbonio subiscono spesso - a differenza dei radicali liberi - è la trasposizione (isomerizzazione) per trasferimento dell'idrogeno o di un alchile (o di un arile). Gli ioni carbonio terziari sono più stabili dei secondari, a loro volta più stabili dei primari.
Il concetto generale di ioni carbonio si è affermato anche se sulle prime i chimici furono alquanto riluttanti ad ammettere la possibilità che composti relativamente stabili come gli idrocarburi potessero facilmente trasformarsi in specie cariche positivamente. Soltanto negli anni sessanta G. A. Olah accertò sperimentalmente, con metodi strumentali (spettrometria IR e Raman, NMR), l'esistenza di cationi idrocarburici. Nel 1971 lo stesso Olah suggerì la possibilità dell'esistenza di due tipi di carbocationi: lo ione classico trivalente (ione carbenio) e uno ione non classico tetra-o pentacoordinato (ione carbonio). Quest'ultimo consisterebbe di cinque atomi uniti a un atomo di carbonio da tre legami semplici e da un legame tricentrico a due elettroni. Il concetto dello ione pentacoordinato consente una spiegazione attendibile dell'estrazione di un atomo di idrogeno da un idrocarburo saturo in catalisi acida, sotto forma di ione idruro.
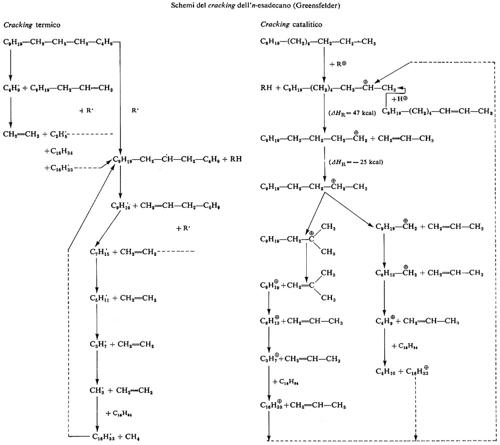
b) Il cracking
Questo processo pirolitico, che nelle sue diverse versioni è alla base della petrolchimica, è stato realizzato industrialmente prima di essere conosciuto nei suoi aspetti fondamentali. Un contributo decisivo alla sua conoscenza è stato dato da B. S. Greensfelder nel 1948: il cracking termico si svolge secondo un meccanismo a catena di radicali liberi (v. schema), mentre nei cracking catalitico il processo avviene con l'intervento di ioni carbonio (carbocationi). La tendenza degli ioni carbonio primari a isomerizzarsi e la rottura del legame in β delle molecole idrocarburiche spiegano la diversa composizione del prodotto del cracking termico e di quello catalitico: etilene e olefine superiori lineari nel primo caso, propilene e olefine superiori prevalentemente ramificate nel secondo (v. schemi). Questa diversa composizione del prodotto ha portato all'affermazione del cracking termico nella versione steam-cracking - in petrolchimica (olefine C2 - C4) e del cracking catalitico nelle raffinerie (benzine da distillati medi). Effettuando il cracking catalitico in presenza di idrogeno sotto pressione (hydrocracking) si consegue il risultato di ottenere idrocarburi esclusivamente saturi di peso molecolare più basso di quelli dell'alimentazione. Il luogo della rottura della molecola reagente non dipende solo dai suoi fattori strutturali ma anche, in larga misura, dalle condizioni di reazione e dal tipo di catalizzatore.
Già nel 1948 V. Haensel e V. Ipatieff dimostrarono che in presenza di nichel su farina fossile l'hydrocracking degli alcani avviene prevalentemente per demetilazione; questa ultima e selettiva anche dal punto di vista della struttura della molecola che reagisce (un CH3 legato a un atomo di C secondario viene allontanato più facilmente di un -CH3 unito a un atomo di C terziario, e questo a sua volta più facilmente di un −CH3 unito a un C quaternario). In presenza di un catalizzatore acido, invece, l'hydrocracking fornisce frammenti molecolari derivanti in prevalenza da rotture di legami interni.
Una modificazione dell'hydrocracking è la idrodealchilazione degli idrocarburi alchilaromatici (più comunemente del toluene a benzene e dei metilnaftaleni a naftalene). Il processo - nelle versioni termica e catalitica - segue nelle sue linee il meccanismo dell'hydrocracking, tenuto conto degli effetti della presenza dell'anello aromatico nella molecola reagente.
Ancora al cracking si devono ascrivere i processi a temperature sopra i 1.300-1.500 °C per la produzione dell'acetilene da metano e da idrocarburi paraffinici superiori (C2-C4 saturi, distillati leggeri di petrolio). Caratteristica peculiare è il tempo assai breve di permanenza dell'alimentazione nelle condizioni di reazione (dell'ordine dei millisecondi), il che rende necessari dispositivi e accorgimenti per portare in tempo assai breve la miscela reagente in temperatura e per bloccare successivamente le reazioni parassite con un brusco raffreddamento dei gas.
c) Polimerizzazione
La polimerizzazione delle olefine a bassi polimeri (oligomerizzazione) è nota da circa un secolo. Le reazioni di tale processo sono state studiate soprattutto negli anni trenta per l'interesse a produrre idrocarburi liquidi (da incorporare nella benzina) dalle olefine gassose ottenute dal cracking in raffineria. Il processo è stato condotto per via termica o in catalisi acida; il meccanismo differente (rispettivamente radicalico e ionico) spiega il diverso andamento e il diverso prodotto:
Altre polimerizzazioni, di rilevante interesse petrolchimico, sono state sviluppate successivamente. Esse hanno consentito di produrre tutta un'estesa gamma di alti polimeri, adatti per la fabbricazione di elastomeri, di materie plastiche e di fibre sintetiche.
La produzione di polimeri solidi ricavati dalle olefine - soprattutto dall'etilene e dal propilene - è stato uno dei più importanti risultati della petrolchimica. Il primo polimero dell'etilene di interesse pratico è del 1937 (polietilene ad alta pressione). Esso era prodotto per polimerizzazione radicalica attivata con ossigeno o con perossidi. Polietilene di caratteristiche migliorate fu ottenuto nel 1959 da K. Ziegler, impiegando un sistema catalitico contenente un metallo dei gruppi dal IV all'VIII in stato di valenza inferiore al massimo (in origine TiCl4 ridotto) e idruri metallici o metalloalchili. O. Natta applicò tali catalizzatori alla polimerizzazione del propilene e scoprì il modo di guidare la regolarità strutturale e la cristallinità del prodotto, con rilevanti conseguenze anche sul piano tecnologico (v. polimeri). Altri sistemi catalitici per la polimerizzazione delle olefine sono stati sviluppati dalla Phillips Petroleum Co. (ossido di cromo su silice-allumina) e dalla Standard Oil Co. (ossido di metallo del V o del VI gruppo su allumina).
d) Disproporzionamento
R. L. Banks e O. C. Bailey hanno descritto nel 1964 una nuova reazione delle olefine: il ‛disproporzionamento' agli omologhi superiore e inferiore. Per es.:
2CH2=CH−CH3→CH=CH−CH2−CH3+CH2=CH2.
Altre olefine vengono convertite in miscele di olefine di peso molecolare superiore e inferiore rispetto all'alimentazione. Il processo si realizza a 100-200 °C, in presenza di ossido di molibdeno su allumina, molibdenoesacarbonile o tungstenoesacarbonile.
La reazione procederebbe attraverso un intermedio tetracentrico (quasi-ciclobutanico) che si formerebbe per interazione col catalizzatore da parte dei quattro atomi di carbonio legati da doppio legame di due molecole di idrocarburo.
Questo processo presenta rilevante interesse pratico, in quanto consente di produrre composti di particolare pregio a partire da miscele di olefine, per es. l'isopentene (intermedio per l'isoprene):
Per il disproporzionamento delle olefine sono stati sviluppati diversi altri sistemi catalitici, specialmente adatti a casi particolari: per es. l'ossido di renio su allumina, che favorisce la trasformazione dell'1-butene in etilene +3-esene; il sistema ottenuto da esacloruro di tungsteno, etanolo ed etilalluminio dicloruro in benzene che, applicato a una miscela di 2-pentene e 6-dodecene, fornisce tutte le olefine previste in base alla formazione dell'intermedio ‛tetracentrico' sopra citato.
e) Alchilazione
L'alchilazione degli idrocarburi aromatici con olefine ha le sue applicazioni industriali più importanti nella sintesi dell'etilbenzene (intermedio per lo stirene) da benzene ed etilene, in quella del cumene (intermedio per il fenolo-acetone) da benzene e propilene, e in quella degli alchilbenzeni superiori (intermedi per detergenti).
Benché gran parte dei catalizzatori per questa reazione fossero noti già nella seconda metà del sec. XIX, le caratteristiche e il meccanismo della reazione sono stati chiariti progressivamente nell'ultimo cinquantennio. Sono stati, per esempio, stabiliti i fattori sterici quando si alchilino aromatici sostituiti, le reattività relative tra benzene e alchilbenzeni, la cicloalchilazione.
L'alchilazione degli aromatici con olefine (in presenza di sistemi tipo AlCl3•HCl) è da tempo spiegata ammettendo la formazione di un catione che si somma a un atomo di carbonio dell'anello aromatico formando un complesso con elettroni p.
L'alchilazione delle paraffine con olefine è un'acquisizione più recente. V. Ipatieff e H. Pines alchilarono l'esano con etilene in presenza di cloruro di alluminio nel 1932. Altri composti tipo Friedel-Crafts e alcuni acidi (solforico, fluoridrico) vennero successivamente proposti per queste reazioni, che si affermarono su scala industriale soprattutto nelle raffinerie per la produzione di idrocarburi ramificati da aggiungere alle benzine super (isoeptani, isoottani, da alchilazione soprattutto dell'isobutano con olefine C3 e C4).
f) Isomerizzazione
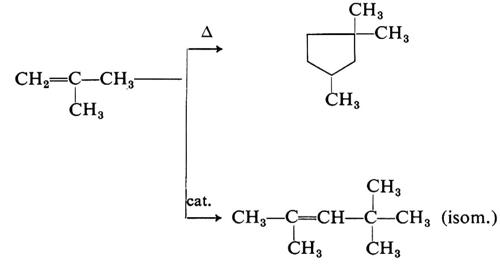
Reazioni di isomerizzazione degli idrocarburi trovano applicazione in diversi settori della petrolchimica. Le n-paraffine C4-C6 vengono isomerizzate in raffineria per ottenere l'isobutano (intermedio per l'alchilazione con olefine) e per ottenere miscele C5-C6 ricche degli isomeri ramificati, ad alto numero di ottano. Di interesse petrolchimico l'isomerizzazione dell'n-pentano a isopentano, intermedio per l'isoprene.
Le olefine possono essere isomerizzate per slittamento del doppio legame (dalle 1 -olefine si ottengono miscele più ricche di olefine interne) oppure, in condizioni più severe, per trasformazione negli isomeri ramificati. Queste reazioni sono spiegate con un meccanismo ionico: l'isomerizzazione del doppio legame comporta la migrazione dello ione idruro nel catione formatosi per addizione di un protone all'olefina; le trasposizioni interessanti lo scheletro idrocarburico comportano invece la migrazione di un gruppo alchilico.
L'isomerizzazione degli idrocarburi aromatici presenta interesse pratico soprattutto per orientare la produzione degli xileni verso gli isomeri orto e para, di maggiore interesse industriale.
g) Deidrogenazione
Mentre per gli idrocarburi più leggeri (etano, propano) la deidrogenazione viene realizzata in condizioni di cracking termico e comporta la formazione di olefine, idrogeno e metano, la deidrogenazione delle n-paraffine superiori è stata studiata impiegando svariati catalizzatori. Per la trasformazione in olefine, con alta selettività, sono particolarmente efficaci sistemi contenenti platino, in presenza di componenti che ne attenuano l'effetto ciclizzante, a pressioni e temperature moderate, e in presenza di idrogeno. Il prodotto consiste nelle n-olefine aventi lo stesso numero di atomi di C dell'alimentazione, con distribuzione apparentemente casuale della posizione del doppio legame. Questo processo è particolarmente importante per produrre olefine lineari C11-C14 per alchilbenzeni lineari (intermedi per detergenti biodegradabili).
Catalizzatori e condizioni di esercizio assai differenti si adottano per la deidrogenazione dei C4 lineari (butano e buteni) a butadiene, monomero per elastomeri di sintesi, e per la produzione dello stirene dall'etilbenzene.
h) L'ossidazione degli idrocarburi
Oltre che sulle reazioni fin qui ricordate, che trasformano idrocarburi in altri idrocarburi, la petrolchimica si fonda su un gruppo di reazioni tra idrocarburi da una parte e sostanze semplici e poco costose dall'altra.
Tra queste reazioni riveste un'importanza fondamentale l'ossidazione. Più che di una reazione, si tratta di un gruppo di reazioni che consentono di ottenere - da alimentazioni idrocarburiche - composti ossigenati organici.
In teoria, è possibile ossidare idrocarburi con un'ampia gamma di sostanze ossidanti. Nella petrolchimica di oggi si ossida quasi soltanto con ossigeno (o con aria) in presenza di catalizzatori selettivi e in condizioni che consentono rese elevate del prodotto desiderato. Le ossidazioni con ossidanti chimici (dall'acido nitrico al dicromato e al permanganato alcalini) sono state via via abbandonate per ragioni economiche e di protezione ambientale. Esse sopravvivono soltanto per produzioni marginali (acido trimellitico da 1 ,2,4-trimetilbenzene, anidride piromellitica da durene), ma anche per queste sono disponibili processi alternativi, diretti.
Le ossidazioni di interesse petrolchimico possono essere classificate in funzione dello stato fisico della miscela reagente (in fase liquida o in fase gassosa) oppure in funzione della presenza di catalizzatore e della forma di questo (catalisi omogenea o eterogenea). Le ossidazioni in fase liquida avvengono più spesso in catalisi omogenea, quelle in fase gassosa più spesso in catalisi eterogenea. Non mancano tuttavia eccezioni di un certo rilievo (v. catalisi).
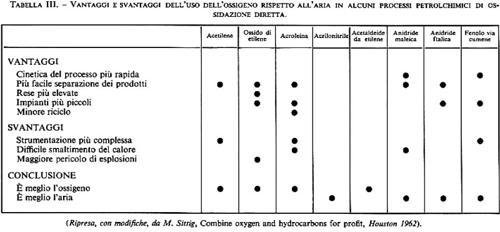
Ossigeno e aria come reagenti. - Le ossidazioni con aria degli idrocarburi sono realizzate su scala industriale da moltissimi anni (v. tab. II). L'espansione e lo sviluppo degli impianti di frazionamento dell'aria hanno successivamente posto a disposizione dell'industria grandi quantità di ossigeno a prezzi convenienti. Si sono quindi affermati processi di ossidazione con ossigeno (di solito al 94-96% circa). L'aria è tuttavia rimasta importante come mezzo ossidante, sia per ragioni economiche, sia - in alcuni casi - perché obiettivamente più adatta allo scopo.
Fondamentali per la scelta tra ossigeno e aria come mezzo ossidante sono le considerazioni sulla sicurezza del processo e quelle sulla separazione e purificazione del prodotto (o dei prodotti) di ossidazione. Le miscele idrocarburi-ossigeno sono infatti infiammabili entro un campo abbastanza esteso di concentrazioni. Tale campo è ovviamente più ristretto per le miscele idrocarburi-aria, per la presenza dell'inerte azoto.
La scelta dell'aria comporta però l'inconveniente di imporre impianti più grandi a pari capacità produttiva. Inoltre, nel caso di prodotti gassosi o bassobollenti, la sezione ricupero e purificazione risulta più complessa e invariabilmente più costosa.
Difficoltà di realizzare ossidazioni dirette - conseguenti sia a caratteristiche intrinseche delle reazioni teoricamente fattibili, sia alla competizione da parte di reazioni non desiderate, prima tra tutte la formazione di CO/C02 + H2O - hanno ostacolato per molto tempo, quando non impedito del tutto, la produzione per tale via di derivati di grande interesse pratico. Casi tipici sono quelli degli alcoli metilico ed etilico, il primo dei quali viene tuttora prodotto dal metano in due stadi:
CH4 + ½O2 → CO + 2H2
CO + 2H2 → CH3OH
essendosi rivelata non conveniente l'ossidazione diretta:
CH4 + +02 CHaOH.
Nonostante le lunghe ricerche, soprattutto nel campo della catalisi applicata, una situazione analoga si è verificata nello sviluppo dei processi per ottenere fenolo da benzene: a onta dei numerosi brevetti che rivendicano la realizzabilità su scala industriale della reazione
il fenolo viene tuttora prodotto con processi indiretti, passando attraverso intermedi, in più stadi.
Alcuni processi non selettivi, dopo un'effimera affermazione negli anni quaranta-cinquanta, sono stati abbandonati. Infatti la complessità tecnologica e pertanto gli alti costi connessi con la separazione e la purificazione annullano il vantaggio della relativa semplicità del reattore e del suo esercizio.
Esempio di tali processi è l'ossidazione diretta di gas naturale ricco di etano e idrocarburi superiori, realizzata in modo da far reagire prevalentemente questi ultimi. Dopo il ricupero dei prodotti ossigenati (una miscela di numerosi componenti, prevalentemente alcoli, aldeidi e acidi) il metano che non aveva reagito veniva distribuito come gas combustibile. Processi analoghi hanno dato risultati migliori se applicati a correnti di idrocarburi C4.
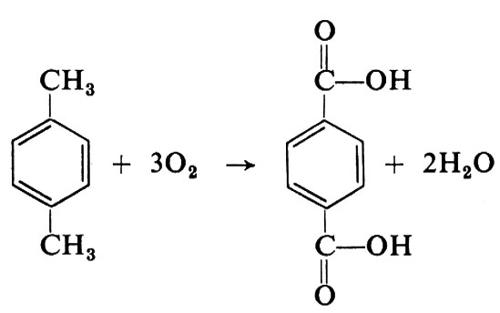
Un successo nel campo dell'ossidazione diretta si è ottenuto (negli anni settanta) con la produzione dell'acido tereftalico dal p-xilene per ossidazione diretta in fase liquida
che ha reso obsoleti i precedenti processi in più stadi. Il progresso è stato conseguito grazie allo sviluppo di adatti catalizzatori.
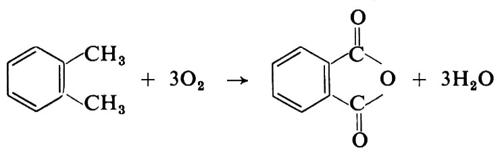
La reazione corrispondente (sulla carta) di ossidazione dell'o-xilene ad anidride ftalica,
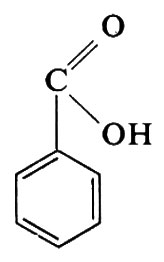
pure assai importante per la petrolchimica, si realizza da tempo. Si tratta di un processo con aria, in fase gassosa, in catalisi eterogenea. Il suo successo - nelle condizioni industriali - è in gran parte legato alla stabilità termica dell'anidride ftalica. In condizioni analoghe, dal p-xilene si avrebbero rese minime di acido tereftalico e la formazione di acido benzoico,
oltre che di prodotti di demolizione ossidativa.
Ossidazioni in fase gassosa. - Le ossidazioni catalitiche dirette in fase gassosa (anidride ftalica da o-xilene o da naftalene, anidride maleica da benzene o da butano/buteni) sono particolarmente favorite per l'impiego dell'aria quale ossidante, grazie alla facile separabilità dei prodotti per desublimazione - dalla corrente gassosa di reazione.
La produzione dell'ossido di etilene, che può essere considerata come la più riuscita applicazione dell'ossidazione diretta, è realizzata in entrambe le versioni (ossigeno/aria). Questo processo ha avuto una lunga gestazione: dai primi brevetti di Lefort (1933-1935) all'industrializzazione sono trascorsi quasi venti anni.
Il processo, in fase gassosa, ossida l'etilene su catalizzatore a base di argento. La reazione principale
nelle condizioni ottimali prevale su quella termodinamicamente più favorita,
che porta all'acetaldeide, mentre subisce in modo rilevante la competizione della combustione completa
che condiziona severamente la progettazione dell'impianto, le condizioni di esercizio e l'economia del processo complessivo.
Le versioni che adottano come ossidante aria od ossigeno (quest'ultimo sempre assieme a un inerte per ragioni di sicurezza contro le esplosioni) hanno entrambe realizzazione industriale. I vantaggi dell'una o dell'altra sono sostanzialmente gli stessi delle ossidazioni in fase gassosa in genere (v. tab. III). Anche per quanto attiene alla regolazione termica, questo processo è tipico delle ossidazioni degli idrocarburi in fase gassosa. Il problema base dei reattori industriali è infatti lo smaltimento del calore di processo (nelle condizioni reali, circa 700 kcal per litro di catalizzatore per ora). In questo come in altri casi, ciò si consegue con reattori multitubolari (alcune migliaia di tubi, di diametro intorno a 2 cm) raffreddati dall'esterno. Ricorrendo a impianti su due reattori in serie si conseguono, assieme, alta conversione dell'etilene e alta resa in ossido.
Ossidazioni in fase liquida. - Un importante gruppo di processi di ossidazione ‛petrolchimici' opera in fase liquida e in catalisi omogenea. I catalizzatori o gli iniziatori sono differenti nei vari casi, e non possono essere facilmente ricondotti a meccanismi simili, ni facilmente classificati.
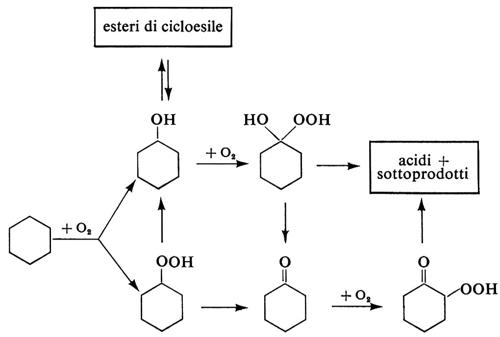
Dal punto di vista pratico meritano menzione l'ossidazione dell'etilene ad acetaldeide con aria in presenza di sistemi catalitici Pd2+/Cu2+ (v. tab. IV); quella degli idrocarburi alchilaromatici (toluene, p-xilene, 1 ,2,4-trimetilbenzene e altri) ai rispettivi acidi carbossilici benzoico, tereftalico, trimellitico, ecc., che impiega catalizzatori a base. di metalli di transizione; quella del cicloesano a cicloesanolo-cicloesanone, realizzata sia con catalizzatori dello stesso tipo sia con acido borico.
La chimica dell'ossidazione dell'etilene ad acetaldeide viene riassunta come segue:
CH2=CH2 + PdCI2 + H2O → CH2CHO + Pd + 2HCI
Pd + 2CuCl2 → PdCl2 + 2CuCI
2CuCI + 2HCI + ½=O2 → 2CuCl2 + H2O.
Si ammette l'attivazione dell'etilene da parte del PdCl2 mediante formazione di un complesso e l'ossidazione tramite l'ossigeno dell'acqua. L'ossigeno molecolare entra quindi nel processo solo per la ‛rigenerazione ossidativa' del sistema catalitico Pd/Cu. Nonostante l'apparente complessità del processo, esso è applicato da tempo con risultati soddisfacenti in grandi impianti, in due versioni (con aria o con ossigeno) che differiscono per particolari dell'impianto. Con non rilevanti adattamenti, questo processo è atto a produrre acetato di vinile da etilene e acido acetico, nonché acetato di allile e alcool allilico da propilene e acido acetico.
Regolando condizioni di reazione e rapporto tra i reagenti, si ottengono produzioni congiunte, con possibilità di variare la quantità relativa dei prodotti.
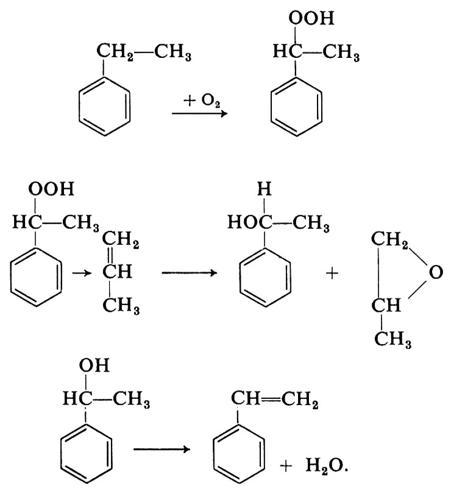
Un gruppo di processi di ossidazione in fase liquida degli idrocarburi, che si avvale dell'aria come mezzo ossidante, è quello delle idroperossidazioni. I processi di questo tipo sono impiegati per ottenere una serie di importanti intermedi petrolchimici, tra cui fenolo-acetone, cicloesanolo-cicloesanone, alcool feniletilico-ossido di propilene.
In tutti i casi si tratta di processi catalitici, dai quali si ottengono idroperossidi che a loro volta vengono trasformati nel prodotto ossigenato stabile, spesso in uno stadio a parte del processo industriale.
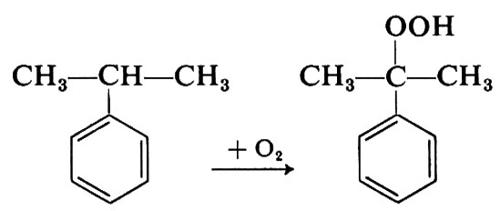
La selettività dell'attacco ossidativo sulla molecola dell'idrocarburo che viene trasformato nell'idroperossido consente rese elevate in quest'ultimo. Un esempio ne è la trasformazione - per ossidazione catalitica con aria - del cumene nell'idroperossido,
primo stadio della sintesi congiunta di fenolo e acetone.
Una recente acquisizione della petrolchimica è l'impiego di un idroperossido - ottenuto come sopra - per l'attacco ossidativo di molecole insature, che ha consentito la realizzazione industriale della produzione congiunta di ossido di etilene-alcool feniletilico (e stirene):
L'ossidazione del cicloesano in fase liquida, con aria, è caratterizzata dalla bassa conversione dell'idrocarburo e pertanto dal rilevante rapporto di riciclo. Il processo segue il seguente schema di reazioni (semplificato):
e può essere ricondotto a una ‛coossidazione' dei tre reagenti principali: cicloesano, cicloesanolo, cicloesanone. Facendo intervenire una reazione di cattura del cicloesanolo (per es. introducendo nel sistema acido borico) si migliora alquanto la selettività del processo complessivo.
Deidrogenazione ossidativa (ossideidrogenazione). - La combinazione dell'ossidazione in fase gassosa (con ossigeno o con aria) con processi di deidrogenazione può essere utilmente realizzata in quanto ne modifica favorevolmente il comportamento termico. Così, per esempio, la deidrogenazione dell'n-butano (o dei buteni)
Formula
può essere realizzata in condizioni ossidative
CH2=CH−Ch2−CH3 + ½O2 → CH2=CH−CH=2 + H2O
che trasformano il processo in esotermico e ne spostano l'equilibrio nel senso desiderato, in condizioni industrialmente più interessanti.
Analogamente, la deidrogenazione ossidativa dell'etilbenzene, con adatti catalizzatori, fornisce rese e selettività in stirene migliori a temperature più basse di quelle della deidrogenazione diretta.
La petrolchimica ricorre in vari casi all'intervento di reazioni di ossidazione e, al limite, di combustione, al fine esclusivo di fornire energia a processi altamente endotermici.
Di particolare rilevanza industriale i processi per acetilene e per acetilene+ olefine da metano e da idrocarburi leggeri, nonché i vari processi per gas di sintesi (CO + H2). Questi ultimi, tuttavia, non attengono propriamente alla petrolchimica, ma rientrano nella categoria dei processi di gassificazione (a gas combustibili o a gas di sintesi) dei combustibili solidi e liquidi e dei processi di conversione in gas combustibili di idrocarburi gassosi.
Ossidazioni a tre componenti. - Tipici della petrolchimica e di rilevante interesse pratico sono alcuni processi che trattano idrocarburi con ossigeno e un terzo reagente (ossidazione a tre componenti). Essi si sono affermati per la produzione dell'acrilonitrile da ammonossidazione del propilene
Formula
grazie allo sviluppo di catalizzatori selettivi, dopo che da molti anni l'ammonossidazione era stata adottata per ottenere il cianuro d'idrogeno dal metano
CH4+NH3 + ³2- O2, HCN + 3H2O
secondo il processo Andrussow, realizzato in condizioni assai severe (t > 1.000 °C) su reti di platino.
Altro processo di ossidazione a tre componenti che trova impiego in petrolchimica è l'ossiclorurazione, che utilizza miscele cloruro di idrogeno-ossigeno. Tale processo è applicato per la produzione del cloruro di vinile dall'etilene e del clorobenzene dal benzene.
i) Altri processi petrolchimici
Le reazioni fin qui considerate sono quelle sulle quali si è fondata e si è successivamente sviluppata la ‛grande industria petrolchimica'. Le reazioni degli idrocarburi aventi interesse industriale non sono soltanto queste; alogenazioni, nitrazione delle paraffine, reazioni di somma agli idrocarburi insaturi, ciclizzazioni di alcheni e alchini e numerose altre non sono qui trattate in quanto non tipiche della petrolchimica, ma riferibili alla chimica organica industriale in genere.
Soltanto eccezionalmente tali reazioni vengono impiegate per processi industriali integrati con i cicli della petrolchimica; più spesso sono realizzate da unità produttive indipendenti, talvolta annesse ad attività chimiche derivate (intermedi, chimica fine, antiparassitari, ecc.) o parachimiche, che ne utilizzano i prodotti (industrie della gomma, delle fibre, della carta, ecc.).
3. Alimentazioni petrolchimiche
Nel 1978 la produzione mondiale di prodotti del petrolio è stata di 3,0 miliardi di t, quella di gas naturali di 1.500 miliardi di m3 (equivalenti a oltre 1 miliardo di t di petrolio).
I consumi di idrocarburi per la petrolchimica (inclusa la produzione dei gas di sintesi per ammoniaca, metanolo, ecc.) hanno rappresentato circa il 5% dei consumi totali.
In Italia, nello stesso anno, sono stati consumati 88,4 milioni di t di prodotti del petrolio e 30 miliardi di m3 di gas naturale. I consumi per la petrolchimica hanno rappresentato circa il 10% del totale. La percentuale dei consumi di idrocarburi naturali per l'industria chimica di sintesi è destinata ad aumentare, sia in Italia sia nel mondo, a causa della più facile sostituibilità del petrolio e del gas naturale per altri impieghi (combustibile per generazione di energia elettrica, per usi industriali, per riscaldamento domestico) con combustibili solidi o con energie alternative. Un altro fattore che stimolerà sempre più l'utilizzazione chimica degli idrocarburi naturali è l'elevato valore aggiunto dei prodotti chimici rispetto a quello dei combustibili secondari.
Si producono attualmente (1979) oltre tremila derivati petrolchimici ‛importanti' e, nei principali paesi industriali, oltre l'80% della produzione chimica organica è derivata dagli idrocarburi. Si valuta che i prodotti petrolchimici rappresentino il 65-70% dell'intera produzione chimica.
Benché per i diversi processi petrolchimici si ricorra a una vasta gamma di alimentazioni (dal petrolio grezzo tal quale, impiegato per alcuni processi di cracking ad alta temperatura, fino a idrocarburi singoli), l'alimentazione più importante è la cosiddetta virgin naphtha. Si tratta di un distillato del petrolio grezzo, che contiene gli idrocarburi da C5 fino alle frazioni con punto di ebollizione finale di circa 180 °C. Questo distillato viene ottenuto dalla distillazione primaria del grezzo, primo stadio del ciclo operativo dei complessi petrolchimici e delle raffinerie.
La virgin naphtha è l'alimentazione di elezione per il processo petrolchimico quantitativamente più rilevante, che è all'origine delle olefine C2-C4 e di importanti quantità di liquidi aromatici: lo steam-cracking. La produzione delle olefine è tuttavia ottenuta anche da idrocarburi gassosi (dall'etano al butano) oppure da distillati più pesanti della virgin naphtha, come il gasolio, o addirittura dal petrolio grezzo.
La composizione dell'alimentazione è ovviamente determinante - assieme alle condizioni del processo - per la qualità del prodotto dello steam-cracking e pertanto condiziona anche la struttura degli impianti di ricupero e purificazione a valle dei reattori.
Le alimentazioni per processi più selettivi di quelli pirolitici, per es. per la deidrogenazione dei butani/buteni a butadiene, per le alchilazioni, per le diverse ossidazioni, sono costituite da idrocarburi singoli o da miscele di un numero relativamente limitato di componenti, uno solo o pochi dei quali in quantità prevalente.
Le esigenze di purezza delle alimentazioni di questo tipo sono ovviamente connesse con le considerazioni riguardanti i comuni parametri dei processi chimici industriali (da una parte le condizioni di esercizio, dall'altra la conversione dell'alimentazione, la resa nei composti desiderati, la necessità di ricicli, la complessità e quindi il costo delle operazioni di ricupero e di purificazione a valle del reattore).
4. L'industria petrolchimica
I derivati petrolchimici di base sono prodotti quasi esclusivamente da grandi imprese, che possono essere o chimiche (come la Dow, la Carbide, la BASF, la Montedison) o petrolifere (come la Exxon, la Shell, l'Amoco, la ELF). Le operazioni ‛chimiche' delle grandi compagnie petrolifere sono in genere su scala maggiore di quelle delle imprese strettamente chimiche.
La logica produttiva e l'economia dell'industria petrolchimica hanno spinto al massimo la realizzazione di processi continui su scala via via più grande e su una sola linea produttiva.
L'industria petrolchimica mostra anche una forte tendenza all'integrazione, sia a monte verso le materie prime, sia a valle verso i derivati della seconda e delle successive generazioni. Per es. un produttore di glicol etilenico è spesso produttore dell'ossido di etilene (materia prima di quello) e anche di etilene, derivato diretto di idrocarburi naturali (per es. della virgin naphtha); è anche caratteristico che - spesso - l'industria venda solo il prodotto finale: nell'esempio citato, solo il glicol e non l'ossido di etilene nè l'etilene. A causa di tale integrazione verticale, soltanto una parte della ‛produzione apparente' delle imprese petrolchimiche viene venduta o comunque esce dallo stabilimento produttivo.
Un esempio dell'integrazione possibile nell'industria petrolchimica è quello illustrato nella fig. 1, che riguarda gli idrocarburi aromatici. Questi possono derivare sia dal reforming catalitico (di solito un processo di raffineria) sia dallo steam-cracking della virgin naphtha (come sottoprodotto della produzione delle olefine).
Nel primo caso il ‛riformato' catalitico dev'essere separato nelle sue costituenti aromatica e non aromatica mediante estrazione di quest'ultima con solventi selettivi. Nel secondo caso, trattandosi di prodotto ricco di aromatici e di olefine aromatiche, queste ultime vengono idrogenate selettivamente ad aromatici. A questo punto le due correnti aromatiche possono essere inviate al frazionamento, che separa componenti singoli (benzene, toluene) o gruppi di componenti (xileni, aromatici C9).
A valle, processi di separazione fine e di conversione possono trasformare gli idrocarburi intermedi in prodotto chimico di alto grado di purezza. Nello schema, che ha carattere meramente esemplificativo, sono considerati processi di alchilazione, idrogenazione, dealchilazione, isomerizzazione; risulta anche l'integrazione ‛petrolchimica-raffineria', con la destinazione di parte delle correnti a benzina per auto e a combustibile.
La tendenza al gigantismo degli impianti - e conseguentemente alle produzioni di massa - affermatasi fin dalle origini dell'industria, attualmente si va affievolendo. Per esempio, le capacità produttive dell'etilene sono passate in Italia dalle 30-50.000 t/anno negli anni cinquanta alle 150-250.000 t/anno nel decennio successivo, fino ad assestarsi poi sulle 500.000 t/anno. Ovviamente, tali capacità produttive comportano investimenti assai rilevanti, una strumentazione molto complessa, misure di sicurezza di grande affidabilità, oltre alla necessità di far funzionare gli impianti a livelli prossimi al 100% della capacità. Incidenti, ritardi nell'approvvigionamento della materia prima o ristagno nello smaltimento dei prodotti, con conseguenti rallentamenti della produzione e fermate non programmate, hanno ripercussioni rilevanti sull'economia della gestione degli impianti, in quanto ne abbassano il tasso di utilizzazione. Questo è un fenomeno comune a tutte le industrie e tipico dell'industria chimica, tuttavia assume particolare rilevanza nella petrolchimica a causa delle grandi dimensioni degli impianti e dell'integrazione spinta delle produzioni. Per queste ragioni, una recente tendenza è quella di creare ‛poli petrolchimici' collegando gruppi di impianti ubicati in località diverse, anche distanti tra loro, mediante sistemi di tubazioni. In tal modo è più facile scambiare materie prime, intermedi e prodotti, integrare i cicli operativi e smorzare l'effetto degli eventi sopra accennati. Un'altra tendenza è quella di limitare agli impianti meno ‛critici' per l'esercizio di un complesso produttivo la struttura su una sola linea produttiva. Gli impianti a monte, il cui funzionamento condiziona l'intero complesso in modo determinante, vengono progettati più spesso su più linee, in maniera da assicurare l'esercizio continuo, sia pure con produzione ridotta, anche durante le grandi manutenzioni e comunque in caso di fermate che riguardino una delle diverse linee dell'impianto.
A mano a mano che le capacità produttive dei singoli impianti sono aumentate, l'industria petrolchimica ha avuto la possibilità di produrre anche composti tipici dell'industria chimica secondaria.
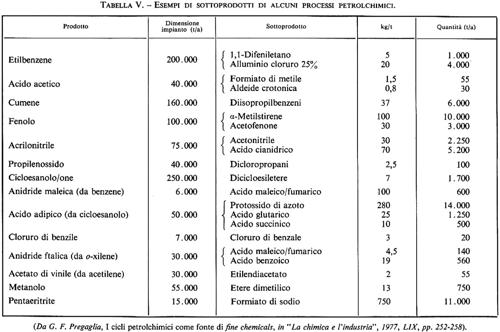
Quando alcuni composti presenti in piccola concentrazione nella corrente del prodotto grezzo costituiscono quantità assolute significative, può diventare interessante ricuperarli e purificarli. Si ha in questo modo una ‛promozione' di prodotti di scarto destinati spesso alla combustione (e pertanto valorizzati solo in base al loro calore di combustione, come un combustibile qualunque) a prodotti vendibili, spesso di apprezzabile valore aggiunto. Si incontrano numerosi esempi di questo tipo. Lo steam-cracking della virgin naphtha, accanto per es. a 500.000 t/anno di etilene e alle quantità congiunte delle altre olefine di base, può fornire mediamente 10.000 t di alchilnaftaleni, 2.500 t di indene, e quantità significative di trialchilbenzeni (tutti presenti nel sottoprodotto liquido, utilizzato in genere come combustibile). La sintesi congiunta fenolo-acetone dal cumene fornisce a-metilstirene, acetofenone e altri derivati interessanti; al livello di 100.000 tianno di fenolo diventano potenzialmente valorizzabili quantità industriali di tali composti.
Quasi ogni processo petrolchimico, raggiunta una certa produzione, è suscettibile di essere sfruttato per ottenere dalle correnti del sottoprodotto composti d'interesse commerciale, come mostra la tab. V.
5. Il futuro della petrolchimica
L'evoluzione della situazione delle materie prime, e soprattutto dei materiali fonte di energia in tutto il mondo (v. energia: Fonti primarie), non potrà non influire in modo rilevante sullo sviluppo della petrolchimica. Particolare rilevanza avrà l'andamento della disponibilità degli idrocarburi naturali, che per la petrolchimica rappresentano sia la materia prima sia la fonte energetica.
Il mercato chimico è strutturalmente più adatto di quello energetico ad assorbire gli effetti di crisi come quella seguita (alla fine del 1973) al brusco aumento del prezzo del petrolio grezzo.
La materia prima idrocarburica è certo molto importante per la chimica moderna: essa è tuttavia assai più importante per la produzione dell'energia.
La petrolchimica, impiegando un'aliquota relativamente piccola degli idrocarburi naturali estratti in tutto il mondo e fornendo produzioni di elevato valore aggiunto, si trova in una posizione di forza rispetto all'industria produttrice di energia (raffinerie di petrolio, industria termoelettrica). Ciò non significa che i nuovi rapporti tra i costi delle varie voci che assieme determinano la struttura e conomica delle imprese non abbiano influito sulla petrolchimica.
La fig. 2 esemplifica quanto è avvenuto per lo steam-cracking, il processo fondamentale della petrolchimica. Benché il quadro fornito dalla figura si stia già in parte modificando, con un certo riallineamento delle varie voci considerate (in quanto tutti i costi si adattano all'aumentato costo degli idrocarburi naturali), l'impatto del costo dell'alimentazione è stato tale, e tale rimane, da influire anche sulla tecnologia. I processi grandi consumatori (o ‛degradatori') di energia, come quelli per l'acetilene e alcune ossidazioni dirette, sono riesaminati appunto sotto questo punto di vista.
Un'attenta contabilizzazione dell'energia consumata per ottenere una tonnellata di prodotto ha mostrato che - nella nuova situazione - alcuni prodotti hanno perduto competitività rispetto ad altri idonei a sostituirli negli impieghi finali; lo stesso fatto si è verificato per taluni processi.
Le previsioni sul futuro sviluppo della petrolchimica devono tener conto di quanto sopra esposto, anche per quanto riguarda le tendenze della tecnologia. Saranno privilegiati prodotti e processi di basso contenuto energetico inteso non nella comune accezione chimico-fisica, ma quale si determina contabilizzando la quantità - e la qualità - dell'energia spesa per ottenere dalla materia prima una tonnellata di prodotto.
Processi più diretti, processi a temperatura relativamente bassa, più selettivi, meno inquinanti, ecc., saranno sempre più privilegiati.
La penuria di petrolio e di gas naturale si renderà evidente - secondo le previsioni più attendibili - dopo gli anni novanta. La petrolchimica ne risentirà meno dell'industria energetica e potrà assorbire percentuali crescenti delle alimentazioni idrocarburiche disponibili sul mercato.
A scadenza più lontana è possibile un passaggio progressivo della petrolchimica ad alimentazioni diverse dal petrolio e dal gas naturale: liquidi derivati dal carbone, materiali vegetali e infine il CO2 dalle combustioni e financo dalle rocce saranno le probabili fonti di carbonio. Per l'approvvigionamento d'idrogeno, che con il carbonio è l'elemento essenziale della petrolchimica, già si intravvedono vie di produzione, rese possibili dall'utilizzazione dell'energia di scarto delle centrali nucleari.
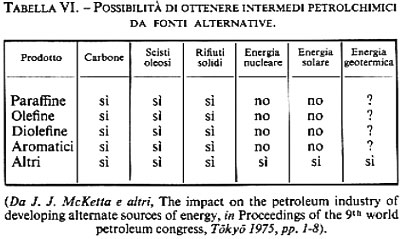
Lo sviluppo di sorgenti di energia alternative sosterrà, direttamente o indirettamente, la petrolchimica. Infatti libererà una parte degli idrocarburi del petrolio dagli impieghi come combustibili; la realizzazione su grande scala della conversione del carbone in combustibili liquidi e gassosi renderà disponibili quantità rilevanti di alimentazioni adatte a trasformazioni petrolchimiche; i processi di conversione di combustibili quali gli oli di scisto - ricchi di zolfo e di azoto - forniranno anche ammoniaca e zolfo come sottoprodotti; infine, dai rifiuti solidi si potranno ottenere alimentazioni petrolchimiche, o quanto meno la loro combustione libererà quantità equivalenti di idrocarburi naturali. Gli intermedi di base della petrolchimica - oggi ottenuti da petrolio e gas naturale - possono infatti avere origine anche da altre fonti, come risulta dalla tab. VI. Le tecnologie necessarie sono in parte già disponibili; esse non sono oggi competitive con il petrolio e il gas naturale, ma sono suscettibili di diventarlo.
Altre vie per la mobilitazione degli elementi essenziali per l'industria chimica potranno venire, in un futuro più lontano, da tecnologie nuove fondate sulla biochimica e sulla fotochimica.
La petrolchimica - anche se il suo nome non avrà più il significato originario - è quindi destinata a durare a lungo. Essa si è infatti trasformata, nel breve volgere di pochi decenni, da ‛chimica che si alimenta con il petrolio' a ‛un certo tipo di approccio a un certo tipo di chimica'. Con alimentazioni di origine differente, con processi adatti alle mutate esigenze, ma probabilmente con molti dei prodotti di oggi, la petrolchimica servirà l'umanità di domani. (V. anche petrolio).
bibliografia
American Chemical Society (ACS), Refining petroleum for chemicals, Washington 1970.
Asinger, F., Einführung in die Petrolchemie, Berlin 1959.
Astle, M. J., The chemistry of petrochemicals, New York 1956.
Brooks, B. T., Boord, C. E., Kurtz, S. S., Schmerling, L. (a cura di), The chemistry of petroleum hydrocarbons, 3 voll., New York 1955.
Ellis, C., The chemistry of petroleum derivatives, 2 voll., New York 1937.
Giavarini, C., Girelli, A., Petrolchimica, Roma 1977.
Goldstein, R. F., Waddams, A.L., The petroleum chemicals industry, London 1967.
Kobe, K. A., McKetta, J. J. (a cura di), Advances in petroleum chemistry and refining, 10 voll., New York 1958-1965.
World Petroleum Congress (W.P.C.), Proceedings of the world petroleum congress (4th to 10th), Roma 1955; New York 1959; Frankfurt a. M. 1963; Mexico 1967; Moskva 1971; Tōkyō 1975; Bucureşti 1979.