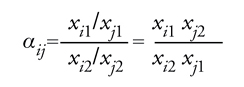Processi chimici industriali
Processi chimici industriali
La chimica, a differenza di altre scienze, si è sviluppata sia attraverso l’indagine sui fenomeni naturali, sia attraverso varie operazioni di trasformazione della materia. Nell’Antichità quest’ultime erano di fondamentale importanza, per la sopravvivenza dei singoli nonché per l’evoluzione delle diverse tecnologie. La produzione di metalli a partire dai loro minerali, la produzione di tessuti colorati, la concia dei pellami, la produzione e la colorazione del vasellame, sono esempi di processi chimici artificiali che in passato avevano un ruolo sociale fondamentale e che si basavano su procedimenti empirici, spesso noti a pochi. L’evoluzione nelle conoscenze, che ha portato all’enucleazione di una scienza particolare chiamata chimica, è avvenuta quasi contemporaneamente alla Rivoluzione scientifica e, soprattutto, alla Rivoluzione industriale. Ciò ha consentito lo sviluppo di un numero impressionante di processi chimici realizzati nelle manifatture e nelle industrie, sostituito da un approccio sempre più scientifico. La Rivoluzione industriale, infatti, è stata possibile per la disponibilità di grandi quantità di energia attinta inizialmente dalla combustione del carbone e successivamente da quella del petrolio. Di qui ha preso origine la cosiddetta carbochimica, ovvero quella serie di attività chimiche che utilizza come materia prima fondamentale il carbone. A essa farà seguito la petrolchimica, che utilizza il petrolio e che rappresenta lo stadio attuale più evoluto. Si conoscono ormai più di 100.000 prodotti e di questi ben 30.000 sono commercialmente disponibili. Molti di questi prodotti non esistono in natura, sono cioè un risultato dell’applicazione tecnica (o tecnologica) delle conoscenze scientifiche. Ognuno di essi, in effetti, viene ottenuto attraverso una sequenza di operazioni che nel loro complesso, costituiscono ciò che viene comunemente chiamato processo chimico industriale.
Rappresentazioni dei processi chimici industriali
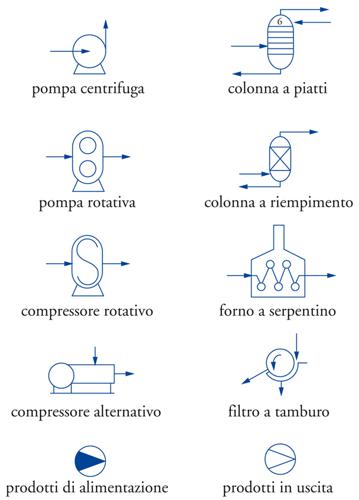
La schematizzazione degli impianti si è notevolmente sviluppata negli ultimi anni, grazie all’introduzione di tecniche di rappresentazione assistita dal calcolatore o CAD (Computer aided design). Quindi, di conseguenza, schemi e disegni più completi e più complessi possono essere realizzati in poco tempo. In particolare, nel disegno degli impianti deve essere utilizzata una simbologia che identifichi immediatamente il tipo di apparecchiatura e la funzione che essa svolge. Ancor meglio se la simbologia adottata è accettata da tutti gli esperti del settore. In tal caso, si ha una sorta di linguaggio simbolico universale, che consente di leggere, senza sforzo e senza possibilità di equivoci, le caratteristiche di un impianto nei più minuti particolari. Generalmente sono disponibili raccolte di simboli definiti secondo norme unificate, delle quali le più diffuse sono quelle statunitensi. In ambito italiano, con lo scopo di fornire le linee guida, l’UNICHIM (Associazione per l’unificazione nel settore dell’industria chimica) ha redatto un manuale molto dettagliato nel quale sono riportate tavole riassuntive contenenti simboli per gli schemi di processo. Nella fig.3 sono riportati, a titolo di esempio, alcuni di questi simboli e la relativa descrizione. A questo proposito, è utile precisare che è possibile elaborare schemi di impianto a diverso livello di complessità denominati rispettivamente:
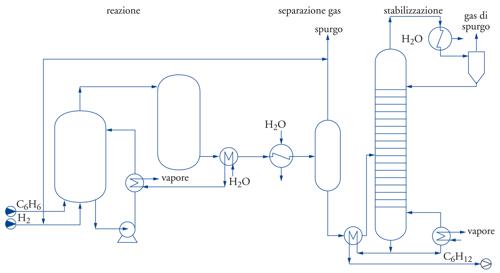
Schema di flusso (flow-sheet). Rappresenta, in modo molto semplificato, la sequenza di operazioni e di reazioni che intervengono nel processo e la movimentazione dei fluidi. Un esempio di schema di flusso relativo a un impianto per l’idrogenazione del benzene è riportato nella fig. 4.
Schema di processo (PFD, Process flow diagram). Fa comprendere con immediatezza le informazioni di base e le caratteristiche salienti di un processo chimico industriale. Le informazioni contenute in schemi di questo tipo riguardano: le apparecchiature principali; le linee di processo (escludendo le linee secondarie, avviamento, sfiato, ecc.); la strumentazione di controllo strettamente indispensabile; il bilancio materiale (riportato a parte su schede apposite); gli indicatori dello stato fisico, della temperatura e della pressione nei punti principali.
Schema di marcia (P&ID, Piping and instrumentation diagram). È più complesso rispetto allo schema di processo, poiché contiene una maggiore quantità di informazioni. In questo caso, lo scopo è quello di rappresentare in maggior dettaglio la connessione di tutte le apparecchiature installate in un impianto industriale. Le informazioni che vengono riportate nello schema di marcia sono: sigla, funzione ed elevazione delle apparecchiature; linee di processo; linee di avviamento; svuotamento; aggiunta di additivi chimici, ecc.; linee di servizio; tracciatura e isolamento delle linee; strumentazione completa di indicatori, registratori, allarmi, controlli, ecc.; valvole e dispositivi di sicurezza; valvole di regolazione e relativi bypass. Inoltre le linee sono tutte codificate in modo da fornire: diametro nominale della linea; servizio generico della linea; numero progressivo e classe del materiale.
2. Il reattore chimico
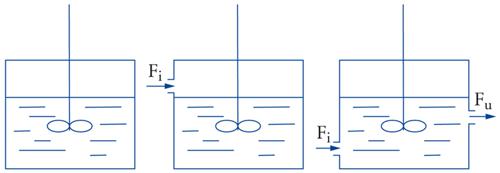
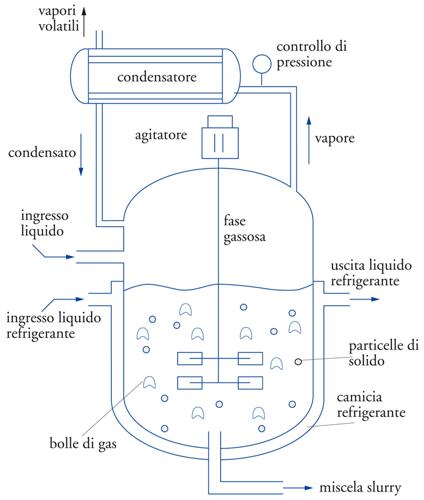
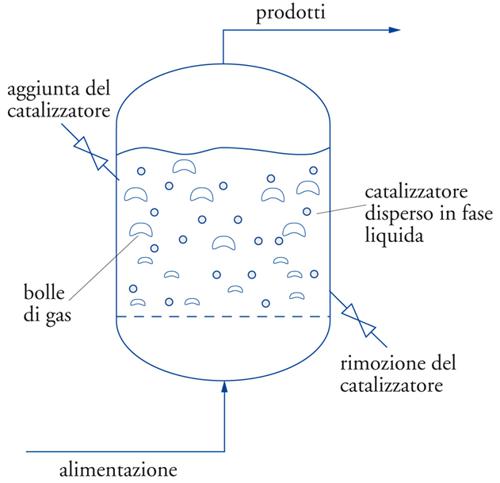
Le reazioni da effettuare potranno essere omogenee o eterogenee, esotermiche o endotermiche, richiedere una pressione e una temperatura bassa o elevata, avvenire in fase liquida, gassosa, gas-liquido, gas-solido, gas-liquido-solido, liquido-liquido, in ambiente più o meno corrosivo, e così via. Il reattore chimico, pertanto, cambierà caratteristiche e aspetto in ognuna delle diverse possibilità menzionate e di conseguenza cambierà anche la struttura dell’impianto. Come accennato in precedenza, una prima classificazione dei reattori può essere fatta in base alle modalità di flusso. Cioè si potranno avere reattori discontinui, semicontinui e continui (fig. 5). Il caso più semplice è rappresentato dalle reazioni condotte in fase omogenea, cioè in cui sia i reagenti sia l’eventuale catalizzatore (detto catalizzatore omogeneo) si trovano in un’unica fase. Un’ulteriore differenziazione deriva dal numero e dal tipo di fasi che vengono a contatto durante la reazione, in particolare dalle caratteristiche del catalizzatore utilizzato. Per esempio, capita spesso di avere il catalizzatore in forma di polvere sospesa in un liquido per effetto dell’agitazione (reattore slurry) e un reagente gassoso che viene fatto gorgogliare nel reattore (reattore semicontinuo gas-liquido-solido) (fig. 6).
Come accennato in precedenza, i reattori discontinui e molti reattori semicontinui vengono utilizzati per piccole produzioni di chimica fine o di chimica farmaceutica e spesso lo stesso reattore viene impiegato per produzioni diverse (reattori multipurpose).
Uno dei problemi cruciali nella progettazione dei reattori è rappresentato dallo smaltimento del calore di reazione, qualora le reazioni siano fortemente esotermiche. Si possono adottare strategie diverse basate su uno scambio di calore all’interno o all’esterno del reattore, oppure utilizzare un solvente che, evaporando a ricadere, permette di sottrarre calore al sistema.
Le opzioni possibili per i reattori continui sono numerose. I reattori gas-liquido, per esempio, possono essere semplici colonne a bolle nelle quali il gas è distribuito attraverso un dispersore in una colonna di liquido. In alternativa, nelle colonne spray il liquido viene disperso in gocce minute in una atmosfera costituita dal reagente gassoso. Lo smaltimento del calore può essere ottenuto con scambiatori di calore interni o esterni al reattore, prevedendo un ricircolo forzato del liquido per raggiungere il livello desiderato di conversione (moli reagite/moli iniziali) del reagente in fase liquida. Quando il catalizzatore è in forma solida si possono verificare molte possibilità diverse. Nel caso di polveri sospese in un liquido, per consentire l’operazione continua è necessaria un’operazione di filtrazione o di sedimentazione o di centrifugazione e di riciclo del catalizzatore che si allontana dall’ambiente di reazione per effetto del flusso del liquido. Comunque, nell’industria, le reazioni gas-solido sono largamente preferite per la semplicità di conduzione e i catalizzatori normalmente impiegati in questo caso sono in forma di pastiglie (pellets) di forma diversa per ottimizzarne le prestazioni.
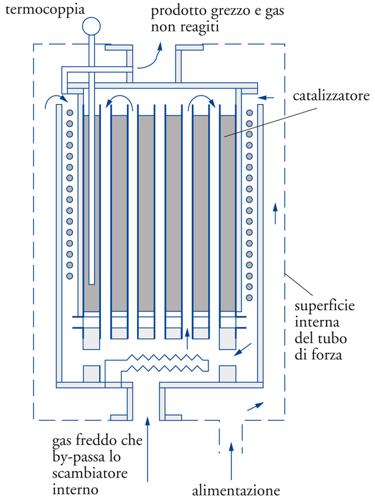
I reattori più utilizzati per questo tipo di reazioni gas-solido sono i reattori tubolari, distinti in monotubolari o multitubolari (fig. 7). Quando la reazione è fortemente esotermica si preferisce utilizzare un catalizzatore in polvere tenuto in sospensione dai gas reagenti (reattori a letto fluidizzato) (fig. 8) oppure un catalizzatore in pastiglie in un reattore adiabatico a più strati con raffreddamento intermedio grazie all’uso di scambiatori di calore fra uno strato e l’altro (come nella produzione di acido solforico). Se la reazione è estremamente rapida si può ricorrere all’impiego di catalizzatori di bassa area specifica, ma di elevata resistenza meccanica e termica utilizzando, per esempio, reti metalliche (come nella ossidazione dell’ammoniaca su reti di platino per la produzione di acido nitrico).
Tre fattori influiscono in maniera prevalente sul comportamento dei reattori condizionandone la progettazione: (a) la termodinamica della reazione, che permette di individuare il campo di temperatura e di pressione in cui la reazione è favorita; la resa massima di equilibrio e la tonalità termica della reazione, cioè la quantità di calore da somministrare o da smaltire; (b) la velocità della reazione, che influisce sulle dimensioni della struttura e che impone le caratteristiche del catalizzatore; (c) la velocità di trasferimento di materia e di calore, che possono condizionare la velocità di reazione.
Infine, un’importante classe di reattori ancor più peculiari è rappresentata dai reattori di polimerizzazione, le cui caratteristiche sono fortemente influenzate dalle molteplici modalità di condurre la reazione.
3. Purificazione e separazione
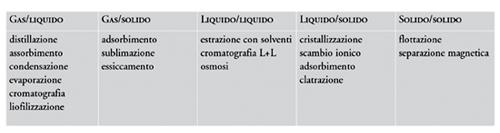
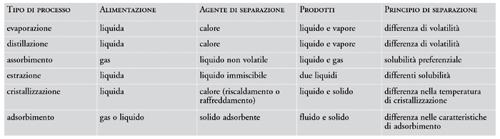
I metodi di separazione sfruttano, in generale, le differenti proprietà delle sostanze da separare, in particolare le proprietà termodinamiche, quelle cinetiche, e, infine, quelle meccaniche o fisiche. Nelle tabelle seguenti, sono riportati alcuni metodi di separazione ordinati secondo questo tipo di classificazione (tabb.1, 2, 3).
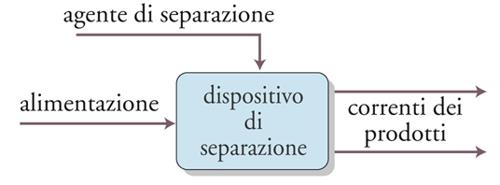
La classificazione dei metodi descritti non è sempre agevole e perciò alcuni di essi compaiono più di una volta nelle diverse categorie considerate. In molti casi, un processo di separazione o di purificazione può essere visto come l’operazione − o la serie di operazioni − attraverso cui una miscela di sostanze viene trasformata in due o più prodotti che differiscono tra loro per la composizione. Un diagramma schematico di un tipico processo di separazione è riportato nella fig. 9. In uscita dal sistema devono essere presenti almeno due correnti dei prodotti di differente composizione. La separazione tra i componenti della miscela alimentata è dovuta all’aggiunta di un agente di separazione che è rappresentato nello schema come un’ulteriore corrente in ingresso al sistema. Questa corrente può essere costituita da un flusso di materia, da un flusso di energia o da entrambi.
Per avere un’idea della tipologia delle operazioni di separazione, dei princìpî su cui sono basate e degli agenti di separazione che sfruttano, nella tab. 4 è riportato un quadro riassuntivo di alcuni processi di separazione spesso applicati industrialmente.
Come si può osservare, alla base di tutte le operazioni di separazione riportate in tabella esiste un principio fisico che viene sfruttato per effettuare la separazione stessa e consiste sempre in una differenza di una certa proprietà tra le sostanze da separare. Per esempio, per distillazione si possono separare agevolmente tra loro sostanze che hanno differenti volatilità mentre per estrazione liquido-liquido si sfruttano le differenze di solubilità dei diversi componenti in due liquidi immiscibili tra loro. Dal punto di vista quantitativo, il parametro fondamentale che caratterizza ogni particolare processo di separazione e che indica quanto sia facile la separazione tra due componenti di una miscela, è il fattore di separazione, definito attraverso la relazione seguente:
[1] formula.
Dove αij è il fattore di separazione, xiN indica la frazione molare del componente generico i nella corrente uscente generica N, i e j sono gli indici dei componenti da separare, 1 e 2 sono gli indici delle correnti uscenti dall’unità di separazione. Nel caso in cui αij risulti uguale a 1 non è possibile separare i due componenti i e j in quanto nelle correnti 1 e 2 li si ritrova in uguale concentrazione. Solo nel caso in cui il fattore di separazione sia molto diverso dall’unità, la separazione risulta relativamente facile.
4. Operazioni unitarie e bilanci di materia e di energia
Su ognuna delle unità che intervengono in un impianto chimico è possibile impostare i bilanci di materia e di energia che, nella forma più generale possibile e per un generico componente i, si presentano secondo la seguente modalità:
[2] Accumuloi = Quantità entrantei −
− Quantità uscentei + Generazionei − Consumoi
Il termine di accumulo è presente nel caso di processi discontinui ed è nullo per i processi continui. I termini di generazione e consumo, invece, si riferiscono all’eventuale presenza di reazioni chimiche, come accade nel reattore chimico, mentre, in assenza di reazioni, cioè nelle apparecchiature di separazione, l’espressione generale del bilancio si semplifica a:
[3] Accumuloi = Quantità entrantei −
− Quantità uscentei
Se poi il sistema è stazionario, come avviene sempre per gli impianti di separazione continui, il termine di accumulo si annulla e avremo una semplificazione ulteriore:
[4] Quantità entrantei = Quantità uscentei
Oltre al bilancio di materia riferito a ogni singolo componente è possibile impostare un bilancio globale che obbedisce al principio di conservazione della materia, cioè, la massa totale entrante sarà uguale a quella uscente. Il bilancio energetico per ogni operazione unitaria potrà essere scritto in modo analogo ai bilanci materiali e dovrà tener conto rispettivamente delle variazioni di energia interna, di energia potenziale e di energia cinetica riferite, per comodità, all’unità di massa. L’insieme dei bilanci materiali ed energetici, relativi ai singoli componenti oppure globali, rappresenta un sistema di equazioni algebriche o differenziali di grandi dimensioni, per la cui soluzione sono attualmente disponibili specifici software applicativi che vanno sotto il nome di simulatori di processo. Il software di questo tipo può essere utilizzato sia per la simulazione, che per il dimensionamento delle operazioni unitarie.
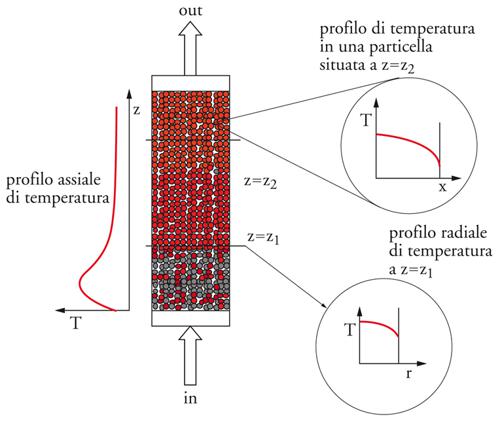
Particolarmente complesso può risultare il bilancio materiale per un reattore tubolare, poiché in questo caso è necessario definire i profili di concentrazione dei reagenti e dei prodotti e i profili della temperatura che si verificano, rispettivamente, lungo l’asse del reattore (profili longitudinali), sulle diverse sezioni trasversali (profili radiali) e all’interno della particella catalitica, come si può vedere nell’esempio illustrato nella fig. 10.
5. Approccio iterativo allo sviluppo di un processo
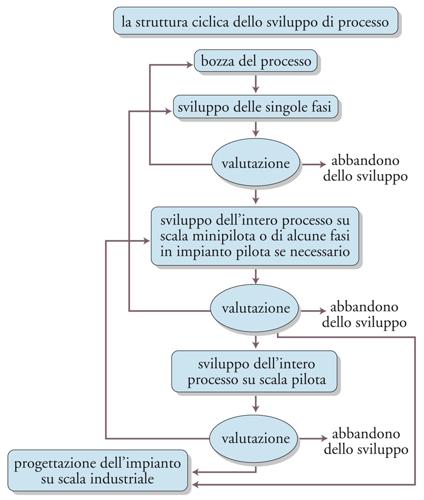
Lo sviluppo di un processo chimico è una procedura abbastanza complessa, che parte dal laboratorio e termina con la realizzazione e l’esercizio di un impianto produttivo industriale. Esso ha successo se il prodotto desiderato viene immesso sul mercato nei tempi previsti e con la potenzialità prefissata. Fattori ugualmente importanti per tale successo sono i costi di produzione, che devono essere competitivi, e gli standard qualitativi che il processo deve garantire. L’attività di sviluppo di un processo chimico industriale procede attraverso fasi distinte, ognuna delle quali è seguita da una fase di controllo e di valutazione che può indurre a tornare a una delle fasi precedenti secondo un procedimento iterativo che è illustrato nella fig.11.
L’inizio della procedura iterativa per lo sviluppo di un processo può essere costituito dall’esame di diversi processi alternativi o di varianti dello stesso processo, mantenendo questa vasta gamma di possibilità alla scala di laboratorio dove i costi sono relativamente contenuti ed effettuando poi una scelta in fase di realizzazione dell’impianto minipilota. Il processo di sviluppo procede, per grandi linee, attraverso tre fasi che possono essere definite: (a) fase preliminare di studio di laboratorio; (b) fase di studio su impianto minipilota; (c) fase di studio su impianto pilota.
Le operazioni preliminari di laboratorio sono in genere del tipo batch, mentre, se si immagina un processo continuo si procede con prove continue di laboratorio, poi in impianto pilota, studiando le caratteristiche del reattore chimico, esaminando tutte le altre operazioni unitarie e raccogliendo tutti i dati chimico-fisici di interesse per ciascuna delle sostanze coinvolte. Lo studio di un processo prevede, in particolare, un esame accurato dei suoi vari aspetti: (a) termodinamici: relativi sia alla reazione per stabilirne le condizioni d’equilibrio e la tonalità termica, sia agli equilibri di stato, come l’equilibrio liquido-vapore dei diversi componenti e loro miscele oppure eventuali equilibri di ripartizione liquido-liquido o liquido-solido; (b) catalitici: per identificare il catalizzatore migliore in termini di attività, di selettività, di resistenza meccanica, termica e all’avvelenamento; (c) cinetici e di trasferimento di materia e di calore: indispensabili per dimensionare gli impianti e ottimizzarne la marcia; (d) tecnologici: che riguardano la struttura che l’impianto dovrebbe avere per effettuare al meglio le operazioni necessarie per la produzione; (e) riduzione dei costi: scelta dei materiali da impiegare per ridurre i costi, cercando però di evitare fenomeni di corrosione.
I tempi di realizzazione, per passare dall’idea di laboratorio a un processo commerciale funzionante, sono complessivamente di circa una decina d’anni (o più). Quando si effettuano le varie fasi di tale passaggio di scala, le dimensioni delle singole operazioni unitarie che compongono il processo vengono aumentate moltiplicandole per alcuni fattori, che prendono il nome, appunto, di fattori di scala o fattori di scale-up. Questi sono caratteristici di ogni classe di operazioni unitarie o di apparecchiature e sono tanto più elevati quanto maggiore è la confidenza che si ha nell’estrapolare le dimensioni verso l’alto.
6. Regolazione e controllo
Un’informazione di importanza fondamentale, per la comprensione approfondita del funzionamento di un impianto, è quella dei cicli o loop di regolazione e controllo. Sono definite in questo modo tutte quelle operazioni di rilevamento di una variabile (temperatura, pressione, portata, ecc.) in un dato punto dell’impianto, allo scopo di effettuare una regolazione su un’altra variabile in un altro punto dell’impianto che, a sua volta, influenza la prima. Un esempio può essere costituito dalla lettura di un livello di un serbatoio, che agisce su una valvola posta su una linea in uscita dal serbatoio stesso. La valvola verrà comandata in modo da aprirsi o chiudersi mantenendo il livello nei limiti voluti. Gli elementi che costituiscono un loop di controllo sono quindi: (a) elemento di rilevamento della variabile (termocoppia, trasduttore di pressione, flangia tarata, ecc.); (b) elemento per la trasmissione del valore letto; (c) dispositivo logico o regolatore che, sulla base del valore che riceve dal trasmettitore, calcola l’azione che deve effettuare; (d) attuatore o dispositivo che attua l’azione stabilita dal regolatore (motore, dispositivo pneumatico, ecc.).
Bibliografia
Aftalion 2001: Aftalion, Fred, A history of the international chemical industry, 2. ed., Philadelphia, Chemical Heritage Press, 2001.
Berti 1983: Berti, Lamberto - Calatozzolo, Mariano - Di Bartolo, Rocco, Aspetti teorici e pratici dei processi chimici, Messina-Firenze, D’Anna, 1983.
Carrà 1977: Carrà, Sergio, La produzione chimica: processi e operazioni unitarie, in: Enciclopedia della chimica, Milano, ISEDI, 1977.
Carrà, Morbidelli 1983: Carrà, Sergio - Morbidelli, Massimo, Chimica fisica applicata, Milano, Hoepli, 1983.
Dillon 1992: Dillon, C. Paul, Materials selection for the chemical process industries, New York-London, McGraw-Hill, 1992.
Fogler 1986: Fogler, H. Scott, Elements of chemical reaction engineering, Englewood Cliffs (N.J.), Prentice-Hall, 1986.
Foley 2002: Foley, Henry C., Introduction to chemical engin-eering analysis using mathematica, San Diego, Academic Press, 2002.
Froment, Bishoff 1990: Froment, Gilbert F. - Bishoff, Kenneth B., Chemical reactor analysis and design, 2. ed., New York - Chichester, Wiley, 1990.
Henley, Rosen 1969: Henley, Ernest F. - Rosen, Edward M., Material and energy balance computations, New York, Wiley, 1969.
Himmelblau 1989: Himmelblau, David M., Basic principles and calculations in chemical engineering, London, Prentice-Hall, 1989.
Missen 1999: Missen, Ronald W. - Mims, Charles A. - Sa-ville, Bradley A., Introduction to chemical reaction engineering and kinetics, New York-Chichester, Wiley, 1999.
Moulijn 2001: Moulijn, Jacob A. - Makkee, Michiel - van Diepen, Annelies, Chemical process technology, Chichester, Wiley, 2001.
Shinskey 1988: Shinskey, Francis G., Process control system, 3. ed., New York, McGraw-Hill International, 1988.
Stephanopoulos 1984: Stephanopoulos, George, Chemical process control, Englewood Cliffs (N.J.), Prentice-Hall, 1984.
UNICHIM 1994: Impianti chimici: simboli e sigle per schemi e disegni, Milano, UNICHIM, 1994.
Walas 1989: Walas, Stanley, Reaction kinetics for chemicalengineers, Boston, Butterworths, 1989.
Westerterp 1984: Westerterp, Klaas R. - van Swaaij, Wim P.M. - Beenackers, Antonie A.C.M., Chemical reactordesign and operation, 2. ed., Chichester, Wiley, 1984.
Winterbottom, King 1999: Reactor design for chemical engin-eers, edited by J. Mike Winterbottom, Michael B. King, Cheltenham, Thornes, 1999.